共无定形(coamorphous, CM)是由药物活性成分(active pharmaceutical ingredient, API)及小分子配体(co-former, CF)组成的多组分单相固态体系[1]。其中, CF可以为具有协同药理作用的另一药物活性成分, 如盐酸鲁拉西酮-瑞格列奈共无定形[2]、利托那韦-吲哚美辛共无定形[3], 也可以为安全的小分子辅料, 如瑞格列奈-糖精共无定形[4]、盐酸鲁拉西酮-糖精共无定形[5]和喹硫平-烟酰胺共无定形[6]等。一般共无定形体系中各组分间可通过氢键、π-π堆积等非共价键相连, 也可仅为分子水平的混溶而无明显分子间作用力[7]。本课题组前期研究表明, 相较于无定形态, 将难溶性药物制备成共无定形后, 有很大潜能可改善其低溶解性缺陷, 并具有良好的物理稳定性[2, 4, 5, 7]。
葛根素(puerarin, PUE, 图 1A)是中药葛根中重要的异黄酮类成分, 因具有抗氧化、保肝[8]、抗癌[9]和雌激素样作用等药理活性[10], 被广泛用于高血压、糖尿病[11]和心脑血管疾病[12, 13]等方面的治疗。临床上, 通过静脉注射的方式给药。然而为提高葛根素溶解度, 在注射剂制备中使用了大量的丙二醇, 长期注射可引起溶血、过敏和肝肾损害等不良反应。因此, 为提高患者顺应性, 避免丙二醇产生的不良反应, 开发葛根素固体口服给药制剂一直是诸多学者研究关注的热点。文献[14, 15]报道, 葛根素属于BCS (biopharmaceutics classification system) IV药物, 低水溶性及低渗透性是导致其口服生物利用度低的主要原因。因此, 选择适宜的策略改善葛根素理化性质缺陷, 对进一步提高其口服生物利用度及促进其口服制剂开发具有重要意义。烟酰胺(nicotinamide, NIC)是一种FDA批准的GRAS (generally recognized as safe)小分子辅料。NIC分子结构中同时含有氢键供体和受体(图 1B), 具备形成共无定形的结构基础。因此, 本研究通过共无定形技术制备PUE-NIC共无定形, 以提高PUE溶出度, 并进一步阐明了共无定形对PUE增溶作用的机制。
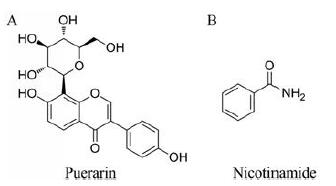
|
Figure 1 Chemical structures of puerarin (PUE, A) and nicotinamide(NIC, B) |
药品及试剂 PUE (纯度99.98%, 浙江震元制药有限公司); NIC (纯度98.5%, 国药集团化学试剂有限公司); 甲醇(色谱纯, Merck公司); 实验用水(Milli-Q水纯化系统自制, 美国Millipore公司); 其他试剂均为分析纯。
仪器 能溶出仪(RC-806, 天津市天大天发科技有限公司); Shimadzu高效液相仪(LC-10AD泵, SPD-10A检测器, 日本Shimadzu公司); 雷磁电导率仪(DDSJ-308F, 上海仪电科学仪器股份有限公司)。
PUE无定形的制备 称取PUE晶体1 g至100 mL圆底烧瓶中, 加入甲醇10 mL, 室温超声溶解, 于55℃下减压旋转蒸发溶剂, 得到白色旋蒸产物, 将所得产物于25℃下真空干燥24 h后置干燥器内保存, 备用。
PUE-NIC共无定形的制备 称取PUE晶体800 mg、NIC晶体234 mg (摩尔比为1∶1)至100 mL圆底烧瓶中, 加入甲醇10 mL, 室温超声溶解, 于55℃下减压旋转蒸发溶剂, 得到白色旋蒸产物, 将所得产物于25℃下真空干燥24 h后置干燥器内保存, 备用。
PUE晶体+NIC晶体物理混合物的制备 称取PUE晶体800 mg、NIC晶体234 mg (摩尔比为1∶1), 采用等量递增法混合均匀, 再过80目筛混合均匀, 备用。
PUE无定形+NIC晶体物理混合物的制备 称取PUE无定形800 mg、NIC晶体234 mg (摩尔比为1∶1), 采用等量递增法混合均匀, 再过80目筛混合均匀, 备用。
固态表征
粉末X-射线衍射(powder X-ray diffraction, PXRD) 分别取适量过200目筛的PUE晶体、NIC晶体、PUE晶体+NIC晶体物理混合物、PUE无定形、PUE无定形+NIC晶体物理混合物和PUE共无定形, 采用D8 Advance X-射线衍射仪Cu-Kα靶测定, 波长为1.540 6Å(1Å=0.1 nm), 管压40 kV, 管流40 mA, 步长0.02°, 扫描速度4°·min-1, 扫描范围3~40°/2θ。
差示扫描量热法(differential scanning calorimetry, DSC) 分别称取约3~5 mg PUE晶体、NIC晶体、PUE晶体+NIC晶体物理混合物、PUE无定形、PUE无定形+NIC晶体物理混合物和PUE共无定形置于敞口的铝制坩埚中, 升温速率10℃·min-1, 晶态药物的测定范围为50~250℃, 无定形态药物的测定范围为0~250℃。数据用NETZSCH-Proteus热分析软件(Version 4.2)处理。
傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FT-IR) 分别取适量PUE晶体、NIC晶体、PUE晶体+NIC晶体物理混合物、PUE无定形、PUE无定形+NIC晶体物理混合物、PUE共无定形与KBr压片, 在4 000~400 cm-1范围内扫描。数据经Nicolet Omnic红外光谱软件(Version 8.0)处理。
过饱和粉末溶出 分别将PUE晶体、PUE晶体+NIC晶体物理混合物、PUE无定形+NIC晶体物理混合物和PUE-NIC共无定形过80目筛(180μm)处理, 以避免粉末粒径差异引起的溶出差异。依照《中国药典》2015年版通则0931溶出度与释放度测定法第三法, 分别精密称取上述样品(相当于PUE 0.775 g)投入100 mL介质中[水、0.1 mol·L-1HCl、pH 6.8磷酸盐缓冲液(PBS)], 介质温度为25℃或37℃, 转速为50 r·min-1, 于0.17、0.5、1、2、4、7、10、12和24 h取样2 mL, 同时补充相同温度和体积的溶出介质。取出的溶液经0.22μm滤膜过滤, 续滤液经适当稀释后, 采用HPLC法测定PUE浓度。每份样品平行测定3次。HPLC条件如下: 色谱柱: Kromasil 100-5 C18色谱柱(150 mm×4.6 mm, 5μm), 流动相: 水-甲醇(35∶65, w/w), 流速: 1.0 mL·min-1, 柱温: 30℃, 检测波长: 250 nm; 进样体积: 5μL。
相溶解度研究 分别将过量的PUE投入5 mL含不同浓度的NIC水溶液中(约0~1.2 mol·L-1), 于25℃或37℃水浴条件下磁力搅拌48 h, 溶液达到平衡后, 将混悬液静置一段时间后取上清液过0.22μm滤膜, 续滤液经适当稀释后采用HPLC法测定溶液中PUE和NIC的浓度。每组样品平行测定3次。
结果与讨论 1 固态表征 1.1 PXRD各样品的PXRD图谱如图 2所示。晶体PUE在6.5°、8.0°、11.6°、13.9°、19.6°、23.4°/2θ处呈特征衍射峰, 晶体NIC在14.7°、25.2°、25.7°、27.2°/2θ处呈特征衍射峰, 与文献[16, 17]所述一致。两者物理混合物的衍射峰为各组分衍射峰的简单叠加。PUE旋蒸产物及PUE-NIC共旋蒸产物的PXRD图谱中仅能观察到1个较大的衍射环, 图谱呈弥散状, 这是由于与晶态相比, 无定形态缺乏长程有序的三维分子结构[18]。因此, 可初步判断两种旋蒸产物均为无定形态。PUE旋蒸产物与NIC晶体的物理混合物在14.7°、25.2°、25.7°、27.2°/2θ处呈NIC晶体的特征衍射峰, 进一步表明PUE旋蒸产物为无定形态。PUE无定形与PUE-NIC共旋蒸产物的衍射环形状也有所不同, 表明两种无定形态内部结构中分子排列存在差异[19]。

|
Figure 2 Powder X-ray diffraction (PXRD) patterns for crystalline PUE (a), crystalline NIC (b), physical mixture of crystalline PUE and NIC (c), physical mixture of amorphous PUE and crystalline NIC (d), amorphous PUE (e), and coamorphous PUE-NIC (f) |
各样品的DSC图谱如图 3所示。晶体药物通常具有明显的熔点(melting temperature, Tm), 而无定形态常以玻璃化转变温度(glass transition temperature, Tg)作为特征的热力学参数。PUE晶体为一水合物, 115.2℃处的宽峰为其脱水吸热峰, 208.7℃处的吸热峰为熔融峰, 与文献[20]所述一致。NIC晶体在128.7℃处有单一且尖锐的吸热熔融峰。两者晶体物理混合物仅在116.9℃处有一宽的吸热峰, 此为PUE的脱水峰与NIC熔融峰的重合。PUE无定形的玻璃化转变温度为50.7℃; 对于PUE无定形与NIC晶体的物理混合物而言, PUE无定形作为杂质导致NIC晶体由128.7℃降至90.3℃。PUE-NIC共旋蒸产物仅存在单一的玻璃化转变温度(35.1℃), 表明PUE-NIC共旋蒸产物为单相的二元共无定形体系。
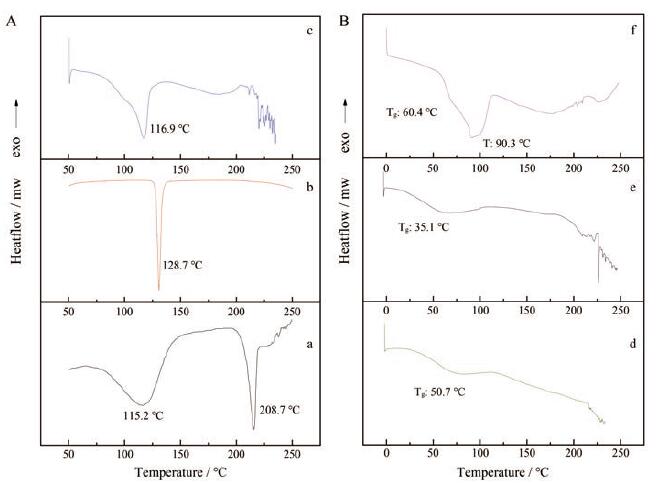
|
Figure 3 A: Differential scanning calorimetry (DSC) thermograms for crystalline PUE (a), crystalline NIC (b), physical mixture of crystalline PUE and NIC (c); B: DSC thermograms for amorphous PUE (d), coamorphous PUE-NIC (e), physical mixture of amorphous PUE and crystalline NIC (f) |
PUE晶体O-H的伸缩振动峰位于3 346.8 cm-1, C=O的伸缩振动峰位于1 632.9 cm-1(图 4a); NIC晶体N-H的伸缩振动峰位于3 365.6和3 155.9 cm-1处, C=O的伸缩振动峰位于1 680.2 cm-1(图 4b), 与文献[21, 22]报道一致。两者物理混合物的吸收峰为二者晶体吸收峰的叠加(图 4c)。与PUE晶体相比, PUE无定形的吸收峰峰形变宽(图 4e), 这是由于PUE晶体规整的晶格遭到破坏, 分子内部重排后呈长程无序、短程有序的结构[23]。此外, O-H的伸缩振动峰红移至3 325.1 cm-1。这表明PUE无定形化后增加了原晶体中氢键缔合程度[24]。PUE无定形与NIC晶体物理混合物的吸收峰为两者吸收峰的叠加, 并主要表现出NIC晶体的特征(图 4d)。
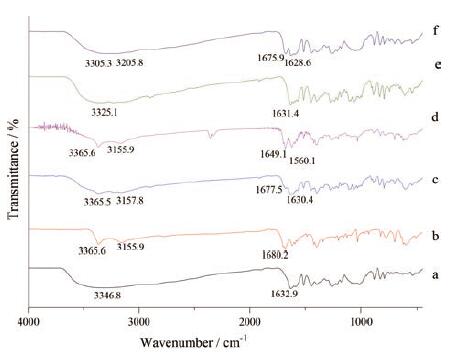
|
Figure 4 Fourier transform infrared spectroscopy (FT-IR) spectra of crystalline PUE (a), crystalline NIC (b), physical mixture of crystalline PUE and NIC (c), physical mixture of amorphous PUE and crystalline NIC (d), amorphous PUE (e), and coamorphous PUE-NIC (f) |
PUE-NIC共无定形与单独的PUE无定形相比, PUE的C=O峰由无定形中的1 631.4 cm-1红移至1 628.6 cm-1, O-H峰由3 325.1 cm-1移至3 205.8 cm-1; NIC的N-H峰由3 365.6 cm-1红移至3 305.3 cm-1, 且峰形由尖变宽, C=O峰由1 680.2 cm-1红移至1 675.9 cm-1(图 4f)。因此, 在PUE-NIC共无定形中, PUE的O-H与NIC的C=O之间、PUE的C=O与NIC的N-H之间可能形成了分子间氢键。
2 过饱和粉末溶出 2.1 葛根素不同固体形态对其过饱和溶出的影响PUE晶体、PUE晶体+NIC晶体物理混合物、PUE无定形+NIC晶体物理混合物和PUE-NIC共无定形在37℃水中过饱和溶出曲线如图 5所示。与PUE晶体相比, 晶体物理混合物、PUE无定形与NIC晶体物理混合物中PUE溶出趋势与PUE晶体相似, 即PUE浓度逐渐增加, 于4 h后趋于平衡, 但在0.17~1 h内晶体混合物中PUE浓度高于PUE晶体。这表明NIC分子对PUE有一定的增溶作用; 而PUE无定形与NIC晶体物理混合物中PUE始终具有高于PUE晶体的表观浓度(24 h约为晶体的1.2倍)。此外, PUE-NIC共无定形表现出不同的溶出行为。共无定形中的PUE在溶出一开始便具有较高的表观浓度, 随后随溶出时间PUE浓度略有下降, 24 h时仍可维持在6.25 mg·mL-1, 相比PUE晶体提高了约1.4倍。由此可知, PUE-NIC共无定形不仅可以提高PUE溶出度, 还可同时在相当长的时间内维持较高的药物过饱和度, 这将有助于PUE的渗透吸收[25]。
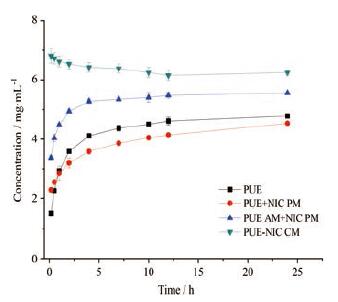
|
Figure 5 Supersaturated dissolution profiles of PUE from crystalline raw material, amorphous (AM) state, physical mixture(PM) of amorphous PUE and crystalline NIC, coamorphous (CM)system in water at 37℃(n=3) |
此外, PUE-NIC共无定形在溶出过程中表现出特殊的溶出现象, 即粉末遇水后迅速溶解, 随后在溶出杯底部聚集成透明状的“油状液滴”, 之后开始析出白色固体, 随时间延长白色固体逐渐增多, 最后形成白色粉末堆, 此现象被称为“液-液相分离”(liquid-liquid phase separation, LLPS), 如图 6所示。LLPS现象常发生在过饱和溶液中, 如在利托那韦、尼卡地平、克霉唑等药物在过饱和溶液中都可发生LLPS[26-28]。从热力学角度讲, 相分离只在混合吉布斯自由能大于0时发生, 即ΔGmix > 0, 如式(1)。其中µA/µA*和µB/µB*分别是组分A和B的化学势与标准化学势, χA和χB分别为组分A和B摩尔分数。

|
Figure 6 Liquid-liquid phase separation (LLPS) of coamorphous PUE-NIC in supersaturated dissolution in water |
| $\Delta G_{\operatorname{mix}}=\chi_{\mathrm{A}}\left(\mu_{\mathrm{A}}-\mu_{\mathrm{A}}^{*}\right)+\chi_{\mathrm{B}}\left(\mu_{\mathrm{B}}-\mu_{\mathrm{B}}^{*}\right)$ | (1) |
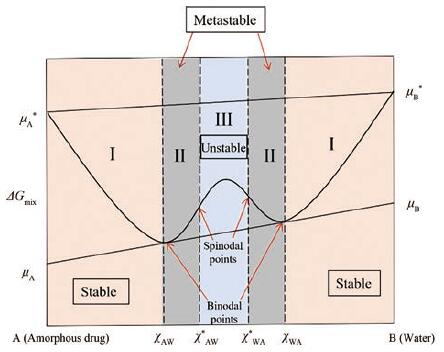
但在某些体系中, 相分离也可发生在ΔGmix < 0的条件下, 如LLPS。图 7描述了发生LLPS的两种部分混溶液体的混合自由能与其组成的关系曲线图。其中, 右侧为纯液态水(W), 左侧为纯无定形药物态(A)。由图可知, 对于W和A两组分的所有混合体系下, ΔGmix均为负值(µA < µA*, µB < µB*)。但在两组分比例为χAW(药物富集相)或χWA(水富集相)时, 体系ΔGmix可达到最小值, 从而产生均相混溶间隙。χAW或χWA对应的ΔGmix曲线上点被称为双节点(binodal points), 其热力学含义为此时无定形药物和水在各相中的化学势相等。因此, 对于无定形药物和水形成的混合体系中, 当组分比例小于χAW或大于χWA时(Ⅰ区), 即溶液未达到饱和时, 体系稳定且不会发生相分离。当组分比例在χAW~χAW*或χWA~χWA*时(Ⅱ区), 体系处于亚稳态, 可能发生相分离, 但此时需克服较高能量势垒才能形成新的液相。χAW*与χWA*对应的ΔGmix曲线上点被称为旋节点, 是混合体系中亚稳状态与不稳定状态的分界点, 即当组分比例在χAW*与χWA*之间时(Ⅲ区), 体系处于不稳定状态, 会自发地向双节点移动, 分成两个化学势相等的液相, 该过程即为LLPS[29, 30]。当溶液中迅速产生超过无定形溶解度的高饱和度时, 系统可以通过形成两个液相(富含药物的液滴相及富含水的溶液相)以获得较低的自由能, 如果药物分子自身结晶速率较慢或在体系中存在结晶抑制剂、局部过饱和度较高的情况下[31], 该富含药物的液滴相可以持续存在一段时间。本研究中的PUE-NIC共无定形在遇水的瞬间, 迅速溶解产生高过饱和度, 产生LLPS现象, 并在24 h内维持高于晶体的过饱和度, 与其他固体形态葛根素相比具有最显著的溶出优势。
|
Figure 7 Gibbs free energy function of two liquids exhibiting LLPS.µA: Chemical potential of A (amorphous drug); µA*: Standard chemical potential of A; µB: Chemical potential of B(water); µB*: Standard chemical potential of B; χAW: Amorphous drug-rich phase; χWA: Water-rich phase; χAW*andχWA*: Inflections in the free energy versus composition curve where ΔGmix=0 |
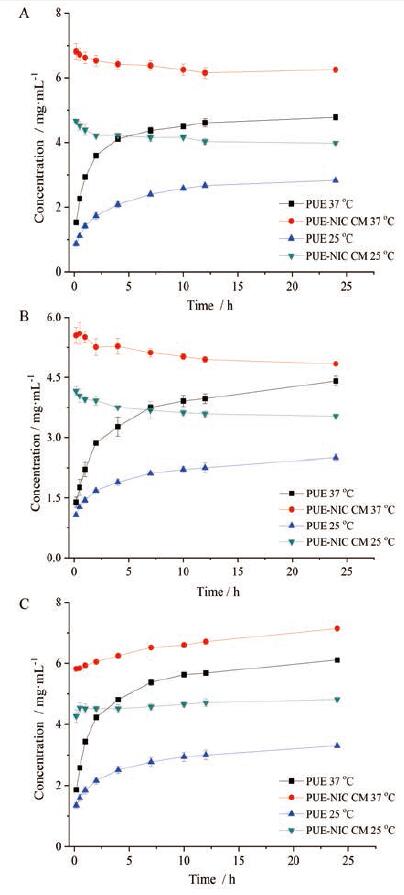
PUE-NIC共无定形在37℃水中可发生LLPS现象, 并维持较高的药物过饱和度, 本研究进一步考察了PUE晶体与PUE-NIC共无定形在不同介质及温度下的过饱和溶出行为。如图 8所示, PUE晶体在37℃0.1 mol·L-1HCl、水、pH 6.8 PBS中的平衡浓度分别为4.41、4.78和6.11 mg·mL-1, 这是由于PUE分子呈弱酸性, 其溶解度随pH值的升高而增大; 当温度降低至25℃, PUE晶体的溶出趋势没有发生变化, 上述各介质中PUE的平衡浓度分别为2.50、2.83和3.30 mg·mL-1, 表明随温度降低, PUE在各介质中的溶解度减小。
|
Figure 8 Supersaturated dissolution profiles of crystalline PUE and coamorphous (CM) PUE-NIC in water (A), 0.1mol·L-1HCl (B)and pH 6.8 PBS (C) at 25 ℃ and 37 ℃(n=3) |
PUE-NIC共无定形在不同温度下的3种介质中均观察到LLPS现象, 约2~10 min后从“油状液滴”中逐渐析出白色固体。溶出曲线表明, 在37℃水和0.1 mol·L-1HCl中, PUE浓度具有缓缓下降的趋势, 但仍高于PUE晶体, 表现出较高的过饱和态; 而在pH6.8 PBS中, PUE浓度呈现缓慢上升的趋势, 过饱和优势更为明显。当温度降低至25℃时, 溶液中的PUE浓度相比37℃有所减小, 但溶出趋势不变。因此, 共无定形在遇水瞬间产生的过饱和度是引起LLPS现象的主要原因, 受温度及pH值的影响较小。
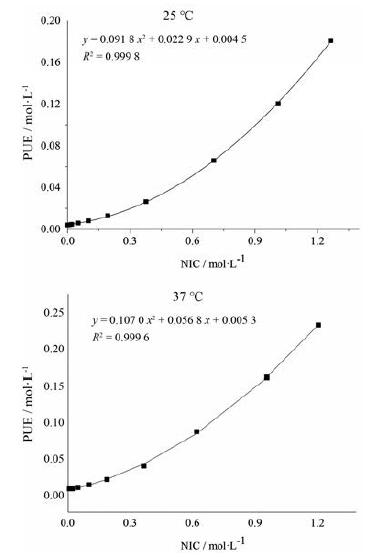
3 相溶解度的研究假设溶液中存在难溶性化合物D和可溶性化合物L, 当D与L存在络合效应时, D的溶解度曲线将随L浓度变化而变化[32]。络合模型根据络合物是否可溶分为可溶型(A型)与不可溶型(B型)两种, 其中可溶型又分为AL、AP和AN3种亚型。AL曲线代表D的溶解度与L浓度线性正相关; AP曲线为正偏离线性关系, 即L在高浓度时对D的增溶效果更显著; AN曲线为负偏离线性关系, 即L在高浓度时对D的增溶效果反而有所减弱[33]。不同浓度NIC溶液中PUE的溶解度曲线如图 9所示。在25℃及37℃下, PUE的溶解度均随NIC浓度的增加而增加, 且在NIC浓度较高时发生正性偏离, 呈现出单调递增的趋势, 表明在上述温度下, PUE与NIC之间存在络合作用, 络合类型属于AP型络合。
|
Figure 9 Influence of NIC concentration on the solubility of PUE in water at 25 ℃ and 37 ℃ |
若PUE与NIC在溶液中存在1∶1和1∶2的络合, 则其在溶液中的反应为:
| $[\mathrm{PUE}]+[\mathrm{NIC}] \stackrel{\mathrm{K}_{1: 2}}{\rightleftharpoons}[\mathrm{PUE} \cdot \mathrm{NIC}] \\ [\mathrm{PUE} \cdot \mathrm{NIC}]+[\mathrm{NIC}] \stackrel{\mathrm{K}_{1: 2}}{\rightleftharpoons}\left[\mathrm{PUE} \cdot \mathrm{NIC}_{2}\right]$ |
其中, [PUE]为PUE在水中的摩尔溶解度, [NIC]为NIC的摩尔浓度, [PUE·NIC]是PUE与NIC 1∶1络合物的浓度, [PUE·NIC2]是PUE与NIC 1∶2络合物的浓度, 络合常数K1∶1和K1∶2可分别表示为:
| $K_{1: 1}=\frac{[\mathrm{PUE} \cdot \mathrm{NIC}]}{[\mathrm{PUE}][\mathrm{NIC}]}$ | (2) |
| $K_{1: 2}=\frac{\left[\mathrm{PUE} \cdot \mathrm{NIC}_{2}\right]}{[\mathrm{PUE}][\mathrm{NIC}]^{2}}$ | (3) |
整理公式(2)和(3)可得以下公式, 从而计算得到K1:1和K1:2:
| $\frac{\left[\mathrm{PUE}_{\mathrm{t}}\right]-\left[\mathrm{PUE}_{0}\right]}{\left[\mathrm{NIC}_{\mathrm{t}}\right]-2\left(\left[\mathrm{PUE}_{\mathrm{t}}\right]-\mathrm{PUE}_{0}\right)}= \\ \mathrm{A}+\mathrm{B}\left\{\left[\mathrm{NIC}_{\mathrm{t}}\right]-2\left(\left[\mathrm{PUE}_{\mathrm{t}}\right]-\left[\mathrm{PUE}_{0}\right]\right)\right\}$ | (4) |
其中, [PUEt]和[NICt]分别代表PUE和NIC的总摩尔浓度, [PUE0]表示当溶液中NIC浓度为0时的PUE溶解度, 对上式进行简化可得:
| $\frac{\left[\mathrm{PUE}_{\text {complex }}\right]}{\left[\mathrm{NIC}_{\mathrm{t}}\right]-2\left[\mathrm{PUE}_{\text {complex }}\right]}= \\ \mathrm{A}+\mathrm{B}\left\{\left[\mathrm{NIC}_{\mathrm{t}}\right]-2\left[\mathrm{PUE}_{\text {complex }}\right]\right\}$ | (5) |
其中, [PUEcomplex]为产生络合的IBU浓度, A和B可表达为:
| $\mathrm{A}=\frac{K_{1: 1}\left[\mathrm{PUE}_{0}\right]}{1-K_{1: 1}\left[\mathrm{PUE}_{0}\right]}$ | (6) |
| $\mathrm{B}=\frac{K_{1: 1} K_{1: 2}\left[\mathrm{PUE}_{0}\right]}{\left(1-K_{1: 1}\left[\mathrm{PUE}_{0}\right]\right)^{2}}$ | (7) |
根据公式(5)作图(图 10), 所拟合直线具有较好的拟合度(r2 > 0.97)。A和B可分别由直线的斜率和截距计算得到, 可进一步计算在25℃下的络合常数K1:1和K1:2分别为6.31和6.05;在37℃下的络合常数K1:1和K1:2分别为4.51和10.71。通常认为, 络合常数越大, 相对应的络合物越稳定, 由此得出PUE与NIC在25℃水中以1∶1型络合物为主, 而在37℃水中以1∶2型络合物为主。关于NIC对药物的增溶机制通常被认为是胶束效应及作为离液剂破坏水分子的自缔合等[34], 而本研究通过相溶解度的研究证实, PUE-NIC共无定形对PUE溶解性改善的机制是PUE与NIC在介质中络合作用的结果。

|
Figure 10 Plot of equation (5) for determination of K1:1 and K1:2 for the complexation of PUE and NIC in water at 25℃and 37℃ |
本研究通过旋转蒸发法制备了PUE-NIC共无定形, 其玻璃化转变温度为35.1 ℃, 共无定形体系中PUE的O-H与NIC的C=O间、PUE的C=O与NIC的N-H间可能形成了分子间氢键。与PUE晶体、PUE无定形和NIC晶体物理混合物相比, PUE-NIC共无定形在溶出过程中发生LLPS现象, 且PUE与NIC在介质中形成1∶1与1∶2络合物, 可显著增加药物的溶出度, 并能维持24 h的过饱和态优势, 有利于药物吸收。本研究为改善难溶性药物水溶性及增溶机制的研究提供了新思路。
作者贡献: 吴秀娟和庞遵霆负责实验操作、结果分析及起草、撰写文章; 杨思彤和严梦梦负责实验操作、结果分析; 高缘负责修改文章。
利益冲突: 作者排名顺序无争议, 稿件不涉及泄密和知识产权争议。
| [1] |
Chavan RB, Thipparaboina R, Kumar D, et al. Coamorphous systems: a product development perspective[J]. Int J Pharm, 2016, 515: 403-415. DOI:10.1016/j.ijpharm.2016.10.043 |
| [2] |
Qian S, Li Z, Heng WL, et al. Charge-assisted intermolecular hydrogen bond formed in coamorphous system is important to relieve the pH-dependent solubility behavior of lurasidone hydrochloride[J]. RSC Adv, 2016, 6: 106396-106412. DOI:10.1039/C6RA18022A |
| [3] |
Dengale SJ, Ranjan OP, Hussen SS, et al. Preparation and characterization of co-amorphous ritonavir-indomethacin systems by solvent evaporation technique: improved dissolution behavior and physical stability without evidence of intermolecular interactions[J]. Eur J Pharm Sci, 2014, 62: 57-64. DOI:10.1016/j.ejps.2014.05.015 |
| [4] |
Gao Y, Liao J, Qi X, et al. Coamorphous repaglinide-saccharin with enhanced dissolution[J]. Int J Pharm, 2013, 450: 290-295. DOI:10.1016/j.ijpharm.2013.04.032 |
| [5] |
Qian SA, Heng WL, Wei YF, et al. Coamorphous lurasidone hydrochloride-saccharin with charge-assisted hydrogen bonding interaction shows improved physical stability and enhanced dissolution with pH-independent solubility behavior[J]. Cryst Growth Des, 2015, 15: 2920-2928. DOI:10.1021/acs.cgd.5b00349 |
| [6] |
Ali AM, Al-Remawi MM. Freeze dried quetiapine-nicotinamide binary solid dispersions: a new strategy for improving physicochemical properties and ex vivo diffusion[J]. J Pharm, 2016, 2016: 2126056. |
| [7] |
Su ML, Xia YM, Shen YJ, et al. A novel drug-drug coamorphous system without molecular interactions: improve the physicochemical properties of tadalafil and repaglinide[J]. RSC Adv, 2020, 10: 565-583. DOI:10.1039/C9RA07149K |
| [8] |
Xia DZ, Zhang PH, Fu Y, et al. Hepatoprotective activity of puerarin against carbon tetrachloride-induced injuries in rats: a randomized controlled trial[J]. Food Chem Toxicol, 2013, 59: 90-95. DOI:10.1016/j.fct.2013.05.055 |
| [9] |
Wang Y, Ma Y, Zheng Y, et al. In vitro and in vivo anticancer activity of a novel puerarin nanosuspension against colon cancer, with high efficacy and low toxicity[J]. Int J Pharm, 2013, 441: 728-735. DOI:10.1016/j.ijpharm.2012.10.021 |
| [10] |
Jin G, Yang P, Gong Y, et al. Effects of puerarin on expression of apelin and its receptor of 2K1C renal hypertension rats[J]. Chin J Chin Mater Med(中国中药杂志), 2009, 34: 3263-3267. |
| [11] |
Hsu FL, Liu IM, Kuo DH, et al. Antihyperglycemic effect of puerarin in streptozotocin-induced diabetic rats[J]. J Nat Prod, 2003, 66: 788-792. DOI:10.1021/np0203887 |
| [12] |
Zhang S, Chen S, Shen Y, et al. Puerarin induces angiogenesis in myocardium of rat with myocardial infarction[J]. Biol Pharm Bull, 2006, 29: 945-950. DOI:10.1248/bpb.29.945 |
| [13] |
Gao L, Ji X, Song J, et al. Puerarin protects against ischemic brain injury in a rat model of transient focal ischemia[J]. Neurol Res, 2009, 31: 402-406. DOI:10.1179/174313209X444017 |
| [14] |
Tu LX, Yi YN, Wu W, et al. Effects of particle size on the pharmacokinetics of puerarin nanocrystals and microcrystals after oral administration to rat[J]. Int J Pharm, 2013, 458: 135-140. DOI:10.1016/j.ijpharm.2013.10.001 |
| [15] |
Li H, Dong L, Liu Y, et al. Biopharmaceutics classification of puerarin and comparison of perfusion approaches in rats[J]. Int JPharm, 2014, 466: 133-138. DOI:10.1016/j.ijpharm.2014.03.014 |
| [16] |
Xie J, Yang F, Shi X, et al. Improvement in solubility and bioavailability of puerarin by mechanochemical preparation[J]. Drug Dev Ind Pharm, 2013, 39: 826-835. DOI:10.3109/03639045.2012.664147 |
| [17] |
Yuliandra Y, Zaini E, Syofyan S, et al. Cocrystal of ibuprofen(-) nicotinamide: solid-state characterization and in vivo analgesic activity evaluation[J]. Sci Pharm, 2018, 86: 23. DOI:10.3390/scipharm86020023 |
| [18] |
Hancock BC, Zografi G. Characteristics and significance of the amorphous state in pharmaceutical systems[J]. J Pharm Sci, 1997, 86: 1-12. DOI:10.1021/js9601896 |
| [19] |
Karmwar P, Graeser K, Gordon KC, et al. Investigation of properties and recrystallisation behaviour of amorphous indomethacin samples prepared by different methods[J]. Int J Pharm, 2011, 417: 94-100. DOI:10.1016/j.ijpharm.2010.12.019 |
| [20] |
Zhong ZY, Wu M, Qian S, et al. Inhibition of transformation from puerarin monohydrate to puerarin dihydrate by polyvinylpyrrolidones during dissolution[J]. Acta Pharm Sin(药学学报), 2017, 52: 302-308. |
| [21] |
Bayari S, Atac A, Yurdakul S. Coordination behaviour of nicotinamide: an infrared spectroscopic study[J]. J Mol Struct, 2003, 655: 163-170. DOI:10.1016/S0022-2860(03)00256-4 |
| [22] |
Chen AZ, Li Y, Chau FT, et al. Application of organic nonsolvent in the process of solution-enhanced dispersion by supercritical CO2 to prepare puerarin fine particles[J]. J Supercrit Fluid, 2009, 49: 394-402. DOI:10.1016/j.supflu.2009.02.004 |
| [23] |
Heinz A, Strachan CJ, Gordon KC, et al. Analysis of solid-state transformations of pharmaceutical compounds using vibrational spectroscopy[J]. J Pharm Pharmacol, 2009, 61: 971-988. DOI:10.1211/jpp.61.08.0001 |
| [24] |
Ren J, Meng S, Lekka CE, et al. Complexation of flavonoids with iron: structure and optical signatures[J]. J Phys Chem C, 2008, 112: 1845-1850. DOI:10.1021/jp076881e |
| [25] |
Brouwers J, Brewster ME, Augustijns P. Supersaturating drug delivery systems: the answer to solubility-limited oral bioavailability?[J]. J Pharm Sci, 2009, 98: 2549-2572. DOI:10.1002/jps.21650 |
| [26] |
Indulkar AS, Box KJ, Taylor R, et al. pH-dependent liquid-liquid phase separation of highly supersaturated solutions of weakly basic drugs[J]. Mol Pharm, 2015, 12: 2365-2377. DOI:10.1021/acs.molpharmaceut.5b00056 |
| [27] |
Purohit HS, Taylor LS. Phase behavior of ritonavir amorphous solid dispersions during hydration and dissolution[J]. Pharm Res, 2017, 34: 2842-2861. DOI:10.1007/s11095-017-2265-5 |
| [28] |
Purohit HS, Taylor LS. Phase separation kinetics in amorphous solid dispersions upon exposure to water[J]. Mol Pharm, 2015, 12: 1623-1635. DOI:10.1021/acs.molpharmaceut.5b00041 |
| [29] |
Taylor LS, Zhang GGZ. Physical chemistry of supersaturated solutions and implications for oral absorption[J]. Adv Drug Deliv Rev, 2016, 101: 122-142. DOI:10.1016/j.addr.2016.03.006 |
| [30] |
Deneau E, Steele G. An in-line study of oiling out and crystallization[J]. Org Process Res Dev, 2005, 9: 943-950. DOI:10.1021/op050107c |
| [31] |
Kangovi GN, Lee S. Engineering the crystallization behavior of an organic compound mixed with polymers using hidden liquid phase domains[J]. Mol Syst Des Eng, 2020, 5: 177-185. DOI:10.1039/C9ME00063A |
| [32] |
Higuchi T, Connors KA. Phase-solubility techniques[M]//Charles. Advances in Analytical Chemistry and Instrument. New York: Wiley, 1965: 117-122.
|
| [33] |
Brewster ME, Loftsson T. Cyclodextrins as pharmaceutical solubilizers[J]. Adv Drug Deliv Rev, 2007, 59: 645-666. DOI:10.1016/j.addr.2007.05.012 |
| [34] |
Balasubramanian D, Srinivas V, Gaikar VG, et al. Aggregation behavior of hydrotropic compounds in aqueous solution[J]. JPhys Chem C, 1989, 93: 3865-3870. DOI:10.1021/j100346a098 |
 2021, Vol. 56
2021, Vol. 56


