2. 西安交通大学药学院, 陕西 西安 710061;
3. 国家药典委员会, 北京 100061;
4. 国医学科学院、北京协和医学院药物研究所药物晶型研究中心, 晶型药物研究北京市重点实验室, 北京 100050
2. School of Pharmacy, Xi'an Jiaotong University, Xi'an 710061, China;
3. Chinese Pharmacopoeia Commission, Beijing 100061, China;
4. Beijing Key Laboratory of Polymorphic Drugs, Center of Pharmaceutical Polymorphs, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
心力衰竭(简称心衰)是世界范围内的主要死亡原因之一[1], 是各种心脏结构或功能性疾病导致心室充盈和(或)射血功能受损, 心排血量不能满足机体组织代谢需要, 主要临床特征为体循环、肺循环血液淤积及器官、组织血液灌注不足[2]。它是各种严重心血管疾病终末阶段所表现出来的一种临床综合征, 目前全世界约有2 600万心衰患者[3], 心衰引起的入院治疗是目前医院主要收治患者之一, 约占住院率的1%~2%[4]。慢性心衰的发生还会影响患者的神经内分泌、呼吸循环, 伴随有多种严重并发症, 危及患者生命[5]。药物治疗是慢性心衰临床治疗的主要选择, 但即使在心衰确诊后采用最佳的治疗手段, 5年内死亡率仍较高, 尽管采用了循证治疗, 近20年里心衰生存率几乎没有明显改变甚至出现恶化趋势[6], 因而心衰与房颤并称为21世纪两大难题[7]。由于这种疾病的复杂性, 寻找能够降低心衰患者住院与死亡风险的新药十分重要[8]。
诺华制药公司研发了治疗心衰的药物沙库巴曲缬沙坦钠, 于2015年7月7日获得美国FDA的批准上市, 同年11月19日获得欧盟批准, 2017年7月26日在中国上市。商品名Entresto、诺欣妥, 代号为LCZ696。国内外关于心衰诊断和治疗的相关指南均推荐将LCZ696应用于治疗射血分数降低的心衰(HFr EF)患者, 以降低心衰的发病率和死亡率, 包括了2017年美国心脏病学会(ACC)/美国心脏协会(AHA)[9]、2016年欧洲心脏病学会(ESC)[10]以及2018年中华医学会心血管病学分会心力衰竭学组等[11]发布更新的三个指南。
LCZ696是首个血管紧张素受体脑啡肽酶抑制剂(ARNI)药物, 结构如图 1所示, 是由缬沙坦、沙库巴曲、钠离子和水分子按1∶1∶3∶2.5的摩尔比结合形成的离子型共晶药物, 有血管紧张素Ⅱ受体阻滞剂和脑啡肽酶抑制剂的双重作用。2014年ESC年会公布的PARADIGM-HF[12]研究表明, 与依那普利相比, LCZ696使受试者因心衰的住院率下降了21%, 在降低心衰患者的死亡率和住院率方面优于依那普利, 并减少了心衰的症状和身体限制。已有多项研究[13-15]表明, 和传统血管紧张素转换酶抑制剂(ACEI)、血管紧张素Ⅱ受体阻滞剂(ARB)药物相比, LCZ696具有明显的治疗优势, 具体体现在提高患者的心功能、抑制心肌重构、降低患者脑钠肽水平、改善患者生活质量以及降低患者住院率和死亡率等多个方面, 是一种极具市场潜力和前景的抗心衰药物。
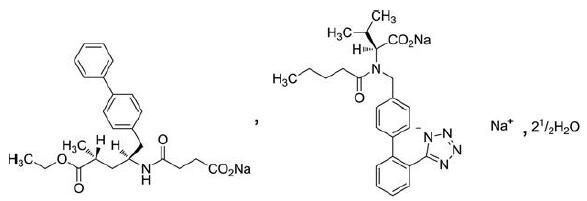
|
Figure 1 Structure of LCZ696 (Mr 957.99) |
药物活性分子(active pharmaceutical ingredient, API)通常因含有各种官能团而具有不同的生物活性, 这些官能团能够利用氢键等非共价键作用与其他有机分子通过分子间的识别作用生成超分子化合物, 即共晶物[16]。美国食品药品监督管理局(food and drug administration, FDA)在2016年发布的《药物共晶监管分类指南》[17]中明确给出了共晶物的定义, 共晶物是在同一晶格中包含2种或2种以上不同分子的结晶物质。《中华人民共和国药典》2020年版[18]中对共晶物的定义是由两种或两种以上的化学物质共同形成的晶态物质, 属晶型物质范畴。通过晶型表征确认超分子化合物的形成, 是鉴别共晶物的一种有效手段。目前对LCZ696的研究主要为临床应用方面[19-21], 关于晶型表征及质量控制方面的文献很少。本研究采用粉末X射线衍射法(powder X-ray diffraction, PXRD)、傅里叶变换红外光谱法(fourier transform infrared spectroscopy, FTIR)、拉曼光谱法(Raman spectra, RM)、差示扫描量热法(differential scanning calorimetry, DSC)和固体核磁共振波谱法(solid state nuclear magnetic resonance, ssNMR)对LCZ696原料药及三种规格共9批片剂的共晶特征进行了表征分析, 获得了5种分析方法的共晶物标准图谱和数据, 并评估这5种方法运用于LCZ696共晶物鉴别的可行性, 同时采用热重法(thermogravimetric analysis, TGA)、动态蒸气吸附法(dynamic vapor sorption, DVS)、引湿性试验(hygroscopicity test, HT)以及卡尔费休水分测定法(Karl Fischer titration, KFT)等分析方法, 对LCZ696的结晶水、引湿性等进行了研究, 为LCZ696的质量控制和贮存条件等提供数据支持。
材料与方法仪器 日本理学公司的D/max-2550 9kw型粉末X射线衍射仪; 美国珀金埃尔默公司的Spectrum 400型红外光谱仪; 奥地利安东帕公司的Cora7200便携式拉曼光谱仪; 瑞士梅特勒-托利多公司的DSC3差示扫描量热仪; 德国布鲁克公司的400 MHz宽腔固体核磁谱仪; 瑞士梅特勒-托利多公司的TGA2热重分析仪; 英国SMS公司的DVS Advantage动态蒸气吸附仪; 德国美墨尔特公司的HPP260恒温恒湿箱; 瑞士梅特勒-托利多公司的V30S水分测定仪; 瑞士梅特勒-托利多公司的XP205DR电子天平。
材料与试剂 LCZ696原料药、3种规格共9批LCZ696片、沙库巴曲钙、缬沙坦、辅料均由企业提供; 按摩尔比为1∶1称取沙库巴曲钙和缬沙坦, 混匀得到沙库巴曲钙与缬沙坦物理混合物(1∶1)(实验室自制); 按摩尔比为1∶3称取LCZ696原料药和辅料, 混匀得到LCZ696原料药与辅料物理混合物(1∶3)(实验室自制); 甲醇(色谱纯, 美国飞世尔公司); Composite 5容量法单组份滴定剂(美国霍尼韦尔公司); 纯化水(实验室自制)。
测定方法
PXRD 测定条件为石墨单色器, Cu-Kα辐射, 波长1.541Å, 管压45 kV, 管流200 mA, 连续扫描模式, 步长0.01°, 扫描速度5°·min-1, 扫描范围2θ为3°至40°。
FTIR 采用衰减全反射法(attenuated total reflection, ATR)测定, 消除压片、研磨等因素对晶型的干扰[22]。扫描范围4 000~650 cm-1, 分辨率4 cm-1, 扫描次数16次。
RM RM与FTIR一样反映化合物分子结构中基团的振动信息, 二者可以形成有力互补[23]。激光波长785 nm, 激光功率400 mw, 平均次数1, 扫描范围100~3 200 cm-1, 单次扫描, 采样间距3~5 mm, 光谱采集环境为暗光, 可避免荧光干扰。选取100~2 300 cm-1作图, 数据处理噪音阈值为2 000。
DSC 称取样品3~4 mg放入不密封的40μL铝坩埚中, 将坩埚放入DSC中进行测试, 以氮气为保护气, 氮气流速20 mL·min-1, 升温范围为30~200℃, 升温速率为10℃·min-1。
ssNMR 可利用供试品不同晶型物质的同一原子核局部的化学环境差异, 引起相应原子核磁共振吸收峰的化学位移、偶合常数、积分值等差异实现对晶型物质状态的鉴别[18]。ssNMR法被《中华人民共和国药典》2020年版四部新增收录, 作为晶型药物的相对鉴别方法。在布鲁克400 MHz宽腔磁体中采集样品的13C谱, 探头为4 mm H/X双共振探头, 采样在5 000 Hz魔角转速下, 通过CPTOSS脉冲序列获得抑制旋转边带的13C谱, 驰豫延时为2 s, 交叉极化接触时间为2 ms。
TGA 称取样品3~4 mg放入不密封的70μL氧化铝坩埚中, 将坩埚放入TGA中进行测试, 氮气流速20 mL·min-1, 升温范围为26~250℃, 升温速率为10℃·min-1。
DVS 温度为25℃, 以氮气为载气, 水蒸气湿度发生器, 采用dm/dt模式, 每分钟样品质量变化小于0.002%视为达到平衡, 即自动进入下一湿度条件。(条件1)相对湿度以10%的变化步进, 从0增加到90%, 再降低到0;(条件2)相对湿度以10%的变化步进, 从0增加到60%, 再降低到0, 重复两个循环。
HT 取干燥的具塞玻璃称量瓶, 于试验前1天置于温度25℃、相对湿度80%恒温恒湿箱内, 精密称定质量m1。取样品适量, 平铺于上述称量瓶中, 精密称定质量m2。将称量瓶敞口, 并与瓶盖同置于上述恒温恒湿条件下若干小时。盖好称量瓶盖子, 精密称定质量m3。条件设置为温度25℃、相对湿度60%, 同法操作。
KFT 溶剂为无水甲醇, 称取样品约50 mg, 不断搅拌下用滴定度为5的费休氏试液滴定, 水分测定仪直接测定。
结果 1 PXRD分析粉末X射线衍射特征峰以2θ值表示, 由图 2可知, 缬沙坦为无定形, 在2θ值为3°~40°内无明显锐锋或窄峰; 沙库巴曲钙明显窄峰也较少, 在2θ=3.36°、7.49°、11.37°、18.74°、22.62°处出现衍射峰; 沙库巴曲钙与缬沙坦物理混合物(1∶1)的特征衍射图基本为沙库巴曲钙和缬沙坦衍射峰的物理叠加; LCZ696原料药与两个单体、物理混合物的衍射图有显著差异, 出现两个明显的锐锋, 2θ=4.23°、12.57°, 与专利报道[24, 25]一致, 表明LCZ696是由沙库巴曲钙和缬沙坦作用形成的新共晶物质, 而不是单纯的物理混合。PXRD可作为LCZ696原料药晶型鉴别的有效方法。
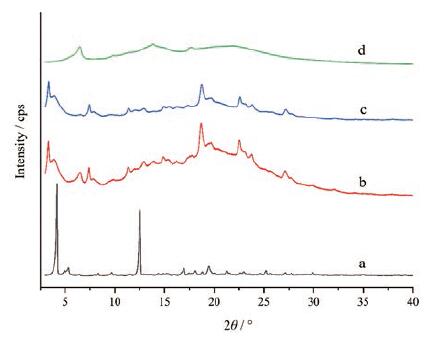
|
Figure 2 Powder X-ray diffraction patterns of LCZ696 (a), physical mixture of sacubitril calcium and valsartan (1∶1)(b), sacubitril calcium (c) and valsartan (d) |
三种规格LCZ696片(50、100和200 mg)的衍射图基本一致, 均在2θ=4.16°、4.97°、5.33°、9.46°、12.53°、14.92°、16.92°、18.09°、22.68°和28.59°处有特征衍射峰, 50 mg与另两种规格在2θ=20~25°之间的衍射峰存在差异, 分析是由于50 mg规格片剂的辅料占比大, 使得辅料的特征衍射峰相对较强。通过定量扣除片剂对应量的辅料得到的衍射图, 与LCZ696原料药的衍射图作比较, 衍射峰位及强度基本一致; LCZ696原料药和辅料按处方比例1∶3混合得到的物理混合物, 与片剂的衍射图基本一致, 表明LCZ696片中原料药仍为共晶物状态, 晶型没有发生变化, 片剂生产工艺未对共晶物的晶型产生影响。
2 FTIR分析图 3是LCZ696原料药等4个样品的FTIR对比图。LCZ696原料药与缬沙坦、沙库巴曲钙、沙库巴曲钙与缬沙坦物理混合物(1∶1)在官能团区1 750~1 400 cm-1存在明显差异, 在该波数范围内, LCZ696原料药主要存在4个红外吸收峰, 分别为1 711 cm-1的羧酸C=O伸缩振动峰、1 637 cm-1的酰胺C=O伸缩振动峰、1 597和1 401 cm-1的羧酸阴离子C=O伸缩振动峰; 缬沙坦主要存在1 730、1 599、1 470和1 409 cm-1等4个红外吸收峰; 沙库巴曲钙主要存在1 727、1 645、1 547和1 439 cm-1等4个红外吸收峰; 沙库巴曲钙与缬沙坦物理混合物(1∶1)的红外光谱图基本为沙库巴曲钙和缬沙坦二者特征吸收峰的物理叠加。LCZ696原料药在红外光谱中表现出的这些差异可归因为缬沙坦和沙库巴曲之间氢键和配位键的作用[26], 例如羧酸C=O伸缩振动峰向低波数移动至1 711 cm-1就是由于氢键的作用。此外, 羧酸阴离子C=O伸缩振动峰的存在表明LCZ696原料药结构中存在阴离子, 是离子型共晶物。FTIR可作为LCZ696原料药晶型鉴别的有效方法。
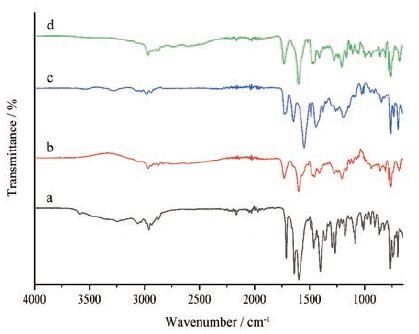
|
Figure 3 Fourier transform infrared spectroscopy (FTIR) spectra of LCZ696 (a), physical mixture of sacubitril calcium and valsartan(1∶1)(b), sacubitril calcium (c) and valsartan (d) |
LCZ696片的FTIR图谱见图 4, 三种规格的红外图谱基本一致, 均有1 711、1 637、1 597和1 401 cm-1等LCZ696原料药的特征吸收峰。50 mg与另两种规格在1 200~1 000 cm-1内吸收峰的个数存在差异, 具体表现在100 mg和200 mg规格主要存在1 085、1 010 cm-1等尖吸收峰, 而50 mg规格是在1 020 cm-1处有一个宽吸收峰, 这是由于50 mg规格片剂的辅料占比大, 使得辅料的红外吸收对其影响大。LCZ696原料药和辅料混合物(1∶3)的红外图谱与LCZ696片基本一致, 表明LCZ696片剂生产工艺未对共晶物的晶型产生影响, 也没有改变原料药的结构, FTIR的结论与PXRD是一致的。

|
Figure 4 FTIR spectra of physical mixture of LCZ696 and excipients (1∶3)(a), LCZ696 tablets 50 mg (b), 100 mg (c), 200 mg (d), excipients(e), and LCZ696 (f) |
图 5是LCZ696原料药、沙库巴曲钙、缬沙坦、沙库巴曲钙与缬沙坦物理混合物(1∶1)的RM图, LCZ696原料药与其他三个样品各不相同, 主要体现在500~1 700 cm-1内峰数量、峰位置和峰强度的差异, 以及1 610 cm-1处最强峰和1 286 cm-1处次强峰的峰强度之比。
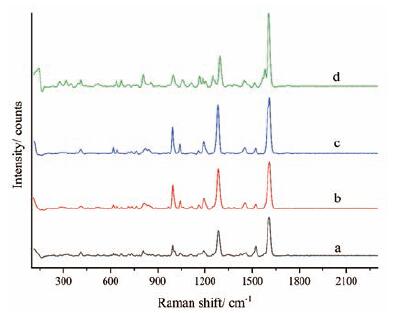
|
Figure 5 Raman spectra of LCZ696 (a), physical mixture of sacubitril calcium and valsartan (1∶1)(b), sacubitril calcium (c)and valsartan (d) |
三种规格LCZ696片以及原辅料混合物(1∶3)的RM图基本一致, 均在807、997、1 286、1 522和1 610 cm-1处有特征散射峰, 由于辅料的影响, 50 mg规格在1 100 cm-1处与另两种规格存在细微差异。和PXRD和FTIR相比, 拉曼光谱法的区分力较弱, 可用于佐证这两种方法的结论。
4 DSC分析根据样品的DSC图分析, 缬沙坦和沙库巴曲钙都仅有一个吸热峰, 熔点分别为101.6和72.9℃, 二者物理混合物(1∶1)的DSC曲线是缬沙坦和沙库巴曲钙两个吸热峰的加和, 熔点分别为100.7和76.8℃。而LCZ696原料药的DSC图中, 原有单体的吸热峰消失了, 取而代之形成了两个新的吸热峰, 第一个熔点为113.1℃, 提示为结晶水的吸热峰, 第二个熔点为152.4℃, 表明形成了熔点区别于缬沙坦和沙库巴曲钙单体的新物质。3种规格的LCZ696片均有三个吸热峰, 是辅料和LCZ696原料药吸热峰的加和, 各批次间的DSC数据基本一致。测定结果见表 1。
| 表 1 DSC experiment results of samples. Peak: Melting point; Delta H: The enthalpy change |
取LCZ696原料药和100 mg规格片剂分别重复测定3次, 考察DSC方法的重复性, 不同吸热峰的熔点温度极差在2.0~10.4内, RSD介于0.8%~4.0%。以上研究表明DSC法可鉴别LCZ696原料药的晶型, 仍需进一步考察实验中影响熔点温度的因素, 以期获得重复性更优的数据。
5 ssNMR分析图 6是LCZ696原料药、缬沙坦、沙库巴曲钙、沙库巴曲钙与缬沙坦物理混合物(1∶1)的ssNMR图, LCZ696原料药与其他三个样品有明显的区别, 谱峰更尖细, 表明LCZ696原料药分子更有序, 结晶性更好。沙库巴曲钙与缬沙坦物理混合物(1∶1)的谱图与两个单体谱图的加和基本一致, 表明简单的物理混合不能形成共晶。在化学位移δ150~170区域内, 缬沙坦在δ154处的谱峰归属为其四氮唑上的C, 由于LCZ696是缬沙坦和沙库巴曲钙形成的共晶, 其结构中缬沙坦四氮唑上的N原子与沙库巴曲钙中酰胺氨基上的H原子形成-N-H…N-氢键, 使缬沙坦四氮唑上C的屏蔽效应减弱, 因此化学位移向低场移动至δ162。ssNMR法可作为LCZ696原料药的晶型有效鉴别方法, 但该法目前不太普及, 故不建议作为该品种的质量控制方法。
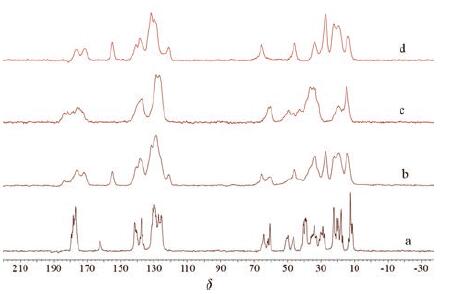
|
Figure 6 Solid-state nuclear magnetic resonance spectra of LCZ696 (a), physical mixture of sacubitril calcium and valsartan(1∶1)(b), sacubitril calcium (c) and valsartan (d) |
三种规格LCZ696片以及原辅料混合物(1∶3)的ssNMR峰形、峰位移基本一致, 表明片剂的生产工艺稳定, 且生产工艺未对片剂中共晶原料的晶型和结构产生影响。
6 结晶水和引湿性研究根据LCZ696原料药的TGA图分析, 35~65℃出现第一个失重台阶, 失重率为0.3%, 推测样品失去吸附水; 70~145℃出现第二个失重台阶, 失重率为4.0%, 分析样品失去结晶水; 145~195℃出现第三个失重台阶, 失重率为0.8%, 分析样品进一步失去结晶水。两步失去结晶水的和是4.8%, 与LCZ696的结构式中所含2.5个水分子的理论值4.7%相符, 表明LCZ696原料药样品中含有2.5个结晶水, 在TGA试验升温过程中已完全失去。样品从约210℃开始分解, 之后重量急速下降。
DVS是通过测定样品在一定温度和不同相对湿度的条件下达到平衡状态时样品质量的变化, 计算蒸气吸附、解吸附的平衡量, 根据它们之间的关系绘制吸附-解吸附等温线, 从而研究样品吸附水蒸气的趋势和程度。采用条件1测定, 相对湿度(RH)从0增加到90%, 再降低到0, 得到吸附-解吸附等温线如图 7所示, LCZ696极具引湿性, 呈现Ⅳ型等温线, 样品在RH60%以下形成了结晶水, 随着相对湿度的增加, 开始形成吸附水。从图中可以观察到明显的滞后环, 可能是由于发生了毛细管凝聚。选择RH60%为节点, 采用条件2进一步试验, RH从0增加到60%, 再降低到0, 重复两个循环, 至RH60%LCZ696原料药共吸附增重4.5%, 形成结晶水, 呈现完全可逆的过程。
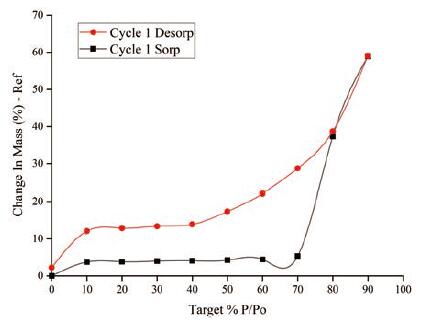
|
Figure 7 Adsorption-desorption isotherm of LCZ696 by condition 1 |
基于DVS研究结果, 将LCZ696原料药分别放置在25℃、60%和25℃、80%的恒温恒湿箱中进行引湿性试验, 结果LCZ696原料药在25℃、60%条件下放置24 h样品质量几乎没有变化, 不会和水发生相互作用。在25℃、80%条件下放置24 h增重34.5%, 极具引湿性。LCZ696原料药在高于RH70%的环境中就会发生潮解。
采用卡尔费休水分测定法测定LCZ696原料药在25℃、60%条件放置122 h后的水分值, 与原样进行比较, 水分值基本一致, 分别为5.75%(n=3)和5.76%(n=3), 验证了LCZ696原料药在25℃、60%条件不与水发生相互作用。
结合TG、DVS、引湿性试验和水分测定结果, LCZ696原料药含有2.5个结晶水, 极具引湿性, 建议设置水分检查项, 在RH60%以下的环境中贮存。
讨论本研究采用PXRD、FTIR、RM、DSC、ssNMR等不同分析技术对LCZ696原料药及片剂进行表征研究, 证明LCZ696为共晶, 结果表明以上手段都可实现对LCZ696共晶物质状态的有效鉴别。其中FTIR和RM同为反映分子结构中基团的振动信息, RM的区分力相对较弱, 二者相比FTIR更适合作为质控手段; PXRD操作过程简便, 不破坏样品, 测定结果准确, 可作为药物晶型定性判断的依据; DSC测定结果表明需进一步考察熔点温度的影响因素, 以获得重复性更佳的数据; ssNMR有区分力, 但目前还不够普及, 试验成本较高。因此经过比较研究, PXRD和FTIR最适合作为LCZ696的常规质控手段, 既可鉴别LCZ696原料药的晶型, 又可对LCZ696片中原料药的晶型进行定性。
通过TG、DVS、引湿性试验和水分测定的结果, LCZ696极具引湿性, 建议在RH60%以下的环境中贮存, 设置水分检查项以控制结晶水和吸附水的含量。
本研究获得的标准图谱可作为晶型鉴别与质量控制的对照图谱使用, 为LCZ696药物的质量控制提供标准与科学数据, 对其他共晶药物的质量评价有技术指导作用。
致谢: 感谢诺华制药公司提供的支持。
作者贡献: 熊婧负责表征实验、数据处理及稿件撰写; 徐德忠参与实验及数据处理; 徐昕怡提供优质的课题研究平台; 吕扬为实验设计提出宝贵的参考意见; 杨世颖负责对实验数据复核及处理分析; 王嗣岑指导和修改稿件。
利益冲突: 无任何利益冲突。
| [1] |
Chunduri RHB, Dannana GS. Development and validation of a reliable and rapid LC-MS/MS method for simultaneous quantification of sacubitril and valsartan in rat plasma and its application to a pharmacokinetic study[J]. Biomed Chromatogr, 2016, 30: 1467-1475. DOI:10.1002/bmc.3707 |
| [2] |
He YQ, Liu YM, Yan FF. Meta analysis of efficacy and safety of LCZ696 in treatment of heart failure[J]. Clin Focus(临床荟萃), 2020, 35: 581-588. |
| [3] |
Zhao G, Zhang H. Research progress of sacubitril valsartan in cardiovascular diseases[J]. Anhui Med Pharm J(安徽医药), 2020, 24: 1273-1277. |
| [4] |
Jin CC, Zhang XW. Research progress of natural medicines and bioactive compounds against heart failure[J]. Acta Pharm Sin(药学学报), 2020, 55: 1147-1156. |
| [5] |
Wang LJ, Bai HX, Fan H. Clinical study on Yixinshu capsules combined with recombinant human brain natriuretic peptide in treatment of chronic congestive heart failure[J]. Drugs Clin(现代药物与临床), 2016, 31: 619-622. |
| [6] |
Du X, Han HY, Dong J, et al. Analysis of clinical application of LCZ696 tablets in patients with chronic heart failure[J]. Chin Remed Clin(中国药物与临床), 2020, 20: 2930-2931. |
| [7] |
Yu B, Ding JW, Wang XA. Progress of entresto in the treatment of heart failure[J]. Hainan Med J(海南医学), 2018, 10: 1420-1422. |
| [8] |
Ragab MAA, Galal SM, Korany MA. First derivative emission spectrofluorimetric method for the determination of LCZ696, a newly approved FDA supramolecular complex of valsartan and sacubitril in tablets[J]. Luminescence, 2017, 32: 1417-1425. DOI:10.1002/bio.3339 |
| [9] |
Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/AHA/HFSAfocused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American college of cardiology/American heart association task force on clinical practice guidelines and the Heart Failure Aociety of America[J]. Circulation, 2017, 136: e137-161. |
| [10] |
Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology(ESC)developed with the special contribution of the Heart Failure Association(HFA)of the ESC[J]. Eur Heart J, 2016, 37: 2129-2200. DOI:10.1093/eurheartj/ehw128 |
| [11] |
Heart Failure Group, Chinese Society of Cardiology, Professional Committee of Heart failure of Chinese Physicians Association, Editorial Board of Chinese Journal of Cardiovascular Diseases. Chinese heart failure diagnosis and treatment guide 2018[J]. Chin J Cardiol(中华心血管病杂志), 2018, 46: 760-789. |
| [12] |
Mc Murray JJ, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure[J]. N Engl J Med, 2014, 371: 993-1004. DOI:10.1056/NEJMoa1409077 |
| [13] |
Bloch MJ, Basile JN. Combination angiotensin receptor blocker neutral endopeptidase inhibitor provides additive blood pressure reduction over angiotensin receptor blocker alone[J]. J Clin Hypertens, 2010, 12: 809-812. DOI:10.1111/j.1751-7176.2010.00358.x |
| [14] |
Gu J, Noe A, Chandra P, et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dual-acting angiotensin receptorneprilysin inhibitor(ARNi)[J]. J Clin Pharmacol, 2010, 50: 401-414. DOI:10.1177/0091270009343932 |
| [15] |
Feng X. Short-Term Efficacy of Sacubitril/Valsartan on Coronary Heart Disease-Induced Heart Failure(沙库巴曲缬沙坦对冠心病所致心衰的短期疗效观察)[D]. Hengyang: University of South China, 2020.
|
| [16] |
Chen JM, Wu CB, Lu TB. Application of supramolecular chemistry on pharmaceutical cocrystals[J]. Chem J Chin Univ(高等学校化学学报), 2008, 32: 1996-2009. |
| [17] |
U. S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research(CDER). Regulatory classification of pharmaceutical co-crystals, Revision 1[EB/OL]. Silver Spring, MD. 2016-08[2020-10-25]. https://www.fda.gov/media/99917/download.
|
| [18] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China(中华人民共和国药典)[S]. Part 4. Beijing: China Medical Science Press, 2020: 476-478.
|
| [19] |
Wang CY, Li SY. Clinical study of Lixin Pills combined with sacurabatril valsartan sodium in treatment of chronic heart failure[J]. Drugs Clin(现代药物与临床), 2020, 35: 2028-2032. |
| [20] |
Teng LF, Lin J, Huang YB. Observation of effect of sacubitril valsartan sodium tablets on the treatment of dilated cardiomyopathy[J]. Chin J Pharmacoepidemiol(药物流行病学杂志), 2020, 29: 525-528. |
| [21] |
Jian CY, Wu YF, Jiang J, et al. Clinical study of protective effect of sacubatril valsartan sodium on cardiac function in patients with acute myocardial infarction treated by direct PCI[J]. Chin JMod Drug Appl(中国现代药物应用), 2020, 14: 143-145. |
| [22] |
Zhang Y, Gong NB, LÜY. Polymorphism screening, preparation and identification of adapalene[J]. Chin J New Drugs(中国新药杂志), 2016, 25: 1108-1113. |
| [23] |
Zhou J, Yang SY, Jin GM, et al. Application progress of raman spectroscopy in the study of drug polymorphism[J]. Her Med(医药导报), 2019, 38: 197-202. |
| [24] |
Feng LL, Gottfredson SE, Kapinski P, et al. Drug combination product of angiotensin receptor antagonist and NEP inhibitor: CN, 102702119 A[P]. 2012-10-03.
|
| [25] |
Chen WH. A new crystal form of LCZ696 and its preparation method: CN, 109912525 A[P]. 2019-06-21.
|
| [26] |
Liu XJ, Zhang Y, Wang XZ. Study on co-crystallization of LCZ696 using in situ ATR-FTIR and imaging[J]. Crystals, 2020. DOI:10.3390/cryst10100922 |
 2021, Vol. 56
2021, Vol. 56


