2. 武汉友芝友生物制药有限公司, 湖北 武汉 430075;
3. 北京大学第三医院药物临床试验机构, 北京 100191
2. Wuhan YZY Biopharma Co., Ltd., Wuhan 430075, China;
3. Drug Clinical Trial Center, Peking University Third Hospital, Beijing 100191, China
M701是一种用于治疗恶性腹水的新型双特异性抗体, 其双抗原识别区可分别结合肿瘤细胞表面上皮细胞黏附因子(epithelial cell adhesion molecule, Ep‐CAM)抗原和免疫细胞表面CD3抗原, 拉近二者的空间距离, 激活免疫细胞, 发挥杀伤肿瘤细胞的作用[1]。M701拟用于的临床适应证是Ep CAM高表达的癌症病人(结肠癌、卵巢癌等)中由癌细胞腹腔转移引起的恶性腹水。临床前体外[1]及体内药效实验表明, M701对于Ep CAM高表达的肿瘤细胞及肿瘤模型动物均显示出较强的肿瘤抑制作用; 且临床前毒理实验表明, M701在BALB/c小鼠及食蟹猴中均有良好的耐受性, 最大耐受剂量(maximal tolerable doses, MTD)分别为126和30 mg·kg-1。
群体药动学/药效学(pharmacokinetic/pharmaco‐dynamic, PK/PD)模型使用数学和统计学模型集成不同试验数据, 定量地描述、解释和预测药物的药动学和药效学行为并量化其影响因素[2, 3]。近年来, 药动学/药效学模型与仿真在抗体类药物中的应用逐渐增多[4]。在抗肿瘤药物的临床前体内研究中, 肿瘤模型动物肿瘤体积(或重量)是一个重要的药效指标, 该指标可以直观反映药物对肿瘤生长的抑制作用[5]。目前文献中报道的用于评估肿瘤模型动物的肿瘤体积(或重量)生长抑制的模型有Simeoni模型[6], logistic模型[7]和Koch模型[8]等。根据动物肿瘤生长曲线的具体特征选择上述模型中的最佳模型[5]。
本研究使用非线性混合效应模型法(nonlinear mixed-effect modeling, NONMEM), 基于临床前M701在人结肠癌异种移植小鼠中的药动学数据及肿瘤体积数据构建M701药动学/药效学模型。定量评估M701的药动学特征及药物浓度对肿瘤生长抑制作用, 为新化合物M701进一步临床研发提供药效学参考。
材料与方法药动学数据 本研究使用的血浆药物浓度数据来源于[125I]M701单次尾静脉注射给予HCT116荷瘤小鼠的组织分布实验。实验选用HCT116荷瘤小鼠24只, 雌雄各半, 体重18~20 g, 购于常州卡文斯实验动物有限公司, 合格证编号201603310, 实验严格遵守武汉友芝友公司动物实验福利规定。实验首先使用[125I]对M701进行标记, 活性验证合格后进行动物实验[125I]M701单次尾静脉注射给药, 给药剂量为30μg·kg-1。给药后30 min及6、24、72 h处死动物后采集血液及各组织。利用γ计数仪测量血浆总放射性及沉淀放射性, 按照标记产物比活度转化为血浆各组织中药物浓度。本研究使用血浆浓度数据构建PK模型。
肿瘤体积生长数据 肿瘤体积数据来源于HCT116人源结肠癌异种移植瘤小鼠体内药效实验。实验动物购于北京维通利华实验动物技术有限公司, 合格证编号11400700116064, 实验严格遵守武汉友芝友公司动物实验福利规定。动物模型通过在NOD-SCID小鼠侧背部皮下按1∶1的比例接种人细胞因子诱导的杀伤(cytokine-induced killer, CIK)细胞和人结肠癌HCT116细胞获得。其中CIK细胞为免疫细胞是将人外周血单核细胞在体外用多种细胞因子共同培养后获得的异质细胞, 其表面可表达CD3+膜蛋白分子。将人结肠癌异种移植小鼠随机分为对照组及低、中、高给药组(每组8只, 起始体重为18~20 g), 各组小鼠在接种后第0、2、4天经过尾静脉分别给予溶剂及0.1、1、2 mg·kg-1 M701。在接种后的第7、9、12、14、16、19、21、23、26、28、30和33天测量肿瘤的长径(L)和短径(W), 按照椭球体体积V=π/6×L×W2计算肿瘤体积[9, 10]。由于高剂量组(2 mg·kg-1)全部小鼠及中剂量组(1 mg·kg-1)中3只小鼠的肿瘤体积均低于定量下限, 因此本研究用于PK/PD建模的剂量组为溶剂组、0.1 mg·kg-1组及1 mg·kg-1组中高于定量下限的个体。
软件 本研究使用NONMEM软件(版本7.4.0, ICON Development Solutions, MD, USA)进行群体药动学/药效学模型化, 模型参数估算方法为带互相作用的一级条件评估法(first order conditional estimation with η-ε interaction option, FOCEI), 使用PsN (perl-speaksnonmem版本4.8.1, Uppsala, Sweden)作为NONMEM运行的辅助软件。使用R (版本3.6.2, Foundation for Statistical Computing, Vienna, Austria; http://www.rproject.org)用于数据整理及模型结果图形制作。
药动学模型构建 分别尝试一室、二室模型对[125I]M701在人结肠癌异种移植小鼠中的药物浓度-时间曲线进行建模。通过比较目标函数值(objective function value, OFV)、模型数据拟合优度, 及各参数合理性等选取最优者为PK结构模型。
肿瘤自然生长模型构建 采用Semeoni模型描述对照组中人结肠癌异种移植小鼠肿瘤体积的增长动力学, 即使用先指数增长后线性增长的数学方程描述肿瘤体积随时间变化曲线, 用方程1表示。
| $\frac{\mathrm{d} v(t)}{\mathrm{d} t}=\frac{\lambda_{0} \cdot v(t)}{\left[1+\left(\frac{\lambda_{0}}{\lambda_{1}} \cdot v(t)\right)^{\psi}\right]^{\frac{1}{\psi}}} \\ v(0)=v_{0}$ | (1) |
其中, v(t)代表t时间的肿瘤体积, λ0和λ1分别表示肿瘤体积指数增长及线性增长速率常数, ψ=20作为经验系数引入以实现方程从指数阶段向线性阶段的迅速切换。
药物PK/PD模型构建 利用小鼠中给药组的数据, 在肿瘤自然进展模型的基础上, 整合药物的PK模型, 反映肿瘤生长随药物浓度变化的动态规律, 建立PK/PD模型, 模型结构如图 1所示。该模型假设: ①在给药后肿瘤增殖隔室(X1)的肿瘤细胞保持继续增殖, 且药物以k2·c(t)速率促使肿瘤细胞由增殖状态向凋亡状态转移, 发挥其细胞毒性作用; ②给药后肿瘤细胞从增殖状态经凋亡到最终死亡不是瞬间实现的, 具有一定的时间延迟, 因此引入转移隔室模型(transit compartment model) X2~X4表示肿瘤细胞凋亡相较于给药的延迟作用; ③肿瘤体积是增殖隔室和所有转移隔室中肿瘤体积之和。PK/PD模型方程见式2~6。
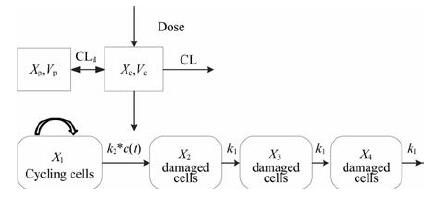
|
Figure 1 Scheme of PK-PD model of bispecific cluster of differentiation 3/epithelial cell adhesion molecule (CD3/EpCAM) T-cell engager antibody M701 in human colorectal cancer xenograft mice. Xc: Amount of M701 in central compartment; Xp: Amount of M701 in peripheral compartment; Vc: Distribution volume in central compartment; Vp: Distribution volume in peripheral compartment; CLd: Clearance of peripheral compartment |
| $\frac{\mathrm{d} X_{1}(t)}{\mathrm{d} t}=\frac{\lambda_{0} \cdot X_{1}(t)}{\left[1+\left(\frac{\lambda_{0}}{\lambda_{1}} \cdot v(t)\right)^{\psi}\right]^{\frac{1}{\psi}}}-k_{2} \cdot c(t) \cdot X_{1}(t) \\ X_{1}(0)=v$ | (2) |
| $\frac{\mathrm{d} X_{2}(t)}{\mathrm{d} t}=k_{2} \cdot c(t) \cdot \mathrm{X}_{1}(t)-k_{1} \cdot X_{2}(t) \\ X_{2}(0)=0$ | (3) |
| $\frac{\mathrm{d} X_{3}(t)}{\mathrm{d} t}=k_{1} \cdot\left[X_{2}(t)-X_{3}(t)\right] \\ X_{3}(0)=0$ | (4) |
| $\frac{\mathrm{d} X_{4}(t)}{\mathrm{d} t}=k_{1} \cdot\left[X_{3}(t)-X_{4}(t)\right] \\ X_{4}(0)=0$ | (5) |
| $v(t)=X_{1}(t)+X_{2}(t)+X_{3}(t)+X_{4}(t)$ | (6) |
其中, X1(t)代表t时刻肿瘤细胞继续增殖部分, c(t)代表t时刻药物浓度, k2代表药物效应参数, v(t)表示t时刻肿瘤体积; X2~X4隔室表示肿瘤细胞凋亡的不同阶段, k1表示肿瘤细胞在不同转移隔室之间的转移速率常数。
统计学模型 对于PK模型及肿瘤生长模型, 个体间随机效应模型均选用指数型误差模型, 见式7。
| $P_{i j}=P_{\mathrm{TV}, j} \cdot \operatorname{Exp}\left(\eta_{i j}\right)$ | (7) |
其中, Pij是第i个个体的第j个模型参数, PTV, j是第j个模型参数的群体典型值, ηij代表个体参数Pij对群体参数PTV, j的个体间随机变异, 其值符合以0为中心、方差为ω2的正态分布。残留随机误差采用比例性误差模型计算, 见式8。
| $C_{\mathrm{obs}}=C_{\text {pred }} \cdot(1+\varepsilon)$ | (8) |
其中, Cobs和Cpred分别为观测值和预测值。ε为比例性误差, 其值符合以0为中心、方差为σ2的正态分布。
模型验证评价 本研究对不同模型的拟合优度(goodness-of-fit, GOF)通过绘制诊断图来评估模型的适当性。评估观测值(observed data, OBS)对群体预测值(predictive data, PRED)和个体预测值(individual predictive data, IPRED)作图是否均匀分布在y=x周围。评估条件加权残差(conditional weighted residual error, CWRES)对群体预测值PRED和给药后时间作图是否均匀分布在x轴周围, 用于评估残留误差模型是否合适。此外, 本研究采用个体拟合图评估参与模型构建的单个个体的观测值, 群体预测值和个体预测值随时间曲线的具体拟合情况, 可以更加直接地评估模型对每个个体的预测准确度。
本研究采用可视化预测检测(visual predictive check, VPC)评估模型的预测性能。VPC是基于模拟的模型验证方法。对于每次模拟, 使用模型参数估算值、随机效应的个体间变异、随机误差产生模拟数据。分别计算出观测值和预测值的5%、50%和95%分位数值, 并得出预测值的5%、50%和95%分位数的90%置信区间(confidence interval, CI)。然后将观测值及预测值以图示法叠加在一张图上, 评估模型的预测性能。
药物PK/PD模型的仿真 基于PK/PD模型, 仿真不同给药方案下M701对人结肠癌异种移植小鼠30天内肿瘤体积生长的抑制作用, 表 1为拟定的仿真给药方案。基于仿真结果, 为后续研究选择最优的给药方案提供参考。
| 表 1 Simulated dose regimens based on pharmacokinetic/pharmacodynamic (PK/PD) model |
分别考察不同模型结构对人结肠癌异种移植小鼠PK数据的拟合程度。最终选择二室模型作为PK模型结构。模型的药动学参数结果见表 2, 各参数的估算值相对标准误(relative standard error, RSE)在50%之内。
| 表 2 PK parameters of M701 in the human colorectal cancer xenograft mice. RSE: Relative standard error |
肿瘤自然生长模型以及药物的PK/PD模型参数如表 3所示, 各参数的估算值RSE均在50%之内(多数参数在30%以内)。模型拟合优度(goodness-of-fit, GOF)如图 2所示, 群体(图 2A)及个体(图 2B)预测肿瘤体积均较好的拟合观测值; 模型误差较为均匀和集中的分布在x轴的两侧(图 2C及图 2D), 没有明显的呈现趋势性偏移。个体拟合图见图 3 (编号1~21表示不同的个体), 个体肿瘤体积的预测值均能很好的拟合观测值。肿瘤自然生长(图 4A)、0.1 mg·kg-1(图 4B)、1 mg·kg-1(图 4C) M701 PK/PD模型的VPC结果(模拟500次)显示观测值的5%、50%和95%分位数值均分布在预测值对应分位数的90%置信区间内。
| 表 3 PK/PD parameter estimates of M701 in the treatment of human colorectal cancer xenograft. IIV: Inter-individual variability |
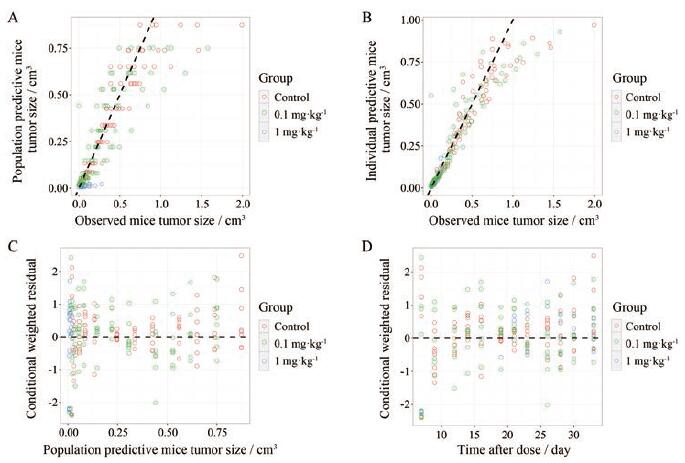
|
Figure 2 Goodness of fit (GOF) plot of tumor growth model of human colorectal cancer xenograft mice.A: Population predictive data versus observed data; B: Individual population predictive data versus observed data; C: Conditional weighted residual versus population predictive data; D: Conditional weighted residual versus time |
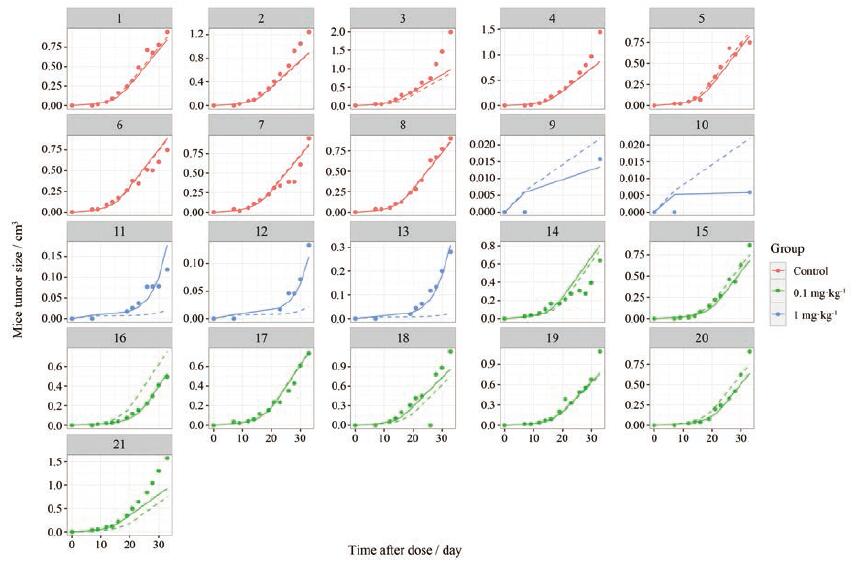
|
Figure 3 Individual predicted and observed fitted plot of tumor growth model of human colorectal cancer xenograft mice.Points, dashed lines and lines represent observed data, population predictive data and individual predictive data, respectively.No.1-21:Different individual numbers |
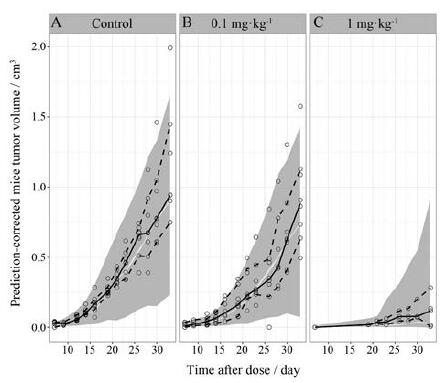
|
Figure 4 Visual predictive check (VPC) for rat tumor growth model of human colorectal cancer xenograft mice for control (A), 0.1 mg·kg-1(B) and 1 mg·kg-1(C) group.Points represent observed data; three dashed lines represent 95%, 50% and 5% quantile of observed data.Ribbons represent 90% CI on 95%, 50% and 5% quantile of simulated data |
不同给药方案下PK/PD模拟的肿瘤体积见图 5。图 5A使用了2.0 mg·kg-1剂量组隔日一次给药的观测数据(点)对该剂量下PK/PD模型预测数据(线)进行外部验证, 可见预测数据可以较好的拟合观测数据, 说明了模型的预测性和准确性良好。图 5B和5C分别为给药间隔为6天和给药间隔为3天下相同日剂量组给药后模拟的肿瘤体积生长曲线。两图比较可见, 在日给药剂量相同的情况下, 两种给药方式下药效基本一致。从不同剂量组给药后的仿真结果可以看出0.5 mg·kg-1剂量组每6日给药和0.25 mg·kg-1剂量组每3日给药即可有效地抑制肿瘤体积的增长。

|
Figure 5 Simulated tumor volume of different dose regimens based on PK/PD model.A: Model validation based on observed data of 2 mg·kg-1 QOD once every two days administration, line represented simulated data, point represented observed data; B: Dosing interval of 6 days; C: Dosing interval of 3 days |
本研究采用药动学/药效学模型, 评估M701对人结肠癌异种移植小鼠肿瘤生长的抑制作用。其中人结肠癌异种移植小鼠的PK模型选择二房室模型描述, 与M701在食蟹猴静脉注射0.3、1和3 mg·kg-1后的PK模型一致(另文发表)。此外, 食蟹猴静脉注射M701后, 其PK特征在0.3~3 mg·kg-1剂量内均呈现线性特征, 也为本研究中人结肠癌异种移植小鼠的PK在PK/PD模型剂量范围内(0.1~2 mg·kg-1)呈现线性的假设提供支持。
本研究中人结肠癌异种移植小鼠PK模型估测的清除率数值为0.039 4 mL·h-1, 与小分子药物相比, 抗体药物在体内的清除率数值偏低, 这主要是由于抗体药物体内的消除并非经肝肾系统作用(分子质量大于70 kD的抗体药物肾排泄所占比例即可忽略不计), 而是经过淋巴系统消除[11, 12]。IgG构架的抗体药物(如M701)主要的消除途径为细胞内吞和蛋白降解; 少部分抗体会经受体介导的方式消除[11, 12]。在细胞内吞过程中, 抗体药物能与如新生Fc受体(neonatal Fc receptor, FcRn)结合被保护, 因此, 抗体药物的代谢半衰期普遍较长, 血浆中药物浓度下降缓慢, 清除率数值偏低[12]。
本研究中人结肠癌异种移植小鼠溶剂对照组中肿瘤体积生长曲线呈现先指数增长后线性增长的特征, 因此本研究未选择平稳描述肿瘤体积生长曲线的Koch模型[8]。在肿瘤生长模型构建初期, 分别尝试采用Semeoni模型和logistic模型拟合对照组及给药组中肿瘤生长数据[5]。其中Semeoni模型是基于经验的数学模型, logistic模型由于引入了肿瘤饱和体积这一参数, 限制了肿瘤的增殖上限, 使得肿瘤生长曲线能够出现平台期[5, 7]。本研究对两种模型均进行了尝试, 最终Semeoni模型可以较好的拟合观测数据, 模型参数值也更符合评价标准。这可能由于在当前采样时间内小鼠肿瘤体积生长数据并未明显观察到平台期, 导致logistic模型的拟合结果并不优于Semeoni模型。使用Semeoni模型计算的肿瘤体积初始值v0为0.004 5 cm3, 低于实际测量中定量下限的标准, 吻合本研究人结肠癌异种移植小鼠初始肿瘤体积观测值(定量下限); 此外, 目前模型估算出的肿瘤指数生长常数λ0(0.212 d-1)与文献报道的Semeoni模型在人结肠癌异种移植小鼠中估算的肿瘤生长常数λ0(0.146 d-1)接近, 肿瘤线性生长常数λ1(0.044 7 cm3·d-1)与文献值0.334 cm3·d-1有差异, 可能与两个研究中接种的肿瘤细胞数量或动物类型(文献为裸鼠, 本研究为NOD-SCID小鼠)有关[6], 且模型拟合的λ1的个体间随机效应接近0, 因此本研究固定λ1的IIV值为0;由于目前缺乏抗体类药物应用Semeoni模型的报道, 因此药效相关参数(k1, k2)还有待相关文献验证, 此外当前研究中荷瘤小鼠的药效实验的给药时间是从肿瘤接种当天开始的, 而不是待肿瘤生长到一定体积再开始给药。对于给药组来说, 部分药物效应将合并于肿瘤初期生长过程, 这可能会对模型药效相关参数(k1, k2)的估算产生一定的影响。
综上所述, 本研究使用二房室模型拟合双特异性抗体M701在人结肠癌异种移植小鼠体内的药动学行为。在此基础上整合M701抑制人结肠癌异种移植瘤生长的药效学数据, 建立并评价了M701抑制肿瘤生长的PK/PD模型。该模型可定量理解M701在人结肠癌异种移植小鼠的抗肿瘤效果, 为新化合物M701的进一步药物研发提供支持。
作者贡献: 在本研究中, 宋玲、姚庆宇、薛钧升负责数据整理及模型构建与仿真工作; 李思、张敬提供了建模所需的临床前实验数据; 周田彦、刘东阳、宋玲负责整体研究设计; 宋玲、周田彦负责文章撰写与审阅。
利益冲突: 本研究内容无任何利益冲突。
| [1] |
Zhang CM, Yu LY, Lv JF, et al. Effects of immuno-related gene polymorphisms on a bispecific antibody targeting colorectal cancer cell[J]. Per Med, 2018, 15: 167-179. DOI:10.2217/pme-2017-0071 |
| [2] |
Chen WJ, Zhou TY, Lu W. Population pharmecokinetics and its application in new drug research[J]. Acta Pharm Sin(药学学报), 2017, 52: 371-377. |
| [3] |
Marshall SF, Burghaus R, Cosson V, et al. Good practices in model-informed drug discovery and development: practice, application, and documentation[J]. CPT Pharmacomet Syst Pharmacol, 2016, 5: 93-122. DOI:10.1002/psp4.12049 |
| [4] |
Diao L, Meibohm B. Pharmacometric applications and challenges in the development of therapeutic antibodies in immuno-oncology[J]. Curr Pharmacol Rep, 2018, 4: 285-291. DOI:10.1007/s40495-018-0142-5 |
| [5] |
Carrara L, Lavezzi SM, Borella E, et al. Current mathematical models for cancer drug discovery[J]. Expert Opin Drug Discov, 2017, 12: 785-799. |
| [6] |
Simeoni M, Magni P, Cammia C, et al. Predictive pharmacoki‐netic-pharmacodynamic modeling of tumor growth kinetics in xenograft models after administration of anticancer agents[J]. Cancer Res, 2004, 64: 1094-1101. DOI:10.1158/0008-5472.CAN-03-2524 |
| [7] |
Ji XW, Ji SM, Li RT, et al. Pharmacokinetic-pharmacodynamic modeling of the antitumor effect of TM208 and EGFR-TKI resis‐tance in human breast cancer xenograft mice[J]. Acta Pharmacol Sin, 2016, 37: 825-833. DOI:10.1038/aps.2016.40 |
| [8] |
Koch G, Walz A, Lahu G, et al. Modeling of tumor growth and anticancer effects of combination therapy[J]. J Pharmacokinet Pharmacodyn, 2009, 36: 179-197. DOI:10.1007/s10928-009-9117-9 |
| [9] |
Tomayko MM, Reynolds CP. Determination of subcutaneous tumor size in athymic(nude)mice[J]. Cancer Chemother Phar‐macol, 1989, 24: 148-154. DOI:10.1007/BF00300234 |
| [10] |
He ZJ, Chen XX, Cai QH. Comparative study of the different calculating and measuring methods in the implanted tumor volume[J]. Chin J Comp Med(中国比较医学杂志), 2009, 19: 47-50, 90. |
| [11] |
Lin JH. Pharmacokinetics of biotech drugs: peptides, proteins and monoclonal antibodies[J]. Curr Drug Metab, 2009, 10: 661-691. DOI:10.2174/138920009789895499 |
| [12] |
Tang L, Persky AM, Hochhaus G, et al. Pharmacokinetic aspects of biotechnology products[J]. J Pharm Sci, 2004, 93: 2184-2204. DOI:10.1002/jps.20125 |
 2021, Vol. 56
2021, Vol. 56

 ,
周田彦1
,
周田彦1