2. 广州医科大学药学院广东省分子靶标与临床药理学重点实验室, 广东 广州 511436
2. Guangdong Provincial Key Laboratory of Molecular Target and Clinical Pharmacology, School of Pharmaceutical Sciences, Guangzhou Medical University, Guangzhou 511436, China
鸦胆子是苦木科植物鸦胆子的成熟果实, 性寒, 味苦, 有小毒。鸦胆子又名老鸦胆、苦参子, 主产于我国广东、广西、海南和云南等地, 常用于疟疾、痢疾、赘疣和鸡眼等的治疗。近年来, 鸦胆子油乳注射液也常常与其他化疗药物, 如紫杉醇、多柔比星等联合使用, 在肺癌、乳腺癌、结肠癌和食管癌等治疗中有广泛的应用。鸦胆亭(bruceantin, BCT)是鸦胆子中的主要有效成分之一, 化学结构如图 1所示, 在1973年首次被报道从鸦胆子中分离, 并发现其具有抗白血病的作用[1]。在此之后, 研究人员进行了针对黑色素瘤和转移性乳腺癌等的多项Ⅰ期与Ⅱ期的临床试验, 均以其较大的不良反应和肿瘤消退不明显而告终[2, 3]。然而, 在2004年, Cuendet等[4]报道BCT通过下调c-myc与激活caspase级联通路诱导骨髓瘤细胞的凋亡, 同时, 在体内模型中, 低剂量的鸦胆亭通过抑制癌细胞增殖与诱导癌细胞凋亡, 使肿瘤消退, 而不产生明显的毒性, 表明鸦胆亭的有效性在一定情况下应被重新评估, 这使得鸦胆亭这一活性化合物重新受到关注。在此之后, Issa等[5]发现, BCT能够抑制多发性骨髓瘤干细胞的增殖, 表明了BCT具有进一步开发的潜力。

|
Figure 1 Chemical structure of bruceantin (BCT) |
微小RNA (microRNA, miRNA)是非编码RNA的一种, 成熟的miRNA能够通过与靶RNA的3'非翻译区特异性结合而抑制相关蛋白的翻译或使靶mRNA降解[6]。近年来众多研究表明, miRNA与癌症的发生与进展有着密切的关系。在肿瘤的诊断与治疗方面, miRNA表达谱不仅可以作为表征癌症发展良好的生物标志物[7], 还可以作为一个有力的治疗工具, 用于降解抗凋亡基因, 或被沉默从而上调抑癌基因[8]。
整合素是一种跨膜受体, 它可以通过细胞外基质调控细胞内部的信号传导[9]。有研究表明, 整合素可以通过表皮生长因子受体(epidermal growth factor receptor, EGFR)调控乳腺上皮细胞的分化与转化, 诱导肿瘤的发生[10]。它还能够介导肿瘤细胞与周围细胞和基质的黏附作用, 定向地传导信号通路[11], 同时提高信号传导的效率, 这有可能与肿瘤的转移有关[12]。其中, 整合素β1 (integrinβ1, ITGB1)能在多种细胞类型中表达并参与上皮、神经和骨骼的分化和发育等过程[13]。
肺癌是全世界最常见的死亡原因, 每年估计有180万人死于肺癌[14], 非小细胞肺癌属于肺癌的一类, 在肺癌中占比约85%[15]。查阅文献后发现, 有关鸦胆亭治疗非小细胞肺癌的研究很少。因此, 本研究主要探讨了鸦胆亭通过调控miRNA从而抑制非小细胞肺癌H1299细胞迁移与侵袭的相关作用机制。
材料与方法细胞系 人肺癌细胞株H1299、A549和PC-9[赛百慷(上海)生物技术股份有限公司]。
药物与试剂 鸦胆亭标准品(质量分数≥98%, 南京春秋生物工程有限公司); 细胞级二甲基亚砜(DMSO, MP Biomedicals公司); F-12K培养基、RPMI-1640培养基、胰酶(0.25%胰酶+0.02%EDTA)、磷酸盐缓冲液(phosphate buffer saline, PBS)、双抗(青-链霉素)溶液(吉诺生物医药技术有限公司); 胎牛血清(FBS, 美国Gibco公司); GAPDH (MB001)、HRP-鼠二抗、HRP-兔二抗(Bioworld Technology公司); ITGB1 (ab52971)、整合素α2 (ITGA2, ab133557)、血管内皮生长因子(vascular endothelial growth factor, VEGF, ab32152)(Abcam公司); 整合素αv (ITGAV, 4711S)、α6 (ITGAV6, 3750S)、β3 (ITGB3, 4702S)、β4 (ITGB4, 14803S)、β8(ITGB8, 88300)、β-catenin (8480)、p-Src (12432)(Cell Signaling Technology公司); ECL试剂发光盒(上海天能科技有限公司); TRIzol (美国Life Technologies公司); Prime ScriptTM RT Master Mix、Mir-XTM miRNA First-Strand Synthesis、SYBR® Premix Ex TaqTM II (Tli RNase H Plus)、SYBR® Premix ExTaqTM (Tli RNaseH Plus)(日本Takara公司)。
主要仪器 CO2细胞培养箱; NanoDrop 1000 Spectrophotometer (美国Thermo Scientific公司); 洁净工作台(SW-CJ-2FD, 苏州安泰空气技术有限公司); 台式低速离心机(湖南星科科学仪器有限公司); 光学显微镜(CKX53, Olympus Life Science公司); 酶标仪(Bio Tek公司); 垂直电泳及印迹系统、凝胶成像仪(Chemi Doc XRS+)(Bio-Rad Laboratories公司); Agilent Strata Gene Mx3000P QPCR (Agilent Technologies公司)。
细胞培养与药物的配制 人肺癌细胞株H1299与PC-9培养于含有10%FBS、1%青-链霉素溶液的RPMI-1640培养基中; A549细胞培养于10%FBS、1%青-链霉素溶液的F-12K培养基中。细胞均培养于5%CO2、37℃的培养箱中。鸦胆亭标准品使用DMSO配制成40 mg·mL-1储备液, 给药时用培养基稀释成不同的浓度。
MTT法检测细胞存活率 将处于对数生长期的H1299、A549及PC-9细胞从培养皿上消化后, 在显微镜下计数, 将3种细胞以4 000个/孔的密度种板于96孔板中。细胞贴壁后, 将鸦胆亭母液梯度稀释后加入96孔板中孵育68 h。将96孔板从培养箱中取出, 每孔加入5 mg·mL-1 MTT溶液20μL, 放入培养箱中孵育4 h后取出。用移液枪吸出孔板中的培养基与MTT溶液, 再在每孔中加入DMSO溶液100μL。摇床10 min震荡混匀后放入酶标仪中, 540/655 nm双波长测定各组吸光度(A值)并计算细胞存活率。细胞存活率(cell viability rate)=(A值用药组-A值空白组)/(A值对照组-A值空白组)×100%。
集落形成实验检测细胞增殖能力 将处于对数生长期的H1299细胞消化后, 以1 000个/孔的密度接种于12孔板中, 培养约1周, 在显微镜下观察, 待每个细胞集落有30~40个细胞时, 加入不同浓度的鸦胆亭药液。本研究的药液均由培养基稀释, 对照组均加入与稀释后药液同体积的培养基。培养24 h后, 在显微镜下对每组细胞计数, 大于50个细胞为1个集落。计数完成后吸去培养基, 每孔加入甲醇1 mL, 固定细胞30 min。固定完成后, 弃甲醇, 加入0.1%结晶紫溶液染色1 h。染色完成后, 用清水轻柔地冲洗结晶紫, 晾干, 拍照。
划痕实验检测细胞的平面迁移能力 在6孔板底部用马克笔画出3条直线, 用于划痕拍照的定位。再将H1299细胞以3×105个/孔细胞密度种板于6孔板, 待细胞贴壁后, 用200μL枪头垂直于底部直线画出划痕, 然后用PBS轻柔地将悬浮的细胞洗去。将无血清的含有不同浓度药液的培养基加入孔板中培养细胞, 并于0、12、24 h三个时间点取样拍照, 测量划痕距离并计算迁移率。迁移率公式: 划痕迁移率(%)=(1-某一时间点划痕面积/0 h划痕面积)×100%。
Transwell实验检测细胞的空间迁移能力与侵袭能力 将Transwell小室分成两组, A组用于检测细胞的侵袭能力, B组用于检测细胞的空间迁移能力。按照基质胶: 无血清培养基体积比1∶8稀释基质胶, 在A组小室中每孔加入45μL稀释后的基质胶, 放在培养箱中2.5 h使其凝固, B组小室不铺胶。当基质胶凝固后, 在下室加入含有10%FBS的完全培养基600μL, 小室上室以105个/孔的密度接种细胞, 并加入不同浓度的鸦胆亭药液, 放入培养箱中培养。24 h后, 弃去上室培养基, 将小室浸泡在甲醇中固定30 min, 使用结晶紫染色1 h。使用棉签轻柔地去除A组小室残留的基质胶后, 用PBS将结晶紫轻柔地洗去, 显微镜下拍照。
RT-qPCR实验检测细胞中miRNA与mRNA的表达 将H1299细胞培养于6孔板中, 待其生长到约80%时加入不同浓度的鸦胆亭药液, 培养箱中孵育24 h。消化细胞, 使用TRIzol法提取总RNA, 在Nano Drop分光光度计上检测总RNA浓度。以mRNA或miRNA为模板, 使用PrimeScriptTM RT Master Mix或Mir-XTM miRNA First-Strand Synthesis试剂盒合成cDNA, 步骤参照试剂盒说明书。合成cDNA后, 按照说明书上的步骤, 使用SYBR® Premix Ex TaqTM II (Tli RNase H Plus)或SYBR®Premix Ex TaqTM (Tli RNaseH Plus)试剂盒与相关mRNA和miRNA的引物准备RT-qPCR的反应体系, 在Agilent Strata Gene Mx3000P QPCR仪器上按照说明书上的规定程序运行反应。运行完毕后导出数据, 检测所得CT值, 以ΔΔCT法分析结果, 得到mRNA与miRNA相对表达情况。mRNA与miRNA的引物序列如表 1所示。
| 表 1 The primer sequences employed in RT-qPCR |
miRNA的靶基因预测 运用TargetScan (http://www.targetscan.org/vert_71/)和miRDB (http://mirdb.org/)预测miR-29a-3p的靶基因, 将两个网站上预测的靶基因列表取交集。
Western blot实验检测蛋白表达水平 将H1299细胞从培养皿中消化后离心, 弃去培养基, 将细胞用PBS清洗3次以便将残留培养基清洗干净。根据细胞数量加入裂解液, 在冰上使细胞充分裂解, 提取总蛋白。测定蛋白浓度后, 以每孔20μg总蛋白在SDS-PAGE凝胶中进行电泳分离, 电泳完毕后进行转膜步骤, 转膜条件为200 m A, 1~3 h, 具体转膜时间根据蛋白分子量的不同有所变化。将转膜后的PVDF膜置于用TBST配制的5%脱脂牛奶中封闭1 h。根据说明书推荐的浓度配制一抗溶液, 将封闭完的膜放入一抗溶液中, 4 ℃条件下过夜孵育。孵育完毕后用TBST溶液洗膜, 摇床90 r·min-1, 5 min×3次。在摇床上以60 r·min-1的转速孵育二抗1 h。洗膜后, 使用化学发光法在凝胶成像仪上曝光。选择GAPDH为内参。选择ITGB1、ITGA2、ITGA6、ITGAV、ITGB3、ITGB4、ITGB8、β-catenin、p-Src和VEGF一抗测定上述蛋白的表达情况。
数据分析 数据均以x ± s表示, 使用SPSS 25.0分析实验结果的统计学差异, P < 0.05表明差异有统计学意义。使用Graph Pad Prism 8.0作统计图。每项实验至少重复3次。
结果 1 BCT对人肺癌细胞株H1299、PC-9和A549细胞活力的影响如图 2A所示, BCT对H1299、PC-9和A549细胞增殖有较好的抑制活性。MTT结果表明, BCT对H1299、PC-9和A549细胞的半数抑制浓度(IC50)分别为0.12±0.02、0.31±0.20和2.07±0.70μmol·L-1。相比之下, BCT对H1299细胞的IC50更低, 因此, 后续选定H1299细胞进行实验研究。

|
Figure 2 BCT inhibited colony formation of H1299 cells in a concentration-dependent manner.A: After H1299, PC-9 and A549cells were treated with BCT for 72 h, the relative survival rate curves were observed; B: H1299 was treated in different concentrations of BCT and the colonies numbers could be observed; C: Quantitative results of (B).n≥3, x ± s.*P < 0.05, **P < 0.01 |
细胞集落形成实验结果如图 2B所示, 随着BCT给药浓度的增加(0、0.03、0.15和0.75μmol·L-1), H1299细胞的集落形成数量逐渐降低且集落大小逐渐减小, 统计结果如图 2C所示。以上结果表明, BCT能够浓度依赖性地抑制H1299细胞的集落形成能力。
3 BCT对H1299细胞平面迁移能力、空间迁移能力以及侵袭能力的影响细胞划痕实验结果如图 3A和图 3B所示, 随着时间的增加, 细胞迁移面积逐渐增加, 划痕面积逐渐减小; 随着BCT给药浓度的增加, H1299细胞的迁移能力逐渐减弱, 表明BCT能够浓度依赖性地抑制H1299细胞的平面迁移能力。

|
Figure 3 BCT inhibited the plane migration, spatial migration and invasion ability of H1299 cells.A: The plane migration ability of H1299 cells was inhibited in a dose-dependent manner; B: Quantitative results of (A); C: The spatial migration ability of H1299 cells was inhibited in a concentration-dependent manner; D: Quantitative results of (C); E: H1299 cells were treated in different concentrations of BCTand invasive cells were shown; F: Quantitative results of (E).n≥3, x±s.*P < 0.05, **P < 0.01, ***P < 0.001.ns: No significance |
Transwell迁移实验结果如图 3C所示。与划痕实验检测细胞平面迁移能力不同, Transwell迁移实验用于检测细胞的空间迁移能力。结果表明, 当BCT处理细胞24 h后, 随着BCT浓度的增加, H1299细胞穿过微孔滤膜的数量逐渐减少, 统计数据如图 3D所示, 表明BCT能够浓度依赖性地抑制H1299细胞的空间迁移能力。
Transwell侵袭实验结果如图 3E所示。BCT能够明显抑制H1299细胞的侵袭, 且抑制程度与BCT的给药浓度明显相关。当BCT处理H1299细胞24 h后, 随着给药浓度的增加, 穿过基质胶与微孔滤膜的细胞的数量明显减少, 统计数据如图 3F所示, 表明BCT在抑制H1299细胞侵袭能力方面有着较好的活性。
4 BCT能够下调miR-29a-3p并上调ITGB1蛋白的表达通过RT-qPCR对多种与细胞迁移与侵袭能力相关的miRNA进行初步筛选, 结果如图 4A所示, miR-29a-3p、miR-21-3p、miR-183-5p与miR-34b-5p的表达水平随着BCT的给药浓度的增加而增加。其中BCT调控miR-29a-3p作用最为明显。因此, 选定miR-29a-3p作为主要研究对象, 进行后续的实验。
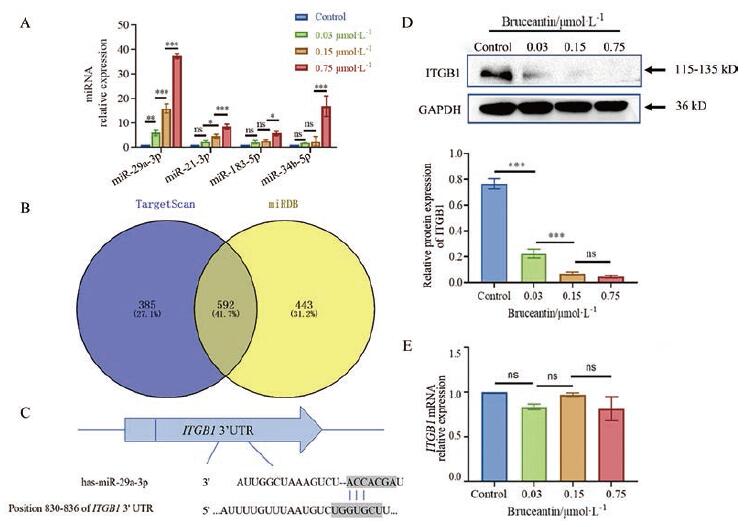
|
Figure 4 BCT increased the expression of miR-29a-3p and decreased the expression of integrin β1 (ITGB1) protein.A: Relative expression of miR-29a-3p, miR-21-3p, miR-183-5p, and miR-34b-5p in H1299 cells after treating BCT for 24 h.The expression of miR-29a-3p was significantly increased in a dose-dependent manner; B: Venn diagram showed the overlapping predicted targeted mRNA of miR-29a-3p in two different software; C: The potential binding sites for miR-29a-3p in the 3'untranslated regions (3'UTRs) of ITGB1; D: BCT inhibited the expression of ITGB1 protein, GAPDH was used as a control to normalize expression levels; E: BCT did not affect the mRNA level of ITGB1.n≥3, x ± s.*P < 0.05, **P < 0.01, ***P < 0.001 |
以TargetScan (http://www.targetscan.org/vert—_71/)和miRDB (http://mirdb.org/)网站为工具, 对miR-29a-3p的靶基因进行预测, 再将两个网站预测的靶基因列表取交集, 见图 4B, 发现预测的下游靶基因包括与侵袭和转移密切相关的ITGB1 (图 4C)。Koshizuka等[16]通过双荧光素酶报告基因, 发现与miR-29家族和携带ITGB1 mRNA野生型3'非翻译区(3' untranslated region, 3' UTR)的载体共转染后, 发光强度明显降低, 证实ITGB1 mRNA中确实包含miR-29家族的结合靶点。除此之外, He等[17]在其研究中也证实ITGB1 mRNA的确具有miR-29a的结合靶点。因此, 初步推测ITGB1可能为miR-29a-3p的靶基因, 具体的机制将在后续进一步研究。
本研究通过Western blot法检测BCT作用于H1299细胞后, ITGB1的蛋白表达情况。结果表明, 随着BCT给药浓度的增加, ITGB1的表达下降(图 4D)。此外, 通过RT-qPCR实验发现, 随着给药浓度的增加, ITGB1在mRNA水平上表达差异无统计学意义(图 4E)。文献[18-21]表明, miRNA常与mRNA的3'UTR互补, 从而形成沉默复合体(RNA-induced silencing complex, RISC), 抑制mRNA翻译成蛋白的过程, 但不影响mRNA的表达, 这也是miRNA经典的作用模式之一。因此推测, BCT作用于H1299细胞后, 可能通过上调miR-29a-3p, 影响ITGB1 mRNA的转录后过程, 从而影响了ITGB1的蛋白表达。
5 BCT抑制整合素家族多种蛋白以及β-catenin、p-Src和VEGF的表达如图 5所示, 随着BCT给药浓度的增加, 整合素家族的多种蛋白: ITGA2、ITGA6、ITGAV、ITGB3、ITGB4和ITGB8均被不同程度的抑制, 且抑制程度随着给药浓度的增加而增加。p-Src为ITGB1相关的下游蛋白, Src的磷酸化能够增强肿瘤细胞的迁移与侵袭, 在肿瘤的发展中具有重要的作用[22-24]。Src的激活能够影响β-catenin的表达水平, 从而促进细胞增殖[25]。此外, 过度活化的Src可以通过激活VEGF, 促进肿瘤新生血管的生成[26]。Western blot实验表明, BCT能够浓度依赖性地抑制β-catenin、p-Src和VEGF的表达。

|
Figure 5 BCT decreased expression level of integrin family members and some downstream proteins of ITGB1.A: The expression of some integrin family members, including ITGB3, ITGB4, ITGB8, ITGA2, ITGA6, and ITGAV were inhibited after treating BCT in a dose-dependent manner; B: Quantitative results of (A); C: The downstream proteins of ITGB1, such as vascular endothelial growth factor(VEGF), β-catenin, and p-Src were decreased after treating with BCT in a dose-dependent manner; D: Quantitative results of (C).n≥3, x ± s.*P < 0.05, **P < 0.01, ***P < 0.001 |
非小细胞肺癌发病率较高, 临床治疗多采用手术、放疗和化疗以及免疫疗法。然而, 由于预后不佳以及耐药性的出现, 寻找有效、毒副作用小的药物仍然是新药开发的重中之重。中药辅助疗法是癌症治疗的有效手段之一, 在中药中寻找有效的活性化合物并探索其作用机制非常必要。传统中药鸦胆子所衍生的鸦胆子油乳已经在临床中得到了部分的应用。有文献[27, 28]显示, 运用鸦胆子油乳辅助治疗非小细胞肺癌, 能够改善晚期非小细胞肺癌患者的肺功能与血脂水平, 增强患者的免疫力。BCT在1973年首次被从鸦胆子中分离出, 此后, BCT抗癌作用及作用机制被不断探索。
miRNA作为非编码RNA的一类, 在肿瘤的发生与发展中发挥着重要的作用, 它不仅能够作为指示疾病发展程度的良好的生物标志物, 在新药的开发方面, 也作为一种充满希望的新型药物, 正在不断的研究与完善中。本研究显示, BCT对3种人肺癌细胞株H1299、A549与PC-9均有良好的抑制活性, 其中对H1299的作用最强, 因此本研究选取H1299细胞进行后续的实验。结果显示, BCT能够浓度依赖性地抑制H1299细胞的增殖、侵袭与迁移能力, 其作用机制可能与上调miR-29a-3p和下调整合素家族等多种蛋白表达有关。本研究结果不仅显示了BCT在治疗NSCLC方面具有进一步的研究潜力, 也为探索miR-29a-3p在BCT抑制NSCLC恶性化的机制方面提供了一定的参考。结合Western blot、RT-qPCR结果及靶基因预测结果, 本课题组初步认为miR-29a-3p有可能通过miRNA经典的转录后调控机制, 在不影响mRNA表达的前提下抑制ITGB1蛋白的表达, 与文献报道的结论一致[18-21], 具体的机制将在后续进一步研究。此外, 本研究还发现, 整合素家族的多种蛋白, 以及ITGB1下游相关蛋白VEGF、β-catenin和p-Src的表达也因BCT的作用而被抑制, 表明BCT也可能通过抑制多种整合素蛋白及其下游通路相关蛋白的表达, 从而影响H1299细胞的迁移与侵袭能力。
综上所述, BCT能够上调H1299细胞中包括miR-29a-3p在内的多种miRNA的表达, 并下调ITGB1在内的整合素家族多种蛋白的表达, 从而抑制H1299细胞的侵袭与迁移, 但其更深层次的作用机制亟待进一步的研究。BCT在治疗NSCLC方面具有一定的潜力, 具备继续研究的价值。本研究也可为BCT在治疗NSCLC的研究与应用提供参考。
作者贡献: 闫燕艳负责实验设计及论文初稿撰写; 郭乔如参与实验操作以及文献的整理; 范欣悦负责细胞的培养以及Transwell实验; 周雯敏负责实验中细胞划痕以及细胞增殖实验; 朱壮彦和张海燕负责文献的调研; 杨璐铭和黄东宇负责初稿的修改; 张建业为本文的通讯作者, 负责实验进程的把关及稿件修改等工作。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Kupchan SM, Britton RW, Ziegler MF, et al. Bruceantin, a new potent antileukemic simaroubolide from brucea antidysenterica[J]. J Org Chem, 1973, 38: 178-179. DOI:10.1021/jo00941a049 |
| [2] |
Arseneau JC, Wolter JM, Kuperminc M, et al. A phase II study of bruceantin(nsc-165, 563)in advanced malignant melanoma[J]. Invest New Drugs, 1983, 1: 239-242. DOI:10.1007/BF00208896 |
| [3] |
Wiseman CL, Yap HY, Bedikian AY, et al. Phase II trial of bruceantin in metastatic breast carcinoma[J]. Am J Clin Oncol, 1982, 5: 389-391. DOI:10.1097/00000421-198208000-00007 |
| [4] |
Cuendet M, Christov K, Lantvit DD, et al. Multiple myeloma regression mediated by bruceantin[J]. Clin Cancer Res, 2004, 10: 1170-1179. DOI:10.1158/1078-0432.CCR-0362-3 |
| [5] |
Issa ME, Berndt S, Carpentier G, et al. Bruceantin inhibits multiple myeloma cancer stem cell proliferation[J]. Cancer Biol Ther, 2016, 17: 966-975. DOI:10.1080/15384047.2016.1210737 |
| [6] |
Lu TX, Rothenberg ME. MicroRNA[J]. J Allergy Clin Immunol, 2018, 141: 1202-1207. DOI:10.1016/j.jaci.2017.08.034 |
| [7] |
Mishra S, Yadav T, Rani V. Exploring miRNA based approaches in cancer diagnostics and therapeutics[J]. Crit Rev Oncol Hematol, 2016, 98: 12-23. DOI:10.1016/j.critrevonc.2015.10.003 |
| [8] |
Rupaimoole R, Slack FJ. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases[J]. Nat Rev Drug Discov, 2017, 16: 203-222. DOI:10.1038/nrd.2016.246 |
| [9] |
Huang S, Ingber DE. Cell tension, matrix mechanics, and cancer development[J]. Cancer Cell, 2005, 8: 175-176. DOI:10.1016/j.ccr.2005.08.009 |
| [10] |
Wang F, Weaver VM, Petersen OW, et al. Reciprocal interactions between beta1-integrin and epidermal growth factor receptor in three-dimensional basement membrane breast cultures: a different perspective in epithelial biology[J]. Proc Natl Acad Sci U S A, 1998, 95: 14821-14826. DOI:10.1073/pnas.95.25.14821 |
| [11] |
Bershadsky AD, Balaban NQ, Geiger B. Adhesion-dependent cell mechanosensitivity[J]. Annu Rev Cell Dev Biol, 2003, 19: 677-695. DOI:10.1146/annurev.cellbio.19.111301.153011 |
| [12] |
Wu J, Gao W, Tang Q, et al. M2 macrophage-derived exosomes facilitate hepatocarcinoma metastasis by transferring α(m) β(2) integrin to tumor cells[J]. Hepatology, 2020. DOI:10.1002/hep.31432 |
| [13] |
Chen W, Harbeck MC, Zhang W, et al. MicroRNA regulation of integrins[J]. Transl Res, 2013, 162: 133-143. DOI:10.1016/j.trsl.2013.06.008 |
| [14] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021. DOI:10.3322/caac.21660 |
| [15] |
Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer[J]. Nature, 2018, 553: 446-454. DOI:10.1038/nature25183 |
| [16] |
Koshizuka K, Kikkawa N, Hanazawa T, et al. Inhibition of integrin β1-mediated oncogenic signalling by the antitumor family in head and neck squamous cell carcinoma[J]. Oncotarget, 2018, 9: 3663-3676. DOI:10.18632/oncotarget.23194 |
| [17] |
He B, Xiao YF, Tang B, et al. Htert mediates gastric cancer metastasis partially through the indirect targeting of ITGB1 by microRNA-29a[J]. Sci Rep, 2016, 6: 21955. DOI:10.1038/srep21955 |
| [18] |
Gregory RI, Chendrimada TP, Cooch N, et al. Human risc couples microrna biogenesis and posttranscriptional gene silencing[J]. Cell, 2005, 123: 631-640. DOI:10.1016/j.cell.2005.10.022 |
| [19] |
Li X, Liu L, Yang J, et al. Exosome derived from human umbilical cord mesenchymal stem cell mediates miR-181c attenuating burn-induced excessive inflammation[J]. EBio Medicine, 2016, 8: 72-82. |
| [20] |
Romero-Cordoba SL, Salido-Guadarrama I, Rodriguez-Dorantes M, et al. MiRNA biogenesis: biological impact in the development of cancer[J]. Cancer Biol Ther, 2014, 15: 1444-1455. DOI:10.4161/15384047.2014.955442 |
| [21] |
Song X, Li Y, Cao X, et al. MicroRNAs and their regulatory roles in plant-environment interactions[J]. Annu Rev Plant Biol, 2019, 70: 489-525. DOI:10.1146/annurev-arplant-050718-100334 |
| [22] |
Ashour AA, Gurbuz N, Alpay SN, et al. Elongation factor-2 kinase regulates TG2/β1 integrin/Src/uPAR pathway and epithelialmesenchymal transition mediating pancreatic cancer cells invasion[J]. J Cell Mol Med, 2014, 18: 2235-2251. DOI:10.1111/jcmm.12361 |
| [23] |
Fan JJ, Hsu WH, Lee KH, et al. Dietary flavonoids luteolin and quercetin inhibit migration and invasion of squamous carcinoma through reduction of Src/Stat3/S100A7 signaling[J]. Antioxidants(Basel), 2019, 8: 557. |
| [24] |
Que ZJ, Yang Y, Liu HT, et al. Jinfukang regulates integrin/Src pathway and anoikis mediating circulating lung cancer cells migration[J]. J Ethnopharmacol, 2021, 267: 113473. DOI:10.1016/j.jep.2020.113473 |
| [25] |
Li X, Liu X, Deng R, et al. Nintedanib inhibits wnt3a-induced myofibroblast activation by suppressing the Src/β-catenin pathway[J]. Front Pharmacol, 2020, 11: 310. DOI:10.3389/fphar.2020.00310 |
| [26] |
Fournier P, Viallard C, Dejda A, et al. The protein tyrosine phosphatase PTPRJ/DEP-1 contributes to the regulation of the Notchsignaling pathway and sprouting angiogenesis[J]. Angiogenesis, 2020, 23: 145-157. DOI:10.1007/s10456-019-09683-z |
| [27] |
Lu YY, Huang XE, Cao J, et al. Phase II study on javanica oil emulsion injection(yadanzi®)combined with chemotherapy in treating patients with advanced lung adenocarcinoma[J]. Asian Pac J Cancer Prev, 2013, 14: 4791-4794. DOI:10.7314/APJCP.2013.14.8.4791 |
| [28] |
Xu W, Jiang X, Xu Z, et al. The efficacy of oil emulsion injection as adjunctive therapy for advanced non-small-cell lung cancer: a meta-analysis[J]. Evid Based Complement Alternat Med, 2016, 2016: 5928562. |
 2021, Vol. 56
2021, Vol. 56


