2. 中国医学科学院北京协和医学院药物研究所, 北京 100050
2. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
骨质疏松症(osteoporosis, OP)是最常见的骨骼系统疾病, 其特点是骨量低和骨组织微结构破坏, 导致骨脆性增加以及易发生骨折[1]。骨重塑和重建主要通过成骨细胞(osteoblast, OB)调节的骨形成和破骨细胞(osteoclast, OC)控制的骨吸收来实现, 保持骨重塑过程的动态耦联平衡对于骨稳态至关重要[2], 当骨吸收大于骨形成时则会引起骨质疏松症[3]。
骨保护素(osteoprotegerin, OPG)也被称为破骨细胞抑制因子(ostelclastogenesis inhibitory factor, OCIF), 是肿瘤坏死因子(tumor necrosis factor, TNF)受体家族的一个成员, 是成骨细胞和基质细胞分泌的可溶性糖蛋白。在小鼠中过表达OPG可导致严重骨硬化症[4], 而OPG缺陷型小鼠(OPG-/-)总体骨密度降低且骨折发生率升高[5, 6]。核因子-κB受体活化因子配体(receptor activator of nuclear factor-κB ligand, RANKL)是TNF超家族成员之一, 其主要作用是与破骨细胞前体细胞表面的核因子-κB受体活化因子(RANK)结合, 诱导破骨细胞分化[7]。OPG通过与RANKL竞争性结合, 抑制破骨细胞及其前体上的RANKL/RANK相互作用, 从而发挥其对破骨细胞形成的抑制作用[8, 9]。因此, RANKL/RANK/OPG信号系统在骨形成和骨重建中发挥重要作用, 开发能够增加OPG水平的抗骨质疏松药物具有重要研究意义。
本研究利用实验室前期构建的含有人OPG启动子区域的荧光素酶报告基因的稳定转染细胞模型[10], 通过筛选发现化合物吴茱萸次碱(rutaecarpine, RUT)能够明显上调OPG的表达; RUT在体外能促进成骨细胞分化, 抑制破骨细胞分化, 且能有效改善卵巢去势(ovariectomized, OVX)大鼠骨质疏松症。
材料与方法试剂与培养基 化合物吴茱萸次碱(RUT)购于杨凌慈缘生物科技有限公司(含量 > 99%, 浅黄色粉末, 相对分子质量: 287.32, CAS号: 84-26-4);DMEM-高糖培养基、α-MEM培养基和蛋白浓度测定试剂盒(Thermo公司); McCoy's 5A培养基和胎牛血清(fetal bovine serum, FBS)(Gibco公司); 成骨细胞诱导培养基: α-MEM完全培养基中加入终浓度为50μg·mL-1的L-抗坏血酸(Thermo公司)和终浓度为10 mmol·L-1的β-甘油磷酸钠(TCI公司); 破骨分化诱导培养基: DMEM-高糖培养基完全培养基中加入终浓度50 ng·mL-1的重组小鼠s RANKL (Reprotech公司); G418 (Amresco公司); 荧光素酶检测试剂盒(Promega公司); 人OPG、小鼠OPG、大鼠OPG、大鼠RANKL、大鼠CTX-1 (C-terminal telopeptide of collagen type 1)和大鼠ALP (alkaline phosphatase)酶联免疫吸附(enzyme-linked immunosorbent assay, ELISA)试剂盒(南京森贝伽生物科技有限公司); 抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase, TRAP)染色试剂盒(Sigma公司); 茜素红S染液(索莱宝公司)。
细胞培养 表达人OPG上游调控序列(-5917~+19)-荧光素酶报告基因的稳定转染细胞株OPG-Luc U-2OS (简称UOP)由实验室前期构建保存[10]。UOP细胞培养于含500μg·mL-1G418和10%FBS的McCoy's 5A培养基; 小鼠成骨细胞前体细胞MC3T3-E1培养于含10%FBS的α-MEM培养基; 小鼠单核巨噬细胞RAW264.7培养于含10%FBS的DMEM培养基; 人骨肉瘤细胞U-2OS培养于含10%FBS的McCoy's 5A培养基。细胞均在37℃、5%CO2条件下培养并由实验室保存。
化合物上调OPG表达活性检测 将处于对数生长期的UOP细胞按每孔5×104个接种至96孔透明底白板(Costar公司)。待细胞贴壁后, 移去培养基, 加入稀释于含5%FBS的McCoy's 5A培养基的不同浓度化合物(起始浓度100μmol·L-1), 每个浓度设3个复孔, 设空白对照(无RUT)。化合物作用24 h后, 弃培养基并利用荧光素酶报告基因检测系统测定细胞荧光素酶活性。计算化合物浓度对OPG的调节率, 利用Graph Pad Prism 8.0软件作图, 得到化合物作用的半数有效浓度(median effect concentration, EC50)。
免疫印迹法分析将不同浓度RUT (0、1.0和10.0μmol·L-1)分别作用于MC3T3-E1及U-2OS细胞24 h, 并收集细胞。利用RIPA (radio immunoprecipitation assay)细胞裂解液(普利莱基因技术有限公司)裂解细胞, 提取细胞总蛋白; 用BCA (bicinchoninic acid)试剂盒(Pierce公司)测定总蛋白浓度, 并将各样品调整成相同浓度, 加入5×蛋白样品缓冲液, 煮沸10 min。将制备好的蛋白样品进行SDS-PAGE (sodium dodecyl sulfate polyacrylamide gel electrophoresis)电泳, 半干法转PVDF (polyvinelidene difuloride)膜; 5%脱脂奶粉封闭1 h, 4℃过夜孵育一抗; 以TBST (Tris-buffered saline tween)洗膜3次(10 min/次), 然后室温孵育相应的二抗1 h, 曝光液(Millipore公司)曝光显色。使用Image J软件扫描蛋白条带并定量分析。抗体使用如下: 小鼠抗OPG单克隆抗体(1∶1 000, Abcam); 兔抗GAPDH (glyceraldehydes-3-phosphate dehydrogenase)单克隆抗体(1∶4 000, Abcam); HRP标记山羊抗鼠二抗和抗兔二抗(1∶2 000, 北京中杉金桥生物技术公司)。
ELISA实验以不同浓度RUT (0、1.0和10.0μmol·L-1)分别处理MC3T3-E1及U-2OS细胞48 h, 收集细胞上清。4℃, 2 000~3 000 r·min-1离心20 min后收集上清。应用ELISA试剂盒测定细胞上清中OPG蛋白水平。
茜素红染色MC3T3-E1细胞以每孔5×105个接种至12孔板, 待细胞充分贴壁后换成骨分化培养基, 每隔1天换1次液。诱导21天后, 弃去培养基, 用PBS(phosphate buffered saline)洗细胞2次。95%乙醇固定细胞10 min, 蒸馏水漂洗3次。用40 mmol·L-1茜素红S溶液(pH 4.2)室温染色10 min, 蒸馏水漂洗3次; 再加入苏木素室温染色1 min, 蒸馏水漂洗3次。置于显微镜(Leica公司, DMIL)下拍照, 用Image J软件进行钙化结节定量分析。
破骨细胞分化检测 TRAP是检测骨吸收和破骨细胞活性的良好标志物。利用酸性磷酸酶试剂盒(#387-A, Sigma公司)进行TRAP染色, 通过检测TRAP阳性细胞数量检测破骨细胞形成。小鼠巨噬细胞RAW264.7以每孔2×102个接种于96孔板, 待细胞贴壁后换为破骨分化诱导培养基, 37℃、5%CO2条件下诱导6天, 每隔2天换1次液。诱导结束后弃去培养液, 加入固定剂(25.5%柠檬酸盐溶液+66.3%丙酮+8.2%的37%甲醛溶液, 100μL/孔)固定30 s, 蒸馏水洗净, 加入配好的混合液(萘酚AS-BI磷酸盐与酒石酸盐溶液, 200μL/孔), 于37℃避光孵育1 h。蒸馏水清洗后, 苏木素复染2 min, 用自来水冲洗数分钟; 自然晾干并置于显微镜下观察。选取细胞核≥3个的TRAP阳性细胞为破骨细胞并进行计数。
OVX大鼠骨质疏松模型 7月龄雌性SpragueDawley大鼠24只(290~310 g, 北京维通利华实验动物科技有限公司)。6只雌性大鼠切除卵巢附近部分脂肪组织作为对照组(sham), 18只OVX大鼠作为模型组和给药组[11]。切除卵巢1周后, 将OVX大鼠肌肉注射地塞米松(1 mg·kg-1, Sigma公司), 每周2次, 持续4周, 构建骨质疏松模型[11]。将18只OVX大鼠随机分为3组, 每组6只, 设为OVX[灌胃溶剂0.3%CMC-Na(sodium carboxymethyl cellulose)水溶液]组、RUT低剂量组(RUT-L, 5 mg·kg-1·day-1, 溶于0.3%CMC-Na)和RUT高剂量组(RUT-H, 45 mg·kg-1·day-1, 溶于0.3%CMC-Na)组, 每天分别灌胃给药1次。12周后处死大鼠, 取股骨进行Micro-CT (micro-computed tomography)分析。动物实验遵循中国医学科学院医药生物技术研究所动物护理和使用委员会的规定进行。
Micro-CT检测 取大鼠股骨, 小心去除多余脂肪及软组织, 用4%多聚甲醛固定, 使用Micro-PET/CT扫描仪(德国Inveon公司)对大鼠股骨远端进行分析。扫描仪设定条件为工作电压50 V, 工作电流400μA, 分辨率为每像素10μm。扫描结束后利用Inveon分析工作站进行三维重建、二维成像及数据分析, 最后计算骨密度(bone mineral density, BMD)并对骨形态学指标进行测量分析。骨形态学指标包括骨体积分数(bone volume to tissue volume, BV/TV)、骨小梁数目(trabecular number, Tb.N)、骨小梁厚度(trabecular thickness, Tb.Th)、骨面积与骨体积比(bone surface to tissue volume, BS/BV)和骨小梁间距(trabecular separation, Tb.Sp)。
H & E (hematoxylin-eosin staining)染色 4%多聚甲醛固定股骨24 h后, 用PBS (0.1 mol·L-1)充分清洗, 并用10%EDTA·Na2(0.1 mol·L-1PBS配制, pH7.2)于4℃进行脱钙处理, 每隔5天换1次液, 连续脱钙5周, 脱钙结束后用于制作石蜡切片。石蜡切片脱蜡后进行H & E染色, 在显微镜下观察并拍照股骨组织形态。
血清ELISA检测 采用ELISA试剂盒测定大鼠血清中OPG、RANKL、CTX-1和ALP水平
甲苯胺蓝染色及成骨细胞计数 石蜡切片制备方法同H & E染色部分。切片脱蜡后用蒸馏水清洗, 甲苯胺蓝染液染色10 min, 95%酒精分化, 风干后置于显微镜下观察并进行图像采集分析。每个切片在显微镜下随机选3个视野, 对成骨细胞进行计数, 利用Image Pro Plus 6进行统计分析。
钙黄绿素双标实验 动物实验结束前13、14天及3、4天两个时间点, 将对照组(sham)、OVX组以及RUT-L组分别注射钙黄绿素, 钙黄绿素能在此两个时间点产生两条沉积线, 可计算矿物质沉积率(mineral apposition rate, MAR)。MAR=两次钙黄绿素沉积线宽度/两次注射时间间隔天数。
免疫组织化学染色 石蜡切片制备方法同H & E染色部分。切片脱蜡后置于盛满EDTA抗原修复缓冲液(pH 9.0)的修复盒中于微波炉内进行抗原修复, 修复后切片放入3%H2O2溶液中灭活内源性过氧化物酶; 3%BSA室温封闭30 min, 甩掉封闭液, 在切片上滴加稀释好的一抗(1∶200, ab73400, Abcam), 于湿盒内4℃过夜孵育。将玻片置于PBS中洗涤后加入与一抗对应种属的辣根过氧化物酶标记二抗, 覆盖组织并于室温孵育50 min。将玻片置于PBS中洗涤3次后滴加新鲜配制的DAB (diaminobenzidine)显色液, 于显微镜下控制染色时间, 阳性为棕黄色。用自来水冲洗切片终止显色; 采用苏木素复染, 自来水洗后脱水封片, 于显微镜下观察拍照。
统计学分析实验数据均以平均值±标准误[mean ± SEM (standard error of mean)]表示, 采用Graph Pad Prim 8软件进行统计分析, 组间进行Student's t检验, P < 0.05时认为具有统计学意义。
结果 1 化合物RUT在UOP模型上的量效关系曲线将不同浓度RUT (结构如图 1A所示)作用于UOP模型细胞24 h后, 测定荧光素酶的值来考察其对OPG表达活性的影响, 并计算量效关系曲线。结果显示, 化合物RUT能剂量依赖性增加OPG的表达, EC50值为0.06μmol·L-1, 最大上调活性约为170%(图 1B)。
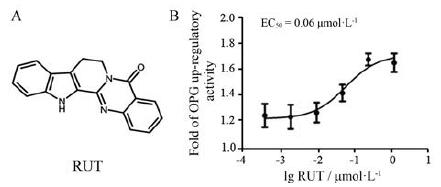
|
Figure 1 A: Structure of rutaecarpine (RUT); B: Dose-response curve for RUT in osteoprotegerin (OPG)-Luc plasmid stabled transfected U-2OS cells (UOP).UOP cells were seeded in 96-well plates (5×104 cells/well), and then treated with different concentrations of RUT for 24 h.Luciferase activity was detected using luciferase determining kits.n=3, mean ± standard error of mean(SEM) |
OPG是由成骨细胞和基质细胞分泌的TNF受体超家族的可溶性糖蛋白[12], 对成骨细胞分化具有重要作用。鉴于RUT在UOP模型中对OPG启动子区的上调作用, 作者在MC3T3-E1及U-2OS细胞分别考察了其对OPG蛋白表达及分泌的作用, 和RUT对RANKL蛋白表达水平的影响。Western blot检测结果显示, RUT(10.0 μmol·L-1)能显著上调MC3T3-E1及U-2OS细胞OPG的蛋白表达(图 2A~D), 但对RANKL的蛋白表达水平没有明显影响; 经定量后计算, RUT (10.0μmol·L-1)能显著上调OPG/RANKL比值(图 2A~D)。此外, ELISA检测结果显示, RUT在1.0和10.0 μmol·L-1能明显促进MC3T3-E1及U-2OS细胞中OPG的分泌(图 2E、F)。上述结果表明, RUT在体外可显著上调MC3T3-E1及U-2OS细胞中成骨分化关键蛋白OPG表达水平并促进其分泌。
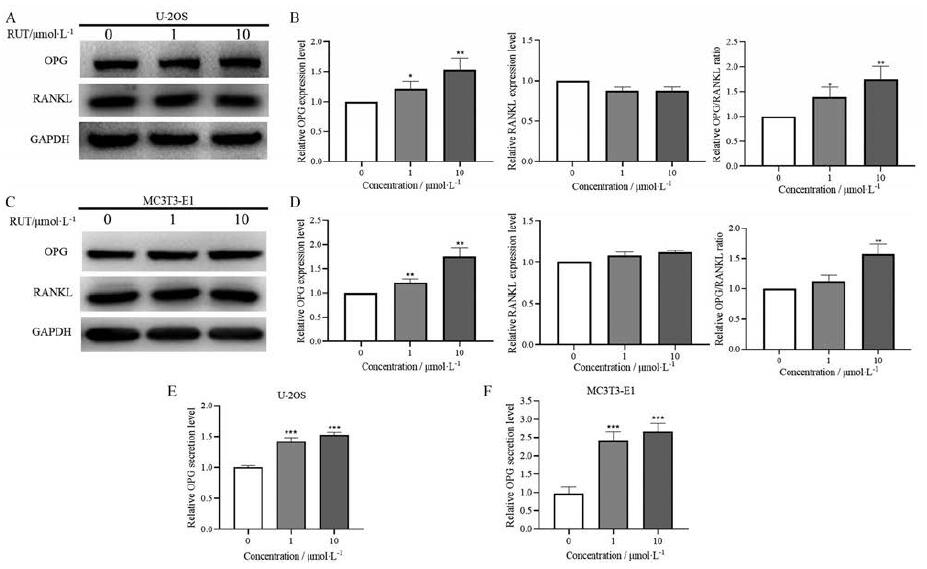
|
Figure 2 Effects of RUT on OPG expression and secretion in both MC3T3-E1 and U-2OS cells.MC3T3-E1 and U-2OS cells were treated with RUT for 24 h, respectively.A–D: The total OPG expression, total receptor activator of nuclear factor-κB ligand (RANKL), and glyceraldehydes-3-phosphate dehydrogenase (GAPDH) expression levels in cells were detected by Western blot, respectively; E and F: The OPG expression levels in cell supernatants were examined by enzyme-linked immunosorbent assay (ELISA).n=3, mean ± SEM.*P < 0.05, **P < 0.01, ***P < 0.001 vs control (without RUT) |
钙化结节形成是评价成骨细胞晚期分化的指标[13], 采用成骨分化培养基诱导小鼠胚胎成骨前体细胞MC3T3-E1向成骨细胞分化, 同时加入不同浓度RUT (1.0和10.0 μmol·L-1)干预21天, 采用茜素红染色法检测钙化结节形成情况。如图 3所示, 与单纯诱导组(无RUT)相比, RUT给药组钙化结节数目显著增加, 说明RUT能够促进MC3T3-E1向成骨细胞分化。

|
Figure 3 Effects of RUT on osteoblast differentiation in MC3T3-E1 cells using alizarin red S (ARS) staining assay.MC3T3-E1 cells were treated with RUT (0, 1.0, and 10.0μmol·L-1) in osteogenic medium for 21 days.A: Representative images of ARS staining for mineralization were shown; B: Quantification of mineralization according to the results of Alizarin red S staining.Scale bar=100 μm.n=3, mean ± SEM.***P < 0.001 vs control (without RUT) |
在确定RUT促成骨细胞分化作用之后, 作者进一步研究了RUT是否影响破骨细胞的分化。RUT (1.0和10.0μmol·L-1)作用于RANKL (50 ng·mL-1)诱导下的RAW264.7细胞3天, 然后通过TRAP染色检测破骨细胞形成情况。如图 4所示, 与空白对照(未经RANKL诱导)组相比, RANKL诱导显著增加了RAW264.7分化为破骨细胞的数目; 与只有RANKL的诱导组相比, RUT (1.0和10.0μmol·L-1)干预组中破骨细胞数目显著减少, 破骨细胞体积减小, 其中RUT (10.0μmol·L-1)效果更为明显, 说明RUT能抑制RANKL诱导RAW264.7向破骨细胞分化。

|
Figure 4 Effects of RUT on osteoclast differentiation in RANKL induced RAW264.7 cells.Tartrate-resistant acid phosphatase (TRAP)staining of RAW264.7 cells treated with or without RUT at the indicated concentrations in the presence of RANKL for 3 days.A: Representative images were shown; B: Quantitative analysis of TRAP-positive multinuclear cells.TRAP-positive multinucleated (nuclei > 3) cells were counted as osteoclasts.Scale bar=100 μm.n=3, mean ± SEM.###P < 0.001 vs control; ***P < 0.001 vs RANKL only group |
基于RUT的体外抗骨质疏松活性, 作者进一步在OVX大鼠模型中研究了RUT体内抗骨质疏松活性。结果如图 5A所示, 与假手术(sham)组相比, OVX组大鼠的Micro-CT二维图像表现出明显小梁骨骨丢失, 而RUT-L (5 mg·kg-1·day-1)和RUT-H (45 mg·kg-1·day-1)组治疗12周后可减轻小梁骨骨丢失的程度。H & E染色结果显示(图 5B), 与OVX组相比, RUT给药治疗后的OVX大鼠股骨结构明显改善。Micro-CT分析股骨远端的骨形态学参数结果表明(图 5C), 与sham组相比, OVX组骨密度显著降低, 骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)和骨小梁数量(Tb.N)明显低于sham组, 而骨小梁间距(Th.sp)显著增加; 然而, RUT给药治疗后骨体积分数(BV/TV)和骨小梁厚度(Tb.Th)相比于OVX组明显增加, 骨小梁数量(Tb.N)也有一定程度增加, 但骨小梁间距(Th.sp)显著降低。这些数据表明RUT给药可改善OVX大鼠的骨质疏松症状。

|
Figure 5 RUT attenuates bone mass loss in an ovariectomized (OVX) osteoporosis rat model.A: Representative Micro-CT images of distal femurs from sham, OVX, low-dose RUT group (RUT-L, 5 mg·kg-1·day-1), and high-dose RUT group (RUT-H, 45 mg·kg-1·day-1), respectively; B: Representative H & E staining of femurs from each group of rats at 40×magnification.Scale bars=500μm; C: Trabecular bone parameters were shown after analyzed by Micro-CT.Trabecular bone parameters include bone mineral density (BMD), bone surface to tissue volume (BV/TV), trabecular thickness (Tb.Th), trabecular separation (Tb.Sp), and trabecular number (Tb.N).n=6, mean ± SEM.#P < 0.05, ##P < 0.01 vs sham-operated group; *P < 0.05, **P < 0.01, ***P < 0.001 vs OVX group |
检测大鼠血清中骨吸收特异性标志物大鼠Ⅰ型胶原C端肽(CTX-1)和骨形成标志物碱性磷酸酶(ALP)的水平。结果显示, 与sham对照组相比, OVX大鼠血清中OPG水平降低且RANKL水平显著增加(图 6A~C)。与OVX模型组相比, RUT-L (5 mg·kg-1·day-1)给药后显著增加了血清中OPG水平, 并且一定程度地降低了RANKL的水平, 显著增加大鼠血清中的OPG/RANKL比值(图 6A~C); RUT-L组(5 mg·kg-1·day-1)能够明显增加骨形成标志物ALP的水平(图 6D), 并且降低CTX-1水平(图 6E)。与OVX模型组相比, RUT-H组(45 mg·kg-1·day-1)对OPG和RANKL的表达、以及ALP和CTX-1的表达均无显著性影响(图 6A~E)。基于此结果, 提示RUT在OVX大鼠体内具有促进骨形成和抑制骨吸收的作用, 并且RUT-L组治疗效果更优。
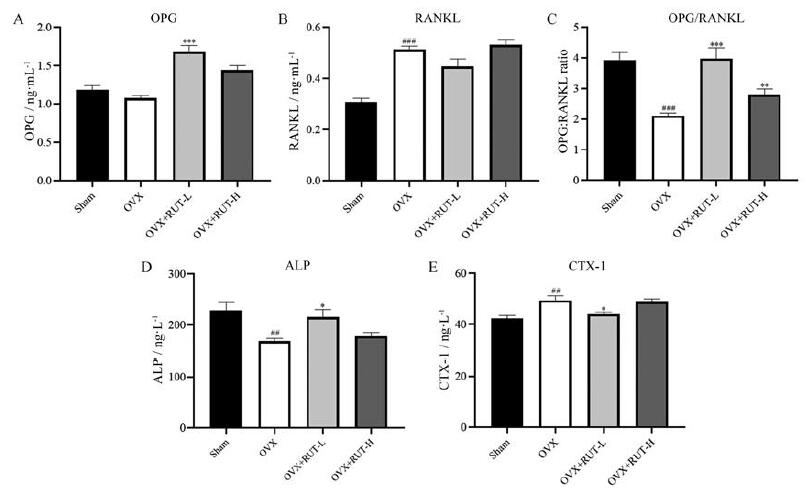
|
Figure 6 Serum parameters in rats.A–E: OPG (A), RANKL (B), OPG/RANKL ratio (C), alkaline phosphatase (ALP, D), and C-terminal telopeptide of collagen type 1 (CTX-1, E) levels in serum of rats treated with RUT-L (5 mg·kg-1·day-1), RUT-H (45 mg·kg-1·day-1), or vehicle(0.3%CMC-Na).n=6, mean ± SEM.##P < 0.01, ###P < 0.001 vs sham group; *P < 0.05, **P < 0.01, ***P < 0.001 vs OVX group |
为了探究RUT在体内如何发挥抑制骨丢失作用, 并且鉴于RUT-L组对OVX大鼠血清中ALP和CTX-1的效果更优, 进一步选择RUT-L (5 mg·kg-1·day-1)组考察了RUT在体内对骨形成和OPG表达水平的影响。首先对各组大鼠左侧股骨石蜡切片进行甲苯胺蓝染色, 观察大鼠股骨中成骨细胞形成的情况(图 7A); 然后通过对单位骨小梁周长上的成骨细胞数目进行计数, 反映骨表面成骨细胞数目。结果表明, RUT-L(5 mg·kg-1·day-1)给药后相较于OVX组大鼠股骨中成骨细胞数目明显增加, 表明RUT能够在体内促进成骨细胞形成(图 7B)。进一步通过钙黄绿素双标实验计算了RUT-L (5 mg·kg-1·day-1)给药对OVX大鼠矿化沉积率的影响。结果显示, 与sham组相比, OVX组大鼠的矿化宽度显著性减少(图 7B); 与OVX组相比, RUT-L(5 mg·kg-1·day-1)给药治疗后明显增加矿化宽度和矿化沉积率(图 7C、D)。免疫组化的结果表明, 与sham组相比, OVX组OPG蛋白表达量显著降低, 经RUT治疗后, OPG蛋白表达量明显增加(图 7E)。结果表明, RUT在OVX大鼠体内能增加OPG的表达并促进骨形成。

|
Figure 7 RUT treatment promotes bone formation in OVX rats.A: Toluidine blue staining.Scale bar=100 μm; B: Count the numbers of osteoblasts (N.Ob) per millimeter of trabecular bone surface (BS) and percent osteoblast perimeter (Ob.S/BS) were calculated; C: Representative calcein double labeling images were shown; D: Mineralization deposition rate (MAR) was calculated as in methods part; E: Immunohistochemical staining OPG expression in femurs in OVX rats.Scale bar=200 μm.n=6, mean ± SEM.###P < 0.001 vs sham group; *P < 0.05, ***P < 0.001 vs OVX group |
RANKL/RANK/OPG信号系统由核因子-κB受体活化剂活化因子配体RANKL、其受体RANK和可溶性诱饵受体骨保护蛋白OPG三个基本信号分子组成[8]。RANKL与其受体RANK结合后刺激下游信号, 导致破骨细胞分化增强; OPG作为RANKL的诱饵受体, 阻止RANKL与RANK结合, 从而抑制破骨细胞的分化[9]。OPG主要由成骨细胞分泌, 是公认的骨转换标志物[14]。因此, 适度增加骨组织中OPG的表达是治疗骨质疏松的一种重要策略[15]。
本研究利用实验室前期构建的OPG表达上调剂高通量筛选模型, 发现活性化合物RUT, 并对其进行了体内外抗骨质疏松活性研究。RUT能在UOP模型以及细胞水平上调OPG蛋白水平并促进其分泌, 并且增加OVX大鼠股骨中OPG的水平, 这说明RUT确实能在体内外增加OPG的表达。体内外功能实验表明, RUT在体外能较好地促进成骨细胞分化, 并且可以显著地抑制破骨细胞生成; 重要的是, RUT在OVX诱导的骨质疏松大鼠模型中具有很好的抗骨质疏松作用, 其能有效抑制OVX大鼠的骨丢失并改善其骨显微结构的退化; 并且, 作者发现, 低剂量RUT (5 mg·kg-1·day-1)在OVX大鼠体内抗骨质疏松效果更优, 能明显增加股骨中成骨细胞数目、矿化宽度以及矿化沉积率等, 在体内促进骨形成。如前所述, 增加OPG的表达水平可促进成骨形成并抑制破骨发生, 因此, 作者推测RUT主要是通过上调OPG的水平在体内外发挥促进骨形成作用。
本研究认为化合物RUT发挥抗骨质疏松的作用是通过影响了OPG的表达, 但其是如何影响OPG的表达并不清楚。已有研究表明, Wnt/β-catenin信号通路在控制成骨细胞分化中发挥重要作用[16], Wnt/β-catenin信号通路能够在分化的成骨细胞中通过影响靶基因OPG的水平, 从而进一步影响OPG/RANKL比值, 调节破骨细胞分化[17, 18]。作者计划进一步分析RUT对OPG表达的影响是否与Wnt/β-catenin信号通路有关。此外, 骨形成蛋白2[19]和Runt相关转录因子2[20]等也是成骨细胞分化相关的重要蛋白, 也不排除RUT可能会同时影响这些与成骨分化相关的蛋白来发挥促进成骨作用, 需要进一步实验研究。
综上所述, 作者通过体内外研究证明化合物吴茱萸次碱(RUT)能够增加骨保护素(OPG)的表达, 促进成骨细胞分化, 在体内改善骨代谢平衡, 本研究为新型抗骨质疏松药物的研发提供了实验依据及先导化合物。
作者贡献: 司书毅、许艳妮、李依宁和韩小婉构思并设计了实验。李依宁和韩小婉进行论文的整体实验和数据分析; 王伟志、姜新海、韩江雪、张晶、李霓和任羽参与体内动物实验; 李东升、巫晔翔、盛任和徐扬参与数据分析工作。李依宁、韩小婉、许艳妮和司书毅撰写论文。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Raisz LG. Pathogenesis of osteoporosis: concepts, conflicts, and prospects[J]. J Clin Invest, 2005, 115: 3318-3325. DOI:10.1172/JCI27071 |
| [2] |
Chen X, Wang Z, Duan N, et al. Osteoblast-osteoclast interactions[J]. Connect Tissue Res, 2018, 59: 99-107. DOI:10.1080/03008207.2017.1290085 |
| [3] |
Coughlan T, Dockery F. Osteoporosis and fracture risk in older people[J]. Clin Med(Lond), 2014, 14: 187-191. |
| [4] |
Ominsky MS, Stolina M, Li X, et al. One year of transgenic overexpression of osteoprotegerin in rats suppressed bone resorption and increased vertebral bone volume, density, and strength[J]. J Bone Miner Res, 2009, 24: 1234-1246. DOI:10.1359/jbmr.090215 |
| [5] |
Ozaki Y, Koide M, Furuya Y, et al. Treatment of OPG-deficient mice with WP9QY, a RANKL-binding peptide, recovers alveolar bone loss by suppressing osteoclastogenesis and enhancing osteoblastogenesis[J]. PLoS One, 2017, 12: e0184904. DOI:10.1371/journal.pone.0184904 |
| [6] |
Simonet WS, Lacey DL, Dunstan CR, et al. Osteoprotegerin: a novel secreted protein involved in the regulation of bone density[J]. Cell, 1997, 89: 309-319. DOI:10.1016/S0092-8674(00)80209-3 |
| [7] |
Nagy V, Penninger JM. The RANKL-RANK story[J]. Gerontology, 2015, 61: 534-542. DOI:10.1159/000371845 |
| [8] |
Infante M, Fabi A, Cognetti F, et al. RANKL/RANK/OPG system beyond bone remodeling: involvement in breast cancer and clinical perspectives[J]. J Exp Clin Cancer Res, 2019, 38: 12. DOI:10.1186/s13046-018-1001-2 |
| [9] |
Silva I, Branco JC. Rank/Rankl/opg: literature review[J]. Acta Reumatol Port, 2011, 36: 209-218. |
| [10] |
Gong S, Han X, Li X, et al. Development of a high-throughput screening strategy for upregulators of the OPG/RANKL ratio with the potential for antiosteoporosis effects[J]. J Biomol Screen, 2016, 21: 738-748. DOI:10.1177/1087057116654657 |
| [11] |
Ren H, Liang D, Shen G, et al. Effects of combined ovariectomy with dexamethasone on rat lumbar vertebrae[J]. Menopause, 2016, 23: 441-450. DOI:10.1097/GME.0000000000000547 |
| [12] |
Rochette L, Meloux A, Rigal E, et al. The role of osteoprotegerin and its ligands in vascular function[J]. Int J Mol Sci, 2019, 20: 705. DOI:10.3390/ijms20030705 |
| [13] |
Guo QP. Improvement of alizarin red stain method for osteoblasts[J]. Technol Life(科技与生活), 2012, 4: 174. |
| [14] |
Trouvin AP, Goeb V. Receptor activator of nuclear factor-kappa B ligand and osteoprotegerin: maintaining the balance to prevent bone loss[J]. Clin Interv Aging, 2010, 5: 345-354. |
| [15] |
Walsh MC, Choi Y. Biology of the RANKL-RANK-OPG system in immunity, bone, and beyond[J]. Front Immunol, 2014, 5: 511. |
| [16] |
Zhou ZH, Xiao JR. Regulation of Wnt/beta-catenin signaling in bone development and bone tumor[J]. Chin J Surg(中华外科杂志), 2018, 56: 797-800. |
| [17] |
Agholme F, Li X, Isaksson H, et al. Sclerostin antibody treatment enhances metaphyseal bone healing in rats[J]. J Bone Miner Res, 2010, 25: 2412-2418. DOI:10.1002/jbmr.135 |
| [18] |
Han X, Gong S, Li N, et al. A novel small molecule which increases osteoprotegerin expression and protects against ovariectomy-related bone loss in rats[J]. Front Pharmacol, 2019, 10: 103. DOI:10.3389/fphar.2019.00103 |
| [19] |
Zhou N, Li Q, Lin X, et al. BMP2 induces chondrogenic differentiation, osteogenic differentiation and endochondral ossification in stem cells[J]. Cell Tissue Res, 2016, 366: 101-111. DOI:10.1007/s00441-016-2403-0 |
| [20] |
Komori T. Runx2, an inducer of osteoblast and chondrocyte differentiation[J]. Histochem Cell Biol, 2018, 149: 313-323. DOI:10.1007/s00418-018-1640-6 |
 2021, Vol. 56
2021, Vol. 56

 ,
司书毅1
,
司书毅1