2. 抗体药物国家工程研究中心, 上海 201203;
3. 三生国健药业(上海)股份有限公司, 上海 201203
2. National Engineering Research Center of Antibody Medicine, Shanghai 201203, China;
3. Sunshine Guojian Pharmaceutical (Shanghai) Co., Ltd., Shanghai 201203, China
抗体偶联药物(antibody-drug conjugates, ADCs)是由单克隆抗体与小分子细胞毒药物通过特定连接子(linker)共价连接而成的新型肿瘤靶向药物。抗体作为靶向载体运送细胞毒药物即“效应分子”或“弹头”至肿瘤部位后, 与肿瘤细胞表面抗原特异性结合, 经内吞到达溶酶体, 然后释放细胞毒药物杀伤肿瘤细胞。因此, 与传统化疗药物相比, ADC可显著改善治疗指数, 减少对正常组织的毒副作用[1]。近年来, 随着单克隆抗体技术的发展, 以及新型毒素、连接子和肿瘤靶标的发现, ADCs药物发展迅速, FDA仅在2019年就批准了3种ADCs上市, 截至目前, 已有8个抗体偶联药物先后获得FDA批准上市[2]。ADCs在临床应用中体现了很好的安全性和有效性, 已成为肿瘤靶向治疗领域的研究热点和重要发展方向。当前, 全球已有超过100个ADC新药处于临床试验的不同阶段[3], 预计在未来5年内将有多个ADC药物获批上市[1]。但是, 目前已上市或在研的ADC药物“弹头”的种类非常有限, 绝大多数采用微管抑制剂美登素或海兔毒素(monomethyl auristatin E, MMAE)衍生物, 但这类药物依赖于细胞的快速分裂, 对在复发和耐药中起关键作用的休眠的肿瘤细胞无影响, 并且易发生耐药。因此, 寻找与上述药物作用机制不同的新型ADC“弹头”尤为重要。由于肿瘤细胞表面抗原数量有限(每个细胞表面5×103~1×106个抗原), 并且每个抗体偶联的药物分子数有限(平均3.5~4个), 最后通过ADC输送并到达肿瘤细胞的药物分子数很低, 因此“弹头”分子必须有极强的毒性。这也被认为是采用氨甲喋呤、紫杉醇和蒽环类抗生素等毒性一般的传统化疗药物作为“弹头”的ADC临床试验失败的主要原因[4]。
力达霉素(lidamycin, LDM)是从我国湖北潜江县土壤分离得到的一株放线菌分泌的肽类代谢产物, 是一种强效抗肿瘤抗生素。其结构为一条含110个氨基酸的辅基蛋白(apoprotein of LDM, LDP, 10 500 Da)和一个九元环烯二炔发色团(active enediyne chromophore of LDM, AE, 843 Da)组成, AE是LDM活性成分, LDP起稳定和保护发色团作用, 二者在体外可进行拆分和重建, 重建后的分子与天然力达霉素的活性相同[5]。LDM具有高效杀伤肿瘤细胞作用, 克隆形成实验显示其对肿瘤细胞的半数抑制浓度(IC50)在10-17~10-16 mol·L-1之间, 比多柔比星和丝裂霉素等传统化疗药物强10 000倍以上, 是迄今发现活性最强的肽类抗生素之一[6]。LDM和卡奇霉素(calicheamicin)同属烯二炔家族, 目前已有两种以卡奇霉素为“弹头”的ADC (Besponsa和Mylotarg)被批准上市, 因此, 以LDM作为“弹头”构建ADC极具发展潜力。
HER2是具有酪氨酸蛋白激酶活性的跨膜蛋白, 由胞内的蛋白酪氨酸激酶区、单链跨膜区和胞外的抗体结合区3部分组成, 是人表皮生长因子受体(epidermal growth factor receptor, EGFR)家族成员之一, 参与细胞分化、黏附及运动等重要生理过程[7, 8]。HER2可与同家族受体HER3、HER4发生异源二聚化从而增强二者与特异性配体的亲和能力, 促进酪氨酸残基磷酸化, 从而介导细胞增殖和肿瘤发生[9]。目前, HER2在乳腺癌中的表达与功能已研究得比较透彻, 15%~30%的乳腺癌会发生HER2基因扩增或过表达, 正常乳腺组织中低表达或不表达, 其高表达与乳腺癌发生发展密切相关, 是重要的临床预后标志物。除乳腺癌以外, HER2在卵巢癌、结直肠癌、非小细胞肺癌、子宫内膜癌、膀胱癌和头颈癌等多种肿瘤中也有部分高表达。HER2高表达与肿瘤患者不良预后以及耐药性密切相关, 是判断肿瘤恶性程度的独立预后指标[10-14]。HER2已被证实是肿瘤治疗的理想靶标。
607为三生国健药业(上海)股份有限公司制备的抗HER2抗体, 为曲妥珠单抗生物类似药, 本研究尝试以607为载体, 以力达霉素为“弹头”, 根据LDM可拆分和重建的分子特点, 采用DNA重组和分子重建相结合的特殊“定点偶联”技术, 制备靶向HER2的新型ADC 607-LDM并研究其抗肿瘤活性, 为肿瘤靶向治疗提供潜在的候选药物。
材料与方法实验材料和试剂 人HER2重组蛋白购自北京义翘神州科技股份有限公司, MTT购于Sigma公司, BD MatrigelTM Basement Membrane Matrix购于北京兰博利德生物科技有限公司; 蛋白分子量标准、Annexin V-FITC凋亡检测试剂盒、凋亡周期检测试剂盒等购于Cell Signaling Technology公司; 辣根过氧化物酶(HRP)标记山羊抗人Ig G二抗购自北京中杉金桥生物技术公司; 抗HER2抗体607重组表达载体、融合蛋白重组表达载体p TT由三生国健药业(上海)股份有限公司保存, LDP表达载体由中国医学科学院医药生物技术研究所保存。
HER2高表达的人卵巢癌细胞系SKOV3和人乳腺癌细胞系BT474、HEK293E细胞由三生国健药业(上海)股份有限公司保存; 7~9周龄雌性BALB/c裸鼠, 18~20 g, 购自北京安凯毅博生物技术有限公司, 动物许可证号: SCXK (京) 2012-0009。动物实验符合中国实验动物护理和使用准则, 并经中国医学科学院医药生物技术研究所实验动物伦理委员会批准。
融合蛋白607-LDP构建表达及纯化 采用PCR技术将融合蛋白607-LDP[607-(G4S)3-LDP]基因克隆至PTT5表达载体, 转化大肠杆菌DH5α进行扩增, 然后提取质粒, 经测序鉴定序列无误后瞬时转染HEK293E细胞, 经无血清培养后收集上清, 采用Protein A亲和柱进行纯化, 获得607抗体和融合蛋白607-LDP。将纯化后的抗体通过SDS-PAGE凝胶电泳和HPLC法检测抗体的纯度, 并用BCA试剂盒(标准品为牛血清免疫球蛋白BGG)测定抗体的浓度。
ELISA法检测融合蛋白607-LDP与重组人HER2抗原的亲和活性 96孔板包被重组人HER2抗原, 每孔1μg, 并用2%BSA 4 ℃孵育过夜。PBST洗3次, 加入10倍梯度稀释的607-LDP或607, 浓度分别为100、10、1、0.1、0.01、0.001和0.000 1 nmol·L-1, 37 ℃孵育1 h。PBST洗3次, 加入HRP标记的山羊抗人Ig G二抗, 37℃孵育1 h, PBST洗3次, 避光条件下加入TMB底物溶液进行显色反应, 避光孵育15 min, 加入浓度为2 mol·L-1H2SO4终止反应, 用酶标仪测定光吸收值A450。
融合蛋白607-LDP与发色团AE组装 采用HPLC分离LDM发色团, 色谱柱为(Jupiter5U C4, 1 500 mm×100 mm), 流动相为水-乙腈-三氟乙酸=78%∶22%∶0.05%, 350 nm检测吸收值, 收集AE, 将AE与607-LDP蛋白按3∶1分子比混合, 4℃避光搅拌14 h, 过夜组装后用50 000 MW超滤管超滤, 除去游离的AE, 反相HPLC (C4, 300 A)在350 nm处检测吸收值, 制作浓度/峰面积的标准曲线, 计算组装效率, 得到组装后的强化融合蛋白607-LDM。
MTT法检测607-LDM对肿瘤细胞杀伤抑制作用 将对数生长的HER2高表达的人卵巢癌SKOV3和人乳腺癌BT474肿瘤细胞经0.25%的胰蛋白酶消化后, 制成适当浓度的单细胞悬液, 计数, 稀释成适宜浓度铺板, 37%、5%CO2培养箱培养24 h, 待细胞贴壁生长后, 加入不同浓度梯度的药物培养48 h。然后每孔加入MTT溶液10μL (10 mg·mL-1)培养4 h, 弃上清, 每孔加入二甲基亚砜150μL, 室温震荡10 min, 酶标仪测定570 nm处的吸光值(A570)。实验设置无药对照组和无细胞空白对照组, 按照公式计算细胞存活率并算出IC50值: 细胞存活率=(加药组A570值-空白对照组A570值)/(对照组A570值-空白对照组A570值)×100%。
Annexin V-FITC/PI双染结合流式细胞仪检测607-LDM诱导肿瘤细胞凋亡作用 将对数生长期的SKOV3和BT474细胞计数后稀释成适宜浓度铺6孔板, 24 h后给药, 继续培养24 h, 然后小心收集细胞培养液到离心管内备用。0.25%胰蛋白酶消化细胞, 终止消化后细胞悬液与前面收集的上清液混合, 1 000 r·min-1离心5 min, 弃上清, 然后加入冰浴预冷的PBS洗涤2次, 冰浴备用。
加入预先配置好的Annexin V结合缓冲液, 制成细胞数为每毫升1×106个的细胞悬液, 取出细胞悬液100μL加入到新的EP管中, 向细胞悬液中加入Annexin V-FITC结合物5μL, 再加入碘化丙啶(propidium iodide, PI)溶液5μL, 室温下避光放置15 min, 加入1×Annexin V结合缓冲液400μL, 用200目滤网过滤样品后冰浴避光存放, 待流式细胞仪加样检测(具体参照Annexin V-FITC凋亡检测试剂盒说明处理)。
PI染色结合流式细胞仪检测607-LDM诱导肿瘤细胞周期调节作用 细胞处理部分同凋亡检测, 向洗涤后冰浴备用的细胞团中加入冰浴预冷的70%乙醇制成细胞悬液, 4℃固定24 h, 3 000 r·min-1离心5 min, 弃上清, 残留约50μL左右的70%乙醇, 避免吸走细胞沉淀, 轻轻弹击离心管管底松散细胞, 加入配置好的碘化丙啶染色液(具体步骤参照凋亡周期检测试剂盒说明), 37℃避光温育30 min, 用200目滤网过滤, 流式细胞仪于488 nm激发波长检测。
607-LDM对裸鼠SKOV-3移植瘤模型的抑瘤作用 采用人卵巢癌SKOV3裸鼠移植模型评价抗体偶联药物607-LDM的体内抗肿瘤疗效。选取雌性BALB/c裸鼠, 7~9周龄, 体重18~20 g, 每只接种7×106个细胞和等体积混合基质胶(Matrigel)的悬液200μL至右侧腋窝皮下。待瘤体积达150~200 mm3时, 将小鼠按照肿瘤大小和体重随机分组, 使组间肿瘤大小平均值接近、各组体重平均值接近, 每组6只, 共8组。尾静脉注射给药, 给药方案: 607 (1.0和5.0 mg·kg-1), LDM (0.05 mg·kg-1), 607 (1.0 mg·kg-1)+LDM (0.05 mg·kg-1), 607-LDM (0.6、0.8和1.0 mg·kg-1), 给药1次, 对照组不做处理。实验期间, 密切观察肿瘤生长和小鼠体重的变化, 每隔2~3天测量肿瘤直径(长径和短径)和小鼠体重。根据公式V=ab2/2计算肿瘤体积(a: 肿瘤长径; b: 肿瘤短径), 绘制肿瘤生长曲线并根据公式[1-(终末体积给药组-初始体积治疗组)/(终末体积对照组-初始体积对照组)]×100%计算抑瘤率。
统计学方法 实验数据采用Graph Pad Prism 5.0处理, 表示为x ± s。两组间的差异性比较采用Student's t检验分析, P < 0.05认为有显著性差异。
2 结果 1 融合蛋白607-LDP纯度检测及亲和活性分析采用SDS-PAGE对纯化后的融合蛋白607-LDP进行鉴定, 结果表明: 还原条件下607重链分子质量约为50 kDa, 607-LDP重链由于连接了LDP (10 kDa)分子质量约60 kDa, 二者轻链分子质量均约25 kDa, 与理论分子量相符(图 1A)。通过HPLC高效液相色谱法检测融合蛋白607-LDP纯度, 纯度达到98%以上(图 1B), 纯化后产量为23 mg·L-1。ELISA法检测融合蛋白607-LDP及607抗体与HER2抗原的亲和活性(图 1C), 607-LDP与抗原的亲和曲线与裸抗体607基本一致, 证明将LDP融合在607抗体重链C端并没有影响其亲和活性。
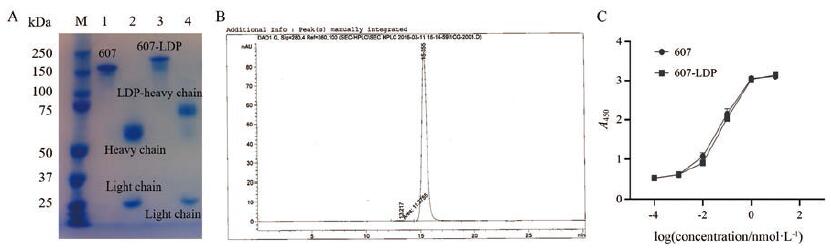
|
Figure 1 Analysis of purified fusion protein 607-LDP by SDS-PAGE (A), HPLC (B) and ELISA (C).Lane M: Protein marker; Lane 1:607 under non-reducing condition; Lane 2:607 under reducing condition; Lane 3:607-LDP under non-reducing condition; Lane 4:607-LDP under reducing condition.607:Anti-HER2 antibody; LDP: Apoprotein of lidamycin (LDM) |
LDM由辅基蛋白LDP与活性发色团AE通过非共价键连接构成, 当有机溶剂存在时, LDP与AE之间的非共价键破坏, 二者分离。除去有机溶剂后, 二者可重新组装, 且组装后产物活性与天然LDM相似, LDM发色团AE在340 nm波长处有特征吸收峰。采用有机溶剂对LDM的辅基蛋白LDP与发色团AE进行拆分, 利用凝胶色谱柱分离AE, 再与融合蛋白607-LDP进行组装, 即获得ADC药物607-LDM (图 2A)。图 2B表明组装后的607-LDM在340 nm处有发色团的特征吸收峰, 说明融合蛋白607-LDP和发色团AE组装成功。图 2C表示超滤后的蛋白溶液中不存在游离AE, 说明游离AE已去除干净。在反向高效液相色谱(RP-HPLC)条件下, 607-LDM可解离出融合蛋白607-LDP和发色团AE, 通过计算峰面积可检测607-LDP和AE的组装效率。检测成功组装ADC后的AE吸收峰面积是113.2, 根据LDM浓度与AE吸收峰面积的标准曲线, 计算组装效率为82%。

|
Figure 2 Molecular reconstitution of 607-LDP and AE.A: Sche‐matic structure of of 607-LDM; B: RP-HPLC analysis of 607-LDM using a Vydac C4 300 A column at 340 nm; C: Analysis of the residual free AE after ultrafiltration by RP-HPLC.AE: Active enediyne chromophore of LDM |
采用MTT法检测抗体偶联药物607-LDM以及单药LDM对肿瘤细胞生长的抑制作用。结果表明, LDM单药对HER2阳性的SKOV3和BT474有强烈的杀伤作用, IC50值分别为0.042和0.171 nmol·L-1; 而607-LDM的杀伤活性则强于LDM单药, 对上述两种细胞的IC50值分别为0.028和0.056 nmol·L-1(图 3)。

|
Figure 3 Cell viabilities of SKOV3 (A) and BT474 (B) cells treated with different concentration of 607-LDM and LDM for 48 h by MTT |
SKOV3和BT474细胞经过607-LDM处理24 h后, Annexin V-FITC/PI双染结合流式细胞仪检测607-LDM对肿瘤细胞的凋亡诱导作用, 结果如图 4所示, 分别得到早期凋亡(右下象限)、中晚期凋亡(右上象限)、坏死(左上象限)、以及活细胞(左下象限)的比例。可以看出, 随着药物浓度的增大, 活细胞比例减少, 凋亡细胞比例明显上升, 表明607-LDM可呈浓度依赖性诱导肿瘤细胞凋亡。
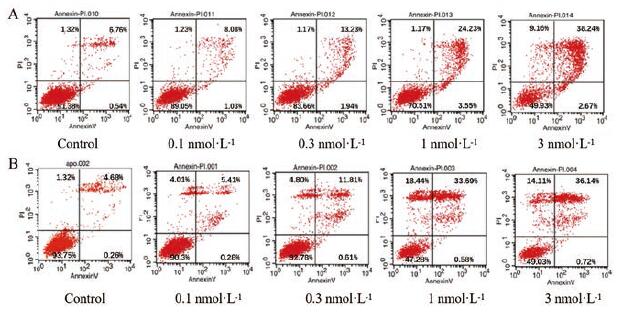
|
Figure 4 Apoptosis analysis of SKOV3 (A) and BT474 (B) cells treated with 607-LDM for 24 h via Annexin V-FITC/PI staining by flow cytometry.Untreated cells were used as control |
PI染色结合流式细胞仪检测607-LDM对细胞周期的影响, 结果显示: 在0.003、0.01和0.03 nmol·L-1时, 607-LDM可诱导SKOV3细胞(图 5A)和BT474细胞(图 5B)明显的G2/M期阻滞, 且呈浓度依赖性。
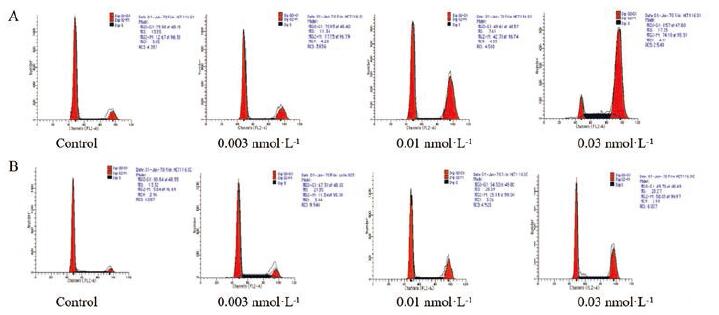
|
Figure 5 607-LDM induced G2/M phase arrest in SKOV3 (A) and BT474 (B) cells treated with 0.003, 0.01 and 0.03 nmol·L-1 for 24 h |
采用人卵巢癌SKOV3裸鼠移植模型检测抗体偶联药物607-LDM的体内抗肿瘤疗效, 结果显示: 不同剂量的607-LDM给药组肿瘤生长速度均有明显不同程度的减慢, 且呈现剂量依赖性关系。607-LDM在0.6、0.8和1.0 mg·kg-1剂量下对SKOV3裸鼠移植瘤的抑瘤率分别为58.4%、67.3%和72.4%, 而单独607抗体在1.0和5.0 mg·kg-1的抑瘤率分别为30.2%和46.7%, LDM最大耐受剂量0.05 mg·kg-1的抑瘤率为50.6%, 607抗体(1.0 mg·kg-1)和LDM (0.05 mg·kg-1)联合给药组抑瘤率为50.1%(图 6A)。与LDM (0.05 mg·kg-1)或607抗体(1.0 mg·kg-1)及二者联用相比, 607-LDM (1.0mg·kg-1)组抑瘤率(72.4%)有显著差异(P < 0.05)。实验期间上述各组裸鼠状态良好, 活动饮食正常且未出现死亡, 给药组体重无明显下降(图 6B)。上述结果说明, 抗体偶联药物607-LDM相比单药LDM或607裸抗及二者联合具有更好的抗肿瘤活性。
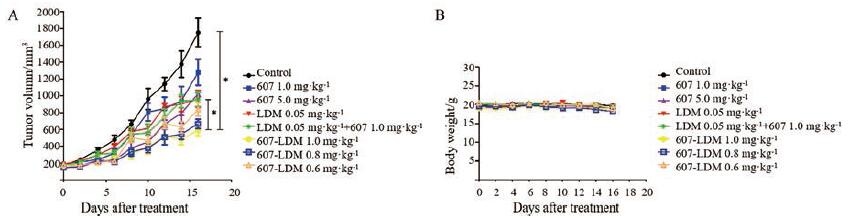
|
Figure 6 In vivo antitumor efficacy of 607-LDM against SKOV3 cell xenograft tumors.A: The tumor growth curves of tumor-bearing mice after injection with different doses of drugs; B: Body weight shifting in tumor bearing mice.The drugs were injected intravenously once on day 0.n=6, x ± s.*P < 0.05 |
目前, 已有多种以HER2为靶点的抗肿瘤药物上市, 包括抗体药物、抗体偶联药物和小分子酪氨酸激酶抑制剂[15, 16]。然而, 作为最易发生突变的蛋白酪氨酸家族成员之一, HER2耐药型肿瘤相比野生型更易侵袭和转移, 且恶性程度大。肿瘤对HER2抗体耐药的主要原因是细胞通过减少抗体与HER2受体结合, 增强可替代HER2的酪氨酸激酶受体家族下游通路的调节及改变其他信号通路进而产生耐药[9]。T-DM1是曲妥珠单抗与微管抑制剂类药物美登素衍生物DM1偶联而成的ADC, 与单纯抗体药物不同的是, 它不依赖HER2介导的下游通路调节, 而是利用单抗的靶向作用将效应分子DM1运至肿瘤细胞内, 然后释放DM1, 从而发挥其抑制肿瘤细胞生长和促进凋亡等作用。因此, T-DM1在很大程度上克服了由于仅依赖与HER2结合进而介导下游信号通路发挥抗肿瘤作用的单抗和小分子酪氨酸激酶抑制剂药物的耐药问题。但是, 研究表明T-DM1也会出现耐药, 主要原因是DM1诱导P-糖蛋白、多药耐药相关蛋白、乳腺癌抗性蛋白过表达及微管蛋白突变等[17], 因此采用与微管抑制剂类药物不同作用机制的强效细胞毒药物作为效应分子则有可能克服现有药物T-DM1的耐药问题。与DM1不同, 作为烯二炔家族的新成员, LDM通过断裂DNA发挥强效细胞毒作用, 是ADC的理想效应分子。本研究以LDM为弹头制备的新型抗HER2抗体ADC 607-LDM, 不仅为HER2阳性恶性肿瘤治疗提供了新的候选药物分子, 还可能用于T-DM1耐药的肿瘤。
与传统的化学偶联方法不同, 本研究利用LDM分子可组装和重建的分子特点, 采用一种特殊“定点偶联”方法实现ADC药物的构建。首先, 利用基因工程技术, 将LDM的辅基蛋白LDP通过连接肽融合到607抗体重链C端, 得到融合蛋白607-LDP。然后, 通过有机溶剂分离得到LDM的活性发色团AE, 利用分子组装法将AE与607-LDP重新组装, 得到极具杀伤活性且药物抗体比(DAR)理论上为2 (抗体的2条重链各连接1个LDM分子)的新型ADC药物607-LDM。该方法既有效避免了传统非定点化学偶联带来的药物结合位置及数量的不可控、稳定性低和不均一等问题[18], 又克服了传统定点偶联技术复杂的抗体修饰和连接肽的合成过程。此外, 本实验室已成功构建抗CD30抗体与LDM的ADC anti-CD30-LDM[19], 证明经过基因工程技术将LDM的辅基蛋白LDP通过连接肽连接于抗体VL可变区N端是可行的, 且对于抗体亲和活性和靶向性无影响。本研究采用了与前期工作不同的设计, 将辅基蛋白LDP通过(G4S)3连接于抗体重链C端, 以避免可能出现的抗体可变区连接LDP影响其亲和活性的问题。从理论上来讲, C末端融合异源蛋白可能会影响抗体的抗体依赖的细胞介导的细胞毒效应, 但ADC的抗肿瘤功能主要由“弹头”药物实现。从实验结果来看, 607-LDM对抗原阳性肿瘤细胞有强烈的杀伤作用, 活性强于游离LDM, 因此C末端连接LDM是可行的。本研究为以LDM为“弹头”的ADC药物提供另一可行的连接位点, 该方法还具有可通过哺乳动物细胞大量制备、操作简便和产品均一性好等优势。
本研究构建的新型靶向HER2的ADC药物607-LDM, 具有良好的体内外抗肿瘤活性。MTT结果显示抗体偶联药物607-LDM对HER2阳性的SKOV-3和BT474细胞相比于单药LDM具有更强的增殖抑制及杀伤活性。在SKOV-3移植瘤抑制实验中, 尾静脉注射给药1次, 607-LDM相比抗体或LDM单药及二者联合组具有更好的抑瘤效果(P < 0.05), 且各实验组动物体重无明显下降, 因此, 607-LDM具有良好的体内外抗肿瘤活性及安全性。以上结果说明, 607-LDM可作为一种新型极具发展潜力的治疗HER2阳性恶性肿瘤的候选抗体偶联药物。
作者贡献: 于群、翟小田完成了607-LDM的体内外抗肿瘤活性研究; 袁佳璐、马健完成了607-LDP融合蛋白的构建、表达、纯化及亲和活性研究; 于群、苗庆芳完成了论文初稿; 苗庆芳、甄永苏设计并指导了所有实验; 苗庆芳完成了论文修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Birrer MJ, Moore KN, Betella I, et al. Antibody-drug conjugatebased therapeutics: state of the science[J]. J Natl Cancer Inst, 2019, 111: 538-549. DOI:10.1093/jnci/djz035 |
| [2] |
Zhang ZB, Wang Y, Bai Y. Consideration of antibody drug conju‐gates development and regulation[J]. Acta Pharm Sin(药学学报), 2020, 55: 1971-1977. |
| [3] |
Chau CH, Steeg PS, Figg WD. Antibody-drug conjugates for cancer[J]. Lancet, 2019, 394: 793-804. DOI:10.1016/S0140-6736(19)31774-X |
| [4] |
Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of antibody-drug conjugates[J]. Nat Rev Drug Discov, 2017, 16: 315-337. DOI:10.1038/nrd.2016.268 |
| [5] |
Shao RG, Zhen YS. Relationship between the molecular compo‐sition of C1027, a new macromolecular antibiotic with enediyne chromophore, and its antitumor activity[J]. Acta Pharm Sin(药学学报), 1995, 30: 336-342. |
| [6] |
Zhen YS, Xue YC, Shao RG. Antitumor activity of the new enediyne antibiotic C1027[J]. Chin J Antibiot(中国抗生素杂志), 1994, 19: 164-168. |
| [7] |
Elster N, Collins DM, Toomey S, et al. HER2-family signalling mechanisms, clinical implications and targeting in breast cancer[J]. Breast Cancer Res Treat, 2014, 149: 5-15. DOI:10.1007/s10549-014-3250-x |
| [8] |
Miller T, Hosford S. Clinical potential of novel therapeutic targets in breast cancer: CDK4/6, Src, JAK/STAT, PARP, HDAC, and PI3K/AKT/m TOR pathways[J]. Pharmgenomics Pers Med, 2014, 7: 203-215. |
| [9] |
Nami B, Maadi H, Wang Z. Mechanisms underlying the action and synergism of trastuzumab and pertuzumab in targeting HER2-positive breast cancer[J]. Cancers(Basel), 2018, 10: 342. |
| [10] |
Day KC, Hiles GL, Kozminsky M, et al. HER2 and EGFR overexpression support metastatic progression of prostate cancer to bone[J]. Cancer Res, 2016, 77: 74-85. |
| [11] |
Connell CM, Doherty GJ. Activating HER2 mutations as emerging targets in multiple solid cancers[J]. Esmo Open, 2017, 2: e000279. DOI:10.1136/esmoopen-2017-000279 |
| [12] |
Curea FG, Hebbar M, Ilie SM, et al. Current targeted therapies in HER2-positive gastric adenocarcinoma[J]. Cancer Biother Radiopharm, 2017, 32: 351-363. DOI:10.1089/cbr.2017.2249 |
| [13] |
Salvia AL, Lopez-Gomez V, Garcia-Carbonero R. HER2-targeted therapy: an emerging strategy in advanced colorectal cancer[J]. Expert Opin Investig Drugs, 2019, 28: 29-38. DOI:10.1080/13543784.2019.1555583 |
| [14] |
Black JD, Salvatore L, Emiliano C, et al. PIK3CA oncogenic mutations represent a major mechanism of resistance to trastu‐zumab in HER2/neu overexpressing uterine serous carcinomas[J]. Br J Cancer, 2015, 113: 1020-1026. DOI:10.1038/bjc.2015.306 |
| [15] |
Smith MB, Reardon J, Olson EM. Pertuzumab for the treatment of patients with previously untreated HER2-positive metastatic breast cancer[J]. Drugs Today(Barc), 2012, 48: 713-722. |
| [16] |
Swain SM, Baselga J, Kim SB, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer[J]. NEngl J Med, 2015, 372: 724-734. DOI:10.1056/NEJMoa1413513 |
| [17] |
Wang H, Wang W, Xu Y, et al. Aberrant intracellular metabolism of T-DM1 confers T-DM1 resistance in human epidermal growth factor receptor 2-positive gastric cancer cells[J]. Cancer Sci, 2017, 108: 1458-1468. DOI:10.1111/cas.13253 |
| [18] |
Boylan NJ, Zhou W, Proos RJ, et al. Conjugation site hetero‐geneity causes variable electrostatic properties in Fc conjugates[J]. Bioconjug Chem, 2013, 24: 1008-1016. DOI:10.1021/bc4000564 |
| [19] |
Wang R, Li L, Zhang S, et al. A novel enediyne-integrated anti‐body-drug conjugate shows promising antitumor efficacy against CD30+ lymphomas[J]. Mol Oncol, 2018, 12: 339-355. DOI:10.1002/1878-0261.12166 |
 2021, Vol. 56
2021, Vol. 56


