纳米粒(nanoparticles, NPs)具有粒径小、比表面积大、反应活性高等特点, 且其三维多组分结构能与生物系统产生独特的相互作用, 使药物递送系统(drug delivery system, DDS)的设计具有高度灵活性, 可以克服生物屏障, 甚至发挥靶向作用[1, 2]。NPs进入机体后可与细胞、细胞器、蛋白质和DNA等相互作用, 建立一系列的纳米-生物界面(nano-bio interface)。该界面的动态变化主要由胶体力学以及纳米材料表面与生物组分之间的动态物理化学相互作用维持, 表现为蛋白冠(protein corona, PC)形成、NPs包裹、细胞内吸收和生物催化等过程, 其中PC是影响NPs在血液中循环时间和疗效发挥的重要因素[3]。了解PC在NPs体内循环过程中所起的作用, 有利于降低NPs清除率、延长其循环时间和增强药物疗效。因此, 本文介绍了PC的一般组成和形成的影响因素, 综述了PC对细胞吞噬NPs的影响, 以及目前利用PC减少细胞吞噬和延长NPs体内循环时间的技术手段, 助力NPs制剂的进一步研究与开发。
1 PC的形成与组成PC是NPs进入体内环境后, 其表面迅速吸附各种蛋白质形成的动态多层蛋白质结构[4], 见图 1。根据Vroman效应, 最初NPs的表面会吸附丰富的低亲和力蛋白质, 形成“soft层”, 其相互作用较弱, 在溶液中的结合蛋白和未结合蛋白之间经过动态平衡进一步形成“hard层”[4, 5], 即蛋白质最初附着于表面后, 会进行一系列吸附与解吸, 形成平衡状态, 最终进入更加稳定的状态, 呈现不可逆性[6]。吸附的决定因素不仅是蛋白质的亲和力, 而是一系列复杂的力的作用, 比如疏水作用、静电相互作用及氢键, 还有分子松弛时间、蛋白质在表面的扩散机制和热力学稳定机制的多重作用, 即构象重排和拥挤效应[6-8]。

|
Figure 1 The formation process of protein corona.When the nanoparticles enter the blood circulatory system, the surface of the nanoparticles will adsorb protein to form a protein corona |
PC的主要成分为蛋白质, 还有少量脂质[9]和糖类[10]。构成PC的蛋白质具有较高丰度, 如血清白蛋白(HSA)、载脂蛋白、补体蛋白和纤维蛋白原等, 以及一些特异性蛋白。NPs进入血液循环之初所形成“soft层”中的蛋白, 主要是在血液中丰度较高而亲和力低的蛋白质, 如白蛋白和纤维蛋白原, 但随后经过动态吸附形成“hard层”, 其组成是丰度较低而亲和力高的蛋白质(如Apo A-1)[11, 12]。NPs的载体材料也会影响“hard层”, 正如Tenzer等[13]研究二氧化硅(SiO2)和聚苯乙烯NPs随着血浆孵育时间增加, PC以白蛋白、载脂蛋白和补体蛋白为主, 特异性蛋白如激肽原、转铁蛋白、凝溶胶蛋白、铜蓝蛋白、血凝素、玻连蛋白和角蛋白等依然存在, 但成分占比却发生了变化。另外, 血浆中蛋白浓度也是影响“hard层”的主要因素, 如Monopoli等[14]研究发现SiO2NPs主要含纤维蛋白原、载脂蛋白和补体蛋白的PC, 当血浆浓度增加时, 纤维蛋白原含量降低, 而糖蛋白、血小板反应蛋白、纤溶酶原、HSA、转铁蛋白和硒蛋白等蛋白质的含量增加。可见, PC中蛋白的吸附呈现出特异性, 这对NPs的生物学效应十分重要, 特别是NPs与细胞之间的相互作用, 如细胞膜黏附、吸收和转运, 甚至是细胞毒性[15, 16]。因此, PC在减少NPs的清除方面发挥重要的意义, 尤其是减少单核吞噬系统中的吞噬细胞对NPs的清除[17]。
2 蛋白冠形成的影响因素PC作为纳米-生物界面的重要现象, 在复杂的生物环境中, 血液中的各种物质和分子都可能影响PC的形成, 影响因素除了前文所述蛋白质的亲和力等一系列决定性因素外, 还有NPs的大小、表面电荷、表面性质和表面材料等物理化学性质。
2.1 粒径对蛋白冠的影响粒径是NPs的基本性质之一, 主要决定了NPs表面曲率和表面积, 从而影响了PC的形成。对于单一球形NPs来说, 粒径越大, 表面曲率越小, 表面吸附的蛋白质受到的空间位阻越大, 可阻止蛋白质的再吸附; 粒径增大, 与蛋白质接触面积增加, 蛋白质吸附量增加[3, 5, 6, 12, 14]。NPs进入血液系统后, 生物分子在热力学和动力学的作用下吸附到表面形成PC, 主要是蛋白质[12]。一方面蛋白质的大小是其中的关键因素, PC吸附的血浆蛋白以中等分子质量(30~100 kDa)的蛋白质为主[18], 低血浆浓度下NPs吸附90 kDa和26 kDa的蛋白质较多, 而高血浆浓度下“hard层”以70~50 kDa的蛋白质较多[14]。而且Casals等[5]发现4 nm NPs表面较小无法形成PC, 10 nm NPs与血清中的蛋白质大小相似可以形成PC, 而40 nm NPs比一般血清蛋白大, 吸附的量多, 易发生调理作用; 另一方面, NPs表面曲率也是重要因素, 如Cedervall等[12]发现70和200 nm的颗粒表面吸附蛋白质的量不同, 70 nm NPs以较小的曲率半径导致较低的蛋白吸附, 而在颗粒表面分离的5种蛋白质中, 200 nm NPs吸附最大分子量的蛋白质最多。Lima等[9]采用粒径为26、80和200 nm的3种羧化聚苯乙烯NPs (COOH-PS NPs)在小鼠血清中分别孵育1和24 h, 经蛋白组学研究发现, 由于NPs表面曲率的影响, PC中分别吸附6、83和49种特异性蛋白; 表面积和表面曲率的双重作用使200 nm NPs吸附胆固醇最多, 进而影响了NPs和细胞的相互作用和细胞摄取机制。NPs粒径增加使其总表面积增加, 对PC的总量和成分也影响很大。较大粒径的金纳米粒(Au NPs)由于其较高的表面积, 对蛋白质的吸附作用更强, 吸附蛋白质的数量也较多, 而且分子质量 < 80 kDa的蛋白质占PC的75%~80%, 40 nm Au NPs在PC最高丰度的20种蛋白质中存在精氨琥珀酸合成酶(argininosuccinate synthase)和激肽释放酶(kallistatin)两种特异性蛋白, 而70 nm Au NPs具有α-1B糖蛋白(α-1B glycoprotein)、铜蓝蛋白、α1-抗胰蛋白酶1-3 (α1-antitrypsin 1-3)和丝氨酸蛋白酶抑制剂A1 (serpin A1)等特异性蛋白[19]。同样, Lima等[9]发现26 nm NPs的PC中蛋白质总量较少, 特别是载脂蛋白; 粒径大为蛋白质吸附提供了更多的表面空间, 因此200 nm的NPs吸附蛋白的总量较多, 尤其是肌球蛋白重链-9 (myosin-9)和Apo A-1。
2.2 表面电荷对蛋白冠的影响NPs表面所带电荷可与蛋白质发生静电作用, 从而影响PC的形成。大多数蛋白质的等电点在5.0左右, 在生理pH值时(7.35~7.45), 血液中的蛋白质总体带负电[9]。带负电的NPs首先吸附带正电的蛋白质, 再吸附带负电荷的蛋白质, 最终所形成的PC带负电[9, 19-21]; 带正电荷的NPs在pH 7.4条件下, 表面可以显著吸附蛋白质, 呈现中度负表面电势(-20~-30 mV)[22, 23]。蛋白质吸附机制认为, 由于电荷吸附作用, 表面带正电荷的NPs比带负电和中性的NPs具有更强的蛋白吸附性[24], 并影响了PC中蛋白质的总量。如采用不同材料修饰而带有正、负两种电位的Fe3O4NPs, 前者的蛋白质吸附量显著高于后者[25], 在其他研究中, 蛋白吸附总量上的差异可以达到40%[26], 因此阳离子NPs可形成更加致密且多样性较低的PC。
2.3 表面性质对蛋白冠的影响NPs表面性质为蛋白质吸附提供了热力学表面, 亲水性程度影响PC的形成。蛋白质分子具有很多极性基团, 吸附水分子后形成水化膜, 疏水性NPs更容易破坏蛋白质水化膜, 使其在热力学稳定的条件下吸附在NPs表面[12, 23]。例如Saha等[23]改变NPs端基的组成结构, 发现虽然PC中的蛋白质主要为免疫球蛋白和载脂蛋白(约占总蛋白的60%), 而且静电作用是影响NPs与蛋白质结合的主要因素, 但是, 在10%血清中NPs的疏水性是载脂蛋白形成的关键, 随NPs表面疏水性增加载脂蛋白的量会降低。甚至研究发现疏水性NPs是亲水性NPs吸附蛋白质2.1倍, 而且在NPs表面优先吸附的蛋白质随NPs表面亲水性程度而异, 亲水性NPs优先吸附玻连蛋白和抗凝血酶III, 疏水性NPs优先吸附HSA、血红蛋白β亚基(hemoglobin fetal subunit beta, HB), 中等疏水性NPs优先吸附踝蛋白1 (talin 1)和凝血酶原, 但是所有类型的纳米粒都优先吸附了载脂蛋白, 而且亲水性NPs在PC的动态平衡中比疏水性NPs的蛋白质交换速率更高[21]。还有研究[27]认为, 亲水性纳米材料主要吸附白蛋白、纤维蛋白原和IgG, 而载脂蛋白不同, 不同类型具有不同的吸附倾向, 如Apo A-4、Apo B、Apo C-3和Apo E优先吸附至疏水量子点, 而Apo A-1、Apo A-2和Apo C-1优先吸附至更亲水的NH2修饰的量子点。NPs表面粗糙度影响PC的形成, 研究者[28]利用6种基于葡萄糖、甘露糖和半乳糖制备的三嵌段三元共聚物, 发现粗糙的NPs比光滑表面的球形NPs吸附的蛋白质减少, 而且以非特异性结合的蛋白质减少为主。
2.4 表面材料对蛋白冠的影响常见的载药NPs表面材料如可降解的如聚氰基丙烯酸烷酯和聚酯类; 天然高分子材料中的亲水性聚合物和脂质材料; 不可降解的如聚丙烯酰胺类、聚甲基丙烯酸烷酯类和磁性氧化铁和SiO2[29]。载药NPs的制备材料的化学特性促成了特异性的PC的形成, 尤其是NPs最表面材料能与血液中的分子直接接触, 成为诱导PC形成的关键因素之一。研究SiO2NPs和聚苯乙烯NPs发现, 聚苯乙烯NPs的吸附蛋白质的总量随血浆浓度上升明显增加, 特别是纤维蛋白原和免疫球蛋白的量增加, 而开始以HSA最多, 最后与载脂蛋白、补体蛋白一起减少; 随着血浆浓度增加, 虽然SiO2NPs吸附蛋白质的总量略有降低, 且纤维蛋白原下降约10%, 但血小板反应蛋白、富含组氨酸的糖蛋白、纤溶酶原、HSA、转铁蛋白、硒蛋白以及β-糖蛋白等蛋白质被富集[14]。Zhang等[30]探究发现多壁碳纳米管(multiwalled carbon nanotubes, MWCNT)主要吸附牛血清白蛋白和免疫球蛋白G, MWCNT与蛋白质之间的相互作用在一定程度上改变了吸附蛋白质的特性和结构。
为了改变NPs的表面性质, NPs通常会在其表面包覆新的材料以达到设计的目标, 如Li等[31]以聚乙二醇(polyethylene glycol, PEG)、壳聚糖(chitosan, CS)和聚乙烯亚胺(polyethylenimine)包覆Au NPs研究表面化学对器官组织分布的影响, 结果表明PEG使Au NPs吸附的血清蛋白最少, 在体内显示出良好的分散稳定性和抗蛋白质吸附性, 使Au NPs在血液循环时间最长; CS和聚乙烯亚胺使Au NPs吸附更多的血清蛋白, 易在体内凝聚。与无机NPs相比, 采用CS、羧甲基葡聚糖及巯基葡聚糖的包覆聚合物NPs具有较薄的蛋白冠层, 主要由载脂蛋白、蛋白C (protein C)、血红蛋白亚单位(hemoglobin subunits)和α-间胰蛋白酶抑制剂(inter-alpha-trypsin inhibitor)组成, 这可能影响纳米粒的生物分布和细胞摄取[32]。
为了使NPs达到长循环或靶向的目标, 通常也会在其表面接枝一些小分子配体, 因此表面配体也能影响PC的形成。Walkey等[33]发现Au NPs的PEG接枝密度决定了NPs表面PEG分子构象的自由度和蛋白质吸附的热力学, 通过PC调节NPs与细胞表面受体的相互作用影响巨噬细胞摄取。研究者[34]利用转铁蛋白受体的靶向配体, 发现配体大小和构象的差异影响PC的组成, 主要是纤维蛋白原、白蛋白、载脂蛋白和补体蛋白吸附的含量, 导致其细胞摄取和胞吐的变化。
3 蛋白冠对纳米粒体内循环时间的影响在复杂的生物环境中, PC作为NPs与细胞或分子接触的界面, 对NPs的生物学效应十分重要, 甚至影响NPs发挥药物疗效。研究发现单核吞噬系统清除体内占比90%以上的NPs, 引起药物疗效降低, 毒副作用增大[35, 36], 而且PC中较高丰度的蛋白质及一些特异性蛋白可以影响单核吞噬系统中吞噬细胞对NPs吞噬, 从而影响NPs在体内的血液循环时间[17]。
研究表明PC中较高丰度的蛋白质, 如白蛋白、载脂蛋白和纤维蛋白原等, 会影响NPs在体内的吞噬, 其中, 吸附的蛋白质如白蛋白、载脂蛋白能起到降低吞噬细胞吞噬的作用, 有助于NPs在体内循环时间的延长, 然而吸附的免疫球蛋白、纤维蛋白原和补体蛋白等一系列具有激活吞噬作用的蛋白质, 会导致NPs从体内快速清除[37-39]。由于蛋白质的亲和力和丰度的影响, 各种蛋白质之间产生一种复杂的相互竞争作用形成动态的蛋白冠, 通过各种蛋白质的综合作用会影响细胞黏附、补体激活或巨噬细胞识别和摄取, 进而影响吞噬细胞对NPs的清除[4, 9, 14]。研究发现羧化聚苯乙烯NPs(COOH-PS NPs) PC中Apo A-1的吸附和Apo E的解吸有助于蛋白质和脂质在PC上的重新分布[9]。Apo A-4和Apo C-3包被可以降低细胞摄取聚苯乙烯NPs, 而Apo H包被则可以增加其细胞摄取, 由于蛋白质的竞争作用, NPs表面吸附的凝血酶原、抗凝血酶III、玻连蛋白和凝血因子的相对含量与细胞摄取呈正相关, 而白蛋白和第3种补体成分(complement 3, C3)呈负相关[22]。补体、脂蛋白和凝血类的蛋白质与巨噬细胞摄取呈现高度正相关, 免疫球蛋白与巨噬细胞摄取呈负相关性, 因此PC中各种蛋白质的含量和复杂相互作用是影响巨噬细胞摄取的关键[23]。就像Saha等[23]研究发现具有亲水和疏水表面的Au NPs可以调节血清孵育中α-C4b结合蛋白(human C4b-binding protein alpha, C4BPA)和IGLC-2 (Ig lambada-2 chain C regions)的吸附, 进而影响细胞摄取, 其中, C4BPA与巨噬细胞摄取成正相关, IGLC-2与巨噬细胞摄取成负相关。Bertrand等[38]制备PEG化聚乳酸-羟基乙酸共聚物[poly(lacticco-glycolic acid), PLGA]NPs, 将缺乏补体C3、Apo E、Apo J和低密度脂蛋白(LDLR)的基因敲除小鼠对NPs的清除与正常小鼠相比, 缺乏补体C3的基因敲除小鼠无法引发补体激活, 却没有显著延长NPs循环时间, 然而缺乏Apo E和Apo J的基因敲除小鼠使NPs的血液清除速度加快, 尤其是对于低密度PEG修饰的NPs。而且Apo E和Apo J作为PC中几种丰度最高的蛋白质, 说明PC中的载脂蛋白显著延长了NPs在血液的循环时间。因此, PC中较高丰度的蛋白质及一些特异性蛋白可以影响NPs的表面性质和生物学效应。
对吞噬细胞吞噬NPs的影响, 主要与吞噬细胞清除NPs的方式有关, 分别是经受体介导的细胞吞噬、非特异性黏附激活吞噬作用及补体激活反应促进吞噬等, 这三种方式都是PC中的特定蛋白可以与细胞表面发生相互作用[40]。Visalakshan等[20]发现含有羧基的丙烯酸(acrylic acid, AC)亲水性表面和富含甲基的1, 7-辛二烯(1, 7-octadiene, OD)疏水表面分别吸附了以白蛋白和免疫球蛋白IgG2最高含量的PC, 以调节抗炎细胞因子(精氨酸酶和IL-10)和促炎细胞因子(TNF-α和IP-10)来激活不同的细胞吞噬途径。调理素吸附在NPs表面并改变构象, 与吞噬细胞接触, 经吞噬细胞表面的受体识别后使NPs被摄取。Candace等[41]制备胺改性的阳离子聚苯乙烯NPs (NH2-PS NPs)和羧酸盐改性的阴离子聚苯乙烯NPs (COOH-PS NPs), 吸附的血清蛋白使NPs成为净的阴离子蛋白-NPs复合物, PC组分差异使COOH-PS NPs以白蛋白受体介导细胞内化为主, NH2-PS NPs却以清道夫受体介导细胞内化, 进而影响细胞摄取。一方面, 蛋白冠不仅降低了NPs对细胞膜的黏附, 而且阻碍清道夫受体对Au NPs的识别, 促进网格蛋白对Au NPs的识别, 因此血清蛋白的存在抑制了细胞对NPs摄取[42]。同样有研究认为PC的血清蛋白对吞噬细胞产生非特异性黏附, 导致免疫细胞非特异性吞噬NPs, 其中增加载脂蛋白的占比和PEG化可以抑制蛋白质的吸附防止非特异性细胞摄取[3, 11, 22, 23, 25]; 另一方面, 补体C3与吸附的蛋白质共价结合, 而且可与PC中的蛋白质进行动态交换, 甚至补体因子和凝血因子等与高丰度的免疫球蛋白之间竞争性吸附, 有助于促进巨噬细胞识别和摄取[23, 43]。
4 应用蛋白冠促进纳米粒体内长循环的方法NPs在体内的清除系统包括肝脏、脾脏和肾脏。除了肾过滤系统的清除以外, NPs的清除主要是调理蛋白吸附在NPs表面, 启动了细胞的摄取和内化机制所致。因此可以利用PC的作用改善NPs进入体循环后的状态。如前所述, NPs的物理化学性质能影响其表面PC的形成。为了改善表面性质, NPs常通过设计采用合适的骨架材料、表面接枝亲水化合物或采用仿生的细胞膜包被等方式影响NPs的PC, 延长其血液循环时间[37, 44]。此外, 通过充分理解蛋白质的竞争关系和利用其在生物循环体系内的功能达到精准设计PC, 以达到延长NPs体内循环的目标, 见图 2。
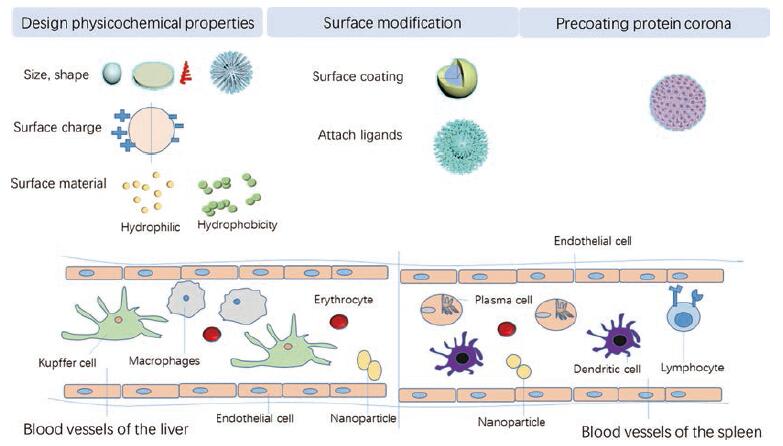
|
Figure 2 Method for using protein corona to promote long circulation of nanoparticle.It is mainly through the design of appropriate physical and chemical properties, surface modification and targeted design of protein crowns to reduce the adsorption of proteins on the surface of nanoparticles, especially opsonizing proteins (immunoglobulin, fibrinogen and complement proteins).This can reduce the clearance of nanoparticles in the mononuclear phagocytic system (mainly the phagocytes of the liver and spleen) to achieve the goal of long circula‐tion of nanoparticles in the body |
NPs表面PC的形成主要取决于所处的生物介质与NPs本身性质。不同的生理环境, 如血浆、血清、动物血清(胎牛血清)、游离白蛋白和游离纤维蛋白原, 以及动态培养基血等能影响PC的形成[45, 46]。通过设计NPs的物理化学性质(粒径、形状、表面电荷、材料的亲水疏水性)来控制纳米粒表面PC的形成, 改变NPs的细胞摄取或生物分布, 延长NPs血液循环时间。Martin等[47]研究了6种不同的聚苯乙烯NPs, 分别是3种表面化学性质(中性、羧基改性和胺改性)的两种尺寸(50和100 nm)在人血浆中对PC形成的影响, 发现在50 nm NPs的3种表面化学性质, 其PC共有35%~40%蛋白质, 特异性蛋白约35%, 胺修饰NPs的PC中以载脂蛋白数量最多, 10个载脂蛋白中有9个与高密度脂蛋白(HDL)相关, 表明胺修饰50 nm NPs与HDL相关, 其他的与极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)相关。而羧基修饰的100 nm NPs, PC中只有约15%特异性蛋白质, 还含有大量的免疫球蛋白。因此, 通过对表面性质和尺寸的影响进行系统研究, 完全改变了PC中生物活性蛋白质的性质, 从而改变NPs的生物学效应。Madathiparambil等[48]制备棒状和球状SiO2NPs在人血浆和血清中孵育1 h后, 发现棒状NPs低曲率更有利于蛋白质吸附, 使其比球形NPs上吸附的蛋白质总量明显升高, 主要是免疫球蛋白、IgG2c和补体C1s蛋白更高, 但是球形NPs上吸附白蛋白和纤维蛋白原的量更高, 因此棒状NPs可能会触发更强的免疫反应, 球形NPs的体内循环时间更长。
4.2 采用表面修饰控制表面性质针对NPs表面的亲水疏水性对PC的形成的影响, 当以亲水性分子(多糖、多肽或蛋白质)修饰NPs时, 亲水层能减少血清蛋白吸附, 影响细胞摄取[22], 其中, PEG修饰研究最深入, 也被作为减少NPs被非特异性吞噬细胞吞噬的准则。PEG的长度和密度对循环时间的影响是减少蛋白质吸附的关键, 也是PEG层的“蘑菇状”和“刷状”结构的理论基础[49-55], 这主要与空间位阻效应、分子链的构象波动及水合作用有关[40, 56]。亲水性分子修饰对PC的形成及体内循环的影响见表 1[11, 25, 27, 33, 43, 57-63]。
| 表 1 The effect of hydrophilic molecular modification on protein corona and circulation in vivo. SPIONs: Superparamagnetic iron oxide nanoparticles; ITIH4: Inter-alpha-trypsin inhibitor heavy chain H4; AGP: Alpha-1-acid glycoprotein; HES: Hydroxyethylstarch; PS: Polysarcosine; NP-Pd: Pd coated nanoparticles (NPs); NP-pD-Al: Albumin-coated NPs; NPxAl: NPs with surface-embedded albumin 1; LSECs: Liver sinusoidal endothelial cells; PEEP: Poly(ethyl ethylene phosphate); PVA: Polyvinyl alcohol polymer; MPS: Mononuclear phagocytic system |
此外, 以自然原理为基础开发了各种细胞膜修饰NPs的仿生技术, 通过发挥细胞膜上特殊蛋白的作用使NPs无法被吞噬细胞识别为异物, 增加其循环时间。正如Li等[64]发现80 nm RBC-PLGA NPs中含有与各种生物学过程有关的474种小鼠膜蛋白, 其中CD47占总膜蛋白的0.423%, 高度表达使RBC-PLGA NPs避免了巨噬细胞的吞噬作用。甚至, 由细胞膜修饰中蛋白质的功能出发, 发现CD47修饰NPs不但与PEG修饰一样, 能降低NPs在所有类型中的巨噬细胞摄取, 而且通过降低M1巨噬细胞表达SIRPα蛋白显著地降低了NPs在M1巨噬细胞的摄取[61]。Hu等[65]在PLGA上包覆一种血小板膜制造的单层膜, 虽然含有的免疫调节蛋白CD47、CD55、CD59、各种整合蛋白及其他跨膜蛋白的量与血小板膜中的量不同, 但CD47蛋白以特异性方式减少细胞的摄取, 补体调节蛋白CD55和CD59抑制了补体激活系统, 减少NPs在血浆孵育后的补体激活反应。
4.3 定向设计蛋白冠当PC在NPs表面迅速形成, NPs的生物学效应的定义由其本身的物理化学性质变成了PC与NPs的生物相互作用。PC不仅影响细胞对NPs的摄取内化等, 而且在减少NPs的清除方面发挥重要意义。因此, 通过精准设计PC的组分以改善体内循环, 有助NPs的开发与应用。现阶段主要通过NPs在体外预先形成特定PC, 主要是增加反调理蛋白(白蛋白、载脂蛋白)吸附, 减少调理蛋白(免疫球蛋白、纤维蛋白原和补体蛋白)吸附, NPs进入体内后可以减少免疫反应。Johanna等[66]通过亲和层析的方法将人血浆中除去IgG (IgG的总量从28%降低到4%)的蛋白部分作为蛋白涂层, 以生成特定的PC。这种预先形成的蛋白冠降低了NPs与巨噬细胞的相互作用, 达到定向设计PC实现控制的细胞相互作用的目的。将棕榈酸鲸蜡酯和聚山梨酯80制备成脂质NPs, 并将其在富含Apo E-4的大肠杆菌中孵育以形成PC, 从而可以特异性靶向脑血管内皮, 使静脉给药注射后30 min显示出大脑蓄积增加了3倍[67]。
5 总结与展望在复杂的生物环境中, NPs表面形成的PC改变了其生物学效应, 不仅包括黏附特性、细胞识别、摄取以及内化机制, 还包括NPs在体内的分布、积累、降解、清除和毒性, 尤其是NPs在体内的循环时间, 比如单核吞噬系统引起NPs在血液快速清除或由于相关蛋白的构象变化而激活免疫应答。因此, 利用PC成为改善NPs生物学效应的重要方法之一, 利用蛋白质动态竞争吸附和特定蛋白吸附对细胞吞噬的影响已经取得了众多成果。开发新的策略, 如铁蛋白纳米笼修饰[68], 将有助于NPs体内循环。虽然PC在2007年首次提出后, 有关PC组分研究采用平衡解离和动力学系数、吸附指数或定量构效关系为依据, 但PC的研究技术还是以离心分离和蛋白组学为主, 对于“soft层”和“hard层”形成的基本机制及组分研究还需开发新技术。目前的难点包括PC中蛋白质“构象变化”、蛋白质动态竞争吸附关系、特定蛋白的作用途径及NPs的物理化学性质对PC影响的内在联系, 甚至是PC对NPs生物学作用的机制等。在将PC的应用与NPs的设计联系时, 已有研究提出了设计特定PC达到血液循环时间的新思路, 而在靶向配体修饰的NPs时, 虽然血液循环时间延长有助于靶向效果, 但是PC可能影响体内的靶向作用。总之, PC作为纳米生物界面的一个重要的由生物学、物理学及化学动力学共同影响的复杂现象, 还需要更为深入的研究, 才能为NPs制剂提供长远的发展。
作者贡献: 周冬艳提出了本文的主旨和思路, 查找、归纳和撰写本文; 关志宇肯定了本文思路, 对本文进行了指导和修改; 姜晟进行了相关文献的查询; 朱卫丰、钟凌云、刘婧和刘荣华帮助完善了本文思路, 有助本文修改。
利益冲突: 作者声明不存在利益冲突。
| [1] |
Zhang L, Pornpattananangkul D, Hu CJ, et al. Development of nanoparticles for antimicrobial drug delivery[J]. Curr Med Chem, 2010, 17: 585-594. DOI:10.2174/092986710790416290 |
| [2] |
Desai N. Challenges in development of nanoparticle-based therapeutics[J]. AAPS J, 2012, 14: 282-295. DOI:10.1208/s12248-012-9339-4 |
| [3] |
Nel AE, Madler L, Velegol D, et al. Understanding biophysicochemical interactions at the nano-bio interface[J]. Nat Mater, 2009, 8: 543-557. DOI:10.1038/nmat2442 |
| [4] |
Docter D, Distler U, Storck W, et al. Quantitative profiling of the protein coronas that form around nanoparticles[J]. Nat Protoc, 2014, 9: 2030-2044. DOI:10.1038/nprot.2014.139 |
| [5] |
Casals E, Pfaller T, Duschl A, et al. Time evolution of the nanoparticle protein corona[J]. ACS Nano, 2010, 4: 3623-3632. DOI:10.1021/nn901372t |
| [6] |
Barbero F, Russo L, Vitali M, et al. Formation of the protein corona: the interface between nanoparticles and the immune system[J]. Semin Immunol, 2017, 34: 52-60. DOI:10.1016/j.smim.2017.10.001 |
| [7] |
Basu A, Kundu S, Basu C, et al. Biopolymer nanoparticle surface chemistry dictates the nature and extent of protein hard corona[J]. J Mol Liq, 2019, 282: 169-176. DOI:10.1016/j.molliq.2019.03.016 |
| [8] |
Ke PC, Lin S, Parak WJ, et al. A decade of the protein corona[J]. ACS Nano, 2017, 11: 11773-11776. DOI:10.1021/acsnano.7b08008 |
| [9] |
Lima T, Bernfur K, Vilanova M, et al. Understanding the lipid and protein corona formation on different sized polymeric nanoparticles[J]. Sci Rep, 2020, 10: 1129. DOI:10.1038/s41598-020-57943-6 |
| [10] |
Palchetti S, Colapicchioni V, Digiacomo L, et al. The protein corona of circulating PEGylated liposomes[J]. Biochim Biophy Acta, 2016, 1858: 189-196. DOI:10.1016/j.bbamem.2015.11.012 |
| [11] |
Winzen S, Schoettler S, Baier G, et al. Complementary analysis of the hard and soft protein corona: sample preparation critically effects corona composition[J]. Nanoscale, 2015, 7: 2992-3001. DOI:10.1039/C4NR05982D |
| [12] |
Cedervall T, Lynch I, Lindman S, et al. Understanding the nanoparticle-protein corona using methods to quantify exchange rates and affinities of proteins for nanoparticles[J]. Proc Nat Acad Sci U S A, 2007, 104: 2050-2055. DOI:10.1073/pnas.0608582104 |
| [13] |
Tenzer S, Docter D, Kuharev J, et al. Rapid formation of plasma protein corona critically affects nanoparticle pathophysiology[J]. Nat Nanotech, 2013, 8: 772-781. DOI:10.1038/nnano.2013.181 |
| [14] |
Monopoli MP, Walczyk D, Campbell A, et al. Physical-chemical aspects of protein corona: relevance to in vitro and in vivo biological impacts of nanoparticles[J]. J Am Chem Soc, 2011, 133: 2525-2534. DOI:10.1021/ja107583h |
| [15] |
Abdelkhaliq A, Der Zande MV, Punt A, et al. Impact of nanoparticle surface functionalization on the protein corona and cellular adhesion, uptake and transport[J]. J Nanobiotechnol, 2018, 16: 70. DOI:10.1186/s12951-018-0394-6 |
| [16] |
Mirshafiee V, Kim R, Park S, et al. Impact of protein pre-coating on the protein corona composition and nanoparticle cellular uptake[J]. Biomaterials, 2016, 75: 295-304. DOI:10.1016/j.biomaterials.2015.10.019 |
| [17] |
Cai R, Chen CY. The crown and the scepter: roles of the protein corona in nanomedicine[J]. Adv Mater, 2019, 31: e1805740. DOI:10.1002/adma.201805740 |
| [18] |
Giulimondi F, Digiacomo L, Pozzi D, et al. Interplay of protein corona and immune cells controls blood residency of liposomes[J]. Nat Commun, 2019, 10: 3686. DOI:10.1038/s41467-019-11642-7 |
| [19] |
Garciaalvarez R, Hadjidemetriou M, Sancheziglesias A, et al. In vivo formation of protein corona on gold nanoparticles. The effect of their size and shape[J]. Nanoscale, 2018, 10: 1256-1264. DOI:10.1039/C7NR08322J |
| [20] |
Visalakshan RM, MacGregor MN, Sasidharan S, et al. Biomaterial surface hydrophobicity-mediated serum protein adsorption and immune responses[J]. ACS Appl Mater Interfaces, 2019, 11: 27615-27623. DOI:10.1021/acsami.9b09900 |
| [21] |
Yu QH, Zhao LX, Guo CC, et al. Regulating protein corona formation and dynamic proteinexchange by controlling nanoparticle hydrophobicity[J]. Front Bioeng Biotechnol, 2020, 8: 210. DOI:10.3389/fbioe.2020.00210 |
| [22] |
Ritz S, Schöttler S, Kotman N, et al. Protein corona of nanoparticles: distinct proteins regulate the cellular uptake[J]. Biomacromolecules, 2015, 16: 1311-1321. DOI:10.1021/acs.biomac.5b00108 |
| [23] |
Saha K, Rahimi M, Yazdani M, et al. Regulation of macrophage recognition through the interplay of nanoparticle surface functionality and protein corona[J]. ACS Nano, 2016, 10: 4421-4430. DOI:10.1021/acsnano.6b00053 |
| [24] |
Alexis F, Pridgen E, Molnar LK, et al. Factors affecting the clearance and biodistribution of polymeric nanoparticles[J]. Mol Pharm, 2008, 5: 505-515. DOI:10.1021/mp800051m |
| [25] |
Calatayud M. Sanz B, Raffa V, et al. The effect of surface charge of functionalized Fe3O4 nanoparticles on protein adsorption and cell uptake[J]. Biomaterials, 2014, 35: 6389-6399. DOI:10.1016/j.biomaterials.2014.04.009 |
| [26] |
Almalik A, Benabdelkamel H, Masood A, et al. Hyaluronic acid coated chitosan nanoparticles reduced the immunogenicity of the formed protein corona[J]. Sci Rep, 2017, 7: 10542. DOI:10.1038/s41598-017-10836-7 |
| [27] |
Schottler S, Becker G, Winzen S, et al. Protein adsorption is required for stealth effect of poly(ethylene glycol)-and poly(phosphoester)-coated nanocarriers[J]. Nat Nanotechnol, 2016, 11: 372-377. DOI:10.1038/nnano.2015.330 |
| [28] |
Piloni A, Wong CK, Chen F, et al. Surface roughness influences the protein corona formation of glycosylated nanoparticles and alter their cellular uptake[J]. Nanoscale, 2019, 11: 23259-23267. DOI:10.1039/C9NR06835J |
| [29] |
He W, Hong Y. Research progress of preparation of drug-loading nanoparticles[J]. China Med Herald(中国医药导报), 2016, 13: 33-36. |
| [30] |
Zhang T, Tang M, Yao Y, et al. MWCNT interactions with protein: surface-induced changes in protein adsorption and the impact of protein corona on cellular uptake and cytotoxicity[J]. Int J Nanomedicine, 2019, 14: 993-1009. DOI:10.2147/IJN.S191689 |
| [31] |
Li X, Wang B, Zhou S, et al. Surface chemistry governs the suborgan transfer, clearance and toxicity of functional gold nanoparticles in the liver and kidney[J]. J Nanobiotechnol, 2020, 18: 45. DOI:10.1186/s12951-020-00599-1 |
| [32] |
Tekie FSM, Hajiramezanali M, Geramifar P, et al. Controlling evolution of protein corona: a prosperous approach to improve chitosan-based nanoparticle biodistribution and half-life[J]. Sci Rep, 2020, 10: 9664. DOI:10.1038/s41598-020-66572-y |
| [33] |
Walkey CD, Olsen JB, Guo HB, et al. Nanoparticle size and surface chemistry determine serum protein adsorption and macrophage uptake[J]. J Am Chem Soc, 2012, 134: 2139-2147. DOI:10.1021/ja2084338 |
| [34] |
Zhang HJ, Wu TM, Yu WQ, et al. Ligand size and conformation affect the behavior of nanoparticles coated with in vitro and in vivo protein corona[J]. ACS Appl Mater Interfaces, 2018, 10: 9094-9103. DOI:10.1021/acsami.7b16096 |
| [35] |
Zhou YM, Dai ZF. New strategies in the design of nanomedicine to oppose uptake by the mononuclear phagocyte system for enhancing cancer therapeutic efficacy[J]. Chem Asian J, 2018, 13: 3333-3340. DOI:10.1002/asia.201800149 |
| [36] |
Wilhelm S, Tavares AJ, Dai Q, et al. Analysis of nanoparticle delivery to tumors[J]. Nat Rev Mater, 2016, 1: 16014. DOI:10.1038/natrevmats.2016.14 |
| [37] |
Nguyen VH, Lee BJ. Protein corona: a new approach for nanomedicine design[J]. Int J Nanomedicine, 2017, 12: 3137-3151. DOI:10.2147/IJN.S129300 |
| [38] |
Bertrand N, Grenier P, Mahmoudi M, et al. Mechanistic understanding of in vivo protein corona formation on polymeric nanoparticles and impact on pharmacokinetics[J]. Nat Commun, 2017, 8: 777. DOI:10.1038/s41467-017-00600-w |
| [39] |
Aoyama M, Hata K, Higashisaka K, et al. Clusterin in the protein corona plays a key role in the stealth effect of nanoparticles against phagocytes[J]. Biochem Biophys Res Commun, 2016, 480: 690-695. DOI:10.1016/j.bbrc.2016.10.121 |
| [40] |
Owens III DE, Peppas NA. Opsonization, biodistribution, and pharmacokinetics of polymeric nanoparticles[J]. Int J Pharm, 2006, 307: 93-102. DOI:10.1016/j.ijpharm.2005.10.010 |
| [41] |
Candace FC, Christine PK. Nanoparticle-cell interactions: molecular structure of the protein corona and cellular outcomes[J]. Acc Chem Res, 2014, 47: 2651-2659. DOI:10.1021/ar500190q |
| [42] |
Cheng XJ, Tian X, Wu AQ, et al. Protein corona influences cellular uptake of gold nanoparticles by phagocytic and nonphagocytic cells in a size-dependent manner[J]. ACS Appl Mater Interfaces, 2015, 7: 20568-20575. DOI:10.1021/acsami.5b04290 |
| [43] |
Chen FF, Wang GK, Griffin JI, et al. Complement proteins bind to nanoparticle protein corona and undergo dynamic exchange in vivo[J]. Nat Nanotechnol, 2017, 12: 387-393. DOI:10.1038/nnano.2016.269 |
| [44] |
Choi BY, Park W, Park SB, et al. Recent trends in cell membrane-cloaked nanoparticles for therapeutic applications[J]. Methods, 2020, 177: 2-14. DOI:10.1016/j.ymeth.2019.12.004 |
| [45] |
Ahsan SM, Rao CM, Ahmad MF. Nanoparticle-protein interaction: the significance and role of protein corona[J]. Adv Exp Med Biol, 2018, 1048: 175-198. |
| [46] |
Xiao W, Gao HL. The impact of protein corona on the behavior and targeting capability of nanoparticle-based delivery system[J]. Int J Pharm, 2018, 552: 328-339. DOI:10.1016/j.ijpharm.2018.10.011 |
| [47] |
Martin L, Stigler J, Elia G, et al. Nanoparticle size and surface properties determine the protein corona with possible implications for biological impacts[J]. Proc Natl Acad Sci U S A, 2008, 105: 14265-14270. DOI:10.1073/pnas.0805135105 |
| [48] |
Madathiparambil VR, González GLE, Benzigar MR, et al. The Influence of nanoparticle shape on protein corona formation[J]. Small, 2020, 16: 2000285. DOI:10.1002/smll.202000285 |
| [49] |
Bernhard C, Bauer KN, Bonn M, et al. Interfacial conformation of hydrophilic polyphosphoesters affects blood protein adsorption[J]. ACS Appl Mater Interfaces, 2019, 11: 1624-1629. DOI:10.1021/acsami.8b17146 |
| [50] |
Patsula V, Horák D, Kuka J, et al. Synthesis and modification of uniform PEG-neridronate-modified magnetic nanoparticles determines prolonged blood circulation and biodistributionin a mouse preclinical model[J]. Sci Rep, 2019, 9: 10765. DOI:10.1038/s41598-019-47262-w |
| [51] |
Guo YF, Zhao S, Qiu HH, et al. Shape of nanoparticles as a design parameter to improve docetaxel antitumor efficacy[J]. Bioconjug Chem, 2018, 29: 1302-1311. DOI:10.1021/acs.bioconjchem.8b00059 |
| [52] |
Berrecoso G, Crecente-Campo J, Alonso MJ. Unveiling the pitfalls of the protein corona of polymeric drug nanocarriers[J]. Drug Deliv Transl Res, 2020, 10: 730-750. DOI:10.1007/s13346-020-00745-0 |
| [53] |
Gulati NM, Stewart PL, Steinmetz NF. Bioinspired shielding strategies for nanoparticledrug delivery applications[J]. Mol Pharm, 2018, 15: 2900-2909. DOI:10.1021/acs.molpharmaceut.8b00292 |
| [54] |
Pan Z, Fang D, Song N, et al. Surface distribution and biophysicochemical properties of polymeric micelles bearing geminicationic and hydrophilic groups[J]. ACS Appl Mater Interfaces, 2017, 9: 2138-2149. DOI:10.1021/acsami.6b14339 |
| [55] |
Li JQ, Qin L, Zheng HL, et al. PEGylated phospholipid-coatedpolylacticacid-glycolic acid microspheres to escape the phagocytosis of alveolar macrophages[J]. Acta Pharm Sin(药学学报), 2019, 54: 1303-1311. |
| [56] |
Penna M, Yarovsky I. Nanoscale in silico classification of ligand functionalised surfaces for protein adsorption resistance[J]. Nanoscale, 2020, 12: 7240-7255. DOI:10.1039/C9NR10009A |
| [57] |
Parveen S, Sahoo SK. Long circulating chitosan/PEG blendedPLGA nanoparticle for tumor drug delivery[J]. Eur J Pharmacol, 2011, 670: 372-383. DOI:10.1016/j.ejphar.2011.09.023 |
| [58] |
Abdollah MRA, Carter TJ, Jones C, et al. Fucoidan prolongs the circulation time of dextran-coated iron oxide nanoparticles[J]. ACS Nano, 2018, 12: 1156-1169. DOI:10.1021/acsnano.7b06734 |
| [59] |
Chen Y, Xu ZQ, Zhu DF, et al. Gold nanoparticles coated with polysarcosine brushes to enhance their colloidal stability and circulation time in vivo[J]. J Colloid Interf Sci, 2016, 483: 201-210. DOI:10.1016/j.jcis.2016.08.038 |
| [60] |
Hyun H, Park JY, Willis K, et al. Surface modification of polymer nanoparticles with native albumin for enhancing drug delivery to solid tumors[J]. Biomaterials, 2018, 180: 206-224. DOI:10.1016/j.biomaterials.2018.07.024 |
| [61] |
Qie YQ, Yuan HF, von Roemeling CA, et al. Surface modification of nanoparticles enables selective evasion of phagocytic clearance by distinct macrophage phenotypes[J]. Sci Rep, 2016, 6: 26269. DOI:10.1038/srep26269 |
| [62] |
Zhou H, Fan ZY, Li PY, et al. Dense and dynamic polyethylene glycol shells cloak nanoparticles from uptake by liver endothelial cells for long blood circulation[J]. ACS Nano, 2018, 12: 10130-10141. DOI:10.1021/acsnano.8b04947 |
| [63] |
Sakulkhu U, Mahmoudi M, Maurizi L, et al. Protein corona composition of superparamagnetic iron oxide nanoparticles with various physicochemical properties and coatings[J]. Sci Rep, 2014, 4: 5020. |
| [64] |
Li HC, Jin K, Luo M, et al. Size dependency of circulation and biodistribution of biomimetic nanoparticles: red blood cell membrane-coated nanoparticles[J]. Cells, 2019, 8: 881. DOI:10.3390/cells8080881 |
| [65] |
Hu CM, Fang RH, Wang KC, et al. Nanoparticle biointerfacing by platelet membrane cloaking[J]. Nature, 2015, 526: 118-121. DOI:10.1038/nature15373 |
| [66] |
Johanna S, Müller LK, Kokkinopoulou M, et al. Exploiting the biomolecular corona: pre-coating of nanoparticles enables controlled cellular interactions[J]. Nanoscale, 2018, 10: 10731-10739. DOI:10.1039/C8NR03331E |
| [67] |
Dal MR, Albertini B, Beretta S, et al. Artificial apolipoprotein corona enables nanoparticle brain targeting[J]. Nanomedicine, 2018, 14: 429-438. DOI:10.1016/j.nano.2017.11.008 |
| [68] |
Yuan SR, Qi XL, Qin C, et al. Research progress of ferritin nanocage for drug delivery systems[J]. Acta Pharm Sin(药学学报), 2019, 54: 1574-1581. |
 2021, Vol. 56
2021, Vol. 56


