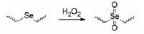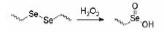癌症是人类目前最难攻克的疾病之一, 其传统治疗手段包括手术切除、化学疗法及放射治疗等。其中, 手术切除和放射治疗只能用于实体瘤, 临床中治疗范围有限; 而化学疗法是一种全身性的药物治疗手段, 不可避免地存在着严重的毒副作用。从肿瘤治疗的发展趋势看, 靶向给药为解决化疗药物的非选择性问题提供了巨大的空间, 也成为肿瘤治疗领域一个非常重要的发展方向[1]。纳米药物可以经血液循环进入毛细血管, 通过内皮细胞间隙进入病灶, 实现被动靶向; 此外, 纳米载体还可经靶向基团修饰后实现主动靶向。到目前为止, 美国食品药品监督管理局(FDA)已经批准多个纳米药物上市[2], 如蒽环类药物脂质体(Doxil)和紫杉醇白蛋白纳米粒(Abraxane)等。
近几年, 基于前药的纳米药物递送系统研究处于井喷式发展阶段, 主要包括聚合物前药纳米粒和小分子前药纳米粒。小分子前药具有分子质量小、载药量高、化学结构明确, 易于被监测体内代谢过程并进行安全性评价, 可自组装形成纳米粒, 得到了越来越多研究者青睐。与药物偶联分子的不同, 小分子前药纳米粒可实现药物靶向递送(多肽-药物偶联物)、共递送(药物-药物偶联物)和诊疗一体化(荧光探针-药物偶联物)等功能。
为了使小分子前药纳米粒发挥优异的功能, 在前药设计的过程中, 连接臂的选择是一个非常值得关注的问题, 它直接关系到药效的发挥。目前连接臂大多依据肿瘤组织及肿瘤细胞内的微环境来选择。肿瘤组织由于肿瘤细胞生长失控和基因表达异常等特点, 常表现出与正常组织显著不同的生理特征[3]: ①肿瘤内的氧化还原状态失衡, 具有更高浓度的活性氧(ROS)和更高水平的谷胱甘肽(GSH); ②肿瘤细胞外及肿瘤细胞内过度表达一些酶, 如基质金属蛋白酶、酯酶、α-淀粉酶和组织蛋白酶B等; ③肿瘤细胞外及肿瘤细胞内的溶酶体、内吞体呈弱酸性环境等。针对这些特殊的肿瘤组织和细胞微环境, 已经设计出许多微环境响应型药物递送系统(DDS)。
本文将基于肿瘤的氧化还原失衡的微环境, 综述肿瘤细胞各区室氧化还原状态、氧化还原响应型DDS的设计、不同连接臂偶联的小分子前药纳米粒的代谢特点及其与药效的关系, 为肿瘤氧化还原微环境响应型小分子前药DDS的设计和应用提供依据。
1 氧化还原响应型小分子前药纳米粒的设计 1.1 肿瘤细胞氧化还原微环境细胞的氧化还原微环境是指细胞氧化还原反应的平衡状态, 即电子传递的平衡态。当细胞受到环境影响或信号调控, 氧化活性物质或还原活性物质变化时, 细胞的氧化还原平衡状态发生改变。与正常组织和细胞相比, 肿瘤组织和细胞中氧化还原状态失衡。这可能与许多因素有关, 如线粒体功能障碍、致癌基因激活、异常的氧化代谢和缺氧/复氧循环。
细胞内的主要氧化活性物质是ROS, 常见的有羟自由基(·OH)、超氧阴离子(O2·-)、单线态氧(1O2)和过氧化氢(H2O2)等。ROS是机体氧化应激时产生的主要分子, 主要在线粒体呼吸链中产生, 在生理和病理过程中都起着重要的作用。正常生理条件下, 生物体内的ROS保持在较低的平衡水平, 维持着细胞正常的生长凋亡; 但在许多类型的癌症中, ROS相关敏感信号通路蛋白的表达持续升高, 出现肿瘤细胞的氧化应激状态。低水平的氧化应激可能对癌症进展有利, 因为ROS的存在会导致遗传突变率增加, 有助于癌细胞获得恶性表型[4], 而更高水平的ROS则可能损害生物大分子, 包括DNA、蛋白质和细胞膜成分, 并在癌症的发生与发展中起作用[5]。细胞内的主要还原活性物质包括各种酶及蛋白系统, 最常见的有谷胱甘肽(GSH)、过氧化氢酶(CAT)和硫氧还蛋白(Trx)等。GSH是主要的还原配体, 在肿瘤细胞质中最丰富(2~10 mmol·L-1), 远高于其细胞外浓度(2~20μmol·L-1), 且肿瘤组织GSH浓度比正常组织高至少4倍[6]。此外, 二价铁离子、半胱氨酸和溶酶体硫醇还原酶(GILT)等均具有还原性。
在真核细胞不同的亚细胞结构中, 氧化还原电位有所不同(图 1)。线粒体和过氧化物酶体是产生活性氧的主要结构, 但线粒体内的GSH/GSSG电位为-330 mV, 比胞质值要更小(-250 mV)[7]。线粒体中的GSH必须在细胞质中合成并随后转运到线粒体中, 因此, GSH转运是GSH/GSSG氧化还原状态的关键决定因素。内质网和溶酶体都为偏氧化的亚细胞区室, 内质网在不同的细胞类型中具有不同的氧化功能, 如在肝脏细胞中, 其功能是将O2活化用于类固醇合成; 此外, 内质网更普遍的功能是在蛋白质折叠中引入结构化二硫键。而溶酶体中的低pH值使得通常在中性环境中起作用的Trx或GSH氧化还原系统不能将溶酶体中的二硫化物还原, 因此溶酶体相对于其他亚细胞器而言处于氧化状态[8]。细胞核相对细胞质是偏还原的状态, 研究显示蛋白的S-谷胱甘肽化在细胞质和细胞核中独立进行, GSH/GSSG氧化还原电势在细胞核中可能比在细胞质中降低得更多[9]。
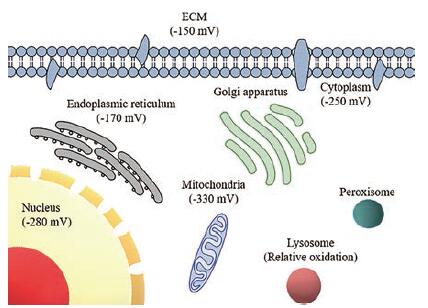
|
Figure 1 The oxidation-reduction potential of the subcellular compartments.ECM: Extracellular matrix |
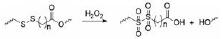
肿瘤特异性的氧化还原微环境中, 过量的GSH和ROS均可作为智能响应纳米药物载体的刺激因子, 利用其设计氧化还原敏感的小分子前药纳米粒。常见的氧化还原敏感连接臂包括二硫键、硫醚键、二硒键、硒醚键、硫缩酮键和琥珀酰亚胺-硫醚键等[10, 11]。
1.2.1 基于二硫键的小分子前药纳米粒二硫键是氧化还原响应策略最常用的化学键。通常认为, 二硫键偶联的小分子前药纳米粒在体循环中稳定, 进入肿瘤细胞质后在高浓度GSH条件下还原为巯基, 纳米载体结构改变, 释放出游离药。
Wang等[12]首先提出用二硫键偶联两个疏水性药物/分子, 通过独立于传统的两亲或离子相互作用的方式自组装形成纳米粒。该研究在紫杉醇(PTX)或多柔比星(DOX)和维生素E (VE)之间插入二硫键合成前药(PTX-SS-VE、DOX-SS-VE), 该前药在水性介质中自组装成稳定的二硫键诱导的纳米药物(DSINM)。分子水平上结构和动力学性质研究结果显示, 二硫键接近90°键角可以显著提高空间灵活性, 有利于小分子前药纳米粒的自组装和稳定。
其后也出现了多种基于二硫键的小分子前药纳米粒, 如喜树碱二聚体(CPT-SS-CPT)[13]、紫杉醇二聚体(PTX-SS-PTX)[14]、多柔比星二聚体(DOX-SS-DOX)[15]和卟啉与紫杉醇药物偶联物(Py-SS-PTX)[16]等, 均可组装形成纳米粒。
1.2.2 基于硫醚键的小分子前药纳米粒除了经典的二硫键, 还出现了一些其他肿瘤氧化还原微环境响应的前药纳米粒用于癌症治疗, 硫醚键即是其中的一种。Wang等[17]将羟基喜树碱(SN-38)通过硫醚键与乙二醇低聚体(OEG)偶联形成OEG-2S-SN-38, 并组装成粒径均一的纳米粒。研究者认为硫醚键具有双重敏感性, 即这些前药纳米粒对GSH和ROS均有响应, 导致其在肿瘤细胞中可以快速释放SN-38。
Cong等[18]也构建了一种PTX和光敏剂焦脱镁叶绿素a (PPa)的ROS响应二聚体, 通过单硫醚键相连。在激光照射下, 肿瘤细胞中过量产生的内源性ROS与PPa生成的ROS协同促进了纳米粒中单硫醚键连接臂的断裂。纳米粒的崩解也有效解决了由于PPa的聚集引起的淬灭(ACQ)效应的问题。体外和体内结果均表明, PTX的化疗作用与PPa介导的光动力疗法(PDT)结合表现出协同的抗肿瘤活性。
1.2.3 基于二硒键和硒醚键的小分子前药纳米粒除了二硫键和硫醚键, 硒作为硫的同族元素, 也具有一定的氧化还原反应性和抗肿瘤活性。硒是人类必需的微量元素, 也是几种重要酶(如谷胱甘肽过氧化物酶)的重要组成部分, 在保护细胞免受氧化损伤方面起着重要作用。与C-S (272 kJ·mol-1)和S-S (240 kJ·mol-1)相比, C-Se (244 kJ·mol-1)和Se-Se (172 kJ·mol-1)的键能更低, 这使含硒化物或二硒化物的前药在温和的刺激条件下比含硫的同类物更敏感。据报道, 几种含硒分子具有产生ROS并诱导肿瘤细胞凋亡的独特能力[19, 20], 这可能进一步影响前药自组装纳米粒的细胞毒性和抗肿瘤效率。
Sun等[21]提出硒键的独特性质可能会显著影响前药纳米粒性能, 包括自组装能力、氧化还原响应型药物释放和抗肿瘤效率。通过采用硫醚键、二硫键、硒醚键和二硒键作为连接键, 将PTX与香茅醇(CIT)偶联来合成4种氧化还原响应型前药, 并将其组装成纳米粒。该研究系统地比较了硫/硒/碳键之间的二面角、氧化还原响应性和抗肿瘤活性的差异。在H2O2存在下, 硒键可被氧化, 形成亲水性亚硒砜或硒砜基团, 促进相邻酯键的水解和PTX的释放[22, 23]。氧化反应性遵循硒醚键 > 硫醚键 > 二硒键 > 二硫键的顺序, 其原因是与S相比, Se具有更大的原子半径和较弱的电负性, 从而导致键能降低。因此, 硒键对H2O2更加敏感。此外, 由于较低的电负性, -Se-和-S-的氧化敏感性远远高于-Se Se-和-SS-。还原敏感性上, S比Se更容易被还原, 遵循二硫键 > 二硒键 > 硫醚键 > 硒醚键的顺序。
1.2.4 基于硫缩酮键的小分子前药纳米粒ROS敏感的硫缩酮(TK)键也常用于前药纳米粒的设计。Liu等[24]将吉西他滨(GEM)通过TK键与光敏剂四苯基卟啉(TPP)偶联开发了一种具有光敏性的前药TPP-L-GEM, 以实现图像引导的原位肿瘤PDT和可光照激活的化学疗法的联合作用。在红光的照射下, TPP可以通过PDT产生单线态氧并破坏肿瘤细胞。同时, 硫缩酮键可被单线态氧诱导裂解并导致GEM级联释放, 通过化学疗法引起持续的细胞损伤, 在体内外均显示出显著的肿瘤治疗效果。此外, TPP固有的荧光特性使TPP-L-GEM前药具有无创药物追踪能力, 有利于图像引导的原位肿瘤治疗。
在氧化还原响应型DDS设计中, 除了上述二硫键、硫醚键、硒键和硫缩酮键外, 还有很多其他种类的氧化还原敏感的化学连接臂, 如芳基硼酸酯、氨基丙烯酸酯、低聚脯氨酸和过草酸酯等结构[25, 26]。但在小分子前药纳米粒的应用中, 考虑到疏水性药物偶联物的特性, 通常要求连接臂为具有一定长度的柔性碳链结构, 这有助于小分子药物形成空间灵活的π-π堆叠, 进而自组装形成纳米粒。因此, 最常使用的连接臂为二硫键和硫醚键, 并常以碳碳键作为对照进行研究。
2 氧化还原响应型连接臂的细胞内代谢氧化还原响应型连接臂的化学结构及代谢方式如表 1所示。二硫键和硫醚键均有氧化还原双响应的代谢途径[13, 23-25]: GSH存在的还原条件下, 二硫键首先断裂成巯基, 之后发生分子内环化, 形成含硫的环状物从酯键上脱落, 释放出游离的活性基团; 硫醚键则与GSH形成硫酯键。H2O2模拟的氧化条件下, 二硫键和硫醚键均形成硫砜, 增强连接臂的亲水性, 导致酯键等活性基团水解。含硒的化合物以氧化为主, 单硒键形成硒砜, 二硒键则转化为硒酸, 均可增加连接臂的亲水性。硫缩酮是典型的氧化型连接臂, 当受到氧化条件刺激时, 易断裂形成巯基和丙酮。
| 表 1 Representative redox‐responsive linkers and their possible metabolites |
迄今为止, 二硫键是应用最为广泛的氧化还原响应型连接臂之一[27-29]。通常认为二硫键易被肿瘤组织中高浓度的GSH还原成巯基, 进而增加药物体系的亲水性, 促进相邻化学键(酯键等)的水解和游离药的释放。二硫键的代谢方式可分为两类: 醌甲基化物级联反应(TQM)和分子内环化级联反应(图 2a)。在这两种代谢途径中, 二硫键断裂后首先变成巯基, 然后自发启动重排过程, 释放出所需的化合物。前一种代谢途径的原理为电子级联反应, 可产生醌类中间体; 后一种代谢途径的原理是在分子内环化的过程中形成热力学稳定的片段(如五~七元环), 可产生硫代内酯或环状硫代碳酸酯等中间体[30]。通常能自组装成纳米粒的小分子前药的连接臂为具有一定长度的柔性链[21], 因此二硫键可以通过分子内环化级联机制进行代谢。
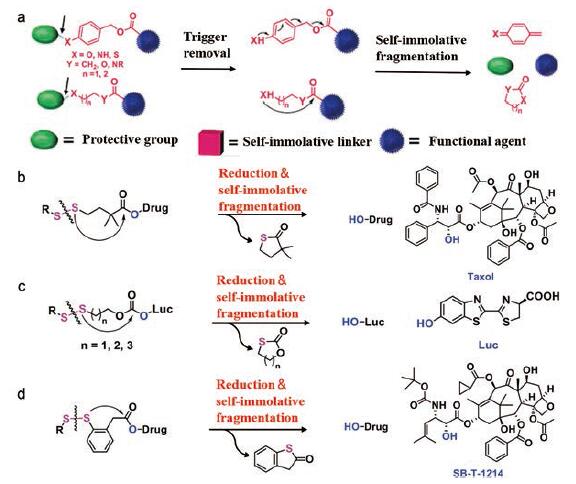
|
Figure 2 Several metabolic mechanisms in response to disulfide bonds reduction.a: General self-immolative cleavage mechanisms via quinone methide cascade rearrangement (upper) and intramolecular cyclization reaction (lower); b: Prodrug of paclitaxel using disulfide.Geminal dimethyl group in the spacer is designed to enhance structural stability toward serum esterase and promote triggered cyclization reaction; c: Disulfide-carbonate-based traceless linkers with varying spacer lengths were used to tune hydrolytic stability; d: Prodrug of taxoid is activated inside tumor cells by endogenous thiols to achieve native drug release.(Adapted from Ref.30 with permission.Copyright © 2019 John Wiley and Sons) |
Vrudhula等[31]设计了一种PTX的自裂解前药, 由于Thorpe-Ingold效应, 连接臂中羰基α碳的双甲基化可以增强其对血清酯酶的稳定性, 并且能促进巯基中间体的环化(图 2b)。在另一项研究中, Jones等[32]设计了一系列前药系统, 该系统在羰基和近端硫原子之间具有不同间隔的长度, 可用于构建各种转运蛋白-药物/探针结合物, 并能在细胞摄取后释放出游离化合物(图 2c)。Chen等[33]开发了基于多价单壁碳纳米管(SWNT)的肿瘤靶向药物递送系统, 将一种PTX的前药(SB-T-1214)通过二硫键偶联到SWNT的表面上, 肿瘤细胞内源性硫醇触发PTX游离药物的释放, 同时形成副产物五元环状苯并噻吩(图 2d)。
Cheetham等[34]报道二硫键连接的可自组装成纳米结构的肽-药物偶联物(CPT-bu SS-Tau), 通过不同浓度的GSH模拟肿瘤细胞内的还原环境, 使用高效液相色谱(HPLC)和液质联用(LC-MS)的方法来研究二硫键的降解机制。如图 3所示, 在还原环境中, 形成的两个中间产物分别是含巯基的CPT (3)和对称的CPT-二硫化物二聚体(4)。24 h释放曲线表明, GSH浓度对释放的CPT量有显着影响。在低浓度下释放出约49%的游离CPT; 而在高浓度下, 24 h后仅释放了26%的游离CPT。此外, 高浓度下的中间产物4几乎没有进一步水解, 但两种浓度下的产物3都会耗尽。这表明GSH浓度对二硫化物二聚体的稳定性有影响, 高浓度的GSH阻止了二硫化物二聚体的进一步降解。但该研究未表明产物3的降解是否由于分子内环化作用而加速释放, 只观察到简单的水解过程。
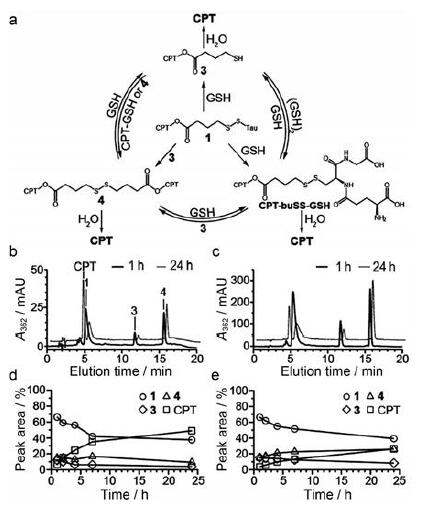
|
Figure 3 Glutathione (GSH)-induced release of camptothecin(CPT) from product 1.CPT-containing reaction products formed and the exchange reactions that can occur during the GSH-induced reduction of 1 (a).High performance liquid chromatography(HPLC) analysis of GSH-induced release of CPT from product 1 at 5 (b) and 50μmol·L-1(c) in 10 mmol·L-1 sodium phosphate containing 10 mmol·L-1 GSH at 37℃ after 1 and 24 h.Peak areas of the 4 main species showing the evolution over time for the 5 (d)and 50 μmol·L-1(e) solutions of 1.(Adapted from Ref.34 with permission.Copyright © 2014 Royal Society of Chemistry) |
Wang等[27]系统比较了二硫键和硫醚键偶联的DOX纳米粒的细胞转运和代谢。该研究合成了3类DOX二聚体的药物偶联物: ①连接臂类型的改变。将具有还原敏感的二硫键换为非还原敏感的碳碳键(-CC-), 与DOX的氨基相连, 形成DOX-CC-DOX (DCCD-3)偶联物; ②连接臂长短的改变。将二硫键与DOX氨基之间的距离从3个碳原子调整为2个碳原子或4个碳原子, 从而缩短和增长连接臂形成DOX-SS-DOX ②(DSSD-2)和DOX-SS-DOX (4)(DSSD-4)偶联物; ③连接位点的改变。将二硫键或硫醚键与DOX的羟基相连, 从而由酰胺键变为酯键, 形成DOX-SS-DOX (OH)(DSSD-OH)和DOX-S-DOX (OH)(DSD-OH)偶联物。
在二硫键(DSSD-4, DSSD-OH)和硫醚键(DSD-OH)前药纳米粒的对比研究中, 发现二硫键前药纳米粒的摄取显著高于硫醚键前药, 细胞毒也强于硫醚键前药, 但是动物体内药效比较并没有那么显著的差异。研究认为这是由于两类前药向游离DOX的转化效率不同造成的。为了进一步解释这种现象, 研究者用UPLC-MS/MS进行了细胞水平的代谢研究, 但在二硫键偶联的纳米粒并没有监测到巯基DOX (DOX-SH)的生成。此外, 根据常规认知中二硫键断裂后发生分子内环化的特点[26], 进一步检测未见γ-硫代丁内酯生成。因此, 研究者推测: DSSD-4有可能并不是通过还原环境中二硫键断裂产生巯基, 进而释放出游离药物。肿瘤细胞中虽然存在使DSSD-4还原为DOX-SH的还原性环境, 但还原性环境主要存在于细胞质中。由于DSSD-4纳米粒主要以囊泡的形式入胞, 并通过膜-膜融合进入溶酶体中, 进入细胞质较少, 所以DSSD-4纳米粒主要通过溶酶体内各种相关酶, 如酰胺酶的作用, 导致酰胺键断裂, 从而释放出游离DOX, 而非通过细胞质还原性环境生成DOX (图 4)。
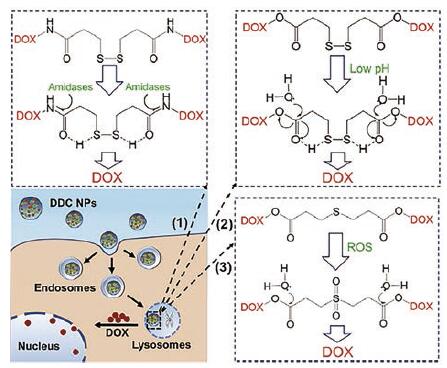
|
Figure 4 Schematic illustrations of cellular pathways of DSSD-3[DOX-SS-DOX ③], doxorubicin (DOX) NPs and hypothetical release mechanism of DOX.(Adapted from Ref.27 with permis‐sion.Copyright © 2018 Elsevier) |
在一项基于二硫键的抗体-药物偶联物(ADC)的研究中[35], 内吞体和溶酶体更倾向于氧化环境, 而不是还原环境[8]。同时研究者认为, 在这些内吞隔室中, 二硫键的还原裂解是很不充分的, 其速率甚至远远慢于抗体本身的降解。
此外, Sun等[28]也证明二硫键确实可以被氧化成硫砜, 增加连接臂的亲水性, 从而促进前药的水解(图 5)。作者构建了用二硫键连接的紫杉醇-香茅醇二聚物(PTX-SS-CIT), 并自组装成纳米粒, 采用高分辨质谱研究了前药纳米粒与H2O2孵育后的分子量变化。结果显示, 孵育后PTX-SS-CIT的相对分子质量由1 206.5 (M+Na+)变为1 222.5 (M一氧化物+Na+)、1 238.5(M二氧化物+Na+)和1 254.5 (M三氧化物+Na+), 证明二硫键上的硫原子被氧化为硫砜。此外, 该研究还证明了连接臂的长短和游离药的释放速度有关: 二硫键被氧化后, 酯键离亲水性强的硫砜越近则越容易水解, 即碳链越短, 药物的释放速度越快。
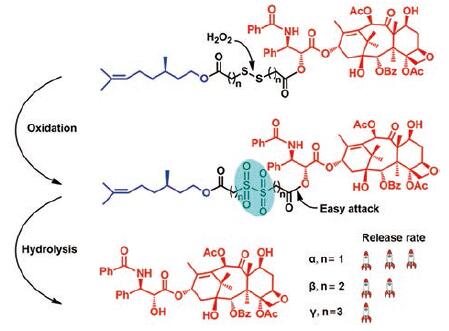
|
Figure 5 Redox-sensitive drug release mechanism of PTX-SS-CIT triggered by reactive oxygen species (ROS).PTX: Paclitaxel; CIT: Citronello.(Adapted from Ref.28 with permission.Copyright©2018 American Chemical Society) |
Wang等[17]首次提出硫醚键具有氧化还原双响应性。该研究通过硫醚键将SN38和短链OEG相连, 成功获得具有GSH/ROS双响应性的纳米输送体系OEG-2S-SN38。研究者通过检测硫醚键的代谢产物, 提出硫醚键具有ROS和GSH双重响应的作用机制。向OEG-2S-SN38纳米粒的水溶液中加入H2O2, 模拟氧化环境, 采用HPLC和1H NMR等方法分析出硫醚可以被氧化成亲水的亚砜或砜(-SOx-), 导致酚酯快速水解和SN38快速释放。同样的, 向纳米粒溶液中加入GSH, 模拟还原环境, 研究硫醚键的代谢方式。GSH含有1个胺基和1个硫醇基, 因此SN38的释放可以通过酯的氨解或硫解来实现。在OEG-2S-SN38溶液中添加乙二胺(EDA)不会改变SN38的释放曲线, 但添加了类似GSH的二硫苏糖醇(DTT)大大促进了SN38的释放, 此结果表明GSH上的巯基使SN38的酯键硫解, 进而促进游离药的释放。
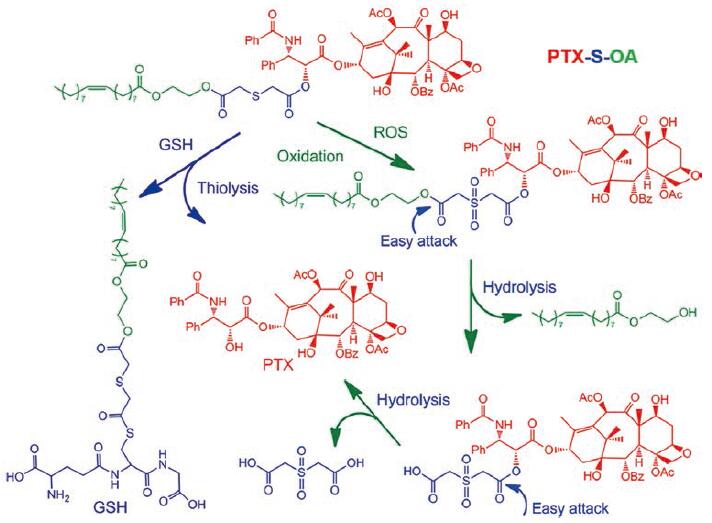
Luo等[29]设计了两种硫醚键(-2S-和-S-)连接的油酸(OA)与PTX的前药, 并在体外证明真正起氧化还原双响应作用的化学键为靠近PTX的硫醚键, 以此提出了药物在氧化和还原环境下的释放途径。PTX-S-OA的氧化还原双重应答代谢机制如图 6所示: 在还原环境下, 由GSH的硫醇基团引发的硫解过程促进了药物从前药的释放; 在氧化环境下药物释放分为3个步骤: ①硫醚氧化为亲水砜; ②油酸2-羟乙基酯的水解; ③释放活性PTX分子。在硫醚被氧化成亲水性的砜之后, 近端的酯键将更容易被水解。油酸2-羟乙基酯由于其位阻较低而首先受到攻击。一旦去除了长的亲脂性OA链, 与PTX共轭的另一个酯键就更易水解, 并且释放出游离的PTX分子。
|
Figure 6 Redox-sensitive drug release mechanism of PTX-S-OA triggered by GSH/ROS.OA: Oleic acid.(Adapted from Ref.29 with permission.Copyright © 2016 American Chemical Society) |
在氧化条件下, 硒醚键同硫醚键一样可以形成硒砜, 增强连接臂的亲水性进而释放出游离药。此外, 由于硒的电负性较低, 更易失电子, 其氧化敏感性更强[21]。Liu等[36]开发了基于两亲性超支化聚合物的H2O2响应纳米载体, 该聚合物的树枝状骨架中具有交替的疏水硒基和亲水性磷酸酯链段。在癌细胞特异的氧化微环境下, 疏水性硒键转变为亲水性硒氧化物或硒酮基团, 两亲性物质变为亲水性物质, 导致胶束分解。此外, 含硒的纳米载体具有优异的抗癌作用, 因为硒化合物可以增强免疫反应并产生抗癌代谢产物, 从而有效地干扰癌细胞的代谢, 抑制血管生成并诱导癌细胞的凋亡。
2.3 其他连接臂的代谢特点如同二硫键一样, 二硒键也可以具有氧化还原双重响应。通常, 二硒化物可以在氧化剂的作用下被氧化裂解成硒酸, 在还原剂的存在下还原成硒醇[34]。利用这一特点, Deepagan等[37]开发了原位二硒化物交联的胶束(DCM)作为一种新型抗癌药物载体, 可以响应肿瘤细胞内高浓度ROS。含硒醇的三嵌段共聚物DCM由聚乙二醇(PEG)和多肽衍生物组成, 疏水核被用于封装化疗药物DOX, 二硒化物交联形成了壳。DCM能够在正常生理状态下保持结构完整性, 而富含ROS的环境可以使疏水性二硒化物转化为亲水性硒酸, 从而导致DOX从DCM中的快速释放。
针对硫缩酮连接臂, Pei等[38]设计了一种PTX二聚物, 通过TK键连接并自组装形成纳米粒(PTX2-TK), 包载卟啉后起到化疗-光动力协同治疗的效果。作者通过HPLC实时监测10 mmol·L-1 H2O2处理条件下, 硫缩酮键的断裂机制及进一步触发PTX原药释放的情况, 结果显示, 不同时间点的HPLC峰位置和数量具有显著区别。基于LTQ-MS鉴定的降解产物化学结构的结果, 作者认为H2O2触发TK键降解的机制为: ①硫缩酮键被断裂成两个巯基; ②巯基被H2O2氧化成亲水的磺酸; ③释放活性分子PTX。
3 不同连接臂偶联的小分子前药纳米粒药效对比不同氧化还原响应的连接臂有不同的代谢途径, 相同体系中不同连接臂的药效也有所差别。
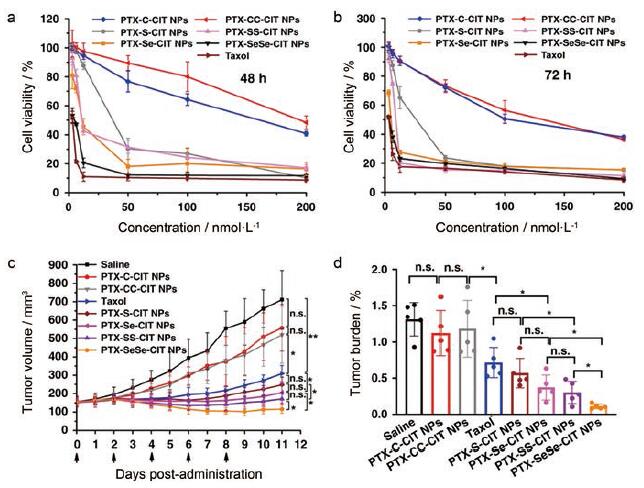
Sun等[21]进行了前药纳米粒的体内和体外药效学研究(图 7)。在体外细胞毒性的评价中, 各纳米粒的细胞毒性顺序为PTX-Se Se-CIT NPs > PTX-Se-CIT NPs > PTX-SS-CIT NPs > PTX-S-CIT NPs > > PTX-CC-CIT NPs/PTX-C-CIT NPs, 并发现细胞毒性与前体药物纳米粒中PTX的释放速率密切相关: 药物释放越快, 细胞毒性就越高。在接种了KB细胞的裸鼠上评估了不同连接臂偶联的前药纳米粒的抗肿瘤效率, 与PTX相比, 硫/硒键桥接的前药纳米粒具有更强的抗肿瘤药效。用非氧化还原敏感PTX-CC-CIT NPs/PTX-C-CIT NPs治疗的小鼠肿瘤体积迅速增加; PTX-Se Se-CIT NPs/PTX-SS-CIT NPs比PTX-S-CIT NPs/PTX-Se-CIT NPs具有更好的抑瘤活性, 研究者认为这是因为-SS-和-Se Se-具有更好的胶体稳定性、更长的循环时间和更高的生物利用度。其中, PTX-Se Se-CIT NPs具有多种治疗优势, 表现出最有效的肿瘤抑制活性。
|
Figure 7 In vitro and in vivo antitumor efficacy of prodrug nanoassemblies.Viability of KB cells (human oral epidermoid carcinoma cells)after treated with various concentrations of Taxol and prodrug nanoassemblies for 48 h (a) and 72 h (b).c: Tumor volume; d: Tumor burden.n=6.*P < 0.05, **P < 0.01.(Adapted from Ref.21 with permission.Copyright © 2019 Springer Nature) |
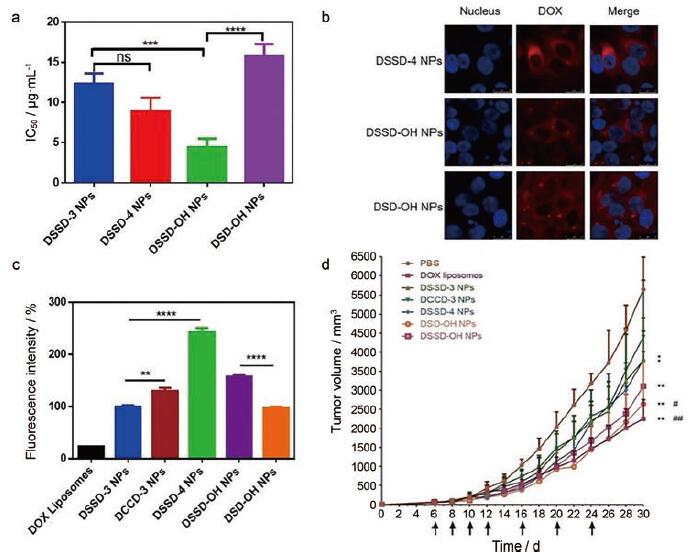
Wang等[27]在DOX二聚物前药纳米粒的研究中, 以MCF-7细胞为模型考察纳米粒的体外药效。不同纳米粒的半抑制浓度(IC50)由大到小的顺序为: DCCD-3 > DSD-OH > DSSD-3≈DSSD-4 > DSSD-OH。在二硫键(DSSD-4、DSSD-OH)和硫醚键(DSD-OH)前药纳米粒的对比中, 研究者发现二硫键前药纳米粒的摄取显著高于硫醚键前药, 推测二硫键前药更强的细胞毒性与能高水平的摄取有关(图 8)。但不同纳米粒的体内药效并没有显著的差异, 研究者认为这与两类前药向游离DOX的转化效率不同有关。
|
Figure 8 In vitro and in vivo antitumor efficacy of a series of doxorubicin drug conjugate nanoparticles (pictures obtained after subsequent integration).a: Cytotoxicity (n=5).***P < 0.001, ****P < 0.000 1;b: Uptake (confocal observation results); c: Uptake (flow cytometry results, n=3).**P < 0.01, ****P < 0.000 1;d: Tumor volume (n=6).*P < 0.05, **P < 0.01 vs phosphate buffer saline (PBS); #P < 0.05, ##P < 0.01 vs DCCD-3 NPs.(Adapted from Ref.27 with permission.Copyright © 2018 Elsevier) |
Liang等[39]进行了二硫键、硫醚键和组织蛋白酶B可切割的缬氨酸-瓜氨酸二肽(VC)分别作为多肽药物偶联物的连接臂对抗肿瘤药效影响的对比研究。研究者使用DOX作为模型药物, 合成了3种两亲性多肽药物偶联物(APDC), 即c RGD-SS-DOX (RSSDOX)、c RGD-S-DOX (RSDOX)和c RGD-VC-DOX (RVCDOX)。结果表明, RSDOX和RVCDOX的体内效力分别是游离DOX的1.4~1.7倍, 是RSSDOX的1.7~2.0倍。RSDOX和RVCDOX具有更强的抗肿瘤作用, 研究者认为这与它们的细胞摄取水平、胞内转运、与溶酶体的共定位情况有关。
综合上述研究, 不同连接臂对应前药纳米粒的药效水平尚无定论。Sun等[21]和Wang等[27]的研究结果说明-SS-的体外药效比-S-更胜一筹; 但就体内药效而言, 两个研究的结果并不一致, Sun等[21]认为-SS-体内药效更强, 而Wang等[27]认为-SS-和-S-的药效结果并没有显著差异。此外, Liang等[39]的研究结果表明, -S-相比-SS-具有更强的抗肿瘤作用。体外药效可能与不同种类纳米粒的摄取水平、胞内转运情况和游离药释放水平有关, 体内药效可能与纳米粒的稳定性与体内长循环时间有关。不同代谢途径的连接臂对氧化还原的响应敏感性不同, 造成游离药的释放速度不同, 这可能会对药效造成重要影响。
4 对肿瘤氧化还原响应型小分子前药纳米粒设计的思考针对肿瘤特异的氧化还原微环境有许多响应型连接臂, 常见的有二硫键、硫醚键、硒醚键、二硒键和硫缩酮键等, 这些连接臂也常常应用在新型小分子前药纳米粒的构建中[40]。然而, 随着研究的不断拓展, 一些经典连接臂的代谢途径出现了新的认知, 如二硫键既可以被GSH还原成巯基然后发生分子内环化断裂, 也可以被ROS氧化成硫砜, 通过增强连接臂的亲水性发生水解断裂。硫醚键也有两种代谢途径: 由GSH的硫醇基团引发的硫解过程促进了药物从前药的释放, 以及ROS将硫醚氧化为亲水砜, 进而促进了药物的释放。那么在肿瘤细胞内, 这些氧化还原双敏感的连接臂, 究竟是哪一种代谢途径占主导地位呢?
传统观点认为, 二硫键是纳米粒在肿瘤还原微环境下响应的连接臂, 但越来越多的研究显示, 它有可能更倾向于对氧化环境做出响应。分析其可能的原因是: 纳米粒的入胞和胞内转运一般有其特定的路线, 即纳米粒与细胞膜相互作用后形成内吞囊泡, 经过早期内吞体→晚期内吞体→溶酶体的降解途径在胞内运输。在这个路线中并没有充分的还原环境打开二硫键, 使前药分子发生降解。而只有在前药分子释放到胞浆后, 胞浆中的高浓度的GSH才能使二硫键打开。然而, 纳米粒从囊泡运输到释放到胞浆涉及到内吞体和溶酶体的逃逸, 可能并不是一个容易的过程, 需要较长的时间, 在囊泡运输的过程中可能已经发生了结构变化[41]。
由于内吞体和溶酶体更倾向于氧化的环境, 而不是还原环境[8], 氧化环境可能将二硫键上的硫原子氧化成硫砜或磺酸基, 使前药分子亲水性增强, 容易受到酶的攻击。同时, 早期内吞体→晚期内吞体→溶酶体是一系列酸性逐步增强的细胞器, 逐渐降低的pH值为水解酶提供所需的酸性环境, 使各种酶解反应更容易发生, 包括释放原型药物所需的酰胺酶和酯酶等。所以推测在纳米粒胞内囊泡运输的过程中, 硫原子本身的氧化性所带来的前药分子亲疏水性的变化可能是前药发挥作用的关键。
总之, 肿瘤氧化还原微环境响应型前药纳米粒的代谢机制及其与药效的关系还需要进一步探索, 这些结果将为该类前药纳米粒的设计和应用提供依据。
作者贡献: 赵耀撰写完成综述主要内容; 杨璨羽给出修改建议; 王学清和张强全程指导。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Rajendran L, Knolker HJ, Simons K. Subcellular targeting strategies for drug design and delivery[J]. Nat Rev Drug Discov, 2010, 9: 29-42. DOI:10.1038/nrd2897 |
| [2] |
Svenson S. Clinical translation of nanomedicines[J]. Curr Opin Solid State Mater Sci, 2012, 16: 287-294. DOI:10.1016/j.cossms.2012.10.001 |
| [3] |
Chuan HU, Gao HL. Advances in tumor microenvironment responsive and regulatory drug delivery system[J]. Acta Pharm Sin(药学学报), 2020, 55: 1520-1527. |
| [4] |
Jackson AL, Loeb LA. The contribution of endogenous sources of DNA damage to the multiple mutations in cancer[J]. Mutat Res, 2001, 477: 7-21. DOI:10.1016/S0027-5107(01)00091-4 |
| [5] |
Karihtala P, Soini Y. Reactive oxygen species and antioxidant mechanisms in human tissues and their relation to malignancies[J]. APMIS, 2007, 115: 81-103. DOI:10.1111/j.1600-0463.2007.apm_514.x |
| [6] |
Thambi T, ParkJH, Lee DS. Stimuli-responsive polymersomes for cancer therapy[J]. Biomater Sci, 2016, 4: 55-69. DOI:10.1039/C5BM00268K |
| [7] |
Chu HL, Yan QY, Yi J, et al. Redox regulation of subcellular compartments and impacts on cells[J]. Chin J Cell Biol(中国细胞生物学学报), 2015, 37: 895-905. |
| [8] |
Go YM, Jones DP. Redox compartmentalization in eukaryotic cells[J]. Biochim Biophys Acta, 2008, 1780: 1273-1290. DOI:10.1016/j.bbagen.2008.01.011 |
| [9] |
Watson WH, Pohl J, Montfort WR, et al. Redox potential of human thioredoxin 1 and identification of a second dithiol/disulfide motif[J]. J Biol Chem, 2003, 278: 33408-33415. DOI:10.1074/jbc.M211107200 |
| [10] |
Lan SY, Zhang D, Li XL, et al. Tumor-microenvironment activable smart nanocarrier system for photodynamic therapy of cancers[J]. Chin J Lasers(中国激光), 2018, 45: 113-123. |
| [11] |
Zhou ZX, Ma XP, Jin E, et al. Linear-dendritic drug conjugates forming long-circulating nanorods for cancer-drug delivery[J]. Biomaterials, 2013, 34: 5722-5735. DOI:10.1016/j.biomaterials.2013.04.012 |
| [12] |
Wang Y, Liu D, Zheng Q, et al. Disulfide bond bridge insertion turns hydrophobic anticancer prodrugs into self-assembled nanomedicines[J]. Nano Lett, 2014, 14: 5577-5583. DOI:10.1021/nl502044x |
| [13] |
Pei Q, Hu X, Li Z, et al. Small molecular nanomedicines made from a camptothecin dimer containing a disulfide bond[J]. RSC Adv, 2015, 5: 81499-81501. DOI:10.1039/C5RA18586F |
| [14] |
Han XF, Chen JL, Jiang MJ, et al. Paclitaxel-paclitaxel prodrug nano-assembly as a versatile nanoplatform for combinational cancer therapy[J]. ACS Appl Mater Interfaces, 2016, 8: 33506-33513. DOI:10.1021/acsami.6b13057 |
| [15] |
Song Q, Wang X, Wang YQ, et al. Reduction responsive selfassembled nanoparticles based on disulfide-linked drug-drug conjugate with high drug loading and antitumor efficacy[J]. Mol Pharm, 2015, 13: 190-201. |
| [16] |
Zheng XH, Li ZS, Chen L, et al. Self-assembly of porphyrinpaclitaxel conjugates into nanomedicines: enhanced cytotoxicity due to endosomal escape[J]. Chem Asian J, 2016, 11: 1780-1784. DOI:10.1002/asia.201600423 |
| [17] |
Wang J, Sun X, Mao W, et al. Tumor redox heterogeneity-responsive prodrug nanocapsules for cancer chemotherapy[J]. Adv Mater, 2013, 25: 3670-3676. DOI:10.1002/adma.201300929 |
| [18] |
Cong L, Sun BJ, Wang C, et al. Self-facilitated ROS-responsive nanoassembly of heterotypic dimer for synergistic chemo-photodynamic therapy[J]. J Control Release, 2019, 302: 79-89. DOI:10.1016/j.jconrel.2019.04.001 |
| [19] |
Sun CX, Ji SB, Li F, et al. Diselenide-containing hyperbranched polymer with light-induced cytotoxicity[J]. ACS Appl Mater Interfaces, 2017, 9: 12924-12929. DOI:10.1021/acsami.7b02367 |
| [20] |
Zhang W, Lin WH, Pei Q, et al. Redox-hypersensitive organic nanoparticles for selective treatment of cancer cells[J]. Chem Mater, 2016, 28: 4440-4446. DOI:10.1021/acs.chemmater.6b01641 |
| [21] |
Sun BJ, Luo C, Zhang XB, et al. Probing the impact of sulfur/selenium/carbon linkages on prodrug nanoassemblies for cancer therapy[J]. Nat Commun, 2019, 10: 3211. DOI:10.1038/s41467-019-11193-x |
| [22] |
Shim MS, Xia Y. A reactive oxygen species(ROS)-responsive polymer for safe, efficient, and targeted gene delivery in cancer cells[J]. Angew Chem Int Ed, 2013, 52: 6926-6929. DOI:10.1002/anie.201209633 |
| [23] |
Dan S, Li MQ, Zheng W, et al. Bioinspired diselenide-bridged mesoporous silica nanoparticles for dual-responsive protein delivery[J]. Adv Mater, 2018, 30: e1801198. DOI:10.1002/adma.201801198 |
| [24] |
Liu LH, Qiu WX, Li B, et al. A red light activatable multifunctional prodrug for image-guided photodynamic therapy and cascaded chemotherapy[J]. Adv Funct Mater, 2016, 26: 6257-6269. DOI:10.1002/adfm.201602541 |
| [25] |
Lallana E, Tirelli N. Oxidation-responsive polymers: which groups to use, how to make them, what to expect from them(biomedical applications)[J]. Macromol Chem Phys, 2013, 214: 145-158. |
| [26] |
Song CC, Du FS, Li ZC, et al. Oxidation-responsive polymers for biomedical applications[J]. J Mater Chem B, 2014, 2: 3413-3426. DOI:10.1039/C3TB21725F |
| [27] |
Wang YQ, Wang X, Deng FY, et al. The effect of linkers on the self-assembling and anti-tumor efficacy of disulfide-linked doxorubicin drug-drug conjugate nanoparticles[J]. J Control Release, 2018, 279: 136-146. DOI:10.1016/j.jconrel.2018.04.019 |
| [28] |
Sun BJ, Luo C, Han Y, et al. Disulfide bond-driven oxidationand reduction-responsive prodrug nanoassemblies for cancer therapy[J]. Nano Lett, 2018, 18: 3643-3650. DOI:10.1021/acs.nanolett.8b00737 |
| [29] |
Luo C, Sun J, Liu D, et al. Self-assembled redox dual-responsive prodrug-nanosystem formed by single thioether-bridged paclitaxel-fatty acid conjugate for cancer chemotherapy[J]. Nano Lett, 2016, 16: 5401-5408. DOI:10.1021/acs.nanolett.6b01632 |
| [30] |
Deng ZY, Hu JM, Liu SY. Disulfide-based self-immolative linkers and functional bioconjugates for biological applications[J]. Macromol Rapid Commun, 2020, 41: e1900531. DOI:10.1002/marc.201900531 |
| [31] |
Vrudhula VM, Macmaster JF, Li Z, et al. Reductively activated disulfide prodrugs of paclitaxel[J]. Bioorg Med Chem Lett, 2003, 12: 3591-3594. |
| [32] |
Jones LR, Goun EA, Shinde R, et al. Releasable luciferin-transporter conjugates: tools for the real-time analysis of cellular uptake and release[J]. J Am Chem Soc, 2006, 128: 6526-6527. DOI:10.1021/ja0586283 |
| [33] |
Chen JY, Chen SY, Zhao XR, et al. Functionalized single-walled carbon nanotubes as rationally designed vehicles for tumortargeted drug delivery[J]. J Am Chem Soc, 2008, 130: 16778-16785. DOI:10.1021/ja805570f |
| [34] |
Cheetham AG, Ou YC, Zhang P, et al. Linker-determined drug release mechanism of free camptothecin from self-assembling drug amphiphiles[J]. Chem Commun, 2014, 50: 6039-6042. DOI:10.1039/C3CC49453E |
| [35] |
Austin CD, Wen X, Gazzard L, et al. Oxidizing potential of endosomes and lysosomes limits intracellular cleavage of disulfide-based antibody-drug conjugates[J]. Proc Natl Acad Sci U S A, 2006, 102: 17987-17992. |
| [36] |
Liu JY, Pang Y, Zhu ZY, et al. Therapeutic nanocarriers with hydrogen peroxide-triggered drug release for cancer treatment[J]. Biomacromolecules, 2013, 14: 1627-1636. DOI:10.1021/bm4002574 |
| [37] |
Deepagan VG, Kwon S, You DG, et al. In situ diselenide-crosslinked polymeric micelles for ROS-mediated anticancer drug delivery[J]. Biomaterials, 2016, 103: 56-66. DOI:10.1016/j.biomaterials.2016.06.044 |
| [38] |
Pei Q, Hu XL, Zheng XH, et al. Light-activatable red blood cell membrane-camouflaged dimeric prodrug nanoparticles for synergistic photodynamic/chemotherapy[J]. ACS Nano, 2018, 12: 1630-1641. DOI:10.1021/acsnano.7b08219 |
| [39] |
Liang YQ, Li SX, Wang XL, et al. A comparative study of the antitumor efficacy of peptide-doxorubicin conjugates with different linkers[J]. J Control Release, 2018, 275: 129-141. DOI:10.1016/j.jconrel.2018.01.033 |
| [40] |
Saravanakumar G, Kim J, Kim WJ. Reactive-oxygen-speciesresponsive drug delivery systems: promises and challenges[J]. Adv Sci, 2016, 4: 1600124. |
| [41] |
Hillaireau H, Couvreur P. Nanocarriers' entry into the cell: relevance to drug delivery[J]. Cell Mol Life Sci, 2009, 66: 2873-2896. DOI:10.1007/s00018-009-0053-z |
 2021, Vol. 56
2021, Vol. 56