蛋白激酶与肿瘤、炎症、自身免疫病、神经性疾病等众多疾病的发病机制密切相关, 近30多年来, 激酶作为一个非常有潜力的药物靶点受到了广泛的研究。全世界高达20%~33%的药物发现都和蛋白激酶超家族相关[1]。本文通过对已上市的以及正处在Ⅲ期和Ⅱ期临床试验的激酶小分子抑制剂进行统计分析。针对已上市的抑制剂的靶点和适应证进行统计。针对Ⅱ期和Ⅲ期在研的激酶小分子抑制剂, 则是筛选出能够查找到化合物结构的药物, 然后按照靶点和适应证进行归纳统计, 并将这些数据资料展现出来, 期望对该领域的研究起到参考和辅助作用。
1 激酶简介激酶(kinase)属于磷酸转移酶大家族, 参与底物磷酸化的过程, 把磷酸基团从能量高的分子如ATP转移到能量相对较低的特定靶分子(如蛋白质、脂质、糖、氨基酸和核苷等)上。目前在人体中发现的激酶有518种[2, 3]。蛋白激酶(protein kinases, PK)是激酶家族里面最大的族群, 可通过催化特定底物蛋白的磷酸化(将ATP末端的γ-磷酸基团转移到底物蛋白质的特定氨基酸上)影响底物的结构和活性, 进而参与了一系列细胞信号传导和调节过程[4]。基因改变引起的蛋白激酶的突变、易位、失调和过表达等和肿瘤、心血管疾病、炎症、退化、传染病等众多疾病的发病机制有着非常密切的关系。后文所提到的激酶无特别注明则均默认为蛋白激酶。蛋白激酶主要分为丝氨酸/苏氨酸激酶和酪氨酸激酶。丝氨酸/苏氨酸包含TKL、STE、CK1、AGC、CAMK和CMGC六个亚家族[5]。酪氨酸激酶(TK)根据其是否存在于细胞表面, 分为受体型酪氨酸激酶(receptor tyrosine kinase, RTKs)和非受体型酪氨酸激酶(non receptor tyrosine kinase, NRTKs)。
1.1 激酶结构与作用机制激酶尽管在一级序列上有所差异, 但在三维结构上却具有高度的保守性, 特别是由250~300个氨基酸残基构成的功能域折叠形成的含有12个高度保守亚区的催化结构域。激酶的催化区域可以分为铰链区(hinge)以及由铰链区连接的较小的N端区域(N-lobe)和较大的C端区域(C-lobe)(图 1A)[6, 7]。N-端区域包含5个反向平行的β折叠(β1~β5)和一个以“盐桥”连接的αC螺旋[8, 9]。β1和β2间包含有1个保守的富含甘氨酸的环(GXGXΦG, Φ代表疏水残基), 又叫P环(P-loop), 它可以与ATP分子中的磷酸根形成氢键(图 1B), 从而起到稳定ATP的作用。此外, 柔性的P环可以根据蛋白激酶的构象状态和配体的形状灵活变化从而适应不同的配体。P环之后的β2链上存在1个缬氨酸残基, 它能和ATP的腺嘌呤碱基以及许多小分子激酶抑制剂形成疏水相互作用。在β3链上有1个保守的AXK特征序列, 该序列中的赖氨酸(以FGFR2中的K517为例, 下同)能够与ATP的α-和β-磷酸基团形成氢键, 且能与αC螺旋中部的1个保守的谷氨酸(E534)以“盐桥”连接(图 1A), 此时的结构称为“αCin”构象。如果没有这个盐桥, 此时的激酶代表一种无活性状态的“αCout”构象。“αCout”构象转化为“αCin”构象是激酶获得催化活性所必需的过程[9]。

|
Figure 1 Structure of the protein kinase domain (A) and cocrystal structure of ATP analog bound to the site of FGFR2 (B, PDB ID: 2pvf).Mg2+ is shown as green balls and hydrogen bonds are shown as yellow dashes |
C-端区域占主导地位的是8个保守的α螺旋(αD~αI, αEF1/2), 此外还包含位于αE和αF间的4个小的β链(β6~β9)。β6之后是一条催化回环(catalytic loop), 包含HRD(x)4N基序, 主要起到催化和稳定镁离子的作用。天冬酰胺(N631)能够稳定镁离子, 天冬氨酸(D626)能够夺取底物蛋白羟基的质子, 从而有助于γ-磷酸基从ATP转移到底物上(图 1B)。此外, 位于ATP腺嘌呤结合口袋底部的β7链上的第二个残基能够跟几乎所有ATP竞争性的激酶抑制剂发生疏水相互作用[1]。
ATP结合区域位于N端和C端之间的裂口处, 在该处铰链区的氨基酸与ATP分子中的腺嘌呤形成氢键相互作用(图 1B)。在ATP活性位点附近, 还存在一条保守的活化环(activation loop), 其前端通常存在一个保守的Asp-Phe-Gly (DFG)结构基序, 末端为Ala-ProGlu (APE)序列, 当激酶处于活性构象时, DFG基序的Asp (D644)指向ATP结合空腔与镁离子结合(“DFG-Din”, 图 1B), 并且活化环处于开放状态(activation loop-open)[10]。
1.2 激酶与药物的结合口袋大多数激酶小分子抑制剂都是结合在ATP位点, 与ATP竞争结合(ATP竞争抑制剂), 因此N-端和C-端间的催化裂口是激酶抑制剂开发的主要焦点。该裂口可分为前端、守门区域和后端3部分(图 2)[11]。裂口前端主要包含铰链残基、催化回环以及P-loop, 组成了腺嘌呤结合口袋(AP)、位于DFG和暴露于溶剂区的铰链残基间的前口袋-I (FP-I)以及位于P-loop和裂口顶部β3链间的前口袋-II (FP-II)。守门区域起着药物从前端进入后端的门控作用[12], 该区域主要包含β3链和包含DFG在内的活化环的近端部分, 组成了靠上端的后口袋-I-A (BP-I-A)和中部的相对较大的后口袋-I-B(BP-I-B)。裂口后端主要包含αC螺旋、β4链、β5链以及αE螺旋, 其主要作用是调节激酶催化。当激酶处于DFG-Din构象时, 其裂口后端的口袋由后口袋-II-A-in(BP-II-A-in)、后口袋-II-in (BP-II-in)及后口袋-II-B(BP-II-B)组成。当激酶处于DFG-Dout构象时, 苯丙氨酸的位置发生了反转, 因此其裂口后端的结合口袋与DFG-Din存在差异, 由后口袋-II-out (BP-II-out)、后口袋-II-B (BP-II-B)、后口袋-III (BP-III)、以及部分暴露于溶剂区的后口袋-IV (BP-IV)和后口袋-V (BP-V)组成。
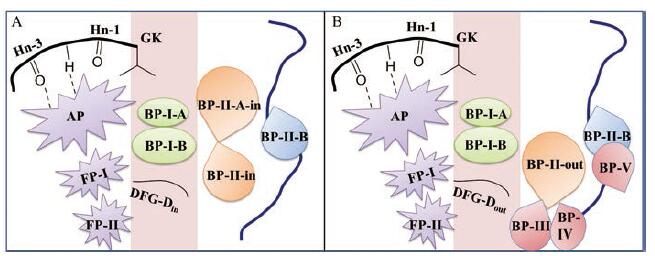
|
Figure 2 The two binding modes of ATP-competitative protein kinase inhibitors.A is for DFG-Din and B is for DFG-Dout conformations |
目前报道的小分子激酶抑制剂主要通过3种模式进行激酶活性的抑制[13]。①直接和ATP结合位点结合, 阻断后续信号通路。目前研发的大部分小分子激酶抑制剂都是结合激酶的ATP结合位点即ATP竞争抑制剂。ATP竞争抑制剂按照结合类型分为可逆抑制剂和共价抑制剂, 其中可逆抑制剂根据激酶的活性/非活性状态主要分为Type I型、Type I1/2型和Type II型抑制剂(表 1)[14]。DFG-Din为激酶处于活性构象的必要但不充分条件, 激酶处于DFG-Din状态的活性构象时结合的抑制剂即为Type I型抑制剂, 激酶处于DFG-Din状态的非活性构象时结合的抑制剂即为Type I1/2型抑制剂。当激酶处于DFG-Dout状态的非活性构象时, 此时结合的抑制剂即为Type II型抑制剂。此外, 根据Type I1/2型和Type II型抑制剂是否延伸至裂口后端, 又将其分为A型和B型。共价抑制剂即为Type VI型抑制剂; ②与非活化构象的变构位点相结合, 间接与ATP竞争, 即变构抑制剂, 其结合位点接近于ATP结合位点的为Type III型抑制剂, 远离ATP结合位点的为Type IV型抑制剂。此外, 一些变构抑制剂还可与假激酶域结合或与激酶的胞外域结合[15]; ③同时结合激酶的ATP结合位点和表面的另外一个位点(如变构位点)[16], 即Type V型抑制剂。在获批的小分子中大多数是ATP竞争型抑制剂, 变构抑制剂目前只有MEK1激酶的4个抑制剂被获批。
| 表 1 Classification of protein kinase inhibitors |
2001年FDA批准了由诺华公司开发的第一个激酶小分子抑制剂伊马替尼(imatinib), 作用靶点为Ab1激酶, 用于慢性粒细胞白血病的治疗, 这是肿瘤靶向治疗的一个重要突破。从2001年到2020年4月累计有59个激酶小分子抑制剂获得了FDA的批准, 且每年的批准量呈现出总体上升的趋势(图 3)。

|
Figure 3 FDA-approved small molecule kinase inhibitors from 2001 to April 2020 |
初步分析, 59个激酶小分子抑制剂中属于酪氨酸激酶抑制剂的有43个, 其次为丝氨酸/苏氨酸激酶抑制剂11个, 剩下的为3个脂激酶抑制剂和2个双特异性激酶抑制剂(图 3)。若按适应证(肿瘤药和非肿瘤药)分类, 其中肿瘤药占到了86%, 即有51个用于肺癌、乳腺癌、白血病等肿瘤疾病的药物, 有8个用于非肿瘤疾病(fedratinib用于骨纤维化; ruxolitinib用于骨纤维化和红细胞增多症; fostamatinib用于慢性免疫性血小板减少症; upadacitinib、baricitinib用于类风湿关节炎; nintedanib用于特发性肺纤维化; netarsudi用于青光眼; tofacitinib用于类风湿关节炎、克罗恩病、溃疡性结肠炎)。这些药物除了极个别外, 几乎都是口服用药。关于这59个药物的结构信息见图 4, 靶点信息见网络版支持材料中的表S1。
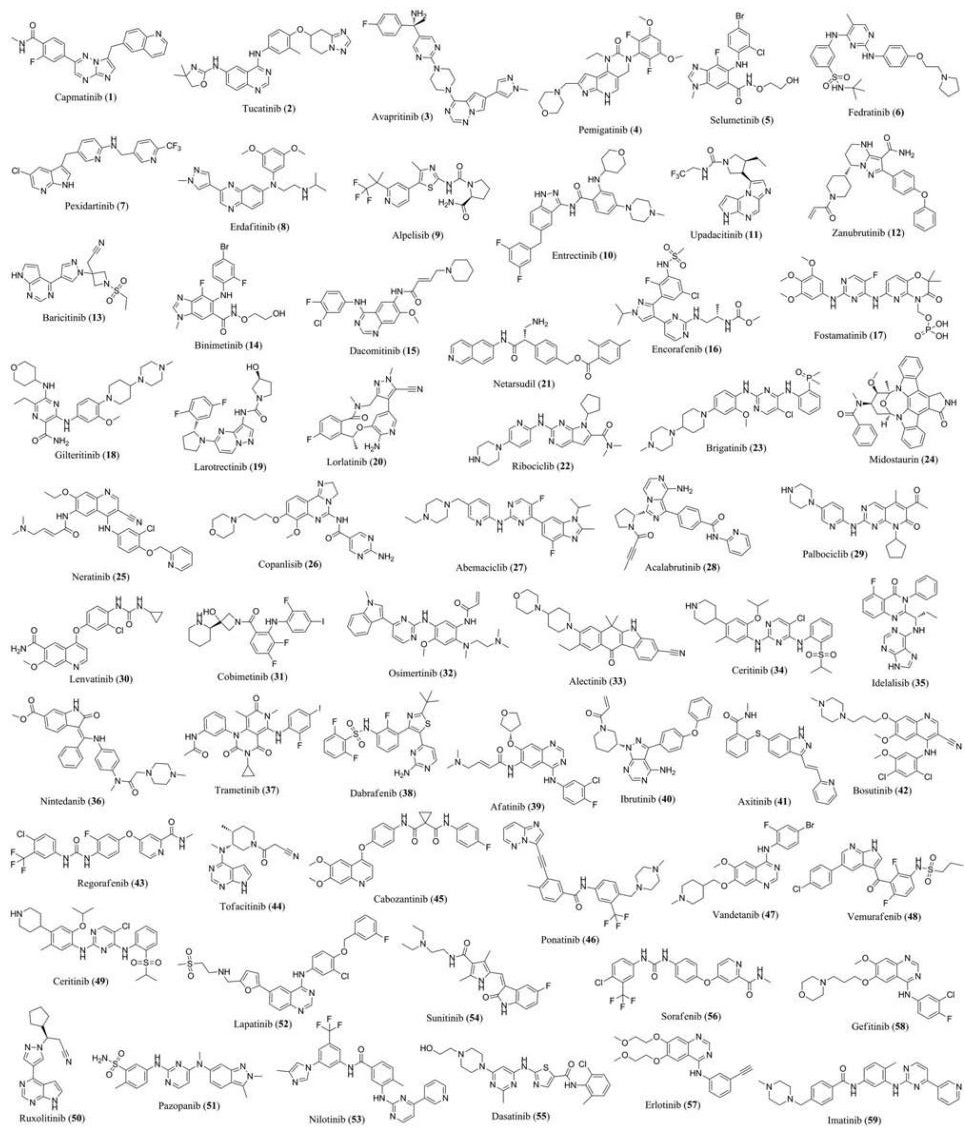
|
Figure 4 Structures of small molecule kinase inhibitors (1-59) approved by FDA from 2001 to April 2020 |
目前在人体发现的激酶有518种, 有大量的激酶抑制剂处在临床试验阶段。下面将对统计到的121个处于III和II期临床试验阶段的激酶小分子抑制剂按照靶点类型进行简单地综合分析。这121个小分子抑制剂中酪氨酸激酶抑制剂共有63个(受体型41个和非受体型22个)、丝氨酸/苏氨酸激酶抑制剂44个、其他激酶抑制剂14个。本次统计只选用了化合物结构公开的且能检索到的小分子抑制剂。
3.1 酪氨酸激酶抑制剂酪氨酸激酶(protein tyrosine kinase, PTK)因为其确切的药物作用效果占据了激酶抑制剂药物中的很大一部分, 是激酶抑制剂开发中当之无愧的主力军。按其是否分布在细胞膜上, 酪氨酸激酶可以分为受体型和非受体型两类。
3.1.1 受体型酪氨酸激酶抑制剂受体型酪氨酸激酶是一类具有内源性蛋白酪氨酸激酶活性的细胞表面跨膜蛋白受体, 一般由1个可以与特定配体结合的细胞外结构域、1个跨膜区及1个可以选择性地与底物结合并将其磷酸化的细胞内区域组成。配体和受体型酪氨酸激酶的细胞外结构域结合, 引起其结构改变而产生酶催化活性[17]。图 5是目前处于临床试验的受体型酪氨酸激酶抑制剂的药物结构, 网络版支持材料中的表S2展示了这些药物具体的临床试验阶段和靶点信息。
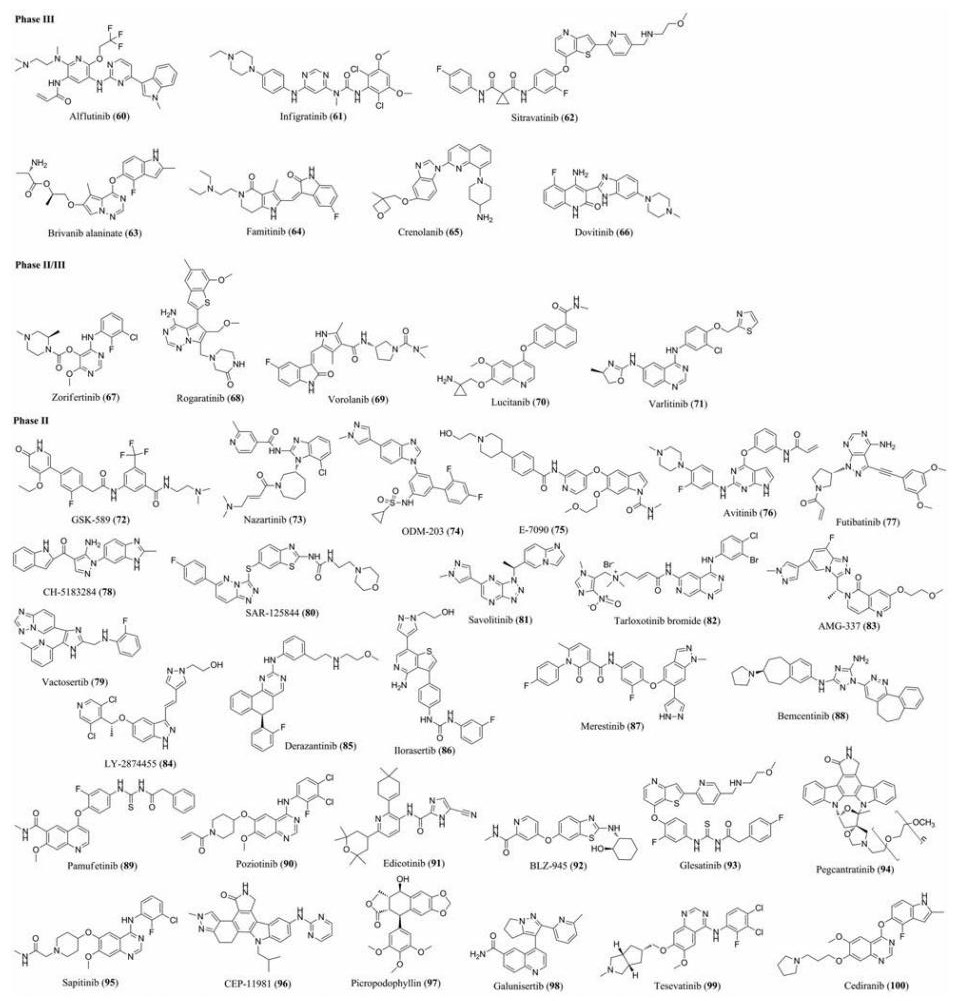
|
Figure 5 Structures of receptor tyrosine kinase inhibitors (60-100) currently in clinical phase Ⅱ and Ⅲ trials |
非受体酪氨酸激酶通常没有细胞外结构域, 一般存在于细胞膜或者细胞质中, 持续或暂时位于胞浆, 或者在细胞膜内侧与跨膜受体结合, 主要通过细胞因子受体、T细胞受体及其他信号通路执行信号转导[18]。图 6是目前处于Ⅲ期和Ⅱ期临床试验的非受体型酪氨酸激酶抑制剂的药物结构, 具体的临床试验阶段, 靶点等信息见网络版支持材料中的表S3。

|
Figure 6 Structures of non receptor tyrosine kinase inhibitors (101-122) currently in clinical phase Ⅱ and Ⅲ trials |
受体丝氨酸/苏氨酸激酶(receptor serine/theonine kinase)是一类跨膜受体蛋白, 在细胞内具有丝氨酸/苏氨酸蛋白激酶活性, 通过磷酸化下游信号蛋中的丝氨酸/苏氨酸残基而进行信号转导。图 7是目前处于Ⅱ期和Ⅲ期临床试验的丝/苏氨酸蛋白激酶抑制剂的结构, 具体的临床试验阶段, 靶点等信息见网络版支持材料中的表S4。
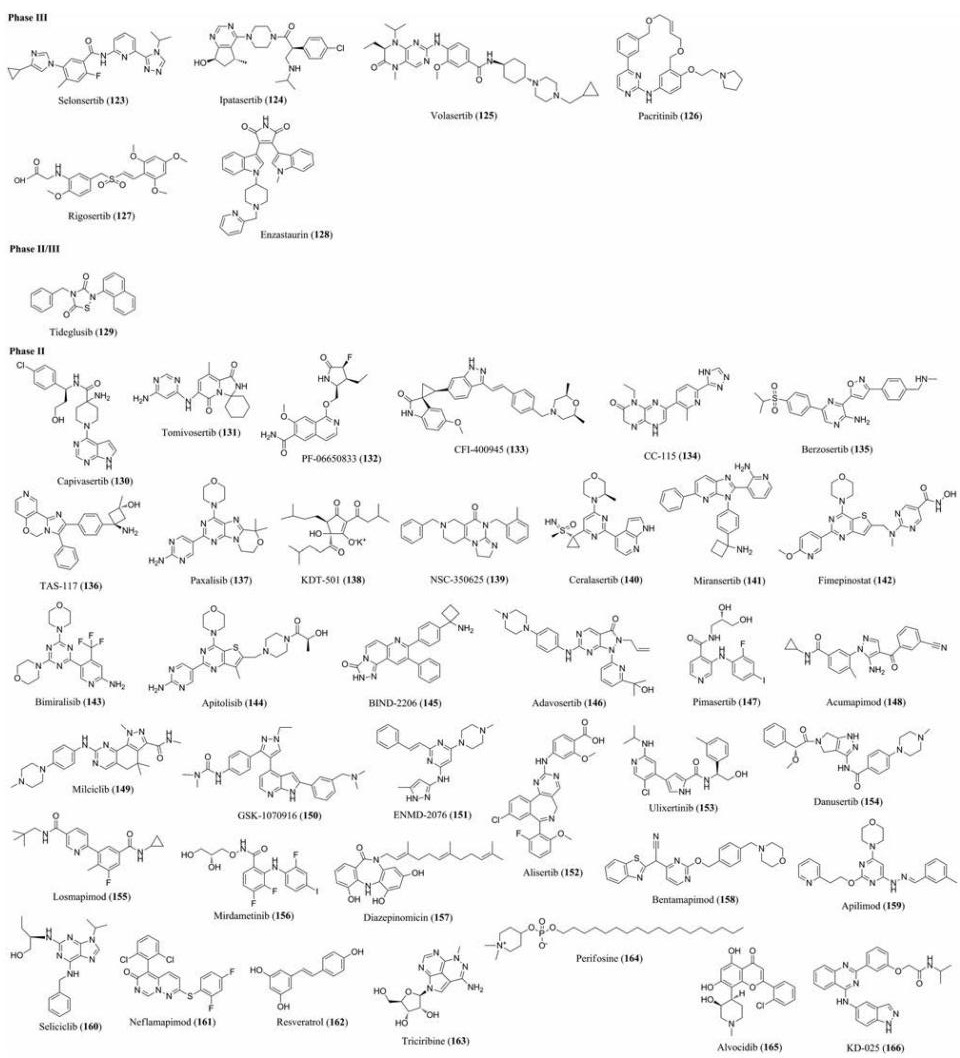
|
Figure 7 Structures of receptor serine/theonine kinase inhibitors (123-166) currently in clinical phase Ⅱ and Ⅲ trials |
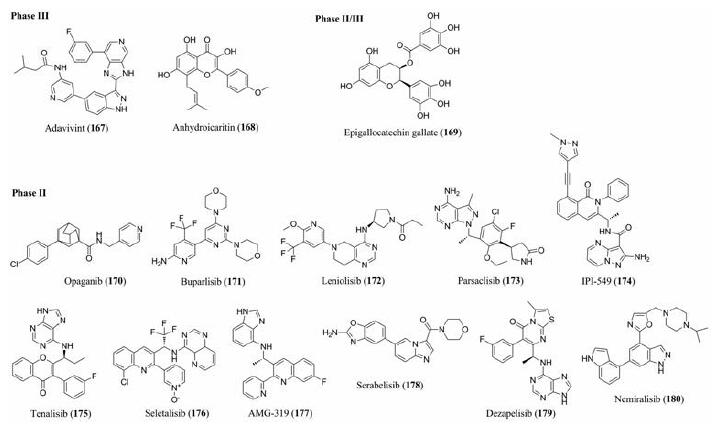
除了前面提到的酪氨酸激酶抑制剂和丝/苏氨酸激酶抑制剂, 还有一小部分为脂激酶抑制剂以及其他类型的激酶抑制剂, 药物结构如图 8, 靶点和适应证等信息见网络版支持材料中的表S5。
|
Figure 8 Structures of other kinase inhibitors (167-180) currently in phase Ⅱ and Ⅲ clinical trials |
表皮生长因子受体(EGFR)是一类受体型酪氨酸, 家族成员有HER1、HER2、HER3、HER4四种分型, 位于细胞膜上, 分为膜内、跨膜和膜外3个区域[19]。EGFR家族成员能两两形成同源和异源两种二聚体, 其中同源二聚体不需要配体, 异源二聚体需要配体。形成二聚体之后与ATP结合, 然后进行自磷酸化, 激活下游Ras/Raf/MAPK和PI3K/Akt/m TOR等信号通路, 参与细胞的生长、分裂、分化等活动。EGFR酪氨酸激酶抑制剂选择性地竞争细胞内结构域中Mg-ATP结合位点, 导致酪氨酸残基不能磷酸化, 进而阻断了下游通路的信号转导。目前经FDA批准上市的涉及到EGFR靶点有tucatinib (HER2阳性乳腺癌)[20]、dacomitinib (非小细胞肺癌)[21]、brigatinib (非小细胞肺癌)[22]、neratinib(HER2阳性乳腺癌)[23]、osimertinib (非小细胞肺癌)[24]、afatinib (非小细胞肺癌)[25]、vandetanib (甲状腺癌)[26]、lapatinib (乳腺癌)[27]、dasatinib (CML)[28]、erlotinib (非小细胞肺癌, 胰腺癌)[29]、gefitinib (非小细胞肺癌)[30]。从上面的列举可以看出针对该靶点开发出的药物主要适应证以非小细胞肺癌为主, 研究表明EGFRs在癌细胞表面高度表达, 其中非小细胞肺癌表达阳性率40%~80%[31]。在本综述统计的处于临床试验的药物中有10个药物涉及到该靶点, 其主要针对疾病仍然是非小细胞肺癌(因部分药物治疗组很多, 此处不一一列举, 具体见表 2)。
| 表 2 EGFR inhibitors, their protein kinase targets, and therapeutic indications |
成纤维细胞生长因子受体(FGFRs)跟EGFR类似, 也分为胞外、跨膜和胞内3个区域。其中胞外区域是与配体结合的地方, 包含3个免疫球蛋白(Ig)样区; 胞内为酪氨酸激酶区, 能够进行信号转导[32]。FGFR有FGFR1、FGFR2、FGFR3、FGFR4四位家族成员, 因Ig-III样结构域的剪切体的不同又可将其分为FGFR1b、FGFR1c、FGFR2b、FGFR2c、FGFR3b、FGFR3c和FGFR4七种亚型, 因此FGFRS与配体结合具有多样性[33, 34]。除FGF-7只能激活FGFR2b一种受体, 其他FGFs一般可以激活多种FGFR, 而FGFR也能被多种FGF激活[35, 36]。硫酸肝素蛋白多糖(HSPGs)能够协助FGFRs与FGFs结合, 然后使得FGFRs磷酸化, 从而激活下游一系列的相关信号通路如磷酸肌醇、MAPK和PI3K/Akt等, 进而参与细胞的生长、增殖、分化和血管生成等各种生理活动[37]。在经FDA批准上市中涉及到FGFR受体的药物有pemigatinib (胆管癌)[38]、erdafitinib (泌尿道上皮细胞癌)[39]、lenvatinib (多靶点, 分化型甲状腺癌)[40]、nintedanib (多靶点, 肺纤维化)[41]、regorafenib (多靶点, 结肠直肠癌, 肺细胞癌, 胃肠道间质瘤)[42]、ponatinib (多靶点, 慢性粒细胞性白血病, 急性淋巴细胞性白血病)[43]和pazopanib (肾细胞癌, 软组织肉瘤)[44]7个, 大多数为多靶点药物。在本综述统计的处于Ⅱ和Ⅲ期临床试验的药物中有12个药物靶点涉及到FGFR, 其中5个是多靶点药物(表 3)。
| 表 3 FGFR inhibitors, their protein kinase targets, and therapeutic indications |
血管内表皮生长因子(VEGF)由VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、VEGF-F和胎盘生长因子PIGF等7个成员组成, 它在血管生成、促进细胞存活以及通过与特定受体结合而促进内皮细胞生长和生存等方面发挥关键作用[45, 46]。VEGFR是VEGF的受体酪氨酸激酶跨膜蛋白, 由胞外7个免疫蛋白结构域、跨膜结构域和胞内酪氨酸激酶结合域3部分组成, 有VEGFR-1 (FLT-1)、VEGFR2 (KDR)、VEGFR3 (FLT-4)e3种亚型[47]。VEGFR与VEGF结合后首先发生二聚化, 然后进行自身磷酸化, 进而激活下游信号通路, 促进血管内皮细胞的生成。由于肿瘤细胞的大量增殖需要新生血管来供应营养物质和新陈代谢, 因此VEGFR表达会比较高。它与受体结合诱导肿瘤血管生成, 能够促进肿瘤生长, 参与肿瘤的转移和耐药机制形成[48]。在FDA批准的已上市药物中有11个涉及到VEGFR靶点, 分别为midostaurin (急性髓细胞性白血病、肥大细胞白血病)[49]、lenvatinib (分化型甲状腺癌)[40]、ninte‐danib (特发性肺纤维化)[41]、axitinib (肾细胞癌)[50]、regorafenib (结肠直肠癌、肺细胞癌、胃肠道间质瘤)[42]、cabozantinib (肾细胞癌、肺细胞癌、髓甲状腺癌)[51]、ponatinib (慢性粒细胞性白血病、急性淋巴细胞性白血病)[52]、vandetanib (甲状腺癌)[26]、pazopanib (肾细胞癌、软组织肉瘤)[43]、sunitinib (肾细胞癌、胃肠道间质瘤、胰腺神经内分泌肿瘤)[53]和sorafenib (甲状腺癌、肾细胞癌)[54]。值得注意的是这11个药物全部是多靶点药物。本综述统计的处于临床的药物中有12个药物涉及到该靶点, 也均为多靶点药物(表 4)。
| 表 4 VEGFR inhibitors, their protein kinase targets, and therapeutic indications |
布鲁顿酪氨酸激酶(BTK)属于非受体酪氨酸Tec家族, 是人类非受体激酶的第二大家族, 广泛表达于造血系统的所有细胞系中(除T细胞外), 分布在骨髓、脾脏和淋巴结组织中[55]。BTK在B细胞发育和功能中起着重要作用, BTK的异常激活与B细胞淋巴瘤的发病机制密切相关, 因此BTK在血液恶性肿瘤的治疗中一直是重要的靶点[56]。BTK由PH (Pleckstrin homology)、TH (Tec homology)、SH3 (Src homology 3)、SH2 (Src homology 2)和SH1 (Src homology 1) 5个结构域组成[57]。BTK的活化过程比较复杂, 该过程重要的步骤为磷脂酰肌醇三磷酸(PIP3)与BTK的PH结构域结合后将后者募集至细胞膜, 然后其Tyr551残基被Syk和Lyn激酶磷酸化, 最后BTK在Tyr223残基进行自磷酸化反应从而获得生理活性[58]。目前FDA批准的上市药物中靶点为BTK的药物有3个: zanubrutinib(套淋巴瘤)[59]、acalabrutinib (套淋巴瘤)[60]和ibrutinib(套淋巴瘤、慢性淋巴细胞白血病)[61]。这几个药物都是单靶点药物, 对BTK有很高的选择性。在本综述统计的处于临床的药物中有6个BTK抑制剂, 均为单靶点, 不过值得注意的是这几个药物的治疗组不是针对肿瘤而是炎症性疾病和自身免疫性疾病(表 5)。
| 表 5 BTK inhibitors, their protein kinase targets, and therapeutic indications |
JAK激酶家族属于非受体酪氨酸蛋白激酶, 目前发现的共有4位家族成员: JAK1、JAK2、JAK3和TYK2[62]。其中JAK1、JAK2和TYK2广泛存在于各种组织和细胞中, JAK3只在淋巴细胞和骨髓中表达。JAK蛋白与不同的受体特异性结合能发挥特定的生理功能。研究表明JAK激酶和血液系统肿瘤关系密切, JAK2跟红细胞和血小板的生成密切相关, JAK1/3则和免疫调节有关[63]。近几年研究发现JAK-STAT信号通路与炎症细胞因子、肿瘤细胞等的信号转导密切相关, 广泛参与人类健康和疾病过程中的细胞活动[64]。FDA批准上市的有fedratinib (骨髓纤维变性)[65]、upadacitinib (中度/重度类风湿性关节炎)[66]、baricitinib (类风湿关节炎)[67]、tofacitinib (银屑病关节炎、类风湿关节炎、溃疡性结肠炎)[68]和ruxolitinib (骨纤维化)[69]5个药物, 均为单靶点且都不是肿瘤药。本综述统计的处于临床试验的JAK抑制剂有10个, 基本都是单靶点, 炎症和自身免疫性疾病相关适应证占绝大部分(表 6)。
| 表 6 JAK inhibitors, their protein kinase targets, and therapeutic indications |
PI3K (磷脂酰肌醇3-激酶)是一类脂质激酶, 根据其结构特征和底物特异性可分为I、II、III 3种类型[70]。I型又可以分为IA和IB两种分型, 其中IA有PI3Kα、PI3Kβ、PI3Kδ3种分型, 它是一种异源二聚体酶, 含有1个调节亚基p85和1个催化亚基p110。调节亚基被激活后可以将催化亚基富集到细胞膜然后磷酸化其底物, 在非活化状态下催化亚基的酶活性受到抑制。IB也是异源二聚体酶, 只有PI3Kγ一种分型, 主要在免疫和造血细胞中表达。I型PI3K的PIP2磷酸化生成PIP3, 然后进行信号转导。II型没有调节亚基, 只存在1个可以与磷酸化的适配器蛋白作用的催化亚基。III型PI3K也是异型二聚体酶, 同样含有两个亚基: 调节亚基P150和催化亚基Vps34, 其底物为PI, 磷酸化后生成PIP, 参与调控细胞内的运输和自噬[71]。在FDA批准上市的药物中以PI3K为靶点的只有alpelisib (乳腺癌)[72]、copanlisib (复发滤泡淋巴瘤)[73]和idelalisib(慢性粒细胞白血病)[74]3个药物, 但是处于临床试验的药物中则有16个, 涉及的适应证为炎症、肿瘤、免疫性疾病等(表 7)。
| 表 7 PI3K inhibitors, their protein kinase targets, and therapeutic indications |
CDK4/6是细胞周期蛋白依赖性激酶(cyclin dependent kinase)家族成员, 该家族一共有13个, CDK1~13[75]。细胞周期蛋白依赖性激酶是一类丝氨酸/苏氨酸激酶。CDK通过与其对应的细胞周期蛋白结合, 能够在细胞周期调控、转录、代谢等各个阶段发挥作用[76]。在细胞周期的4个分期里, CDK4/6主要负责G1-S期的调控。CDK4和CDK6有71%的氨基酸序列同源性, 都能与cyclin D结合成复合物进而促使抑癌基因Rb磷酸化, 使得转录因子E2F从Rb-E2F脱离出来, 激活一系列基因使细胞进入S期开始的DNA复制[77]。CDK4/6的抑制剂在抗肿瘤方面作用机制主要有3方面: ①抑制肿瘤细胞恶性增殖, 恢复正常细胞周期; ②触发免疫机制; ③改变癌细胞微环境[78]。FDA批准的ribociclib (乳腺癌)[79]、abemaciclib (乳腺癌)[80]和palbociclib (乳腺癌)[81]3个药物对CDK4/6都具有很高的选择性, 适应证都是乳腺癌。但处于临床的几个药物则不再是单纯地作用于CDK4/6, 对家族的其他成员也有一定的作用(表 8)。
| 表 8 CDK4/6 inhibitors, their protein kinase targets, and therapeutic indications |
近几十年来小分子激酶抑制剂作为一个极具潜力的靶点, 一直被研究者青睐, 从2001年到2020年4月累计有59个药物经FDA批准上市, 发展势头强劲, 这些药物的出现彻底改变了癌症的治疗方式, 为医生和患者提供了更多的治疗方案。但是相较于研究发现的518个激酶这个基数, 目前小分子激酶抑制剂数量还是很少的, 其发展仍处于起步阶段。同时现在所开发的药物还集中在EGFRs、FGFRs、VEGFRs、JAK、PI3K和CDK等小部分激酶靶点, 对其他激酶成员发掘不够, 而且现有药物都具有较大的相似性, 绝大多数是对已知药物进行优化改造而成, 在骨架结构和作用机制方面缺乏创新性, 需要探索的空间还很大。
由于早期对于激酶的研究主要是基于酪氨酸激酶及其在肿瘤学中的作用展开的, 所以早期的上市药物以及目前处于临床试验的药物, 它们的适应证主要都集中在不同类型的癌症, 没有能够很好地将该领域的研究成果运用到其他疾病领域。不过近几年有一个比较好的现象就是开始有一些药物慢慢扩散到其他疾病领域且有加强的趋势, 例如现在上市的药物中有适应证为炎症、退行性疾病相关药物了。在临床试验的药物更是向炎症、退行性疾病、自身免疫病、中枢神经系统疾病、糖尿病、心血管疾病等除肿瘤以外的适应证不断扩散和尝试, 不断地向其他疾病领域突破有利于激酶价值潜力的最大程度挖掘, 前景值得期待。
耐药性是目前在TKI类药物临床应用道路上比较大的阻碍。TKI类药物的耐药性主要分为原发性耐药和获得性耐药。对TKI天然不敏感的称之为原发性耐药; 获得性耐药则是指起初有效使用一段时间之后出现的耐药性。以EGFR抑制剂在非小细胞肺癌中的运用为例, 使用EGFR-TKIs治疗一般有效持续9~13个月就会出现获得性耐药, 从而限制了其临床运用和获益的持续性, 而T790M突变是NSCLC患者最常见的获得性耐药机制[82, 83]。奥希替尼(osimertinib)作为克服EGFR T790M突变的抑制剂于2015年被FDA获批用于临床, 然而其又会发生靶点继发性的C797S突变, 诱导其耐药。因此, 仍需要研发下一代的可以克服EGFR C797S突变的抑制剂。事实上, 很大部分的耐药问题都是由于靶点突变造成的, 但却远不止这么简单, 比如它还与肿瘤的异质性有很大的关系[84], 所以探明耐药机制以及采取何种措施解决小分子抑制剂类药物的耐药问题是目前摆在研究者们面前的一大挑战。
作者贡献: 龙春庭对文献整理和初稿撰写; 邵敏进行论文数据和图标处理; 陆小云提供撰写思路和论文修改。
利益冲突: 所有作者无利益冲突。
| [1] |
Roskoski R. Properties of FDA-approved small molecule protein kinase inhibitors: a 2020 update[J]. Pharmacol Res, 2020, 152: 104609. DOI:10.1016/j.phrs.2019.104609 |
| [2] |
Ficarro SB, McCleland ML, Stukenberg PT, et al. Phosphoproteome analysis by mass spectrometry and its application to saccharomyces cerevisiae[J]. Nat Biotechnol, 2002, 20: 301-305. DOI:10.1038/nbt0302-301 |
| [3] |
Cohen P. The regulation of protein function by multisite phosphorylation-a 25 year update[J]. Trends Biochem Sci, 2000, 25: 596-601. DOI:10.1016/S0968-0004(00)01712-6 |
| [4] |
Manning G, Whyte DB, Martinez R, et al. The protein kinase complement of the human genome[J]. Science, 2002, 298: 1912-1916, 1933-1934. DOI:10.1126/science.1075762 |
| [5] |
Duong-Ly KC, Peterson JR. The human kinome and kinase inhibition[J]. Curr Protoc Pharmacol, 2013. DOI:10.1002/0471141755.ph0209s60 |
| [6] |
Knighton DR, Zheng J, Ten Eyck LF, et al. Crystal structure of the catalytic subunit of cyclic adenosine monophosphate-dependent protein kinase[J]. Science, 1991, 253: 407-414. DOI:10.1126/science.1862342 |
| [7] |
Liao JJL. Molecular recognition of protein kinase binding pockets for design of potent and selective kinase inhibitors[J]. J Med Chem, 2007, 50: 409-424. DOI:10.1021/jm0608107 |
| [8] |
Taylor SS, Kornev AP. Protein kinases: evolution of dynamic regulatory proteins[J]. Trends Biochem Sci, 2011, 36: 65-77. DOI:10.1016/j.tibs.2010.09.006 |
| [9] |
Kornev AP, Taylor SS. Dynamics-driven allostery in protein kinases[J]. Trends Biochem Sci, 2015, 40: 628-647. DOI:10.1016/j.tibs.2015.09.002 |
| [10] |
Kang CM, Dai YJ, Wang QY, et al. Small-molecule inhibitors of protein tyrosine kinases and their mechanisms of action[J]. Chin J New Drugs(中国新药杂志), 2013, 22: 1170-1178. |
| [11] |
van Linden OPJ, Kooistra AJ, Leurs R, et al. KLIFS: a knowledge-based structural database to navigate kinase-ligand interaction space[J]. J Med Chem, 2014, 57: 249-277. DOI:10.1021/jm400378w |
| [12] |
Cohen MS, Zhang C, Shokat KM, et al. Structural bioinformaticsbased design of selective, irreversible kinase inhibitors[J]. Science, 2005, 308: 1318-1321. DOI:10.1126/science1108367 |
| [13] |
Zhang XX, Sun LQ, Qi J. Research progress of small-molecule tyrosine kinase inhibitors as antitumor agents[J]. Chin J New Drugs(中国新药杂志), 2018, 27: 2616-2629. |
| [14] |
Roskoski R. Classification of small molecule protein kinase inhibitors based upon the structures of their drug-enzyme complexes[J]. Pharmacol Res, 2016, 103: 26-48. DOI:10.1016/j.phrs.2015.10.021 |
| [15] |
Lu X, Smaill JB, Ding K. New promise and opportunities for allosteric kinase inhibitors[J]. Angew Chem Int Ed, 2020. DOI:10.1002/anie.201914525 |
| [16] |
Lamba V, Ghosh I. New directions in targeting protein kinases: focusing upon true allosteric and bivalent inhibitors[J]. Curr Pharm Des, 2012, 18: 2936-2945. DOI:10.2174/138161212800672813 |
| [17] |
Choura M, Rebai A. Receptor tyrosine kinases: from biology to pathology[J]. J Recept Sig Transduct Res, 2011, 31: 387-394. DOI:10.3109/10799893.2011.625425 |
| [18] |
Hojjat-Farsangi M. Targeting non-receptor tyrosine kinases using small molecule inhibitors: an overview of recent advances[J]. J Drug Targeting, 2016, 24: 192-211. DOI:10.3109/1061186X.2015.1068319 |
| [19] |
Li Y, Tian C, Wang L, et al. Research progress of small-molecule epidermal growth factor receptor-tyrosine kinase inhibitors[J]. Anti-tumor Pharm(肿瘤药学), 2016, 6: 81-88. |
| [20] |
Lee P, Anderson D, Bouhana K, et al. In vivo activity of ARRY-380, a potent, small molecule inhibitor of ErbB2 in combination with trastuzumab, docetaxel or bevacizumab[J]. Cancer Res, 2009, 69: 5104. |
| [21] |
Smaill JB, Gonzales AJ, Spicer JA, et al. Tyrosine kinase inhibitors. 20. Optimization of substituted quinazoline and pyrido[3, 4-d]pyrimidine derivatives as orally active, irreversible inhibitors of the epidermal growth factor receptor family[J]. J Med Chem, 2016, 59: 8103-8124. DOI:10.1021/acs.jmedchem.6b00883 |
| [22] |
Zhang S, Anjum R, Squillace R, et al. The potent ALK inhibitor brigatinib(AP26113)overcomes mechanisms of resistance to first-and second-generation ALK inhibitors in preclinical models[J]. Clin Cancer Res, 2016, 22: 5527-5538. DOI:10.1158/1078-0432.CCR-16-0569 |
| [23] |
Rabindran SK, Discafani CM, Rosfjord EC, et al. Antitumor activity of HKI-272, an orally active, irreversible inhibitor of the HER-2 tyrosine kinase[J]. Cancer Res, 2004, 64: 3958-3965. DOI:10.1158/0008-5472.CAN-03-2868 |
| [24] |
Ward RA, Anderton MJ, Ashton S, et al. Structure-and reactivitybased development of covalent inhibitors of the activating and gatekeeper mutant forms of the epidermal growth factor receptor(EGFR)[J]. J Med Chem, 2013, 56: 7025-7048. DOI:10.1021/jm400822z |
| [25] |
Li D, Ambrogio L, Shimamura T, et al. BIBW2992, an irreversible EGFR/HER2 inhibitor highly effective in preclinical lung cancer models[J]. Oncogene, 2008, 27: 4702-4711. DOI:10.1038/onc.2008.109 |
| [26] |
Wedge SR, Ogilvie DJ, Dukes M, et al. ZD6474 inhibits vascular endothelial growth factor signaling, angiogenesis, and tumor growth following oral administration[J]. Cancer Res, 2002, 62: 4645-4655. |
| [27] |
Rusnak DW, Lackey K, Affleck K, et al. The effects of the novel, reversible epidermal growth factor receptor/ErbB-2 tyrosine kinase inhibitor, GW2016, on the growth of human normal and tumor-derived cell lines in vitro and in vivo[J]. Mol Cancer Ther, 2001, 1: 85-94. |
| [28] |
Lombardo LJ, Lee FY, Chen P, et al. Discovery of N-(2-chloro-6-methyl-phenyl)-2-(6-(4-(2-hydroxyethyl)-piperazin-1-yl)-2-methylpyrimidin-4-ylamino)thiazole-5-carboxamide(BMS-354825), a dual Src/Abl kinase inhibitor with potent antitumor activity in preclinical assays[J]. J Med Chem, 2004, 47: 6658-6661. DOI:10.1021/jm049486a |
| [29] |
Moyer JD, Barbacci EG, Iwata KK, et al. Induction of apoptosis and cell cycle arrest by CP-358, 774, an inhibitor of epidermal growth factor receptor tyrosine kinase[J]. Cancer Res, 1997, 57: 4838-4848. |
| [30] |
Barker AJ, Gibson KH, Grundy W, et al. Studies leading to the identification of ZD1839(iressa): an orally active, selective epidermal growth factor receptor tyrosine kinase inhibitor targeted to the treatment of cancer[J]. Bioorg Med Chem Lett, 2001, 11: 1911-1914. DOI:10.1016/S0960-894X(01)00344-4 |
| [31] |
Yrden Y. The EGFR family and its ligands in human cancer signalling mechanisms and therapeutic opportunities[J]. Eur J Cancer, 2001, 37: 3-8. |
| [32] |
Turner N, Grose R. Fibroblast growth factor signalling: from development to cancer[J]. Nat Rev Cancer, 2010, 10: 116-129. DOI:10.1038/nrc2780 |
| [33] |
Krause DS, Van Etten RA. Tyrosine kinase as targets for cancer therapy[J]. N Eng1 J Med, 2005, 353: 172-187. DOI:10.1056/NEJMra044389 |
| [34] |
Beenken A, Mohammadi M. The Fgf family: biology, pathophysiology and therapy[J]. Nat Rev Drug Discov, 2009, 8: 235-253. DOI:10.1038/nrd2792 |
| [35] |
Olsen SK, Ibrahimi OA, Raucci A, et al. Insights into the molecular basis for fibroblast growth factor receptor autoinhibition and ligang-binding proniscuity[J]. Proc Natl Acad Sci U S A, 2004, 101: 935-940. DOI:10.1073/pnas.0307287101 |
| [36] |
Johnson DE, Willians LT. Structural and functional diversity in the Fgf receptor multigene family[J]. Adv Cancer Res, 1993, 60: 1-41. |
| [37] |
Omitz DM, Xu J, Colvin JS, et al. Receptor specificity of the fibroblast growth factor family[J]. J Biol Chem, 1996, 271: 15292-15297. DOI:10.1074/jbc.271.25.15292 |
| [38] |
Dai S, Zhou Z, Chen Z, et al. Fibroblast growth factor receptors(FGFRs): structures and small molecule inhibitors[J]. Cells, 2019, 8: 614. DOI:10.3390/cells8060614 |
| [39] |
Perera TPS, Jovcheva E, Mevellec L, et al. Discovery and pharmacological characterization of JNJ-42756493(erdafitinib), a functionally selective small-molecule fgfr family inhibitor[J]. Mol Cancer Ther, 2017, 16: 1010-1020. DOI:10.1158/1535-7163.MCT-16-0589 |
| [40] |
Yamamoto Y, Matsui J, Matsushima T, et al. Lenvatinib, an angiogenesis inhibitor targeting VEGFR/FGFR, shows broad antitumor activity in human tumor xenograft models associated with microvessel density and pericyte coverage[J]. Vasc Cell, 2014, 6: 18. DOI:10.1186/2045-824X-6-18 |
| [41] |
Roth GJ, Heckel A, Colbatzky F, et al. Design, synthesis, and evaluation of indolinones as triple angiokinase inhibitors and the discovery of a highly specific 6-methoxycarbonyl-substituted indolinone(BIBF 1120)[J]. J Med Chem, 2009, 52: 4466-4480. DOI:10.1021/jm900431g |
| [42] |
Wilhelm SM, Dumas J, Adnane L, et al. Regorafenib(BAY 73-4506): a new oral multikinase inhibitor of angiogenic, stromal and oncogenic receptor tyrosine kinases with potent preclinical antitumor activity[J]. Int J Cancer, 2011, 129: 245-255. DOI:10.1002/ijc.25864 |
| [43] |
Gozgit JM, Wong MJ, Moran L, et al. Ponatinib(AP24534), a multitargeted pan-FGFR inhibitor with activity in multiple FGFRamplified or mutated cancer models[J]. Mol Cancer Ther, 2012, 11: 690-699. DOI:10.1158/1535-7163.MCT-11-0450 |
| [44] |
Harris PA, Boloor A, Cheung M, et al. Discovery of 5-[[4-[(2, 3-dimethyl-2H-indazol-6-yl)methylamino]-2-pyrimidinyl]amino]-2-methyl-benzenesulfonamide(pazopanib), a novel and potent vascular endothelial growth factor receptor inhibitor[J]. J Med Chem, 2008, 51: 4632-4640. DOI:10.1021/jm800566m |
| [45] |
Tocchetti CG, Gallucci G, Coppola C, et al. The emerging issue of cardiac dysfunction induced by antineoplastic angiogenesis inhibitors[J]. Eur J Heart Failure, 2013, 15: 482-489. DOI:10.1093/eurjhf/hft008 |
| [46] |
Di LD, Novo G, Madonna R, et al. Anticancer therapy-induced vascular toxicity: VEGF inhibition and beyond[J]. Int J Cardiol, 2017, 227: 11-17. DOI:10.1016/j.ijcard.2016.11.174 |
| [47] |
Furet P, Manley PW. Prospects for antiangiogenic therapies based upon VEGF inhibition[J]. ACS Symp Ser, 2001, 796: 282-298. |
| [48] |
Rapisarda A, Melillo G. Role of the VEGF/VEGFR axis in cancer biology and therapy[J]. Adv Cancer Res, 2012, 114: 237-267. |
| [49] |
Fabbro D, Ruetz S, Bodis S, et al. PKC412-a protein kinase inhibitor with a broad therapeutic potential[J]. Anticancer Drug Des, 2000, 15: 17-28. |
| [50] |
Hu-Lowe DD, Zou HY, Grazzini ML, et al. Nonclinical antiangiogenesis and antitumor activities of axitinib(AG-013736), an oral, potent, and selective inhibitor of vascular endothelial growth factor receptor tyrosine kinases 1, 2, 3[J]. Clin Cancer Res, 2008, 14: 7272-7283. DOI:10.1158/1078-0432.CCR-08-0652 |
| [51] |
Yakes FM, Chen J, Tan J, et al. Cabozantinib(XL184), a novel MET and VEGFR2 inhibitor, simultaneously suppresses metastasis, angiogenesis, and tumor growth[J]. Mol Cancer Ther, 2011, 10: 2298-2308. DOI:10.1158/1535-7163.MCT-11-0264 |
| [52] |
O'Hare T, Shakespeare WC, Zhu X, et al. AP24534, a pan-BCRABL inhibitor for chronic myeloid leukemia, potently inhibits the T315I mutant and overcomes mutation-based resistance[J]. Cancer Cell, 2009, 16: 401-412. DOI:10.1016/j.ccr.2009.09.028 |
| [53] |
Sun L, Liang C, Shirazian S, et al. Discovery of 5-[5-fluoro-2-oxo-1, 2-dihydroindol-(3Z)-ylidenemethyl]-2, 4-dimethyl-1H-pyrrole-3-carboxylic acid(2-diethylaminoethyl)amide, a novel tyrosine kinase inhibitor targeting vascular endothelial and plateletderived growth factor receptor tyrosine kinase[J]. J Med Chem, 2003, 46: 1116-1119. DOI:10.1021/jm0204183 |
| [54] |
Wilhelm SM, Carter C, Tang L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J]. Cancer Res, 2004, 64: 7099-7109. DOI:10.1158/0008-5472.CAN-04-1443 |
| [55] |
Smith CIE, Baskin B, Humire-Greiff P, et al. Expression of Bruton's agammaglobulinemia tyrosine kinase gene, BTK, is selectively down-regulated in T lymphocytes and plasma cells[J]. J Immunol, 1994, 152: 557-565. |
| [56] |
Davis RE, Ngo VN, Lenz G, et al. Chronic active B-cell-receptor signaling in diffuse large B-cell lymphoma[J]. Nature, 2010, 61: 88-92. |
| [57] |
Kawakami Y, Kitaura J, Hata D, et al. Functions of Bruton's tyrosine kinase in mast and B cells[J]. J Leukocyte Biol, 1999, 65: 286-290. DOI:10.1002/jlb.65.3.286 |
| [58] |
Deng R, Zhao LZ. Research progress on Btk inhibitors[J]. J Pharm Res(药学研究), 2014, 33: 359-361, 372. |
| [59] |
Guo Y, Liu Y, Hu N, et al. Discovery of zanubrutinib(BGB-3111), a novel, potent, and selective covalent inhibitor of Bruton's tyrosine kinase[J]. J Med Chem, 2019, 62: 7923-7940. DOI:10.1021/acs.jmedchem.9b00687 |
| [60] |
Byrd JC, Harrington B, O'Brien S, et al. Acalabrutinib(ACP-196)in relapsed chronic lymphocytic leukemia[J]. N Engl J Med, 2016, 374: 323-332. DOI:10.1056/NEJMoa1509981 |
| [61] |
Honigberg LA, Smith AM, Sirisawad M, et al. The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy[J]. Proc Natl Acad Sci U S A, 2010, 107: 13075-13080. DOI:10.1073/pnas.1004594107 |
| [62] |
Kiu H, Nicholson SE. Biology and significance of the JAK/STAT signalling pathways[J]. Growth Factors, 2012, 30: 88-106. DOI:10.3109/08977194.2012.660936 |
| [63] |
Xie WH, Zhang ZL. Current situation and prospect of Janus tyrosine kinase inhibitors in the treatment of rheumatoid arthritis[J]. Chin J Rheumatol(中华风湿病学杂志), 2019, 23: 482-486. |
| [64] |
Ji QQ, Guo WW, Zhang QQ, et al. Research progress of JAK inhibitors in the treatment of rheumatoid arthritis[J]. China Pharm(中国药房), 2016, 27: 711-713. |
| [65] |
Wernig G, Kharas MG, Okabe R, et al. Efficacy of TG101348, a selective JAK2 inhibitor, in treatment of a murine model of JAK2V617F-induced polycythemia vera[J]. Cancer Cell, 2008, 13: 311-320. DOI:10.1016/j.ccr.2008.02.009 |
| [66] |
Nakayamada S, Kubo S, Iwata S, et al. Recent progress in JAK inhibitors for the treatment of rheumatoid arthritis[J]. BioDrugs, 2016, 30: 407-419. DOI:10.1007/s40259-016-0190-5 |
| [67] |
Fridman JS, Scherle PA, Collins R, et al. Selective inhibition of JAK1 and JAK2 is efficacious in rodent models of arthritis: preclinical characterization of INCB028050[J]. J Immunol, 2010, 184: 5298-5307. DOI:10.4049/jimmunol.0902819 |
| [68] |
Jiang Jk, Ghoreschi K, Deflorian F, et al. Examining the chirality, conformation and selective kinase inhibition of 3-((3R, 4R)-4-methyl-3-(methyl(7H-pyrrolo[2, 3-d]pyrimidin-4-yl)amino)piperidin-1-yl)-3-oxopropanenitrile(CP-690, 550)[J]. J Med Chem, 2008, 51: 8012-8018. DOI:10.1021/jm801142b |
| [69] |
Quintas-Cardama A, Vaddi K, Liu P, et al. Preclinical characterization of the selective JAK1/2 inhibitor INCB018424: therapeutic implications for the treatment of myeloproliferative neoplasms[J]. Blood, 2010, 115: 3109-3117. DOI:10.1182/blood-2009-04-214957 |
| [70] |
Liu P, Cheng H, Roberts TM, et al. Targeting the phosphoinositide3-kinase pathway in cancer[J]. Nat Rev Drug Discov, 2009, 8: 627-644. DOI:10.1038/nrd2926 |
| [71] |
Cai TT, Zhao M, Wang JP. Advances in antitumor studies of PI3K inhibitors[J]. Zhejiang J Integr Tradit Chin West Med(浙江中西医结合杂志), 2018, 28: 709-714. |
| [72] |
Furet P, Guagnano V, Fairhurst RA, et al. Discovery of NVPBYL719 a potent and selective phosphatidylinositol-3 kinase alpha inhibitor selected for clinical evaluation[J]. Bioorg Med Chem Lett, 2013, 23: 3741-3748. DOI:10.1016/j.bmcl.2013.05.007 |
| [73] |
Liu N, Rowley BR, Bull CO, et al. BAY 80-6946 is a highly selective intravenous PI3K inhibitor with potent p110α and p110δ activities in tumor cell lines and xenograft models[J]. Mol Cancer Ther, 2013, 12: 2319-2330. DOI:10.1158/1535-7163.MCT-12-0993-T |
| [74] |
Lannutti BJ, Meadows SA, Herman SEM, et al. CAL-101, a p110δ selective phosphatidylinositol-3-kinase inhibitor for the treatment of B-cell malignancies, inhibits PI3K signaling and cellular viability[J]. Blood, 2011, 117: 591-594. DOI:10.1182/blood-2010-03-275305 |
| [75] |
Malumbres M, Barbacid M. Cell cycle, CDKs and cancer: a changing paradigm[J]. Nat Rev Cancer, 2009, 9: 153-166. DOI:10.1038/nrc2602 |
| [76] |
Lim S, Kaldis P. CDKs cyclins and CKIs: roles beyond cell regulation[J]. Developement, 2013, 140: 3079-3093. |
| [77] |
Hamilton E, Infante JR. Targeting CDK4/6 in patient with cancer[J]. Cancer Treatment Rev, 2016, 45: 129-138. DOI:10.1016/j.ctrv.2016.03.002 |
| [78] |
Fu B, Mo CM, Qin YC, et al. Progress of CDK4/6 inhibitors in treatment of malignant tumors[J]. J Hainan Med Univ(海南医学院学报), 2019, 25: 1676-1680. |
| [79] |
Van Arsdale T, Boshoff C, Arndt KT, et al. Molecular pathways: targeting the cyclin D-CDK4/6 axis for cancer treatment[J]. Clin Cancer Res, 2015, 21: 2905-2910. DOI:10.1158/1078-0432.CCR-14-0816 |
| [80] |
Gelbert LM, Cai S, Lin X, et al. Preclinical characterization of the CDK4/6 inhibitor LY2835219: in-vivo cell cycle-dependent/independent anti-tumor activities alone/in combination with gemcitabine[J]. Invest New Drugs, 2014, 32: 825-837. DOI:10.1007/s10637-014-0120-7 |
| [81] |
Fry DW, Harvey PJ, Keller PR, et al. Specific inhibition of cyclindependent kinase 4/6 by PD 0332991 and associated antitumor activity in human tumor xenografts[J]. Mol Cancer Ther, 2004, 3: 1427-1438. |
| [82] |
Yao YF, Wang J, Wang BC, et al. Advances in primary resistance mechanism of tyrosine kinase inhibitors in non-small cell lung cancer[J]. Chin J Oncol(中华肿瘤杂志), 2016, 38: 801-805. |
| [83] |
Liu QH, Li ZH, Li DB. Progress on acquired drug-resistance mechanism of EGFR-TKIs and its relation with microRNAs in patients with non-small cell lung cancer[J]. Pract J Cardiac Cerebr Pneu Vasc Dis(实用心脑肺血管病杂志), 2019, 27: 9-14, 19. |
| [84] |
He QY. Tumor heterogeneity and drug resistance of targeted antitumor agents[J]. Acta Pharm Sin(药学学报), 2016, 51: 197-201. |
 2021, Vol. 56
2021, Vol. 56


