2. 天津国际生物医药联合研究院中药新药研发中心, 天津 300457;
3. 中国中医科学院中药研究所, 北京 100700
2. Chinese Medicine New Drug Research and Development Center, Tianjin International Biomedical Research Institute, Tianjin 300457, China;
3. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
血小板作为从骨髓造血组织中的巨核细胞胞浆解脱下来的无核细胞, 不仅是血栓形成的主要影响因素, 而且在恶性肿瘤的发展中也起着促进作用。研究发现血小板和肿瘤细胞之间存在着显著的交叉通信[1]。一方面, 肿瘤细胞可以“教育”血小板, 影响它们的RNA谱、循环血小板的数量以及活化状态, 若血小板因其造成过度活化, 它们本身的黏附、聚集、释放及代谢能力都会明显增强, 并且还有可能导致血栓的形成; 另一方面, 接受肿瘤细胞“教育”的血小板含有过多的活性生物分子, 包括血小板特异性分子以及循环摄入的分子等, 它们在血小板活化后大量释放并参与恶性肿瘤的发展。此外, 血小板衍生因子、血管内皮生长因子以及转化生长因子β等也是肿瘤微环境的重要组成部分, 在恶性肿瘤的发展中也起着促进作用[2]。由于血小板与肿瘤细胞之间相互作用的过程较为复杂, 故针对其作用机制及药物的研究一直以来尚不明晰, 本文通过研究血小板与肿瘤细胞相互作用的机制以及靶向血小板与肿瘤细胞相互作用的潜在药物, 无论对今后临床上防治恶性肿瘤转移还是与之相关的血栓形成都具有重要意义。
1 血小板与肿瘤细胞的相互作用机制近年来, 关于血小板和肿瘤细胞的相互作用在恶性肿瘤的发展进程中逐渐引起了人们的关注, 主要表现为肿瘤细胞可以诱导血小板活化, 而活化的血小板可以促进肿瘤转移, 其中血小板膜上的环磷酸腺苷(adenosine diphosphate, ADP)、凝血酶和血栓素A2等G蛋白偶联受体在整个过程中发挥着至关重要的作用。
ADP存在于血小板内的高密度颗粒中, 与血小板的活化密切相关。P2Y12和P2Y1是ADP主要作用的两种G蛋白偶联受体, 并且它们也是ADP受体抑制剂的作用靶点。其中, P2Y12受体在血小板活化中最为重要, 其可以通过与Gi家族的蛋白结合, 使腺苷酸环化酶下调, 从而降低环磷酸腺苷(cyclic adenosine mono‐phosphate, cAMP)浓度, 同时其还能激活磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)信号通路, 抑制环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)的生成, 减少对磷酸二酯酶(phosphodiesterases, PDEs)的抑制, 从而使cAMP发生降解, 导致血小板大量活化进而促进血栓的形成。近年来的研究发现, 血小板活化对于肿瘤的生长、转移以及周围血管的生成也非常重要, 并且建议在恶性微环境中可以通过抑制P2Y12来降低血小板活化, 从而防止肿瘤的转移和扩散[3]。
凝血酶受体(protease-activated receptors, PARs)是血小板上存在的最为丰富的受体, 主要分为PAR1、PAR2、PAR3和PAR4四种亚型, 其中PAR3和PAR4是凝血酶引起鼠血小板活化的信号转导者, 而PAR1和PAR4一般在介导由凝血酶引起的人血小板活化过程中最常见, 且PAR1受体抑制剂还能选择性干扰凝血酶介导的血小板活化和血栓形成, 同时还不增加出血风险。另外, 研究发现PAR1受体还参与肿瘤血管生物学和组织重塑相关的转移和侵袭过程。例如PAR1的表达可以促进异种移植模型中乳腺癌细胞的生长和侵袭, 而且基质金属蛋白酶1可作为PAR1受体的激动剂, 在适当的位置切割受体以产生PAR1依赖性的Ca2+信号, 从而促进乳腺癌的迁移和侵袭[4, 5]。
血栓素A2 (thromboxane A2, TXA2)是花生四烯酸的重要代谢产物, 血小板上主要存在TPα和TPβ两种血栓素受体变异体, 其不仅可以诱发血管的收缩还可以促进血小板的活化。血栓素A2也已被确立为许多类型肿瘤中的启动子, 尤其是血栓素A2受体的α同工型(TPα)可以促进肺肿瘤的生长和转移。另外血栓素A2除了是肿瘤的启动子, 还可以用作肿瘤的生物标志物, 通过诱导慢性炎症来参与癌症恶病质的过程[6]。
1.1 肿瘤细胞诱导血小板活化1865年, Armand Trousseau首次描述了局部癌症可在远处诱发血栓形成, 甚至在进行癌症诊断之前, 血栓形成仍是癌症的特征, 因此癌症的这种表现被称为Trousseau综合征[7]。近年来, 通过大量的研究发现, 与正常人相比, 肿瘤患者中血栓形成和血栓栓塞的发生率要比其高出5倍以上[8]。而肿瘤患者高血栓形成风险的主要原因是肿瘤细胞可以通过多种机制诱导血小板活化。首先, 肿瘤细胞可以释放引起血小板活化的因子, 例如ADP、凝血酶、血栓素A2、P-选择素、基质金属蛋白酶、血小板因子4和血小板反应蛋白等。其次, 肿瘤细胞与血小板之间受体与配体的相互作用也会刺激血小板的活化, 从而促进肿瘤细胞存活和癌症进展, 例如血小板膜上Toll样受体4 (toll-like receptor 4 poly‐peptide, TLR4)与肿瘤细胞释放的高迁移率族蛋白1(high mobility group box-1 protein, HMGB1)结合[9], 血小板膜上的整合素(α6β1)与肿瘤细胞中的解整合素金属蛋白酶9 (a disintegrin and metalloprotease 9, AD‐AM9)结合[10], 以及血小板膜上的C型凝集素受体2(c-type lectin 2, CLEC2)与肿瘤细胞表达的平足蛋白(podoplanin)结合[11]等都可以诱导血小板的活化, 同时肿瘤细胞还会引起血小板表型的变化, 从而改变其生物学特性。此外, 肿瘤细胞还会释放一些促凝血蛋白, 例如组织因子(tissue factor, TF)、尿激酶型纤溶酶原激活物、纤溶酶原激活物抑制剂I型以及微粒等, 其也可能会诱导血小板活化。其中, TF是一种跨膜糖蛋白, 与凝血丝氨酸蛋白酶因子VII/VIIa结合后会形成复合物, 从而导致凝血酶和血纤蛋白的形成, 然后其可以作为体内凝血级联反应的主要引发剂参与正常血液凝固的过程[12], 但是若TF大量表达可能会引起血小板的过度活化, 进而诱发血栓形成的危险。在几种不同类型的恶性肿瘤中也发现TF可代表血小板活化的主要标志物, 主要与癌症患者血栓形成前的状态有关, 并且TF的过度表达也可以增强肿瘤细胞的侵袭能力[13, 14]。
1.2 活化的血小板促进肿瘤转移肿瘤转移涉及肿瘤细胞与荷瘤宿主之间的复杂相互作用, 其中血小板可以通过多种方式来加剧肿瘤的转移, 包括提高循环系统中肿瘤细胞的存活率或者促进肿瘤细胞在血管系统中的滞留等, 从而增强肿瘤细胞的外渗以及刺激继发性肿瘤部位的细胞增殖和血管生成[15-17]。此外, 血小板还将单核细胞和粒细胞募集到肿瘤细胞停滞的部位, 并与它们合作以建立促进转移的微环境和转移性的生态位。
当血小板与肿瘤细胞相互作用后, 血小板会被肿瘤细胞自身所产生的ADP、血栓素A2和凝血酶等激活, 而活化的血小板膜上包含着多种黏附蛋白, 如6种整联蛋白(αIIbβ3、α2β1、α5β1、α6β1、αLβ2和αvβ3)、糖蛋白GPVI (glycoprotein VI)、糖蛋白复合物GPIb-IX-V (glycoprotein Ib-IX-V)、C型凝集素以及P-选择素等, 其增强了肿瘤细胞与血小板之间的黏附, 使血小板成为肿瘤细胞表面的防护膜, 帮助其逃避自然杀伤细胞和血流剪切应力的攻击, 进而稳定了肿瘤细胞在血液循环系统中的滞留并加快了肿瘤转移。例如, 来自α-颗粒内的P-选择素在血小板活化后会易位至血小板表面并介导血小板与肿瘤细胞的结合, 所以P-选择素的阻滞或缺乏可导致小鼠肺部结肠癌细胞转移灶的减少[18], 同时在肿瘤转移过程中活化的血小板还可以促进上皮间质的转化[19], 抑制自然杀伤细胞活性, 促进肿瘤细胞增殖、血管生成和侵袭的可溶性因子释放, 包括腺苷三磷酸和基质金属蛋白酶等。此外, 活化的血小板还会释放异质性囊泡, 其中包括质膜来源的微粒, 也称为血小板来源的微囊泡或多囊体来源的囊泡。而其中包含多种生物活性分子的囊泡和外泌体可以增强血小板与肿瘤细胞之间的相互作用, 进一步促进肿瘤的转移, 而且降低血小板的活化已被证明在许多动物肿瘤转移模型中都具有较好的作用[20]。
2 靶向血小板与肿瘤细胞相互作用的潜在药物在恶性肿瘤的发展过程中, 肿瘤细胞从原发肿瘤脱离后会进入血液循环, 期间与血液中的血小板发生相互作用并激活血小板, 而血小板活化后可以促进肿瘤细胞的转移使其扩散到远处器官, 进一步表明了血小板在肿瘤转移中的重要作用[21]。在相关动物实验转移模型中也能观察到肿瘤细胞与血小板聚集体的形成, 其中肺转移的形成常伴有血小板明显升高的趋势[22]。根据数据统计显示, 约90%的癌症相关死亡是由肿瘤转移造成的[23], 所以当今恶性肿瘤治疗的主要目标仍是控制肿瘤的转移和扩散, 而靶向血小板与肿瘤细胞相互作用的抗肿瘤转移策略也因此可被用来协同临床上手术治疗恶性肿瘤。
2.1 靶向血小板与肿瘤细胞相互作用的抗血小板化药的肿瘤抑制活性目前, 市场上有越来越多的抗血小板化药可应用于临床上的抗肿瘤治疗, 其中, 以血小板与肿瘤细胞相互作用为靶标抑制肿瘤转移的药物主要是一些环氧化酶(cyclooxygenase, COX)抑制剂、P2Y12受体抑制剂和PDE抑制剂等[24], 其可以通过抑制血小板与肿瘤细胞的相互作用而有效降低肿瘤致死风险和扩散转移的可能性, 延长患者生存期, 如图 1所示。
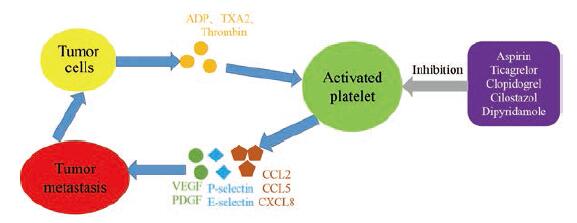
|
Figure 1 Chemical drugs targeting the interaction between platelets and tumor cells.VEGF: Vascular endothelial growth factor; PDGF: Platelet-derived growth factor; CCL: Chemokine (C-C motif) ligand; CXCL8:Chemokine (C-X-C motif) ligand 8;ADP: Adenosine diphos‐phate; TXA2:Thromboxane A2 |
环氧化酶是一种具有环氧化酶和过氧化氢酶活性的双功能酶, 主要分为COX-1和COX-2两种同化酶, 可将花生四烯酸转化为不同前列腺素或血栓烷的前体酶, 包括乙酰水杨酸(阿司匹林)和其他非甾体抗炎药[25]。
阿司匹林因具有较好的抗血小板活性, 不仅可有效抑制血栓形成, 而且还可降低恶性肿瘤的发病率以及增加总体的存活率。首先, 阿司匹林作为活性位点的乙酰化剂, 通过诱导COX-1 (Ser 529的乙酰化)不可逆失活, 导致产生的血栓素A2减少, 从而抑制血小板活化和血栓的形成。其次, 阿司匹林还可以通过诱导COX-2 (Ser 516的乙酰化)不可逆失活的机制来影响恶性肿瘤的发展, 包括破坏血小板与肿瘤细胞的相互作用, 抑制环氧化酶的合成, 促进肿瘤细胞凋亡, 并通过阻断线粒体钙摄取抑制肿瘤细胞增殖。例如, 它可以预防结直肠癌及其前体腺瘤的发生和发展, 降低结直肠癌的发病率、复发率和致死率[26]。随着阿司匹林的治疗作用得到越来越多的关注, 也开发出了具有相同抗炎、镇痛和解热活性的其他非甾体抗炎药, 如针对COX-1和COX-2的安替比林、非那西丁、布洛芬和萘普生, 以及主要针对COX-2的塞来昔布和罗非考昔[27], 而它们是否也能通过抑制血小板与肿瘤细胞的相互作用来治疗恶性肿瘤还需进一步研究。
2.1.2 P2Y12受体抑制剂P2Y12是血小板上Gαi偶联的ADP受体。一方面, P2Y12是所有目前使用的抗血小板ADP受体抑制剂的靶标; 另一方面, P2Y12介导的血小板活化有助于肿瘤生长因子VEGF的释放, 参与恶性肿瘤的发生和发展。在Lewis肺癌细胞(LLC)诱导的自发性肺转移模型中, P2Y12的缺陷明显减少了肺转移, 证实了血小板P2Y12受体在肿瘤转移中的重要作用[28]。同时, P2Y12的缺陷还减少了LLC细胞诱导血小板释放活性TGFβ1的能力, 从而减弱血小板诱导的LLC细胞上皮-间充质样的转化, 这是LLC细胞转移的先决条件。P2Y12抑制剂在心血管疾病治疗中是最广泛应用的处方药物, 主要包括噻吩吡啶类药物(氯吡格雷等)和非噻吩吡啶类药物(替卡格雷等), 而近年来越来越多的研究表明, P2Y12抑制剂这一类药物也在抗肿瘤转移过程中发挥着重要作用。
替卡格雷(ticagrelor)是一种通过可逆机制抑制P2Y12受体的环戊基三唑并嘧啶口服抑制剂, 常用于预防或治疗心脑血管疾病, 尤其在治疗血栓性疾病中最常用。研究发现, 在B16-F10黑色素瘤静脉内和脾内转移模型中, 替卡格雷还可以通过减少肿瘤细胞与血小板的相互作用或随后与内皮细胞的结合来抑制黑色素瘤细胞B16-F10向肺和肝内的转移[29], 与生理盐水处理的动物相比, 替卡格雷的治疗改善了肿瘤小鼠存活率。另外, 在小鼠体内4T1乳腺癌模型中也观察到替卡格雷可以通过抑制血小板与肿瘤细胞的相互作用来减少乳腺癌细胞4T1向肺的转移[30]。
氯吡格雷(clopidogrel)是一种可以通过不可逆机制抑制P2Y12受体的噻吩并吡啶口服抑制剂。在临床治疗上氯吡格雷不仅具有较好的抗血小板活性, 还可以抑制恶性肿瘤的发展。例如, 在胶质瘤动物模型的研究中发现, 肿瘤区域中有大量的血小板螯合, 以及血小板-内皮细胞的黏附分子和血管内皮生长因子等的表达明显升高, 其主要原因是由于源自外核苷三磷酸二磷酸水解酶(NTPDase2)活性的ADP可以刺激血小板向肿瘤区域迁移, 但是使用氯吡格雷治疗后, 这些参数都可以降低至控制水平[31], 同时还能抑制肿瘤的转移和扩散, 延长动物的生存期。另外, NTPDase2调节的血管生成和炎症似乎也在肿瘤的发展中起了重要作用, 而氯吡格雷因为具有抗血小板活性, 所以也可以通过减少血小板活化后炎症因子和血管生成蛋白的释放而阻止肿瘤转移[32]。
2.1.3 磷酸二酯酶抑制剂磷酸二酯酶可催化两个强大的细胞内抑制性第二信使cAMP和cGMP的水解。其中血小板表达的PDE2、PDE3和PDE5, 它们的抑制作用会增加血小板内cAMP和cGMP的含量, 从而抑制血小板的活化进而影响血栓的形成。在开发抗血小板药的同工酶选择性PDE抑制剂中, 西洛他唑和双嘧达莫等药物也常被用作辅助治疗恶性肿瘤。
西洛他唑(cilostazol)是血小板和平滑肌细胞中PDE3的特异性强抑制剂, 其显示对缺血性心血管具有保护作用并且还能抑制癌症的发生和发展。例如, 在体内异种移植肿瘤模型中, 西洛他唑联合顺铂可以协同发挥抗肿瘤作用, 使其凋亡癌细胞的数量显著增加[33]。在体外, 西洛他唑也可抑制小鼠黑色素瘤B16细胞诱导的血小板聚集, 从而抑制肿瘤细胞向肺转移[34]。
双嘧达莫(dipyridamole)目前在临床上常作为抗血栓药物与阿司匹林联用。双嘧达莫不仅可以作为PDE5和PDE3的抑制剂来影响血小板活化, 还可以通过抑制红细胞对腺苷的再摄取来抑制血小板的活化从而阻止血栓的形成。近年来的研究发现, 在恶性淋巴肿瘤患者中常出现外周血小板的活化, 且双嘧达莫在治疗恶性肿瘤的同时还能有效抑制血小板的活化[35]。因为血小板与肿瘤细胞的相互作用可以引起血小板的活化, 所以据此推测双嘧达莫在防治恶性肿瘤时能抑制血小板与肿瘤细胞的相互作用。同时在乳腺癌细胞诱导的肿瘤异种移植小鼠模型中也观察到, 注射给予双嘧达莫可以通过抑制Wnt、ERK1/2-MAPK和NF-κB信号通路的激活以及巨噬细胞和髓样细胞的浸润来阻止肿瘤转移[36]。
2.2 靶向血小板与肿瘤细胞相互作用的抗血小板中药的肿瘤抑制活性基于中医所坚持的整体观和辨证论治的理念, 研究发现大多数恶性肿瘤患者都有血瘀证的表现[37]。一方面表现为肿块、疼痛、出血、舌质暗紫或有瘀点及瘀斑、脉细涩等; 另一方面表现为凝血机制异常, 其特点主要是凝血机制被激活, 引起血小板的活化和抗凝血功能的减弱, 从而导致血液处于高凝状态并且容易形成血栓。因此中医将恶性肿瘤的发病机制归结为3类: 气滞血瘀型、痰结湿聚型和气血亏虚型。从最终导致肿瘤形成的原因来看, 大多数都与形成瘀血或影响发展的各个病理阶段[38]。所以, 现在临床也常通过一血行有关, 其中“气滞血瘀”被认为贯穿于肿瘤发生和些具有疏通经络、破瘀散结和祛瘀生新功效的中药来发挥止痛、消肿、散结和恢复正常气血运行的作用, 从而抑制恶性肿瘤的发展[39], 此外, 此类中药也具有较好的抗血小板活化和抗血栓作用, 例如丹参(丹酚酸A、丹酚酸B、丹参素和丹参酮IIA)、鸡血藤(刺芒柄花素和染料木素)、川芎(川芎嗪)、赤芍(芍药苷)、苏木(巴西苏木素)、红花(羟基红花黄色素A)、三七(三七皂苷R1和人参皂苷Rg3)、水蛭(水蛭素)、三棱(山柰酚和阿魏酸)和莪术(姜黄素、β-榄香烯和莪术二酮)等中药及其活性成分。然而, 近年来人们对于以上大多数中药防治恶性肿瘤的研究都聚焦在其可以抑制肿瘤细胞增殖与转移、促进肿瘤细胞凋亡、抑制肿瘤血管生长因子生成或者降低肿瘤细胞侵袭力等肿瘤自身方面[40], 忽视了在血液循环中肿瘤细胞会通过释放一些血小板活化因子来刺激血小板的活化, 活化的血小板又可以作为肿瘤细胞的防护膜, 通过帮助其逃避机体免疫系统的攻击和血流剪切力的损伤来进一步促进肿瘤的转移与扩散这一环节。因此, 目前鲜有中药通过抑制血小板与肿瘤细胞相互作用影响的肿瘤转移来进行抗肿瘤研究。为了今后从中药角度开发靶向血小板与肿瘤细胞相互作用来治疗恶性肿瘤转移的新药, 从同时具有抗血小板和抗肿瘤双重疗效的代表性中药活性成分中发现血小板与肿瘤细胞相互作用的潜在机制至关重要。本文首先在PubMed和IPA中, 分别以“血小板活化”和“肿瘤”为关键词进行靶点检索, 然后将以上18种中药活性成分与两个模型所涉及的靶点进行“Path Explorer”作用关系分析(寻找两者之间可能存在的互作路径), 发现二者之间的公共靶点包括肿瘤坏死因子(tumor necrosis factor, TNF)、白介素(interleukin, IL)-6、IL-10、HMGB1、TLR4等炎症因子或CCL2[chemokine(C-C motif) ligand 2]、CCL5、CXCL8[chemokine (C-X-C motif) ligand 8]等趋化因子或细胞黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)、血管细胞黏附分子-1 (vascular cell adhesion molecule-1, VCAM-1)等黏附因子, 如表 1[41-44]所示。最后, 将“血小板活化”和“肿瘤”之间所涉及的公共靶点进行“Core Analysis”核心分析, 并通过“Canonical Pathways”模块按照代表通路相关性的-Log P-value进行排序, 发现神经炎症和癌症中组织因子等信号通路相关性比较高, 如图 2所示。
| 表 1 The main molecular types and functions of platelet-tumor cell interaction. TNF: Tumor necrosis factor; HMGB1: High mobility group box-1 protein; TLR4: Toll-like receptor 4; IL: Interleukin; ICAM-1: Intercellular cell adhesion molecule-1; VCAM-1: Vascular cell adhesion molecule-1 |
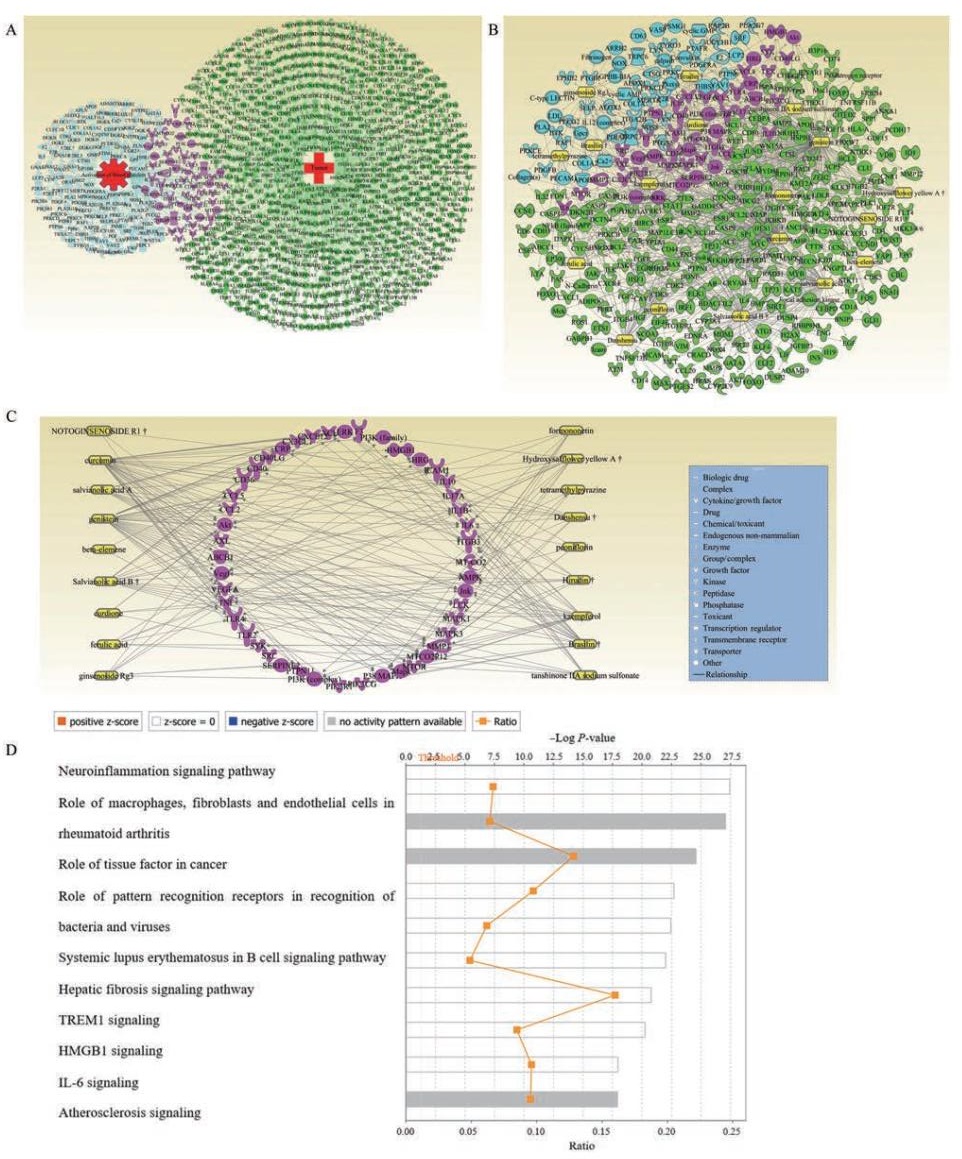
|
Figure 2 Key targets and signaling pathways for platelet-tumor cell interactions.A: Targets related to platelet activation and tumor; B: Network analysis between active ingredients of traditional Chinese medicine and platelet activation, tumor-related targets; C: Network analysis of common targets between active components of traditional Chinese medicine and platelet activation and tumor; D: Core analysis of related signaling pathways |
综上所述, 目前市场上抗血小板与肿瘤细胞相互作用的化药因所含成分明确, 不仅在治疗肿瘤转移的过程中作用机制清晰, 而且还具有起效快且服用周期短的优点。但是其也会伴随着一些不良反应或耐药性问题出现, 例如长期服用阿司匹林会使机体产生耐药性, 并对胃、肝、肾以及神经系统造成伤害, 在一些特异体质的人群中有可能还会引发出血和过敏等症状[45]。中药主要来源于天然药及其加工品, 包括植物药、动物药、矿物药等, 对人体的不良反应相对较小, 且临床实践基础丰富, 为新药研发奠定了较好基础。但是, 因中药有效成分非常复杂, 包括单味中药、提取物及单体化合物, 所以其在抗肿瘤转移过程中的作用机制一直较为模糊。本文通过总结和分析一些中药活性化合物在同时发挥抗血小板和抗肿瘤作用时所调控靶点的相同之处, 指出了该类化合物影响血小板与肿瘤细胞相互作用的潜在机制, 为今后从中药角度开发靶向血小板与肿瘤细胞相互作用的抗恶性肿瘤转移药物提供了新的研究思路。毋庸置疑, 靶向血小板与肿瘤细胞相互作用的中药开发对于恶性肿瘤及相关血栓性疾病的防治具有非常广阔的前景, 但同时这也仍需要后期在实验和临床中进一步发掘和验证。
作者贡献: 李珊负责文献的检索、整理以及综述的撰写; 陈子豪负责网络药理学部分的作图; 吕明和朱彦负责综述撰写框架内容的确定和文章的审核。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Plantureux L, Mège D, Crescence L, et al. Impacts of cancer on platelet production, activation and education and mechanisms of cancer-associated thrombosis[J]. Cancers(Basel), 2018, 10: 441. |
| [2] |
Wang S, Li Z, Xu R. Human cancer and platelet interaction, a potential therapeutic target[J]. Int J Mol Sci, 2018, 19: 1246. DOI:10.3390/ijms19041246 |
| [3] |
Benkli K. PO-35-designing of the new antithrombotic and also anticancer gold complexes[J]. Thromb Res, 2016, 140 Suppl 1: S189. |
| [4] |
Zhang C, Srinivasan Y, Arlow DH, et al. High-resolution crystal structure of human protease-activated receptor 1[J]. Nature, 2012, 492: 387-392. DOI:10.1038/nature11701 |
| [5] |
Boire A, Covic L, Agarwal A, et al. PAR1 is a matrix metalloprotease-1 receptor that promotes invasion and tumorigenesis of breast cancer cells[J]. Cell, 2005, 120: 303-313. DOI:10.1016/j.cell.2004.12.018 |
| [6] |
Deng QP, Wang MJ, Zeng X, et al. Effects of glycyrrhizin in a mouse model of lung adenocarcinoma[J]. Cell Physiol Biochem, 2017, 41: 1383-1392. DOI:10.1159/000467897 |
| [7] |
Gore JM, Appelbaum JS, Greene HL, et al. Occult cancer in patients with acute pulmonary embolism[J]. Ann Intern Med, 1982, 96: 556-560. DOI:10.7326/0003-4819-96-5-556 |
| [8] |
Silverstein MD, Heit JA, Mohr DN, et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study[J]. Arch Intern Med, 1998, 158: 585-593. DOI:10.1001/archinte.158.6.585 |
| [9] |
Yu LX, Yan L, Yang W, et al. Platelets promote tumour metastasis via interaction between TLR4 and tumour cell-released highmobility group box1 protein[J]. Nat Commun, 2014, 5: 5256. DOI:10.1038/ncomms6256 |
| [10] |
Mammadova-Bach E, Zigrino P, Brucker C, et al. Platelet integrin α6β1 controls lung metastasis through direct binding to cancer cell-derived ADAM9[J]. JCI Insight, 2016, 1: e88245. |
| [11] |
Tsukiji N, Inoue O, Morimoto M, et al. Platelets play an essential role in murine lung development through Clec-2/podoplanin interaction[J]. Blood, 2018, 132: 1167-1179. |
| [12] |
Mackman N. Role of tissue factor in hemostasis, thrombosis, and vascular development[J]. Arterioscler Thromb Vasc Biol, 2004, 24: 1015-1022. DOI:10.1161/01.ATV.0000130465.23430.74 |
| [13] |
Wang J, Xiao J, Wen D, et al. Endothelial cell-anchored tissue factor pathway inhibitor regulates tumor metastasis to the lung in mice[J]. Mol Carcinog, 2016, 55: 882-896. DOI:10.1002/mc.22329 |
| [14] |
Ruf W, Yokota N, Schaffner F. Tissue factor in cancer progression and angiogenesis[J]. Thromb Res, 2010, 125 Suppl 2: S36-S38. |
| [15] |
Gay LJ, Felding-Habermann B. Contribution of platelets to tumour metastasis[J]. Nat Rev Cancer, 2011, 11: 123-134. DOI:10.1038/nrc3004 |
| [16] |
Li N. Platelets in cancer metastasis: to help the "villain" to do evil[J]. Int J Cancer, 2016, 138: 2078-2087. DOI:10.1002/ijc.29847 |
| [17] |
Golebiewska EM, Poole AW. Platelet secretion: from haemostasis to wound healing and beyond[J]. Blood Rev, 2015, 29: 153-162. DOI:10.1016/j.blre.2014.10.003 |
| [18] |
Läubli H, Borsig L. Selectins as mediators of lung metastasis[J]. Cancer Microenviron, 2010, 3: 97-105. DOI:10.1007/s12307-010-0043-6 |
| [19] |
Labelle M, Begum S, Hynes RO. Direct signaling between platelets and cancer cells induces an epithelial-mesenchymal-like transition and promotes metastasis[J]. Cancer Cell, 2011, 20: 576-590. DOI:10.1016/j.ccr.2011.09.009 |
| [20] |
Elaskalani O, Berndt MC, Falasca M, et al. Targeting platelets for the treatment of cancer[J]. Cancers(Basel), 2017, 9: 94. |
| [21] |
Egan K, Cooke N, Kenny D. Living in shear: platelets protect cancer cells from shear induced damage[J]. Clin Exp Metastasis, 2014, 31: 697-704. DOI:10.1007/s10585-014-9660-7 |
| [22] |
Hilgard P. The role of blood platelets in experimental metastases[J]. Br J Cancer, 1973, 28: 429-435. DOI:10.1038/bjc.1973.168 |
| [23] |
Seyfried TN, Huysentruyt LC. On the origin of cancer metastasis[J]. Crit Rev Oncog, 2013, 18: 43-73. DOI:10.1615/CritRevOncog.v18.i1-2.40 |
| [24] |
Gresele P, Malvestiti M, Momi S. Anti-platelet treatments in cancer: basic and clinical research[J]. Thromb Res, 2018, 164Suppl 1: S106-S111. |
| [25] |
Xiong YQ, Li XJ. Common risk factors of cardiovascular diseases and malignant tumors and the influence of drugs[J]. Acta Pharm Sin(药学学报), 2020, 55: 1-7. |
| [26] |
Rothwell PM, Wilson M, Elwin CE, et al. Long-term effect of aspirin on colorectal cancer incidence and mortality: 20-year follow-up of five randomised trials[J]. Lancet, 2010, 376: 1741-1750. DOI:10.1016/S0140-6736(10)61543-7 |
| [27] |
Ornelas A, Zacharias-Millward N, Menter DG, et al. Beyond COX-1: the effects of aspirin on platelet biology and potential mechanisms of chemoprevention[J]. Cancer Metastasis Rev, 2017, 36: 289-303. DOI:10.1007/s10555-017-9675-z |
| [28] |
Wang Y, Sun Y, Li D, et al. Platelet P2Y12 is involved in murine pulmonary metastasis[J]. PLoS One, 2013, 8: e80780. DOI:10.1371/journal.pone.0080780 |
| [29] |
Gebremeskel S, LeVatte T, Liwski RS, et al. The reversible P2Y12 inhibitor ticagrelor inhibits metastasis and improves survival in mouse models of cancer[J]. Int J Cancer, 2015, 136: 234-240. DOI:10.1002/ijc.28947 |
| [30] |
Gareau AJ, Brien C, Gebremeskel S, et al. Ticagrelor inhibits platelet-tumor cell interactions and metastasis in human and murine breast cancer[J]. Clin Exp Metastasis, 2018, 35: 25-35. DOI:10.1007/s10585-018-9874-1 |
| [31] |
Braganhol E, Morrone FB, Bernardi A, et al. Selective NTPDase2 expression modulates in vivo rat glioma growth[J]. Cancer Sci, 2009, 100: 1434-1442. DOI:10.1111/j.1349-7006.2009.01219.x |
| [32] |
Bambace NM, Levis JE, Holmes CE. The effect of P2Y-mediated platelet activation on the release of VEGF and endostatin from platelets[J]. Platelets, 2010, 21: 85-93. DOI:10.3109/09537100903470298 |
| [33] |
Uzawa K, Kasamatsu A, Baba T, et al. Targeting phosphodiesterase 3B enhances cisplatin sensitivity in human cancer cells[J]. Cancer Med, 2013, 2: 40-49. DOI:10.1002/cam4.56 |
| [34] |
Okoshi H, Hakomori S, Nisar M, et al. Cell membrane signaling as target in cancer therapy II: inhibitory effect of N,N,N-trimethylsphingosine on metastatic potential of murine B16 melanoma cell line through blocking of tumor cell-dependent platelet aggregation[J]. Cancer Res, 1991, 51: 6019-6024. |
| [35] |
Desai PB, Duan J, Sridhar R, et al. Reversal of doxorubicin resistance in multidrug resistant melanoma cells in vitro and in vivo by dipyridamole[J]. Methods Find Exp Clin Pharmacol, 1997, 19: 231-239. |
| [36] |
Spano D, Marshall JC, Marino N, et al. Dipyridamole prevents triple-negative breast-cancer progression[J]. Clin Exp Metastasis, 2013, 30: 47-68. DOI:10.1007/s10585-012-9506-0 |
| [37] |
Li XX, Ma YF, Li GD, et al. The pathogenesis of hypercoagulable state of malignant tumors and the progress of traditional Chinese and Western medicine treatment[J]. World J Integr Tradit West Med(世界中西医结合杂志), 2019, 14: 1619-1623. |
| [38] |
Zhang PT, Park BK. Blood stasis syndrome and malignant tumors[J]. Chin J Surg Integr Tradit West Med(中国中西医结合外科杂志), 1998, 4: 378. |
| [39] |
Lin WF, Lu JY, Cheng BB, et al. Progress in research on the effects of traditional Chinese medicine on the tumor microenvironment[J]. J Integr Med, 2017, 15: 282-287. DOI:10.1016/S2095-4964(17)60345-5 |
| [40] |
Zhu YC, Xu XF, Li W. Advances in research on promoting blood circulation and removing blood stasis and tumor treatment[J]. Asia Pacific Tradit Med(亚太传统医药), 2019, 15: 182-185. |
| [41] |
Takagi S, Tsukamoto S, Park J, et al. Platelets enhance multiple myeloma progression via IL-1βupregulation[J]. Clin Cancer Res, 2018, 24: 2430-2439. DOI:10.1158/1078-0432.CCR-17-2003 |
| [42] |
Labelle M, Begum S. Platelets guide the formation of early metastatic niches[J]. Proc Natl Acad Sci U S A, 2014, 111: E3053-E3061. DOI:10.1073/pnas.1411082111 |
| [43] |
Häuselmann I, Roblek M, Protsyuk D, et al. Monocyte induction of E-selectin-mediated endothelial activation releases VE-cadherin junctions to promote tumor cell extravasation in the metastasis cascade[J]. Cancer Res, 2016, 76: 5302-5312. DOI:10.1158/0008-5472.CAN-16-0784 |
| [44] |
Han H, Wang XW. Research progress of tumor platelet-related angiogenesis regulatory protein[J]. Chin J Cancer Prevent Treat(中华肿瘤防治杂志), 2018, 25: 1045-1050. |
| [45] |
Wang S, Yu Y, Ryan PM, et al. Association of aspirin therapy with risk of hepatocellular carcinoma: a systematic review and dose-response analysis of cohort studies with 2.5 million participants[J]. Pharmacol Res, 2020, 151: 104585. DOI:10.1016/j.phrs.2019.104585 |
 2021, Vol. 56
2021, Vol. 56


