随着人们生活方式的变化和人口老龄化的发展, 我国糖尿病患病率逐年攀升, 2013年我国慢性病及其危险因素监测显示, 18岁及以上人群2型糖尿病(type 2 diabetes mellitus, T2DM)患病人数已成为世界第一[1]。而最新的流行病学调查结果[2]显示, 中国18岁及以上人群T2DM患者1.298亿, 患病率12.8%, 糖尿病前期, 即糖耐量受损(impaired glucose tolerance)患病率高达35.2%, 若不积极防治, 进展为糖尿病可能只是时间问题。因此, 研究糖尿病的发病机制, 发现新靶标药物, 是防治糖尿病的重要环节之一。
众所周知, 胰岛素抵抗(insulin resistance)是T2DM的主要特征, 它贯穿于糖尿病前期以至糖尿病的整个疾病过程, 胰岛素增敏剂是治疗T2DM的有效药物[3]。自1999年上市以来, 以罗格列酮(rosiglitazone)为代表的噻唑烷二酮类(thiazolidinediones, TZDs)药物, 被认为是临床效果最佳的胰岛素增敏剂, 长期作为一线用药[4, 5]。但是, 随着临床广泛应用, 该类药物一系列的不良反应被陆续报道, 例如体重增加、水钠潴留、骨质疏松、肿瘤及心血管风险[6, 7], 尤其以长期服药诱发心血管事件受到广泛关注[8], 直接导致了该类药物的暂停使用或者限制使用, 但临床上也没有更好的其他胰岛素增敏剂替代, 这给新型胰岛素增敏剂的药物研发带来了新的挑战和契机。
TZDs药物的靶点是过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ), 在调节机体糖脂代谢稳态上发挥着重要作用。已报道的PPAR亚型中, PPARγ主要分布在脂肪组织, 被内源性及外源性配体识别、结合和激活后, 可调节靶基因的表达, 这些靶基因涉及到细胞能量代谢、物质代谢和细胞增殖等众多生物学效应, 在整体水平, PPARγ激活使机体外周组织对胰岛素的敏感性增加, 包括肌肉摄取和利用葡萄糖增加, 肝脏糖异生抑制, 脂肪组织脂肪酸分解抑制、合成增加, 促进脂肪细胞重构等[9]。因此, PPARγ激动剂作为胰岛素增敏剂应用于糖尿病治疗, 疗效确切。虽然2010年美国FDA限制了罗格列酮的使用, 但经过2013年大规模临床试验的重评价(RECORD), 该类药物的临床使用限制被撤销[10]。对于临床医生和糖尿病患者而言, 目前TZDs药物依旧是胰岛素增敏剂的不二选择。
然而, 从新药研发的角度, 研究者却希望更好地平衡药效和安全性的关系, 寻找新型PPARγ激动剂成为各大医药企业和科研机构竞相追逐的目标。于是, 选择性PPARγ调节剂(selective PPARγmodulators, SPPARMs)的概念孕育而生, 并且在新药研发的实践中不断完善和丰富, 本文就SPPARMs的定义、分类以及作用机制进行概述, 并且举例说明最新的SPPARMs候选化合物研究进展。
1 选择性PPARγ调节剂的定义——尚在丰富和发展的概念和学说SPPARMs是一个不断丰富和发展的概念, 目前还没有完全定论, 本文从不同的研究角度归纳目前已获得认可的几种学说。首先是“选择性”这一说法, 其实是区别于经典的TZDs, 与罗格列酮对比, SPPRAMs具有类似或者不同的PPARγ受体结合位点, 或者是募集受体辅因子的亲和力或特异性有区别, 亦或者是PPARγ调节转录的一系列靶基因有倾向性和选择性, 转录水平有强弱差别。目前相对认可的观点是, 由于配体-受体-辅因子的构象差别, 影响靶基因的选择性转录调控, 进一步影响PPARγ靶向的药物治疗作用和不良反应的发生[11, 12]。在此模式上, 药物预期的治疗作用与不良反应的剂量反应线性关系差别较大, 产生一个更宽的安全治疗窗, 如图 1所示。目前, 有许多SPPARMs被开发且开始临床前研究[13, 14], 部分已经进入了临床研究, 如INT131[14], 研发SPPARMs为寻找新型胰岛素增敏药物提供了极具前景的思路, 在发挥抗糖尿病治疗作用的同时, 将药物安全性与不良反应限制在一个可接受的范围内。

|
Figure 1 The dose response relationship of treat effect and side effect of selective PPARγ modulators (SPPARMs)[14].Compared to full agonist, the linear regression of treat effect and side effect of SPPARMs were separated |
相较于“选择性”, SPPARMs的另一个概念解释为“部分激动剂(partial agonist)”, 以罗格列酮作为“完全激动剂(full agonist)”, 一般认为达到罗格列酮效能的20%~60%即为部分激活剂[15]。部分激动剂在体外实验水平可拮抗完全激动剂的活性。在体内水平, 当内源性PPARγ激动剂(脂肪酸及其代谢产物)水平较高时, 部分激动剂可拮抗内源性配体的作用, 维持或调节体内PPARγ活性在一定水平。目前, 有许多具有PPARγ部分激动活性的化合物在临床前实验中表现出与完全激动剂相当或接近的胰岛素增敏作用, 而少发生或不发生TZD不良反应[16]。事实上, PPARγ部分激动剂是否产生脂肪生成和水肿等不良反应, 取决于PPARγ靶基因调节的强度, 部分激动剂发挥的弱激动活性, 可调节与治疗作用相关的靶基因转录, 但不调节与不良反应相关的靶基因转录, 这是部分激动剂能保留治疗作用而避免不良反应发生的根本原因, 其本质也是PPARγ活性调节的“选择性”结果。
相较于“激动剂”, 调节剂的范畴更广, 除激活剂外, 也包括抑制剂或者拮抗剂。很长一段时间, 发挥胰岛素增敏作用究竟应该激活还是抑制PPARγ活性, 在学术界一直是个有争议的问题。对PPARγ的基因敲除表明, PPARγ+/-杂合小鼠相对于野生型小鼠, PPARγ表达水平降低, 却表现出比野生型小鼠更强的胰岛素敏感性、胰岛素介导的葡萄糖利用率及葡萄糖生成抑制率[17, 18]; 亦可抵御年龄[19]和高脂饮食[17, 19, 20]诱导的胰岛素抵抗, 且不产生脂肪细胞肥大[18, 20]。PPARγ拮抗剂BADGE降低高脂饮食喂养小鼠骨骼肌、肝脏及白色脂肪组织中甘油三酯(triglyceride, TG)的含量, 增加脂肪酸的消耗及能量代谢, 改善高脂饮食诱导的肥胖及胰岛素抵抗[15, 21]。类似地, 另一PPARγ拮抗剂SR202抑制高脂饮食喂养的小鼠和糖尿病ob/ob小鼠的脂肪细胞分化, 增加小脂肪细胞数量, 降低肿瘤坏死因子α(tumor necrosis factorα, TNF-α)和瘦素分泌, 改善胰岛素抵抗[22]。以上结果表明, PPARγ表达下调或者活性抑制均可在一定条件下发挥胰岛素增敏作用。但是, BADGE可导致PPARγ+/-杂合小鼠的胰岛素抵抗[19], 这表明PPARγ介导的胰岛素增敏作用, 取决于PPARγ基础表达水平和活性水平, 将PPARγ的活性调节到适度水平, 才是发挥药理作用的基本原理。
传统认为, PPARγ激活需要配体识别并结合受体, 调节受体介导的基因转录, 从而以基因转录活性的强弱评价PPARγ配体的活性高低。而近年来, 更多的研究表明, PPARγ的活性可以被磷酸化调节, 例如细胞周期依赖性激酶5 (cell cycle dependent kinase 5,CDK5)对PPARγ 273位丝氨酸的磷酸化[23]。一些非PPARγ激动剂的配体可以通过抑制CDK5的活性从而激活PPARγ[24, 25]。因此, “非激动剂PPARγ配体”的概念孕育而生, 这些化合物激活PPARγ的特点是与PPARγ结合, 封闭CDK5对PPARγ的磷酸化位点; 或者通过辅因子与PPARγ的相互作用, 封闭PPARγ的磷酸化位点[26]。事实上, TZDs药物也具有对CDK5介导的PPARγ磷酸化的抑制作用, 但不同的是, TZDs是高亲和力的PPARγ配体, 可以更广泛地影响PPARγ的转录激活作用。因此, 无论是完全激动剂/部分激动剂, 或者抑制剂/拮抗剂, 亦或者PPARγ磷酸化抑制剂, 本质上是对PPARγ活性调节的不同模式, 均属于“PPARγ调节剂”范畴, 化合物与PPARγ的作用模式, 决定了PPARγ介导的转录激活作用的强度和宽度, 也就是PPARγ选择性活化的基本原理。评价PPARγ靶向药物的活性, 不再以PPARγ转录活性作为唯一标准, 化合物和PPARγ的作用模式才是PPARγ药物活性的关键。
2 SPPARMs的分类——部分激动剂、PPARγ磷酸化抑制剂以及TZDs衍生物以上述理论为指导, 目前国际上在研的PPARγ靶向化合物可以分为如下几类: 部分激动剂、PPARγ磷酸化抑制剂以及TZDs衍生物(表 1)[11, 16, 23, 24, 27-46]。
| 表 1 Classification of peroxisome proliferator-activated receptor γ(PPARγ) modulators. TZD: Thiazolidinediones; T2DM: Type 2 diabetes mellitus; NAFLD: Nonalcoholic fatty liver disease |
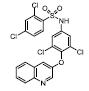
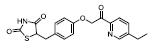
部分激动剂, 如INT131[14]、GW1929[27]和MBX-102[28, 29]等。以INT131为代表, 其对PPARγ的转录激动活性明显弱于完全激动剂罗格列酮, 与PPARγ结合具有类似的结合位点, 但募集辅因子的能力明显降低。药效方面, INT131保留了和罗格列酮接近的胰岛素增敏作用, 可以降低高血糖, 但没有诱导脂肪生成和增加体重的不良反应[14, 30, 31]。目前, INT131及其类似物INT131-004、INT131-007等[32-34]均处于临床研究Ⅱ期, 适应症为糖尿病。
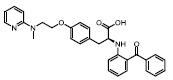
第二类PPARγ调节剂, 也称PPARγ磷酸化抑制剂, 如SR1664[24]、GQ-16[39, 40]、MRL-24[16]和amorfrutin[41, 42]等。以SR1664为代表, 其对PPARγ基本没有转录激活作用, 但和PPARγ亲和力较高, 属于非激动剂PPARγ配体, 其与PPARγ的作用位点是PPARγ的273位丝氨酸, 封闭CDK5介导的PPARγ在Ser273的磷酸化。
另一类PPARγ调节剂比较特殊, 其结构上是TZDs类似物, 但对PPARγ几乎没有作用, 代表化合物为MSDC-0160[46]和MSDC-0602[47]。其作用靶点报道为线粒体丙酮酸运载体2 (mitochondrial pyruvate carrier 2,MPC2), 即TZDs的线粒体靶点(mitochondrial target of thiazolidinediones, m TOT), 虽然对PPARγ没有直接激活作用, 但仍有胰岛素增敏的药效作用[35]。
目前, 文献报道的新型PPARγ调节剂的化学结构各不相同, 但主要特点均是对PPARγ的转录激活作用明显降低, 因此PPARγ相关的不良反应均明显减少。但不同化合物与PPARγ的结合位点和结合构象不同, 因此, 募集辅因子的能力和选择性也不同。
3 SPPARMs的作用机制——PPARγ介导的基因转录调控、PPARγ蛋白翻译后修饰以及非PPARγ的作用靶点PPARγ作为细胞内重要的核受体, 是调节糖脂代谢相关基因的关键转录因子。因此, 传统寻找PPARγ靶点药物以PPARγ转录激活活性高低作为衡量指标, TZDs药物如罗格列酮, 正是以此指标通过化合物高通量筛选获得的代表性药物。但近年来的研究认为, PPARγ的活性调节有复杂的调控机制, 涉及PPARγ介导的基因转录调控、PPARγ蛋白翻译后修饰以及非PPARγ的其他蛋白及其作用机制。
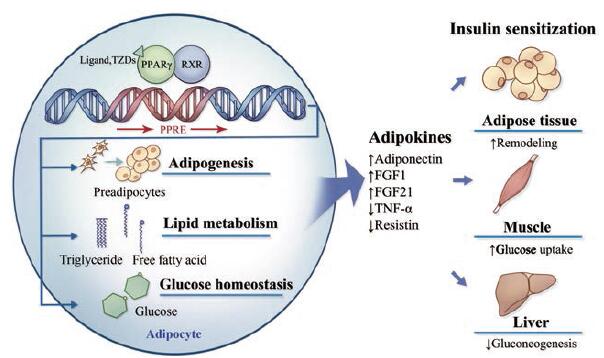
在转录调控水平, 当配体和PPARγ结合后, 诱导PPARγ/维甲酸X受体(retinoic acid X receptor, RXR)复合物构象变化, 识别结合PPARγ反应元件(PPARγ responsive elements, PPRE), 调控靶基因表达, 这些靶基因是调节脂肪生成、脂质代谢和糖稳态调节的关键基因。其中, 调节脂联素(adiponectin)等脂肪因子的表达水平是该类药物发挥胰岛素增敏作用的关键[48], 如图 2所示。
|
Figure 2 PPARγ activation and targeted gene transcription regulation in adipose tissue[48].FGF: Fibroblast growth factor; TNF-α: Tumor necrosis factor-α |
配体和PPARγ的结合位点和结合区决定了PPARγ的构象以及后续辅因子募集的变化。有研究报道PPARγ的helix 12是以罗格列酮为代表的TZD类药物的主要配体结合区, 其中Tyr473是决定PPARγ转录激活的关键位点, 而选择性激动剂如MRL-24,其配体结合区与罗格列酮不同[49]。
PPARγ辅因子包括共抑制因子和共激活因子, 前者如核受体共抑制子(nuclear receptor co-repressor, NcoR), 后者如PPARγ共激活子1α(PPARγ coactivator 1α, PGC-1α)和介导复合物亚单位1 (mediator complex subunit1, MED1)等。PGC-1α是参与调节糖异生的关键基因, 选择性抑制PGC-1α可通过抑制糖异生发挥抗糖尿病作用[50]。对辅因子的选择性募集决定了PPARγ调控靶基因的选择性。如INT131激活PPARγ, 但不募集辅因子MED1, 后者是调节脂肪生成的关键因子, 因此INT131可选择性地降低血糖, 却没有明显脂肪生成的不良反应[14]。
PPARγ的翻译后修饰涉及到磷酸化、乙酰化和泛素化等[48], 如图 3所示。其中, PPARγ的磷酸化调节是活性调节的主要方式之一, 涉及到的激酶有CDK5、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)等, 其对PPARγ的Ser273位点的磷酸化可明显抑制PPARγ的活性。作用于Ser273位点的PPARγ磷酸化抑制剂对脂肪生成的基因诱导能力明显下降, 但可以诱导诸如adiponectin等调节胰岛素敏感性的基因[23, 24]。除Ser273位点外, 有报道Ser112的磷酸化也参与调节PPARγ的活性, TZDs类化合物明显抑制PPARγ在Ser112的磷酸化, 而telmisartan作为部分PPARγ激动剂, 不影响PPARγ在Ser112的磷酸化, 因此, telmisartan对破骨细胞分化和骨质形成没有明显影响[51]。

|
Figure 3 Post-translational modification of PPARγ and related effects on activity[48].AF1:N-terminal transactivation domain; DBD: DNA binding domain; LBD: Ligand binding domain; NH2: N-terminal; COOH: C-terminal; MAPK: Mitogen-activated protein kinase; CDK5:Cell cycle dependent kinase 5;SUMO: Small ubiq‐uitin-like modification; AC: Acetylation; P: Phosphorylation |
有报道称在PPARγ敲除的条件下, TZD类药物依旧可以发挥其抗糖尿病作用, 并发现TZD类化合物作用的另一个靶点为MPC2。新合成的TZD类似物, 如MSDC-0160和MSDC-0602,对PPARγ的激活作用基本消失, 作用于MPC2,因此, 也称为TZD类药物的线粒体靶点(mTOT)[47, 52]。
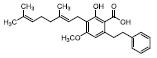
4 YR系列化合物——一类新型SPPARMs的发现YR系列是一类四氢异喹啉衍生物, 化学合成的最初设想是根据PPARγ激动剂已有的构效关系, 设计合成以四氢异喹啉母核作为亲脂性结构片段, 芳香羧酸结构作为极性结构片段的化合物[53], 或将亲脂性尾部由四氢异喹啉环换为体积较大的四氢咔啉环[54]。以YR4-42 (图 4)为例[55], 在PPARα、γ和δ三个亚型的活性筛选中, YR化合物表现出特异的PPARγ激活活性, 但与经典的PPARγ激动剂相比, 其转录激活作用仅相当于罗格利酮的8%, 与PPARγ受体的亲和力Ki值为5 744 nmol·L-1(罗格列酮的Ki值为38 nmol·L-1), 且募集PPARγ辅因子PGC1α和TRAP220的作用也远低于罗格列酮和吡格列酮。虽然YR4-42显示PPARγ弱激动作用, 但在体内水平, YR4-42却表现出与吡格列酮相当的抗糖尿病作用, 可以明显改善糖尿病小鼠的高血糖和胰岛素抵抗, 改善脂代谢紊乱。值得注意的是, YR4-42不增加糖尿病小鼠体重, 对肥胖小鼠脂肪肝有明显改善作用, 这与吡格列酮有明显区别。
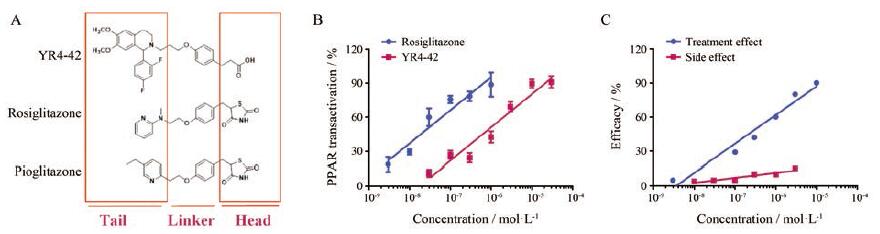
|
Figure 4 YR4-42 is a novel SPPARM[55].A: According to quantitative structure activity relationship of rosiglitazone and pioglitazone, YR4-42 was designed and synthesized by linking the aromatic carboxylic acid structure (head) and tetrahydroisoquinoline core structure(tail); B: Determined by PPARγ transactivation assay, the concentration activity curve of YR4-42 significantly shifts right and separates from the rosiglitazone's; C: The treat effect is expressed by the level of glucose uptake in adipocytes while the side effect is expressed by the degree of lipid accumulation in adipocytes.The efficacy of side effect induced by YR4-42 is much less than the efficacy of the treat effect |
本课题组进一步探讨了YR4-42调节PPARγ活性的作用机制, 发现YR4-42通过抑制MAPK和CDK5介导的PPARγ磷酸化, 活化PPARγ。Ser273是YR4-42的关键作用位点, 除此之外, Met348、His449和Tyr473也是YR4-42与PPARγ的重要作用位点[55]。
通过对YR系列化合物与PPARγ的作用评价, 本课题组认为YR系列化合物是一类新结构的SPPARMs, 对糖尿病和胰岛素抵抗有明显改善作用, 对高血脂和非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)也具有潜在治疗作用, 值得进一步研究[55]。目前, 该类化合物在国家“重大新药创制”科技重大专项的支持下, 开展临床前研究。
5 展望--SPPARMs作为新药研发的方向及潜在应用范围TZD类药物具有明确的抗糖尿病临床疗效, 目前仍是胰岛素增敏剂的不二选择, 但其不良反应不容忽视。以PPARγ为靶点的新药研发, 主要目标是保留TZD类药物的胰岛素增敏作用, 尽量控制和减少不良反应的发生。SPPARMs, 无论是PPARγ部分激动剂还是PPARγ磷酸化抑制剂, 无论是TZD结构类似物还是非TZD结构化合物, 均是目前的研究方向。对SPPARMs作用机制的解析[56]将有利于研究者对该类药物更深入的认识, 促进药物研发进展。
PPARγ转录活性曾是PPARγ类化合物筛选的活性评价标准, 而选择性PPARγ调节剂的特点是PPARγ转录活性明显下降或消失, 目前对SPPARMs的活性评价主要基于化合物与PPARγ的结合水平, 对PPARγ磷酸化影响, 以及对PPARγ靶基因调控的选择性。在前期研究基础上, 本课题组也建立了PPARγ非激动剂的筛选方法和模型[57], 发现了新型PPARγ非激动剂化合物[58]。
除胰岛素增敏作用外, 近年来研究认为PPARγ可以作为许多代谢性疾病、炎症和与炎症相关的疾病、癌症等的药物靶点[59-61]。SPPARMs亦表现出胰岛素增敏之外的其他药效作用, 例如治疗脂肪肝和非酒精性肝硬化[45]、阿尔茨海默症(Alzheimer's disease)[62]、痛风[37]、血脂异常和动脉粥样硬化[63]、抗炎[64]和抗癌[65]等。由于2型糖尿病的病因复杂性以及糖尿病并发症的发生, 胰岛素抵抗常与其他代谢异常相伴, SPPARMs的多面治疗作用对糖尿病及其并发症的治疗具有潜在意义。并且, 除糖尿病外, SPPARMs对其他疾病的治疗作用和应用价值也值得进一步挖掘。
作者贡献: 环奕和彭军负责文章的选题、资料收集; 环奕负责文章撰写和修改; 潘璇整理收集化合物信息及提供YR系列化合物; 刘站柱提供YR系列化合物的设计思路, 对文章的选题和思路提出建设性意见; 申竹芳为该文章的主要负责人, 负责文章的选题、思路和框架的提出, 对本文进行了细致的修改。
利益冲突: 本文无利益冲突。
| [1] |
Society CD. Guidelines for the prevention and control of type 2 diabetes in China(2017 Edition)[J]. Chin J Pract Intern Med(中国实用内科杂志), 2018, 38: 292-344. |
| [2] |
Li Y, Teng D, Shi X, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: national cross sectional study[J]. BMJ, 2020, 369: m997. |
| [3] |
Kahn SE, Hull RL, Utzschneider KM. Mechanisms linking obesity to insulin resistance and type 2 diabetes[J]. Nature, 2006, 444: 840-846. DOI:10.1038/nature05482 |
| [4] |
Sugii S, Evans RM. Epigenetic codes of PPARgamma in metabolic disease[J]. FEBS Lett, 2011, 585: 2121-2128. DOI:10.1016/j.febslet.2011.05.007 |
| [5] |
Savage DB. PPAR gamma as a metabolic regulator: insights from genomics and pharmacology[J]. Expert Rev Mol Med, 2005, 7: 1-16. |
| [6] |
Kahn BB, McGraw TE. Rosiglitazone, PPARgamma, and type 2diabetes[J]. N Engl J Med, 2010, 363: 2667-2669. DOI:10.1056/NEJMcibr1012075 |
| [7] |
Mannucci E, Monami M, Di Bari M, et al. Cardiac safety profile of rosiglitazone: a comprehensive meta-analysis of randomized clinical trials[J]. Int J Cardiol, 2010, 143: 135-140. DOI:10.1016/j.ijcard.2009.01.064 |
| [8] |
Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes[J]. N Engl J Med, 2007, 356: 2457-2471. DOI:10.1056/NEJMoa072761 |
| [9] |
Yessoufou A, Wahli W. Multifaceted roles of peroxisome proliferator-activated receptors(PPARs)at the cellular and whole organism levels[J]. Swiss Med Wkly, 2010, 140: w13071. |
| [10] |
Soccio RE, Chen ER, Lazar MA. Thiazolidinediones and the promise of insulin sensitization in type 2 diabetes[J]. Cell Metab, 2014, 20: 573-591. DOI:10.1016/j.cmet.2014.08.005 |
| [11] |
Higgins LS, Depaoli AM. Selective peroxisome proliferatoractivated receptor gamma(PPARgamma)modulation as a strategy for safer therapeutic PPARgamma activation[J]. Am J Clin Nutr, 2010, 91: 267S-272S. DOI:10.3945/ajcn.2009.28449E |
| [12] |
Whitehead JP. Diabetes: new conductors for the peroxisome proliferator-activated receptor gamma(PPARgamma)orchestra[J]. Int J Biochem Cell Biol, 2011, 43: 1071-1074. DOI:10.1016/j.biocel.2011.04.017 |
| [13] |
Zhang F, Lavan BE, Gregoire FM. Selective modulators of PPAR-gamma activity: molecular aspects related to obesity and side-effects[J]. PPAR Res, 2007, 2007: 32696. |
| [14] |
Higgins LS, Mantzoros CS. The development of INT131 as a selective PPARgamma modulator: approach to a safer insulin sensitizer[J]. PPAR Res, 2008, 2008: 936906. |
| [15] |
Yamauchi T, Waki H, Kamon J, et al. Inhibition of RXR and PPARgamma ameliorates diet-induced obesity and type 2 diabetes[J]. J Clin Invest, 2001, 108: 1001-1013. DOI:10.1172/JCI12864 |
| [16] |
Acton JJ 3rd, Black RM, Jones AB, et al. Benzoyl 2-methyl indoles as selective PPARgamma modulators[J]. Bioorg Med Chem Lett, 2005, 15: 357-362. DOI:10.1016/j.bmcl.2004.10.068 |
| [17] |
Miles PD, Barak Y, He W, et al. Improved insulin-sensitivity in mice heterozygous for PPAR-gamma deficiency[J]. J Clin Invest, 2000, 105: 287-292. DOI:10.1172/JCI8538 |
| [18] |
Yamauchi T, Kamon J, Waki H, et al. The mechanisms by which both heterozygous peroxisome proliferator-activated receptor gamma(PPARgamma)deficiency and PPARgamma agonist improve insulin resistance[J]. J Biol Chem, 2001, 276: 41245-41254. DOI:10.1074/jbc.M103241200 |
| [19] |
Miles PD, Barak Y, Evans RM, et al. Effect of heterozygous PPARgamma deficiency and TZD treatment on insulin resistance associated with age and high-fat feeding[J]. Am J Physiol Endocrinol Metab, 2003, 284: E618-E626. DOI:10.1152/ajpendo.00312.2002 |
| [20] |
Kubota N, Terauchi Y, Miki H, et al. PPAR gamma mediates high-fat diet-induced adipocyte hypertrophy and insulin resistance[J]. Mol Cell, 1999, 4: 597-609. DOI:10.1016/S1097-2765(00)80210-5 |
| [21] |
Wright HM, Clish CB, Mikami T, et al. A synthetic antagonist for the peroxisome proliferator-activated receptor gamma inhibits adipocyte differentiation[J]. J Biol Chem, 2000, 275: 1873-1877. DOI:10.1074/jbc.275.3.1873 |
| [22] |
Rieusset J, Touri F, Michalik L, et al. A new selective peroxisome proliferator-activated receptor gamma antagonist with antiobesity and antidiabetic activity[J]. Mol Endocrinol, 2002, 16: 2628-2644. DOI:10.1210/me.2002-0036 |
| [23] |
Choi JH, Banks AS, Estall JL, et al. Anti-diabetic drugs inhibit obesity-linked phosphorylation of PPARgamma by Cdk5[J]. Nature, 2010, 466: 451-456. DOI:10.1038/nature09291 |
| [24] |
Choi JH, Banks AS, Kamenecka TM, et al. Antidiabetic actions of a non-agonist PPARgamma ligand blocking Cdk5-mediated phosphorylation[J]. Nature, 2011, 477: 477-481. DOI:10.1038/nature10383 |
| [25] |
Kamenecka TM, Busby SA, Kumar N, et al. Potent Anti-Diabetic Actions of A Novel Non-agonist PPARgamma Ligand That Blocks Cdk5-mediated Phosphorylation[R]. Bethesda: NIH Molecular Libraries Program, 2010.
|
| [26] |
Li P, Fan W, Xu J, et al. Adipocyte NCoR knockout decreases PPARgamma phosphorylation and enhances PPARgamma activity and insulin sensitivity[J]. Cell, 2011, 147: 815-826. DOI:10.1016/j.cell.2011.09.050 |
| [27] |
Brown KK, Henke BR, Blanchard SG, et al. A novel N-aryl tyrosine activator of peroxisome proliferator-activated receptorgamma reverses the diabetic phenotype of the Zucker diabetic fatty rat[J]. Diabetes, 1999, 48: 1415-1424. DOI:10.2337/diabetes.48.7.1415 |
| [28] |
Gregoire FM, Zhang F, Clarke HJ, et al. MBX-102/JNJ39659100, a novel peroxisome proliferator-activated receptor-ligand with weak transactivation activity retains antidiabetic properties in the absence of weight gain and edema[J]. Mol Endocrinol, 2009, 23: 975-988. DOI:10.1210/me.2008-0473 |
| [29] |
Chandalia A, Clarke HJ, Clemens LE, et al. MBX-102/JNJ39659100, a novel non-TZD selective partial PPAR-gamma agonist lowers triglyceride independently of PPAR-alpha activation[J]. PPAR Res, 2009, 2009: 706852. |
| [30] |
Kintscher U, Goebel M. INT-131, a PPARgamma agonist for the treatment of type 2 diabetes[J]. Curr Opin Investig Drugs, 2009, 10: 381-387. |
| [31] |
Motani A, Wang Z, Weiszmann J, et al. INT131: a selective modulator of PPAR gamma[J]. J Mol Biol, 2009, 386: 1301-1311. DOI:10.1016/j.jmb.2009.01.025 |
| [32] |
Dunn FL, Higgins LS, Fredrickson J, et al. Selective modulation of PPARgamma activity can lower plasma glucose without typical thiazolidinedione side-effects in patients with type 2 diabetes[J]. J Diabetes Complicat, 2011, 25: 151-158. DOI:10.1016/j.jdiacomp.2010.06.006 |
| [33] |
DePaoli AM, Higgins LS, Henry RR, et al. Can a selective PPARgamma modulator improve glycemic control in patients with type 2 diabetes with fewer side effects compared with pioglitazone?[J]. Diabetes Care, 2014, 37: 1918-1923. DOI:10.2337/dc13-2480 |
| [34] |
Frkic RL, He Y, Rodriguez BB, et al. Structure-activity relationship of 2,4-dichloro-N-(3,5-dichloro-4-(quinolin-3-yloxy)phenyl)benzenesulfonamide(INT131)analogs for PPARgamma-targeted antidiabetics[J]. J Med Chem, 2017, 60: 4584-4593. DOI:10.1021/acs.jmedchem.6b01727 |
| [35] |
Bolten CW, Blanner PM, McDonald WG, et al. Insulin sensitizing pharmacology of thiazolidinediones correlates with mitochondrial gene expression rather than activation of PPAR gamma[J]. Gene Regul Syst Biol, 2007, 1: 73-82. |
| [36] |
Poiley J, Steinberg AS, Choi YJ, et al. A randomized, doubleblind, active-and placebo-controlled efficacy and safety study of arhalofenate for reducing flare in patients with gout[J]. Arthritis Rheumatol, 2016, 68: 2027-2034. DOI:10.1002/art.39684 |
| [37] |
McWherter C, Choi YJ, Serrano RL, et al. Arhalofenate acid inhibits monosodium urate crystal-induced inflammatory responses through activation of AMP-activated protein kinase(AMPK)signaling[J]. Arthritis Res Ther, 2018, 20: 204. DOI:10.1186/s13075-018-1699-4 |
| [38] |
Marciano DP, Kuruvilla DS, Boregowda SV, et al. Pharmacological repression of PPARgamma promotes osteogenesis[J]. Nat Commun, 2015, 6: 7443. DOI:10.1038/ncomms8443 |
| [39] |
da Costa Leite LF, Veras Mourao RH, de Lima Mdo C, et al. Synthesis, biological evaluation and molecular modeling studies of arylidene-thiazolidinediones with potential hypoglycemic and hypolipidemic activities[J]. Eur J Med Chem, 2007, 42: 1263-1271. DOI:10.1016/j.ejmech.2007.02.015 |
| [40] |
Amato AA, Rajagopalan S, Lin JZ, et al. GQ-16, a novel peroxisome proliferator-activated receptor gamma(PPARgamma)ligand, promotes insulin sensitization without weight gain[J]. J Biol Chem, 2012, 287: 28169-28179. DOI:10.1074/jbc.M111.332106 |
| [41] |
Weidner C, de Groot JC, Prasad A, et al. Amorfrutins are potent antidiabetic dietary natural products[J]. Proc Natl Acad Sci U S A, 2012, 109: 7257-7262. DOI:10.1073/pnas.1116971109 |
| [42] |
Weidner C, Wowro SJ, Freiwald A, et al. Amorfrutin B is an efficient natural peroxisome proliferator-activated receptor gamma(PPARgamma)agonist with potent glucose-lowering properties[J]. Diabetologia, 2013, 56: 1802-1812. DOI:10.1007/s00125-013-2920-2 |
| [43] |
Shi H, Ma J, Mi C, et al. Amorfrutin A inhibits TNF-alphainduced NF-kappaB activation and NF-kappaB-regulated target gene products[J]. Int Immunopharmacol, 2014, 21: 56-62. DOI:10.1016/j.intimp.2014.04.016 |
| [44] |
Lavecchia A, Di Giovanni C. Amorfrutins are efficient modulators of peroxisome proliferator-activated receptor gamma(PPARgamma)with potent antidiabetic and anticancer properties: a patent evaluation of WO2014177593 A1[J]. Expert Opin Ther Pat, 2015, 25: 1341-1347. |
| [45] |
Colca JR, McDonald WG, Adams WJ. MSDC-0602K, a metabolic modulator directed at the core pathology of non-alcoholic steatohepatitis[J]. Expert Opin Investig Drugs, 2018, 27: 631-636. DOI:10.1080/13543784.2018.1494153 |
| [46] |
Chen Z, Vigueira PA, Chambers KT, et al. Insulin resistance and metabolic derangements in obese mice are ameliorated by a novel peroxisome proliferator-activated receptor gamma-sparing thiazolidinedione[J]. J Biol Chem, 2012, 287: 23537-23548. DOI:10.1074/jbc.M112.363960 |
| [47] |
Colca JR, VanderLugt JT, Adams WJ, et al. Clinical proof-ofconcept study with MSDC-0160, a prototype mTOT-modulating insulin sensitizer[J]. Clin Pharmacol Ther, 2013, 93: 352-359. DOI:10.1038/clpt.2013.10 |
| [48] |
Ahmadian M, Suh JM, Hah N, et al. PPARgamma signaling and metabolism: the good, the bad and the future[J]. Nat Med, 2013, 19: 557-566. DOI:10.1038/nm.3159 |
| [49] |
Nettles KW. Insights into PPARgamma from structures with endogenous and covalently bound ligands[J]. Nat Struct Mol Biol, 2008, 15: 893-895. DOI:10.1038/nsmb0908-893 |
| [50] |
Sharabi K, Lin H, Tavares CDJ, et al. Selective chemical inhibition of PGC-1alpha gluconeogenic activity ameliorates type 2 diabetes[J]. Cell, 2017, 169: 148-160.e15. DOI:10.1016/j.cell.2017.03.001 |
| [51] |
Kolli V, Stechschulte LA, Dowling AR, et al. Partial agonist, telmisartan, maintains PPARgamma serine 112 phosphorylation, and does not affect osteoblast differentiation and bone mass[J]. PLoS One, 2014, 9: e96323. DOI:10.1371/journal.pone.0096323 |
| [52] |
Colca JR, McDonald WG, Cavey GS, et al. Identification of a mitochondrial target of thiazolidinedione insulin sensitizers(mTOT)--relationship to newly identified mitochondrial pyruvate carrier proteins[J]. PLoS One, 2013, 8: e61551. DOI:10.1371/journal.pone.0061551 |
| [53] |
Yu R, Zhou YL, Huan Y, et al. Design, synthesis, and PPARalpha/gamma agonistic activity of novel tetrahydroisoquinoline derivatives[J]. Acta Pharm Sin(药学学报), 2011, 46: 311-316. |
| [54] |
Peng K, Huan Y, Liu Q, et al. Design, synthesis and antidiabetic activity of novel tetrahydrocarboline PPAR regulators[J]. Acta Pharm Sin(药学学报), 2014, 49: 490-496. |
| [55] |
Huan Y, Pan X, Peng J, et al. A novel specific peroxisome proliferator-activated receptor γ (PPARγ)modulator YR4-42 ameliorates hyperglycaemia and dyslipidaemia and hepatic steatosis in diet-induced obese mice[J]. Diabetes Obes Metab, 2019, 21: 2553-2563. DOI:10.1111/dom.13843 |
| [56] |
Lam VQ, Zheng J, Griffin PR. Unique interactome network signatures for peroxisome proliferator-activated receptor gamma(PPARgamma)modulation by functional selective ligands[J]. Mol Cell Proteomics, 2017, 16: 2098-2110. DOI:10.1074/mcp.RA117.000308 |
| [57] |
Huan Y, Peng J, Wang Y, et al. Establishment and application of screening methods for non-agonist PPARγ ligand[J]. Acta Pharm Sin(药学学报), 2014, 49: 1658-1664. |
| [58] |
Zheng Y, Huan Y, Liu SX, et al. PPARγ non-agonist ligand: the structure optimization based on PPARγ partial agonist[J]. Acta Pharm Sin(药学学报), 2017, 52: 1424-1431. |
| [59] |
Mirza AZ, Althagafi II, Shamshad H. Role of PPAR receptor in different diseases and their ligands: physiological importance and clinical implications[J]. Eur J Med Chem, 2019, 166: 502-513. DOI:10.1016/j.ejmech.2019.01.067 |
| [60] |
Wang J, Cheng H, Sun X, et al. Research advances in peroxisome proliferator-activated receptor γ and related diseases[J]. China Modern Med(中国当代医药), 2019, 26: 30-32,36. |
| [61] |
Wen S, Su YP. Advances in research on PPARγ and antitumor effects[J]. World Latest Med Inf(世界最新医学信息文摘), 2019, 19: 100-101. |
| [62] |
Shah RC, Matthews DC, Andrews RD, et al. An evaluation of MSDC-0160, a prototype mTOT modulating insulin sensitizer, in patients with mild Alzheimer's disease[J]. Curr Alzheimer Res, 2014, 11: 564-573. DOI:10.2174/1567205011666140616113406 |
| [63] |
Camejo G. Selective PPAR modulators(SPPARs)may fill the need for treatment of the atherogenic dyslipidemia of insulin resistance and type 2 diabetes: can they reduce the associated cardiac risk?[J]. Atherosclerosis, 2016, 249: 224-225. DOI:10.1016/j.atherosclerosis.2016.03.026 |
| [64] |
Olefsky JM, Glass CK. Macrophages, inflammation, and insulin resistance[J]. Annu Rev Physiol, 2010, 72: 219-246. DOI:10.1146/annurev-physiol-021909-135846 |
| [65] |
Panigrahy D, Huang S, Kieran MW, et al. PPARgamma as a therapeutic target for tumor angiogenesis and metastasis[J]. Cancer Biol Ther, 2005, 4: 687-693. DOI:10.4161/cbt.4.7.2014 |
 2021, Vol. 56
2021, Vol. 56