2. 中国中医科学院中药资源中心道地药材国家重点实验室培育基地, 北京 100700
2. State Key Laboratory Breeding Base of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
鼠李糖是自然界中广泛分布的6-脱氧己糖, 是植物细胞壁的果胶多糖成分[1]。含鼠李糖多糖的细胞壁对于维管植物的生长和发育具有重要的作用[2]。尿苷二磷酸鼠李糖(UDP-Rha)可作为糖供体与小分子化合物糖基化生成次生代谢产物鼠李糖苷。而鼠李糖苷的生成在一定程度上可增加苷元的溶解度, 其生物活性也发生一定的变化。例如, 槲皮素3-O-鼠李糖苷对流感病毒复制具有阻断作用[3]; 杨梅素-3-O-β-鼠李糖苷可促进成纤维细胞迁移, 并加速植物伤口愈合[4], 可见鼠李糖糖基化产物具有多种生物活性。植物中的鼠李糖合成酶(RHM)可直接将胞浆中的UDP-Glc转化成UDP-Rha, 该酶兼具UG4, 6-Dh、UDP-4K6DG 3, 5-差向异构酶和UDP-4KR 4-酮-还原酶3种酶的功能[2], 其氨基酸序列存在NADP(H)结合位点(GxxGxxG/A)和类似Rml D酶结构的活性中心(YxxxK)[5]。
欧洲花楸(Sorbus aucuparia L.)为蔷薇科(Rosaceae)苹果亚科(Pyrinae)花楸属植物, 原产于欧洲和亚洲西部, 分布于我国北方部分地区[6]。其果实、枝叶及茎皮皆可入药, 富含抗坏血酸、酚类化合物、有机酸及糖, 具有抗炎、抗糖尿病和抗氧化等作用[7]。欧洲花楸悬浮细胞体系对外界胁迫具有较好的响应作用。据报道, 欧洲花楸悬浮细胞在酵母提取物(yeast extract, YE)诱导下可产生新的次生代谢产物, 包括欧花楸素、3-羟基-5-甲氧基联苯和2'-羟基欧花楸素等联苯类化合物[8, 9], 其对苹果和梨等植物中破坏性较强的火疫病的致病菌(欧文氏菌Erwinia amylovora)有一定的抑制作用[10], 被称为苹果亚科植物植保素。研究发现, 联苯糖苷可能是苹果亚科植物应对外界胁迫的重要物质[11, 12]。但目前对联苯糖苷及其活性的报道较少, 为探索更多类型的联苯糖苷, 本研究从寻找糖基供体入手, 为后续进一步利用生物合成的方法合成联苯糖苷提供分子基础。课题组前期利用YE诱导欧洲花楸悬浮细胞, 并进行了转录组测序。本研究基于转录组数据筛选并克隆了2条SaRHMs, 为后续联苯鼠李糖苷的生物合成提供鼠李糖供体。
材料与方法材料 欧洲花楸悬浮细胞系由中国科学院植物研究所叶和春研究员赠送, 置于25 ℃培养箱中暗培养, 转速为120 r·min-1, 每14天继代1次。5810R型低温冷冻离心机(Eppendorf, 德国), Nano Drop2000分光光度计(Thermo Fisher Scientific, 美国), 紫外凝胶成像分析仪(Gene, 中国), MM400冷冻混合研磨仪(Retsch, 德国)。高效液相色谱串联质谱仪(Waters Acquity I-Class UPLCTM串联Waters Zevo G2-S Q-TOF MS)(Waters, 美国), 色谱柱为: BEH Amide色谱柱(2.1 mm×100 mm, 1.7 μm)。液相色谱仪: Waters Acquity H-Class UPLCTM超高效液相色谱仪(Waters, 美国)。
特异性引物由北京睿博兴科生物技术有限公司合成, KOD-Plus-Neo高保真酶购自东洋纺(上海)生物科技有限公司, 2×TSINGKE Master Mix购自北京擎科新业生物技术有限公司, Power SYBR Geen PCR Master Mix、BamI/NotI-HF/ScaI/EcoRI限制性内切酶购自New England Biolabs公司, T4-DNA连接酶、β-巯基乙醇、异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside, IPTG)、还原型辅酶Ⅰ(NADH)、还原型辅酶Ⅱ(NADPH)和尿苷二磷酸葡萄糖(UDP-Glc)均购自北京江晨生物技术公司。Ni-琼脂糖树脂柱(Ni-Agarose Resin)购自康为世纪生物科技有限公司。质粒小提试剂盒、胶回收纯化试剂盒、植物总RNA提取试剂盒、大肠杆菌Trans1-T1和大肠杆菌Transetta (DE3)均购自北京全式金生物技术有限公司。
总RNA提取及cDNA合成 欧洲花楸悬浮细胞培养5 d后给予YE诱导, 终浓度为3 g·L-1。诱导时间设定为0、4、8、12、24 h。收取样品用液氮速冻后, 置于-80 ℃冰箱保存。按照植物总RNA提取试剂盒说明书提取总RNA, 用1.5%的琼脂糖凝胶电泳检测RNA的完整性, 将质量合格的RNA用反转录试剂盒获得cDNA, 用于本实验研究的基因克隆。
基因克隆与载体构建 参考欧洲花楸悬浮细胞转录组数据结合NCBI (http://www.ncbi.nlm.nih.gov/)BLAST, 获得鼠李糖合成酶RHM基因序列和开放阅读框(open reading frame, ORF), 设计cDNA全长克隆引物(表 1)。根据KOD-Plus-Neo高保真酶说明书配制PCR体系: ddH2O 32 μL、10×PCR Buffer for KOD-Plus-Neo5 μL、2 mmol·L-1d NTPs 5 μL、25 mmol·L-1MgSO4 3 μL、正反向引物各2.5 μL、cDNA 1 μL和KOD-PlusNeo 1 μL。反应程序: 94 ℃ 2 min; 98 ℃ 10 s, 55 ℃ 30 s, 72 ℃ 30 s, 重复35个循环; 72 ℃ 5 min, 分别用BamI/Not I-HF和ScaI/EcoRI两对限制性内切酶双酶切PCR反应产物, 反应体系如下: ddH2O 21 μL、NE Buffer 5 μL、pET28a载体13 μL和限制性内切酶各1 μL, 37 ℃ 5 h。蛋白表达载体pET28a同时进行酶切反应。将酶切产物纯化后, 按T4-DNA连接酶说明书将目的片段与载体连接, 并转化至大肠杆菌Trans1-T1克隆感受态细胞中, 涂布在含有50 mg·L-1Kan的LB固体培养基上过夜培养, 选取单克隆进行菌液PCR, 并将阳性结果送公司测序验证。将获得的重组质粒pET28a-SaRHM1和pET28a-SaRHM2, 分别转化至大肠杆菌Transetta(DE3)表达感受态细胞中, 涂布在含有50 mg·L-1Kan的LB固体培养基上过夜培养, 选取单克隆进行菌液PCR, 并将阳性结果送公司测序验证。
欧洲花楸SaRHMs的生物信息学分析 将测序得到的序列通过Inter Pro在线软件(http://www.ebi.ac.uk/Tools/InterProScan)进行结构域分析。通过Ex PASy Prot Param tool (http://web.expasy.org/protparam/)预测蛋白分子质量和理论等电点。根据NCBI BLAST结果下载同源序列, 分别使用DNAMAN软件和MEGA 5.0软件进行多重序列比对和系统进化树的构建。Signal P4.1 (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析。TRMHMM server v2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)进行跨膜域分析。Predict Protein(https://www.predictprotein.org/)进行二级结构预测和二级结构分析。
SaRHMs重组蛋白表达及纯化 将保存的菌液扩大培养于100 mL含有50 mg·L-1 Kan的LB液体培养基中, 37 ℃ 250 r·min-1摇到A600约0.6, 加入异丙基硫代半乳糖苷(IPTG)至终浓度0.4 mmol·L-1, 16 ℃、200 r·min-1诱导12 h。将诱导完的菌液4 ℃、8 000 r·min-1离心5 min收集菌体, 用ddH2O清洗2次, 最后用10 mL磷酸盐缓冲液(pH 7.4)重悬菌体。将重悬菌液置于冰中, 用超声波细胞破碎机超声破碎(30%功率, 超声5 s, 间隔5 s, 持续5 min), 破碎后4 ℃、12 000 r·min-1离心15 min, 上清即为蛋白粗提物。
按照Ni-Agarose Resin说明书, 将Ni-Agarose Resin填料混匀后加入色谱柱, 室温静置10 min, 将保存液乙醇放出, 用5倍柱体积的去离子水洗净乙醇, 再用10倍柱体积的磷酸盐缓冲液平衡镍柱后上样, 控制流速为每小时10倍柱体积, 用10倍柱体积的20 mmol·L-1咪唑的磷酸盐缓冲液洗脱杂蛋白, 用200 mmol·L-1咪唑的磷酸盐缓冲液洗脱SaRHM1和SaRHM2蛋白, 最后依次用5倍柱体积500 mmol·L-1咪唑的磷酸盐缓冲液、磷酸盐缓冲液和ddH2O洗涤镍柱, 最后用20%乙醇封存镍柱于4 ℃冰箱。将含SaRHM1和SaRHM2蛋白的流分通过10 kD超滤管进行脱盐浓缩, 以牛血清蛋白作标准用Bradford方法(Bio-Rad Protein Assay Kit)测浓度, 并进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳检测。
SaRHMs重组蛋白酶促反应检测 酶促反应体系: 总体系200 μL, 包含SaRHM1和SaRHM2蛋白20μg、1.25 mmol·L-1 NADPH、1.25 mmol·L-1 NADH、1 mmol·L-1 UDP-Glc、20 mmol·L-1磷酸盐缓冲液(pH 7.5)[13]。以未连接目的基因的pET28a空载表达蛋白作为对照组。将反应混合物在40 ℃下孵育1 h后, 加甲醇400 μL终止反应, 充分振荡, 12 000 r·min-1离心10 min, 取上清液经0.22 μm微孔滤膜滤过, 取续滤液于UPLC-Q-TOF-MS进行检测。液相检测条件为: 流动相: 25 mmol·L-195%乙酸铵-乙腈(pH 5.5)(A)-乙腈(B); 梯度洗脱: 0~0.5 min, 70% B; 0.5~3.5 min, 70%~60% B; 3.5~6.5 min, 60% B; 6.5~8.0 min, 60%~55% B; 8.0~9.0 min, 55% B; 9.0~9.5 min, 55%~70% B; 流速: 0.2 mL·min-1, 柱温: 40 ℃, 进样量: 1.0 μL。质谱检测条件: 离子化模式为负离子, 毛细管电压为2 500 V, 锥孔电压为30 V, 除溶剂气体为氮气, 900 L·h-1, 除溶剂温度为450 ℃, 离子源温度为100 ℃, 扫描范围为m/z 50~1 400, 碰撞气体为氩气。低能量扫描时trap电压为6 e V, 高能量扫描时trap电压为35~65 e V。准确质量数用亮氨酸脑啡肽(leucine enkephalin)作校正液。
SaRHMs重组蛋白酶促动力学分析 为确定两种纯化重组蛋白催化的最佳pH和最佳温度, 依次设置不同pH梯度及温度梯度。每个SaRHMs反应混合物的总体积为200 μL, 包含20μg纯化的SaRHM蛋白、1.25 mmol·L-1 NADPH、1.25 mmol·L-1 NADH、1 mmol·L-1 UDP-Glc, 缓冲液分别为20 mmol·L-1酸柠檬酸钠缓冲液(pH 5~7)、20 mmol·L-1磷酸盐缓冲液(pH 7~9)和20 mmol·L-1 Tris-HCl缓冲液(pH 7~10), 反应温度分别设置为10、20、30、40、50和60℃, 孵育1 h。通过热处理(100 ℃) 10 min终止反应, 每个反应重复3次。将混合物以12 000 r·min-1离心20 min, 取上清液于高效液相色谱进行检测, 计算反应物UDP-Glc剩余量[7]。使用Graphpad Prism 6.02软件计算动力学值。
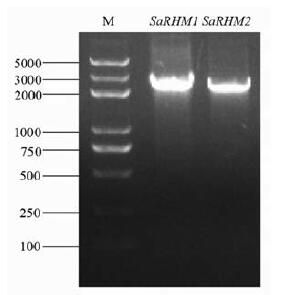
结果与讨论 1 SaRHMs基因cDNA的克隆以欧洲花楸悬浮细胞cDNA为模板进行PCR扩增, 产物经琼脂糖凝胶电泳检测, 在2 000 bp附近有明亮条带(图 1), 与预期目的条带大小一致。测序结果表明, SaRHM1的ORF大小为2 007 bp, 编码668个氨基酸; SaRHM2的ORF大小为2 040 bp, 编码679个氨基酸。
|
Figure 1 Agarose gel electrophoresis of the full-length cDNA of SaRHM1 and SaRHM2 |
SaRHM1和SaRHM2蛋白的分子质量分别为75.25和76.26 kD, 理论等电点分别为7.24和6.41;信号肽分析显示无信号肽; 跨膜域分析结果表明其为非膜蛋白, 无分泌蛋白。结构域分析表明: SaRHMs的N端区域(SaRHM1:10~315 aa; SaRHM2:11~316 aa)含有NADP(H)结合位点, 而C端区域(SaRHM1:385~557 aa; SaRHM2:389~561 aa)含有类似Rml D酶结构的活性中心, 表明这两个基因可能均具有将UDP-Glc转化为UDP-Rha的生物活性。二级结构预测结果显示: 无规则卷曲和α-螺旋结构是SaRHM1主要结构元件, 无规则卷曲占51.35%、α-螺旋结构占33.68%;无规则卷曲和α-螺旋结构是SaRHM2主要结构元件, 无规则卷曲占54.64%、α-螺旋结构占30.34%。
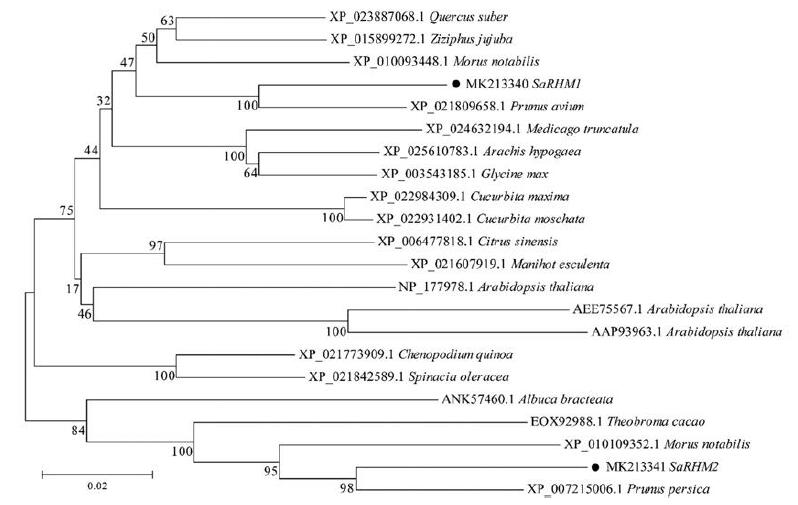
4 同源性比对及系统进化树分析BLASTP对比结果显示SaRHM1和SaRHM2与NCBI基因库的同源性达80%, 包括桃Prunus persica PpRHM (XP_007215006.1)、川桑Morus notabilis MnRHM1和MnRHM2 (XP_010109352.1和XP_010093448.1)、可可Theobroma cacao TcRHM (EOX92988.1)、虎眼万年青Albuca bracteata AbRHM (ANK57460.1)、欧洲栓皮栎Quercus suber QsRHM (XP_023887068.1)、枣Ziziphus jujuba ZjRHM (XP_015899272.1)、欧洲甜樱桃Prunus avium PaRHM (XP_021809658.1), 该结果说明RHM蛋白氨基酸序列在系统进化上有高度的保守性。将它们与SaRHM1和SaRHM2氨基酸序列进行多重序列比对, 发现SaRHM1和SaRHM2均存在GxxGxxG/A基序和YxxxK基序, 该基序为SaRHM1和SaRHM2蛋白的功能结构域[7] (图 2)。比对结果暗示, SaRHM1和SaRHM2可能均为一种多功能性酶, 该酶可通过中间体UDP-4-酮-6-脱氧葡萄糖和UDP-4-酮-鼠李糖将UDP-Glc生成UDP-Rha[14]。为了进一步研究SaRHM1和SaRHM2蛋白的功能, 在NCBI中下载完整RHM蛋白的氨基酸序列, 利用MEGA 6.0软件构建系统进化树(图 3)。结果发现, SaRHM1与欧洲栓皮栎(XP_023887068.1)、枣(XP_015899272.1)、川桑(XP_010093448.1) 和欧洲甜樱桃(XP_021809658.1) 聚为一支, 与欧洲甜樱桃的亲缘关系最近; SaRHM2与可可(EOX92988.1)、川桑(XP_010109352.1) 和桃(XP_007215006.1) 聚为一支, 与桃的亲缘关系最近。

|
Figure 2 Multiple sequence alignment of SaRHMs and RHM proteins from other plants |
|
Figure 3 Phylogenetic analysis of RHM proteins.Amino acid sequences were analyzed using the clustal X2 program and the bootstrapconsensus tree was constructed using MEGA 6.0 software with the neighbor-joining method and 1 000 bootstrapreplicates.Black circles indicate SaRHMs |
诱导表达的SaRHM1和SaRHM2蛋白经纯化后的SDS-PAGE扫描结果(图 4)表明, 在IPTG诱导大肠杆菌Transetta (DE3)表达后, 重组蛋白pET28a-SaRHM1和pET28a-SaRHM2在近70 kD处有蛋白条带, 与预测的蛋白大小基本一致, 说明欧洲花楸鼠李糖合成酶基因SaRHM1和SaRHM2均在大肠杆菌Transetta (DE3)中成功表达。

|
Figure 4 SDS-PAGE analysis of recombinant protein of SaRHM1and SaRHM2 protein purification |
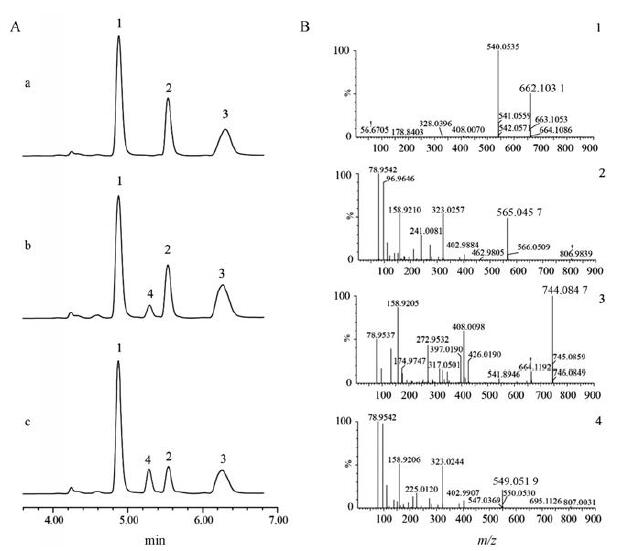
使用UPLC-Q-TOF-MS对酶促反应进行分析。对照组与实验组的基峰离子比较色谱图见图 5A, 其中图 5A-a为对照组, 图 5A-b为SaRHM1酶促反应实验组, 图 5A-c为SaRHM2酶促反应实验组, 图 5B-1、5B-2和5B-3分别为峰1、2、3的二级质谱图。通过质谱图可知, 峰1为NADH (m/z 662.103 1[M-H]-)、峰2为UDP-Glc(m/z 565.045 7[M-H]-)[7]、峰3为NADPH (m/z 744.084 7[M-H]-)。由图 5A-a可知, 对照组中未出现新的产物峰, 说明空载不能催化UDP-Glc生成UDP-Rha; 与对照组相比, 图 5A-b和图 5A-c均在5.28 min出现了新的产物峰(峰4)。质谱图(图 5B-4)显示峰4的质核比m/z为549.051 9[M-H]-, 由此得出产物为UDP-Rha (相对分子质量为550), 即SaRHM1和SaRHM2蛋白均具有鼠李糖合成酶的功能。
|
Figure 5 UPLC-Q-TOF-MS analyses of the reaction products from UDP-Glc catalyzed by the SaRHMs.(5A-a: Reaction products of empty plasmid with UDP-Glc as a substrate; 5A-b: Reaction products of SaRHM1 with UDP-Glc as a substrate; 5A-c: Reaction products of SaRHM2with UDP-Glc as a substrate; 5B-1:MS analysis of NADH; 5B-2:MS analysis of UDP-Glc; 5B-3:MS analysis of NADPH; 5B-4:MS analysis of reaction product) |
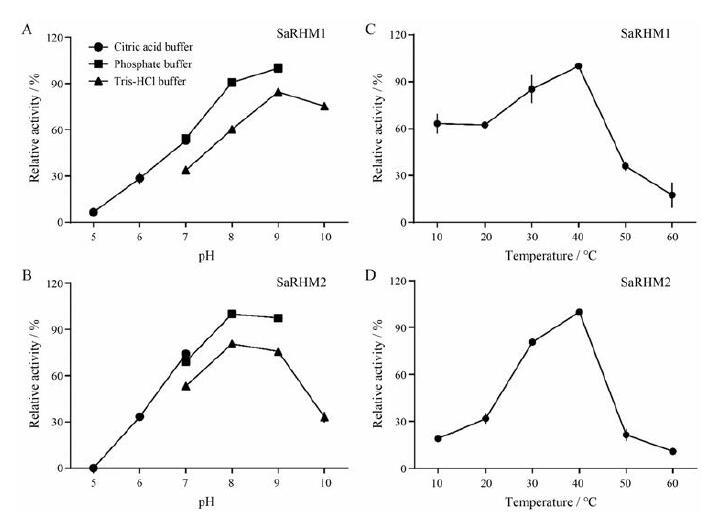
为进一步对两种SaRHMs蛋白的生物学特性进行表征, 以底物UDP-Glc含量测量酶活性, 获得了最佳pH、最佳温度和动力学参数。结果表明, SaRHM1在pH 9时显示最大活性, 而SaRHM2在pH 8时显示最大活性, 最佳温度均为40 ℃ (图 6)。利用Michaelis-Menten方程确定SaRHMs的Km值和Vmax值(图 7)。SaRHM1和SaRHM2的Km值分别为212.4±56.70和361.0±63.74 μmol·L-1; Vmax值分别为235.5±18.98和516.5±22.30 nmol·min-1·μg-1。
|
Figure 6 Effect of pH (A and B) and temperature (C and D) on SaRHM1 and SaRHM2 activity |

|
Figure 7 Determination of Michaelis constant of recombinant protein of SaRHM1 (A) and SaRHM2 (B).Data are the means of three replicate analyses±standard error |
UDP-Rha是植物细胞壁果胶多糖(鼠李半乳糖醛酸聚糖-Ⅰ和鼠李半乳糖醛酸聚糖-Ⅱ)及各种鼠李糖苷类次生代谢产物生物合成所必需的重要组分。因此, UDP-Rha对于植物的生长发育及天然鼠李糖苷类次生代谢产物的合成具有重要的作用。研究显示, 鼠李糖苷类次生代谢物具有广泛的生物活性, 如抗炎[15]、抗病毒[16]、抗氧化[17]、抗癌[18]等作用。在植物中, UDP-Rha的生物合成是由一个三功能酶(RHM)通过3步连续催化反应完成[5]。目前, 已从拟南芥[2]、玉米[19]等植物中克隆鉴定出相应的RHM基因, 而对药用植物中的RHM基因研究相对较少。Liu等[20]首次从我国传统中药何首乌中成功克隆出2条FmRHMs, 并通过体外酶促反应证实了FmRHM1和FmRHM2均具有将UDP-葡萄糖转化为UDP-鼠李糖的功能。
本研究首次从欧洲花楸中克隆获得2个RHM基因(SaRHM1和SaRHM2)全长, 并对其进行了生物信息学分析。多重序列比对分析显示SaRHM1和SaRHM2均存在GxxGxxG/A和YxxxK两种基序, 暗示着SaRHM1和SaRHM2具有将UDP-Glc转化成UDP-Rha的潜在能力。通过构建原核表达载体, 诱导重组蛋白的表达, 利用纯化后的重组蛋白进行体外酶促反应, 结果进一步证实了SaRHM1和SaRHM2蛋白具有催化合成UDP-Rha的功能。为了进一步研究在体外具有催化功能的2个RHM的生化特性, 本文对SaRHM1和SaRHM2进行了酶促动力参数测定, 测定结果显示尽管SaRHM1和SaRHM2均具有将UDP-Glc转化成UDP-Rha的功能, 但是两者的催化能力存在一定的差异。
课题组前期研究显示, 欧洲花楸悬浮细胞在YE的诱导下可产生联苯和二苯并呋喃类植保素, 其中包含鼠李糖苷化合物。在此条件下, 本文克隆得到2条SaRHMs基因, 这说明UDP-Rha的生物合成将为下一步鼠李糖苷类植保素的生物合成奠定物质基础。苹果亚科植物在受到细菌或真菌感染后能够产生具有抗菌活性的联苯和二苯并呋喃类植保素, 如2'-羟基欧花楸素、异欧花楸素等, 但目前关于植保素糖苷的抗菌活性研究相对甚少。因此, 本研究从植保素糖苷的糖供体入手, 寻找可以合成UDP-Rha的关键酶基因, 为获得具有较强抗菌活性的植保素糖苷提供UDP-Rha糖供体。
作者贡献:周良云和郭兰萍设计本研究内容; 周良云和李佳兴提供实验数据; 周良云撰写文章; 杨健、王升和吕朝耕负责部分数据分析及文章修改; 郭兰萍提供项目资助。
利益冲突:所有作者没有利益冲突。
| [1] |
Caffall KH, Mohnen D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides[J]. Carbohydr Res, 2009, 344: 1879-1900. DOI:10.1016/j.carres.2009.05.021 |
| [2] |
Oka T, Nemoto T, Jigami Y. Functional analysis of Arabidopsis thaliana RHM2/MUM4, a multidomain protein involved in UDP-D-glucose to UDP-L-rhamnose conversion[J]. J Biol Chem, 2007, 282: 5389-5403. DOI:10.1074/jbc.M610196200 |
| [3] |
Choi HJ, Song JH, Kwon DH. Quercetin 3-rhamnoside exerts antiinfluenza A virus activity in mice[J]. Phytother Res, 2012, 26: 462-464. DOI:10.1002/ptr.3529 |
| [4] |
Sara M, Samad E, Peyman S, et al. Wound healing potential of chlorogenic acid and myricetin-3-O-β-rhamnoside isolated from Parrotia persica[J]. Molecules, 2017, 22: 1501. DOI:10.3390/molecules22091501 |
| [5] |
Yin S, Liu M, Kong JQ. Functional analyses of OcRhS1 and OcUER1 involved in UDP-L-rhamnose biosynthesis in Ornithogalum caudatum[J]. Plant Physiol Biochem, 2016, 109: 536-548. DOI:10.1016/j.plaphy.2016.10.029 |
| [6] |
Chinese Academy of Sciences Chinese Flora Editorial Committee. Chinese Flora(中国植物志)[M]. Vol 36. Beijing: Science and Technology Press, 1974: 284
|
| [7] |
Yang XD, Yu XJ, Lu CY, et al. Research progress on main chemical constituents and pharmacological effects of Sorbus aucuparia[J]. J Mod Med Health(现代医药卫生), 2020, 36: 850-852. |
| [8] |
Liu B, Beuerle T, Beerhues KL. Biphenyl synthase from yeastextract-treated cell cultures of Sorbus aucuparia[J]. Planta, 2004, 218: 492. DOI:10.1007/s00425-003-1144-y |
| [9] |
Huttner C, Beuerle T, ScharnhopH, et al. Differential effect of elicitors on biphenyl and dibenzofuran formation in Sorbus aucuparia cell cultures[J]. J Agric Food Chem, 2010, 58: 11977-11984. DOI:10.1021/jf1026857 |
| [10] |
Chizzali C, Beerhues L. Phytoalexins of the Pyrinae: biphenyls and dibenzofurans[J]. Beilstein J Org Chem, 2012, 8: 613-620. DOI:10.3762/bjoc.8.68 |
| [11] |
Li JX, Li HL, Zhou LY, et al. Chemical constituents from Sorbus aucuparia cell suspension treated with yeast and their antifungal activity[J]. Nat Prod Res Dev(天然产物研究与开发), 2019, 31: 2071-2076. |
| [12] |
Zhou LY, Yang J, Yang G, et al. Biphenyl phytoalexin in Sorbus pohuashanensis suspension cell induced by yeast extract[J]. Molecules, 2016, 21: 1180. DOI:10.3390/molecules21091180 |
| [13] |
Lim EK, Ashford DA, Bowles DJ. The synthesis of smallmolecule rhamnosides through the rational design of a wholecell biocatalysis system[J]. Chem Bio Chem, 2006, 7: 1181-1184. DOI:10.1002/cbic.200600193 |
| [14] |
Kim BG, Jung WD, Ahn JH. Cloning and characterization of a putative UDP-rhamnose synthase 1 from Populus euramericana Guinier[J]. J Plant Biol, 2013, 56: 7-12. DOI:10.1007/s12374-012-0333-2 |
| [15] |
Lee SH, Ko CI, Ahn G, et al. Molecular characteristics and antiinflammatory activity of the fucoidan extracted from Ecklonia cava[J]. Carbohydr Polymers, 2012, 89: 599-606. DOI:10.1016/j.carbpol.2012.03.056 |
| [16] |
Choi HJ, Kim JH, Lee CH, et al. Antiviral activity of quercetin 7-rhamnoside against porcine epidemic diarrhea virus[J]. Antiviral Res, 2009, 81: 77-81. DOI:10.1016/j.antiviral.2008.10.002 |
| [17] |
Tatsimo SJ, Tamokou JD, Havyarimana L, et al. Antimicrobial and antioxidant activity of kaempferol rhamnoside derivatives from Bryophyllum pinnatum[J]. BMC Res Notes, 2012, 5: 158. DOI:10.1186/1756-0500-5-158 |
| [18] |
Diantini A, Subarnas A, Lestari K, et al. Kaempferol-3-O-rhamnoside isolated from the leaves of Schima wallichii Korth. inhibits MCF-7 breast cancer cell proliferation through activation of the caspase cascade pathway[J]. Oncol Lett, 2012, 3: 1069-1072. DOI:10.3892/ol.2012.596 |
| [19] |
Casas MI, Falcone-Ferreyra ML, Jiang N, et al. Identification and characterization of maize salmon silks genes involved in insecticidal maysin biosynthesis[J]. Plant Cell, 2016, 28: 1297-1309. DOI:10.1105/tpc.16.00003 |
| [20] |
Liu L, Zhou LY, Zhang CR, et al. Cloning and characterization of UDP-L-rhamnose synthase 1/2 from Fallopia multiflora[J]. Acta Pharm Sin(药学学报), 2019, 54: 1515-1523. |
 2021, Vol. 56
2021, Vol. 56


