2. 江苏省中药资源产业化过程协同创新中心, 江苏 南京 210023
2. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing 210023, China
甘草又名甜草、国老, 为豆科甘草属植物甘草Glycyrrhiza uralensis Fisch.、光果甘草Glycyrrhiza glabra L.或胀果甘草Glycyrrhiza inflate Bat.的干燥根及根茎, 具有清热解毒、缓急止痛之功效[1]。现代研究表明, 甘草中富含黄酮、三萜皂苷、多糖等多种活性成分[2-4], 其中皂苷类成分因具有抗炎[5]、抗肝损伤[6]、免疫调节[7]等多种药理作用而备受关注, 是医药工业中重要的原料; 此外, 它们作为一类高效的甜味剂[8], 在食品工业中也有着广泛的应用。目前, 国内外研究者从甘草属植物中已分离得到50多个三萜皂苷化合物, 但针对光果甘草中化学成分的研究尚不深入。本实验开展了光果甘草三萜皂苷类化学成分研究, 从中分离并鉴定了10个皂苷类化合物, 并通过多种波谱技术鉴定了它们的结构, 分别鉴定为3β-O-[β-D-glucuronpyranosyl-(1→2)-β-D-glucuronpyranosyl]-30β-O-β-D-glucuronpyranosyl-oleanane-11-oxo-12(13)-ene (1)、3β-O-[β-D-glucuronpyranosyl-(1→2)-β-D-glucuronpyranosyl]-30β-O-α-L-rhamn-opyranosyl-oleanane-11-oxo-12(13)-en-22β, 30-diol (2)、uralsaponin C (3)、licorice-saponin A3 (4)、licorice-saponin P2 (5)、22β-acetoxyl-glycyrrhizin (6)、macedonoside A (7)、29-hydroxyl-glycyrrhizin (8)、licorice-saponin G2 (9)和glycyrrhizin (10), 其中化合物1和2为两个新三萜皂苷化合物, 结构见图 1。
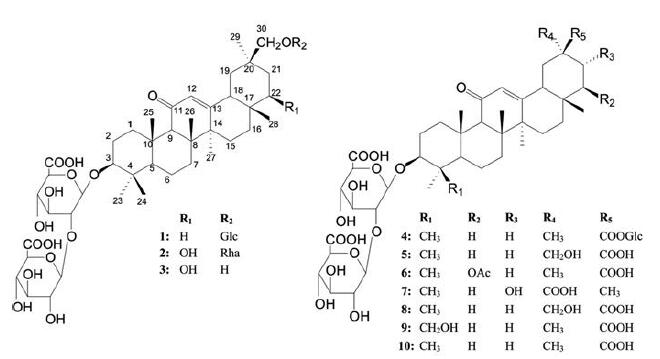
|
Figure 1 Structures of compounds 1-10 isolated from G.glabra |
化合物1 白色无定形粉末。紫外光谱UV(Me OH)λmax(logε)=253.1 (4.15) nm, 提示化合物结构具有α, β-不饱和系统; 红外光谱IR也显示化合物结构中存在α, β-不饱酮(1 763、1 654 cm-1)取代; 此外, 在3 100~3 500 cm-1处的宽吸收谱带提示化合物1中有糖基取代。高分辨质谱(HR-ESI-MS)检测可见准分子离子峰m/z: 971.478 5[M+H]+(计算值971.484 6, C48H75O20), 确定分子式为C48H74O20, 不饱和度为12。此外, 在质谱图中还可观察到m/z 809.428 5 ([M+H-C6H10O5]+)、795.447 9 ([M+H-C6H8O6]+)、457.364 1 ([M+H-2C6H8O6-C6H10O5]+)等碎片离子峰, 根据皂苷类成分的质谱裂解规律, 推测这些碎片离子来源于分子中糖苷键的断裂, 从失去的特征分子量176 Da和162 Da来分析, 显示结构中应含有2个葡萄糖醛酸及1个葡萄糖取代基。化合物1经酸水解及衍生化后, HPLC分析, 结果显示化合物1中存在两种类型单糖, 其保留时间与D-葡萄糖醛酸、D-无水葡萄糖对照品基本一致, 提示化合物所连接的糖为D-葡萄糖醛酸和D-无水葡萄糖。
在13C NMR谱中可以观察到48个碳信号, 其中18个来自3个糖取代基(δC104.8、106.7及105.5三个端基碳信号, δC171.9、172.2两个糖碳基信号, δC62.7一个连羟基的亚甲基信号, 以及δC71.5~84.2之间12个连羟基的次甲基信号); 化合物1的1H NMR中显示有3个糖的端基氢信号δH5.05 (1H, d, J=7.5 Hz)、5.44(1H, d, J=7.5 Hz)和4.84 (1H, d, J=7.7 Hz), 表明分子结构中糖苷键均为β构型。在HMBC谱中可见, δH5.05 (H-1')与δC88.8 (C-3)有相关信号, δH5.44 (H-1'')与δC84.2 (C-2')有相关信号, 从而确定2个葡萄糖醛酸以β(1→2)苷键相连, 并与苷元3β-羟基成苷。此外, 13C NMR谱结合HSQC谱显示, 化合物1中含有的30个苷元碳信号, 包括7个甲基信号δC27.9 (C-23)、17.6 (C-24)、36.2 (C-25)、28.2 (C-26)、23.3 (C-27)、28.1(C-28)、28.2 (C-29), 2个连氧碳原子δC88.8 (C-3)、73.5(C-30), 2个双键碳原子δC128.3 (C-12)、169.4 (C-13)和1个羰基碳δC199.3 (C-11)。与甘草酸的分子式以及碳谱[9]信息对比可以发现, 化合物1的苷元中少了一个羰基信号δC179.2, 多了一个连氧亚甲基δC73.5碳信号, 推测分子结构中C-30不是羧基取代, 而是为一羟亚甲基取代。在HMBC谱中葡萄糖端基氢信号δH4.84 (H-1''')与δC73.5 (C-30)存在相关信号, 显示葡萄糖取代基并非与葡萄糖醛酸相连形成糖链, 而是与苷元上30位碳相连。进一步以HMBC及1H-1H COSY谱对以上推测结构进行了验证, 见图 2。

|
Figure 2 Key HMBC (→) and COSY (━) correlation of compounds 1 and 2 |
化合物1的苷元结构中共有10个不对称碳, 从生源上来分析, 其中的3、5、8、9、10、14、17、18和20位的碳应与甘草酸相应碳上的构型一致。即H-5、H-9、CH3-14应为α-键, 而O-3、CH3-8、CH3-10、CH3-17、H-18、CH2-20应为β-键。化合物1的ROESY谱可进一步确证上述推测的立体构型, 其中H-3和H-5、H-9和H-5、H-18与H-30以及H-22与H-29之间有ROE效应。
综上, 化合物1的结构确定为3β-O-[β-D-glucuronpyranosyl-(1→2)-β-D-glucuronpyranosyl]-30β-O-β-D-glucuronpyranosyl-oleanane-11-oxo-12(13)-ene。经检索为一新化合物, 命名为licorice-saponin R3。
化合物2 白色无定形粉末。紫外光谱UV(Me OH)λmax(logε)=254.3 (4.18) nm; 红外光谱IR显示化合物结构中存在α, β-不饱酮(1 751、1 652 cm-1), 3 100~3 500 cm-1处的宽吸收谱带提示化合物2中有糖基取代。HR-ESI-MS m/z: 971.481 6[M+H]+(计算值971.484 6, C48H75O20), 分子式确定为C48H74O20, 不饱和度为12, 与化合物1为同分异构体。在质谱图中除了准分子离子峰外, 还可观察到m/z 825.425 3 ([M+H-C6H10O4]+)、649.391 4 ([M+H-C6H10O4-C6H8O6]+)、473.361 7 ([M+H-C6H10O4-2C6H8O6]+)等碎片离子峰, 从失去的特征分子量为146 Da和176 Da来推测, 结构中应含有2个葡萄糖醛酸取代基和1个鼠李糖取代基。化合物2经酸水解及衍生化, HPLC分析, 结果显示化合物2中存在两种类型单糖, 其保留时间与D-葡萄糖醛酸、L-鼠李糖对照品基本一致, 提示化合物中两种单糖分别为D-葡萄糖醛酸和L-鼠李糖。
将化合物2与化合物1的13C NMR谱及1H NMR谱进行对比后发现, 两者大部分信号都较为接近, 主要区别在于化合物2结构中少了一个葡萄糖上的连氧亚甲基δC62.7信号, 而多了一个鼠李糖上的甲基信号δC18.5, 这一结果与质谱信息相吻合; 此外, 化合物2苷元上少了一个亚甲基信号δC32.0 (C-22), 而多了一个连氧次甲基信号δC78.6, 氢谱见δH3.72, 推测化合物2分子结构中C-22有一羟基取代。HMBC谱中, 鼠李糖端基氢信号δH5.49 (H-1''')与δC68.3 (C-30)有相关信号, δH3.72 (H-22)与δC32.9 (C-20)有相关信息, 在1H-1H COSY谱中还可见δH3.72 (H-22)与δH1.35, 1.90 (H-21)的相关信号, 以上相关信息进一步证实了相应的结构推测。
由以上的分析最终可确定化合物2的结构是3β-O-[β-D-glucuronpyranosyl-(1→2)-β-D-glucuronpyranosyl]-30β-O-α-L-rhamnopyranosyl-oleanane-11-oxo-12(13)-en-22β, 30-diol。经检索为一新化合物, 命名为licoricesaponin S3。
实验部分紫外可见分光光度仪(UV-2401, 日本岛津); Agilent1100高效液相色谱仪, VWD紫外检测器, Agilent Chemstation色谱工作站(美国Agilent公司); Thermo Nicolet IR100红外光谱仪(Thermo Nicolet, Inc., Madison, WI, USA); AB SCIEX Triple TOFTM 5600高分辨质谱仪(美国AB公司); Bruker ASR-500核磁共振仪(Bruker Bio Spin AG Facilities, Fallenden, Switzerland); BUCHI中压柱(BUCHI Chromatography pump B-688, 65 mm×500 mm, column); Waters 600半制备高效液相, 2487紫外-可见光检测器, Empower色谱工作站(美国waters公司); 旋转蒸发仪(BUCHI Rotavapor R-114);MS-105DU电子天平(十万分之一, 梅特勒-托利多仪器有限公司); 甘草酸铵对照品(中国食品药品检定研究院, 批号: 110731-201720);D-葡萄糖醛酸(批号: 814B021)、D-无水葡萄糖(批号: 1122A025)、L-鼠李糖(批号: 1019B021)均购置于北京索莱宝科技有限公司; 1-苯基-3-甲基-5-吡唑啉酮(南京化学试剂有限公司, 批号: RS6574B352);乙腈、甲醇为色谱纯, 水为超纯水, 其余试剂均为分析纯。甘草药材购自新疆和静县, 经南京中医药大学严辉副教授鉴定为豆科植物光果甘草(Glycyrrhiza glabra.L)的干燥根及根茎。
1 提取分离光果甘草5 kg, 加8倍量水回流提取两次, 每次2 h, 合并煎液, 放冷, 滤过。滤液调节pH至7.0, 通过聚酰胺树脂柱(10 L, 30~60 mesh), 除去甘草黄酮类成分, 流出液再调节pH至5~6, 通过D101大孔树脂(10 L, 20~40目), 70%乙醇洗脱30 L, 洗脱液减压浓缩, 冷冻干燥, 得甘草总皂苷提取物46.8 g。
总皂苷提取物分次采用ODS中压柱色谱(800 g, 25~50μm, 65 mm×500 mm)分离, 以Me OH-H2O-HCOOH (50∶50∶1;55∶45∶1;60∶40∶1;65∶35∶1)梯度洗脱, 每一浓度洗脱3 L, HPLC-UV检测, 相似流分合并, 减压浓缩, 冷冻干燥, 共获得4个流分, 50∶50∶1部分(Fr.A, 5.5 g)、55∶45∶1 (Fr.B, 6.2 g)、60∶40∶1 (Fr.C, 6.8 g)、65∶35∶1 (Fr.D, 9.7 g), 备用。
Fr.A先采用中压柱色谱, 以CH3CN-H2O-HCOOH(25∶75∶1~40∶60∶1)梯度洗脱, 进一步以半制备高效液相分离得到化合物1 (15 mg)、2 (28 mg)、3 (37 mg), 目标化合物在半制备高效液相色谱(色谱柱: Agilent Eclipse XDB-C18, 5μm, 流动相: CH3CN-H2O-HCOOH32∶78∶0.2, 流速3.5 mL·min-1)中的保留时间分别为化合物1 (5.4 min)、化合物2 (7.2 min)、化合物3 (8.1 min)。Fr.B先采用中压柱色谱, 以CH3CN-H2O-HCOOH (30∶70∶1~40∶60∶1)梯度洗脱, 进一步以半制备高效液相分离得到化合物4 (38 mg)、5 (32 mg)、6 (45 mg), 目标化合物在半制备高效液相色谱(色谱柱: Agilent Eclipse XDB-C18, 5μm, 流动相: CH3CN-H2O-HCOOH35∶75∶0.2, 流速3.5 mL·min-1)中的保留时间分别为化合物4 (7.8 min)、化合物5 (9.5 min)、化合物6(13.1 min)。Fr.C采用中压柱色谱(ODS柱)分离, 以CH3CN-H2O-HCOOH (35∶80∶1~40∶60∶1)梯度洗脱, 分离得到化合物7 (55 mg)、8 (151 mg)。Fr.D采用中压柱色谱(ODS柱)分离, 以CH3CN-H2O-HCOOH (35∶80∶1~40∶60∶1)梯度洗脱, 分离得到化合物9 (35 mg)、10 (420 mg)。
高效液相色谱条件: Agilent 1100为高效液相色谱分析仪, 紫外UV检测器; 流动相以乙腈为流动相A, 0.2%甲酸为流动相B: 0~15 min, 19%A~25%A, 15~25 min, 25%A~30%A; 25~40 min, 30%A~45%A, 40~60 min, 45%A~70%A; 色谱柱Hedra C18(4.6 mm×250 mm, 5μm); 流速为1.0 mL·min-1; 检测波长254 nm, 柱温为30℃。目标化合物在高效液相色谱中的保留时间分别为化合物1 (20.1 min)、化合物2(25.7 min)、化合物3 (27.1 min)、化合物4 (28.8 min)、化合物5 (29.9 min)、化合物6 (32.1 min)、化合物7(32.7 min)、化合物8 (35.7 min)、化合物9 (37.9 min)和化合物10 (38.4 min)。
2 化合物的酸水解、衍生化及HPLC分析分别称取化合物1和化合物2各5 mg, 加入2 mol·L-1三氟乙酸水溶液1 mL, 100℃水解10 h, 水解液蒸干, 加水2 mL溶解, 即得化合物样品溶液; 分别称取D-葡萄醛酸、D-葡萄糖和L-鼠李糖对照品1 mg, 加入水1 mL溶解, 制成单一对照品溶液。分别取样品溶液及对照品溶液100μL, 加入0.3 mol·L-1氢氧化钠溶液100μL、10%1-苯基-3-甲基-5-吡唑啉酮(PMP)甲醇溶液200μL, 充分混匀, 70℃水浴45 min, 放冷; 再加入0.3 mol·L-1盐酸溶液100μL及水500μL, 充分混匀, 再以三氯甲烷萃取3次, 每次1 mL, 离心10 min (转速为10 000 r·min-1)取上清液, 得到单糖样品及对照品的衍生化产物, HPLC分析。色谱条件如下: 以Eclipse XDB-C18为色谱柱; 以pH 6.7磷酸缓冲盐水溶液为流动相A, 乙腈为流动相B, 0~65 min, 15%A~25%A; 流速1.0 mL·min-1; 检测波长254 nm; 柱温30℃; 进样量10μL。在对照品色谱图中, D-葡萄糖醛酸、D-葡萄糖及L-鼠李糖的保留时间分别为43.8、50.2、37.0 min; 化合物1单糖色谱图呈现两个色谱峰, 保留时间分别为43.3和50.2 min, 与D-葡萄糖醛酸和D-葡萄糖对照品色谱峰基本一致; 化合物2单糖色谱图呈现两个色谱峰, 保留时间分别为43.3和37.1 min, 与D-葡萄糖醛酸和L-鼠李糖对照品色谱峰基本一致。
3 结构鉴定化合物1 白色无定形粉末(MeOH)。紫外光谱λmaxMeOH nm (logε): 253.1 (4.15);IR (KBr)νmaxcm-1: 3 375, 1 763, 1 654;1H NMR (C5D5N-d5, 500 MHz)和13C NMR谱(C5D5N-d5, 125 MHz)数据见表 1; HR-ESI-MS m/z: 971.478 5[M+H]+(计算值971.484 6, C48H75O20)。
| 表 1 NMR of compounds 1 and 2 (500 MHz for 1H NMR; 125 MHz for 13C NMR; C5D5N-d5) |
化合物2 白色无定形粉末(MeOH)。紫外光谱λmaxMeOHnm (logε): 254.3 (4.18);IR (KBr)νmaxcm-1: 3 382, 1 751, 1 652;1H NMR (C5D5N-d5, 500 MHz)和13C NMR谱(C5D5N-d5, 125 MHz)数据见表 1; HR-ESI-MS m/z: 971.481 6[M+H]+(计算值971.484 6, C48H75O20)。
化合物3 白色粉末。HR-ESI-MS m/z: 825.428 1[M+H]+, 分子式为C42H64O16, 不饱和度为11。主要氢谱数据1H NMR (C5D5N-d5, 500 MHz)δH0.73 (H-5), 2.43 (H-9), 3.34 (H-3), 3.73 (H-22), 3.83 (H-30), 5.03(H-1'), 5.41 (H-1''), 5.79 (H-12)。13C NMR (C5D5N-d5, 125 MHz)δC39.5(C-1), 26.7 (C-2), 89.2 (C-3), 39.9 (C-4), 55.5 (C-5), 17.6 (C-6), 33.1 (C-7), 45.4 (C-8), 62.0 (C-9), 37.2 (C-10), 199.5 (C-11), 128.7 (C-12), 169.5 (C-13), 44.1 (C-14), 26.6 (C-15), 28.0 (C-16), 37.8 (C-17), 45.3(C-18), 40.5 (C-19), 35.8 (C-20), 38.6 (C-21), 74.6 (C-22), 28.1 (C-23), 16.9 (C-24), 16.8 (C-25), 18.9 (C-26), 23.1(C-27), 21.7 (C-28), 28.2 (C-29), 69.9 (C-30), 105.1 (C-1'), 84.5 (C-2'), 77.6 (C-3'), 73.0 (C-4'), 77.4 (C-5'), 172.3(C-6'), 106.9 (C-1''), 76.8 (C-2''), 77.6 (C-3''), 73.3 (C-4''), 78.4 (C-5''), 172.0 (C-6'')。以上数据与文献报道基本一致[10], 故鉴定化合物3为uralsaponin C。
化合物4 白色粉末。HR-ESI-MS m/z: 985.464 3[M+H]+, 分子式为C48H72O21, 不饱和度为13。主要氢谱数据1H NMR (C5D5N-d5, 500 MHz)δH0.74 (H-5), 2.43 (H-9), 3.35 (H-3), 4.38 (H-6'''), 4.57 (H-6'''), 5.11(H-1'''), 5.46 (H-1'), 5.92 (H-12), 6.46 (H-1'')。13C NMR(C5D5N-d5, 125 MHz)δC40.3 (C-1), 27.6 (C-2), 90.1 (C-3), 40.8 (C-4), 56.2 (C-5), 18.4 (C-6), 38.8 (C-7), 45.2(C-8), 62.9 (C-9), 33.0 (C-10), 201.0 (C-11), 129.5 (C-12), 170.8 (C-13), 44.3 (C-14), 27.6 (C-15), 27.5 (C-16), 38.0 (C-17), 49.1 (C-18), 42.3 (C-19), 46.4 (C-20), 32.1(C-21), 33.7 (C-22), 17.6 (C-23), 29.4 (C-24), 17.8 (C-25), 28.9 (C-26), 29.0 (C-27), 19.6 (C-28), 24.3 (C-29), 177.0 (C-30), 105.8 (C-1'), 84.5 (C-2'), 77.6 (C-3'), 73.0(C-4'), 77.6 (C-5'), 173.6 (C-6'), 107.2 (C-1''), 76.8 (C-2''), 77.6 (C-3''), 73.3 (C-4''), 78.4 (C-5''), 173.3 (C-6''), 96.8 (C-1'''), 74.3 (C-2'''), 78.8 (C-3'''), 71.2 (C-4'''), 79.5(C-5'''), 62.3 (C-6''')。以上数据与文献报道基本一致[11], 故鉴定化合物4为licorice-saponin A3。
化合物5 白色粉末。HR-ESI-MS m/z: 839.412 0[M+H]+, 分子式为C42H62O17, 不饱和度为12。主要氢谱数据1H NMR (C5D5N-d5, 500 MHz)δH0.62 (H-5), 2.30 (H-9), 3.27 (H-3), 3.99 (H-29), 4.06 (H-29), 5.03(H-1'), 5.38 (H-1''), 5.82 (H-12)。13C NMR (C5D5N-d5, 125 MHz)δC41.4 (C-1), 28.6 (C-2), 91.3 (C-3), 41.8 (C-4), 57.3 (C-5), 19.5 (C-6), 34.8 (C-7), 47.6 (C-8), 64.0 (C-9), 34.5 (C-10), 202.4 (C-11), 130.3 (C-12), 173.1 (C-13), 45.4 (C-14), 28.5 (C-15), 28.6 (C-16), 34.5 (C-17), 50.3(C-18), 49.0 (C-19), 52.9 (C-20), 28.7 (C-21), 39.8 (C-22), 30.0 (C-23), 18.9 (C-24), 18.8 (C-25), 20.7 (C-26), 25.6(C-27), 30.7 (C-28), 72.9 (C-29), 180.2 (C-30), 106.7 (C-1'), 85.6 (C-2'), 79.4 (C-3'), 75.4 (C-4'), 79.3 (C-5'), 174.9 (C-6'), 108.1 (C-1''), 78.5 (C-2''), 79.4 (C-3''), 75.2(C-4''), 80.1 (C-5''), 174.7 (C-6'')。以上数据与文献报道基本一致[12], 故鉴定化合物5为licorice-saponin P2。
化合物6 白色粉末。HR-ESI-MS m/z: 881.426 3[M+H]+, 分子式为C44H64O18, 不饱和度为12。主要氢谱数据1H NMR (C5D5N-d5, 500 MHz)δH0.78 (H-5), 2.03 (H-22), 2.43 (H-9), 3.34 (H-3), 5.04 (H-1'), 5.42(H-1''), 6.01 (H-12)。13C NMR (C5D5N-d5, 125 MHz)δC38.7 (C-1), 25.6 (C-2), 88.2 (C-3), 38.7 (C-4), 54.2 (C-5), 17.6 (C-6), 31.6 (C-7), 43.5 (C-8), 61.0 (C-9), 36.1 (C-10), 199.2 (C-11), 127.6 (C-12), 168.2 (C-13), 42.7 (C-14), 24.5 (C-15), 25.5 (C-16), 38.2 (C-17), 44.7 (C-18), 39.5(C-19), 33.8 (C-20), 35.0 (C-21), 76.2 (C-22), 27.0 (C-23), 15.8 (C-24), 15.7 (C-25), 16.5 (C-26), 23.0 (C-27), 20.9(C-28), 28.3 (C-29), 178.3 (C-30), 104.7 (C-1'), 82.4 (C-2'), 76.3 (C-3'), 72.0 (C-4'), 76.5 (C-5'), 171.9 (C-6'), 104.9(C-1''), 75.4 (C-2''), 76.0 (C-3''), 72.2 (C-4''), 76.9 (C-5''), 171.6 (C-6'')。以上数据与文献报道基本一致[13], 故鉴定化合物6为22β-acetoxyl-glycyrrhizin。
化合物7 白色粉末。HR-ESI-MS m/z: 839.402 0[M+H]+, 分子式为C42H62O17, 不饱和度为12。主要氢谱数据1H NMR (C5D5N-d5, 500 MHz)δH0.71 (H-5), 2.45 (H-9), 3.37 (H-3), 4.51 (H-21), 5.09 (H-1'), 5.45(H-1''), 5.89 (H-12)。13C NMR (C5D5N-d5, 125 MHz)δC40.5 (C-1), 27.6 (C-2), 90.3 (C-3), 40.9 (C-4), 56.3 (C-5), 18.6 (C-6), 34.1 (C-7), 46.4 (C-8), 63.2 (C-9), 38.3 (C-10), 201.1 (C-11), 129.7 (C-12), 171.7 (C-13), 45.0 (C-14), 28.0 (C-15), 31.0 (C-16), 34.1 (C-17), 48.3 (C-18), 36.1 (C-19), 49.0 (C-20), 73.1 (C-21), 44.0 (C-22), 29.1(C-23), 18.0 (C-24), 17.8 (C-25), 19.8 (C-26), 24.1 (C-27), 30.2 (C-28), 181.0 (C-29), 22.0 (C-30), 105.8 (C-1'), 84.8 (C-2'), 78.5 (C-3'), 78.2 (C-4'), 74.2 (C-5'), 173.7 (C-6'), 107.3 (C-1''), 77.6 (C-2''), 78.4 (C-3''), 74.4(C-4''), 79.2 (C-5''), 173.3 (C-6'')。以上数据与文献报道基本一致[14], 故鉴定化合物7为macedonoside A。
化合物8 白色粉末。HR-ESI-MS m/z: 839.412 0[M+H]+, 分子式为C42H62O17, 不饱和度为12。主要氢谱数据1H NMR (C5D5N-d5, 500 MHz)δH0.63 (H-5), 2.30 (H-9), 3.27 (H-3), 3.99 (H-29), 4.06 (H-29), 5.03(H-1'), 5.38 (H-1''), 5.83 (H-12)。13C NMR (C5D5N-d5, 125 MHz)δC41.5 (C-1), 28.6 (C-2), 91.3 (C-3), 41.7 (C-4), 57.3 (C-5), 19.5 (C-6), 34.8 (C-7), 47.6 (C-8), 64.0(C-9), 34.5 (C-10), 202.4 (C-11), 130.4 (C-12), 173.1 (C-13), 45.6 (C-14), 28.6 (C-15), 28.6 (C-16), 34.6 (C-17), 50.3 (C-18), 39.1 (C-19), 52.9 (C-20), 28.7 (C-21), 39.8(C-22), 30.1 (C-23), 18.9 (C-24), 18.8 (C-25), 20.8 (C-26), 25.6 (C-27), 30.9 (C-28), 72.9 (C-29), 180.2 (C-30), 106.7 (C-1'), 85.5 (C-2'), 79.5 (C-3'), 75.3 (C-4'), 79.3(C-5'), 174.9 (C-6'), 108.1 (C-1''), 78.5 (C-2''), 79.4 (C-3''), 75.4 (C-4''), 80.1 (C-5''), 174.7 (C-6'')。以上数据与文献报道基本一致[12], 故鉴定化合物8为29-hydroxylglycyrrhizin。
化合物9 白色粉末。HR-ESI-MS m/z: 839.406 0[M+H]+, 分子式为C42H62O17, 不饱和度为12。主要氢谱数据1H NMR (C5D5N-d5, 500 MHz)δH0.87 (H-5), 2.34 (H-9), 3.51 (H-3), 3.77 (H-24), 4.38 (H-24), 5.06(H-1'), 5.68 (H-1''), 5.81 (H-12)。13C NMR (C5D5N-d5, 125 MHz)δC41.7 (C-1), 29.0 (C-2), 92.0 (C-3), 46.8 (C-4), 58.2 (C-5), 20.6 (C-6), 35.5 (C-7), 40.8 (C-8), 64.3(C-9), 39.2 (C-10), 202.7 (C-11), 130.6 (C-12), 173.4 (C-13), 45.9 (C-14), 29.1 (C-15), 28.8 (C-16), 34.5 (C-17), 51.2 (C-18), 43.9 (C-19), 46.5 (C-20), 33.8 (C-21), 40.7(C-22), 25.3 (C-23), 65.8 (C-24), 19.0 (C-25), 21.0 (C-26), 25.9 (C-27), 31.1 (C-28), 31.1 (C-29), 182.0 (C-30), 106.7 (C-1'), 82.6 (C-2'), 79.9 (C-3'), 75.7 (C-4'), 79.8(C-5'), 175.8 (C-6'), 106.6 (C-1''), 77.8 (C-2''), 79.9 (C-3''), 75.49 (C-4''), 79.8 (C-5''), 175.6 (C-6'')。以上数据与文献报道基本一致[15], 故鉴定化合物9为licoricesaponin G2。
甘草酸(10)通过与标准品HPLC检测对照后确定。
作者贡献:郑云枫负责了论文研究方案的设计、研究过程实施及论文的起草; 孙捷和段伟萍负责了化学成分分离等研究工作; 李洋和陈丽红负责了结构鉴定相关数据采集与分析; 陆兔林和李存玉负责了技术及材料支持及指导性支持工作。彭国平负责了研究选题提出、研究方案设计及论文修改。
利益冲突:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China(中华人民共和国药典)[S]. Part 1.2015 Ed. Beijing: China Medical Science Press, 2015: 86-87.
|
| [2] |
Luan HY, Xu Y, Yang MZ, et al. Deterntination of contents of liquiritin in Radix Rhizoma Glycyrrhizae from different producing areas by HPLC[J]. J Anhui Agric Sci(安徽农业科学), 2011, 39: 12121-12122. |
| [3] |
Zhang QY, Ye M, Xie PS, et al. Chemical analysis of the Chinese herbal medicine Gan-Cao(Licorice)[J]. J Chromatogr A, 2009, 1216: 1954-1969. DOI:10.1016/j.chroma.2008.07.072 |
| [4] |
Al-Hazimi HMA, Al-Jaber NA. Phenolic compounds from Glycyrrhiza plants (Leguminosae) review article I[J]. J Saudi Chem Soc, 2005, 9: 347. |
| [5] |
Yu XM, Bao YR, Meng XS, et al. Multi-pathway integrated adjustment mechanism of licorice flavonoids presenting antiinflammatory activity[J]. Oncol Lett, 2019, 18: 4956-4963. |
| [6] |
Zheng YF, Wei JH, Leng K, et al. Research advances in resource chemistry and utilization of genus Glycyrrhiza[J]. Mod Chin Med(中国现代中药), 2015, 17: 1096-1108. |
| [7] |
Liu YY, Yang YN, Wang W, et al. Two new flavanone glucosides identified in Glycyrrhiza uralensis[J]. Acta Pharm Sin(药学学报), 2017, 52: 948-951. |
| [8] |
Tian QL, Guan YP, Zhang B, et al. Research advances on pharmacological activities of components in licorice[J]. Nat Prod Res Dev(天然产物研究与开发), 2006, 18: 343-347. |
| [9] |
Csermely P, Agoston V, Pongor S. The efficiency of multitarget drugs: the network approach might help drug design[J]. Trends Pharmacol Sci, 2005, 26: 178-182. DOI:10.1016/j.tips.2005.02.007 |
| [10] |
Zheng YF, Qi LW, Cui XB, et al. Oleanane-type triterpene glucuronides from the roots of Glycyrrhiza uralensis Fischer[J]. Planta Med, 2010, 76: 1457-1463. DOI:10.1055/s-0029-1240907 |
| [11] |
Kitagawa I, Zhou JL, Sakagami M, et al. Licorice-saponins A3, B2, C2, D3 and E2, five newoleanene-type triterpene oligoglycosides from Chinese Glycyrrhizae Radix[J]. Chem Pharm Bull, 1988, 36: 3710-3713. DOI:10.1248/cpb.36.3710 |
| [12] |
Zheng YF, Wei JH, Fang SQ, et al. Hepatoprotective triterpene saponins from the roots of Glycyrrhiza inflata[J]. Molecules, 2015, 20: 6273-6283. DOI:10.3390/molecules20046273 |
| [13] |
Li YJW, Nakajima JI, Kimura N, et al. Oleananetype triterpeneglycosides from Glycyrhiza Uralensis[J]. Nat Prod Commun, 2007, 2: 243-248. |
| [14] |
Shibano M, Nukui H, Kita S, et al. Studies on index compounds for HPLC analysis of Glycyrrhiza macedonica[J]. Nat Med, 1999, 53: 166-172. |
| [15] |
Kitagawa I, Hori K, Sakagami M, et al. Saponin and sapogenol. XLVIII. On the constituents of the roots of Glycyrrhiza uralensis Fischer from northeastem China. (2). licorice-saponins D3, E2, F3, G2, H2, J2, and K2[J]. Chem Pharm Bull, 1993, 41: 1337-1345. DOI:10.1248/cpb.41.1337 |
 2021, Vol. 56
2021, Vol. 56


