2. 科志康医药科技有限公司, 广东 佛山 528000
2. KG Pharma Limited, Foshan 528000, China
中药注射剂是在中医理论指导下, 从天然草药中提取有效物质并生产为无菌溶液、悬浮液或无菌粉末等制剂[1]。中药注射剂常被认为药理作用机制具有“多组分、多靶点”的特点, 并且在生物利用度和治疗效果上优于传统的口服制剂[2]。中药注射剂常常与化学药联合使用治疗各种复杂疾病, 具有增强或协同的作用。中药注射剂在临床的使用率逐渐增长, 到目前为止我国共有121种中药注射剂获得国家食品药品监督管理局(CFDA)的批准[3], 并有5种中药注射剂被列入2015年版中国药典。但是中药注射剂药品说明书中关于药物相互作用的内容几近空白, 无法预知和预测中药注射剂与其他化学药物联合用药时的安全性和有效性, 存在着严重的用药安全隐患, 关于药物相互作用的内容亟需完善[4]。
细胞色素P450 (cytochrome P450, CYP450)是人体内主要的代谢酶系统之一, 在外源、内源性物质的氧化代谢过程中起着重要作用。Ⅰ相代谢酶中CYP2C19、CYP2D6、CYP3A、CYP2E1和CYP2C9, 代谢约90%的市场上的药物[5, 6]。CYP3A在肝脏中表达最为丰富, 约占代谢药物的34%, 其次是CYP2D6占19%, CYP2C8和CYP2C9占16%, CYP2C19和CYP1A2占8%。CYP450s的抑制可能导致严重的药物相互作用(drug-drug interaction, DDI), 许多处方药由于对CYP450同工酶的显著抑制, 导致严重的临床相互作用而退出市场。中药注射剂与处方药同时使用会产生严重的不良中药-药物相互作用(herb-drug interaction, HDI), 特别是由于CYP450s的抑制, 这种相互作用也逐渐引起了人们的广泛关注[7, 8]。与其他临床处方药合用时, 如果处方药安全窗较宽, 相互作用可能在临床上无关紧要, 即暴露量的增加不会导致不良的DDI。相反, 如果处方药的安全窗较窄(如华法林[9]、地高辛), 则抑制CYP450会增加药物在血液中的暴露量, 出现中毒症状甚至导致致命的相互作用。目前关于中药注射剂对CYP450s抑制作用的数据还远远不够, 因此阐明中药注射剂与化学药物之间潜在的HDI, 使中药注射剂安全、有效地使用就变得非常重要。
本研究针对人体重要的9种药物代谢酶CYP1A、CYP2A6、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A, 在体外系统地评价与中药注射剂有关的潜在的DDI, 测定其对药物代谢酶的潜在抑制作用, 特别是进行了时间依赖性抑制作用(TDI)研究。希望本研究能够为临床医生提供重要的实验数据, 在临床药物的使用中避免严重的DDI。
材料与方法试剂和材料 人肝微粒体(HLMs, 美国XenoTech公司, 产品编号1210223);临床常用的79种中药注射剂的批号、生产厂家见表 1; 非那西丁、香豆素、1-氨基苯并三唑(ABT)、安非他酮、阿莫地喹、双氯芬酸、S-美芬妥英、右美沙芬、氯唑沙宗、睾酮、奎尼丁(QRT)、α-萘黄酮、反苯环丙胺(TLM)、噻氯匹定、7-羟基香豆素、N-desethylamodiquine、右啡烷、羟基安非他酮、NADPH、6β-羟基睾酮, 葡萄糖6-磷酸(G-6-P)和葡萄糖-6-磷酸脱氢酶(G-6-PDH)(美国Sigma试剂公司); N-3-benzylnirvanol (BZV)、4-羟基双氯芬酸、4-羟基美芬妥英和6-羟基氯唑沙宗(加拿大多伦多化学研究公司); 双氯芬酸和氟康唑(日本东京化学工业株式会社); 酮康唑(上海思域化工科技有限公司); 苯妥英钠和槲皮素(美国Aladdin公司)。Milli-Q去离子水(美国Millipore公司)。色谱纯乙腈和甲醇(德国Merck公司)。
| 表 1 The information of the collected 79 herb injections approved by CFDA |
LC-MS/MS质谱条件 岛津Acquity UPLC液相系统串联AB Sciex API 4000三重四极杆质谱仪, 配备有电喷雾电离(ESI)源, 采用多反应监测模式。探针底物及代谢产物色谱分离使用色谱柱Phenomenex Synergi Hydro-RP C18 (30 mm×2 mm, 4μm), 柱温设置为25℃, 流速为0.4 mL·min-1。流动相由0.1%甲酸-水和0.1%甲酸-乙腈混合组成。液相色谱梯度洗脱程序见表 2, 目标代谢物采用多反应监测模式定量, LC-MS/MS参数见表 3。在ESI+模式下, 质谱仪的参数分别为碰撞气体(CAD)(10 kPa)、帘气(CUR)(35 kPa)、雾化气(GS1)(50 kPa)、涡轮气(GS2)(60 kPa)、离子喷射电压(5 500 V)、离子喷射温度(TEM)(500℃)、入口电位(EP)(10 V)、碰撞单元出口电位(CXP)(14 V)。在ESI-模式下, 质谱仪的参数分别为CAD(10 kPa)、CUR (30 kPa)、GS1 (50 kPa)、GS2 (60 kPa)、离子喷射电压(-4 500 V)和TEM (500℃)、EP (-10 V)、CXP (-14 V)。
| 表 2 The gradient elution for the CYP450s inhibition assay |
| 表 3 MS/MS transitions and parameters for the detection of the target metabolites and internal standards |
CYP450s酶抑制实验 评价79种注射剂对9种CYP450的抑制作用使用体外孵育体系: HLM溶液(0.25 mg·mL-1) 40 μL; 受试品[中药注射液为50%和5%(v/v) 10 μL、注射用粉针剂使用20和2倍日最大使用剂量换算浓度(CMDD, mg·mL-1)]或阳性特异性抑制剂工作溶液[CYP450s酶的特定抑制剂ABT (CYP1A、CYP2C8、CYP2C9、CYP2E1和CYP3A)、QRT (CYP2D6)、TLM (CYP2A6)和BZV (CYP2C19和CYP2B6) 10 μL, 使用DMSO配置成10 mg·mL-1的溶液, 使用PBS稀释成10 000、1 000、100和30 μmol·L-1的工作液(DMSO的终浓度 < 0.5%)]; 底物[非那西汀(CYP1A2) 60 μmol·L-1、香豆素(CYP2A6) 10 μmol·L-1、安非他酮(CYP2B6)20 μmol·L-1、阿莫地喹(CYP2C8) 20 μmol·L-1、双氯芬酸(CYP2C9) 20 μmol·L-1、S-美芬妥英(CYP2C19)160 μmol·L-1、右美沙芬(CYP2D6) 20 μmol·L-1、氯唑沙宗(CYP2E1) 160 μmol·L-1和睾酮(CYP3A4) 40 μmol·L-1]10 μL, 在37℃预孵育10 min。最后加入NADPH再生系统(3.0 mmol·L-1NADPH、6.0 mmol·L-1G-6-P、3 U·mL-1G-6-PDH和7.2 mmol·L-1MgCl2) 40 μL, 配置成混合溶液100 μL, 启动反应孵育10或20 min (CYP2C19)。最后用含甲苯磺丁酰胺(内标) 100 ng·mL-1的冰乙腈溶液200 μL终止反应。然后14 000×g离心20 min, 上清液与2倍体积的水混合, 吸取10 μL进行LC-MS/MS分析。检测的代谢产物分别为对乙酰氨基酚、7-羟基香豆素、羟基安非他酮、N-脱乙酰基阿莫地喹、4-羟基双氯芬酸、4-羟基美芬妥英、O-去甲右美沙芬、6-羟基氯唑沙宗和6β-羟基睾酮。CYP450s酶活性抑制程度由公式计算: 抑制率%=(1-Ainjection/Avehicle)×100%, 其中A为测定探针代谢产物与内标的峰面积的比值。
中药注射剂IC50值 中药注射液工作液50%(v/v)按照3倍, 系列稀释得到50%、16.67%、5.556%、1.852%、0.617%、0.206%、0.069%和0.023%;注射用粉针剂由2CMDD按照3倍的稀释倍数系列稀释得到8个浓度的中药注射液溶液用于CYP450s酶抑制实验, IC50值使用GraphPad Prism 5.0 (San Diego, CA, USA)进行非线性回归分析计算, 估算50%抑制作用的抑制剂浓度(IC50值), 其中Y=100/[(1+XˆHillSlope)/(IC50ˆHillSlope)]。
TDI抑制判别实验 采用共孵育与预孵育实验确定中药注射液是否为TDI型的抑制剂, 预孵育反应混合物由人肝微粒体(0.25 mg·mL-1)、NADPH再生系统组成, 在0.1 mmol·L-1磷酸钾缓冲液(pH 7.4)中, 用中药注射液预培养30 min, 然后添加特定底物并进一步孵育10或20 min。最后用含甲苯磺丁酰胺(内标) 100 ng·mL-1的冰乙腈溶液200 μL终止反应。然后14 000×g离心20 min, 上清液与2倍体积的水混合, 吸取10 μL进行LC-MS/MS分析。酶活性(%)根据有无活度损失计算: 活性损失率%=[(Ainjection/Avehicle)-NADPH-(Ainjection/Avehicle)+NADPH]×100%。
数据分析 实验重复2次, 所有数值均以Mean±SD表示。使用SPSS 22.0统计学软件进行统计分析, 各组数据均为计量资料。对数据进行正态性和方差齐性分析, 然后使用Dunnett's检验来确定实验组与对照组的平均值的显著性差异, 显著性标准均为P < 0.05。
结果 1 药注射剂对CYP450s的抑制作用79种中药注射剂中, 中药注射液选择终浓度为5%和0.5%(v/v)、中药注射用粉针剂使用2和0.2倍CMDD(mg·mL-1)作为CYP450s抑制实验的初筛浓度对9种CYP450活性的抑制作用进行初步研究。初步筛选结果用直方图表示为相对空白组的百分比(100%), 见图 1。ABT、QRT、TLM和BZV等阳性药物的酶抑制活性均在85%及以上。结果显示, 在实验浓度为5%(v/v)时, 79种中药注射液中有37种中药注射剂对CYP1A、24种中药注射剂对CYP2A6、41种中药注射剂对CYP2B6、36种中药注射剂对CYP2C9、41种中药注射剂对CYP2C19、41种中药注射剂对CYP2D6、25种中药注射剂对CYP2E1和42种中药注射剂对CYP3A表现出50%或更大的抑制作用。在实验浓度为0.5%(v/v)时, 3种中药注射剂(SX、BGZ和SFI)对CYP1A的抑制率分别为73.2%、87.5%和72.3%;3种中药注射剂(XD、BGZ和SFI)对CYP2A6的抑制率分别为64.4%、52.5%和73.2%, 6种中药注射剂(SX、XD、YMG、XML、LXX和SFI)对CYP2B6的抑制率分别为55.5%、58.3%、51.1%、72.6%、96.3%和91.0%;5种中药注射剂(XD、GXN、XML、MLN和SFI)对CYP2C8的抑制率分别为61.5%、55.3%、56.2%、59.1%和94.7%, 1种中药注射剂(SFI)对CYP2C9的抑制率为94.2%;7种中药注射剂(SX、XD、BGZ、GXN、YXDM、LXX、SFI)对CYP2C19的抑制率分别为51.3%、71.5%、68.2%、59.4%、60.1%、74.0%和87.2%;2种中药注射剂(XML、SFI)对CYP2D6的抑制率分别为70.2%和81.5%;1种中药注射剂(GKL)对CYP2E1的抑制率为56%, 6种中药注射剂(GYN、XD、GXN、YXDM、MLN和SFI)对CYP3A的抑制率分别为55.2%、57.3%、60.2%、75.4%、54.3%和83.4%。
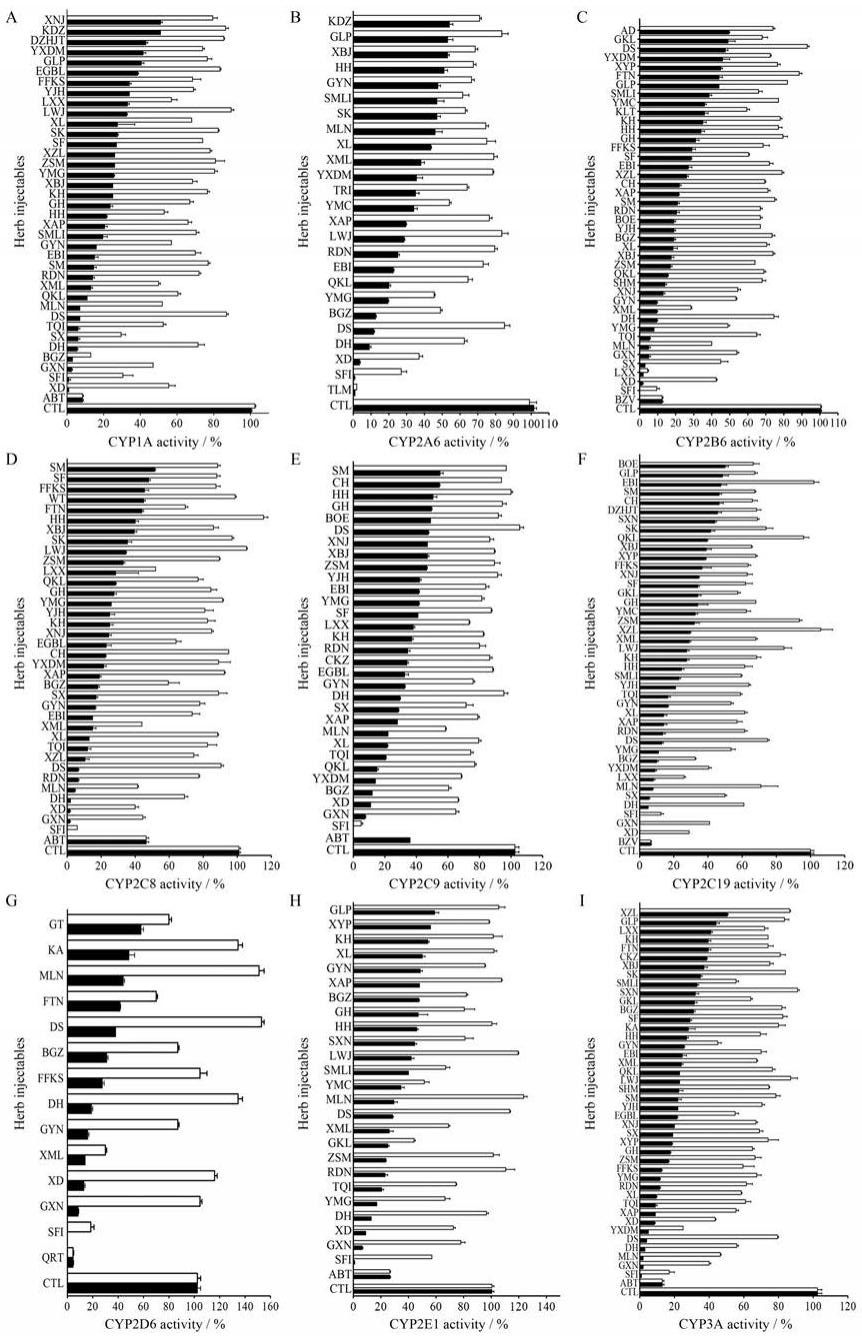
|
Figure 1 Inhibition activities of 79 herb injectables on nine human liver CYP450 enzymes (A-I) evaluated at 5%and 0.5%.The results of the residual enzyme activity were normalized to vehicle control and expressed as relative percentage ratio.Each histogram is the mean of double values (n=2) |
在79种中药注射剂中, 20种中药注射剂对CYP1A、13种中药注射剂对CYP2A6、15种中药注射剂对CYP2B6、16种中药注射剂对CYP2C8、12种中药注射剂对CYP2C19、16种中药注射剂对CYP2D6、12种中药注射剂对CYP2E1、20种中药注射剂对CYP3A抑制率为50%的计算浓度低于根据每日最大剂量计算的最大浓度。各中药注射剂的IC50值详见表 4 (注射液针剂)和表 5 (冻干粉针剂)。
| 表 4 IC50 (v/v) values for P450 enzyme inhibition by the liquid injection investigated. The CMDD (v/v) is the concentration of the injection calculated by the maximum daily dose |
| 表 5 IC50 values for P450 enzyme inhibition by the powder injection investigated |
比较共孵育30 min与预孵育实验的CYP450各亚型酶的活性, SF、SHM对CYP1A的酶活性损失值在浓度为5%时分别为21.2%、26.5%, 在浓度为0.5%时分别为11.7%、22.1%;CH、BOE、BGZ、SF、SHM对CYP2A6的酶活性损失值在浓度为5%时分别为66.0%、41.6%、11.1%、10.1%、44.9%, 在浓度为0.5%时分别为25.4%、30.5%、37.3%、42.3%、40.5%;XAP、SM、BGZ、SF、BOE对CYP2B6的酶活性损失值在浓度为5%时分别为6.8%、8.4%、4.7%、21.7%、22.9%, 在浓度为0.5%时分别为13.8%、20.5%、31.0%、39.1%、19.7%;FTN、WT、BOE、SF、GT、SHM对CYP2C8的酶活性损失值在浓度为5%时分别为15.6%、28.4%、22.6%、23.1%、33.5%、17.9%, 在浓度为0.5%时分别为37.6%、38.8%、7.1%、8.7%、17.5%、35.5%;BGZ对CYP2D6的酶活性损失值在浓度为5%时为25.1%, 在浓度为0.5%时为33.1%;BGZ、SXN、SF、LXX、XZL、EGBL对CYP3A的酶活性损失值在浓度为5%时分别为26.8%、10.4%、21.1%、28.9%、55.7%、24.0%, 在浓度为0.5%时为22.1%、29.1%、28.1%、29.0%、17.0%、30.2%。这些中药注射剂酶活性抑制率的测定结果均呈现时间依赖性, 见图 2。
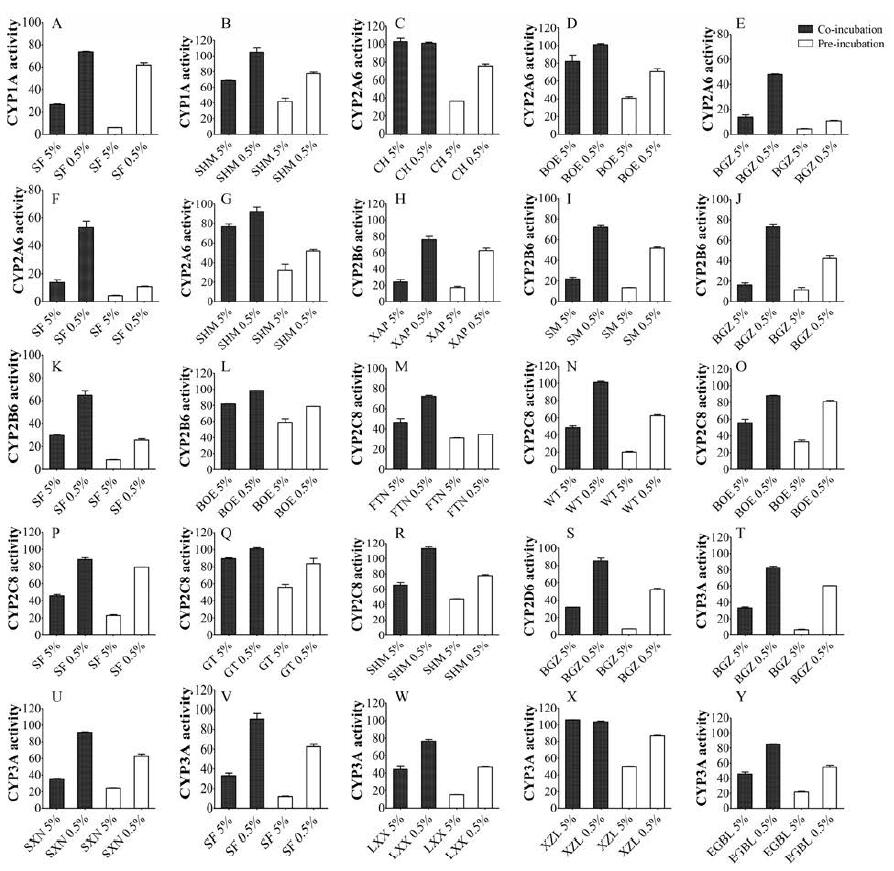
|
Figure 2 The enzyme activity of CYP450 after the herb injectables pre-incubated or co-incubated with HLM for 30 min.The data are represented as mean±SD of 2 independent incubations.A, B: CYP1A;C-G: CYP2A6;H-L: CYP2B6;M-R: CYP2C8;S: CYP2D6, T-Y: CYP3A |
中药注射剂多为复方制剂, 其成分相对较复杂, 如双黄连注射剂[10]、苦参碱注射液[11]等。中药注射剂发挥药效的物质基础还是化学单体, 这些化学物质的体内过程也是要通过CYP450代谢[12]、排泄出体外[13], 对CYP450也存在抑制或诱导的作用[14]。由CYP450的抑制或诱导引起的HDI, 已成为临床常见的问题。CYP450是体内外潜在DDI研究的热点, CYP450混合孵育体系常常被用作体外预测DDI或HDI的常用工具。然而, 实验室间所具备的实验条件、特异性探针底物选择的差异常常会导致室间评估结果的不同。在这项研究中, 在一个孵育体系中系统评估这些中药注射剂对9种CYP450s的抑制能力, 为平行地比较各注射剂的抑制强度提供实验数据支持。
国内外学者预测中药注射剂对CYP450的抑制或诱导作用的研究越来越多, 中药注射剂抑制作用的评价不像单体化合物一样有确切的摩尔质量数, 但是其给药方式为静脉滴注, 很多学者使用人体的血浆容量5 L进行体积比浓度(v/v)估算研究, 推动了临床上中药注射液与其他药物联合使用的科学性和合理性[15, 16]。并且在作者前期的研究中发现, 灯盏细辛注射液(EBI)体外抑制CYP3A的实验结果IC50和Ki值分别为0.4%和0.24%, 使用最大允许日剂量(40~80 mL)进行初步估算为0.8%~1.6%, 大鼠体内研究进一步证实EBI对咪达唑仑药代动力学具有显著的影响[17]。作者认为在使用临床剂量治疗后, 人体可能会出现抑制。因此, 本研究中药注射液选择终浓度为5%和0.5%(v/v)、中药注射用粉针剂使用2和0.2倍CMDD(mg·mL-1)作为CYP450s抑制实验的初筛浓度, 尽可能模拟体内血浆药物浓度。
对于评价的79种中药注射剂, 按照其对CYP450亚型抑制的IC50值与体内预估计的体积比浓度的比值, 一些注射剂发生HDI的可能性较高。如血必净注射液、丹红注射液、香丹注射液、冠心宁注射液、丹参酮Ⅱ注射液、灯盏花素注射液等潜在的抑制作用值得临床警惕, 这也与文献报道的相一致[15]。
TDI类型的DDI预测更具有隐蔽性和挑战性, 母体药物必须经历一系列的代谢转化, 最终与CYP450作用发挥抑制作用[18]。在本研究中, 5%浓度的几种中药注射剂在共孵体系中的抑制作用不明显, 如CH、BOE和SHM对CYP2A6的抑制作用, BOE对CYP2B6的抑制作用, GT对CYP2C8的抑制作用, XZL对CYP3A的抑制作用。但是当分别与HLM预孵育和共孵育30 min后, 比较两组CYP450活性, TDI抑制作用就区分出来了。与可逆性抑制相比, TDIs在临床上可引起更严重的药物安全问题, 是非常危险的。因此, 医生应该更加警惕这些通过代谢抑制CYP450引起临床药物相互作用的中药注射剂。
目前, 对于中药注射剂HDI多采用体积百分比浓度的评价方式, 由于中药注射剂不能完全阐明化学物质的百分含量, 抑制、诱导作用多是综合作用的结果。另外中药注射剂体外的成分在一定程度上, 与体内的浓度也存在差异。利用高灵敏度的分析仪器阐明中药注射剂中发挥CYP450酶抑制作用的成分及具有CYP450酶时间依赖性的成分, 是当前HDI研究的前沿热点[19], 也是下一步实验研究工作的重要内容。但是, 体外预测在一定的研究阶段能起到预警、预测的效果, 随着科学技术的发展, 基于CYP450s的DDI的信息将会越来越多, 评价也将越来越科学。
作者贡献:韩永龙与郭澄教授为本研究的组织者, 姜波、石美智与张科之为本研究内容的实验者, 陈君君与杨姣为本文撰写和数据处理提供咨询与帮助。
利益冲突:本文研究内容不存在任何利益冲突。
| [1] |
Li X, Chen H, Jia W, et al. A metabolomics-based strategy for the quality control of traditional Chinese medicine: shengmai injection as a case study[J]. Evid Based Complement Alternat Med, 2013, 2013: 836179. |
| [2] |
Xu HM, Wang Y, Liu NF. Safety of an injection with a mixture of extracts from Herba Artemisiae Annuae, Fructus Gardeniae and Flos Lonicerae[J]. Pharm World Sci, 2009, 31: 458-463. DOI:10.1007/s11096-009-9297-9 |
| [3] |
Liu LY. In vitro inhibition of 4 anti-tumor traditional Chinese medicine injections on activities of 7 main cytochrome P450s in human liver microsome[J]. Chin J Clin Pharm Ther(中国临床药理学与治疗学), 2014, 19: 522-527. |
| [4] |
Zou L. Advanced in drug-drug interactions among traditional Chinese medicine injections[J]. Cent South Pharm(中南药学), 2016, 14: 1183-1187. |
| [5] |
Han YL, Li D, Ren B, et al. Evaluation of impact of Herba Erigerontis injection, a Chinese herbal prescription, on rat hepatic cytochrome P450 enzymes by cocktail probe drugs[J]. J Ethnopharmacol, 2012, 139: 104-109. DOI:10.1016/j.jep.2011.10.019 |
| [6] |
Ye LH, Zhao XQ, Kong LT, et al. Inhibitory effects of Danhong Injection and its major constituents on human cytochrome P450 enzymes in vitro[J]. Biomed Chromatogr, 2018, 32: e4250. DOI:10.1002/bmc.4250 |
| [7] |
Chatterjee P, Franklin MR. Human cytochrome p450 inhibition and metabolic-intermediate complex formation by goldenseal extract and its methylenedioxyphenyl components[J]. Drug Metab Dispos, 2003, 31: 1391-1397. DOI:10.1124/dmd.31.11.1391 |
| [8] |
Walsky RL, Gaman EA, Obach RS. Examination of 209 drugs for inhibition of cytochrome P450 2C8[J]. J Clin Pharmacol, 2005, 45: 68-78. DOI:10.1177/0091270004270642 |
| [9] |
Zhang F, Huang J, He RJ, et al. Herb-drug interaction between Styrax and warfarin: molecular basis and mechanism[J]. Phytomedicine, 2020, 77: 153287. DOI:10.1016/j.phymed.2020.153287 |
| [10] |
Gao XY, Guo MX, Li Q, et al. Plasma metabolomic profiling to reveal antipyretic mechanism of Shuang-huang-lian injection on yeast-induced pyrexia rats[J]. PLo S One, 2014, 9: e100017. DOI:10.1371/journal.pone.0100017 |
| [11] |
Tian J. Determination of matrine, sophoridine and oxymatrine in Compound Kushen Injection by HPLC[J]. China J Chin Mater Med(中国中药杂志), 2007, 32: 222-224. |
| [12] |
Ge GB. Deciphering the metabolic fates of herbal constituents and the interactions of herbs with human metabolic system[J]. Chin J Nat Med, 2019, 17: 801-802. |
| [13] |
Hei H, Zhang Y, Xu DQ, et al. Metabolism of the synthetic cannabinoid PX-2 inhuman liver microsomes[J]. Acta Pharm Sin(药学学报), 2020, 55: 1201-1208. |
| [14] |
Shang FH, Feng S, Chen Q, et al. Effects of Jiawei Foshou San capsule on rat hepatic cytochrome P450 enzymes in vitro and in vivo[J]. Acta Pharm Sin(药学学报), 2019, 54: 1101-1107. |
| [15] |
Zhang JX, Qi MJ, Shi MZ, et al. Effects of Danhong injection, a traditional Chinese medicine, on nine cytochrome P450 isoforms in vitro[J]. Biomed Chromatogr, 2019, 33: e4454. DOI:10.1002/bmc.4454 |
| [16] |
Li Z, Hou J, Li W, et al. Effect of injection of Yiqi Fumai Lyophilized Injection on activity of CYP450 subtypes in human live[J]. Drug Eval Res(药物评价研究), 2018, 41: 1224-1228. |
| [17] |
Han YL, Dan L, Bin R, et al. Evaluation of impact of Herba Erigerontis injection, a Chinese herbal prescription, on rat hepatic cytochrome P450 enzymes by cocktail probe drugs[J]. J Ethnopharmacol, 2012, 139: 104-109. DOI:10.1016/j.jep.2011.10.019 |
| [18] |
Xie SS, Wang P, Guo JJ, et al. Research advances of time-dependent inhibition of cytochrome P450 enzymes in drug discovery and development[J]. Chin J New Drugs Clin Rem(中国新药与临床杂志), 2013, 32: 419-426. |
| [19] |
Zhou QH, Zhu YD, Zhang F, et al. Interactions of drug-metabolizing enzymes with the Chinese herb Psoraleae Fructus[J]. Chin J Nat Med, 2019, 17: 858-870. |
 2021, Vol. 56
2021, Vol. 56


