2. 天津中医药大学第一附属医院, 天津 300193;
3. 上海中医药大学附属曙光医院, 上海 201203
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
腹水是肝硬化最常见的并发症之一, 腹水会导致预后不良和患者生活质量降低, 大约60%的肝硬化患者在诊断后10年内会出现腹水[1]。难治性腹水的治疗除内科综合治疗外, 可采用经颈静脉肝内门体静脉内支架分流术、肝移植, 但手术存在固有风险的特点; 长期使用利尿剂治疗容易引起一系列不良反应, 如肝性脑病、肾功能损害、血钠血钾异常等[2-4]。中医学认为肝硬化腹水属“臌胀”、“水臌”范畴, 采用脐部给药治疗臌胀具有确切疗效, 如明代《本草纲目》记载“(商陆)治肿满、小便不利者, 以赤根捣烂, 入麝香三分, 贴于脐心, 以帛束之, 得小便利即肿消”; 又如清代《理瀹骈文》记载“十臌取水膏”, 以大戟、甘遂为君药, 通过神阙穴敷贴给药, 对顽固性腹水具有良好疗效; 亦有近代名医如姜春华用甘遂、芒硝, 夏德馨用甘遂、肉桂、车前草, 及其他医家用商陆、甘遂、大戟、防己、桂枝与冰片等组方敷脐治疗腹水的记载[5]。
消胀方为上海中医药大学附属曙光医院治疗肝硬化腹水的临床效验方, 采用敷脐方式给药, 疗效确切, 在其基础上开发的消胀贴膏获批准用于临床研究(批件号: 2012L01550), 提高了制剂水平和患者依从性。消胀贴膏敷脐给药可明显改善患者腹胀、排气、排便不佳与纳食差等症状, 减少体重、腹围, 增加尿量, 其Ⅰ/Ⅱ级综合有效率为63.3%, 明显高于对照组(38.0%), 证实消胀贴膏脐部给药对肝硬化腹水具有良好的临床疗效[6-8]。消胀贴膏的主要起效机制包括促进胃肠动力, 从而降低腹内压, 增加肾血流量, 促进腹水减退[9]; 下调肝硬化腹水肝组织的血管内皮生长因子表达、降低血清一氧化氮含量, 从而抑制其异常增强的腹腔血管通透性[10]; 降低包括血浆肾素活性、血管紧张素Ⅱ和醛固酮等血管活性物质的水平[11]; 调节氨基酸代谢及其代谢产物的水平, 进而改善机体胃肠动力障碍[12]。
近年来, 代谢组学已被广泛应用于中医药作用机制的研究。采用代谢组学方法, 可对经病理刺激或药物治疗后产生的多参数代谢反应进行研究, 通过整体分析小分子代谢产物, 确定生物标志物, 分析相关代谢通路[13]。目前, 代谢组学在肝病诊断与预后生物标记物的鉴定筛选中表现出应用潜力[14, 15], 并且在利用外源性代谢产物分析或内源性代谢产物鉴定来阐释中药复方的起效机制中展现出独特优势[16, 17]。本研究采用非靶向代谢组学研究方法, 通过系统分析消胀贴膏脐部给药前后患者尿液中内源性代谢轮廓变化, 探讨消胀贴膏脐部给药改善肝硬化腹水的分子机制。
材料与方法仪器与试剂 Microfuge 20R台式微量冷冻离心机(美国Beckman Coulter公司); GENIUS 3涡旋振荡器(德国IKA公司); Eppendorf微量移液器(德国Eppendorf公司); TurboVap LV型氮吹仪(瑞典Biotage公司); Milli-Q纯水仪(美国Millipore公司); Dionex UltiMate 3000液相色谱仪(美国Dionex公司); 色谱柱Thermo Scientific Syncronis C18 (150 mm×2.1 mm, 1.7μm)、Thermo Q-Exactive质谱仪(美国Thermo Fisher公司)。
柳胺酚(批号S408921, 美国Sigma公司); 75%医用酒精(国药集团上海化学试剂公司); 甲醇(色谱纯)、甲酸(色谱纯)、乙腈(色谱纯)均购自美国Thermo Fisher公司; 消胀贴膏(批号: 20170823-1, 常熟雷允上制药有限公司)。
研究对象
一般资料 选取2017年11月至2018年6月于上海中医药大学附属曙光医院确诊为肝硬化腹水伴有胃肠动力障碍的住院患者10例, 年龄均在55~75岁之间, 按随机数字法分成安慰剂组(placebo)和消胀贴膏组(XT)。安慰剂组病毒性肝炎肝硬化2例, 酒精性肝硬化1例, 血吸虫性肝硬化1例; 消胀贴膏组病毒性肝炎肝硬化1例, 酒精性肝硬化3例, 混合性肝硬化2例。两组患者白蛋白、血清总胆红素、Child-Pugh分级等指标差异均无统计学意义, 详见表 1。另入组10例健康志愿者为对照(normal), 均来自上海中医药大学附属曙光医院体检中心, 体检结果正常, 自愿签署知情同意书。研究对象获得上海中医药大学附属曙光医院伦理委员会批准(批件号: 2017-528-11-01)。
| 表 1 Baseline information of various groups (Xiaozhang Tie is abbreviated as XT, international normalized ratio is abbreviated as INR) |
诊断标准 西医诊断标准参照中华医学会肝病学分会于2018年发布的《肝硬化腹水及相关并发症的诊疗指南》[18]。失代偿期肝硬化(肝脏储备功能进行量化评估的分级标准(Child-Pugh分级[19]) B/C级), 有明显肝功能失代偿征象, 如血清白蛋白 < 35 g·L-1; 或总胆红素 > 35μmol·L-1; 或凝血酶原延长, 患者出现腹水。影像学诊断, B超见肝表面明显凹凸不平, 锯齿状或波浪状, 肝边缘变钝, 肝实质回声不均、增强, 呈结节状, 门静脉和脾门静脉内径增宽, 肝内血管走向欠清, 腹腔内可见液性暗区[11]。
中医诊断参照中华中医药学会于2008年发布的《中医内科常见病诊疗指南(中医病证部分)》, 符合中医“臌胀”诊断标准, 即腹膨大, 叩之如鼓, 或见腹上青筋暴露; 纳呆、乏力; 尿少。
纳入标准 ①影像学诊断肝硬化腹水。② ChildPugh B或者C级。③有胃肠动力障碍临床表现, 如恶心、腹胀、食欲减退、呕吐、胃食管反流、持续性肠鸣音等。④无腹部手术史(单纯性阑尾手术或胆囊手术除外)。⑤无慢性消化道疾病史。⑥无除肝硬化以外的其他严重全身器质性疾病。⑦近2周没有服用可能影响胃肠道运动的药物。
排除标准 ①不符合纳入标准任意一条。②有腹部手术史(单纯性阑尾手术或胆囊手术除外)。③无明显胃肠动力障碍的临床表现者。④腹泻患者。⑤近期或在试验过程中曾使用或计划使用影响胃肠动力的药物或制剂。⑥既往检查发现有消化道疾病者。⑦有严重全身器质性疾病。⑧孕妇、哺乳期妇女或计划怀孕者。
治疗方法 消胀贴膏药物组成: 大黄(Rheum palmatum L.) 100 g、甘遂(Euphorbia kansui T.N.Liou ex T.P.Wang) 100 g、莱菔子(Raphanus sativus L.) 100 g、丁香(Eugenia caryophyllata Thunb.) 100 g、沉香(Aquilaria sinensis (Lour.) Glig) 20 g、人工麝香(Moschus Artifactus)0.4 g、冰片(Borneolum Syntheticum) 4 g, 经提取加工后制成凝胶贴膏, 每贴7 cm×7 cm, 生药含量为86.6 mg·cm-2。使用时先对脐部周围皮肤进行清洁消毒, 再直接于脐部外敷。XT组患者给予消胀贴膏脐部贴敷, 每日1贴, 连续3日。Placebo组给予治疗药物含量低于5%的凝胶贴膏脐部贴敷, 每日1贴, 连续3日。Normal组不予治疗。
观察指标 腹部B超检测腹水, 治疗前及治疗后相同体位各检测1次, 专人专机操作。观察患者腹胀、纳食、肛门排气与排便等症状。采用全自动生化仪检测血清白蛋白、总胆红素、肌酐、国际标准化比值(INR)等指标, 治疗前后各测定1次。
样本采集与处理 分别收集治疗前后的三个组别的尿液样品4 mL, 样品处理方法参考文献[20], 3 000×g、4℃低温离心10 min, 取尿液样品400μL置入离心管, 加入甲醇400μL, 涡旋混合5 min, 12 000×g、4℃低温离心10 min, 取上清液于-80℃保存, 待样品集齐后同时检测。另分别将治疗前后三个组别的尿液样品等容混合, 制备质控样品(QC), 每个样本加入200 ng·mL-1柳胺酚作为内标, 按照上述样品预处理方法处理后备测。
超高效液相色谱-质谱联用分析条件
色谱条件 色谱柱为Thermo Scientific Syncronis C18 (150 mm×2.1 mm, 1.7μm), 流动相为A (乙腈)-B(水, 含0.1%甲酸), 流动相梯度为0~1 min, 95%(B); 1~10 min, 95%~65%(B); 10~16 min, 65%~37%(B); 16~18 min, 37%~5%(B); 18~19 min, 5%(B); 19~19.5 min, 5%~95%(B); 19.5~22 min, 95%(B)。流速为0.3 mL·min-1, 进样量为5μL, 柱温为40℃。
质谱条件 采用电喷雾(ESI)离子源, 正负离子模式检测, 检测时间为21 min, 毛细管电压大小为正极3.2 kV, 负极2.8 kV。毛细管温度为320℃, 辅助气加热器温度为300℃, 鞘气(N2)压力为35 psi (1 psi≈6.9 kPa), 辅助气(Ar)压力为10 psi。扫描模式为Full Scan/dd-MS2, 采集范围为m/z 70~1 050。
方法学考察 样品分析前连续检测3份平行QC样本, 并在每组样本分析后随行对1个QC样本进行检测, 提取平行QC中随机6个离子与随行QC中内标物质的保留时间与峰面积, 结果表明各离子在正、负检测模式下的保留时间RSD均小于5%, 峰面积RSD均小于10%, 表明分析方法稳定可靠, 重现性良好。
代谢组学数据收集
图谱数据的提取与前处理方法 首先采用Thermo Scientific SIEVE v2.2软件进行图谱峰识别、峰对齐、保留时间校准、滤噪、信号提取, 并对加合物、二聚体与同位素进行解析归类, 获得包含保留时间、质谱响应强度以及质荷比等信息的二维数据矩阵。随后将数据矩阵导入MetaboAnalyst 4.0软件进行数据预处理, 包括删除拥有50%以上缺失值、总面积归一化、平均中心化与Pareto标尺化。
模式识别 将预处理后的二维数据矩阵导入SIMCA 14.1软件进行多元统计分析, 首先采用主成分分析(PCA)观察样本的总体分布和整个分析过程的稳定性, 随后采用偏最小二乘判别分析(PLS-DA)来区分各组间代谢轮廓的总体差异。最后选用正交偏最小二乘判别分析(OPLS-DA)进行组间两两比较, 寻找差异表达代谢物, 并对构建的OPLS-DA模型进行七次循环交互验证和200次置换检验, 评估模型的拟合度和有效性。
生物标志物的鉴定 根据OPLS-DA分析代谢物VIP值, 结合组间T检验结果(P < 0.05), 筛选潜在的生物标志物。通过HMDB数据库进行代谢物的鉴定, 设定分子量的计算值和实测值之间的误差小于1×10-5, 并将预测代谢物的MS/MS二级图谱进行匹配。最后计算生物标志物在不同组别中峰强度平均值的比值, 得到FC值, 分析标志物的变化趋势。
层次聚类分析与通路富集分析 采用MultiExperiment Viewer V 4.9.0软件, 对有显著差异的代谢物进行层次聚类分析。首先将生物标志物原始数据进行整理, 采用Pearson correlation距离算法与Average linkage clustering聚类方法进行代谢物的聚类分析, 并以热图的方式展示最终结果。运用MetaboAnalyst 4.0平台进行代谢通路富集分析, 通过对气泡图以及各通路P值的比较, 筛选可能的代谢通路。
统计方法 采用SPSS 19.0进行数据统计分析, 符合正态分布的计量资料采用均数±标准差表示, 偏态分布的计量资料采用中位数、四分位数进行统计描述, 计数资料则采用频数、百分率、构成比等指标进行统计描述。正态分布的计量资料比较用T检验或单因素方差分析, 偏态分布的计量资料采用Mann-Whitney U检验分析, 计数资料用卡方检验或Fisher精确概率法, P < 0.05表示差异有显著的统计学意义。
结果 1 消胀贴膏治疗前后患者主要症状的变化根据B超、症状与体征等判断综合疗效, 消胀贴膏治疗组与安慰剂组相比有一定程度好转, 但差异无显著的统计学意义(表 2), 表明在短期的治疗过程中, 消胀贴膏对肝功能的改善作用有限。但经消胀贴膏敷脐治疗后, 患者腹胀症状明显改善, 纳食与排气显著增加, 与前期临床研究结果一致, 提示消胀贴膏短期给药可通过调节肝硬化患者胃肠动力障碍而减轻腹水症状。
| 表 2 Biochemical indicators of various groups |
将安慰剂组与消胀贴膏组给药前样本进行合并, 作为病例组(case-B), 并与正常组(normal-B)进行多元统计分析(-B代表给药前采集的样本)。首先对两组样本进行PCA分析, 构建的PCA模型包含2个主成分, 模型参数R2X=0.319, Q2(cum)=0.020。由得分图(图 1A)可见, 两组样本在第一主成分方向上有较明显的分离趋势, 提示肝硬化腹水患者尿液代谢轮廓发生了显著改变。随后进行OPLS-DA分析, 两组样本分离趋势显著, R2X=0.378, R2Y=0.991, Q2(cum)=0.856, 模型预测能力良好。OPLS-DA置换检验结果如图 1C所示, 构建的OPLS-DA模型具有较好的拟合度。

|
Figure 1 PCA score plot (A), OPLS-DA score plot (B) and associated permutation test (C) of urine samples before administration in normal group and case group.-B means urine samples collected before treatment |
对normal组、placebo组以及XT组给药后尿液样本进行PCA分析, 观察消胀贴膏对患者尿液代谢轮廓的影响。构建的PCA模型R2X=0.414, Q2(cum)=0.072。由得分图(图 2A)可见, placebo-T组以及XT-T组样本与normal-T组样本在第一主成分方向上有较明显的分离(-T代表给药后采集的样本), 但二者之间样本区分不明显。进一步进行PLS-DA分析, R2X=0.248, R2Y=0.858, Q2(cum)=0.393, placebo-T组与XT-T组样本在第二主成分方向呈现分离趋势(图 2B)。

|
Figure 2 PCA score plot (A), PLS-DA score plot (B) of urine samples from normal group and placebo group and XT group.-T means urine samples collected after treatment |
根据case-B组与normal-B组OPLS-DA分析中的VIP值, 结合两组间T检验结果, 筛选鉴定尿液中与疾病相关的生物标志物。最终在尿液中指认了31个生物标志物(表 3), 主要包括氨基酸类代谢物、脂肪酸、甾体激素、嘧啶、嘌呤、单胺类神经递质等。与正常组比较, 20个生物标志物在病例组中均有显著的变化(P < 0.05), 由组间FC值与层次聚类热图(图 3)可见, 肝硬化腹水患者尿液中5-甲基胞嘧啶(5-methylcytosine)、5-羟基色氨酸(5-hydroxy-L-tryptophan)、5-羟基赖氨酸(5-hydroxylysine)、苯乙胺(phenylethylamine)、半胱氨酸(cysteine)具有相近的表达趋势, 均显著上调(P < 0.05)。15个生物标志物在患者尿液中的水平显著降低(P < 0.05), 如肌酸酐(creatinine)、乙酰肉碱(acetylcarnitine)、肉碱(carnitine)表达趋势相近, 泛酸(pantothenic acid)、piperideine、高精氨酸(homo-L-arginine)的表达相近, 以及黄尿酸(xanthurenic acid)、皮质酮(corticosterone)、雄甾酮葡糖苷酸(androsterone glucuronide)、谷氨酸盐(glutamine)等物质。
| 表 3 Identification results of potential biomarkers in urine. *P < 0.05, **P < 0.01, ***P < 0.001 vs Normal-B; #P < 0.05, ##P < 0.01, ###P < 0.001 vs Placebo-T; △P < 0.05, △△P < 0.01 vs XT-B |
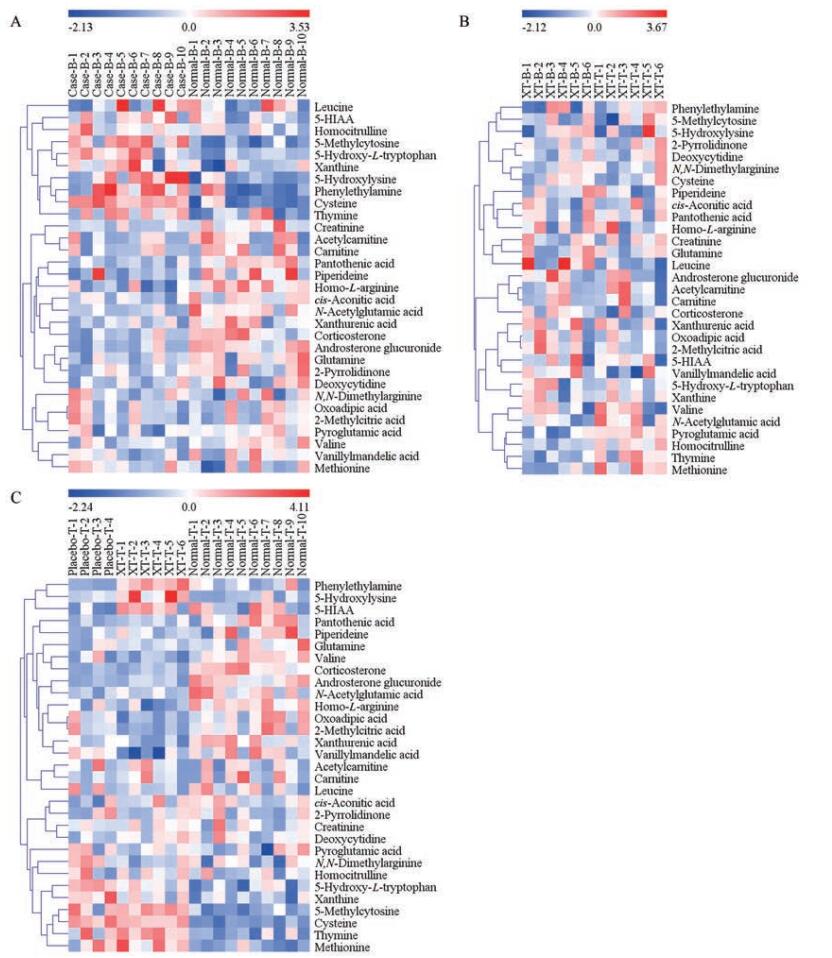
|
Figure 3 Hierarchically clustered heatmap of the urine metabolites levels of human (A: Normal-B group versus Case-B group; B: XT-B group versus XT-T group; C: Normal-T group, Placebo-T group and XT-T group) |
通过统计分析生物标志物在消胀贴膏组与安慰剂组给药后的变化, 以及消胀贴膏组给药前后的变化, 发现14个生物标志物受药物干预有显著的回调(P < 0.05), 其中苯乙胺(phenylethylamine)、胸腺嘧啶(thymine)、5-羟基吲哚乙酸(5-HIAA)、蛋氨酸(methionine)、高瓜氨酸(homocitrulline)、焦谷氨酸(pyroglutamic acid)显著上调(P < 0.05);半胱氨酸(cysteine)、5-羟基色氨酸(5-hydroxy-L-tryptophan)、黄嘌呤(xanthine)、亮氨酸(leucine)、N, N-二甲基精氨酸(N, N-dimethylarginine)、氧代己二酸(oxoadipic acid)、2-甲基柠檬酸(2-methylcitric acid)以及vanillylmandelic acid呈显著下调趋势(P < 0.05), 逐渐回归正常水平。
5 通路富集分析通路富集分析结果如图 4所示。31个生物标志物主要参与27条代谢通路, 涉及机体氨基酸代谢、甾体激素代谢、嘧啶代谢、嘌呤代谢等相关通路。与正常志愿者相比, 肝硬化腹水患者天冬氨酸和谷氨酸代谢通路(alanine, aspartate and glutamate metabolism)、半胱氨酸与蛋氨酸代谢通路(cysteine and methionine metabolism)、甾体激素生物合成(steroid hormone biosynthesis)、泛酸与辅酶生物合成(pantothenate and CoA biosynthesis)等22条代谢通路均发生显著变化(P < 0.05)。与安慰剂组相比, 消胀贴膏治疗对于苯丙氨酸代谢通路(phenylalanine metabolism)、色氨酸代谢通路(tryptophan metabolism)等7条代谢通路具有显著的干预作用(P < 0.05), 提示消胀贴膏对机体氨基酸代谢紊乱有显著的调节作用, 表明调节氨基酸代谢紊乱可能是消胀贴膏治疗肝硬化腹水的重要作用机制。
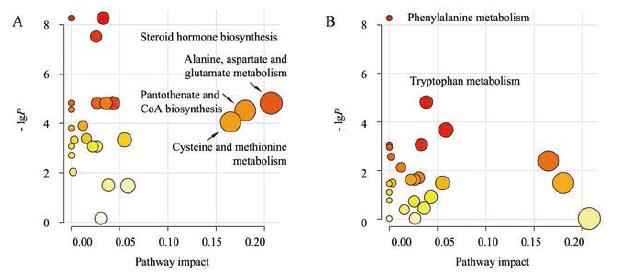
|
Figure 4 Urine biomarker pathway as visualized by bubble plots.A: Case-B group versus Normal-B group; B: XT-T group versus Placebo-T group |
作者所在课题组的前期工作中, 以四氯化碳诱导的肝硬化大鼠模型为研究对象, 发现消胀贴膏可通过调节氨基酸代谢及其代谢产物的水平, 进而改善机体胃肠动力障碍, 促进肝硬化腹水的消退; 通过对回调最为显著的精氨酸/一氧化碳代谢通路进行研究与验证, 发现消胀贴膏可抑制小肠中iNOS与nNOS的表达, 缓解精氨酸代谢异常, 降低一氧化氮水平, 从而改善肝硬化腹水大鼠的胃肠动力障碍, 初步揭示了消胀贴膏治疗肝硬化腹水的作用机制[12]。
本文基于前期研究基础, 以肝硬化腹水患者为研究对象, 对消胀贴膏给药前后患者尿液中内源性代谢轮廓的变化进行分析。最终在尿液中指认了31个生物标志物, 主要涉及氨基酸代谢、脂质代谢、能量代谢等代谢通路。与研究文献[21, 22]及前期结果相比较, 本研究指认的代谢物与已有研究相似度不高, 但尿液生物标志物所富集的代谢通路与前期研究结果较一致, 提示消胀贴膏可通过调节机体氨基酸及其代谢产物的水平, 改善机体神经、免疫与内分泌网络状况, 从而缓解肝硬化腹水及其伴随症状。
通路富集分析结果显示, 苯丙氨酸代谢通路与色氨酸代谢通路是消胀贴膏发挥药效的关键通路。其中, 苯丙氨酸是酪氨酸的代谢前体, 主要从食物中吸收, 吸收后大部分经由肝脏等组织内苯丙氨酸羟化酶的催化转变为酪氨酸。酪氨酸则为体内多种神经递质与激素合成的前体物质, 其主要经酪氨酸羟化酶催化成为二羟基苯丙氨酸, 最终代谢生成多巴胺以及其他神经递质, 如去甲肾上腺素与肾上腺素等。多巴胺与去甲肾上腺素均属于儿茶酚胺类物质, 是调节胃肠动力的重要神经递质。肝硬化患者常存在不同程度的胃肠动力障碍症状, Verne等[23]认为肝硬化患者的自主神经病变是导致胃肠动力障碍的重要因素。多巴胺存在于肠肌神经丛、胃肠黏膜层与肌层内, 具有松弛胃体平滑肌、抑制胃体、胃窦推动、延长胃排空的作用。去甲肾上腺素是作用于胃肠重要的神经递质, 其通过作用于不同受体来调节胃肠功能, 对胃肠运动起抑制性作用[24, 25]。本研究结果提示消胀贴膏可能通过对苯丙氨酸代谢通路的调节, 影响体内交感神经递质的合成释放, 从而改善肝硬化患者的胃肠动力障碍, 增加腹水的排出。
另一方面, 消胀贴膏对肝硬化腹水患者色氨酸代谢紊乱具有显著调节作用, 色氨酸是人体必需的氨基酸, 游离的色氨酸可在色氨酸羟化酶的催化下转变为5-羟色胺(5-hydorxytyrptamien, 5-HT)。5-HT是一种单胺类神经递质, 也是血管活性物质, 在神经系统、内分泌系统与外周血管中起着重要的作用[26]。发生肝硬化时, 由于肝脏对色氨酸的分解代谢能力下降以及低蛋白血症等多方面因素, 引发血清游离色氨酸的水平升高[27], 导致5-HT含量增加, 其经5-HT2A受体介导, 可引起血管平滑肌的收缩, 使肝内阻力增加, 加重门脉高压[28]。另外, 5-HT经由单胺氧化酶催化代谢为5-HIAA, 5-HIAA对肾血管有收缩作用, 可使肾小球滤过率下降, 肾血流减少, 导致水钠潴留, 诱发腹水形成[27]。5-HT对胃肠动力同样发挥着重要的调节作用, 人体内95%的5-HT来源于胃肠道, 其在肠嗜铬细胞及肠神经元中大量合成, 通过与5-HT3R、5-HT4R受体结合, 可直接或间接通过刺激肠内神经纤维的方式作用于肠道平滑肌, 影响胃肠动力[29]。本研究结果提示消胀贴膏可能通过调节5-HT及5-HIAA的代谢紊乱, 进而改善肝硬化腹水症状。
综上所述, 消胀贴膏对肝硬化腹水患者有良好的辅助治疗作用, 其主要通过调节机体氨基酸及其代谢产物的水平, 改善机体神经、免疫与内分泌网络状况, 从而缓解肝硬化腹水及其伴随症状。该研究为消胀贴膏临床用于治疗肝硬化腹水提供了一定科学依据, 但其确切的作用机制有待进一步的研究。
作者贡献:何泽慧、张恺负责试验设计、数据分析及文章撰写, 杨涛负责质谱检测, 邢枫、刘成海负责临床样本与临床数据的收集, 刘珍达负责代谢物鉴定与数据整理, 张永太、冯年平进行了试验指导与论文修改。
利益冲突:无任何利益冲突。
| [1] |
European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis[J]. JHepatol, 2010, 53: 397-417. DOI:10.1016/j.jhep.2010.05.004 |
| [2] |
Maassel NL, Fleming MM, Luo J, et al. Model for end-stage liver disease sodium as a predictor of surgical risk in cirrhotic patients with ascites[J]. J Surg Res, 2020, 250: 45-52. DOI:10.1016/j.jss.2019.12.037 |
| [3] |
Zhao R, Lu J, Shi Y, et al. Current management of refractory ascites in patients with cirrhosis[J]. J Int Med Res, 2018, 46: 1138-1145. DOI:10.1177/0300060517735231 |
| [4] |
Benmassaoud A, Freeman SC, Roccarina D, et al. Comparative study of spironolactone and eplerenone in management of ascites in patients of cirrhosis of liver[J]. Eur J Gastroenterol Hepatol, 2020, 32: 535-539. DOI:10.1097/MEG.0000000000001678 |
| [5] |
Pan CF, Zhang YL, Cai JP, et al. Umbilical therapy for cirrhosis ascites[J]. Chin J Integr Tradit West Med Liver Dis(中西医结合肝病杂志), 2004, 14: 126-128. |
| [6] |
Xing F, Tan Y, Yan GJ, et al. Effects of Chinese herbal cataplasm Xiaozhang Tie on cirrhotic ascites[J]. J Ethnopharmacol, 2012, 139: 343-349. DOI:10.1016/j.jep.2011.10.040 |
| [7] |
Liu CH, Zhang YL, Feng NP, et al. Effects of syndrome dependent umbilical sticking with Shizhang cataplasm and Xuzhang cataplasm in treating liver cirrhosis caused ascites[J]. Chin JIntegr Tradit West Med(中国中西医结合杂志), 2006, 16: 411-414. |
| [8] |
Xing F, Tao YY, Zhang H, et al. Efficacy of internal and external treatment of traditional Chinese medicine for refractory ascites in liver cirrhosis patients[J]. World Chin Med(世界中医药), 2015, 10: 169-173. |
| [9] |
Xing F, Tao YY, Li SH, et al. Discussion on mechanism of Chinese herbal cataplasm Xiaozhangtie in treating cirrhotic ascites based on gastrointestinal motility and transdermal absorbtion[J]. World Chin Med(世界中医药), 2016, 11: 1357-1361. |
| [10] |
Zeng Z, Xing F, Zhou AM, et al. Effect of Xiaozhang Tie on cirrhotic ascites and peritoneal vascular permeability in mice[J]. J Clin Hepatol(临床肝胆病杂志), 2012, 28: 689-694. |
| [11] |
Li S, Tao YY, Xing F, et al. Effect of Xiaozhang plaster in treatment of cirrhotic ascites and its influence on the renin-angiotensin-aldosterone system[J]. J Clin Hepatol(临床肝胆病杂志), 2019, 35: 1496-1500. |
| [12] |
Zhang K, Zhang Y, Li N, et al. An herbal-compound-based combination therapy that relieves cirrhotic ascites by affecting the L-arginine/nitric oxide pathway: a metabolomics-based systematic study[J]. J Ethnopharmacol, 2019, 241: 112034. DOI:10.1016/j.jep.2019.112034 |
| [13] |
A JY, He J, Sun RB. Multivariate statistical analysis for metabolomic data: the key points in principal component analysis[J]. Acta Pharm Sin(药学学报), 2018, 53: 929-937. |
| [14] |
Wei LG, Wang XH, Niu M, et al. Metabolomic screening for diagnostic biomarkers of drug-induced chronic liver injury related cirrhosis[J]. Acta Pharm Sin(药学学报), 2019, 54: 1449-1456. |
| [15] |
Mcphail M, Shawcross DL, Lewis MR, et al. Multivariate metabotyping of plasma predicts survival in patients with decompensated cirrhosis[J]. J Hepatol, 2016, 64: 1058-1067. DOI:10.1016/j.jhep.2016.01.003 |
| [16] |
Zhang XY, Liu Y, Wu H, et al. Identification of major bioactive components and metabolites of Gandou decoction in rat urine by an integrative approach based on UPLC-Q-TOF-MSE coupled with xenometabolomics analytical platform[J]. Acta Pharm Sin(药学学报), 2020, 55: 971-978. |
| [17] |
Yang XL, Zhao SJ, Tian JS, et al. Effects of Guilingji on serum metabolites in D-galactose-induced aging in rats[J]. Acta Pharm Sin(药学学报), 2020, 55: 315-322. |
| [18] |
Xu XY, Ding HG, Li WG, et al. Guidelines on the management of ascites and complications in cirrhosis[J]. Chin J Hepatol(中华肝脏病杂志), 2017, 25: 664-677. |
| [19] |
Yuan GP. The Child-Pugh classification of liver function[J]. Chin J Hepatol(中华肝脏病杂志), 1999, 7: 254. |
| [20] |
Wong MC, Lee WT, Wong JS, et al. An approach towards method development for untargeted urinary metabolite profiling in metabonomic research using UPLC/QToF MS[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2008, 871: 341-348. DOI:10.1016/j.jchromb.2008.06.033 |
| [21] |
Chen T, Xie G, Wang X, et al. Serum and urine metabolite profiling reveals potential biomarkers of human hepatocellular carcinoma[J]. Mol Cell Proteomics, 2011, 10: M110.004945. DOI:10.1074/mcp.M110.004945 |
| [22] |
Bajaj JS, Fan S, Thacker LR, et al. Serum and urinary metabolomics and outcomes in cirrhosis[J]. PLoS One, 2019, 14: e223061. |
| [23] |
Verne GN, Soldevia-Pico C, Robinson ME, et al. Autonomic dysfunction and gastroparesis in cirrhosis[J]. J Clin Gastroenterol, 2004, 38: 72-76. DOI:10.1097/00004836-200401000-00015 |
| [24] |
Braillon A, Gaudin C, Poo JL, et al. Plasma catecholamine concentrations are a reliable index of sympathetic vascular tone in patients with cirrhosis[J]. Hepatology, 1992, 15: 58-62. DOI:10.1002/hep.1840150112 |
| [25] |
Gadano A, Moreau R, Heller J, et al. Relation between severity of liver disease and renal oxygen consumption in patients with cirrhosis[J]. Gut, 1999, 45: 117-121. DOI:10.1136/gut.45.1.117 |
| [26] |
Ruddell RG, Mann DA, Ramm GA. The function of serotonin within the liver[J]. J Hepatol, 2008, 48: 666-675. DOI:10.1016/j.jhep.2008.01.006 |
| [27] |
Chojnacki C, Walecka-Kapica E, Stepien A, et al. Serum and ascitic fluid serotonin levels and 5-hydroxyindoleacetic acid urine excretion in the liver of cirrhotic patients with encephalopathy[J]. Adv Med Sci, 2013, 58: 251-256. DOI:10.2478/ams-2013-0010 |
| [28] |
Li T, Weng SG, Leng XS, et al. Effects of 5-hydroxytamine and its antagonists on hepatic stellate cells[J]. Hepatobiliary Pancreat Dis Int, 2006, 5: 96-100. |
| [29] |
Lesurtel M, Soll C, Graf R, et al. Role of serotonin in the hepatogastro intestinal tract: an old molecule for new perspectives[J]. Cell Mol Life Sci, 2008, 65: 940-952. DOI:10.1007/s00018-007-7377-3 |
 2021, Vol. 56
2021, Vol. 56


