四氢异喹啉是一类重要的N-杂环类化合物, 该类骨架结构存在于许多天然产物中, 例如木兰科、防己科、罂粟科以及樟科等植物中的生物碱均含有相同或类似的结构单元[1]。自1974年Tang等[2]分离出第一个具有抗肿瘤活性的四氢异喹啉天然产物naphthriydi-nomycin开始, 这类具有极强生物活性的天然产物逐渐引起了化学家和药理学家的重视。研究表明, 该类化合物具有多种多样的生物活性, 例如抗肿瘤、抗菌、抗病毒、抗炎和抗血小板凝集等[3]。截至目前, 已从天然产物中提取分离出许多含有四氢异喹啉结构的活性化合物, 如renieramycin G、粉防己碱和那可丁等[4]。其中Schofield等[5]从加勒比海鞘中分离出的一种四氢异喹啉类化合物ecteinascidin 743 (ET-743, Yondelis)已在临床用于软组织瘤的治疗。
尽管四氢异喹啉类化合物具有广泛的生物活性, 但其水溶性差、生物半衰期短[6]、生物利用度较低, 不少化合物还具有神经毒性等缺点[7], 一定程度上限制了该类化合物的应用。随着药物化学和分子药理学的发展, 越来越多四氢异喹啉类化合物的新靶点和作用机制被发现和揭示, 对四氢异喹啉类化合物的合成、改造与修饰已成为药物研究的重点之一[8]。默克公司设计并合成的作用于有丝分裂驱动蛋白的一系列具有强效抗肿瘤活性的四氢喹啉衍生物已用于恶性肿瘤的治疗[9]。Leese等[10]设计合成的四氢异喹啉类似物对人类Burkitt淋巴瘤细胞具有显著抑制作用。此外, 基于四氢异喹啉结构母核的金属配合物也显示出优异的抗肿瘤活性和更低的毒性[11]。综上所述, 四氢异喹啉类化合物在抗肿瘤药物开发中具有很高研究价值。本文以全新合成的以四氢异喹啉为结构母核的化合物SYT-1为研究对象, 通过体外抗肿瘤细胞实验, 初步阐明了该化合物的抑制肿瘤细胞增殖活性及其相关机制, 为其作为抗肿瘤药物的开发奠定基础。
材料与方法药品与试剂 化合物SYT-1由本课题组合成(纯度 > 95%); 胰蛋白酶、DMEM (Dulbecco's modified Eagle's medium)培养基、RPMI1640培养基和胎牛血清(Gibco公司); 顺铂(cisplatin, Sigma公司); PI3K (phos-phatidylinositol 3-kinase)、p-PI3K (phospho-PI3K)、Akt(protein kinase B)、p-Akt (phospho-Akt)和β-actin一抗(Affinity Biosciences公司); Bcl2、Bax和cleaved-cas-pase-3一抗(Cell Signaling Technology公司); JC-1线粒体膜电位检测试剂盒和DCFH-DA (2', 7'-dichlorodihy-drofluorescein diacetate)活性氧检测试剂盒(碧云天公司); Annexin V-FITC/PI (fluorescein isothiocyanate/propidium)细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司)。
细胞培养 乳腺癌MCF-7细胞和肺癌A549细胞(广州吉妮欧生物科技有限公司); 肝癌HepG2细胞和食管鳞癌细胞Kyse-140 (上海盖宁生物科技有限公司); 宫颈癌He La细胞和胃腺癌BGC-823细胞(中山大学科研平台)。分别用含10%胎牛血清的DMEM(MCF-7、HepG2和He La)和RPMI1640 (Kyse-140、BGC-823和A549)培养基培养细胞, 取对数生长期细胞用于实验。
CCK-8法检测细胞毒性 分别消化上述6种细胞, 以细胞密度5 000个/孔接种于96孔板, 24 h后分别加入相同浓度SYT-1和顺铂(终浓度分别为1、5、10、20和40 μmol·L-1)置于CO2培养箱中继续培养。分别于24和48 h后吸去原有培养基, 每孔加入100μL含10%CCK-8液的培养基, 放入孵育箱中继续培养1.5 h, 在酶标仪450 nm波长处测量各孔的吸光度。存活率=[(实验组吸光度-空白孔吸光度)/(对照组吸光度-空白孔吸光度)]×100%。
克隆形成实验 消化MCF-7细胞, 以细胞密度1 000个/孔接种于6孔板内, 十字法使其均匀分布, 待24 h细胞贴壁后, 分组如下: 完全培养基组(control组), 阳性对照组(顺铂1 μmol·L-1), 不同浓度的SYT-1化合物处理组(0.5和1 μmol·L-1)作用24 h后撤掉, 全部换上DMEM完全培养基培养10天, 每间隔2天更换一次培养基。当培养皿中出现肉眼可见克隆且显微镜下可见单个克隆集落细胞计数大于50时, 终止培养, 弃去培养液, 用磷酸盐缓冲液(phosphate buffer saline, PBS)洗2次后, 4%多聚甲醛固定细胞30 min, 加入0.1%结晶紫染色15 min, 蒸馏水洗净干燥后倒置显微镜拍照观察计数。克隆形成率=(克隆数/接种细胞数)×100%。
SYT-1对MCF-7细胞线粒体膜电位的影响 将MCF-7细胞稀释成1×105个/皿的密度接种于共聚焦小皿。待24 h贴壁后, 分为control组和不同浓度SYT-1处理组(10和20 μmol·L-1), 作用6 h后根据JC-1试剂盒说明书对细胞进行染色。CCCP (carbonyl cyanide m-chlorophenyl hydrazine)是一种能引起活细胞线粒体膜电位快速下降的试剂, 在细胞染色前30 min加入作为阳性对照。使用荧光显微镜随机挑选视野进行拍照。流式细胞仪用于细胞线粒体膜电位的定量, 将MCF-7细胞稀释为2×105个/孔的密度接种于6孔板, 应用上述同样方法给药和染色, 最后用胰酶消化细胞, 过筛后上机检测, 流式细胞检测数据用于统计学分析。
SYT-1对MCF-7细胞内活性氧水平的影响 将MCF-7细胞稀释成1×105个/皿的密度接种于共聚焦小皿。待24 h贴壁后, 分为control组和不同浓度SYT-1处理组(5和10 μmol·L-1), 作用4 h后根据DCFH-DA试剂盒说明书对细胞进行染色, 用无血清培养基稀释DCFH-DA。吸去旧培养液, PBS洗2次, 每皿加入DCFH-DA稀释液600μL。在恒温细胞箱内培养15 min, PBS洗细胞3次, 使用荧光显微镜随机挑选视野进行拍照。流式细胞仪定量检测细胞内的活性氧强度, 将MCF-7细胞稀释为2×105个/孔密度接种于6孔板, 应用上述同样方法给药和染色, 最后用胰酶消化细胞, 过筛后上机检测, 流式细胞检测数据用于统计学分析。
细胞凋亡检测 采用Annexin V-FITC/PI复染法检测细胞凋亡, 将MCF-7细胞以3×105个/孔密度接种于6孔板。待24 h细胞贴壁后, 分为control组和不同浓度SYT-1处理组(5、10和20 μmol·L-1), 作用24 h后根据凋亡试剂盒说明书对细胞进行染色。步骤如下: ①收集细胞样品, 将胰酶消化好的细胞收集到离心管中, 1 200 r·min-1离心5 min沉淀细胞; ②用PBS重悬细胞, 再次离心沉淀细胞; ③轻轻吸走PBS上清液, 每个离心管中加入500µL结合缓冲液混匀, 分别加入5µL的Annexin V混合后加入等量PI混匀, 室温避光孵育15~30 min; ④流式细胞仪检测细胞凋亡。
Western blot法检测蛋白表达 将MCF-7细胞以3×105个/孔密度接种于6孔板。待细胞密度到达80%后给药, 分为control组和不同浓度SYT-1处理组(5、10和20 μmol·L-1), 作用24 h后吸弃旧培养基, PBS洗3次, 加入含蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液, 冰上裂解30 min, 于4℃、12 000 r·min-1离心15 min, 取上清液。蛋白定量后, 分别取30μg蛋白加入上样缓冲液, 于95℃变性5 min。10%聚丙烯酰胺-SDS凝胶电泳后, 电转至硝酸纤维素膜上, 5%胎牛血清封闭后孵育一抗过夜, 用TBST (tris buffered saline tween)缓冲液洗涤后, 室温孵育二抗1 h, 洗涤后用凝胶成像系统获取图像, 拷贝数据后应用Image J软件对结果进行灰度分析。
统计学分析 所有数据均用x±s表示, 应用SPSS17.0统计软件进行单因素方差分析, 以P < 0.05表示有显著性差异。
结果 1 SYT-1显著抑制癌细胞增殖经不同浓度SYT-1 (图 1A)作用后, 6种人源癌细胞的增殖均受到不同程度抑制, 并呈剂量依赖性作用。SYT-1和顺铂作用于6种癌细胞的半数抑制浓度(half maximal inhibitory concentration, IC50)分别为: MCF-7, (5.89±0.09)和(8.92±0.15) μmol·L-1; HepG2, (15.13±0.28)和(5.27±0.18) μmol·L-1; Kyse-140, (19.02±1.19)和(3.86±0.32) μmol·L-1; He La, (9.23±0.21)和(5.20±0.31) μmol·L-1; BGC-823, (13.45±0.52)和(7.21±0.46) μmol·L-1; A549, (17.56±0.42)和(12.71±0.82) μmol·L-1。结果显示, SYT-1对乳腺癌MCF-7的抑制作用最强, 其IC50为(5.89±0.09) μmol·L-1(图 1B), 因而选择乳腺癌MCF-7细胞作进一步研究。
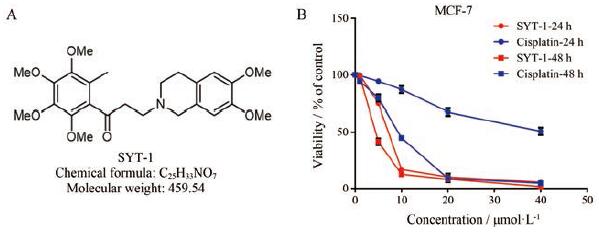
|
Figure 1 SYT-1 inhibited MCF-7 cells proliferation in vitro.A: The structure of SYT-1;B: The anti-proliferative effect of SYT-1 and cisplatin was detected using cell counting kit-8 (CCK-8) assay |
MCF-7细胞经不同浓度的SYT-1作用24 h后的克隆形成实验结果表明(图 2), SYT-1能显著抑制MCF-7细胞的单克隆形成能力, 且其效果优于同等浓度的顺铂。
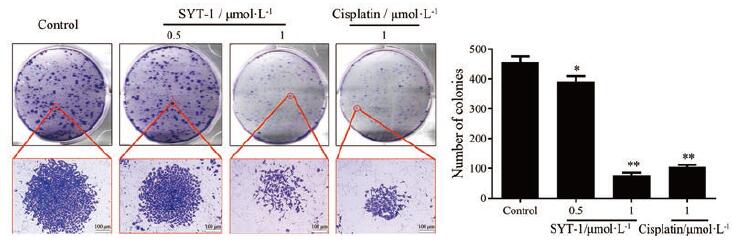
|
Figure 2 SYT-1 inhibited MCF-7 cells clone formation in vitro.MCF-7 cells were treated with SYT-1 and cisplatin at different concentra-tions for 24 h.Scale bar: 100 μm.n=3, x±s.*P < 0.05, **P < 0.01 vs control |
本研究采用JC-1探针检测细胞线粒体膜电位。在正常情况下细胞线粒体膜电位较高, JC-1聚集在线粒体基质中, 形成聚合物并产生红色荧光; 当线粒体膜电位较低时, JC-1不能聚集在线粒体基质中而成为单体, 可以产生绿色荧光。因此, 通过分析红/绿荧光的比值可以反映线粒体膜电位变化。实验结果表明(图 3), 不同浓度SYT-1作用6 h后, 能引起MCF-7细胞线粒体膜电位显著下降。

|
Figure 3 Changes of mitochondrial membrane potential of MCF-7 cells after administration of SYT-1 at 10 and 20 μmol·L-1 for 6 h.Scale bar: 25 μm.n=3, x±s.*P < 0.05, **P < 0.01 vs control.CCCP: Carbonyl cyanide m-chlorophenyl hydrazine |
本研究采用DCFH-DA探针检测细胞内活性氧水平。DCFH-DA能被细胞内的酯酶水解生成DCFH, 细胞内活性氧可以氧化无荧光DCFH生成有荧光的DCF, 因而通过检测荧光强度就可以反映细胞内的活性氧水平。实验结果表明(图 4), 经不同浓度SYT-1作用4 h后, 能引起MCF-7细胞内活性氧水平显著升高。

|
Figure 4 4 Change in reactive oxygen species level of MCF-7 cells after administration of SYT-1 at 5 and 10 μmol·L-1 for 4 h.Scale bar: 50 μm.n=3, x±s.**P < 0.01 vs control.DCF: 2', 7'-Dichlorofluorescein |
采用流式细胞仪检测不同浓度SYT-1化合物(5、10和20 μmol·L-1)干预MCF-7细胞24 h后的凋亡情况。使用PI和Annexin V双染方式检测细胞凋亡, 凋亡细胞分布为右下象限代表早期凋亡细胞, 右上象限代表晚期凋亡细胞, 凋亡率为早期凋亡率与晚期凋亡率之和。结果显示(图 5A), SYT-1作用24 h后, 与对照组相比, 实验组细胞凋亡率由(6.9±0.4)%增加到(81.2±2.5)%, 表明SYT-1诱导MCF-7肿瘤细胞的凋亡具有剂量依赖性。Western blot结果如图 5B所示, 与对照组相比, 不同浓度SYT-1 (5、10和20µmol·L-1)处理MCF-7细胞24 h后, 抗凋亡蛋白Bcl2表达量减少, 促凋亡蛋白Bax和cleaved-caspase-3表达量增加, 结果提示SYT-1可能通过调控Bcl2家族蛋白以及cleaved-caspase-3蛋白的表达促进细胞凋亡。
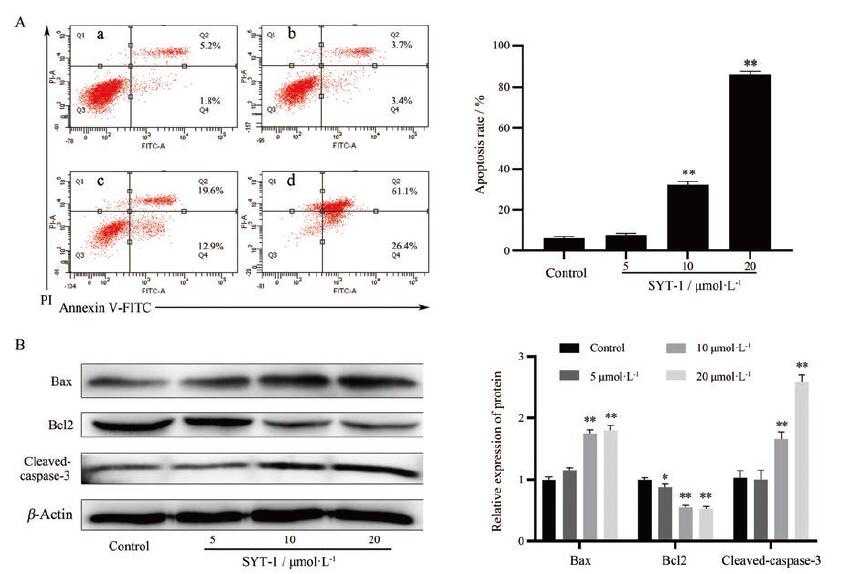
|
Figure 5 SYT-1 induced apoptosis of MCF-7 cells in a dose-dependent manner.The apoptosis rate and the levels of apoptosis-related proteins of MCF-7 cells were detected after administrating of SYT-1 at 5, 10, and 20 μmol·L-1 for 24 h.A: Effect of SYT-1 on cell apoptosis in MCF-7 cells determined by using the flow cytometric analysis.a: Control group; b, c, d: 5, 10, 20 µmol·L-1SYT-1 treated group; B: The levels of apoptosis-related proteins were measured by using Western blot analysis.Quantification of protein levels relative toβ-actin.n=3, x±s.*P < 0.0 5, **P < 0.01 vs control.PI: Propidium iodide; FITC: Fluorescein isothiocyanate |
采用Western blot法对PI3K-Akt信号通路蛋白PI3K和Akt进行检测。实验结果表明(图 6), SYT-1以10和20 μmol·L-1的浓度干预MCF-7细胞24 h后, MCF-7细胞的PI3K和Akt磷酸化水平均显著降低, 表明SYT-1能通过抑制PI3K-Akt信号通路的活化发挥抗乳腺癌MCF-7细胞的作用。
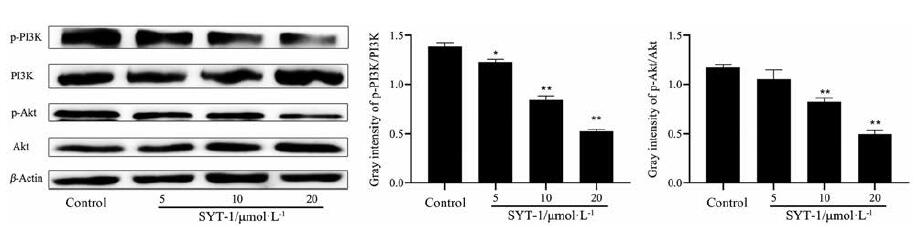
|
Figure 6 SYT-1 inhibited the phosphorylation of PI3K and Akt.Western blot analysis showed the activation of PI3K-Akt signal pathway was suppressed after administration of SYT-1 for 24 h.β-Actin was used as a loading control.The bands were quantified by densitometry scanning by using Image J.n=3, x±s.*P < 0.05, **P < 0.01 vs control.PI3K: Phosphatidylinositol 3-kinase; Akt: Protein kinase B |
本研究探索了四氢异喹啉类新化合物SYT-1对6种人源癌细胞增殖的影响, 结果表明SYT-1对6种癌细胞均具有增殖抑制作用, 其中对乳腺癌MCF-7的作用最强并优于顺铂, 进一步研究发现, SYT-1能显著抑制MCF-7的单克隆形成能力并诱导细胞凋亡, 初步显示出该化合物具有抑制乳腺癌细胞增殖的潜力。
细胞凋亡过程需要多种信号分子参与, 按凋亡途径可分为外源性凋亡信号通路(死亡受体信号通路)和内源性凋亡信号通路(线粒体信号通路)[12]。线粒体不仅是细胞的能量中心, 也是内源性凋亡信号发生的重要场所和凋亡过程的重要组成部分, 线粒体膜电位的下降是细胞凋亡早期的一个标志性事件[13]。线粒体的功能紊乱和活性氧累积密切相关[14]。活性氧是细胞进行正常有氧代谢时线粒体呼吸链中产生的中间产物, 刺激因素引起线粒体膜电位的丧失会导致线粒体渗透过渡孔开放, 从而释放活性氧, 引起胞内活性氧水平的升高, 进一步导致细胞凋亡的发生[15]。Bcl2家族是调节线粒体介导的细胞凋亡的关键成员, 包括促凋亡蛋白Bad、Bax和抑凋亡蛋白Bcl2等[16], 这些蛋白在细胞内死亡信号被接收后激活。首先, 外膜表面与Bcl2家族成员的Bak和Bax之间存在反应, 线粒体膜的通透性发生改变, 导致跨膜电位的丧失和细胞色素细胞因子的释放, 释放的细胞色素C可以与凋亡蛋白酶激活物caspase-9和Apaf1形成簇复合物, 通过剪切和激活caspase-3, 引起caspase级联反应诱导细胞凋亡[17]。本研究发现SYT-1可引起MCF-7细胞快速线粒体膜电位下降、活性氧水平的升高并引起相关凋亡蛋白的变化, 揭示内源性凋亡途径是该化合物引起细胞凋亡的重要途经。
PI3K-Akt信号通路在肿瘤细胞的存活、增殖、迁移和侵袭等过程中起重要作用[18]。研究发现活化的3,4,5-三磷酸磷脂酰肌醇(phosphatidylinositol 3,4,5-trisphos-phate, PIP3)会募集胞质内的丝氨酸/苏氨酸激酶, 然后通过与Akt N端的PH (pleckstrin homology)结构域结合将其转运到细胞膜上, PI3K在3-磷酸肌醇依赖性蛋白激酶1 (phosphoinositide dependent protein kinase-1, PDK1)辅助下磷酸化Akt上的丝氨酸磷酸化位点(Ser473)和苏氨酸磷酸化位点(Thr308), 最终会激活Akt信号[19]。活化后的Akt会将信号放大, 进而引起多种生物学效应, 如增殖、抗凋亡、促进细胞迁移与侵袭等[20]。为了进一步探讨化合物SYT-1干预乳腺癌MCF-7细胞后对相关信号通路的影响, 本实验采用蛋白印迹法对信号通路蛋白PI3K和Akt进行检测, 结果表明, 与对照组相比, 各SYT-1实验组细胞的磷酸化蛋白p-PI3K和p-Akt均显著下降, 表明SYT-1可能通过抑制PI3K-Akt信号通路进而发挥抗乳腺癌MCF-7细胞的作用。
尽管具有广谱抗肿瘤活性, 但目前研究较多的四氢异喹啉类化合物如小檗碱、粉防己碱和那可丁等普遍存在水溶性差、药效较弱和毒副作用较大等缺点[21, 22], 此外, 双苄基异喹啉类化合物如粉防己碱等还具有碱性较强的特点, 这给相应的口服控释抗癌制剂的研发带来困难[23]。因此, 对四氢异喹啉类化合物进行全新设计合成和改造, 使其具有更显著的药理活性和更优异的溶解性能具有重要意义。本课题组以此为出发点设计并合成了一系列结构新颖、分子量适中的全新四氢异喹啉类化合物, 已初步显示出较好的抑制癌细胞增殖的药理活性。
综上所述, 本研究显示, SYT-1作为一种全新合成的四氢异喹啉类化合物具有优异的抑制肿瘤细胞增殖的活性, 可以显著抑制乳腺癌MCF-7细胞的单克隆形成能力, 引起细胞线粒体膜电位快速下降和活性氧水平的升高, 并激活内源性凋亡途径而引起细胞凋亡。此外, 抑制PI3K-Akt信号通路的活化可能是SYT-1发挥抑制肿瘤细胞增殖作用的机制之一。本研究为四氢异喹啉类化合物的进一步研究开发提供了参考。
作者贡献:徐道华负责文章的设计、撰写及修改; 李玉运负责文章的撰写、修改及实验; 马文辉、曾展维和廖诗怡参与实验; 孙宇通和黄云生负责化合物的合成、文章的设计及修改。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Pyne ME, Kevvai K, Grewal PS, et al. A yeast platform for highlevel synthesis of tetrahydroisoquinoline alkaloids[J]. Nat Com-mun, 2020, 11: 3330-3337. DOI:10.1038/s41467-020-17173-w |
| [2] |
Tang GL, Tang MC, Song LQ, et al. Biosynthesis of tetrahy-droisoquinoline antibiotics[J]. Curr Top Med Chem, 2016, 16: 1717-1726. DOI:10.2174/1568026616666151012112329 |
| [3] |
Liu CJ, Liu DY, Lan X. Bioactivity diversity and functional mechanism of tetrahydroisoquinoline alkaloids[J]. Acta Pharm Sin(药学学报), 2010, 45: 9-16. |
| [4] |
Zhu P, Ye W, Li J, et al. Design, synthesis, and biological evalua-tion of novel tetrahydroisoquinoline derivatives as potential anti-tumor candidate[J]. Chem Biol Drug Des, 2017, 89: 443-455. DOI:10.1111/cbdd.12873 |
| [5] |
Schofield MM, Jain S, Porat D, et al. Identification and analysis of the bacterial endosymbiont specialized for production of the chemotherapeutic natural product ET-743[J]. Environ Microbiol, 2015, 17: 3964-3975. DOI:10.1111/1462-2920.12908 |
| [6] |
Altinoz MA, Topcu G, Hacimuftuoglu A, et al. Noscapine, a nonaddictive opioid and microtubule-inhibitor in potential treatment of glioblastoma[J]. Neurochem Res, 2019, 44: 1796-1806. DOI:10.1007/s11064-019-02837-x |
| [7] |
Singh IP, Shah P. Tetrahydroisoquinolines in therapeutics: a patent review(2010-2015)[J]. Expert Opin Ther Pat, 2017, 27: 17-36. DOI:10.1080/13543776.2017.1236084 |
| [8] |
Montgomery D, Anand JP, Baber MA, et al. Structure-activity relationships of 7-substituted dimethyltyrosine-tetrahydroiso-quinoline opioid peptidomimetics[J]. Molecules, 2019, 24: 4302-4323. DOI:10.3390/molecules24234302 |
| [9] |
Tarby CM, Kaltenbach RR, Huynh T, et al. Inhibitors of human mitotic kinesin Eg5: characterization of the 4-phenyl-tetrahy-droisoquinoline lead series[J]. Bioorg Med Chem Lett, 2006, 16: 2095-2100. DOI:10.1016/j.bmcl.2006.01.056 |
| [10] |
Leese MP, Jourdan F, Dohle W, et al. Steroidomimetic tetrahy-droisoquinolines for the design of new microtubule disruptors[J]. ACS Med Chem Lett, 2012, 3: 5-9. DOI:10.1021/ml200232c |
| [11] |
Huang KB, Wang FY, Tang XM, et al. Organometallic gold(III) complexes similar to tetrahydroisoquinoline induce ER-stressmediated apoptosis and pro-death autophagy in A549 cancer cells[J]. J Med Chem, 2018, 61: 3478-3490. DOI:10.1021/acs.jmedchem.7b01694 |
| [12] |
D'Arcy MS. Cell death: a review of the major forms of apopto-sis, necrosis and autophagy[J]. Cell Biol Int, 2019, 43: 582-592. DOI:10.1002/cbin.11137 |
| [13] |
Nambiar J, Vijayakumar G, Drishya G, et al. (I-3,II-3)-Biacace-tin-mediated cell death involves mitochondria[J]. Mol Cell Bio-chem, 2019, 451: 79-90. DOI:10.1007/s11010-018-3395-8 |
| [14] |
Lee MS. Role of mitochondrial function in cell death and body metabolism[J]. Front Biosci, 2016, 21: 1233-1244. DOI:10.2741/4453 |
| [15] |
Qi S, Guo L, Yan S, et al. Hypocrellin A-based photodynamic action induces apoptosis in A549 cells through ROS-mediated mitochondrial signaling pathway[J]. Acta Pharm Sin B, 2019, 9: 279-293. DOI:10.1016/j.apsb.2018.12.004 |
| [16] |
Wang W, Liu X, Guo X, et al. Mitofusin-2 triggers cervical carci-noma cell He La apoptosis via mitochondrial pathway in mouse model[J]. Cell Physiol Biochem, 2018, 46: 69-81. DOI:10.1159/000488410 |
| [17] |
Ahmed K, Zaidi SF, Mati-Ur-Rehman, et al. Hyperthermia and protein homeostasis: cytoprotection and cell death[J]. J Therm Biol, 2020, 91: 102615. DOI:10.1016/j.jtherbio.2020.102615 |
| [18] |
Shorning BY, Dass MS, Smalley MJ, et al. The PI3K-AKT-mTOR pathway and prostate cancer: at the crossroads of AR, MAPK, and WNT signaling[J]. Int J Mol Sci, 2020, 21: 4507-4515. DOI:10.3390/ijms21124507 |
| [19] |
Jiang S, Meng L, Chen X, et al. MEX3A promotes triple nega-tive breast cancer proliferation and migration via the PI3K/AKTsignaling pathway[J]. Exp Cell Res, 2020, 359: 112191. |
| [20] |
Khan MA, Jain VK, Rizwanullah M, et al. PI3K/AKT/m TORpathway inhibitors in triple-negative breast cancer: a review on drug discovery and future challenges[J]. Drug Discov Today, 2019, 24: 2181-2191. DOI:10.1016/j.drudis.2019.09.001 |
| [21] |
Mirhadi E, Rezaee M, Malaekeh-Nikouei B. Nano strategies for berberine delivery, a natural alkaloid of berberis[J]. Biomed Pharmacother, 2018, 104: 465-473. DOI:10.1016/j.biopha.2018.05.067 |
| [22] |
Singh H, Singh P, Kumari K, et al. A review on noscapine, and its impact on heme metabolism[J]. Curr Drug Metab, 2013, 14: 351-360. DOI:10.2174/1389200211314030010 |
| [23] |
Luan F, He X, Zeng N. Tetrandrine: a review of its anticancer potentials, clinical settings, pharmacokinetics and drug delivery systems[J]. J Pharm Pharmacol, 2020, 22: 339-358. |
 2021, Vol. 56
2021, Vol. 56


