肺高血压是一种十分严重的血管性疾病, 表现为肺动脉压力升高超过一定界值的一种血流动力学和病理生理状态。一般以在海平面静息状态下, 右心导管检测肺动脉平均压≥25 mmHg为诊断标准[1]。目前肺动脉高压主要分为5类, 其中动脉性肺动脉高压(pulmonary arterial hypertension, PAH)是比例最高且研究最广的一类[2], 这一类型的肺动脉高压发病原因为肺小动脉原发性病变、血管重塑增厚而导致的肺动脉阻力进行性增加, 最终将导致患者右心衰竭甚至死亡。
野百合碱(monocrotaline, MCT)是从野百合种子中提取的一种吡咯烷生物碱, 其在大鼠体内被肝脏的混合功能氧化酶转化为野百合吡咯。野百合吡咯可以在肺血管内皮细胞中形成DNA和蛋白加合物, 从而导致细胞周期停滞, 使内皮细胞凋亡, 血管内膜剥脱, 从而引起肺动脉平滑肌细胞进行性增殖, 肺血管重塑, 导致肺动脉压进行性增高, 造成肺动脉高压[3]。利用野百合碱导致的大鼠肺动脉高压模型是一种十分经典常用的动物模型, 具有简单方便和重复性好等特点, 有利于药物药效评价及机制研究[4-6]。
Rho激酶(Rho-associated coiled-coil forming protein serine/threonine kinase, ROCK)是一种在哺乳动物体内广泛分布的丝氨酸/苏氨酸蛋白激酶, 分子质量约为164 k Da, 其参与多种细胞生理病理过程, 在细胞的分裂、收缩、黏附、迁移和分泌等活动中均发挥重要作用。近些年来研究发现, Rho激酶抑制剂对于肺动脉高压可能具有一定的预防和治疗作用。目前唯一上市的Rho激酶抑制剂—法舒地尔, 在多个国家进行了肺动脉高压治疗的临床研究。许多其他Rho激酶抑制剂的临床前研究结果也证明, 抑制Rho激酶的活性对于肺动脉高压的治疗具有积极作用[7-10]。
Rho激酶抑制剂DL0805-2是本实验室前期经过高通量筛选及结构优化得到的一种新型吲唑类化合物[11], 主要药效学实验证明DL0805-2具有明显的Rho激酶抑制活性及血管舒张作用[12], 且前期研究发现DL0805-2在去甲肾上腺素激增所致大鼠高血压危象模型上具有一定的作用, 发现其不仅能快速降低血压, 对肺动脉压力也具有明显的降低作用, 且对高血压危象所导致的肺部损伤具有良好的保护作用[13]。在体外水平, 观察到DL0805-2对离体大鼠肺动脉血管具有一定的舒张作用(未发表的数据), 且可对肺动脉内皮细胞及平滑肌细胞产生一定的保护作用[14]。因此本文采用野百合碱诱导的大鼠肺动脉高压模型, 就DL0805-2对肺动脉高压的预防治疗作用及机制进行了探索。
材料与方法实验动物 SPF (specified pathogen free)级SD(Sprague Dawley)大鼠, 雄性, 170~190 g, 132只(北京华阜康生物科技股份有限公司, 许可证编号: SCXK(京) 2014-0004)。动物福利和实验过程均遵循中国医学科学院药物研究所动物伦理委员会规定, 符合《美国国立卫生研究院实验动物饲养和使用指南》的要求。
试剂 吲唑类新结构化合物DL0805-2由中国医学科学院药物研究所合成, 纯度 > 99%;一水合波生坦(bosentan, BST, 北京华奉联博科技有限公司); 肝素钠(北京华迈科生物技术有限公司), 使用前以生理盐水配制成100 u·m L-1溶液; 戊巴比妥钠(北京华迈科生物技术有限责任公司), 以生理盐水配制成2%(w/v)溶液, 作为麻醉剂, 腹腔注射剂量为40~60 mg·kg-1; MCT (美国Sigma公司); ALT (alanine aminotransferase)、AST (aspartate aminotransferase)和LDH (lactic dehy‐drogenase)检测试剂盒(中生北控生物科技股份有限公司); 内皮素-1 (endothelin-1, ET-1)、白介素(inter‐leukin, IL)-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和B型利钠肽前体的氨基末端(N-ter‐minal pro brain natriuretic peptide, NT-pro BNP) ELISA(enzyme-linked immunosorbent assay)检测试剂盒(武汉华美生物工程有限公司); ROCK2 (Rho-associated protein kinase 2)、MYPT1 (myosin phosphatase target subunit 1)、p-MYPT1 (phospho-myosin phosphatase target subunit 1)、ERM (ezrin radixin moesin)及p-ERM(phospho-ERM)一抗(美国Cell Signaling Technology公司); GAPDH (glyceraldehyde-3-phosphate dehydroge‐nase)一抗(美国Proteintech公司); 辣根过氧化物酶标记的山羊抗兔和山羊抗鼠二抗(北京康为世纪生物科技有限公司)。
仪器 Spectra Max M5酶标仪(Molecular Devices公司); 高速冷冻离心机(Beckman Coulter公司); BL-420S生物机能实验系统(成都泰盟科技有限公司); TBA-420全自动生化仪(日本TOSHIBA公司)。
实验动物分组及处理 分组: 雄性SD大鼠132只, 体重170~190 g, 随机分成6组, 每组22只, 分为正常对照组、模型对照组、波生坦组(30 mg·kg-1, 灌胃给药)以及DL0805-2低、中和高剂量组(1、3和10 mg·kg-1, 腹腔注射)。处理: 除正常对照组皮下注射同体积生理盐水外, 其余各组一次性皮下注射给予MCT 50 mg·kg-1, 制备大鼠肺动脉高压模型。在造模后第7天开始给药, 每天1次, 正常组和模型组给予等剂量生理盐水, 连续给药18天, 每天记录动物体重。实验终点为第25天, 动物用戊巴比妥钠麻醉后固定, 进行血流动力学、脏器指数、肺部炎症因子和免疫组化等相关生理生化指标的检测。
血流动力学指标的测定 大鼠右颈部备皮, 剪开右颈部皮肤, 分离右颈外静脉周围肌肉和神经, 剥离出血管, 埋线两根, 远心端结扎, 近心端打一活结, 用显微剪剪一“v”形切口, 将充满肝素钠溶液的导管缓慢推进上腔静脉, 在上腔静脉汇入右心房处, 缓慢提拉转动导管, 使其进入右心房, 此时出现心房波, 继续旋转推进导管, 将导管插入右心室, 待出现稳定的右心室波形后, 检测右心室收缩压(right ventricular systolic pres‐sure, RVSP), 记录2 min。大鼠颈部正中切口, 分离肌肉神经, 剥离出血管, 埋线3根。远心端用线结扎, 近心端用线暂时阻断血流。小心做一“v”形切口, 插入预先充满肝素钠溶液(100 u·m L-1)的聚乙烯塑料管(PE50), 用线将导管与血管固定, 重新恢复血流, 待血压稳定后, 记录主动脉收缩压、舒张压和心率。
血清生化指标检测 血流动力学指标检测结束后, 经腹主动脉取血, 室温凝聚后, 4℃、6 000 r·min-1离心10 min, 吸取上清并分装, 保存于-80℃, 待各种生化指标检测。全自动生化仪检测血清中LDH、AST和ALT活性变化情况, ELISA试剂盒检测血清中肺动脉高压疾病标志物NT-pro BNP的含量, 具体按试剂盒说明书操作。
各脏器指数测定 实验终点将大鼠取血后动物死亡。取大鼠心脏、肺和肝, 用生理盐水洗净余血后, 用滤纸将多余液体吸干, 进行称重, 与大鼠体重进行比较, 得到脏器指数。为观察右心室肥厚情况, 首先沿心耳下缘将整个心室从心脏上剪下, 其次沿心室间隔边缘剪下右心室, 称取右心室RV (right ventricle)及左心室加室间隔[LV (left ventricle)+S (septum)]重量, 计算RV/(LV+S)及右心室重量与体重之比[RW (right heart weight)/BW (body weight)]确定右心室肥厚程度。
肺部组织中内皮素ET-1及炎症因子含量检测 对肺组织进行匀浆, 低温离心后吸取上清, BCA法对样品中的蛋白浓度进行定量, 蛋白样品保存于-80℃。ELISA试剂盒检测肺组织匀浆中的ET-1及IL-6、IL-1β和TNF-α炎症因子的浓度, 并与总蛋白浓度进行比较, 以确定肺组织中ET-1及炎症因子的变化情况。
肺动脉病理组织学观察 将肺动脉从心脏上剥离, 得到较粗的肺动脉主干和左、右肺动脉干, 将其放入4%多聚甲醛中固定, 石蜡包埋后连续切片, 取肺动脉主干部位切片进行HE (hemotoxylin and eosin)染色, 观察并统计血管壁增厚情况。
Western blot法检测肺动脉相关信号通路 每段肺动脉加入80μL裂解缓冲液进行蛋白提取, 匀浆后, 于4℃、12 000×g离心20 min, 收集上清。用BCA(bicinchoninic acid)法确定蛋白浓度, 按比例加入5×loading buffer, 煮沸10 min使蛋白变性。蛋白进行SDS-PAGE (sodium dodecyl sulfate polyacrylamide gel electrophoresis)电泳, Western blot法鉴定ROCK2、MYPT1、p-MYPT1、ERM及p-ERM蛋白的表达情况。该部分实验中加入了Rho激酶抑制剂法舒地尔进行比较, 以考察DL0805-2对ROCK通路的影响。
数据统计 数据均以mean±SEM (standard error of mean)表示。各组间的差异比较采用单因素方差分析(one-way ANOVA)或双因素方差分析(two-way ANOVA), P < 0.05认为具有统计学意义。
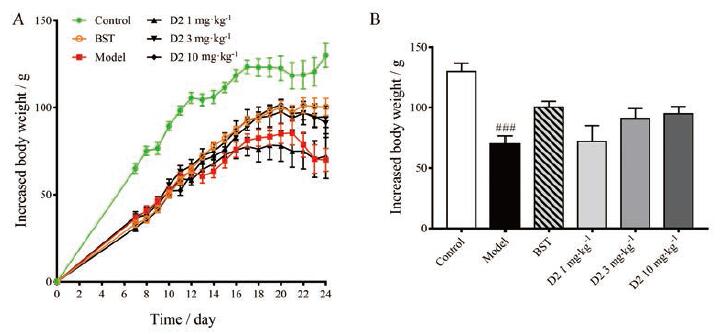
结果 1 DL0805-2对肺动脉高压大鼠体重的影响在给药期间监测动物体重, 结果显示(图 1), MCT造模后动物体重增长放缓, 且在实验进程第20天左右出现体重突然下降的情况。阳性药波生坦能够一定程度改善体重下降, 中、高剂量DL0805-2在一定程度上对疾病导致的体重减轻具有改善作用, 但统计结果无显著性差异。
|
Figure 1 Effects of DL0805-2 on the monocrotaline induced pulmonary arterial hypertension (PAH) rats.A: Changes in body weight of rats in each group during the experiment; B: Statistics of changes in body weight of rats in each group compared with that at day 0.Values are expressed as mean±standard error of mean (SEM), n=10-12.###P < 0.001 vs control.D2:DL0805-2;BST: Bosentan |
利用一次性皮下注射MCT (50 mg·kg-1)所建立的肺动脉高压模型具有较高的死亡率, 在本实验中动物死亡情况主要发生在实验终点前的2~3天内。在实验终点统计每组大鼠死亡情况, 计算死亡率。结果如表 1所示, 模型组死亡率接近50%, 给予阳性药波生坦及DL0805-2均能明显提高动物生存率, 尤其在给予DL0805-2中、高剂量后, 可将疾病动物生存率提高至90.9%。
| 表 1 Effect of DL0805-2 on survival rate of the monocrotaline induced PAH rats (n = 22) |
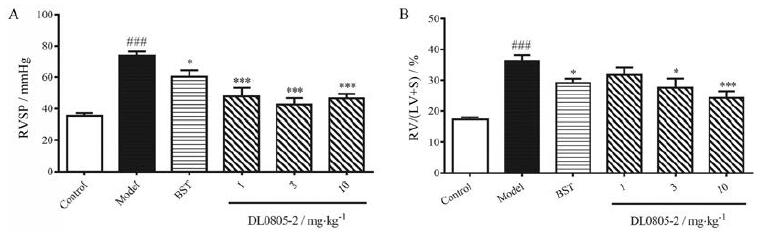
通过右颈静脉插管, 导管可到达右心室。本实验利用右心室的收缩压代替肺动脉压力, 结果如图 2所示。模型组大鼠较正常大鼠右心室收缩压明显升高, 从35.41升至73.73 mmHg, 给予DL0805-2及波生坦均可显著降低肺动脉高压大鼠的右心室收缩压及右心室肥厚指数(right ventricular hypertrophy index, RVHI)。
|
Figure 2 Effects of DL0805-2 on right ventricular systolic pressure (RVSP, A) and right ventricular hypertrophy index (RVHI, B) of the monocrotaline induced PAH rats.Values are expressed as mean±SEM, n=8-10.###P < 0.001 vs control; *P < 0.05, ***P < 0.001 vs model.RV: Right ventricle; LV: Left ventricle; S: Septum |
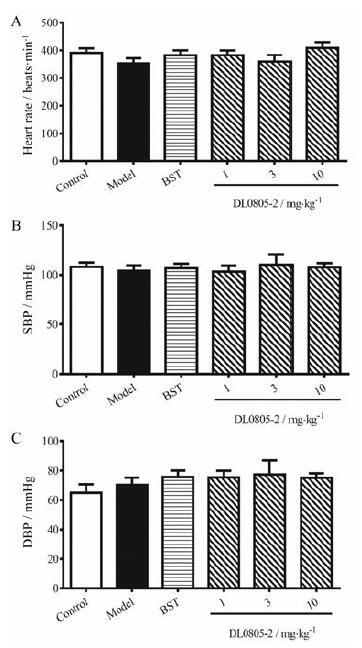
在实验终点, 用左颈动脉插管方法检测大鼠体循环是否正常, 包括动物的心率、收缩压(systolic blood pressure, SBP)和舒张压(diastolic blood pressure, DBP)。结果如图 3所示, 在实验终点时, 肺动脉高压模型大鼠体循环参数未发生明显改变, 给予药物干预后同样对大鼠体循环心率和血压没有显著影响。
|
Figure 3 Effects of DL0805-2 on systemic hemodynamics of the monocrotaline induced PAH rats.A: Heart rate; B: Systolic blood pressure (SBP); C: Diastolic blood pressure (DBP).Values are expressed as mean±SEM, n=8-10 |
在肺动脉高压发生发展到一定阶段, 由于心肺功能障碍会导致多种脏器发生水肿。结果如图 4所示, 模型动物与正常动物相比, 其心脏、右心室、肝脏和肺的脏器指数明显升高。给予DL0805-2高剂量和阳性药波生坦可以显著降低心脏指数。对于肝脏指数, DL0805-2高剂量和阳性化合物可以缓解肝脏水肿。DL0805-2在肺脏上的保护作用较为明显, 其各剂量以及阳性化合物波生坦均能显著缓解PAH大鼠的肺部水肿及脏器指数的升高, 且呈现出一定的剂量依赖性。

|
Figure 4 Effects of DL0805-2 on the organ index of the monocrotaline induced PAH rats including heart (A), heart ventricle (B), liver (C), and lung (D).Values are expressed as mean±SEM, n=8.###P < 0.001 vs control; *P < 0.05, ***P < 0.001 vs model.RW: Right heart weight; BW: Body weight |
当肺动脉高压发生时, 肺部血液循环发生障碍, 进而导致肺功能障碍。肺部血管及各种细胞功能紊乱, 炎症细胞浸润, 产生大量炎性因子, 因此用ELISA方法对肺部组织匀浆中的3种炎性因子包括TNF-α、IL-6及IL-1β进行了检测。结果如图 5所示, 模型组动物肺部各种炎症因子产生明显增加, 低剂量的DL0805-2对3种炎性因子均有明显的降低作用, 而中、高剂量的DL0805-2对IL-6及IL-1β具有明显的降低作用, 尤其是对IL-1β的改善作用显示出比阳性药波生坦更好的效果, 说明DL0805-2能够显著降低疾病动物肺部的炎症反应。

|
Figure 5 Effects of DL0805-2 on inflammatory factors including tumor necrosis factor-α(TNF-α, A), interleukin (IL)-6 (B), and IL-1β (C) in lung tissues of the monocrotaline induced PAH rats.Values are expressed as mean±SEM, n=6.#P < 0.05, ##P < 0.01 vs control; *P < 0.05, **P < 0.01, ***P < 0.001 vs model |
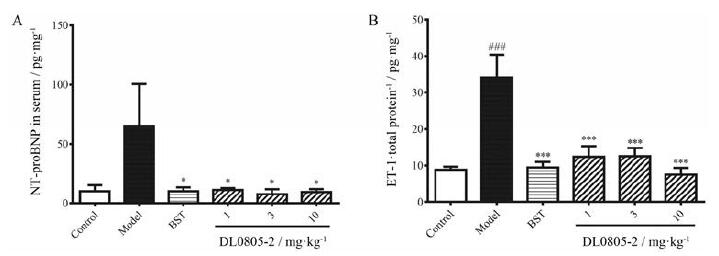
目前认为NT-pro BNP和ET-1是肺动脉高压发病的疾病标志物。动物肺部组织中ET-1含量升高是肺动脉高压发生发展的重要标志。NT-pro BNP是B型利钠肽前体的氨基末端, 目前是临床上诊断心衰的指标之一, 也能够反映肺动脉高压发病情况。利用ELISA方法对肺组织匀浆中ET-1的含量及血清中NT-pro BNP的浓度进行检测, 结果显示(图 6), 当肺动脉高压发生时, 动物肺组织中的ET-1及血清中的NT-pro BNP的含量明显升高, 而给予DL0805-2及阳性化合物可显著下调二者水平, 说明DL0805-2可在一定程度上改善肺动脉高压的发生发展。
|
Figure 6 DL0805-2 significantly decreased the release of NT-pro BNP (A) in the serum and ET-1 (B) in lungs of the monocrotaline induced PAH rats.Values are expressed as mean±SEM, n=6.###P < 0.001 vs control; *P < 0.05, ***P < 0.001 vs model.NT-pro BNP: N-terminal pro brain natriuretic peptide; ET-1:Endothelin-1 |
利用全自动血液生化分析仪, 检测MCT致肺动脉高压大鼠血清中ALT、AST和LDH含量的变化。结果如图 7所示, 肺动脉高压模型动物较正常动物血清中ALT、AST和LDH的含量均有显著上升, 说明PAH动物发生了组织器官损伤尤其是心脏损伤。给予药物干预后, 各指标明显改善, 且DL0805-2的作用呈现一定的剂量依赖性。

|
Figure 7 Effects of DL0805-2 on serum levels of aspartate aminotransferase (AST, A), alanine aminotransferase (ALT, B), and lactic dehy‐drogenase (LDH, C) in the monocrotaline induced PAH rats.Values are expressed as mean±SEM, n=6.#P < 0.05 vs control; *P < 0.05 vs model |
利用MCT一次性注射建立大鼠肺动脉高压模型的原理是MCT选择性损伤肺动脉内皮细胞, 造成其凋亡脱落, 导致平滑肌层暴露, 使细胞增殖迁移, 肺动脉血管壁增厚。在实验终点对大鼠肺动脉进行HE染色, 观察其血管壁增厚情况, 并对其进行统计分析, 评价化合物对肺动脉血管增厚的作用。HE染色病理照片结果显示(图 8A~F), 肺动脉高压大鼠肺动脉主干血管壁明显增厚, 平滑肌细胞排列致密紧凑, 而各给药组均能在一定程度上缓解血管中层增厚的情况(图 8G)。
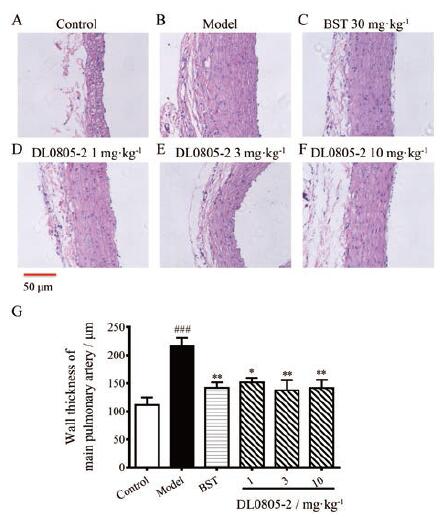
|
Figure 8 Hematoxylin and eosin (HE) staining of main pulmo‐nary arteries in the monocrotaline induced PAH rats (200×).Scale bar: 50 μm.A–F: Representative vascular morphology images of normal or PAH rats treated with or without drugs; G: Statistical re‐sults of vascular wall thickness.Values are expressed as mean±SEM, n=5.###P < 0.001 vs control; *P < 0.05, **P < 0.01 vs model |
近年来发现Rho/ROCK通路在肺动脉高压发生发展中发挥重要作用。Rho/ROCK通路的激活可以促进血管平滑肌细胞的增殖、迁移和表型转化。DL0805-2作为最先以Rho激酶抑制剂而被发现的全新结构小分子化合物, 在前期工作中已发现它能够通过抑制Rho/ROCK通路活性起到舒张胸主动脉血管[15]及肠系膜微血管[11]的作用。因此在本实验中, 利用蛋白免疫印迹方法观察各组大鼠肺动脉中Rho/ROCK通路的激活情况, 以初步说明DL0805-2抗肺动脉高压作用的分子机制。结果如图 9所示, 在肺动脉高压发生时, 肺血管内ROCK2蛋白表达水平明显上调, Rho激酶直接作用底物MYPT1和ERM的磷酸化水平也明显增加。DL0805-2干预后可显著抑制ROCK2表达上调和MYPT1磷酸化水平上升。对于ERM的磷酸化水平, DL0805-2也显示出一定的抑制趋势, 但统计结果并无显著性差异。
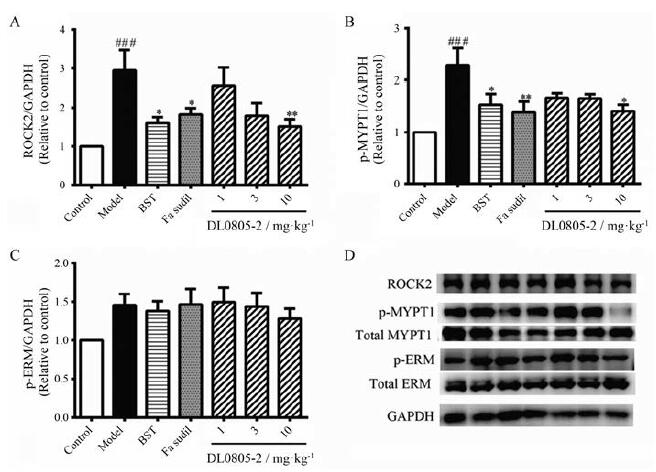
|
Figure 9 Effects of DL0805-2 on the ROCK pathway in the main pulmonary artery of PAH rats.A-C: Densitometric analyses of the relative amount of Rho-associated protein kinase 2 (ROCK2, A), phospho-myosin phosphatase target subunit 1 (p-MYPT1, B), and phospho-ezrin radixin moesin (p-ERM, C) compared to the glyceraldehyde-3-phosphate dehydrogenase (GAPDH); D: Representative Western blot analyses for ROCK2, p-MYPT1, total-MYPT1, p-ERM, total-ERM, and GAPDH.Values are expressed as mean±SEM, n=4.###P < 0.001 vs control; *P < 0.05, **P < 0.01 vs model |
在肺动脉高压发生发展过程中, 疾病动物由于心肺功能发生障碍, 病情加重, 导致体重增长缓慢, 甚至在后期出现体重下降情况。在给药期间监测动物的体重, 模型动物体重在实验第20天左右开始快速下降, 中、高剂量DL0805-2和阳性药波生坦对模型动物体重的下降具有一定改善作用。在实验终点, 对各组动物的各项指标进行了全面的评价。首先, 通过对右心室插管检测其收缩压力(近似等于肺动脉压力), 发现DL0805-2确实可降低肺动脉压力, 减轻右心室负荷。
在肺动脉高压发展到一定阶段, 由于右心功能的变化, 左心功能可能会代偿性加强, 导致体循环血压升高, 因此通过左颈静脉插管检测体循环心率和血压, 这些指标在各组均未显示出明显差异, 原因是本实验终点仍处于肺动脉高压发病的早期, 右心功能的变化还未累及左心。本研究的目的是评价DL0805-2在肺动脉高压发病早期的治疗和预防作用, 而在后续的工作中, 应对DL0805-2对肺动脉高压疾病终末期的治疗作用进行进一步的评价。
在包括NT-pro BNP、Hs-Tn T (high-sensitive troponin T)、Hs-CRP (high-sensitivity C-reactive protein)、galectin-3、RDW (red cell distribution width)及e GFR (epidermal growth factor receptor)在内的与肺动脉高压相关的疾病标志物中, 有研究证明NT-pro BNP是成人肺动脉高压疾病过程中发生不良心脏事件最关键的判别指标, 也是预后心脏功能评价的重要指标[16], 因此本实验将NT-pro BNP作为肺动脉高压判断发生发展的疾病标志物。另一个能够反映肺动脉高压疾病进程的标志物为内皮素(ET-1)。研究表明, 当肺动脉高压发生发展时, 由于肺动脉血管内皮功能紊乱, 会导致ET-1大量合成释放, 而ET-1也是造成肺血管收缩和肺动脉重塑的主要因素[17], 因此检测动物体内ET-1的含量也能够反映疾病的进展程度。本实验利用ELISA实验分别对血清中的NT-pro BNP和肺组织中的ET-1含量进行检测, 发现肺动脉高压模型动物的这2个指标的含量显著升高, 而各给药组均能显著降低NT-pro BNP和ET-1含量, 说明DL0805-2能对肺动脉高压产生一定的缓解作用。
肺动脉高压作为一种恶性疾病, 其呼吸系统和循环系统都会受到严重影响[18], 在肺动脉高压发展过程中, 多种脏器会发生损伤。为了检测化合物对肺动脉高压所致其他组织的损伤, 实验采取了两种方式: ①对各脏器进行称重, 与体重比较后计算脏器指数; ②对血清中的生化指标进行检测。通过计算脏器指数, 发现肺动脉高压发生时心脏、肝脏和肺脏均有明显水肿, 脏器指数明显上升。高剂量的DL0805-2可抑制疾病动物心脏重量的增加, 但DL0805-2的突出药效体现在肺脏损伤方面。给予DL0805-2后, 疾病动物肺脏的水肿程度明显降低。通过血液生化指标检测发现, 动物血液中ALT、AST及LDH的含量有所下降, 说明DL0805-2对肺动脉高压大鼠各脏器的损伤均产生一定的抑制作用。
在肺动脉高压发生与发展过程中, 肺动脉-肺脏-右心室形成该疾病的发病轴, 三者之间关系密不可分, 是整个疾病的发病基础。因此, 利用病理组化切片观察动物各组织细微结构变化情况。在肺动脉血管上, 利用HE染色发现, 模型动物肺动脉血管平滑肌层增殖和血管壁厚度明显大于正常动物, 而各给药组可以明显缓解这一症状。在肺脏上, DL0805-2表现出较明显的保护作用。在肺动脉高压发生过程中, 肺组织受到损伤后会发生一系列炎症反应, 使肺组织内炎症因子大量增加, 并将进一步损伤器官, 造成疾病恶化。给予DL0805-2后, 各炎症因子水平显著下降, 肺组织中的炎症反应明显减弱。
利用蛋白免疫印迹方法观察肺动脉血管中蛋白表达变化情况, 发现肺动脉高压大鼠肺主动脉Rho激酶通路被激活。模型组大鼠肺动脉血管中Rho激酶表达水平明显上调, 并且其直接底物MYPT1和ERM的磷酸化水平增高, 说明Rho激酶活性显著升高。Rho激酶通路的激活能够通过两个过程促进肺动脉血管重塑, 一方面平滑肌细胞中Rho激酶的激活可以促进细胞增殖并发生表型转化, 另一方面Rho激酶的激活介导平滑肌细胞的收缩, 使血管持续处于紧张状态[19]。给药组能够降低Rho激酶的表达, 并抑制Rho激酶底物磷酸化的上调, 这可能是DL0805-2抑制肺血管重塑的内在机制。
综上所述, 利用一次性皮下注射野百合碱所致的大鼠肺动脉高压模型, 在疾病发展初期利用DL0805-2进行治疗, 可以在一定程度上延缓疾病发展进程, 有效提高动物的生存率。对肺动脉高压诊断的几个常用指标均有明显改善作用, 且其防治作用是通过Rho激酶通路发挥的。综合这些结果, 可以认为DL0805-2在预防治疗肺动脉高压上具有一定潜力, 值得进一步研究。
作者贡献:袁天翊、方莲花和杜冠华构思并设计了本研究; 陈迪撰写了手稿; 陈俞材和张惠芳参与了动物实验; 牛子冉参与了试剂的准备; 袁天翊和陈迪进行了数据处理与分析。
利益冲突:本文所有作者无任何利益冲突。
| [1] |
Montani D, Chaumais MC, Guignabert C, et al. Targeted thera‐pies in pulmonary arterial hypertension[J]. Pharmacol Ther, 2014, 141: 172-191. DOI:10.1016/j.pharmthera.2013.10.002 |
| [2] |
Lau EMT, Giannoulatou E, Celermajer DS, et al. Epidemiology and treatment of pulmonary arterial hypertension[J]. Nat Rev Cardiol, 2017, 14: 603-614. DOI:10.1038/nrcardio.2017.84 |
| [3] |
Gomez-Arroyo JG, Farkas L, Alhussaini AA, et al. The monocro‐taline model of pulmonary hypertension in perspective[J]. Am JPhysiol Lung Cell Mol Physiol, 2012, 302: L363-L369. DOI:10.1152/ajplung.00212.2011 |
| [4] |
Zhang M, Chang Z, Zhang P, et al. Protective effects of 18β-glycyrrhetinic acid on pulmonary arterial hypertension via regu‐lation of Rho A/Rho kinsase pathway[J]. Chem Biol Interact, 2019, 311: 108749. DOI:10.1016/j.cbi.2019.108749 |
| [5] |
Bordenave J, Thuillet R, Tu L, et al. Neutralization of CXCL12 attenuates established pulmonary hypertension in rats[J]. Cardio‐vasc Res, 2020, 116: 686-697. DOI:10.1093/cvr/cvz153 |
| [6] |
Li XW, Guo B, Shen YY, et al. Effect of chrysin on expression of NOX4 and NF-κB in right ventricle of monocrotaline-induced pulmonary arterial hypertension of rats[J]. Acta Pharm Sin(药学学报), 2015, 50: 1128-1134. |
| [7] |
Ruan H, Zhang Y, Liu R, et al. The acute effects of 30 mg vs 60 mg of intravenous fasudil on patients with congenital heart defects and severe pulmonary arterial hypertension[J]. Congenit Heart Dis, 2019, 14: 645-650. DOI:10.1111/chd.12764 |
| [8] |
Zhang X, Zhang X, Wang S, et al. Effects of fasudil on patients with pulmonary hypertension associated with left ventricular heart failure with preserved ejection fraction: a prospective inter‐vention study[J]. Can Respir J, 2018, 2018: 3148259. |
| [9] |
Zhang Y, Wu S. Effects of fasudil on pulmonary hypertension in clinical practice[J]. Pulm Pharmacol Ther, 2017, 46: 54-63. DOI:10.1016/j.pupt.2017.08.002 |
| [10] |
Zhao ZX, Pan Y. Relationship between Rho GTPase family regulation and vascular endothelial barrier function[J]. Acta Pharm Sin(药学学报), 2019, 54: 587-593. |
| [11] |
Wu YJ, Wang SB, Yuan TY, et al. Preliminary study on pharma‐cokinetics of DL0805-1: a novel Rho kinase inhibitor in rats[J]. Chin Pharmacol Bull(中国药理学通报), 2014, 30: 1171-1174. |
| [12] |
Yuan TY, Yan Y, Wu YJ, et al. Vasodilatory effect of a novel Rhokinase inhibitor, DL0805-2, on the rat mesenteric artery and its potential mechanisms[J]. Cardiovasc Drugs Ther, 2014, 28: 415-424. DOI:10.1007/s10557-014-6544-7 |
| [13] |
Yuan TY, Chen D, Chen YC, et al. A novel hypertensive crisis rat model established by excessive norepinephrine infusion and the potential therapeutic effects of Rho-kinase inhibitors on it[J]. Biomed Pharmacother, 2019, 109: 1867-1875. DOI:10.1016/j.biopha.2018.11.061 |
| [14] |
Yuan TY, Zhang HF, Chen YC, et al. The protective effect of DL0805 derivatives on pulmonary artery cells and the underlying mechanisms study[J]. Curr Vasc Pharmacol, 2017, 15: 469-476. |
| [15] |
Yuan TY, Chen YC, Zhang HF, et al. DL0805-2, a novel indazole derivative, relaxes angiotensin II-induced contractions of rat aortic rings by inhibiting Rho kinase and calcium fluxes[J]. Acta Pharmacol Sin, 2016, 37: 604-616. DOI:10.1038/aps.2015.161 |
| [16] |
Geenen LW, Baggen VJM, Koudstaal T, et al. The prognostic value of various biomarkers in adults with pulmonary hypertension; a multi-biomarker approach[J]. Am Heart J, 2019, 208: 91-99. DOI:10.1016/j.ahj.2018.11.001 |
| [17] |
Chester AH, Yacoub MH. The role of endothelin-1 in pulmonary arterial hypertension[J]. Glob Cardiol Sci Pract, 2014, 2014: 62-78. |
| [18] |
Laveneziana P, Humbert M, Godinas L, et al. Inspiratory muscle function, dynamic hyperinflation and exertional dyspnoea in pulmonary arterial hypertension[J]. Eur Respir J, 2015, 45: 1495-1498. DOI:10.1183/09031936.00153214 |
| [19] |
Antoniu SA. Targeting RhoA/ROCK pathway in pulmonary arterial hypertension[J]. Expert Opin Ther Targets, 2012, 16: 355-363. DOI:10.1517/14728222.2012.671811 |
 2021, Vol. 56
2021, Vol. 56


