疲劳可分为中枢性疲劳和外周性疲劳。外周性疲劳主要表现为骨骼肌疲劳[1], 临床表现为虚弱、肌肉无力、耐力降低和行动能力受限等。研究表明, 骨骼肌产生ATP以驱动肌球蛋白运动, ATP含量减少或再合成障碍是导致疲劳的重要因素[2]。糖尿病是一种以高血糖为主要特征的代谢疾病[3], 疲劳是糖尿病的并发症之一, 临床发现, 约有68%的糖尿病患者存在不同程度的疲劳感[4]。
血清素(5-HT)是一种亲水性的小分子化合物, 因其不能通过血脑屏障故存在中枢和外周两个5-HT合成系统[5]。5-HT由L-色氨酸经过色氨酸羟化酶(trypto‐phan hydroxylase, Tph)羟化形成5-羟色氨酸, 再经芳香簇氨基酸脱羧酶(aromatic L-amino acid decarboxylase, AADC)脱羧形成5-HT, 外周为Tph1, 中枢为Tph2[6]。5-HT与细胞膜5-HT受体(5-HT receptor, 5-HTR)结合后能激活细胞内的第二信使级联反应, 这类受体目前已知的有7种亚型。除了5-HT3R为配体电压门控受体外, 其他均为G蛋白偶联受体[7]。5-HT浓度在糖尿病患者中升高, 提示其可能参与糖尿病并发症的发生, 5-HT2AR与血管平滑肌收缩、血小板聚集、血栓形成和冠状动脉痉挛相关[8]。糖尿病高血糖导致血管内皮细胞损伤, 而血管内皮细胞损伤激活凝血系统和血小板, 血小板释放储存在其致密颗粒中的5-HT, 使血浆5-HT浓度明显升高[9]。5-HT有很强的收缩血管和促进血小板聚集功能, 激活5-HT2AR引起血管平滑肌收缩, 同时促进血小板聚集, 使毛细血管处于收缩及高凝状态[10], 促进细胞间黏附分子1和血管细胞黏附分子1的释放[11], 最终导致循环障碍, 加重糖尿病及其并发症的发生和发展。5-HT也能通过非受体作用与一些蛋白上的谷氨酸残基发生共价结合, 激活细胞内的相关信号通路[12]。传统观点认为外周5-HT主要由胃肠道合成, 经血小板输送至外周组织, 调节血管收缩、骨代谢以及器官发育等[13, 14]。本课题组在前期研究发现, 外周5-HT的合成不仅限于小肠, 且5-HT在细胞中还存在另一种重要的生物学作用。肝细胞存在明确的5-HT合成酶表达, 且在糖皮质激素、高血糖和高浓度饱和脂肪酸等致病因素的刺激下可导致其5-HT2AR、Tph1和AADC表达上调, 这种5-HT系统异常激活可视为一种病理预警, 其直接参与非酒精脂肪肝的形成和胰岛素抵抗的发生[15-19]。研究发现, 肝细胞5-HT合成酶和5-HT2AR表达上调, 不仅是导致脂代谢紊乱的重要原因, 还是导致肝细胞产生氧化应激的关键原因。5-HT2AR一方面调控脂代谢, 另一方面还调控肝细胞单胺氧化酶A (monoamine oxidase A, MAO-A)的表达。由于5-HT合成增加及MAO-A被上调, 导致肝细胞线粒体的5-HT降解增加、使过氧化氢(H2O2)产生增多, 从而使细胞产生氧化应激, 导致下游炎症信号通路激活和炎症因子产生增多等多种细胞异常, 这是高脂和高糖诱导肝细胞氧化应激、炎症和脂代谢紊乱的根本性原因[17]。
已有研究表明, 体内的5-HT含量与疲劳之间存在着显著联系。国内研究学者发现, 慢性疲劳小鼠血清的5-HT水平显著升高[20, 21]。尽管目前已知2型糖尿病(type 2 diabetes mellitus, T2DM)患者骨骼肌线粒体合成ATP的能力显著受限, 但尚不清楚这种病理改变是能量供应障碍还是线粒体功能障碍所致[22]。鉴于研究者对T2DM时肝细胞线粒体活性氧(reactive oxygen species, ROS)产生与5-HT系统关系的新发现[17], 本课题组推测T2DM患者骨骼肌线粒体损伤可能也与骨骼肌5-HT系统激活、MAO-A降解5-HT导致线粒体H2O2产生增多相关, 导致ATP合成减少。本研究选择长期高脂饲料(high fat diet, HFD)联合小剂量链脲佐菌素(streptozotocin, STZ)诱导小鼠产生T2DM, 并结合体外小鼠肌管细胞(C2C12)培养实验, 以探究T2DM病理性疲劳与骨骼肌5-HT系统异常的相关性。
材料与方法主要药品和试剂 动物实验用盐酸沙格雷酯(sarpogrelate hydrochloride, SH)(上海乾劲化工科技有限公司)及卡比多巴(carbidopa, CDP)(浙江手心制药有限公司); 细胞实验用SH、CDP及氯吉兰(clorgyline, CGL)(美国CSNpharm公司); STZ (北京博爱港商贸中心); 5-HT (美国Selleck公司); 棕榈酸(palmitic acid)、D-葡萄糖(D-glucose)(美国Sigma-Aldrich公司); 乳酸(lactic acid, LA)、非酯化脂肪酸(non-esterified fatty acid, NEFA)、H2O2、丙二醛(malondialdehyde, MDA)、肝/肌糖原、ATP检测试剂盒(南京建成生物工程研究所); 5-HT、白介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)ELISA检测试剂盒(上海酶联生物科技有限公司); 线粒体荧光探针(MitoTracker® Red CMXRos)、线粒体膜电位荧光探针(JC-1)、ROS荧光探针(DCFH-DA)(上海碧云天生物技术有限公司); 5-HT2AR抗体、MAO-A抗体(美国Santa Cruz Biotechnology公司); Tph1抗体、AADC抗体(美国Signalway Antibody公司); GAPDH抗体、ATP合成酶6 (ATP synthase-6, ATP6)抗体、肉碱棕榈酰转移酶1 (carnitine palmitoyltransferase-1, CTP1)抗体(武汉三鹰生物技术有限公司); NF-κB p65抗体、过氧化物酶体增殖物激活受体-γ共激活因子-1(peroxisome proliferator-activated receptor γ coactivator-1, PGC-1)抗体、IκBα抗体、磷酸化IκBα(p-IκBα)及磷酸化NF-κB p65 (p-NF-κB p65)抗体(沈阳万类生物公司)。
主要仪器 Infinite M200 Pro多功能酶标仪(瑞士Tecan Group Ltd.公司); Tanon 5200 Multi全自动化学发光系统(上海天能有限公司); RD1121-RSN-M小鼠转棒疲劳仪(上海移数信息科技有限公司); LSM700系激光共聚焦显微镜(德国ZEISS公司)。
实验动物 SPF级C57BL/6J雄性小鼠, 体重20±2 g, 合格证编号: 201904706, 扬州大学比较医学中心。动物饲养于中国药科大学动物实验中心的清洁动物房。实验规程和方案符合中国药科大学药学动物实验中心伦理审查标准。
T2DM模型建立、分组及给药 `本实验采用HFD(北京博爱港商贸中心)喂养联合腹腔注射(i.p.)小剂量STZ (55 mg·kg-1·d-1, 连续注射5天)诱导建立T2DM模型。小鼠根据体重随机分成两组。对照组给予普通饲料, HFD喂养组给予HFD喂养8周后, i.p.STZ造模。造模一周后禁食6 h测定小鼠空腹血糖(fasting blood glucose, FBG), FBG≥11.1 mmol·L-1作为成模标准。所选动物继续HFD喂养4周, 选择FBG 13~19 mmol·L-1的小鼠并结合外观状态(活动正常、未明显消瘦)重新随机分组: 模型组—灌胃(i.g.) 0.5%羧甲基纤维素钠(CMC-Na)溶液; SH给药组—i.g.SH每次50 mg·kg-1; CDP给药组—i.g.每次CDP 50 mg·kg-1; 复方组(SC组)—i.g.SH+CDP溶液每次50 mg·kg-1, 其中SH∶CDP=2∶1[注: 依据实验室以前在非酒精性脂肪肝及T2DM的研究结果[17], 该比率疗效最佳, 且复方中SH、CDP接近等摩尔剂量(SH、CDP相对分子质量分别为465、226)]。另设对照组—i.g.0.5%CMC-Na溶液。每天给药两次, 连续给药9周, 故各给药组每天给药剂量均为100 mg·kg-1。给药期间模型组动物若死亡用备用动物补充; 而给药组在给药前5周内若死亡用备用动物补充, 5周后死亡则不再补充。连续给药9周后, 动物经戊巴比妥钠(45 mg·kg-1)麻醉, 取血浆(血液加抗凝剂提取血浆)、后肢骨骼肌及组织在-80℃冷冻备用。
细胞培养实验 C2C12细胞(小鼠骨骼肌肌管细胞), 目录号SCSP-505, 中国科院学院细胞库提供, 待细胞生长至80%, 加入含2%马血清DMEM培养基诱导细胞分化。诱导分化5天可见轮廓清晰的肌管细胞。然后, 用含10%胎牛血清的DMEM培养, 待细胞生长至占培养皿80%~90%时进行传代。给药实验时, 细胞用无血清DMEM培养, 按实验要求加入刺激剂及药物, 刺激24 h更换培养基。
小鼠抗疲劳作用评估 用“转棒实验”评估小鼠的疲劳程度。给药第6周和第9周进行转棒实验, 记录各组小鼠的转棒停留时间(riding time), 时间越短表示小鼠越易疲劳。转棒实验开始前2 h灌胃给药, 将小鼠置于转棒上, 40 s内将转速由0加速至20 r·min-1; 当转棒转速达到20 r·min-1时开始计时, 直至小鼠从转棒跌落, 该时间即为“riding time”。
细胞内ROS及线粒体膜电位测定 采用荧光探针法测定细胞内ROS和线粒体膜电位。细胞刺激后, 每孔加入1 mL工作液置于培养箱中温育20 min。温育完成后, 用染色缓冲液润洗数次再加入2 mL无血清DMEM培养基, 于荧光显微镜观察并拍照。
生化指标 使用ELISA法测定血浆、骨骼肌及细胞内或培养基内5-HT、IL-1β和TNF-α。根据试剂盒说明书测定血浆、骨骼肌及细胞或培养基肝/肌糖原、组织及细胞内蛋白、LA、NEFA、甘油三酯(TG)、ATP、H2O2、MDA、超氧化物歧化酶(SOD)和ROS等含量。
蛋白表达检测 采用Western blot法检测组织及细胞内5-HT2AR、AADC、Tph1、MAO-A、IκBα(Ser32和Ser36)和NF-κB p65 (Ser536)磷酸化及总蛋白、CPT1、ATP6和PGC-1表达。
统计学分析 实验结果以均值±标准差(x±s)表示, SPSS version 21进行统计分析。转棒实验结果“转棒停留时间”用非参数检验之Mann-Whitney U检验; 其余数据, 多组间比较用单因素方差分析, 选择LSD检验(方差齐)或Games-Howell检验(方差不齐); 两组间比较, 用Student-t检验。P < 0.05表示有显著统计学差异, P < 0.01表示有非常显著统计学差异。
结果 1 抑制外周5-HT2AR或/和5-HT合成对T2DM小鼠的基础性影响本实验用i.g.SH抑制外周5-HT2AR, 用i.g.CDP抑制AADC来抑制外周5-HT合成。检测表明, 虽然CDP也可抑制多巴胺的合成, 但T2DM小鼠血液及骨骼肌多巴胺水平很低, 与对照组没有差异, 且CDP并不影响血液及骨骼肌内的多巴胺水平(数据略)。实验期间, 模型组死亡动物2只, 用备用动物补充; SH组及CDP组分别在给药第4周、第5周各死亡动物1只, 用备用动物补充; SH和CDP联合给药(SC)组未见动物死亡。
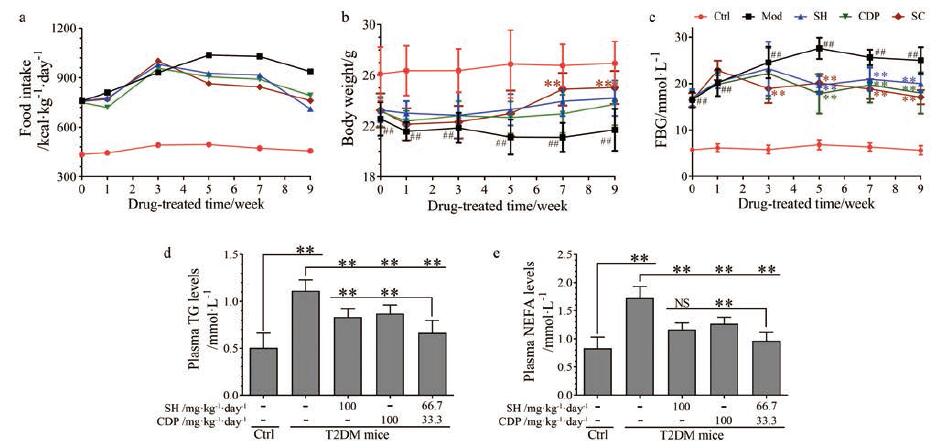
模型组小鼠T2DM特征明显: 实验期间进食量(图 1a)及FBG (图 1c)显著升高, 体重(图 1b)却明显降低, 且检测到明显升高的血浆TG (图 1d)及NEFA(图 1e)水平(与对照组比较)。与模型组比较, 3个给药组T2DM特征明显改善: 连续给药5周后进食量、FBG降低, 体重却回升, 尤其SC组给药第3周FBG已明显降低、第7周后体重明显升高; 降低血浆TG和NEFA水平, 且SC组的疗效明显好于SH组及CDP组。依据SH、CDP及SC组的给药剂量(相同剂量), 及SC组中SH、CDP的用量(分别只有SH、CDP组的2/3及1/3), 可推测SH和CDP联合给药具有协同效应, 可提高降血脂作用。
|
Figure 1 The effects of sarpogrelate hydrochloride (SH) and carbidopa (CDP)(alone or in combination) on the basic state of type 2 diabetes mellitus (T2DM) mice.Food intake (a), body weight (b), fasting blood-glucose (FBG)(c) in the period of nine-week drug treatment, and plasma triglyceride (TG)(d) and non-esterified fatty acids (NEFA)(e) levels in the end of nine-week drug treatment in the control (Ctrl), T2DM model (Mod), SH or CDP-treated, and SH and CDP (SC)-co-treated T2DM mice.n=10, x±s.##P < 0.01 vs Ctrl; **P < 0.01 vs Mod in the b and c, or multiple comparison test in the d and e; NS: Not significant |
结果表明, 抑制外周5-HT2AR及5-HT合成可明显改善T2DM小鼠的生存状态, 降低血糖、血脂及进食量, 且升高体重。但药物的起效较慢, 需给药3周以上才显示明显疗效。
2 T2DM小鼠骨骼肌氧化应激、炎症的发生与5-HT2AR、5-HT合成及5-HT降解的相关性Western blot检测表明, T2DM小鼠骨骼肌5-HT2AR、Tph1和AADC表达明显上调(图 2a)。同时, 骨骼肌(图 2b)及血浆(图 2c) 5-HT水平明显升高(与对照组比较); 而SH及CDP治疗可明显抑制这种5-HT水平升高, 且联合给药效果更好, 具有协同效应。线粒体5-HT降解酶--MAO-A[23]的表达检测结果表明(图 2d), T2DM小鼠骨骼肌MAO-A表达明显上调, SH或/和CDP治疗明显下调其表达, 且显示协同效应。同时, 可检测到T2DM小鼠骨骼肌发生氧化应激, 表现为H2O2(图 2e)、MDA (图 2f)含量升高及SOD活力(图 2g)下降; 也发生炎症, 表现为炎症信号通路NF-κB的激活[24]: NF-κBp65和IκBα的磷酸化表达上调, 而IκBα总蛋白表达下调(图 2h), 并且炎症因子TNF-α(图 2i)和IL-1β(图 2j)含量明显升高。SH或/和CDP治疗则明显降低骨骼肌氧化应激和炎症, 且显示协同效应。

|
Figure 2 The relevance of 5-HT2AR, 5-HT, and 5-HT degradation with oxidative stress and inflammation in skeletal muscle of T2DM mice.a: Expression of 5-HT2AR, Tph1, AADC, and GAPDH in the skeletal muscle of control (Ctrl) and T2DM mice; Levels of 5-HT in the skeletal muscle (b) and plasma (c) of all groups.Expression of MAO-A (d); levels of H2O2(e), MDA (f), and SOD (g); expression of p-IκBα, IκBα, p-NF-κB p65, NF-κB p65, and GAPDH (h); and levels of TNF-α(i) and IL-1β(j) in the skeletal muscle of all groups.n=10, x±s.*P < 0.05, **P < 0.01.5-HT: 5-Hydroxy tryptamine; 5-HT2AR: 5-HT receptor 2A;Tph: Tryptophan hydroxylase; AADC: Aromatic L-ami‐no acid decarboxylase, p-: Phosphorylated |
结果表明, 骨骼肌自身具有5-HT2AR、5-HT合成酶和5-HT降解酶表达, T2DM时它们被上调, 5-HT合成及降解增加; 同时, 骨骼肌发生氧化应激和炎症。通过抑制外周5-HT2AR和5-HT合成, 可明显抑制T2DM时骨骼肌的氧化应激及炎症, 且联合抑制有协同效应。
3 T2DM小鼠疲劳及骨骼肌ATP合成减少与5-HT2AR、5-HT合成的相关性本研究用“转棒实验”来检测小鼠的疲劳程度。T2DM小鼠显示明显的疲劳状态, 表现为在给药的第6周和第9周、小鼠在转棒实验时的“转棒停留时间”大幅缩短(图 3a), 及实验末血浆LA含量升高(图 3b), 而骨骼肌糖原含量(图 3c)和ATP含量(图 3d)大幅降低(与对照组比较)。并且, Western blot检测结果表明, 骨骼肌脂肪酸β氧化限速酶CPT1[25]、ATP合成酶ATP6[26]及调节线粒体生物合成的重要因子PGC-1[27](图 3e)的表达明显下调。SH和/或CDP治疗明显改善以上指标, 且联合给药显示协同效应。

|
Figure 3 The relevance of 5-HT2AR and 5-HT synthesis with fatigue and reduction of ATP synthesis in skeletal muscle of T2DM mice.a: Riding time of rotation test in the 6th week and 9th week of drug treatment in all groups; b: Levels of lactic acid (LA) in the plasma of all groups; Levels of glycogen (c) and ATP (d), and expression of carnitine palmitoyltransferase-1 (CPT1), ATP synthase-6 (ATP6), peroxisome proliferator-activated receptor γ coactivator-1 (PGC-1) and GAPDH (e) in the skeletal muscle of all groups.n=10, x±s.**P < 0.01 |
结果提示, T2DM小鼠疲劳的产生与骨骼肌5-HT合成增加、5-HT2AR上调密切相关; 骨骼肌线粒体功能下降—脂肪酸β氧化受到抑制和ATP合成减少, 可能是产生疲劳的直接原因, 这些都受到5-HT合成和5-HT2AR的调控。
4 高糖高脂诱导C2C12细胞线粒体ROS产生与5-HT2AR、5-HT合成、5-HT降解的相关性采用MTT法检测SH、CDP和CGL对C2C12细胞活力的影响。实验结果表明, 3种化合物以30 μmol·L-1浓度分别处理C2C12细胞24 h后, 细胞活力达到对照的85%~95%, 可用于实验。D-葡萄糖以33和60 mmol·L-1处理细胞24 h, 均未对C2C12细胞的活力产生明显抑制作用, 拟以33 mmol·L-1浓度用于实验。100 μmol·L-1棕榈酸处理细胞24 h, C2C12细胞活力仍达到对照的60%左右, 可用于实验。
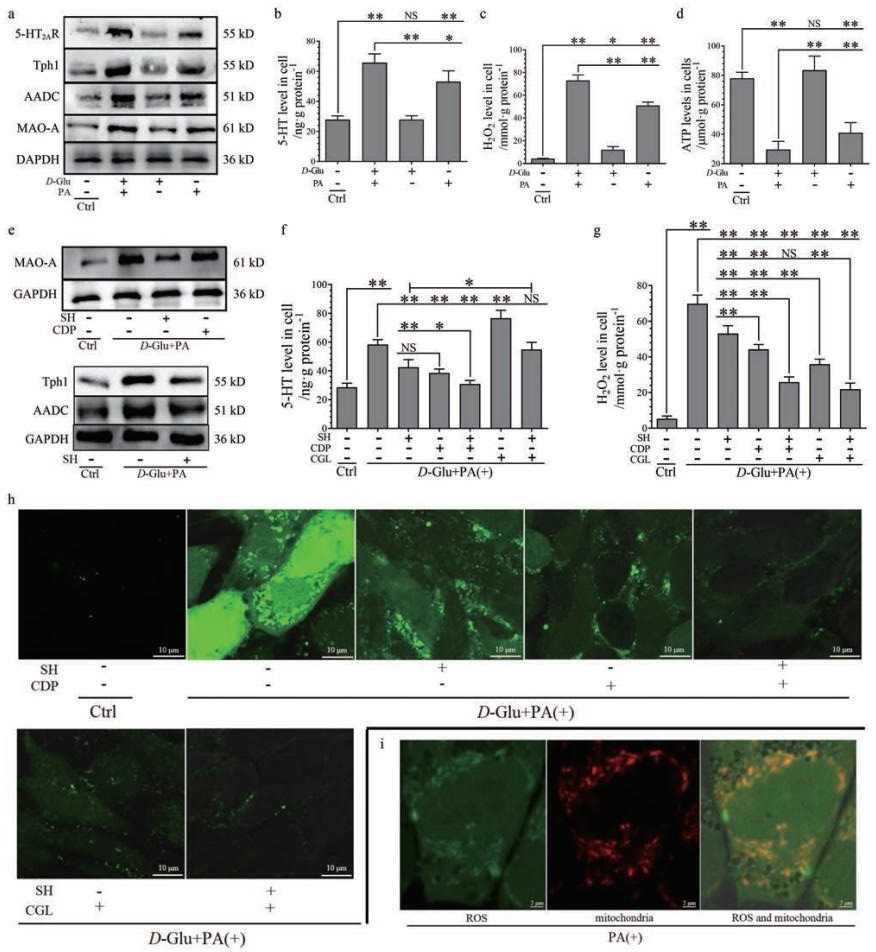
首先确定刺激形式, 分别用D-葡萄糖或棕榈酸, 或联合用两种刺激因子处理细胞24 h。结果表明, 诱导5-HT2AR、Tph1、AADC和MAO-A表达上调(图 4a)、细胞内5-HT (图 4b)、H2O2(图 4c)含量升高及ATP含量下降(图 4d)的主要刺激因子是棕榈酸而不是D-葡萄糖, 但两者联合处理有协同作用。因此, 细胞实验拟用D-葡萄糖+棕榈酸(高糖高脂)的联合刺激形式来处理细胞。
|
Figure 4 The relevance of 5-HT2AR, 5-HT synthesis, and 5-HT degradation on D-Glu or/and PA-induced ROS production in the mitochondria of C2C12 cells.SH (30 μmol·L-1), CDP (30 μmol·L-1), and CGL (30 μmol·L-1) were treated in C2C12 cells.The cells were pre-treated with respective drug for 12 h, followed by D-Glu (33 mmol·L-1) and PA (100 μmol·L-1) treatment (alone or in combination) for another 24 h.Expression of 5-HT2AR, Tph1, AADC, MAO-A, and GAPDH (a), and levels of 5-HT (b), H2O2(c), and ATP (d) in the control(Ctrl), D-Glu and PA (alone or in combination)-treated cells.Expression of MAO-A and GAPDH in the Ctrl, D-Glu and PA co-treated with or without SH or CDP-treated cells (e, up), and expression of Tph1, AADC, and GAPDH in the Ctrl, D-Glu and PA co-treated with or without SH-treated cells (e, down).Levels of 5-HT (f) and H2O2(g), and ROS distribution (63×) determined by fluorescent dye staining (h)in the Ctrl, D-Glu and PA co-treated with or without SH and CDP-treated (alone or in combination), CGL-treated, and CGL and SH cotreated cells.Mitochondria (red) and ROS (green) distribution (63×3) in the PA-treated cells determined by co-localization of mitochondria and ROS fluorescent dye staining (i).n=4, x±s.*P < 0.05, **P < 0.01.PA: Palmitic acid; D-Glu: D-Glucose; CGL: Clorgyline |
MAO-A表达检测结果表明(图 4e, 上), 高糖高脂可诱导C2C12细胞MAO-A表达上调, 这种作用可被SH明显抑制, 但CDP的影响较小; 同时, 研究检测到高糖高脂诱导的Tph1和AADC表达上调也可被SH明显抑制(图 4e, 下)。检测细胞内5-HT (图 4f)、H2O2(图 4g)含量, 并用荧光探针法检测细胞内ROS (其中也包括H2O2)含量(图 4h), 结果表明: SH (抑制5-HT2AR)、CDP (抑制AADC)明显抑制高糖高脂诱导的细胞内5-HT含量升高, 且SH+CDP更明显, 但CGL (抑制MAO-A)则进一步升高细胞内5-HT含量。以上结果提示, 5-HT2AR介导了高糖高脂诱导的C2C12细胞的MAO-A表达上调及5-HT合成增加, 而细胞内5-HT被MAO-A降解; SH、CDP和CGL均明显抑制高糖高脂诱导的细胞内ROS (H2O2)增多。特别地, SH+CDP、CGL、SH+CGL三者的抑制效果是接近的, 强烈抑制高糖高脂诱导的ROS (H2O2)产生, 且明显好于SH或CDP的抑制效果。另外, 通过细胞内ROS和线粒体荧光探针双定位检测, 可发现棕榈酸诱导的细胞内ROS产生部位就是线粒体, 两者定位重叠(图 4i)。结果提示, 高糖高脂刺激C2C12细胞ROS的产生是通过线粒体MAO-A催化的5-HT降解实现的。
5 高糖高脂诱导C2C12细胞炎症及线粒体ATP合成减少与5-HT2AR、5-HT降解的相关性细胞内ROS增多是导致细胞发生氧化应激、炎症以及线粒体功能异常的基础[28]。前面的实验已经表明, 高糖高脂诱导C2C12细胞ROS产生增多的根本原因是线粒体5-HT降解增多。下面的实验将只考虑抑制5-HT2AR (用SH)、抑制MAO-A (用CGL)、或充分抑制5-HT降解(用SH+CGL同时抑制MAO-A表达及其酶活性)对高糖高脂诱导C2C12细胞产生炎症、线粒体ATP合成降低的影响。
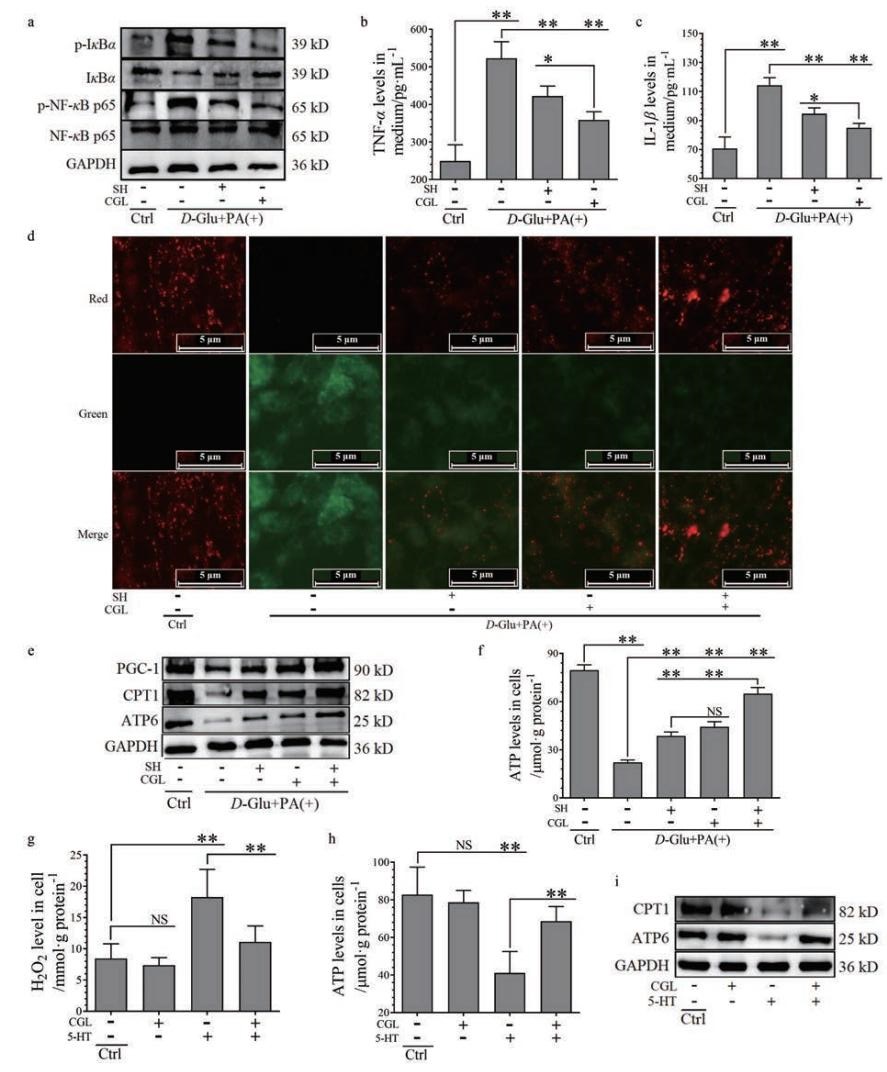
SH和CGL可明显抑制高糖高脂诱导的细胞炎症信号通路NF-κB激活(图 5a), 表现为对NF-κB p65和IκBα磷酸化表达上调及IκBα总蛋白表达下调的逆转作用以及对炎症因子TNF-α(图 5b)、IL-1β(图 5c)分泌增多的抑制作用, 且CGL的抑制效果好于SH, 提示这种细胞炎症的发生确实是因5-HT降解增多引起。
|
Figure 5 The relevance of 5-HT2AR and 5-HT degradation with inflammation and ATP synthesis induced by D-Glu and PA co-treatment in C2C12 cells.SH (30 μmol·L-1) and CGL (30 μmol·L-1) were treated in C2C12 cells.The cells were pre-treated with respective drug for 12 h, followed by either D-Glu (33 mmol·L-1) and PA (100 μmol·L-1) co-treatment for another 24 h or 5-HT (60 μmol·L-1) treatment for another4 8 h.Expression of p-IκBα, IκBα, p-NF-κB p65, NF-κB p65, and GAPDH (a), and levels of TNF-α(b) and IL-1β(c) in medium in the Ctrl, D-Glu and PA co-treated with or without SH or CGL-treated cells.Mitochondrial membrane potential fluorescent dye (JC-1) staining (40×)(d), red indicating polarized membrane potential while green indicating depolarized membrane potential in the mitochondria; expression of PGC-1, CPT1, ATP6, and GAPDH (e); and ATP levels (f) in the Ctrl, D-Glu and PA co-treated with or without SH and CGL-treated (alone or in combination) cells.Levels of H2O2(g) and ATP (h), and expression of CPT1, ATP6, and GAPDH (i) in the Ctrl, CGL-treated, 5-HT-treated with or without CGL-treated cells.n=4, x±s.*P < 0.05, **P < 0.01 |
细胞线粒体受损后线粒体膜电位(mitochondrial membrane potential, MMP)去极化与ATP合成减少密切相关[29]。本研究用MMP荧光探针JC-1检测MMP状态(图 5d), 结果表明: 正常C2C12细胞(对照组)MMP处于极化状态(红色荧光), 而高糖高脂刺激后的细胞MMP处于去极化状态(绿色荧光), SH和CGL均可明显改善MMP的去极化状态, 且CGL优于SH, 而SH+CGL处理细胞几乎完全恢复了MMP的极化状态。同时, SH、CGL及SH+CGL也明显逆转高糖高脂诱导的细胞PGC-1、CPT1及ATP6表达下调(图 5e)及细胞内ATP含量下降(图 5f), 且SH+CGL的逆转作用强烈。结果表明, 高糖高脂诱导的线粒体功能损伤包括MMP去极化、脂肪酸β氧化及ATP合成的功能下降, 与线粒体5-HT降解增多密切相关。
为了证明5-HT确实可刺激C2C12细胞线粒体功能改变, 本研究用5-HT直接刺激细胞, 并用CGL抑制MAO-A活性。结果表明, 5-HT可刺激C2C12细胞内H2O2含量升高(图 5g)、ATP含量下降(图 5h)及CPT1和ATP6表达下调(图 5i), 这种作用可被CGL强烈逆转, 提示5-HT可通过在线粒体的降解导致线粒体ROS产生、脂肪酸β氧化及ATP合成减少。
讨论T2DM患者机体长期处于氧化应激状态, 进一步加重糖尿病原有并发症[30]。临床研究表明, 与T1DM患者相比, T2DM患者更易出现疲劳[31]。本研究表明, 高浓度的饱和脂肪酸是比高血糖更敏感的导致骨骼肌细胞ROS产生、ATP合成减少的刺激因子, 且两种刺激因子具有协同作用。因此, 导致糖尿病患者疲劳的主要刺激因子可能是高浓度的血液游离脂肪酸, 即高血脂状态, 高血糖起到辅助作用, 这可能是T2DM患者比T1DM患者更易出现疲劳的根本原因。高血脂和高血糖导致疲劳的直接原因是它们激活了骨骼肌5-HT系统, 表现为5-HT2A受体(5-HT2AR)激活、5-HT合成增加, 更关键的是线粒体MAO-A激活, 导致骨骼肌线粒体5-HT降解增加。5-HT降解增加导致线粒体ROS产生增加、MMP去极化、ATP合成减少、炎症信号通路激活, 从而使骨骼肌收缩无力、患者产生疲劳感。另外, 本实验中用到的SH、CDP两种药物都不能通过血脑屏障, 它们只能作用于外周而影响外周5-HT系统, 且中枢和外周5-HT合成系统是相互独立的[5]。因此, 本课题组认为T2DM引起的疲劳是一种外周性疲劳[1]。另外, T2DM时肝脏5-HT系统激活, 使得肝脏能量代谢紊乱、炎症、胰岛素抵抗, 可能是导致高血脂和高血糖的重要原因, 之前已作报道[17]。可以肯定, T2DM时骨骼肌功能紊乱、肝脏代谢紊乱和血脂血糖紊乱, 具有相同的病理机制, 都牵涉到相关器官的5-HT系统激活。通过抑制外周5-HT系统——抑制5-HT2AR及5-HT合成, 可对这种现象进行治疗, 其直接的治疗作用是抑制器官本身的5-HT系统激活, 从而改善T2DM相关的骨骼肌、肝脏功能紊乱, 同时也改善血糖血脂紊乱以及进食量、体重的异常。
依据本研究动物及细胞实验结果推测: ① 5-HT2AR对骨骼肌5-HT降解存在两方面的调控作用——介导MAO-A的表达及控制5-HT合成, 从而间接调控5-HT降解, 这与肝脏研究结果一致[17]。另外, 5-HT2AR对线粒体功能及脂肪酸β氧化也存在调控作用。用SH抑制5-HT2AR, 可明显逆转高糖高脂诱导的β氧化限速酶—CPT1[25]、PGC-1及ATP合成酶(ATP6)的表达下调、增加ATP合成。PGC-1是线粒体生物合成最重要的调节因子[27], 通过激活核呼吸因子, 进而激活线粒体转录因子A (mtTFA), mtTFA调控线粒体编码蛋白的mRNA转录[32, 33]。② MAO-A位于线粒体外膜, 催化5-HT降解[23]:
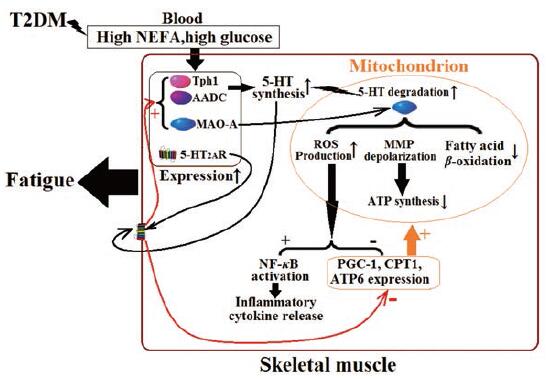
总之, 本研究表明, T2DM性疲劳是骨骼肌5-HT2AR、5-HT合成及5-HT降解激活的结果, 作用机制见图 6。抑制外周5-HT2AR和5-HT合成, 在改善血糖血脂、降低骨骼肌氧化应激及炎症的同时, 可增加骨骼肌ATP合成, 减轻这种T2DM性疲劳。并且, 同时抑制5-HT2AR及5-HT合成是必要的, 可大大提高治疗效果。
|
Figure 6 Schematic diagram of T2DM-caused fatigue mediated by 5-HT system in the skeletal muscle |
作者贡献:傅继华为本项目的课题负责人, 负责实验设计、实验指导及数据分析, 主导论文构思并参与论文写作及修改; 张誉馨负责论文写作、修改及投稿, 并完成部分实验工作; 张锐为本论文实验工作的主要完成人; 杨静、闪雪纯、梁秀睿、张怡、徐凡、金佳琦和关晶均参与本论文实验工作。全体作者都阅读并同意最终的文本。
利益冲突:没有利益冲突。
| [1] |
Gandevia SC. Spinal and supraspinal factors in human muscle fatigue[J]. Physiol Rev, 2001, 81: 1725-1789. DOI:10.1152/physrev.2001.81.4.1725 |
| [2] |
Zhu XX, Duan XH, Li RX, et al. Research progress on the rela‐tionship between mitochondrial dysfunction and non-alcoholic fatty liver disease[J]. Shandong Med(山东医药), 2018, 58: 108-111. |
| [3] |
Ripsin CM, Kang H, Urban RJ. Management of blood glucose in type 2 diabetes mellitus[J]. Am Fam Physician, 2009, 79: 29-36. |
| [4] |
Jain A, Sharma R, Choudhary PK, et al. Study of fatigue, depres‐sion, and associated factors in type 2 diabetes mellitus in indus‐trial workers[J]. Ind Psychiatry J, 2015, 24: 179-184. DOI:10.4103/0972-6748.181731 |
| [5] |
Young SN. How to increase serotonin in the human brain with‐out drugs[J]. J Psychiatry Neurosci, 2007, 32: 394-399. |
| [6] |
Cote F, Thevenot E, Fligny C, et al. Disruption of the nonneuro-nal Tph1 gene demonstrates the importance of peripheral sero‐tonin in cardiac function[J]. Proc Natl Acad Sci U S A, 2003, 100: 13525-13530. DOI:10.1073/pnas.2233056100 |
| [7] |
Boess FG, Martin IL. Molecular biology of 5-HT receptors[J]. Neuropharmacology, 1994, 33: 275-317. DOI:10.1016/0028-3908(94)90059-0 |
| [8] |
Uchiyama S, Ozaki Y, Satoh K, et al. Effect of sarpogrelate, a 5-HT2A antagonist, on platelet aggregation in patients with isch‐emic stroke: clinical-pharmacological dose-response study[J]. Cerebrovasc Dis, 2007, 24: 264-270. DOI:10.1159/000105135 |
| [9] |
Shiba T, Yokota A, Gamoh S, et al. Diabetes mellitus induces hyperreactivity of 5-hydroxytryptamine(5-HT)-induced constric‐tion in human internal thoracic artery and is associated with increase in the membrane protein level of 5-HT2A receptor[J]. Biol Pharm Bull, 2018, 41: 820-823. DOI:10.1248/bpb.b17-01000 |
| [10] |
Yamada K, Niki H, Nagai H, et al. Serotonin potentiates highglucose-induced endothelial injury: the role of serotonin and 5-HT2A receptors in promoting thrombosis in diabetes[J]. J Phar‐macol Sci, 2012, 119: 243-250. |
| [11] |
Su Y, Mao N, Li M, et al. Sarpogrelate inhibits the expression of ICAM-1 and monocyte-endothelial adhesion induced by high glucose in human endothelial cells[J]. Mol Cell Biochem, 2013, 373: 195-199. DOI:10.1007/s11010-012-1490-9 |
| [12] |
Walther DJ, Peter JU, Winter S, et al. Serotonylation of small GTPases is a signal transduction pathway that triggers platelet alpha-granule release[J]. Cell, 2004, 115: 851-862. |
| [13] |
Ruddell RG, Mann DA, Ramm GA. The function of serotonin within the liver[J]. J Hepatol, 2008, 48: 666-675. DOI:10.1016/j.jhep.2008.01.006 |
| [14] |
Berger M, Gray JA, Roth BL. The expanded biology of sero‐tonin[J]. Annu Rev Med, 2009, 60: 355-366. DOI:10.1146/annurev.med.60.042307.110802 |
| [15] |
Li X, Guo K, Li T, et al. 5-HT2 receptor mediates high-fat diet-induced hepatic steatosis and very low density lipoprotein overproduction in rats[J]. Obes Res Clin Pract, 2016, 12: 16-28. |
| [16] |
Fu J, Ma S, Li X, et al. Long-term stress with hyperglucocorticoi‐demia-induced hepatic steatosis with VLDL overproduction is dependent on both 5-HT2 receptor and 5-HT synthesis in liver[J]. Int J Biol Sci, 2016, 12: 219-234. DOI:10.7150/ijbs.13062 |
| [17] |
Fu J, Li C, Zhang G, et al. Crucial roles of 5-HT and 5-HT2 receptor in diabetes-related lipid accumulation and pro-inflam‐matory cytokine generation in hepatocytes[J]. Cell Physiol Bio‐chem, 2018, 48: 2409-2428. DOI:10.1159/000492656 |
| [18] |
Li T, Guo K, Qu W, et al. Important role of 5-hydroxytryptamine in glucocorticoid-induced insulin resistance in liver and intraabdominal adipose tissue of rats[J]. J Diabetes Investig, 2016, 7: 32-41. DOI:10.1111/jdi.12406 |
| [19] |
Ma S, Li T, Guo K, et al. Effective treatment with combination of peripheral 5-hydroxytryptamine synthetic inhibitor and 5-hy‐droxytryptamine 2 receptor antagonist on glucocorticoid-induced whole-body insulin resistance with hyperglycemia[J]. J Diabetes Investig, 2016, 7: 833-844. DOI:10.1111/jdi.12526 |
| [20] |
Xu Y, Liu YX, Li X, et al. Experimental study of the effect of Shenhong tablets on the behavior and 5-HT content of chronic fatigue model rats[J]. Ginseng Res(人参研究), 2016, 28: 19-21. |
| [21] |
Shi SD, Zhou MW, Li JJ, et al. Effect of Yixinle oral liquid on animal behavior and neuroendocrine of chronic stress fatigue model[J]. Chin New Drugs Clin Pharmacol(中药新药与临床药理), 2004, 15: 320-322. |
| [22] |
Lowell BB, Shulman GI. Mitochondrial dysfunction and type 2 diabetes[J]. Science, 2005, 307: 384-387. DOI:10.1126/science.1104343 |
| [23] |
Shih JC, Chen K, Ridd MJ. Monoamine oxidase: from genes to behavior[J]. Annu Rev Neurosci, 1999, 22: 197-217. DOI:10.1146/annurev.neuro.22.1.197 |
| [24] |
Pontoriero M, Fiume G, Vecchio E, et al. Activation of NF-κB in B cell receptor signaling through Bruton's tyrosine kinasedependent phosphorylation of IκB-α[J]. J Mol Med (Berl), 2019, 97: 675-690. DOI:10.1007/s00109-019-01777-x |
| [25] |
Schlaepfer IR, Rider L, Rodrigues LU, et al. Lipid catabolism via CPT1 as a therapeutic target for prostate cancer[J]. Mol Cancer Ther, 2014, 13: 2361-2371. DOI:10.1158/1535-7163.MCT-14-0183 |
| [26] |
Dautant A, Meier T, Hahn A, et al. ATP synthase diseases of mitochondrial genetic origin[J]. Front Physiol, 2018, 9: 329. DOI:10.3389/fphys.2018.00329 |
| [27] |
Valero T. Mitochondrial biogenesis: pharmacological approaches[J]. Curr Pharm Des, 2014, 20: 5507-5509. DOI:10.2174/138161282035140911142118 |
| [28] |
Gong QL, Li X, Lu Y. Research progress of mitochondrial mechanism in oxidative stress-related diseases[J]. Chin J Cell Biol(中国细胞生物学学报), 2013, 35: 1540-1545. |
| [29] |
Mitchell P, Moyle J. Chemiosmotic hypothesis of oxidative phosphorylation[J]. Nature, 1967, 213: 137-139. DOI:10.1038/213137a0 |
| [30] |
Yang H, Jin X, Kei Lam CW, et al. Oxidative stress and diabetes mellitus[J]. Clin Chem Lab Med, 2011, 49: 1773-1782. |
| [31] |
Drivsholm T, Olivarius NDF, Nielsen ABS, et al. Symptoms, signs and complications in newly diagnosed type 2 diabetic patients, and their relationship to glycaemia, blood pressure and weight[J]. Diabetologia, 2005, 48: 210-214. DOI:10.1007/s00125-004-1625-y |
| [32] |
Cartoni R, Léger B, Hock MB, et al. Mitofusins 1/2 and ERRalpha expression are increased in human skeletal muscle after physical exercise[J]. J Physiol, 2005, 567: 349-358. DOI:10.1113/jphysiol.2005.092031 |
| [33] |
Johri A, Chandra A, Flint Beal M. PGC-1α, mitochondrial dysfunction, and Huntington's disease[J]. Free Radic Biol Med, 2013, 62: 37-46. DOI:10.1016/j.freeradbiomed.2013.04.016 |
| [34] |
Moniruzzaman M, Ghosal I, Das D, et al. Melatonin ameliorates H2O2-induced oxidative stress through modulation of Erk/Akt/NFκB pathway[J]. Biol Res, 2018, 51: 17. DOI:10.1186/s40659-018-0168-5 |
| [35] |
Ren DL, Wang HK, Liu JQ, et al. ROS-induced ZNF580 expres‐sion: a key role for H2O2/NF-κB signaling pathway in vascular endothelial inflammation[J]. Mol Cell Biochem, 2012, 359: 183-191. DOI:10.1007/s11010-011-1013-0 |
| [36] |
Weiner ID, Verlander JW. Role of NH3 and NH4+ transporters in renal acid-base transport[J]. Am J Physiol Renal Physiol, 2011, 300: F11-F23. DOI:10.1152/ajprenal.00554.2010 |
| [37] |
Moser H. Electrophysiological evidence for ammonium as a substitute for potassium in activating the sodium pump in a crayfish sensory neuron[J]. Can J Physiol Pharmacol, 1987, 65: 141-145. DOI:10.1139/y87-028 |
| [38] |
Braissant O, Mc Lin VA, Cudalbu C. Ammonia toxicity to the brain[J]. J Inherit Metab Dis, 2013, 36: 595-612. DOI:10.1007/s10545-012-9546-2 |
| [39] |
Zorova LD, Popkov VA, Plotnikov EY, et al. Mitochondrial membrane potential[J]. Anal Biochem, 2018, 552: 50-59. DOI:10.1016/j.ab.2017.07.009 |
| [40] |
Xu T, Li H, Lu SS, et al. Research progress of mitochondrial electron transport respiratory chain and its biological significance[J]. J Fudan Univ(Med Ed)(复旦学报(医学版)), 2015, 42: 250-255, 261. |
 2021, Vol. 56
2021, Vol. 56


