二维材料具有独特的理化性质, 包括易于表面修饰特性、导电性和强光响应性等, 被广泛应用于各个领域。2014年, Li等[1]首次成功地合成了二维黑磷结构, 由此黑磷(black phosphorus, BP)受到了科学工作者的广泛关注。BP纳米结构包括横向尺寸为100~400 nm的黑磷纳米片(black phosphorus nanosheets, BPNSs)、直径约4 nm的黑磷量子点(black phosphorus quantum dots, BPQDs)和粒度分布在100~400 nm的黑磷纳米粒(black phosphorus nanoparticles, BPNPs)。BP中的每个磷原子与相邻的3个磷原子经sp3杂化而共价键合, 从而形成独特的折叠状蜂窝结构, 使其具有极高的载药量, 这为其成为医药载体提供了巨大的可能。相邻的两层BP层通过范德华力而叠加, 多层BP纳米结构在受外力作用下可以被剥离。层状BP的带隙与层数息息相关, 可以从块状时的0.3 e V到单层时的2.0 e V, 因此复合BP光吸收范围广, 可以与紫外到近红外(NIR)范围的光相互作用, 其消光系数和光热转换效率高。此外, 磷原子(P)是生物体的重要元素之一, 复合BP还具有优于普通二维材料的出色的生物降解能力和生物相容性, 这也表明了BP具有潜在的生物医学应用的优势。例如, 超薄的BPNSs在近红外光照射下可以有效地产生单线态氧, 可作为光动力治疗剂。同时BP具有光氧化还原功能, 在光热和光动力治疗方面具有巨大的潜力, 有望应用于癌症的治疗[2]。本文主要围绕近年来BP在光热治疗、光动力治疗和作为药物载体方面的应用进行了综述。
1 黑磷的不稳定性、毒性和生物相容性P外层有孤对电子、容易氧化成磷酸盐, 导致BP的不稳定性。氧气、水和光的存在导致BP降解, 光强度和氧浓度与降解速率成正比。为了提高BP在生物医学应用上的稳定性, 一般对BP进行表面改性, 主要分为物理封装法和化学封装法。物理封装常采用稳定性好的聚合物, 如聚乙二醇(polyethylene glycol, PEG)在BP表面防止其与水的直接接触, 进一步提高纳米BP的生理稳定性和生物相容性[3]。负载多柔比星(doxorubicin, DOX)的BPNSs也可以通过多巴胺自聚合作用在其表面形成聚多巴胺(polydopamine, PDA)涂层, 这种纳米复合材料BPNSs-DOX@PDA具有较低的细胞毒性、良好的光热转换性能、优异的载药能力、pH和光响应控制释放药物的特性[4]。化学封装是钝化分子与BP的孤对电子之间形成配位键或共价键, 这种表面化学修饰阻止纳米BP与氧的反应, 从而显著提高纳米BP在水中的稳定性。通过表面化学修饰制备的TiL4@BPQDs在水中的分散性和稳定性有大幅提高[5, 6]。
快速生物降解是BP在体内使用的一个重要优势。由于P为人体必不可少的元素, 与传统的碳纳米材料和金属纳米材料相比, 基于BP的纳米材料具有可降解性和生物相容性的生物医学优势。
低浓度BP具有极低的毒性, 研究结果表明, BPNPs≤4 μg·mL-1时几乎不显示细胞毒性, BPNPs可以依次通过巨噬细胞增生, 或者通过细胞的胞吞作用和溶酶体进行生物化学降解, 最后依靠血液循环作用从器官组织中清除后由肝脏和肾脏排出[7]。Latiff等[8]构建人肺癌上皮细胞(A549)模型来研究少层黑磷(few layer black phosphrous, FLBP)的生物相容性, 向A549细胞注射3.125~400 mg·mL-1不同浓度BP培养24 h后发现, 当BP质量浓度在3.125~25 mg·mL-1时, 细胞存活率逐渐下降, 这说明未修饰的BP的毒性随着浓度的增加而增加, 并有剂量依赖性; 当BP质量浓度为50 mg·mL-1时, 细胞的存活率急剧下降, 对于WST-8和MTT两种细胞的细胞存活率分别降低到48%和34%。未经修饰的BPNSs可诱发体内免疫反应, 导致一系列炎性因子升高[9]。
Mu等[2]用细胞和动物模型对BPQDs进行毒性研究, 与BPNSs相比, 肾脏对BPQDs的过滤速度更快, 这表明BP尺寸越小, 肾脏对BP的过滤作用越快。通过对比实验组和对照组在不同BPQDs浓度下的细胞存活率和细胞内活性氧(reactive oxygen species, ROS)水平, 发现BPQDs的毒性主要源自BPQDs自身产生的ROS, 在活体内实验结果表明BPQDs无毒副作用。
BP表面可以用多种物质进行改性以提高其稳定性和生物相容性。将不同浓度的PEG-BPNPs在人白血病细胞(CCRF-CEM)、人宫颈癌细胞(HeLa)和人乳腺癌细胞(MCF-7)中培养, 结果表明, 在PEG-BPNPs质量浓度为100 μg·mL-1时细胞的存活率依然很高(分别为97.59%、87.53%和87.43%), 这表明PEG修饰的BP具有较好的生物相容性[3]。Sun等[6]通过化学修饰的方法制备出TiL4@BPs, 不仅可以使BP的稳定性提高, 毒性降低, 同时可以避免BP被巨噬细胞吞噬, 表现出更好的生物相容性。
鉴于目前人类对生物效应的认识是极其有限的, BP在体内的实际生物学效应更是难以识别, 但通过以上研究可以表明BP不会在体内引起长期明显的毒性效应[2], 低浓度条件下BP毒性较低, 且经过修饰的BP在生物体内的相容性大幅增加, 这为BP在生物医学领域的应用提供了良好的条件。长期使用是否会导致磷酸盐离子过量而引起中毒或者其他金属离子的流失仍需要长期研究[10]。
2 肿瘤成像每年有数百万人因癌症这种恶性疾病而失去生命。由于BP具有独特的光电特性, 且无毒易分解, 易于从体内排出, 是良好的肿瘤生物成像替代材料。
2.1 光热成像光热效应是指光能(如激光)通过光敏剂(photosensitizer, PS)的光激发而局部转化为热能, PS对所用的光波长具有很强的吸收能力[11]。BP由于具有较大的消光系数及从紫外到近红外波长的高光热转换效率, 可用于体内光热成像。具体的光热转换效率(η)可以如下列公式计算得到[12]:
| $\eta=h S\left(T_{\max }-T_{\max , \text { water }}\right) / I\left(1-10^{-A}\right)$ | (1) |
| $h S=\sum m C_{\mathrm{p}} / \tau_{\mathrm{s}}$ | (2) |
| $\tau_{\mathrm{s}}=-t / \ln \theta$ | (3) |
| $\theta=\left(T_{\mathrm{amb}}-T\right) /\left(T_{\mathrm{amb}}-T_{\max }\right)$ | (4) |
式中, h是传热系数; S是容器的表面积; τs为样品系统时间常数, 由冷却过程和相应的时间得到; m为产物质量; Cp为溶剂比热容; Tamb为环境温度; Tmax和Tmax, water分别为BP溶液和水的平衡温度; I为近红外光的功率密度; A为溶液在一定波长的近红外光下的吸光度。
影响纳米BP的光热效果的因素有很多。Fu等[13]对BPNSs的光热性能与尺寸之间的关系展开了研究, 验证纳米材料的尺寸可以通过内吞作用引起不同的反应。通过控制超声时间和离心速度, 获得平均尺寸为394±75 nm、厚度为15~8 nm的大尺寸BP; 平均尺寸为118±22 nm、厚度为6~7 nm的中度尺寸BP; 平均尺寸为4.5±0.6 nm、厚度为2~3 nm的小尺寸BP。根据三者在不同浓度下的吸光度光谱, 计算三者的质量消光系数分别为32.56、21.79和15.43 L·g-1·cm-1。当质量浓度为25 μg·mL-1的3种不同尺寸的BPNSs在808 nm、1 W·cm-2的近红外激光下暴露10 min, 结果溶液温度分别上升了24℃、21.8℃和19.2℃, 这表明BP的尺寸越大, 光热性能越好。
为了研究修饰对BP的光热效应是否有影响, Sun等[12]通过机械研磨技术制备了PEG修饰的BPNSs, 携带4T1肿瘤的小鼠在注射PEG修饰的BPNSs后, 经808 nm激光照射后发现, 5 min内温度从34℃上升到59℃。另外, 测得经聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic) acid, PLGA]修饰的BPQDs的光热转换效率高达28.4%, BP在光热成像的同时还为其消融肿瘤提供了可能。
此外, Shao等[14]用简单液态剥离法制备BPQDs, 同时用PLGA修饰来提高其在水中的稳定性和分散性, 如图 1a所示。图 1b、c分别为小鼠注射BPQDs 24 h后的红外温度记录图和红外热像图。在相同的光照功率下, 发现实验组(BPQDs/PLGA 26.3℃)的肿瘤温度变化比对照组(PBS 6.2℃、PLGA 7.8℃和BPQDs 10.8℃)高得多, 显示出BPQDs/PLGA良好的光热性能。通过红外热像图发现实验组的温度升高明显, 这表明其在近红外激光照射下拥有高效的肿瘤光热成像能力。
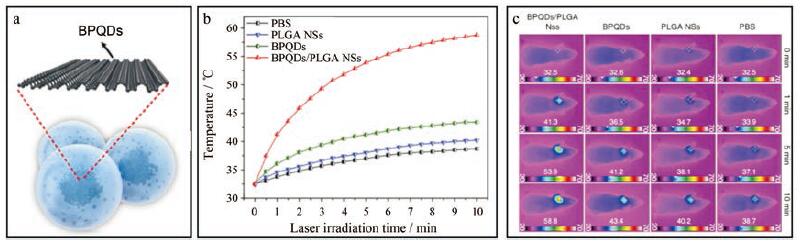
|
Figure 1 PLGA modified BP (a).Time-dependent temperature increase in the MCF7 breast tumor-bearing nude mice irradiated by the 808 nm laser (1 W·cm-2) at 24 h after separate intravenous injection with 100 mL of PBS, PLGA NSs, BPQDs (1 mg·mL-1), and BPQDs/PLGA NSs (1 mg·mL-1 BP) with the colour bar referring to the relative temperature (b) and infrared thermographic maps (c).PLGA: Poly(lactic-co-glycolic acid); BP: Black phosphorus; PBS: Phosphate buffer saline; NSs: Nanosheets; BPQDs: Black phosphorus quantum dots.(Adapted from Ref.14 with permission.Copyright © 1997 the American Association for the Advancement of Science) |
以上事实说明, BP具有优异的光热性能, 对BP进行修饰以提高稳定性和分散性的同时并没有影响BP的光热性能。另外, BP在光热成像的同时还为其消融肿瘤提供了可能。
2.2 光声成像光声成像可以提供高对比度和灵敏度的图像、高空间分辨率和深度分辨率的3D图像, 并且对深层次(5~6 cm)的组织成像[3]。而光声成像主要依赖于体内的生物分子吸收光能量并转换为热能使得局部温度升高, 导致热弹性膨胀, 产生与组织吸收特性相关的超声波, 通过接收超声波, 构建组织内光能量吸收分布的图像达到成像目的, 其在生物组织中有较高的空间分辨率。光声成像不仅具有灵敏度高、特异性高的优势, 而且具有声学成像深度大、深处组织成像分辨率高的特性[15]。
Sun等[12]报道了光稳定性好的BPQDs在光声成像(photoacoustic imaging, PA)中的应用。当PEG修饰的BPQDs质量浓度在0~250 μg·mL-1时, PA信号强度随浓度的增加呈线性上升, 如图 2a所示。由于高渗透长滞留(enhanced permeability and retention, EPR)效应, PEG修饰的BPNPs在肿瘤细胞中累积, 在注射24 h后, 肿瘤细胞的PA信号强度仍高于肝脏和肾脏, 如图 2b为小鼠静脉注射PEG化BPNPs后, 其肝脏、肾脏和肿瘤在不同时间间隔的PA图像。这说明BPNSs主要集中在肿瘤区域, 具有良好的光声成像效果。
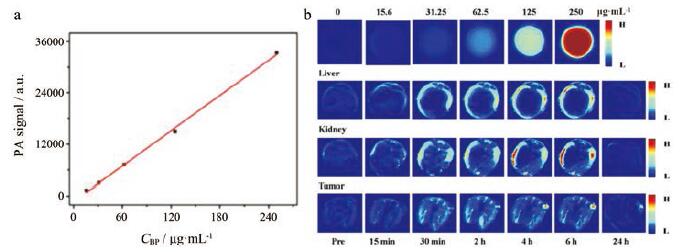
|
Figure 2 PA signal values of PEG-modified BPNPs at different concentrations (a).In-vitro photoacoustic images of PEGylated BPNPs so-lutions (first row), and in-vivo photoacoustic images of liver, kidney, and tumor obtained at different time intervals after intravenous injec-tion of PEGylated BPNPs, in comparison with the corresponding pre-contrast images (b).PA: Photoacoustic imaging; PEG: Polyethylene glycol; BPNPs: Black phosphorus nanoparticles.(Adapted from Ref.12 with permission.Copyright © 1997 the American Association for the Advancement of Science) |
除了纳米BP本身能够产生良好的光声成像效果外, 还可以通过自组装来优化光声信号强度。Li等[16]研究了一种新的对NIR/ROS敏感的BPQDs纳米囊泡(black phosphrous nanovesicles, BPNVs), 通过将尾部连接芘的PEG与尾部连接芘的对ROS敏感的聚苯硫醚[poly(propylene sulfide), PPS]同时连接到BPQDs(BPQDs@PEG/PPS)表面, 生成的颗粒自组装成囊泡。如图 3a所示, 对携带4T1肿瘤细胞的BALB/c小鼠分别注射裸露的BPQDs和BPNVs-CpG后发现, 与裸BPQDs相比, BPNVs-CpG在肿瘤区域的分布更为广泛, 并在注射后24 h达到峰值。在注射BPNVs-CpG后近红外激光辐射24 h, 与未经辐照相比, PA信号具有更强的穿透能力, 穿透深度超过3 mm (图 3b), 对肿瘤组织在不同深度的PA振幅进行定量分析发现, 其振幅比未经辐照组高12倍(图 3c)。在680 nm激光激发下产生的良好PA信号振幅表明, BPNVs具有良好的生物成像性能, 进一步拓展了其应用前景[17, 18]。
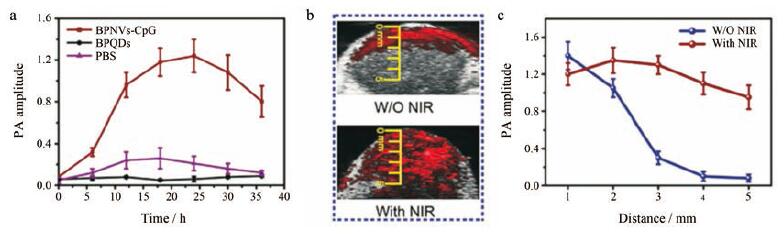
|
Figure 3 In vivo PA imaging.a: The PA amplitudes of tumors treated with BPNVs-CpG, BPQDs and PBS at different post injection time points; b: PA of tumors at different depths 24 h post-injection; c: The corresponding PA amplitudes.BPNVs-CpG: BPQDs nanovesicles for encapsulating CpG; W/O: Without; NIR: Near infrared.(Adapted from Ref.16 with permission.Copyright © 1997 the American Associa-tion for the Advancement of Science) |
除此之外, 在对BP进行修饰后, 还可以将光声成像与其他成像方式相结合, 从而实现高效成像甚至诊疗一体化。Guo等[19]研究了一种简便的单宁酸(tannic acid, TA)包覆策略, 以合成具有增强磁共振成像(magnetic resonance imaging, MRI)性能的基于BPNSs的纳米平台。由于TA具有良好的螯合能力, TA分子可以与顺磁性Mn2+同时螯合, 使得制备的TA-Mn2+螯合涂层修饰的BPNSs (BPNS@TA-Mn)的核磁性显著增强。BPNS@TA-Mn在NIR区域具有很强的光吸收能力, 因此也表现出较好的光声成像效果, 成功实现了MRI/PA双模态成像。此外, BPNS@TA-Mn具有良好的光热转换能力, 可以有效地将近红外光转化为热能, 抑制肿瘤生长。因此, BPNS@TA-Mn可以作为一种新型的诊疗纳米平台, 用于高效成像从而引导光热疗法(photothermal therapy, PTT)[20]。
2.3 荧光成像纳米BP的层相关带隙使其具有优越的光电性能。光致发光(photoluminescence, PL)光谱表明, 较薄的BP表现出较明显的PL峰[21]。2层至5层的BP纳米薄片具有明显的层间PL效应, 其中双层BP纳米薄片的PL强度最强[22]。采用超声辅助溶液法可得到平均直径约10 nm、高度约8.7 nm的高产BPNPs。BP纳米点具有激发波长依赖性发光行为, 最大量子产率约为7.2%。当激发波长为220、234、280和370 nm时, 可明显捕捉到蓝色和绿色荧光。通过与HeLa细胞共孵育, 能捕捉到强荧光成像且未观察到细胞毒性。
在纳米BP光致发光的基础上, 可以对BP进行染料修饰来改善荧光成像效果。Zhao等[23]通过重氮化学法合成了一种奈罗蓝(NB)染料修饰的NB@BPs, 所合成的NB@BPs具有更好的稳定性和NIR荧光成像功能。体外实验表明, 在570 nm光激发下, 仅NB@BPs处理的MCF-7癌细胞中观察到大量红色荧光信号, 如图 4a~c所示。体内实验显示, MCF-7荷瘤BALB/c裸鼠注射NB@BPs后1 h, 荧光信号在体内呈无序分布, 24 h后肿瘤及部分器官红色荧光信号明显(图 4d)。
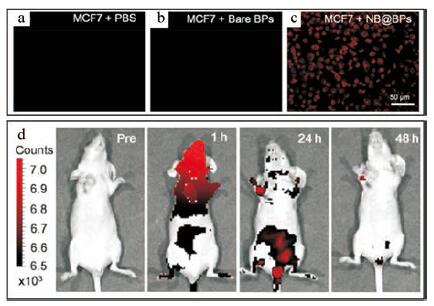
|
Figure 4 In vitro cell culture performance.a-c: Corresponding fluorescence images of MCF7 cells incubated with PBS, bare BPs, and NB@BPs, respectively.In vivo fluorescence bioimaging and photothermal therapy; d: Fluorescence images of the MCF7 breast tumor-bearing nude mice treated with the NB@BPs via the tail vein at different time points post injection.(Adapted from Ref.23 with permission.Copyright © 1997 the American Association for the Advancement of Science) |
除了NB染料外, 将有机荧光染料Rd B负载到PEG化BPQDs上, 形成的荧光探针Rd B/PEG-BPQDs清晰定位于细胞质中, 用于Hep G2细胞和4T1细胞的荧光成像[24]。在激发波长297 nm条件下, 负载荧光氰化物7 (Cyt7)的BPNPs在4T1荷瘤小鼠体内实现了理想的NIR荧光成像[25]。
适用于BP荧光成像的不只有染料, 二氢卟吩e6(chlorin e6, Ce6)是一种具有NIR光谱吸收特性的工业用光敏剂, 也可用于优化BP荧光成像效果。Ce6固定在PEG化的BP纳米薄片上形成BP@PEG/Ce6, 在活体动物体内实现良好的NIR荧光成像。0.65 W·cm-2、660 nm激光照射10 min, BP@PEG/Ce6 NSs (BP@PEG浓度为70 mg·L-1)、BP@PEG NSs (70 mg·L-1)和Ce6(9 mg·L-1)的温度分别升高了12.6、9.9和6.5℃, 光热转换效率分别为43.6%、28.7%和35.4%[26]。由于BP@PEG NSs与Ce6具有良好的光热协同效应, BP@PEG/Ce6比BP@PEG表现出更明显的光热效应[27]。因此, BP@PEG/Ce6可以用于荧光和热成像引导的光热和光动力协同治疗。
以上研究报道表明, BP的独特性质使其具备光热成像、光声成像和荧光成像能力, 成像的方式多种多样并且简单高效。BP表面易进行化学修饰, 通过策略性地引入重金属离子、其他的染料或发光分子, 不仅能提高成像效果, 实现多模态成像, 甚至可以进行更深组织的成像。因此, 基于BP生物成像纳米平台的研究和开发在未来的医学诊断方面具有巨大的优势。
3 光疗与历史数据相比, 近10年来癌症患者数量呈持续增长态势, 但传统的外科手术造成新创和治疗不彻底等缺点; 化疗也难以根除肿瘤细胞, 同时还会杀伤正常的细胞, 破坏人的免疫系统; 放疗缺乏选择性。因此, 需要新的治疗手段来对癌症进行治疗[28]。纳米材料的优势在于, 具有小尺寸效应、表面效应、体积效应和量子效应等特性, 使得其在癌症治疗方面有独特的优势[29]。光治疗以PTT和光动力治疗(photodynamics therapy, PDT)为主, 因为具有不确定性少、靶向性好和可控性好等优点成为传统肿瘤治疗的潜在替代方案。PTT是根据光热剂在光照条件下产生热能来达到治疗效果; PDT可在NIR激光照射下产生ROS来杀死癌细胞。FLBP的直接可调带隙使其具有宽带吸收特性, 这为癌症的光疗应用提供了巨大可能。光热纳米材料由于其独特的性能, 在肿瘤多模式成像及光学治疗中显示出巨大的潜能。
3.1 光热疗法PTT因本身杀伤破坏性小和治疗效率高得到广泛关注。PTT是利用光热转换试剂, 把光能转换成热能来产生局部热量以达到消融肿瘤细胞, 从而治疗肿瘤的一种方法[30]。目前, 光热治疗主要集中在肿瘤治疗中, 这是因为肿瘤细胞对温度变化比较敏感, 温度高于42℃就开始凋亡。一般情况下光热纳米材料只会使肿瘤部位的温度升高, 不会对正常的组织细胞造成损伤。光热治疗的关键在于光热转换试剂在肿瘤部位的累积。纳米药物可以很容易地通过EPR效应穿过血管内皮细胞间隙, 并在肿瘤组织中富集[31]。与波长较短的紫外光相比, 长波长的NIR光组织穿透性好, 可以更好地实现体内的光热治疗。BP光吸收范围广, 特别是能够有效吸收800 nm附近的NIR光并产生光热效应[32], 因此, BP在光热疗法中得到广泛的应用。
PTT试剂需要具备有效靶向肿瘤的适当尺寸、良好的生物相容性和生物降解性, 确保纳米粒在合理的时间内从身体中无害地排出。超小型BPQDs具有良好生物相容性和光热性能, 但存在体内较低的光学特性和容易通过肾脏排出等问题, 仍然限制了它们在临床中的应用[33]。Sun等[34]用液相剥离法制备BPQDs, PEG修饰的BPQDs在808 nm处有较大的消光系数(14.8 L·g-1·cm-1), 并且还具有无辐射性强弛豫、较高的光热转换效率(28.4%)和良好的光稳定性。在功率密度为1 W·cm-2的NIR激光照射下, 质量浓度为50 mg·L-1的PEG-BPQDs水溶液在10 min内上升了31.5℃, 显示了极好的光热性能。在NIR光照射10 min左右, 50 mg·L-1PEG-BPQDs杀死了大部分癌细胞。
除了用PEG修饰外, Shao等[14]制备了用于PTT的PLGA-BPQDs。PLGA通过调节纳米粒的化学组成, 增强了BPQDs的稳定性并能降低BP纳米粒的降解速率。PLGA-BPQDs在8天内保持了稳定的光热性能, 8周后降解了近80%, 并且其代谢产物为无不良反应的水、二氧化碳、磷酸盐和磷酸酯[35]。实验发现最大尺寸的FLBP (394±75 nm)在质量浓度为25 mg·L-1时, NIR激光照射10 min后温度升高了24℃。此外, BPNPs还具有较大的消光系数和较高的NIR光热转换效率。
3.2 光动力疗法PDT是一种基于光敏剂(photosen-sitizer, PS)的光化学反应从而生成有细胞毒性的细胞内ROS的非侵入性治疗模式, 是一种有效的癌症治疗模式[36]。PTT触发的体温过高可能会引起炎症疾病, 或对附近其他器官造成损害。与PTT相比, PDT具有侵袭性小、降低长期发病率和减轻患者痛苦的优点。
Wang等[37]利用超声剥离方法制备了BPNSs, 并发现在波长为660 nm NIR光照射下, 可以有效产生ROS, 对乳腺癌细胞产生较强的毒性, 体内实验结果表明, BPNSs可以有效抑制小鼠肿瘤的生长。Guo等[38]将纳米BP与癌细胞共培养, 在670 nm激光照射下发现在非常低的BP浓度(1.6 mg·L-1)和极弱的激光功率下(160 m W·cm-2)产生的ROS即可有效杀死癌细胞。
由于大部分的光敏剂分子只允许在可见光的激发下产生ROS, 单纯BP也是对可见光响应好, 而可见光的组织穿透性比NIR光弱, 限制了其临床实际使用。为此, 研究者们设计了复合BP纳米材料体系, 使其在NIR光激发下也能产生ROS。通过静电相互作用将作为能量供体的上转化纳米粒(upconversion nanoparticles, UCNPs)装载到BPNSs上制备多功能纳米复合材料, 生成一个NIR光介导的PDT试剂, 使得808 nm下的光转换为更短的波长, 并被BPNSs吸收产生ROS[39]。此外, 由于恶性肿瘤的氧气供应不足会导致ROS产生量低的情况发生。为此, Lin课题组[36]制备了约为28 nm的上转换纳米粒, 并在外面包裹了一层大孔径介孔的二氧化硅壳层, 得到的包裹介孔二氧化硅的上转换纳米粒(mesoporous-silica-coated upconversion nanoparticles, UCMSs)在980 nm激光下能够在523、541和655 nm处产生荧光。UCMSs合适的颗粒大小有利于细胞摄取和运输, 并且大孔径介孔的二氧化硅使得其对光敏剂的负荷量显著增加, 大的中孔结构还可以间接促进单线态氧的产生, 达到更好的PDT效率。另外, 在上转换颗粒上负载花青染料540光敏剂, 得到的光敏剂的吸收光谱和上转换颗粒的发射光谱相吻合, 这说明980 nm激光激发下通过荧光共振能量转移能够成功激发光敏剂产生ROS, 实现NIR光介导的具有较高的组织穿透深度的PDT效应[36]。
PDT效应不仅广泛用于肿瘤治疗, 还适用于关节治疗。Pan等[40]将BPNSs和壳聚糖热敏性水凝胶复合物用于类风湿关节炎的治疗。BPNSs在近红外光照下产生的ROS可以清除增生的滑膜组织, 壳聚糖热敏性水凝胶不仅可以作为关节软骨的润滑剂, 还可以控制BPNS降解产物的释放, 为骨再生提供充足的原料。
4 协同疗法从生物医药的方面来讲, 将BP加工成纳米材料并应用于疾病治疗具有很多优势。首先, 肿瘤细胞分裂速度很快, 这容易造成瘤内血管在结构和形态上的缺陷, 其主要特点是血管的内皮细胞间隙较大, 这就使得纳米药物可以很容易地通过EPR效应穿过血管内皮细胞间隙, 并在肿瘤组织中富集。纳米材料适当的尺寸, 避免了因为过小被肾脏过滤清除的危险, 也避免了因为过大不易进入肿瘤组织降低了药效的问题。此外, 由于纳米材料优异的理化性质, 使得其在修饰后可以实现多模式成像、肿瘤诊断和靶向运输[41]。对BP纳米材料进行功能化修饰能提高BP纳米材料的稳定性和对肿瘤细胞的靶向定位能力[22]。在临床疾病治疗方面, 化疗被认为是最简单、最直接的治疗策略。然而, 药物分子在有机体中的随机分布对正常的组织和器官构成巨大的威胁; 另一方面, 为了达到理想的治疗效果, 患者往往需要连续多次服药, 大大增加了患者的经济负担。基于纳米材料的智能给药系统, 就像一个导航覆盖的化疗, 引导药物分子选择性地积聚在病灶内, 显著提高疗效, 减少化疗的不良反应。最重要的是, 纳米材料的某些光电特性, 加上智能给药平台, 对疾病产生协同治疗作用[16, 17]。
4.1 光热化学疗法化疗是一种有效的治疗方法, 但是毒性高、靶向性低和耐药性限制了其治疗效果。好的药物输送系统可以控制药物释放且显著减少不良反应, 并提高传统化学疗法的疗效。为此, 研究人员在药物输送系统中加入了治疗药物以增强化疗疗效。BP具有独特的褶皱结构、较大的比表面积和良好的光响应特性, 使得其在药物输送系统方面有巨大的开发潜力。纳米BP在整个可见光区域具有广泛的吸收, 表现出优异的NIR光热性能[42-44]。结合BP纳米材料的光热特性及其智能药物递送功能, 其光热化学疗法对肿瘤、骨再生和神经退行性疾病等的协同治疗效果显著。
由于BPNSs表面易于功能化和较大的比表面积, 为化疗药物分子的大量吸附奠定基础; 优异的光学及光热转化性质使其在808 nm激光照射下能够产生局部高热, 可以用于肿瘤的光热治疗, 也能够驱动药物的释放[45]。纳米BP光疗加光热增强化疗显示高效和协同的疾病治疗策略[46, 47]。与吲哚青绿(ICG)(美国FDA批准的临床可用光热剂)相比, BP具有优异的光稳定性。将BPNSs作为纳米载体, 通过静电作用加载DOX, 形成BP-DOX[48]。BPNSs对DOX的负载能力高达950%, 远高于其他报道的2D纳米材料, 如石墨烯、Mo S2等。808 nm激光照射20 min, 释放出90%以上的DOX, 表明光热效应能增强药物的释放行为。体内实验结果证明, 激光照射(660和808 nm)充分利用了BP-DOX协同光热/光动力/化疗的优势, 具有明显的抗肿瘤效果。同时, 主要器官的组织学分析没有发现任何损伤。
在光热化学疗法的基础上, 还可以结合成像、靶向给药等目的对BP进行更多修饰从而提高诊疗效率。Tao等[49]首次将BP纳米材料应用于药物输送系统, 设计了一个基于2D BP NSs的多功能诊疗递送平台, 如图 5a所示。首先通过机械剥离法制备了BP NSs, 以静电吸附作用表面修饰上带正电的PEG-NH2, 以提高其生物相容性和生理稳定性。BP-PEG NSs能高效负载化疗药物DOX和Cy7等实现近红外荧光成像等。同时, 用叶酸(folic acid, FA)对其进行靶向改性, 利用FA能与许多癌细胞上的受体特异性结合的特性来构建特殊的靶向运输系统从而提高治疗效率。实验结果也证实了其良好的靶向作用和治疗效果。以荧光素异硫氰酸酯(fluoresceine isothiocyanate, FITC)标记BP-PEG NSs追踪其可能的内吞途径。结果表明, BP-PEG-FITC NSs通过小窝蛋白依赖型胞腔内吞作用被细胞吸收, 然后运输到早期核内体和晚期核内体, 最终在溶酶体中降解; 或经巨胞饮介导的内吞作用被细胞吸收再运输到晚期核内体, 最终在溶酶体中降解(图 5b)。
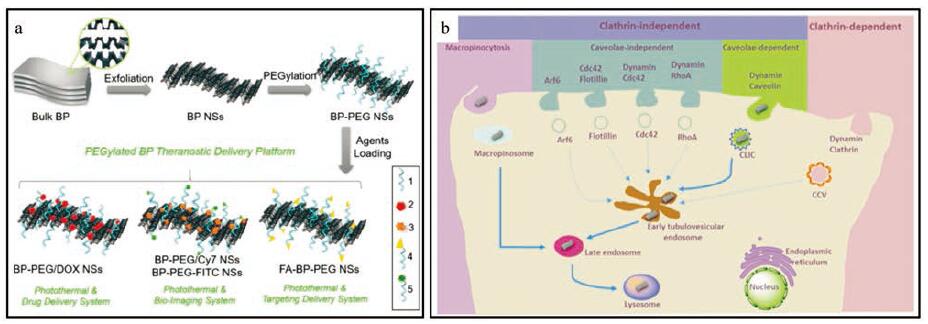
|
Figure 5 Schematic representation of the PEGylated BP theranostic delivery platform (a).1:PEG-NH2 (surface modification); 2:DOX (therapeutic agents); 3:Cy7-NH2 (NIR imaging agents); 4:FA-PEG-NH2 (targeting agents); 5:FITC-PEG-NH2 (fluorescent imaging agents).Screening and summary of the endocytosis pathways and biological activities of PEGylated BP NSs in cancer cells (b).(Adapted from Ref.50 with permission.Copyright © 1997 the American Association for the Advancement of Science) |
BPNSs不仅可作为纳米载体, 其近红外光热效应也有利于促进药物的控释[50]。结合BP的NIR光热效应, 包裹DOX的热响应性BP@水凝胶纳米材料, 由于NIR光热效应使水凝胶熔化从而导致DOX释放, 通过调节NIR光的强度和曝光时间, 可以精确控制DOX从BP@水凝胶中释放的速率[51]。脂质-BPQDs双分子层囊泡内包裹DOX是另一种NIR光控给药系统[52]。在激光照射下, BPQDs吸收NIR光产生的热量破坏脂质膜, 导致脂质-BPQDs囊泡释放DOX。
对纳米BP进行修饰不仅可以增强其光热效应, 还能起到成像作用。Yang等[53]将Fe3O4纳米粒、金纳米粒与BPNSs复合制备了BPs@Au@Fe3O4纳米复合材料, 其中BPs本身具有光热效应, 金纳米粒具有表面等离子体共振效应, 可以吸收红外光或NIR光来产生热效应。此外, Fe3O4纳米粒不仅可以作为磁性造影剂, 还可以作为光吸收剂, 将MRI这种成像方式与PTT结合达到高效消融肿瘤的目的。
Chen等[54]将有序介孔二氧化硅负载到BPNSs上得到介孔二氧化硅-黑磷纳米片(mesoporous-silica black phosphorus nanosheet, BP@MS)。介孔二氧化硅的复合, 不仅可以提高BP的分散性, 而且介孔二氧化硅的多孔性使所制备的BP@MS装载DOX的效率大大提高。BP@MS经过PEG修饰后, 与恶性肿瘤中过表达的mem Hsp70受体特异性结合的配体TKD肽耦合(BPNSs with the MS coating and PEG-TKD modifi-cation, BSPT)[54, 55], 装载DOX后得到的BSPTD (DOX-loaded BSPT)实现了有效光热化学治疗, 由于光热降解促进的二次给药或激活免疫, 可以显著抑制肿瘤肺转移[55]。
纳米BP除了可以治疗肿瘤外, 在其他的医用领域也有广泛的应用前景, 如纳米BP还可以促进骨再生。Yang等[56]用BP纳米片修饰3D打印生物玻璃(bioglass, BG)支架, 构建了BP-BG支架(图 6a)。将BP-BG支架植入荷瘤小鼠骨肉瘤组织中心, 不仅实现了对骨肉瘤的光热消融, 而且促进了随后的骨再生。BPNSs良好的光热效应实现了高温诱导的骨肉瘤消融。更有趣的是, BPNSs的生物降解产生了大量PO43-到体液环境中, 随后的生物矿化反应加速磷酸钙(calcium phos-phate, CAP)纳米粒的形成。利用CAP纳米粒优良的成骨性能, 实现了后续的骨再生(图 6b)。微CT图像和微CT图像的三维重建证明, BP-BG支架比纯BG支架对骨缺损的修复更好。将活性物质SrCl2和BPNSs结合到PLGA中所制备的NIR光介导药物递送平台也可用于骨再生[57]。研究表明, 制备的BP-SrCl2/PLGA微球具有良好的NIR光吸收能力和光热效应。通过NIR光对PLGA壳层的破坏, 触发了Sr2+的释放, 从而达到精确的骨再生治疗。大鼠股骨缺损处植入BP-SrCl2/PLGA微球, 在NIR光照射下, 显示出良好的组织相容性和骨再生能力。另外, 还发现低强度和周期性NIR辐射能有效地促进热休克蛋白的上调, 最终促进体内外的骨再生[58]。
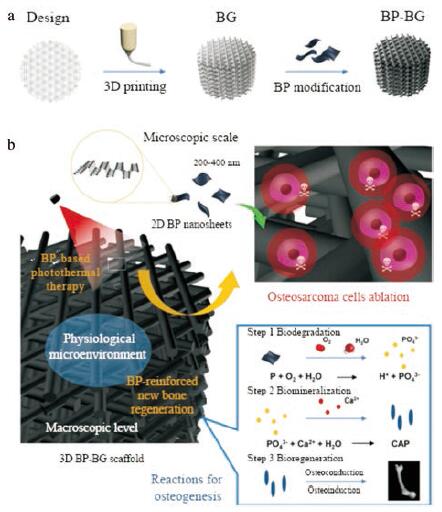
|
Figure 6 Schematic illustration of the fabrication process for BP-BG scaffold (a) and the stepwise therapeutic strategy for the elimi-nation of osteosarcoma followed by osteogenesis by BP-BG (b).BG: Bioglass.(Adapted from Ref.57 with permission.Copyright © 1997 the American Association for the Advancement of Science) |
纳米BP除了可以促进骨再生, 还能应用于神经治疗。BP纳米材料因其与铜离子(Cu2+)的结合能力及光热效应增强通过血脑屏障的能力, 也可被视为一种神经保护性纳米药物, 可预防神经退行性疾病[59]。BPNSs与Cu2+有很强的结合, 可显著减少铜稳态失调引起的细胞毒性ROS的生成, 从而保护神经细胞免受损伤。最重要的是, 体外血脑屏障模型和体内实验采用的埃文斯蓝染色法均证实, BPNSs的NIR光热效应显著增强了BPNSs通过血脑屏障的能力, 使BPNSs作为纳米药物对于脑部神经的治疗效果得以提高(图 7)。
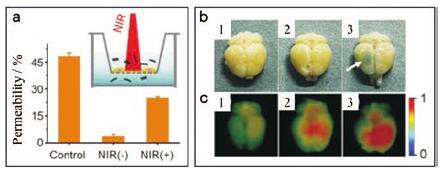
|
Figure 7 The in vitro BBB crossing ability of BP nanosheets pro-moted by photothermal effect (a).Insert: Schematic illustration of in vitro BBB model.The photographs of representative brains of mice after the treatments, using Evans blue as BBB integrity indi-cator (b).The NIR fluorescence imaging of brains after different treatments(c).1:Cy5-PEG-BP; 2:Cy5-PEG+NIR; 3:Cy5-PEG-BP+NIR; BBB: Blood brain barrier.(Adapted from Ref. 60 with permission.Copyright © 1997 the American Association for the Advancement of Science) |
基于BP纳米材料的光热、光动力和化学协同治疗策略为多功能纳米医学平台的开发提供了新的前景, 显示出广阔的临床应用前景。纳米BP不仅在光热/化学联合诊疗肿瘤方面有广泛应用, 其光热效应可增强纳米BP的血脑屏障穿透能力, 在神经性疾病和脑部疾病治疗方面具有潜在的应用前景。纳米BP在体内生物降解和生物矿化形成的CAP纳米粒具有优良的成骨性能, 因此结合纳米BP的光热效应和骨再生能力, 在关节炎和骨瘤等疾病治疗方面有独特优势。
4.2 光/化学/基因协同治疗基因治疗可以定义为一种主要使用核酸聚合物作为药物的化疗。小干扰RNA (siRNA)诱导的基因沉默是基因治疗的主要策略[46, 47]。然而, 暴露于生物体内的裸siRNA面临着酶快速降解和细胞摄取效率低下的挑战。靶向给药策略为上述问题提供了可行的解决方案[60, 61]。基于PEG和聚乙烯亚胺(PEI)双功能化BPNSs (PPBP)的siRNA传递系统可以特异性地将人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)的siRNA传递给癌细胞[62]。BPNSs上的带正电的PEI涂层为带负电荷的siRNA提供了大量的结合位点, 防止siRNA酶降解。另PEI修饰使PPBP-siRNA内化到细胞中, 并引导BP-PEI-siRNA从溶酶体逃逸到细胞质中, 显著提高了PPBP-siRNA的转染效率。实验表明, 含200×10-9 mol·L-1siRNA的BP-PEI-siRNA复合物对MCF-7癌细胞存活蛋白表达的抑制率约为80%, 而siRNA组没有明显的抑制作用。用PPBP-siRNA孵育HeLa细胞48 h, 然后用808和660 nm激光照射, Western blot分析显示hTERT基因mRNA表达降低, Hsp70表达增加, 证实了hTERT-siRNA在PPBP传递系统中的基因沉默效应及PPBP的显著光热效应。荧光共聚焦显微镜也证实了PPBP诱导的细胞内ROS生成。特别值得注意的是, PPBP可以在低pH值和富含ROS的混合环境中逐渐降解, 从而实现PPBP-siRNA的靶向传递和siRNA向癌细胞的释放。体外和体内实验表明, 在808和660 nm激光照射下, PPBP处理的HeLa细胞几乎全部被杀死, PPBP-siRNA处理的荷瘤小鼠表现出最明显的抑瘤作用, 且无明显不良反应, 达到了良好的光/基因协同治疗效果[63]。基于BPNSs的基因传递平台为拓宽基因治疗的临床应用提供了新的视角。
多药共输送系统为多药耐药肿瘤的治疗提供了创新性的新思路。P-gp siRNA已被报道通过下调肿瘤细胞膜上渗透性糖蛋白(P-gp)的表达, 以对抗P-gp介导的多药耐药。将P-gp-siRNA与DOX作为双治疗药物模型加载到BPNSs上, 形成靶向化疗/基因/光疗的多药共输系统[64]。由于PDA修饰的BPNSs的生物稳定性和光热性能进一步增强, 光热效应诱导DOX和P-gp siRNA的药物释放及P-gp siRNA对耐药的抑制, 因此多药共输送系统显示出最佳的肿瘤抑制性能。由此可见, 多模式治疗平台在高效的肿瘤抑制和治疗方面具有巨大的潜力。
4.3 光/化学/免疫协同治疗免疫治疗是目前最受欢迎的肿瘤治疗策略, 不仅可以选择性靶向肿瘤细胞, 对正常组织无任何不良反应, 还可以激活免疫记忆细胞, 延长抗肿瘤效果, 降低肿瘤复发的风险[65]。TorayaBrown等[66]最近的研究表明, 局部热疗可以促进宿主免疫系统的激活。免疫治疗与BP纳米材料光疗相结合, 提高了对肿瘤的治疗效率。
Ou等[67]提出一种通过即插即用纳米化的方式将BP薄片制备成粒径分布均匀的BPNSs。所谓的即插即用系统包括数字化超声气泡爆破、BP薄片的持续补给和串联在单次氩气(Ar)流中的单极性充电器装置(通过静电排斥作用避免纳米级BP之间的团聚)以产生横向纳米级的BPNSs, 制备了尺寸约为40 nm的均匀BPNSs (图 8a)。程序性死亡配体1 (programmed death ligand 1, PL1)、siRNA (s)、DOX (D)和叶酸(F)共同固定在BP上形成一个针对结直肠癌治疗的化学光免疫治疗平台, BP-DcF@sPL (图 8b)。结果表明, BP-DcF@sPL由于基因沉默效应及程序性死亡配体1和小干扰RNA (programmed death ligand 1 and small interfering RNA, s PL)的阻滞, 使癌细胞的PL表达显著降低。对于MC-38荷瘤小鼠, BP-DcF@sPL和NIR光照射均可使T细胞活化率达37%, 超热直接导致44.1%~52.8%的细胞死亡和28.8%~36.3%的细胞凋亡。BP-DcF@sPL带来较高的γ干扰素(interferon-γ, IFN-γ)表达水平, 干扰PL调控的CD8+T细胞的免疫耐受和抑制。所构建的BP-DcF@sPL不仅诱导化学光疗协同杀伤癌细胞, 还利用PL阻断物干扰PL调控的免疫耐受, 为高效治疗癌症提供了一种综合策略。
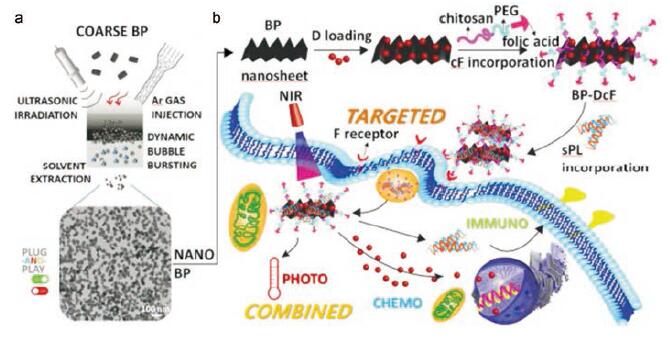
|
Figure 8 Preparation of BP nanosheets by ultrasonic bubble bursting method (a).Schematic diagram of the construction of BP-DcF@sPL and chemo-photoimmunotherapy (b).(Adapted from Ref.68 with permission.Copyright © 1997 the American Association for the Advancement of Science) |
Ji等[68]提出了另一种典型的PTT诱导肿瘤新抗原原位释放的策略, 并探索了一种仿生BPQD-红细胞膜纳米囊泡(BPQD-RMNV)用于光热乳腺癌免疫治疗[52]。近红外光辐射导致乳腺癌细胞凋亡, 刺激免疫系统清除残余和转移的癌细胞。同时, 程序性细胞死亡蛋白1抗体(ap PD-1)的使用进一步保护CD8+T细胞不衰竭。基于BPQD-RMNV的PTT与ap PD-1的免疫检查点阻断协同作用在体内显著抑制乳腺肿瘤的生长。
树突状细胞(DC)是人体中最有效的抗原提呈细胞[69], 对免疫系统的激活至关重要, DC细胞能更有效地激活CD4+和CD8+T细胞的活性, 加强DC细胞的活性能够增强肿瘤疫苗引起的免疫应答[70]。Ye等[70]采用癌细胞膜囊泡(cancer cell membrane nanovesicle, CCNVs)包裹BPQDs制备得到负载黑磷量子点的癌细胞膜囊泡(BPQD-CCNVs), 当DC细胞吞噬后, 通过红外照射引起的光热效应刺激树突状细胞的成熟, 使它能够激活机体的免疫系统对抗癌症。
以BPQDs自组装形成对NIR/ROS敏感的BPNVs, 不仅可用于PA成像, 其囊泡中可负载免疫佐剂CpG寡脱氧核苷酸(CpG oligodeoxynucleotides, CpG ODNs), NIR激光照射后, BPNVs产生高水平的ROS, 引发疏水聚合物PPS转变为亲水聚合物, 从而使囊泡分解为BPQDs。由于同时释放具有肿瘤深度穿透能力的BPQDs和具有增强免疫治疗作用的CpG, BPNVs表现出免疫和光动力的协同治疗效果[16]。
与传统的手术、化学疗法和放射疗法等不同, 癌症免疫疗法增强了肿瘤的免疫原性或激活了宿主的抗肿瘤免疫反应, 从而抑制了肿瘤细胞的增殖。与光疗和药物治疗相结合, 还会增强抗癌免疫效果。在光疗、基因治疗、免疫治疗和药物治疗的基础上, 期待纳米BP在更多元的治疗平台中发挥作用。
5 总结与展望纳米BP材料已经在生物医药方面取得了一些进展, 尤其在目前人类尚且无法攻克的癌症领域。在有效给药剂量下, 复合BP毒性相对较低, 由于其具有卓越的光电性质、荧光特性和大的比表面积、极好的光学响应特性, 使得纳米BP在生物成像方面显示出巨大的潜力; BP也可作为高效的药物载体, 装载治疗药物并运送至病灶部分, BPNSs主要被开发为用于PTT治疗的高效光热转换剂; 并且纳米BP可以与化疗和免疫治疗等治疗手段联合使用来达到协同治疗的效果。即便纳米BP在生物医学应用方面的研究取得了极大的进展, 但是在临床应用之前仍存在一些问题有待解决。由于纳米BP制备条件苛刻, 尺寸对毒性和疗效有巨大影响, 因此制备尺寸适宜, 高产量的纳米BP至关重要。应针对特定疾病开发基于纳米BP的靶向和协同治疗模式, 以此来达到较小的毒副作用和更好的治疗效果。
作者贡献:李欣濛主要负责文章第3、4部分撰写, 李佳月负责第1、2部分撰写, 两人对于文章的贡献相同, 为共同第一作者; 张欣、田晟吉、肖士超和姚梦雨参与文章文献资料的查阅、整理等工作; 刘丹青和郭英分别针对第3、4部分和1、2部分内容进行指导和修改, 为共同通讯作者。
利益冲突:所有作者均声明无利益冲突。
| [1] |
Li LK, Yu YJ, Ye GJ, et al. Black phosphorus field-effect transistors[J]. Nat Nanotechnol, 2014, 9: 372-377. DOI:10.1038/nnano.2014.35 |
| [2] |
Mu XY, Wang JY, Bai XT, et al. Black phosphorus quantum dots induced oxidative stress and toxicity in living cell and mice[J]. ACS Appl Mater Inter, 2017, 9: 20399-20409. DOI:10.1021/acsami.7b02900 |
| [3] |
Wang LL. Nano-Phosphorus Drug Carrier Based on Black Phosphorus and Its Application Basis in Photothermal Targeted Therapy of Leukemia(基于黑磷的纳米药物载体及其在白血病光热靶向治疗中的应用基础)[D]. Nanjing: Southeast University, 2019.
|
| [4] |
Li LL, Lin KP, Zhang YB, et al. Polydopamine-modified black phosphorus nanosheets: a platform with phototherapy/chemotherapy synergistic treatment of cancer[J]. J Henan Univ(Natural Sci)(河南大学学报(自然科学版)), 2019, 49: 581-588. |
| [5] |
Song SJ, Shin YC, Lee UK, et al. Dose-and time-dependent cytotoxicity of layered black phosphorus in fibroblastic cells[J]. Nanomaterials, 2018, 8: 408. DOI:10.3390/nano8060408 |
| [6] |
Sun ZB, Zhao YT, Li ZB, et al. TiL4-coordinated black phosphorus quantum dots as an efficient contrast agent for in vivo photoacoustic imaging of cancer[J]. Small, 2017, 13: 1602896. DOI:10.1002/smll.201602896 |
| [7] |
Zhang S. Application research of black phosphorus[J]. Phosphate Comp Fertil(磷肥与复肥), 2019, 34: 40-42. |
| [8] |
Latiff NM, Teo WZ, Sofer Z, et al. The cytotoxicity of layered black phosphorus[J]. Chem Eur J, 2015, 21: 13991-13995. DOI:10.1002/chem.201502006 |
| [9] |
Qu GB, Yu XF, Jiang GB. Toxic effect and mechanism of black phosphorus nanomaterials[C]. The 10th National Analytical Toxicology Conference and the 6th Analytical Toxicology Committee Meeting, Wuhan, 2018.
|
| [10] |
Luo MM, Fan TJ, Zhou Y, et al. 2D black phosphorus-based biomedical applications[J]. Adv Funct Mater, 2019, 29: 1808306. DOI:10.1002/adfm.201808306 |
| [11] |
Qiu M, Singh A, Wang D, et al. Biocompatible and biodegradable inorganic nanostructures for nanomedicine: silicon and black phosphorus[J]. Nano Today, 2019, 25: 135-155. DOI:10.1016/j.nantod.2019.02.012 |
| [12] |
Sun CX, Wen L, Zeng JF, et al. One-pot solventless preparation of PEGylated black phosphorus nanoparticles for photoacoustic imaging and photothermal therapy of cancer[J]. Biomaterials, 2016, 91: 81-89. DOI:10.1016/j.biomaterials.2016.03.022 |
| [13] |
Fu HD, Li ZB, Xie HH, et al. Different-sized black phosphorus nanosheets with good cytocompatibility and high photothermal performance[J]. RSC Adv, 2017, 7: 14618-14624. DOI:10.1039/C7RA00160F |
| [14] |
Shao JD, Xie HH, Huang H, et al. Biodegradable black phosphorus-based nanospheres for in vivo photothermal cancer therapy[J]. Nat Commun, 2016, 7: 12967. DOI:10.1038/ncomms12967 |
| [15] |
Nie LM, Chen XY. Structural and functional photoacoustic molecular tomography aided by emerging contrast agents[J]. Chem Soc Rev, 2014, 43: 7132-7170. DOI:10.1039/C4CS00086B |
| [16] |
Li Z, Hu YH, Fu QR, et al. NIR/ROS-responsive black phosphorus QD vesicles as immunoadjuvant carrier for specific cancer photodynamic immunotherapy[J]. Adv Funct Mater, 2020, 30: 1905758. DOI:10.1002/adfm.201905758 |
| [17] |
Fu QR, Zhu R, Song JB, et al. Photoacoustic imaging: contrast agents and their biomedical applications[J]. Adv Mater, 2019, 31: 1805875. |
| [18] |
Yang Z, Dai YL, Yin C, et al. Activatable semiconducting theranostics: simultaneous generation and ratiometric photoacoustic imaging of reactive oxygen species in vivo[J]. Adv Mater, 2018, 30: 1707509. DOI:10.1002/adma.201707509 |
| [19] |
Guo JL, Ping Y, Ejima H, et al. Engineering multifunctional capsules through the assembly of metal-phenolic networks[J]. Angew Chem Int Edit, 2014, 53: 5546-5551. DOI:10.1002/anie.201311136 |
| [20] |
Guo T, Lin Y, Jin GX, et al. Manganese-phenolic network-coated black phosphorus nanosheets for theranostics combining magnetic resonance/photoacoustic dual-modal imaging and photothermal therapy[J]. Chem Commun, 2019, 55: 850-853. DOI:10.1039/C8CC08833K |
| [21] |
Castellanos-Gomez A, Vicarelli L, Prada E, et al. Isolation and characterization of few-layer black phosphorus[J]. 2D Mater, 2014, 1: 025001. DOI:10.1088/2053-1583/1/2/025001 |
| [22] |
Zhang S, Yang J, Xu RJ, et al. Extraordinary photoluminescence and strong temperature/angle-dependent raman responses in few-layer phosphorene[J]. ACS Nano, 2014, 8: 9590-9596. DOI:10.1021/nn503893j |
| [23] |
Zhao YT, Tong LP, Li ZB, et al. Stable and multifunctional dye-modified black phosphorus nanosheets for near-infrared imaging-guided photothermal therapy[J]. Chem Mat, 2017, 29: 7131-7139. DOI:10.1021/acs.chemmater.7b01106 |
| [24] |
Li Y, Liu ZM, Hou YQ, et al. A multifunctional nanoplatform based on black phosphorus quantum dots for bioimaging and photodynamic/photothermal synergistic cancer therapy[J]. ACS Appl Mater Interfaces, 2017, 9: 25098-25106. DOI:10.1021/acsami.7b05824 |
| [25] |
Deng LJ, Xu YF, Sun CX, et al. Functionalization of small black phosphorus nanoparticles for targeted imaging and photothermal therapy of cancer[J]. Sci Bull, 2018, 63: 917-924. DOI:10.1016/j.scib.2018.05.022 |
| [26] |
Tian QW, Jiang FR, Zou RJ, et al. Hydrophilic Cu9S5 nanocrystals: a photothermal agent with a 25.7% heat conversion efficiency for photothermal ablation of cancer cells in vivo[J]. ACS Nano, 2011, 5: 9761-9771. DOI:10.1021/nn203293t |
| [27] |
Yang XY, Wang DY, Shi YH, et al. Black phosphorus nanosheets immobilizing Ce6 for imaging guided photothermal/photodynamic cancer therapy[J]. ACS Appl Mater Interfaces, 2018, 10: 12431-12440. DOI:10.1021/acsami.8b00276 |
| [28] |
Kumar D. The personalised medicine. A paradigm of evidencebased medicine[J]. Ann Ist Super Sanita, 2011, 47: 31-40. |
| [29] |
Biju V. Chemical modifications and bioconjugate reactions of nanomaterials for sensing, imaging, drug delivery and therapy[J]. Chem Soc Rev, 2014, 43: 744-764. DOI:10.1039/C3CS60273G |
| [30] |
Zou LL, Wang H, He B, et al. Current approaches of photothermal therapy in treating cancer metastasis with nanotherapeutics[J]. Theranostics, 2016, 6: 762-772. DOI:10.7150/thno.14988 |
| [31] |
Chen YY, Cheng L, Dong ZL, et al. Degradable vanadium disulfide nanostructures with unique optical and magnetic functions for cancer theranostics[J]. Angew Chem Int Edit, 2017, 56: 12991-12996. DOI:10.1002/anie.201707128 |
| [32] |
Chen WS, Liu YN. Black phosphorus nanomaterials and their application in biomedicine[J]. Science, 2017, 69: 18-21. |
| [33] |
Guo WL. Nanostructured Black Phosphorus Sensing Performance(纳米结构的黑磷传感性能研究)[D]. Nanjing: Nanjing University of Posts and Telecommunications, 2019.
|
| [34] |
Sun ZB, Xie HH, Tang SY, et al. Ultrasmall black phosphorus quantum dots: synthesis and use as photothermal agents[J]. Angew Chem Int Edit, 2015, 54: 11526-11530. DOI:10.1002/anie.201506154 |
| [35] |
Ling X, Wang H, Huang SX, et al. The renaissance of black phosphorus[J]. Proc Natl Acad Sci U S A, 2015, 112: 4523-4530. DOI:10.1073/pnas.1416581112 |
| [36] |
Ding BB, Shao S, Yu C, et al. Large-pore mesoporous-silicacoated upconversion nanoparticles as multifunctional immunoadjuvants with ultrahigh photosensitizer and antigen loading efficiency for improved cancer photodynamic immunotherapy[J]. Adv Mater, 2018, 30: 1802479. DOI:10.1002/adma.201802479 |
| [37] |
Wang H, Yang XZ, Shao W, et al. Ultrathin black phosphorus nanosheets for efficient singlet oxygen generation[J]. J Am Chem Soc, 2015, 137: 11376-11382. DOI:10.1021/jacs.5b06025 |
| [38] |
Guo T, Wu Y, Lin Y, etal. Black phosphorus quantum dots with renal clearance property for efficient photodynamic therapy[J]. Small, 2018, 14: 1702815. DOI:10.1002/smll.201702815 |
| [39] |
Lv R, Yang D, Yang PP, et al. Integration of up-conversion nanoparticles and ultrathin black phosphorus for efficient photodynamic theranostics under 808 nm NIR light irradiation[J]. Chem Mater, 2016, 28: 4724-4734. DOI:10.1021/acs.chemmater.6b01720 |
| [40] |
Pan W, Dai C, Li Y, et al. PRP-chitosan thermoresponsive hydrogel combined with black phosphorus nanosheets as injectable biomaterial for biotherapy and phototherapy treatment of rheumatoid arthritis[J]. Biomaterials, 2020, 239: 119851. DOI:10.1016/j.biomaterials.2020.119851 |
| [41] |
Kim D, Shin K, Kwon SG, et al. Synthesis and biomedical applications of multifunctional nanoparticles[J]. Adv Mater, 2018, 30: 1802309. DOI:10.1002/adma.201802309 |
| [42] |
Xing CY, Jing GH, Liang X, et al. Graphene oxide/black phosphorus nanoflakes aerogel with robust thermo-stability and significantly enhanced photothermal property in air[J]. Nanoscale, 2017, 9: 8096. DOI:10.1039/C7NR00663B |
| [43] |
Yi Y, Yu XF, Zhou WH, et al. Two-dimensional black phosphorus: synthesis, modification, properties, and applications[J]. Mater Sci Eng, 2017, 120: 1-33. DOI:10.1016/j.mser.2017.08.001 |
| [44] |
Miao JS, Song B, Li Q, et al. Photothermal effect induced negative photoconductivity and high responsivity in flexible black phosphorus transistors[J]. ACS Nano, 2017, 11: 6048. DOI:10.1021/acsnano.7b01999 |
| [45] |
Chen XL, Zhou Y, Liang X, et al. In vitro study of black phosphorus-loaded quantum dot liposomes for photothermotherapy of cervical cancer[J]. Acta Pharm Sin(药学学报), 2019, 54: 729-736. |
| [46] |
Yin H, Kanasty RL, Eltoukhy AA, et al. Non-viral vectors for gene-based therapy[J]. Nat Rev Genet, 2014, 15: 541-555. DOI:10.1038/nrg3763 |
| [47] |
Bumcrot D, Manoharan M, Koteliansky V, et al. RNAi therapeutics: a potential new class of pharmaceutical drugs[J]. Nat Chem Biol, 2006, 2: 711-719. DOI:10.1038/nchembio839 |
| [48] |
Chen WS, Ouyang J, Liu H, et al. Black phosphorus nanosheetbased drug delivery system for synergistic photodynamic/photothermal/chemotherapy of cancer[J]. Adv Mater, 2017, 29: 1603864. DOI:10.1002/adma.201603864 |
| [49] |
Tao W, Zhu XB, Yu XH, et al. Black phosphorus nanosheets as a robust delivery platform for cancer theranostics[J]. Adv Mater, 2017, 29: 1603276. DOI:10.1002/adma.201603276 |
| [50] |
Yang GH, Wan XJ, Gu ZP, et al. Near infrared photothermalresponsive poly(vinyl alcohol)/black phosphorus composite hydrogels with excellent on-demand drug release capacity[J]. J Mat Chem B, 2018, 6: 1622-1632. DOI:10.1039/C7TB03090H |
| [51] |
Qiu M, Wang D, Liang WY, et al. Novel concept of the smart NIR-light-controlled drug release of black phosphorus nanostructure for cancer therapy[J]. Proc Natl Acad Sci U S A, 2018, 115: 501-506. DOI:10.1073/pnas.1714421115 |
| [52] |
Geng SY, Wu L, Cui HD, et al. Synthesis of lipid-black phosphorus quantum dot bilayer vesicles for near-infrared-controlled drug release[J]. Chem Commun, 2018, 54: 6060-6063. DOI:10.1039/C8CC03423K |
| [53] |
Yang D, Yang GX, Yang PP, et al. Assembly of Au plasmonic photothermal agent and iron oxide nanoparticles on ultrathin black phosphorus for targeted photothermal and photodynamic cancer therapy[J]. Adv Funct Mater, 2017, 27: 1700371. DOI:10.1002/adfm.201700371 |
| [54] |
Chen LL, Qian M, Jiang HL, et al. Multifunctional mesoporous black phosphorus-based nanosheet for enhanced tumor-targeted combined therapy with biodegradation-mediated metastasis inhibition[J]. Biomaterials, 2020, 236: 119770. DOI:10.1016/j.biomaterials.2020.119770 |
| [55] |
Wang SS, Li CY, Meng Y, et al. MemHsp70 receptor-mediated multifunctional ordered mesoporous carbon nanospheres for photoacoustic imaging-guided synergistic targeting trimodal therapy[J]. ACS Biomater Sci Eng, 2017, 3: 1702-1709. DOI:10.1021/acsbiomaterials.7b00326 |
| [56] |
Yang B, Yin JH, Chen Yu, et al. 2D-black-phosphorus-reinforced 3D-printed scaffolds: astepwise countermeasure for osteosarcoma[J]. Adv Mater, 2018, 30: 1705611. DOI:10.1002/adma.201705611 |
| [57] |
Wang XZ, Shao JD, Raouf AM EI, et al. Near-infrared lighttriggered drug delivery system based on black phosphorus for in vivo bone regeneration[J]. Biomaterials, 2018, 179: 164-174. DOI:10.1016/j.biomaterials.2018.06.039 |
| [58] |
Tong LP, Liao Q, Zhao YT, et al. Near-infrared light control of bone regeneration with biodegradable photothermal osteoimplant[J]. Biomaterials, 2019, 193: 1-11. DOI:10.1016/j.biomaterials.2018.12.008 |
| [59] |
Chen WS, Ouyang J, Yi XY, et al. Black phosphorus nanosheets as a neuroprotective nanomedicine for neurodegenerative disorder therapy[J]. Adv Mater, 2018, 30: 1703458. DOI:10.1002/adma.201703458 |
| [60] |
Shen JL, Zhang W, Qi RG, et al. Engineering functional inorganicorganic hybrid systems: advances in siRNA therapeutics[J]. Chem Soc Rev, 2018, 47: 1969. DOI:10.1039/C7CS00479F |
| [61] |
Nordestgaard BG, Nicholls SJ, Langsted A, et al. Advances in lipid-lowering therapy through gene-silencing technologies[J]. Nat Rev Cardiol, 2018, 15: 261. DOI:10.1038/nrcardio.2018.3 |
| [62] |
Chen L, Chen C, Chen W, et al. Biodegradable black phosphorus nanosheets mediate specific delivery of hTERT siRNA for synergistic cancer therapy[J]. ACS Appl Mater Interfaces, 2018, 10: 21137-21148. DOI:10.1021/acsami.8b04807 |
| [63] |
Wang HM, Zhong L, Liu Y, et al. A black phosphorus nanosheetbased siRNA delivery system for synergistic photothermal and gene therapy[J]. Chem Commun, 2018, 54: 3142-3145. DOI:10.1039/C8CC00931G |
| [64] |
Zeng XW, Luo MM, Liu G, et al. Polydopamine-modified black phosphorous nanocapsule with enhanced stability and photothermal performance for tumor multimodal treatments[J]. Adv Sci, 2018, 5: 1800510. DOI:10.1002/advs.201800510 |
| [65] |
Liang X, Ye XY, Wang C, et al. Photothermal cancer immunotherapy by erythrocyte membrane-coated black phosphorus formulation[J]. J Control Release, 2019, 296: 150-161. DOI:10.1016/j.jconrel.2019.01.027 |
| [66] |
Toraya-Brown S, Sheen MR, Zhang PS, et al. Local hyperthermia treatment of tumors induces CD8+ T cell-mediated resistance against distal and secondary tumors[J]. ACS Biomater Sci Eng, 2014, 10: 1273-1285. |
| [67] |
Ou WQ, Byeon JH, Thapa RK, et al. Plug-and-play nanorization of coarse black phosphorus for targeted chemo-photoimmunotherapy of colorectal cancer[J]. ACS Nano, 2018, 12: 10061-10074. DOI:10.1021/acsnano.8b04658 |
| [68] |
Ji XY, Kong N, Wang JQ, et al. A novel top-down synthesis of ultrathin 2D boron nanosheets for multimodal imaging-guided cancer therapy[J]. Adv Mater, 2018, 30: 1803031. DOI:10.1002/adma.201803031 |
| [69] |
Liu YF, Xue XX, Li ZY, et al. Effect of apigenin on dendritic cells maturation and function in murine splenocytes[J]. Acta Pharm Sin(药学学报), 2017, 52: 397-402. |
| [70] |
Ye XY, Mei L. The role of photothermal effect based on black phosphorus quantum dots in the activation of dendritic cells[J]. Acta Pharm Sin(药学学报), 2019, 54: 1297-1302. |
 2021, Vol. 56
2021, Vol. 56


