因晶格中药物分子的空间排列方式和构象存在多样性, 固态药物的晶型也存在很大差异[1]。药物的固体形态差异对其溶解度、溶出速率、吸湿性、稳定性和生物利用度等物理化学性质, 药物有效性和安全性等药代动力学性质, 以及药物加工过程、药物质量等产生重要影响[2]。研究活性药物成分(active pharmaceutical ingredients, APIs)的性质、稳定性和固体形态的转化, 对于过程和配方研发, 以及药物获得上市批准具有重要意义。
固态药物的晶型表征和不同晶型的稳定性研究是药物预配方研究的关键步骤, 对药物质量控制至关重要。目前, 药物多晶型表征的方法有很多种[3, 4], 如热台显微镜(hot stage microscopy, HSM)[5]、扫描电子显微镜(scanning electron microscopy, SEM)[6]、透射电子显微镜(transmission electron microscopy, TEM)[7]等显微镜法, X-射线单晶衍射(single crystal X-ray diffraction, SCXRD)[8]、X-射线粉末衍射(powder X-ray diffraction, PXRD)[9]等X-射线衍射法, 傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)[10]和拉曼(Raman)光谱[11]等振动光谱法, 固体核磁共振(solid-state NMR, SSNMR)[12]等波谱学方法, 以及差示扫描量热(differ-ential scanning calorimetry, DSC)[13]、热失重分析(ther-mal gravimetric analysis, TGA)[14]等热分析方法。
尽管X-射线衍射法和热分析方法是研究固态药物结构多样性的重要方法。但基于对红外光吸收引起振动-转动能级跃迁而获得的FTIR光谱和源于非弹性光散射过程的Raman光谱等互补的振动光谱技术, 均在测定药物分子的振动模式的基础上实现对不同晶型固态药物的结构进行表征, 具有通用、无损、测定快速、需样量少、测定成本低廉等优点, 也日渐成为固态药物晶型表征的重要方法[15]。Raman光谱还具有非破坏性、非侵入性、分子特异性和稳定性高、无需样品制备、样品可回收、能在含水环境中或透过玻璃瓶直接进行测定等多种优点。随着透射拉曼光谱(transmission Raman spectroscopy, TRS)[16, 17]等不同配置的拉曼光谱的使用、表面增强拉曼散射光谱(surface-enhanced Raman scattering, SERS)[18]技术的应用, 以及光纤探头和接触式拉曼装置的联用, 将拉曼光谱的功能发挥得更加强大[19], 成为有效的分子组成和变化的过程分析技术(process analytical technology, PAT), 在药物晶型分析中发挥重要作用。
振动光谱的应用可实现在线监测APIs分子之间、无定形固体分散体中APIs和聚合物之间、药物共晶或共无定形体系中APIs和配体(cocrystal formers, CCFs)之间的相转变和分子间相互作用, 进而在固体形态和制剂配方的相对稳定性预测方面发挥重要作用[20]。中红外(mid-infrared, MIR)、近红外(near-infrared, NIR)和拉曼光谱的应用及一系列化学计量学分析方法的结合[21], 可实现定性测定和定量研究[22, 23]。近红外光谱在药物多晶型筛选和表征方面也发挥重要作用[24]。振动光谱单独使用或与其他分析方法联用, 对于研究不同晶型之间的转换、晶态和无定形之间的转换、水合物和无水晶型之间的转换, 以及药物共晶/盐的形成方面发挥重要作用。量子化学计算的辅助, 也成为利用振动光谱技术研究药物多晶型现象的重要支持。
本文综述了近年来利用振动光谱, 特别是红外光谱和拉曼光谱在药物多晶型表征、晶型转变研究、药物共结晶表征以及药物成盐分析等方面的应用研究进展, 为新型固态药物开发过程中的结构分析和质量控制提供理论和技术支持。
1 固态药物多晶型现象不同的固态药物, 由于药物分子的空间排列存在多样性, 微观构象可能存在微小差异, 进而可以一种、两种或两种以上不同晶体结构形式存在, 晶体的晶胞参数和空间排列均不同, 产生多晶型现象(polymor-phism)[25]。APIs的多晶型现象较为常见, 且亚稳态不同晶型药物向稳态晶型药物转变较为缓慢, 因此, 药物多晶型现象一直是研究的热点。药物共晶、盐、溶剂合物也可能存在多晶型现象[26]。药物多晶型现象的存在, 使得药物的颜色[27]、熔点[28]、溶解度[29]、吸湿性[30]、溶出速率[31, 32]、可压片性[33]、生物利用度[34]等物理化学性质存在很大差别(图 1[26]), 进而直接影响到药物产品的稳定性、有效性、药物质量和制备工艺等[35]。
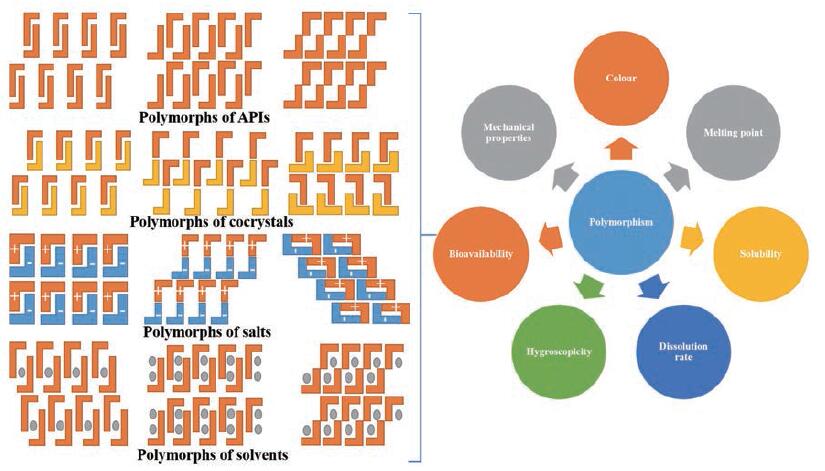
|
Figure 1 Polymorphism of active pharmaceutical ingredients (APIs), cocrystals, salts, solvents and corresponding physicochemical properties[26] |
不同晶型的固态药物, 其物理化学性质差异显著, 药物多晶型研究及晶型控制对于药物产品质量控制、生产工艺选择、临床疗效评价等发挥重要作用。药物多晶型现象使得不同晶型药物分子中, 化学键的键角、键长、晶格振动等存在差异, 进而使得振-转能级跃迁产生差异, 反映在振动光谱中即表现为谱峰位置、谱峰强度、谱峰形状等均产生区别。振动光谱对于表征不同晶型的药物[36, 37]、测定药物的多晶型含量[38]、监测药物多晶型转变过程[39]、研究结晶过程的机制[40]等发挥重要作用。
2.1 红外光谱红外光谱基于化学键可从入射红外光中吸收特定波长的能量进而引起分子振动-转动能级跃迁, 红外光谱对官能团的偶极矩变化较为敏感, 可有效鉴定极性基团, 官能团非对称振动模式常产生较强的红外吸收峰。不同晶型的固态药物晶体, 其化学组成虽相同, 但晶体结构和分子构型存在差异, 一些化学键的键长、键角存在差异, 相应的红外特征吸收谱峰位置、强度、形状等存在差异。
FTIR技术已成为应用广泛的光谱分析技术, IR特征谱带和相应的波数值与特定官能团相对应, 是研究分子化学结构的有效手段, 对于区分具有相同化学结构、不同晶型结构的固态药物发挥重要作用, 在药物多晶型表征、不同晶型固态药物的相转变过程分析、药物质量控制和生物样本检测方面显示出巨大的潜力, 衰减全反射-红外光谱成像[attenuated total reflectance(ATR)-FTIR imaging]和纳米红外光谱(nano-FTIR)技术结合化学计量学方法成为克服传统红外探测不足的有效工具, 满足制剂研究需求以适应药物释放过程和机制的研究[41]。具有不同晶型结构的固态药物, 其红外谱带通常存在差异, 如不同晶型中代表相同官能团振动模式的红外谱峰发生移位现象, 不同晶型的红外光谱中还可能出现新的振动峰[42], 进而实现对固态药物的不同晶型进行区分。
2.1.1 多晶型表征APIs的不同晶型具有区域性的物理和化学特性[20]。红外光谱可有效表征具有不同晶型结构的药物[43], 具有多晶型现象的固态药物的红外特征谱峰存在形状和位置的差异[44]。Maurin等[45]采用漫反射红外光谱技术表征了Roxifiban的晶型Ⅰ和晶型Ⅱ, 发现2种晶型的红外光谱存在细微的差别; Schmidt等[46]采用透射红外光谱技术对PPCHC盐酸盐和DCNHC盐酸盐的2种晶型分别进行表征, 发现晶型Ⅰ和Ⅱ的平均谱带位移相较于晶型LA在3~6 cm-1之间, 红外光谱中1 700~1 600 cm-1处羰基和胺基的价振动及1 500~1 000 cm-1处分子振动显示较大的差异; Detrich等[44]采用ATR-FTIR技术对富马酸比索洛尔的晶型Ⅰ、晶型Ⅱ和水合物进行表征, 发现具有不同单晶结构的晶型Ⅰ和晶型Ⅱ的红外光谱存在细微的差别, 水合物中结晶水的ν(O-H)带较为明显; 为开发确定西咪替丁(cimetidine, CIM)在商业片剂中的晶型, Calvo等[47]制备了晶型A、B、D和M1,采用ATR-FTIR技术结合主成分分析(principal component analysis, PCA), 根据多晶型组成区分CIM和赋性剂、实验室制造和商业片剂的物理混合, 发现2种主成分足以将CIM的4种晶型分成不同的组, 当第2、3种主成分被用于分类过程时, 该方法的性能最佳, 并可应用于商业片剂, 确认使用的晶型A。
2.1.2 晶型转变研究FTIR结合DSC及HSM用于研究固态药物盐酸甲氧氯普胺一水合物(metoclo-pramide hydrochloride monohydrate, MCP HCl·H2O)的脱水、无定形化、再结晶过程[48]; Hsieh等[13]采用DSC-FTIR技术研究了阿斯巴甜(aspartame, APM)半水合物固体在加热过程中的脱水过程, 3 310 cm-1处代表参与氢键形成的ν(N-H)带、3 066~2 951 cm-1区域代表芳香环和脂肪链的ν(C-H)带、1 738 cm-1和1 662 cm-1分别代表酯和酰胺Ⅰ带的ν(CC=CO)带、1 587 cm-1处代表νasym(COO-)带、1 551 cm-1处代表酰胺Ⅱ带δ(N-H)带、1 496 cm-1处代表芳香苯环ν(C=C)带、1 447 cm-1处代表芳香苯环ν(C-C)带、1 383 cm-1处代表δ(C-H)带、1 367 cm-1处代表νsym(COO-)带、1 229 cm-1处代表酯ν(C-O)带, 随样品温度的升高, 这些谱峰的位置和峰强在保持一段时间后发生变化; 研究[49]采用DSC、TGA和FTIR显微光谱技术研究了10-羟基喜树碱(10-hydroxycamptothecin, 10-HCPT)在固态下的热相关性质和热稳定性, 10-HCPT一水合物的红外光谱中, 1 723 cm-1处的峰值可能归属为氢键键合的内酯ν(C=O)带, 脱水破坏氢键后, 该振动带移位至1 750 cm-1, 归属为内酯游离的ν(C=O)带, 进而表明一水合物与10-HCPT通过氢键在分子内发生相互作用。
2.2 拉曼光谱基于拉曼散射原理, 拉曼光谱对官能团的极化率变化较为敏感, 可有效鉴定骨架特征, 官能团对称振动模式常产生较强的拉曼吸收峰。由于水的拉曼信号弱, 采用拉曼光谱实时测定含水溶液中药物结晶过程更易于实现。拉曼光谱还可测定顺反异构。相较于红外光谱需要提前制备样品, 拉曼光谱测定更加快捷, 可减少制样过程中产生转晶现象引起的测定误差, 且需固体药品量较少。同时, 拉曼光谱的峰形更加尖锐, 易于测定低频振动, 可对不同晶型固态药物进行定性对比和定量分析。傅里叶变换拉曼(FT-Raman)光谱技术的应用较为常见, 随着共振拉曼光谱技术、SERS技术、TRS技术等的应用日渐增多, 使得药物的定性和定量分析更加全面。
随着固态药物在工业和学术界的应用越来越多, 拉曼光谱技术在固态药物应用方面的研究日渐增加, 且应用范围很广[50]。从药物发现到制药工业中的药物制造都有涉及, 包括识别和表征药物多晶型[51]、实时监测结晶过程[52]。显微共焦拉曼光谱的应用可获得空间分辨率更高的三维图像。拉曼成像结合光谱和空间信息, 生成样本二维区域图像, 能实现片剂、乳膏、软膏等配方中药物和赋形剂分布的可视化, 在检测掺假药物产品和鉴定固体制剂配方等多个方面具有优势[53]。在药物多晶型表征中, 基于拉曼光谱能提供很多重要的结构信息: 拉曼频率的确认, 可用于鉴定物质组成; 拉曼光谱峰位置的变化, 可提供应力/张力的相关信息; 拉曼光谱峰宽度的大小, 可提供晶体质量的相关信息; 拉曼光谱峰强度的大小, 可提供含量的相关信息; 偏振拉曼光谱可用于研究晶体的对称性和取向性。低频的拉曼光谱谱带与固态药物的分子堆叠、结构变化、多晶型等密切相关, 拉曼光谱日渐成为研究药物多晶型的强有力分析工具之一。
2.2.1 多晶型表征Baraldi等[54]采用拉曼显微境、HSM、SERS光谱、FTIR-ATR等技术研究和表征了溴丙胺太林的晶型Ⅰ和晶型Ⅱ, 在SERS光谱测定中, 溴丙胺太林通过氧原子吸附在银溶胶表面, 溴丙胺太林分子处于银表面的垂直方向; Cailletaud等[55]采用表面增强拉曼化学成像技术(surface-enhanced Raman chemi-cal imaging, SER-CI)结合多变量分析方法检测低水平(0.1%, w/w)不同晶型药物混合物, 研究吡罗昔康的β和α2晶型的SERS谱, 其谱带位置和强度具有明显差异; Šašić等[56]采用拉曼显微镜和拉曼mapping的方法对不同晶型API进行定量和半定量成分分析, 将含有1%(w/w) API的片剂中, 分别掺入10%、5%和2.5%的无定形和5%的另外两种无水晶型, 光谱检测结果表明, 对于光谱上要求最高的无定形状态, 片剂中含量为0.025%(w/w)的无定形状态可被确切检出。
2.2.2 晶型转变研究Kulkarni等[39]采用拉曼光谱技术对具有不同晶型结构的异烟酰胺在固相状态和不同溶液中进行测定, 采用ATR-FTIR技术对溶液中异烟酰胺的酰胺基团的氢键类型进行测定分析, 发现溶液中的氢键是驱动其成核并向特定晶型转变的动力, 进而为理解和控制药物多晶型现象和结晶成核提供启示; 朱冰清等[29]采用变温拉曼(VT-Raman)光谱技术结合变温PXRD (VT-PXRD)技术对黄芩素不同晶型的转晶过程进行研究, 发现加热到120℃时, 新晶型γ逐渐向热力学更加稳定的晶型α转变, 最终实现完全转变(图 2a)。位于1 673 cm-1处拉曼谱峰归属为晶型γ中羰基ν(C=O)带, 当加热到145℃时, 羰基ν(C=O)带红移至1 655 cm-1(图 2b), 归因于转变为晶型α后, 晶型α中羰基形成更强的氢键, 单晶结构数据也进一步证实晶型α中羰基参与的氢键键长(2.626Å)短于晶型γ中相应的氢键键长(2.720Å); Yang等[57]采用显微共焦拉曼光谱和在线拉曼光纤探头监测甘氨酸晶体经溶液介导后, 从亚稳态晶型α向稳态晶型γ转变的多晶型组成等固态性质, 并采用配有Zn Se窗片的FTIR技术监测不同时间的液相浓度, 发现增加Na Cl可显著提高甘氨酸从晶型α向晶型γ转变的相变速率, 相变速率随饱和温度、搅拌速率的增大而增大, 随晶种粒径减小而增大; Simone等[58]采用拉曼光谱和ATR-UV/VIS光谱相结合, 并通过分层控制实现多晶型结晶过程的回馈控制, 提出了多晶型反馈控制(active polymorphic feedback control, APFC)策略, 监测不同晶型混合物的形成, 并通过触发受控的溶解循环和使用过饱和控制稳态晶型的生长来消除亚稳态晶型。拉曼光谱的测定不采用校准技术, 通过识别与存在亚稳态晶型相关的光谱特征峰实现。以邻氨基苯甲酸的冷却结晶为例, 发现使用APFC技术可实现结晶过程中单一晶型的产生, 这个过程中包含多晶型混合物的成核发生或使用受污染的含不需要的晶型杂质的晶种结晶; Manimunda等[59]采用了空间同步拉曼光谱技术和纳米压痕技术研究了压痕诱导阿司匹林不同晶型之间的转变, 发现相较于晶型Ⅱ, 晶型Ⅰ的结构更稳定、更刚性, 结晶网络交联度更高。

|
Figure 2 Solid-state transformation detection of form γ to form α for baicalein upon heating by using variable temperature powder X-ray diffraction (VT-PXRD, a) and variable temperature Raman (VT-Raman, b)[29] |
红外光谱与拉曼光谱等振动光谱技术相互补充, 采用红外光谱和拉曼光谱技术协同表征药物多晶型及药物晶型转变的工作也日渐丰富。Maheux等[60]采用ATR-FTIR技术结合FT-Raman光谱技术等协同表征了盐酸乙基酮的2种具有不同构象的晶型; Sheikhzadeh等[61]采用FTIR技术成功定量研究了盐酸丁螺环酮的晶型1和晶型2混合物中晶型1的含量, 采用拉曼光谱技术研究发现, 盐酸丁螺环酮的2种晶型存在差异, 特别是正丁基; Wardhana等[62]采用FTIR技术、拉曼光谱技术等研究了抗HIV药物依法韦仑的性质, 拉曼光谱数据表明, 不同贮藏温度和研磨时间下, 其晶型会发生改变。研磨10 min后迅速转为晶型A, 加热至约85℃也会因热效应转为晶型A; Zhao等[63]采用ATR-FTIR技术结合聚焦光束反射率测量(FBRM)测定了卡马西平晶型Ⅱ和晶型Ⅲ在1-丙醇中的溶解度和亚稳态区界限, 采用拉曼光谱技术结合FBRM成功监测了等温结晶过程中稳定晶型成核, 从晶型Ⅱ转为晶型Ⅲ; Surwase等[64]采用ATR-FTIR技术结合拉曼光谱技术等研究了p H和温度对吲哚美辛悬浮水溶液中结晶行为的影响, 发现悬浮液的p H值和温度影响结晶的起始时间和结晶速度, p H值和温度越低, 开始结晶的时间越长, 结晶速度越慢, 且在结晶过程中发现了3种新晶型。
3 振动光谱在药物复合物晶型表征中的应用研究共结晶技术应用范围除了应用于制药领域, 也已经涉及有机合成和分离、绿色化学、能量存储、太阳能电池、电子、发光和智能材料等多个领域。药物共晶作为一种潜在的新型可替代药物固体形态变得非常流行[65, 66]; 药物成盐技术也广泛应用于药物性质改善, 美国批准的APIs中, 超过一半是以药物盐的形式存在, 因此在药物研发的后期或早期开发阶段选择合适的药用盐很重要[67]。振动光谱在药物共晶/盐等药物复合物的晶型表征中仍然发挥重要作用, 可区分具有不同单晶结构的药物共晶或药物盐。
3.1 红外光谱应用FTIR技术制备测定样品的方法较为简单, 是确认质子转移和氢键形成的常用方法, 在药物共晶/盐等药物复合物的结构研究和晶型表征方面发挥重要作用。依据成盐前后特征官能团对应红外谱峰的变化来确定多组分药物盐型晶体的形成, 成盐后羧酸阴离子有两个典型的羰基νasym(CO2-)和νsym(CO2-)带: 低于1 600 cm-1区域产生一个强不对称带, 1 400 cm-1附近产生一个弱对称带; 而当羧酸中羰基在更高的波数(约1 700~1 730 cm-1)发生振动吸收时, 则较大可能形成共晶[68, 69]。
3.1.1 共结晶表征FTIR技术在药物共晶的表征方面的代表性工作主要包括: Iwata等[70]采用红外光谱技术结合13C同位素标记羧基氧原子的苯甲酸(benzoic acid, BA)和丁二酸(succinic acid, SA), 同位素标记策略的应用使得ν(C=O)、ν(C-O)和δip(O-H)等谱峰向低频移动; νasym(CO2-)很难精确归属, 主要由于1 600 cm-1附近出现3个谱峰, 同位素标记策略的应用可消除其中1个谱峰, 使得νsym(CO2-)谱峰可被指认, 凸显质子转移探针的振动模式和特征峰, 有效区分了药物盐/共晶中的质子转移, 进而从共晶中区分出盐; δip(O-H)峰可检测共晶中羧基氧的分子间氢键形成, 同位素标记技术也可用于识别此类氢键, 区分共晶中羰基氧的分子间氢键对应的δip(O-H)模式; Putra等[71]采用红外光谱技术表征了依帕司他-咖啡因共晶, 共晶粉末的FTIR光谱于2 500~3 300 cm-1区域存在宽峰, 归属于非离子化和氢键键合的羧酸的ν(O-H)带。依帕司他-咖啡因共晶和咖啡因单体中, 位于1 720 cm-1代表羧酸ν(C-O)带并无显著差异, 进一步表明共晶中依帕司他是以羧酸的形式存在, 而非去质子化的羧酸阴离子, 进而支持了X-射线单晶衍射数据显示的共晶中未发生质子从依帕司他转移到咖啡因分子的结果; 彭浡等[72]采用FTIR技术研究白藜芦醇及共晶, 形成共晶后, 白藜芦醇乙烯基的ν(C=C)带、芳香环的ν(C=C)和δ(C-C)带的形状和峰位置均发生不同程度的改变, 位于1 606 cm-1的芳香环的ν(C=C)带在共晶中均产生不同程度的红移现象, 主要归因于共晶中白藜芦醇的构象和分子堆叠相较于单体发生改变所致; Saha等[73]采用红外光谱中的标记峰来识别芳香酸和一级酰胺共晶中的酸…酰胺二聚体异合成子, 这些标记峰具有单独的N-H…O和O-H…O相互作用的特征, 同时也具有扩展的合成子。苯甲酰胺(图 3a)和3,5-二硝基苯甲酸-苯甲酰胺共晶(图 3b)的红外光谱中酰胺N-H带显示, 共晶中N-H带呈明显的蓝移现象。3,5-二硝基苯甲酸(图 3c)和3,5-二硝基苯甲酸-苯甲酰胺共晶(图 3d)的红外光谱中酸O-H带显示, 预计共晶中O-H带呈> 200 cm-1的红移, 进而表明酸…酰胺二聚体形成。
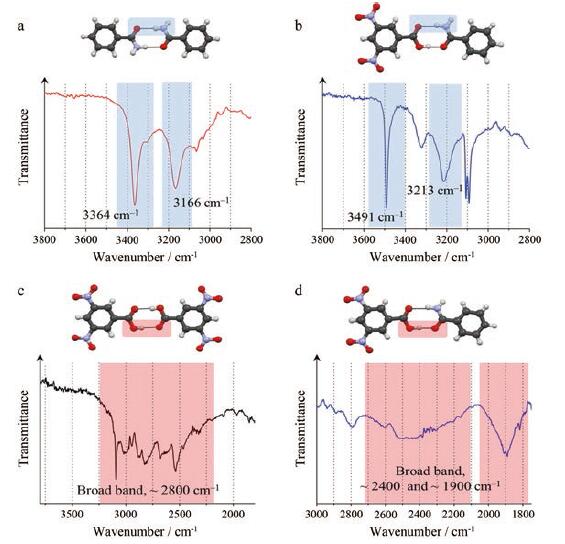
|
Figure 3 Amide N-H band positions in the IR spectra of (a) benzamide and (b) 3,5-dinitrobenzoic acid+benzamide cocrystal.Acid O-H broad band positions in the IR spectra of (c) 3,5-dinitrobenzoic acid and (d) 3,5-dinitrobenzoic acid+benzamide cocrystal[73] |
FTIR技术在药物盐的结构表征方面同样发挥重要作用。Chadha等[74]采用红外光谱技术表征了环丙沙星、环丙沙星与马尿酸以等摩尔比形成的盐, 测定发现位于3 432 cm-1归属为ν(N-H)带的谱峰强度增加, 主要归因于环丙沙星与马尿酸之间的氢键相互作用, 位于2 509~2 535 cm-1区域的红外吸收宽谱带揭示哌嗪基环N原子(NH2+)发生质子化, 且与pKa值预测和单晶结构的ORTEP图显示的结果相同。位于1 542 cm-1和1 385 cm-1处分别出现了由νasym(O-C-O)和νsym(O-C-O)引起的两种典型羧酸盐红外振动谱带, 进一步证实马尿酸中的羧基发生质子转移。马尿酸中ν(C=O)带频率位于1 750 cm-1, 而在环丙沙星-马尿酸盐中移动到1 743 cm-1, 这与环丙沙星-马尿酸盐的晶体堆叠结构中, 马尿酸分子易形成二聚体相关, 单晶结构也可清晰证实; 彭浡等[75]采用FTIR技术结合二阶导数谱分析方法, 研究发现氨苯喋啶(triamterene, Tri)与BA、异烟酸(isonicotinic acid, INA)成盐后, 位于2 800~3 650 cm-1区域的3 474 cm-1和3 371 cm-1谱峰归属为自由氨基的νasym(NH2)和νsym(NH2)带, 谱峰发生移位。因两种盐的分子堆叠方式存在差异, Tri的自由氨基νasym(NH2)和νsym(NH2)带的位移存在差异。Tri-BA、Tri-INA中, 3 579 cm-1、3 569 cm-1分别出现新峰, 归属为Tri-BA、Tri-INA盐形成后质子化的嘧啶N1原子的ν(NH+)带(图 4); Hiendrawan等[76]采用FTIR技术表征了降压药卡维地洛(carvedilol, CVD)与草酸(oxalic acid, OXA)、富马酸(fumaric acid, FUMA)、苯甲酸(benzoic acid, BZA)和扁豆酸(mandelic acid, MDA)形成的盐, 成盐后相较于CVD单体, 复合物中CVD发生质子转移。

|
Figure 4 Second-derivative spectra of Tri, Tri-BA and Tri-INA in the 3 650-2 800 cm-1 region[75].Tri: Triamterene; BA: Benzoic acid; INA: Isonicotinic acid |
拉曼光谱可根据药物成盐后的特征谱带有效区分药物复合物晶体中API是以中性分子或盐的形式存在。药物共晶的拉曼光谱的特征谱带也随共晶的形成而相较于原料API分子呈现谱峰形状和位置的不同程度改变。
3.2.1 共结晶表征拉曼光谱在药物共晶的晶型表征和形成评价方面发挥重要作用。Elbagerma等[77]采用拉曼光谱和TRS发现, 水杨酸与烟酸、DL-苯丙氨酸、6-羟基烟酸以等摩尔比形成的共晶, 以及3, 4-二羟基苯甲酸与草酸以等摩尔比形成的共晶, 其光谱振动模式与原料药不同, 表明拉曼光谱和TRS是通过成分之间的相互作用来评价共晶形成的有效工具; 彭浡等[72]采用显微共焦拉曼光谱研究了白藜芦醇(resveratrol, RSV)及其共晶的特征峰。RSV与吡啶乙烯(4,4'-vinylenedi-pyridine, DPE)、吡啶乙烷(4,4'-ethylenedipyridine, BPE)、偶氮吡啶(4,4'-azobispyridine, AZPY)等形成共晶、共晶的多晶型及溶剂合物后, 位于1 627 cm-1处代表白藜芦醇乙烯基的ν(C=C)带, 在RSV-1.5BPE中蓝移至1 628 cm-1, 在RSV-2DPE FormⅠ中蓝移至1 637 cm-1, 在RSV-2DPE FormⅡ中蓝移至1 641 cm-1, 在RSV-DPE中蓝移至1 631 cm-1, 在2RSV-3DPE·ACE中蓝移至1 638 cm-1, 在RSV-1.5DPE∙MeOH中蓝移至1 634 cm-1, 在RSV-2AZPY中蓝移至1 670 cm-1(图 5)。这些谱带发生蓝移的现象表明, 形成共晶后RSV乙烯基C=C键的构象发生改变。
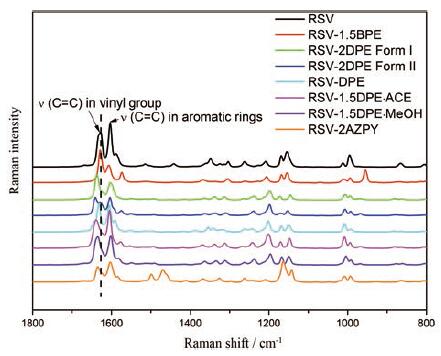
|
Figure 5 Raman spectra of RSV, RSV-1.5BPE, RSV-2DPE FormⅠ, RSV-2DPE FormⅡ, RSV-DPE, 2RSV-3DPE∙ACE, RSV-1.5DPE·Me OH and RSV-2AZPY cocrystals in the 1 800-800 cm-1 region[72].RSV: Resveratrol; BPE: 4,4'-Ethylenedipyridine; DPE: 4,4'-Vinylenedipyridine; AZPY: 4,4'-Azobispyridine |
拉曼光谱在药物盐的表征方面同样发挥重要作用。彭浡等[75]采用显微共焦拉曼光谱研究了Tri与烟酸(nicotinic acid, NA)、对甲苯磺酸(p-tolu-enesulfonic acid, TA)、BA、INA等成盐后的结构特征和光谱特征之间的关系, Tri、Tri-NA和Tri-NA·H2O在1 000~1 800 cm-1区域的拉曼光谱(图 6a)显示, 位于1 595 cm-1的Tri蝶啶环的ν(C=N)带在Tri-NA和Tri-NA·H2O中均发生蓝移, 表明有相似的C=N键的化学环境的变化, 蓝移也发生在Tri-BA、Tri-INA、Tri-TA中(图 6b)。1 550~1 650 cm-1区域与C=N+-H相关的ν(C=N)带的蓝移可作为鉴定离子化Tri的特征峰, Tri的嘧啶环上N1位原子发生质子化; 彭浡等[78]采用显微共焦拉曼光谱研究Tri与呋塞米(furomeside, Fur)形成盐后, 相较于Tri和Tri-Fur在1 000~1 600 cm-1区域出现谱峰形状和位置的改变, Tri-Fur盐的形成导致蝶啶环骨架的C=N或C-N键的ν(C=N)带和ν(C-N)带发生变化。
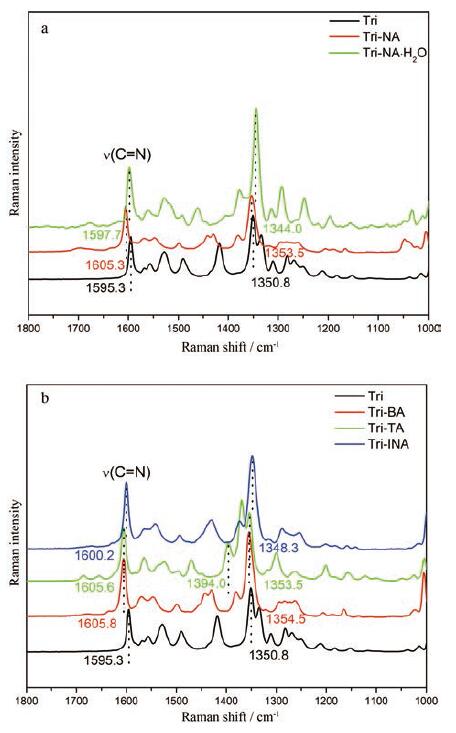
|
Figure 6 Raman spectra of Tri, Tri-NA, and Tri-NA·H2O (a), Raman spectra of Tri, Tri-BA, Tri-TA and Tri-INA in 1 800-1 000 cm-1 region (b)[75].NA: Nicotinic acid; TA: p-Toluenesulfonic acid |
采用红外光谱和拉曼光谱技术协同表征药物共结晶和药物盐的研究工作也日渐增加。Garbacz等[79]采用基于FTIR技术和DSC相变监测技术支持的拉曼光谱的扩展方法筛选苯二氮䓬类化合物共结晶, 发现了4个潜在的共结晶组合, 进而表明FTIR技术和拉曼光谱技术协同表征, 并结合DSC检测相转变, 有助于在溶剂辅助研磨过程中快速筛选和检测苯二氮䓬共晶; Garbacz等[80]还采用FTIR技术结合拉曼光谱技术证实了苯二氮䓬形成共结晶后, 与配体分子之间存在氢键连接, 但无质子交换; Fernandes等[81]采用拉曼光谱和FTIR技术联合表征显示, NH/OH与CO基团之间存在氢键, 进而确认了采用液体辅助研磨方法使得水杨酸、延胡索酸、苹果酸与非甾体抗炎药美洛昔康之间分别形成共晶; Bhandaru等[82]采用FTIR结合拉曼光谱技术表征了通过液体辅助研磨方法获得的依普沙坦甲磺酸盐与琥珀酸、对氨基苯甲酸和水杨酸形成的共晶; Maheux等[83]采用FTIR结合FT-Raman光谱技术协同表征了Buphedrone盐酸盐和Pentedrone盐酸盐。
4 总结与展望近年来, 振动光谱技术在药物晶型表征方面发挥重要作用, 红外光谱和拉曼光谱在固态药物的晶型表征、不同晶型之间的相转变过程研究, 药物共晶/盐的区分和表征方面发挥了重要作用。红外光谱结合同位素标记技术实现了有效区分不同离子化状态的药物共晶/盐, 拉曼光谱能快速区分APIs的多晶型并成为实现自动高通量表征的潜在理想工具, 还能在线监测不同固体形态的药物之间的转变。
振动光谱技术的应用能识别具有不同药理活性的传统和创新型赋形剂的多晶型和非晶型原料药, 但利用振动光谱法研究药物多晶型现象也存在一定的局限性, 不同晶型的固态药物, 其振动-转动光谱的差异较小, 其不同晶格的振动峰差异相较于分子化学键的振动更弱。因此, 在振动光谱上的差异有时很难观测到。未来, 基于振动光谱技术的药物固体形态研究和表征, 需要结合先进的光谱成像技术和在线监测技术, 并结合针对不同体系的个性化量化计算和化学计量学方法, 实现更加精准的定性和定量分析, 成为研究药物晶型、辅料、成分与药效关系的强有力分析工具之一, 在创新药物研发过程中发挥不可替代、关键的技术支撑作用。
作者贡献:王建荣对综述进行了构思及文章修改; 彭浡负责了文献查阅及文章撰写。
利益冲突:无利益冲突。
| [1] |
Singhal D, Curatolo W. Drug polymorphism and dosage form design: a practical perspective[J]. Adv Drug Deliv Rev, 2004, 56: 335-347. DOI:10.1016/j.addr.2003.10.008 |
| [2] |
Talaczynska A, Dzitko J, Cielecka-Piontek J. Benefits and limitations of polymorphic and amorphous forms of active pharmaceutical ingredients[J]. Curr Pharm Design, 2016, 22: 4975-4980. DOI:10.2174/1381612822666160804100036 |
| [3] |
Pindelska E, Sokal A, Kolodziejski W. Pharmaceutical cocrystals, salts and polymorphs: advanced characterization techniques[J]. Adv Drug Deliv Rev, 2017, 117: 111-146. DOI:10.1016/j.addr.2017.09.014 |
| [4] |
Higashi K, Ueda K, Moribe K. Recent progress of structural study of polymorphic pharmaceutical drugs[J]. Adv Drug Deliv Rev, 2017, 117: 71-85. DOI:10.1016/j.addr.2016.12.001 |
| [5] |
Kumar A, Singh P, Nanda A. Hot stage microscopy and its applications in pharmaceutical characterization[J]. Appl Microsc, 2020, 50: 12. DOI:10.1186/s42649-020-00032-9 |
| [6] |
Hao C, Jin J, Xiong J, et al. Polymorphs of DP-VPA solid solutions and their physicochemical properties[J]. J Pharm Sci, 2020, 109: 2156-2165. DOI:10.1016/j.xphs.2020.03.017 |
| [7] |
Eddleston MD, Bithell EG, Jones W. Transmission electron microscopy of pharmaceutical materials[J]. J Pharm Sci, 2010, 99: 4072-4083. DOI:10.1002/jps.22220 |
| [8] |
Sardo M, Martins ICB, Vladiskovic C, et al. Characterization of pharmaceutical solids combining NMR, X-ray diffraction and computer modelling, in Biophysical techniques in drug discovery[M]//Canales A. Biophysical Techniques in Drug Discovery. UK: The Royal Society of Chemistry, 2018: 120-169.
|
| [9] |
Aitipamula S, Chow PS, Tan RBH. Conformational polymorphs of a muscle relaxant, metaxalone[J]. Cryst Growth Des, 2011, 11: 4101-4109. DOI:10.1021/cg200678e |
| [10] |
Zimmermann B, Baranović G. Thermal analysis of paracetamol polymorphs by FT-IR spectroscopies[J]. J Pharm Biomed, 2011, 54: 295-302. DOI:10.1016/j.jpba.2010.08.023 |
| [11] |
Ayala AP, Siesler HW, Boese R, et al. Solid state characterization of olanzapine polymorphs using vibrational spectroscopy[J]. Int J Pharm, 2006, 326: 69-79. DOI:10.1016/j.ijpharm.2006.07.023 |
| [12] |
Xu Y, Southern SA, Szell PMJ, et al. The role of solid-state nuclear magnetic resonance in crystal engineering[J]. CrystEngComm, 2016, 18: 5236-5252. DOI:10.1039/C6CE01206J |
| [13] |
Hsieh WH, Cheng WT, Chen LC, et al. Non-isothermal dehydration kinetic study of aspartame hemihydrate using DSC, TGA and DSC-FTIR microspectroscopy[J]. Asian J Pharm Sci, 2018, 13: 212-219. DOI:10.1016/j.ajps.2017.12.001 |
| [14] |
Gong NB, Yang DZ, Jin GM, et al. Structure, characterization, solubility and stability of podophyllotoxin polymorphs[J]. J Mol Struct, 2019, 1195: 323-330. DOI:10.1016/j.molstruc.2019.05.048 |
| [15] |
Du Y, Xue JD. Investigation of polymorphism and cocrystallization of active pharmaceutical ingredients using vibrational spectroscopic techniques[J]. Curr Pharm Design, 2016, 22: 4917-4928. DOI:10.2174/1381612822666160726104604 |
| [16] |
Feng HZ, Bondi RW, Anderson CA, et al. Investigation of the sensitivity of transmission Raman spectroscopy for polymorph detection in pharmaceutical tablets[J]. Appl Spectrosc, 2017, 71: 1856-1867. DOI:10.1177/0003702817690407 |
| [17] |
Aina A, Hargreaves MD, Matousek P, et al. Transmission Raman spectroscopy as a tool for quantifying polymorphic content of pharmaceutical formulations[J]. Analyst, 2010, 135: 2328-2333. DOI:10.1039/c0an00352b |
| [18] |
Cîntǎ Pînzaru S, Pavel I, Leopold N, et al. Identification and characterization of pharmaceuticals using Raman and surfaceenhanced Raman scattering[J]. J Raman Spectrosc, 2004, 35: 338-346. DOI:10.1002/jrs.1153 |
| [19] |
Paudel A, Raijada D, Rantanen J. Raman spectroscopy in pharmaceutical product design[J]. Adv Drug Deliv Rev, 2015, 89: 3-20. DOI:10.1016/j.addr.2015.04.003 |
| [20] |
Andrea E. Application of vibrational spectroscopy to study solidstate transformations of pharmaceuticals[J]. Curr Pharm Design, 2016, 22: 4883-4911. DOI:10.2174/1381612822666160726110103 |
| [21] |
Hertrampf A, Sousa RM, Menezes JC, et al. Semi-quantitative prediction of a multiple api solid dosage form with a combination of vibrational spectroscopy methods[J]. J Pharm Biomed, 2016, 124: 246-253. DOI:10.1016/j.jpba.2016.03.003 |
| [22] |
Bunaciu AA, Aboul-Enein HY, Hoang VD. Vibrational spectroscopy used in polymorphic analysis[J]. Trends Analyt Chem, 2015, 69: 14-22. DOI:10.1016/j.trac.2015.02.006 |
| [23] |
Ma LW, Du W, Zhao CS. Advances in the quantitative analytical methods of drug polymorphism[J]. Acta Pharm Sin(药学学报), 2011, 46: 896-903. |
| [24] |
Chadha R, Haneef J. Near-infrared spectroscopy: effective tool for screening of polymorphs in pharmaceuticals[J]. Appl Spectrosc Rev, 2015, 50: 565-583. DOI:10.1080/05704928.2015.1044663 |
| [25] |
Lee AY, Erdemir D, Myerson AS. Crystal polymorphism in chemical process development[J]. Annu Rev Chem Biomol, 2011, 2: 259-280. DOI:10.1146/annurev-chembioeng-061010-114224 |
| [26] |
Cherukuvada S, Nangia A. Eutectics as improved pharmaceutical materials: design, properties and characterization[J]. Chem Commun, 2014, 50: 906-923. DOI:10.1039/C3CC47521B |
| [27] |
Li MQ, Zhang Q, Wang JR, et al. Mechanochromism triggered fluorescent color switching among polymorphs of a natural fluorescence pigment[J]. Chem Commun, 2016, 52: 11288-11291. DOI:10.1039/C6CC04958C |
| [28] |
Surov AO, Manin AN, Voronin AP, et al. Weak interactions cause packing polymorphism in pharmaceutical two-component crystals. The case study of the salicylamide cocrystal[J]. Cryst Growth Des, 2017, 17: 1425-1437. DOI:10.1021/acs.cgd.7b00019 |
| [29] |
Zhu BQ, Wang JR, Mei XF. Insight into the phase transformation among various solid forms of baicalein[J]. Cryst Growth Des, 2015, 15: 4959-4968. DOI:10.1021/acs.cgd.5b00858 |
| [30] |
Zhang Q, Mei XF. Two new polymorphs of huperzine a obtained from different dehydration processes of one monohydrate[J]. Cryst Growth Des, 2016, 16: 3535-3542. DOI:10.1021/acs.cgd.6b00493 |
| [31] |
Suresh K, Nangia A. Curcumin: pharmaceutical solids as a platform to improve solubility and bioavailability[J]. CrystEngComm, 2018, 20: 3277-3296. DOI:10.1039/C8CE00469B |
| [32] |
Wang JR, Wang XJ, Lu LY, et al. Highly crystalline forms of valsartan with superior physicochemical stability[J]. Cryst Growth Des, 2013, 13: 3261-3269. DOI:10.1021/cg400762w |
| [33] |
Singaraju AB, Bahl D, Wang CG, et al. Molecular interpretation of the compaction performance and mechanical properties of caffeine cocrystals: a polymorphic study[J]. Mol Pharm, 2020, 17: 21-31. DOI:10.1021/acs.molpharmaceut.9b00377 |
| [34] |
de Oliveira GHO, do Nascimento SB, de Oliveira FM, et al. Systematic evaluation of the impact of solid-state polymorphism on the bioavailability of thalidomide[J]. Eur J Pharm Sci, 2019, 136: 104937. DOI:10.1016/j.ejps.2019.05.015 |
| [35] |
Gao ZG, Rohani S, Gong JB, et al. Recent developments in the crystallization process: toward the pharmaceutical industry[J]. Engineering, 2017, 3: 343-353. DOI:10.1016/J.ENG.2017.03.022 |
| [36] |
Ali SFB, Rahman Z, Dharani S, et al. Chemometric models for quantification of carbamazepine anhydrous and dihydrate forms in the formulation[J]. J Pharm Sci, 2019, 108: 1211-1219. DOI:10.1016/j.xphs.2018.10.023 |
| [37] |
Ma YX, Wang N, Dai SY, et al. Preparation and characterization of rivaroxaban as an anticoagulant[J]. Acta Pharm Sin(药学学报), 2019, 54: 2069-2073. |
| [38] |
Guo CY, Luo XF, Zhou XH, et al. Quantitative analysis of binary polymorphs mixtures of fusidic acid by diffuse reflectance FTIR spectroscopy, diffuse reflectance FT-NIR spectroscopy, Raman spectroscopy and multivariate calibration[J]. J Pharm Biomed, 2017, 140: 130-136. DOI:10.1016/j.jpba.2017.02.053 |
| [39] |
Kulkarni SA, McGarrity ES, Meekes H, et al. Isonicotinamide self-association: the link between solvent and polymorph nucleation[J]. Chem Commun, 2012, 48: 4983-4985. DOI:10.1039/c2cc18025a |
| [40] |
Ewing AV, Kazarian SG. Recent advances in the applications of vibrational spectroscopic imaging and mapping to pharmaceutical formulations[J]. Spectrochim Acta Part A, 2018, 197: 10-29. DOI:10.1016/j.saa.2017.12.055 |
| [41] |
Song YJ, Cong YH, Wang B, et al. Applications of Fourier transform infrared spectroscopy to pharmaceutical preparations[J]. Expert Opin Drug Del, 2020, 17: 551-571. DOI:10.1080/17425247.2020.1737671 |
| [42] |
Liu HD, Yang PP, Li ZH, et al. Thermodynamics, characterization, and polymorphic transformation of 1,5-pentanediamine carbonate[J]. Ind Eng Chem Res, 2020, 59: 10185-10194. DOI:10.1021/acs.iecr.0c00365 |
| [43] |
Liu Y, Huang HW, Wu JM, et al. Polymorphs of clopidogrel bisulfate[J]. Acta Pharm Sin(药学学报), 2013, 48: 1358-1360. |
| [44] |
Detrich Á, Dömötör KJ, Katona MT, et al. Polymorphic forms of bisoprolol fumarate[J]. J Therm Anal Calorim, 2019, 135: 3043-3055. DOI:10.1007/s10973-018-7553-8 |
| [45] |
Maurin MB, Vickery RD, Rabel SR, et al. Polymorphism of roxifiban[J]. J Pharm Sci, 2002, 91: 2599-2604. DOI:10.1002/jps.10078 |
| [46] |
Schmidt AC. Solid-state characterization of falicaine hydrochloride and isomorphic dyclonine hydrochloride-part iv. Crystal polymorphism of local anaesthetic drugs[J]. Eur J Pharm Sci, 2005, 25: 407-416. DOI:10.1016/j.ejps.2005.04.001 |
| [47] |
Calvo NL, Kaufman TS, Maggio RM. A PCA-based chemometrics-assisted ATR-FTIR approach for the classification of polymorphs of cimetidine: application to physical mixtures and tablets[J]. J Pharm Biomed, 2015, 107: 419-425. DOI:10.1016/j.jpba.2015.01.016 |
| [48] |
Lin SY. Molecular perspectives on solid-state phase transformation and chemical reactivity of drugs: metoclopramide as an example[J]. Drug Discov Today, 2015, 20: 209-222. DOI:10.1016/j.drudis.2014.10.001 |
| [49] |
Wang SL, Lin SY, Hsieh TF, et al. Thermal behavior and thermal decarboxylation of 10-hydroxycamptothecin in the solid state[J]. J Pharm Biomed, 2007, 43: 457-463. DOI:10.1016/j.jpba.2006.07.023 |
| [50] |
Wang Y, Li ZH, Zhang ZX, et al. Applications of Raman spectroscopy in pharmaceutical analysis[J]. Acta Pharm Sin(药学学报), 2004, 39: 764-768. |
| [51] |
Du Y, Wang YG, Xue JD, et al. Structural insights into anhydrous and monohydrated forms of 2,4,6-trihydroxybenzoic acid based on Raman and terahertz spectroscopic characterization[J]. Spectrochim Acta Part A, 2020, 224: 117436. DOI:10.1016/j.saa.2019.117436 |
| [52] |
Lin MX, Wu YY, Rohani S. A kinetic study of crystallization process of imatinib mesylate with polymorphic transformation phenomenon[J]. J Cryst Growth, 2019, 507: 146-153. DOI:10.1016/j.jcrysgro.2018.10.061 |
| [53] |
Bhumika DP, Priti JM. An overview: application of Raman spectroscopy in pharmaceutical field[J]. Curr Pharm Anal, 2010, 6: 131-141. DOI:10.2174/157341210791202654 |
| [54] |
Baraldi C, Freguglia G, Tinti A, et al. IR, Raman and SERS spectra of propantheline bromide[J]. Spectrochim Acta A, 2013, 103: 1-10. DOI:10.1016/j.saa.2012.10.070 |
| [55] |
Cailletaud J, De Bleye C, Dumont E, et al. Detection of low dose of piroxicam polymorph in pharmaceutical tablets by surfaceenhanced Raman chemical imaging (SER-CI) and multivariate analysis[J]. Int J Pharm, 2020, 574: 118913. DOI:10.1016/j.ijpharm.2019.118913 |
| [56] |
Šašić S, Mehrens S. Raman chemical mapping of low-content active pharmaceutical ingredient formulations. Iii. Statistically optimized sampling and detection of polymorphic forms in tablets on stability[J]. Anal Chem, 2012, 84: 1019-1025. DOI:10.1021/ac202396u |
| [57] |
Yang X, Lu J, Wang XJ, et al. In situ monitoring of the solutionmediated polymorphic transformation of glycine: characterization of the polymorphs and observation of the transformation rate using Raman spectroscopy and microscopy[J]. J Raman Spectrosc, 2008, 39: 1433-1439. DOI:10.1002/jrs.2016 |
| [58] |
Simone E, Saleemi AN, Tonnon N, et al. Active polymorphic feedback control of crystallization processes using a combined Raman and ATR-UV/VIS spectroscopy approach[J]. Cryst Growth Des, 2014, 14: 1839-1850. DOI:10.1021/cg500017a |
| [59] |
Manimunda P, Asif SAS, Mishra MK. Probing stress induced phase transformation in aspirin polymorphs using Raman spectroscopy enabled nanoindentation[J]. Chem Commun, 2019, 55: 9200-9203. DOI:10.1039/C9CC04538D |
| [60] |
Maheux CR, Alarcon IQ, Copeland CR, et al. Identification of polymorphism in ethylone hydrochloride: synthesis and characterization[J]. Drug Test Anal, 2016, 8: 847-857. DOI:10.1002/dta.1859 |
| [61] |
Sheikhzadeh M, Rohani S, Jutan A, et al. Solid-state characterization of buspirone hydrochloride polymorphs[J]. Pharm Res, 2006, 23: 1043-1050. DOI:10.1007/s11095-006-9779-6 |
| [62] |
Wardhana YW, Soewandhi SN, Wikarsa S, et al. Observation of polymorphic transformation of amorphous efavirenz during heating and grinding processes using Raman spectroscopy[J]. Res J Pharm Biol Chem Sci, 2017, 8: 280-286. |
| [63] |
Zhao YY, Bao Y, Wang JK, et al. In situ focused beam reflectance measurement (FBRM), attenuated total reflectance fourier transform infrared (ATR-FTIR) and Raman characterization of the polymorphic transformation of carbamazepine[J]. Pharmaceutics, 2012, 4: 164-178. DOI:10.3390/pharmaceutics4010164 |
| [64] |
Surwase SA, Boetker JP, Saville D, et al. Indomethacin: new polymorphs of an old drug[J]. Mol Pharm, 2013, 10: 4472-4480. DOI:10.1021/mp400299a |
| [65] |
Cherukuvada S, Kaur R, Guru Row TN. Co-crystallization and small molecule crystal form diversity: from pharmaceutical to materials applications[J]. CrystEngComm, 2016, 18: 8528-8555. DOI:10.1039/C6CE01835A |
| [66] |
Gadade DD, Pekamwar SS. Pharmaceutical cocrystals: regulatory and strategic aspects, design and development[J]. Adv Pharm Bull, 2016, 6: 479-494. DOI:10.15171/apb.2016.062 |
| [67] |
Saal C, Becker A. Pharmaceutical salts: a summary on doses of salt formers from the orange book[J]. Eur J Pharm Sci, 2013, 49: 614-623. DOI:10.1016/j.ejps.2013.05.026 |
| [68] |
Aitipamula S, Wong ABH, Chow PS, et al. Pharmaceutical salts of haloperidol with some carboxylic acids and artificial sweeteners: hydrate formation, polymorphism, and physicochemical properties[J]. Cryst Growth Des, 2014, 14: 2542-2556. DOI:10.1021/cg500245e |
| [69] |
Swapna B, Maddileti D, Nangia A. Cocrystals of the tuberculosis drug isoniazid: polymorphism, isostructurality, and stability[J]. Cryst Growth Des, 2014, 14: 5991-6005. DOI:10.1021/cg501182t |
| [70] |
Iwata K, Karashima M, Ikeda Y. Isotope-edited infrared spectroscopy for efficient discrimination between pharmaceutical salts and cocrystals[J]. Mol Pharm, 2017, 14: 2350-2358. DOI:10.1021/acs.molpharmaceut.7b00226 |
| [71] |
Putra OD, Umeda D, Nugraha YP, et al. Solubility improvement of epalrestat by layered structure formation via cocrystallization[J]. CrystEngComm, 2017, 19: 2614-2622. DOI:10.1039/C7CE00284J |
| [72] |
Peng B, He HY, Li MQ, et al. Comparison of the crystal structures and physicochemical properties of novel resveratrol cocrystals[J]. Acta Crystallogr B, 2019, 75: 1186-1196. DOI:10.1107/S2052520619013477 |
| [73] |
Saha S, Desiraju GR. Acid···amide supramolecular synthon in cocrystals: from spectroscopic detection to property engineering[J]. J Am Chem Soc, 2018, 140: 6361-6373. DOI:10.1021/jacs.8b02435 |
| [74] |
Chadha R, Singh P, Khullar S, et al. Ciprofloxacin hippurate salt: crystallization tactics, structural aspects, and biopharmaceutical performance[J]. Cryst Growth Des, 2016, 16: 4960-4967. DOI:10.1021/acs.cgd.6b00533 |
| [75] |
Peng B, Zhang ZY, Wang JR, et al. Confocal Raman micro-spectral evidence and physicochemical evaluation of triamterene salts[J]. Analyst, 2019, 144: 530-535. DOI:10.1039/C8AN01579A |
| [76] |
Hiendrawan S, Widjojokusumo E, Veriansyah B, et al. Pharmaceutical salts of carvedilol: polymorphism and physicochemical properties[J]. AAPS PharmSciTech, 2017, 18: 1417-1425. DOI:10.1208/s12249-016-0616-x |
| [77] |
Elbagerma MA, Edwards HGM, Munshi T, et al. Characterization of new cocrystals by Raman spectroscopy, powder x-ray diffraction, differential scanning calorimetry, and transmission Raman spectroscopy[J]. Cryst Growth Des, 2010, 10: 2360-2371. DOI:10.1021/cg100156a |
| [78] |
Peng B, Wang JR, Mei XF. Triamterene-furosemide salt: structural aspects and physicochemical evaluation[J]. Acta Crystallogr B, 2018, 74: 738-741. DOI:10.1107/S2052520618013185 |
| [79] |
Garbacz P, Wesolowski M. Benzodiazepines co-crystals screening using FTIR and Raman spectroscopy supported by differential scanning calorimetry[J]. Spectrochim Acta A, 2020, 234: 118242. DOI:10.1016/j.saa.2020.118242 |
| [80] |
Garbacz P, Paukszta D, Sikorski A, et al. Structural characterization of co-crystals of chlordiazepoxide with p-aminobenzoic acid and lorazepam with nicotinamide by DSC, X-ray diffraction, FTIR and Raman spectroscopy[J]. Pharmaceutics, 2020, 12: 648. DOI:10.3390/pharmaceutics12070648 |
| [81] |
Fernandes RP, do Nascimento ALCS, Carvalho ACS, et al. Mechanochemical synthesis, characterization, and thermal behavior of meloxicam cocrystals with salicylic acid, fumaric acid, and malic acid[J]. J Therm Anal Calorim, 2019, 138: 765-777. DOI:10.1007/s10973-019-08118-7 |
| [82] |
Bhandaru JS, Malothu N, Akkinepally RR. Characterization and solubility studies of pharmaceutical cocrystals of eprosartan mesylate[J]. Cryst Growth Des, 2015, 15: 1173-1179. DOI:10.1021/cg501532k |
| [83] |
Maheux CR, Copeland CR. Chemical analysis of two new designer drugs: buphedrone and pentedrone[J]. Drug Test Anal, 2012, 4: 17-23. |
 2021, Vol. 56
2021, Vol. 56


