恶性黑色素瘤是由黑色素细胞或由黑色素细胞发展而来的一种肿瘤[1], 其发病率约占所有恶性肿瘤病例的3%[2], 黑色素瘤中最常见的突变癌基因是BRAF和NRAS, 分别约占60%和20%[3]。根据黑色素瘤的发病特征, 可将其分为4个进展阶段: 早期黑色素瘤(0和Ⅰ期)具有局限性和无创性的特征; Ⅱ期肿瘤体积较大常出现溃疡, 转移风险高; 晚期黑色素瘤(Ⅲ和Ⅳ期)癌细胞已经转移到身体各个组织, 危及生命。目前黑色素瘤的治疗方法主要包括手术切除、化疗、靶向治疗和免疫治疗。大多数转移性黑色素瘤患者对初始治疗反应良好, 但术后易残留转移病灶, 后期易复发且对化疗产生耐药, 是治疗面临的一大挑战[4-6]。此外, 目前临床上常用的抗黑色素瘤药物大多具有严重的不良反应。因此, 开发全新的抗黑色素瘤药物是现阶段医药研究领域亟待解决的问题。近年来研究发现, 天然化合物对肿瘤细胞有良好的杀伤作用, 同时对正常细胞影响较小, 不良反应较少, 在肿瘤治疗上的应用愈发受到重视。目前已开发或具有开发潜力的天然产物种类繁多, 如黄酮类化合物、多酚类化合物、萜类化合物、生物碱类等[7]。天然产物可以在黑色素瘤细胞系和小鼠模型中发挥抗增殖、促凋亡、抗侵袭和抗血管生成的作用, 而且对正常细胞没有明显的毒性[8]。基于上述优点, 本文就近年来各种天然产物在黑色素瘤防治中的作用及应用进行综述, 为其深入研究和开发提供参考。
1 黄酮类化合物黄酮类化合物广泛分布于植物界, 迄今为止共鉴定出5 000多种黄酮类化合物[7], 广义黄酮类化合物共分为六大类, 包括黄酮类、黃烷酮类、黄酮醇类、黄烷醇类、异黄酮类和花青素类[9]。黄酮类化合物是植物的次生代谢产物, 具有多酚结构, 通常由15碳骨架(包括两个苯环)和含一个氧原子的杂环核组成[10], 具有显著的抗氧化和螯合作用, 在预防和治疗癌症疾病方面具有显著的作用[11]。众多研究结果表明多种黄酮类化合物, 例如卡麦角素、槲皮素、芹菜素、木犀草素、丁香苷、柚皮苷、染料木素和大豆苷元, 对黑色素瘤细胞均具有抗增殖和促凋亡作用[12]。
1.1 黄酮类流行病学研究表明, 黄酮类化合物的饮食摄入与癌症风险呈负相关[13]。已有证据指出, 黄酮类化合物具有抗炎、抗氧化和抗癌的特性[13], 其中芹菜素和木犀草素等都已被证明对黑色素瘤具有防治作用[14]。
芹菜素(apigenin, 1)是一种天然的黄酮类化合物, 存在于许多水果和蔬菜中。现有文献报道芹菜素在体外抑制B16BL6黑色素瘤细胞的生长, 其IC50是1.5 μmol·L-1。还可以导致细胞周期停滞, 对黑色素瘤细胞具有强烈的抗增殖和促凋亡作用[15, 16]。在临床前研究中, 芹菜素口服灌胃150 mg·kg-1, 持续12天可抑制黑色素瘤B16细胞系小鼠模型的黑色素瘤生长和转移[11]。芹菜素除了具有对黑色素瘤细胞的生长抑制和促凋亡作用外, 还可以通过限制黑色素瘤异种移植小鼠模型中树突状细胞中细胞程序性死亡配体1 (programmed cell death 1 ligand 1, PD-L1)的表达, 刺激机体对黑色素瘤细胞的免疫反应[17]。IFN-γ是一种Ⅱ型干扰素, 在先天免疫和适应性免疫中起着关键作用, 它可以潜在地诱导肿瘤细胞中PD-L1的表达, 从而有助于肿瘤免疫逃避[18]。芹菜素通过强烈抑制IFN-γ诱导的信号转导与转录激活因子1 (signal transducer and activator of transcription 1, STAT1)激活, 降低黑色素瘤细胞PD-L1表达水平, 从而使其对T细胞介导的杀伤更敏感; 另一方面, 芹菜素也可以下调树突状细胞中PD-L1的表达, 增强宿主T细胞免疫应答。芹菜素通过抑制PD-L1表达发挥出抑制黑色素瘤生长的双重作用[17]。此外, 芹菜素(150 mg·kg-1·d-1, 24天, 口服灌胃)还可以通过下调信号传导与转录激活因子3 (signal transducer and activator of transcription 3, STAT3)信号通路抑制B16F10小鼠黑色素瘤模型的肺转移, 并呈剂量依赖性(5和10 μmol·L-1)抑制B16F10和(10和20 μmol·L-1) A375细胞的侵袭和迁移[19]。以上均证明芹菜素在抗黑色素瘤作用方面具有巨大的潜在临床意义。
木犀草素(luteolin, 2)是一种天然黄酮, 存在于水果、蔬菜和草药中[20]。越来越多的证据表明木犀草素具有多种药理活性, 如抗炎、抗高血压、抗氧化和抗肿瘤等作用[21]。以往研究表明, 木犀草素通过多种机制抑制癌细胞生长, 包括促进癌细胞凋亡和细胞周期阻滞, 以及减轻癌细胞的侵袭和转移[22]。在B16F10黑色素瘤细胞系注射的小鼠模型中, 木犀草素以20 mg·kg-1腹腔注射23天治疗, 发现模型小鼠肺部转移性定植明显减少了50%。其机制与β3整合素和上皮间质转化(epithelial mesenchymal transition, EMT)有关[23]。已有研究采用MTT法检测了不同浓度的木犀草素对黑色素瘤细胞A375和B16F10细胞增殖的抑制作用, 结果表明在作用24、48、72 h后, A375细胞IC50值分别为140.73、64.94和44.45 μmol·L-1, 而B16F10细胞为143.89、67.34和55.09 μmol·L-1, 并呈浓度和时间相关性[24]。木犀草素通过抑制低氧诱导因子1α(hypoxia inducible factor-1α, HIF-1α)/血管内皮生长因子(vascular endothelial growth factor, VEGF)信号途径进而减弱黑色素瘤细胞的迁移、侵袭、黏附作用, 以及毛细血管形成能力[24]。木犀草素对高转移性黑色素瘤细胞具有很强的治疗潜力, 可以作为治疗黑色素瘤的候选药物之一。
1.2 黄酮醇类槲皮素(quercetin, 3)是一种广泛分布于植物界的生物活性物质, 具有相对较高的口服生物利用度和较低的内在毒性, 在体内不具有致癌活性[25, 26]。Caltagirone等[27]的研究表明槲皮素在体内和体外抑制B16BL6黑色素瘤细胞的迁移和侵袭, 其中体外抑制黑色素瘤细胞活力IC50是3.5 μmol·L-1。另外, 槲皮素还通过抑制肝细胞生长因子(hepatocyte growth factor, HGF)/间质表皮转化因子(c-mesenchymalepithelial transition factor, c-MET)信号传导, 阻碍c-MET磷酸化, 干扰c-MET二聚反应, 降低c-MET蛋白表达, 减弱Gab1 (Gab蛋白是一类重要的接头蛋白)、黏着斑激酶(focal adhesion kinase, FAK)和p21活化激酶(P21-activated kinase, PAK)等下游分子的活性, 从而发挥抗黑色素瘤转移作用[28]。此外, 槲皮素(50 μmol·L-1)和萝卜硫素(20 μmol·L-1)通过下调黑色素瘤中基质金属蛋白酶9 (matrix metallopeptidase 9, MMP9)的表达, 发挥化学预防作用。联合注射槲皮素(15 mg·kg-1)和萝卜硫素(3.5 mg·kg-1)到黑色素瘤的周围部位, 可增强抑制C57BL6小鼠的黑色素瘤生长的作用[29]。以上表明槲皮素在黑色素瘤治疗中具有潜在有效的作用。
山柰酚(kaempferol, 4)是一种黄酮醇类化合物, 广泛存在于一些可食用植物如胡椒属植物中[30]。山柰酚具有抗菌、抗炎、抗氧化、抗肿瘤、心脏保护、神经保护等多种药理作用, 目前已用于治疗皮肤癌、肝癌和结肠癌等多种癌症[31], 其作用机制包括促进细胞凋亡、细胞周期阻滞于G2/M期、下调EMT相关标志物和调节PI3K/Akt信号通路(phosphatidylinositol 3-kinase and protein kinase B, P磷脂酰肌醇3激酶和蛋白激酶B)[31]。Yang等[32]研究结果表明, 山柰酚在0、10、20、40和80 μmol·L-1浓度下作用48 h, 对A375黑色素瘤细胞具有抗增殖活性的作用, 且具有剂量依赖性, IC50为20 μmol·L-1。山柰酚通过诱导细胞凋亡、阻滞G2/M细胞周期、抑制细胞迁移和调节哺乳动物配帕霉素靶蛋白(mammalian target of rapamycin, mTOR)/PI3K/AKT信号通路多种途径发挥对恶性黑色素瘤A375细胞系的抗癌作用。因此, 山柰酚可能是治疗恶性黑色素瘤的关键药物。
1.3 黄烷酮类柚皮素(naringenin, 5)是从一种柑橘中分离的天然优质的黄烷酮, 在肝纤维化和肺纤维化中是Smad3 (SMAD family member 3)的有效抑制剂[33, 34]。亚细亚酸是一种三萜类化合物, 以剂量依赖的方式诱导Smad7 (SMAD family member 7), 进一步减轻转化生长因子β1 (transforming growth factorβ1, TGF-β1)诱导的肝纤维化[33, 35]。连广宇团队报道亚细亚酸(10 mg·kg-1·d-1)和柚皮素(50 mg·kg-1·d-1)的联合治疗对B16F10黑色素瘤生长有更好的抑制作用。柚皮素和亚细亚酸联合应用可以增加CD4+和CD8+T细胞, 同时抑制CD4+Foxp3+调节性T细胞(CD4+Foxp3+Treg), 增强T细胞对肿瘤的免疫反应, 这可能是柚皮素和亚细亚酸联合治疗黑色素瘤和抑制肺癌小鼠模型肿瘤生长的一种机制[36]。可见柚皮素是治疗黑色素瘤的有效候选药物。
柑橘类植物提取物广泛用于化妆品领域, 主要作为局部皮肤美白剂, 抑制黑色素生成[37]。其中橙皮苷(hesperidin, 6)是最著名的天然黄烷酮类化合物之一, 具有抗氧化和抗炎作用。已有文献报道, 橙皮苷通过阻断Rab27A (RAS癌基因家族成员)黑色素亲和力抑制黑色素小体转运[38]。除此之外, 橙皮苷也是一种抗氧化剂, Lee等[39]报道橙皮苷可以通过刺激细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK1/2)磷酸化, 降解黑色素生成相关的转录因子(melanogenesis associated transcription factor, MITF), 从而抑制人源和鼠源黑色素细胞黑色素生成酶和黑色素的合成。近期已有实验数据证明经150 kGy γ射线结构修饰的橙皮苷可诱导黑色素瘤B16BL6细胞凋亡, 并抑制C57BL/6小鼠的皮下肿瘤生长和转移[40]。简言之, 橙皮苷是一种很有前途、安全、健康的皮肤美白剂, 同时具有抗氧化、增强皮肤屏障和抑制黑色素生成的作用。
1.4 黄烷醇类许多研究表明, 茶类特别是绿茶, 对治疗人类疾病有益处, 包括帕金森病、阿尔茨海默病、脑卒中和肥胖[41-43]。儿茶精(caredhieacid)系从茶叶等天然植物中提取出来的一类黄烷醇类化学活性物质包括儿茶素(catechin, 7)、表儿茶素(epicatechin, EC)、表没食子儿茶素(epigallocatechin, EGC)、表儿茶素没食子酸酯(epicatechin-3-gallate, ECG)和儿茶素-3-没食子酸酯(epigallocatechin gallate, EGCG, 8)[44]。EGCG是绿茶中含量最丰富的一种儿茶素, 约占绿茶儿茶素总量的50%~80%。Taniguchi等[45]研究报道, 0.05%和0.1%EGCG溶液静脉注射可抑制B16F10黑色素瘤变体的肺转移。此外, 已有实验证明50、100和200 μmol·L-1EGCG处理可剂量依赖性地将B16F10细胞的迁移率分别降低至57.1%、30.3%和12.6%[40]。近年研究发现, EGCG作为一种新的E3泛素连接酶抑制剂, 可以靶向肿瘤坏死因子受体相关因子6 (tumor necrosis factor receptor associated factor 6, TRAF6), 其抗肿瘤特性已经在体外细胞实验、体内动物模型和临床研究中得到了广泛的验证, 已逐渐成为防治黑色素瘤的新药理学化合物[46]。此外, Lozano等[47]的研究结果显示新型黄烷-3-醇衍生物显著降低了黑色素瘤细胞株A375和M21的存活率, 含没食子酸盐的化合物可以将两种肿瘤细胞系阻滞在S期, 并诱导凋亡。这些研究表明绿茶含有的黄烷醇可用于预防黑色素瘤的发生和早期化疗治疗。
1.5 异黄酮类异黄酮类化合物是广泛存在于大豆、大豆食品、豆类和真菌中的一种酚类化合物, 属于黄酮类化合物的一个亚类, 目前已鉴定出6 000多个家族成员, 具有抗氧化、抗菌和抗炎活性[48]。异黄酮类化合物也被认为是乳腺癌、肺癌、黑色素瘤等癌症的有效化学预防剂[14]。并且可促进B16黑色素瘤细胞的体外分化, 抑制其体内外生长[49]。异黄酮类化合物中最重要的成员之一是染料木素, 在大豆中含量很高[50]。染料木素(genistein, 9)是一种体内活性剂, 通过细胞毒性实验发现染料木素作用于F3II和B16F10细胞96 h, IC50值分别为26.3和6.6 μmol·L-1。在体内, 静脉注射10 mg·kg-1·d-1的染料木素可抑制移植B16或F3II细胞的C57BL/6小鼠模型中黑色素瘤的肺转移和减弱肿瘤诱导的血管生成[51]。腹腔注射200 mg·kg-1·d-1的染料木素, 持续15天, 可明显减少B16BL6细胞尾静脉注入C57BL/6小鼠模型的肺转移灶[52]。葛根是豆科攀缘植物, 含有多种酚类化合物和异黄酮, 包括大豆苷、大豆苷元、染料木苷和葛根素, 常用于减轻肝脏损伤和骨质流失。近年来, 在体内外均发现了葛根素(puerarin, 10)具有抗黑色素生成作用[53]。Han等[54]的研究通过测定黑色素含量和B16F10黑色素瘤细胞系染色, 证明了葛根地上部分的提取物异黄酮物质在体内具有抗色素沉着作用。其抗黑色素生成活性的作用机制, 一方面是通过激活蛋白激酶B (kinase and protein kinase B, Akt)/糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)降低MITF的表达, 从而降低酪氨酸酶和酪氨酸酶相关蛋白1的转录; 另一方面是通过抑制α-葡萄糖苷酶来阻断酪氨酸酶的成熟。Danciu等[55]证明植物雌激素对肿瘤大小、转移潜能和黑色素化具有有益的影响。而异黄酮可通过与雌激素受体结合而具有微弱的雌激素(激动剂)活性[48]。异黄酮在防治黑色素瘤方面具有重要意义, 具有单独以及联合其他药物治疗黑色素瘤的潜力。
1.6 花青素花青素是自然界一类广泛存在于植物中的水溶性天然色素, 是一类特殊的黄酮类化合物[56]。黄慧培等[57]发现桑椹花青素对B16F1细胞的生长表现出剂量和时间依赖性抑制作用。将B16F1与1~5 mg·mL-1桑椹花青素孵育B16F1细胞24和72 h, IC50分别为3.1和2.5 mg·mL-1。此外, 采用黑色素瘤B16F1细胞静脉注射的C57BL/6小鼠模型检测桑椹花青素的抗癌效果, 结果表明浓度3%的桑椹花青素通过抑制Ras/PI3K信号通路, 降低MMP2和MMP9活性, 从而显著抑制B16F1细胞转移。最近的一项研究表明, 蓝莓和黑醋栗汁中的花青素对B16F10小鼠黑色素瘤细胞系具有抗增殖活性作用[58]。现有的研究已经显示出花青素抗黑色素瘤的能力, 但更明确的治疗效果以及作用机制有待进一步证明阐释。
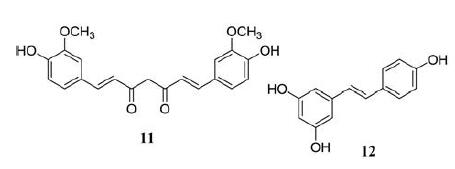
2 多酚类化合物 2.1 姜黄素姜黄素(curcumin, 11)是从姜黄根茎中提取的色素产物, 传统上用于治疗炎症性疾病。目前已有研究通过MTT分析显示姜黄素能有效抑制A375和C8161黑色素瘤细胞的增殖且具有时间和剂量依赖性。24 h时的IC50分别为25和15 μmol·L-1[59], 48 h对A375细胞IC50是80 μmol·L-1[60]。另外, 赵广明团队研究发现姜黄素在体内外均能有效抑制黑色素瘤细胞的增殖、侵袭, 将癌细胞阻滞在细胞周期的G2/M期, 诱导自噬[59]。除此之外, 姜黄素对黑色素瘤细胞的抗侵袭性可以通过下调MMPs的表达和核转录因子(nuclear transcription factor-κB, NF-κB)介导的MMP2的活化, 并抑制MMPs在骨桥蛋白诱导的细胞迁移中的表达[61]。姜黄素对B16F10黑色素瘤细胞诱导C57BL/6小鼠肺转移也具有抑制作用[62]。因此, 姜黄素可能成为治疗黑色素瘤的一种新的候选治疗方法。此外, 利用胶束和纳米粒子等新型给药系统可以提高姜黄素的生物利用度, 从而增强姜黄素的抗黑色素瘤作用[63]。

|
白藜芦醇(resveratrol, 12)是一种天然的非黄酮类多酚, 是一种具有抗氧化、抗炎、心脏保护和抗癌特性的植物雌激素[64]。白藜芦醇通过浓度依赖性方式上调p53、负调节/ERK/丙酮酸激酶M2 (pyru‐vate kinase M2, PKM2)/Bcl-2轴显著抑制黑色素瘤细胞增殖并诱导人黑色素瘤细胞凋亡[65]。吴芳芳等[66]通过将A375细胞注射到裸鼠后侧面造模, 并通过腹膜注射30 mg·kg-1·d-1白藜芦醇, 持续一周, 发现白藜芦醇在体内可通过抑制NF-κB/miR-221 (microRNA 221)并诱导TFG表达来抑制黑色素瘤。近期彰化宫团队检测白藜芦醇在黑色素瘤中的作用, 将A537细胞用0~100 μmol·L-1白藜芦醇处理24 h, 结果显示白藜芦醇以剂量依赖性的方式抑制细胞活力, 100 μmol·L-1是最有效的浓度。白藜芦醇通过抑制PI3K/Akt/mTOR信号通路促进自噬, 从而抑制黑色素瘤的生长[67]。值得注意的是, 白藜芦醇在体外抑制了B16黑色素瘤(B16M)细胞增殖, 具有浓度依赖性, 5 μmol·L-1对肿瘤生长的抑制率为100%。在注射B16M细胞的小鼠中, 口服灌胃白藜芦醇20 mg·kg-1, 每天两次, 通过降低肿瘤激活的肝窦内皮细胞中血管细胞黏附蛋白1 (vascular cell adhesion molecule-1, VCAM-1)的IL-18依赖性表达, 从而减弱了黑色素瘤细胞与微血管的黏附, 成功地预防了黑色素瘤的肝转移[68, 69]。白藜芦醇还可以增加黑色素瘤细胞对药物的敏感性, 增强药物的抗肿瘤活性以发挥协同促凋亡作用[70]。例如, 白藜芦醇增强了黑色素瘤细胞对替莫唑胺治疗的敏感性[71]; 辣椒素和白藜芦醇通过升高NO协同触发A375细胞凋亡[72]; 在B16F10黑色素瘤小鼠模型中, 白藜芦醇可以与大剂量IL-2免疫疗法协同提高治疗效果, 同时预防内皮细胞损伤, 抑制血管渗漏综合征的发展[73]。为了改善白藜芦醇的药物动力学特性, 提高治疗黑色素瘤的药效, 目前已经研发出多种白藜芦醇类似物, 其中药效最显著的合成类似物是六羟基二苯乙烯(M8), M8单独使用或与达卡巴嗪联合使用均能抑制肿瘤和人类黑色素瘤的转移生长, 可以观察到显著的体内效应[74]。
|
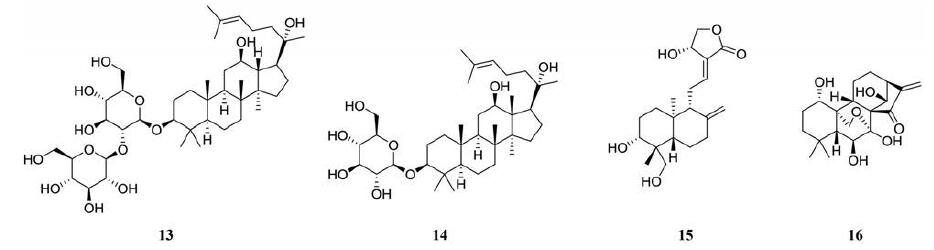
人参皂苷是人参中提取的一类三萜皂苷类化合物[75], 其中最有效的提取物是人参皂苷Rg3 (ginsenoside Rg3, 13), 具有促进免疫应答和抗肿瘤活性[76]。人参皂苷Rg3以剂量依赖的方式显著抑制B16黑色素瘤细胞的生长, IC50为7.76±0.46μg·mL-1。且在黑色素瘤中已经被证实具有抑制癌症细胞增殖的作用, 其机制是, 人参皂苷Rg3通过抑制核因子NF-κB、活化蛋白1、VEGF和PI3K/Akt信号转导, 诱导肿瘤细胞凋亡, 从而抑制肿瘤细胞的增殖和转移[77]。已有研究表明人参皂苷Rg3通过阻碍DNA合成和抑制MMP2、MMP9、VEGF的表达, 有效地抑制黑色素瘤细胞的生长、转移及其诱导的血管生成, 揭示了人参皂苷Rg3可能是一种很有前途的治疗黑色素瘤的新药物[77]。
人参皂苷Rh2 (ginsenoside Rh2, 14)是人参根中重要的生物活性成分, 具有多种生物活性, 如抗糖尿病、抗癌和免疫刺激等[77]。最近有研究表明人参皂苷Rh2通过诱导凋亡抑制人类恶性黑色素瘤细胞的生长[78]。人参皂苷Rh2以浓度和时间依赖性方式抑制A375-S2细胞的生长, 6 h、40 μmol·L-1抑制率达到100%[79]。还有研究发现PIM1抑制剂SMI-4a能通过抑制黑色素瘤细胞中Akt/mTOR信号轴, 触发自噬, 降低细胞活性, 进而促进细胞发生凋亡, 而人参皂苷Rh2可通过增强自噬诱导的体内外细胞凋亡, 协助SMI-4a增强其抗黑色素瘤活性[80]。
3.2 穿心莲内酯穿心莲内酯(andrographolide, 15)是从穿心莲中分离得到的一种天然化合物, 是中药穿心莲的有效成分[81], 主要用于镇痛、抗炎、免疫调节、抗心血管疾病、抗肿瘤等。以往研究表明, 穿心莲内酯在胃癌、软骨肉瘤和结直肠癌等多种恶性肿瘤中具有潜在的抗肿瘤活性[82]。近期有研究通过MTT测定法测定穿心莲内酯在黑色素瘤细胞中的抗增殖活性, 结果表明在恶性黑色素瘤细胞中穿心莲内酯以剂量和时间依赖性的方式表现出有效的抗增殖作用。A375的穿心莲内酯的IC50值为23.08 μmol·L-1(24 h)、12.07 μmol·L-1(48 h), 而C8161的IC50值为20.31 μmol·L-1(24 h)、10.92 μmol·L-1(48 h)。穿心莲内酯通过诱导人恶性黑色素瘤细胞株C8161和A375的细胞周期G2/M期阻滞, 对黑色素瘤细胞增殖有明显的抑制作用[83]。
3.3 冬凌草甲素冬凌草甲素(oridonin, 16)是从冬凌草中分离得到的一种二萜类化合物, 已被证明冬凌草甲素以浓度依赖的方式明显抑制K1735M2黑色素瘤细胞的生长。作用6天后的IC50值7.4±0.6 μmol·L-1, 其抑制作用与G2/M期阻滞和分化诱导有关[84]。已有研究表明, 冬凌草甲素通过激活p53和ERK途径, 增加Bax/Bcl-xL蛋白表达的比例, 从而促进细胞色素c释放到细胞质中进而诱导A375-S2细胞凋亡[85]。近年李春雨团队发现冬凌草甲素通过PI3K/Akt/GSK-3β信号通路抑制了A375和B16F10黑色素瘤细胞的迁移、侵袭和黏附以及TGF-β1诱导的EMT。这些发现表明, 冬凌草甲素有望成为黑色素瘤的抗转移剂[86]。
|
生物碱是存在于自然界的一类含氮杂环化合物, 具有显著的生物活性, 部分具有较强毒性。临床上常用于治疗黑色素瘤的生物碱, 例如长春新碱(长春碱、长春新碱、长春花碱)和紫杉醇(紫杉醇、多西紫杉醇)等, 都具有总反应率低、毒性高的缺点, 并且黑色素瘤细胞易对这些药物产生抗药性[87]。上述局限性限制了生物碱类药物的应用, 因此近年来开发出活性更强、不良反应较小的抗黑色素瘤生物碱类药物已成为重要研究方向。
4.1 黄连素黄连素(berberine, 17)是从许多药用植物的根茎、根和茎皮中提取的一种异喹啉生物碱, 它在印度和中国被广泛应用于传统医疗, 具有抗菌、抗炎、抗氧化、抗感染、抗高血压和抗癌等生物活性, 且对正常细胞无明显细胞毒性[88]。黄连素通过诱导细胞周期阻滞和促进凋亡细胞死亡来减少癌细胞系的细胞数量[89]。肿瘤的进展与环氧酶-2 (cyclooxygenase-2, COX-2)和前列腺素E2(prostaglandin E2, PGE2)的过度表达有关[90]。除此之外, 已有实验证明连续10天以10 mg·kg-1的剂量腹腔给予黄连素治疗静脉注射了B16F10黑色素瘤细胞的模型鼠。发现黄连素可通过降低ERK信号通路活性和COX-2蛋白水平来阻滞B16F10小鼠黑色素瘤细胞和A375人黑色素瘤细胞的迁移和侵袭[91]。更有研究报道黄连素可以通过体内外抗血管生成, 阻碍黑色素瘤C57BL/6小鼠模型的肺转移, 进一步降低黑色素瘤细胞的致瘤性[91, 92]。这种来自于天然中草药的黄连素, 是潜在的黑色素瘤的化疗药物。
4.2 血根碱血根碱(sanguinarine, 18)是一种天然的异喹啉生物碱, 存在于番木瓜科植物, 如血根属。血根碱具有广泛的药理作用, 包括抗肿瘤、抗菌、抗炎等作用[93]。据报道血根碱可诱导不同癌细胞的细胞周期阻滞和凋亡。De Stefano等[94]的研究显示, 血根碱在B16黑色素瘤4A5细胞株中处理72 h后, IC50值为1.96±0.22 μmol·L-1。在小鼠黑色素瘤K1735M2细胞系中, 血根碱作为一种DNA破坏因子, 部分影响线粒体介导的过程[95]。血根碱可以诱导人黑色素瘤细胞发生caspase依赖性死亡, 该过程依赖于氧化应激, 并且不能通过Bcl-xL的过度表达来预防[96]。此外, De Stefano等[94]的研究显示, 口服5 mg·kg-1血根碱抑制了C57BL/6黑色素瘤模型小鼠和免疫缺陷小鼠的人类肿瘤异种移植的肿瘤生长。这些研究结果突出了异喹啉生物碱的抗黑色素瘤活性, 并提示其在皮肤癌治疗中的潜力。
4.3 苦参碱苦参碱(matrine, 19)提取自中药苦参[97], 在我国广泛应用于治疗病毒、肝炎、肝纤维化、心律失常和皮肤病[98-101]。近年来, 越来越多的研究表明苦参碱通过抑制白血病、肝癌、乳腺癌和肺癌等多种肿瘤细胞的增殖, 诱导细胞周期阻滞和凋亡, 发挥抗肿瘤作用[102]。目前已有研究证明苦参碱具有抗黑色素瘤的潜力, 苦参碱对黑色素瘤细胞M21表现出剂量依赖性的细胞增殖抑制作用。利用MTT实验测试出24 h时的IC50是0.769±0.28 mg·mL-1。通过激活PTEN抑制PI3K/Akt通路有效抑制M21黑色素瘤细胞的增殖。苦参碱诱导M21细胞G0/G1期细胞周期阻滞和凋亡且具有剂量依赖性。可见苦参碱是一种很有应用前景的候选抗肿瘤药物, 其PTEN活化机制可能用于治疗黑色素瘤[103]。

|
黑色素瘤以其独特的早期转移能力, 成为影响人类致命的皮肤癌。尽管针对常见突变如BRAF和MEK的个体化化疗最近已经开发出来, 但这些药物仅能延长无进展生存期几个月, 尝试这些治疗的患者往往会产生抵抗力。最近关于联合化疗防治黑色素瘤的研究给研究者带来了可能实现治愈的希望。近年来越来越多的证据揭示这些生物活性分子通过促进黑色素瘤细胞凋亡、抑制增殖等各种途径抑制黑色素瘤的发生发展。天然产物的抗癌特性可作为化学疗法的互补疗法, 提高现有的疗效。目前, 黑色素瘤对既定治疗方案的耐药性以及对正常细胞的毒性作用仍是临床治疗的主要关注问题, 而天然产物如黄酮类、花青素、白藜芦醇、染料木素、新型生物碱等可作为一种必要的辅助化疗药物, 协助治疗转移性黑色素瘤, 且毒性较小安全性较高。本综述概述了天然产物在黑色素瘤的防治中的重要作用及作用机制。由于目前很多天然产物缺乏深入的研究, 距离应用到临床以及联合治疗方案还需要更多的探索。中药作为中华之瑰宝, 通过数千年临床的验证, 可有效帮助人民免受疾病之苦。现在, 经过不断科学研究也发现来源于传统中药的有效成分具有较强的抗癌潜力, 在未来, 期待天然产物也能在治疗黑色素瘤的过程中发挥重要作用。
作者贡献:通讯作者强磊负责总体监督和指导; 高悦负责整理撰写; 王晓萍指导及修改文章思路; 李敏, 窦仁捷负责修改。
利益冲突:本文作者无利益冲突。
| [1] |
Kozovska Z, Gabrisova V, Kucerova L. Malignant melanoma: diagnosis, treatment and cancer stem cells[J]. Neoplasma, 2016, 63: 510-517. DOI:10.4149/neo_2016_403 |
| [2] |
Morton DL, Essner R, Kirkwood JM, et al. Malignant Melanoma in Cancer Medicine[M]. 6th Ed. Ontario: Decker Inc, 2006: 2400.
|
| [3] |
AlQathama A, Prieto JM. Natural products with therapeutic potential in melanoma metastasis[J]. Nat Prod Rep, 2015, 32: 1170-1182. DOI:10.1039/C4NP00130C |
| [4] |
Fontana F, Raimondi M, Di Domizio A, et al. Unraveling the molecular mechanisms and the potential chemopreventive/therapeutic properties of natural compounds in melanoma[J]. Semin Cancer Biol, 2019, 59: 266-282. DOI:10.1016/j.semcancer.2019.06.011 |
| [5] |
Leonardi GC, Falzone L, Salemi R, et al. Cutaneous melanoma: from pathogenesis to therapy (Review)[J]. Int J Oncol, 2018, 52: 1071-1080. |
| [6] |
Domingues B, Lopes J, Soares P, et al. Melanoma treatment in review[J]. Immunotargets Ther, 2018, 7: 35-49. DOI:10.2147/ITT.S134842 |
| [7] |
Albuquerque KRS, Pacheco NM, Del Rosario Loyo Casao T, et al. Applicability of plant extracts in preclinical studies of melanoma: a systematic review[J]. Mediators Inflamm, 2018, 2018: 6797924. |
| [8] |
Pal HC, Hunt KM, Diamond A, et al. Phytochemicals for the management of melanoma[J]. Mini Rev Med Chem, 2016, 16: 953-979. DOI:10.2174/1389557516666160211120157 |
| [9] |
Ververidis F, Trantas E, Douglas C, et al. Biotechnology of flavonoids and other phenylpropanoid-derived natural products. Part I: Chemical diversity, impacts on plant biology and human health[J]. Biotechnol J, 2007, 2: 1214-1234. DOI:10.1002/biot.200700084 |
| [10] |
Middleton E. Effect of plant flavonoids on immune and inflammatory cell function[J]. Adv Exp Med Biol, 1998, 439: 175-182. |
| [11] |
Romagnolo DF, Selmin OI. Flavonoids and cancer prevention: a review of the evidence[J]. J Nutr Gerontol Geriatr, 2012, 31: 206-238. DOI:10.1080/21551197.2012.702534 |
| [12] |
Kumar S, Pandey AK. Chemistry and biological activities of flavonoids: an overview[J]. Sci World J, 2013, 2013: 162750. |
| [13] |
Liu-Smith F, Meyskens FL. Molecular mechanisms of flavonoids in melanin synthesis and the potential for the prevention and treatment of melanoma[J]. Mol Nutr Food Res, 2016, 60: 1264-1274. DOI:10.1002/mnfr.201500822 |
| [14] |
Danciu C, Soica C, Antal D, et al. Natural compounds in the chemoprevention of malignant melanoma[J]. Anticancer Agents Med Chem, 2018, 18: 631-644. DOI:10.2174/1871520617666171121142522 |
| [15] |
Salehi B, Venditti A, Sharifi-Rad M, et al. The therapeutic potential of apigenin[J]. Int J Mol Sci, 2019, 20: 1305. DOI:10.3390/ijms20061305 |
| [16] |
Kashyap D, Sharma A, Tuli HS, et al. Apigenin: anatural bioactive flavone-type molecule with promising therapeutic function[J]. J Funct Foods, 2018, 48: 457-471. DOI:10.1016/j.jff.2018.07.037 |
| [17] |
Xu L, Zhang Y, Tian K, et al. Apigenin suppresses PD-L1 expression in melanoma and host dendritic cells to elicit synergistic therapeutic effects[J]. J Exp Clin Cancer Res, 2018, 37: 261. DOI:10.1186/s13046-018-0929-6 |
| [18] |
Schoenborn JR, Wilson CB. Regulation of interferon-gamma during innate and adaptive immune responses[J]. Adv Immunol, 2007, 96: 41-101. |
| [19] |
Cao HH, Chu JH, Kwan HY, et al. Inhibition of the STAT3 signaling pathway contributes to apigenin-mediated anti-metastatic effect in melanoma[J]. Sci Rep, 2016, 6: 21731. DOI:10.1038/srep21731 |
| [20] |
Liu T, Xu J, Yan HL, et al. Luteolin suppresses teratoma cell growth and induces cell apoptosis via inhibiting Bcl-2[J]. Oncol Res, 2019, 27: 773-778. DOI:10.3727/096504018X15208986577685 |
| [21] |
Aziz N, Kim MY, Cho JY. Anti-inflammatory effects of luteolin: a review of in vitro, in vivo, and in silico studies[J]. J Ethnopharmacol, 2018, 225: 342-358. DOI:10.1016/j.jep.2018.05.019 |
| [22] |
Cook MT, Liang Y, Besch-Williford C, et al. Luteolin inhibits lung metastasis, cell migration, and viability of triple-negative breast cancer cells[J]. Breast Cancer (Dove Med Press), 2017, 9: 9-19. |
| [23] |
Ruan JS, Liu YP, Zhang L, et al. Luteolin reduces the invasive potential of malignant melanoma cells by targeting β3 integrin and the epithelial-mesenchymal transition[J]. Acta Pharmacol Sin, 2012, 33: 1325-1331. DOI:10.1038/aps.2012.93 |
| [24] |
Li C, Wang Q, Shen S, et al. HIF-1α/VEGF signaling-mediated epithelial-mesenchymal transition and angiogenesis is critically involved in anti-metastasis effect of luteolin in melanoma cells[J]. Phytother Res, 2019, 33: 798-807. DOI:10.1002/ptr.6273 |
| [25] |
Okamoto T. Safety of quercetin for clinical application (Review)[J]. Int J Mol Med, 2005, 16: 275-278. |
| [26] |
Gugler R, Leschik M, Dengler HJ. Disposition of quercetin in man after single oral and intravenous doses[J]. Eur J Clin Pharmacol, 1975, 9: 229-234. DOI:10.1007/BF00614022 |
| [27] |
Caltagirone S, Rossi C, Poggi A, et al. Flavonoids apigenin and quercetin inhibit melanoma growth and metastatic potential[J]. Int J Cancer, 2000, 87: 595-600. DOI:10.1002/1097-0215(20000815)87:4<595::AID-IJC21>3.0.CO;2-5 |
| [28] |
Cao HH, Cheng CY, Su T, et al. Quercetin inhibits HGF/c-Met signaling and HGF-stimulated melanoma cell migration and invasion[J]. Mol Cancer, 2015, 14: 103. DOI:10.1186/s12943-015-0367-4 |
| [29] |
Pradhan SJ, Mishra R, Sharma P, et al. Quercetin and sulforaphane in combination suppress the progression of melanoma through the down-regulation of matrix metalloproteinase-9[J]. Exp Ther Med, 2010, 1: 915-920. DOI:10.3892/etm.2010.144 |
| [30] |
Calderón-Montaño JM, Burgos-Morón E, Pérez-Guerrero C, et al. A review on the dietary flavonoid kaempferol[J]. Mini Rev Med Chem, 2011, 11: 298-344. DOI:10.2174/138955711795305335 |
| [31] |
Imran M, Salehi B, Sharifi-Rad J, et al. Kaempferol: a key emphasis to its anticancer potential[J]. Molecules, 2019, 24: 2277. DOI:10.3390/molecules24122277 |
| [32] |
Yang J, Xiao P, Sun JM, et al. Anticancer effects of kaempferol in A375 human malignant melanoma cells are mediated via induction of apoptosis, cell cycle arrest, inhibition of cell migration and downregulation of m-TOR/PI3K/AKT pathway[J]. J BUON, 2018, 23: 218-223. |
| [33] |
Liu X, Wang W, Hu H, et al. Smad3 specific inhibitor, naringenin, decreases the expression of extracellular matrix induced by TGF-beta1 in cultured rat hepatic stellate cells[J]. Pharm Res, 2006, 23: 82-89. DOI:10.1007/s11095-005-9043-5 |
| [34] |
Du G, Jin L, Han X, et al. Naringenin: a potential immunomodulator for inhibiting lung fibrosis and metastasis[J]. Cancer Res, 2009, 69: 3205-3212. DOI:10.1158/0008-5472.CAN-08-3393 |
| [35] |
Tang LX, He RH, Yang G, et al. Asiatic acid inhibits liver fibrosis by blocking TGF-beta/Smad signaling in vivo and in vitro[J]. PLoS One, 2012, 7: e31350. DOI:10.1371/journal.pone.0031350 |
| [36] |
Lian GY, Wang QM, Tang PMK, et al. Combination of asiatic acid and naringenin modulates NK cell anti-cancer immunity by rebalancing Smad3/Smad7 signaling[J]. Mol Ther, 2018, 26: 2255-2266. DOI:10.1016/j.ymthe.2018.06.016 |
| [37] |
Kim SS, Kim MJ, Choi YH, et al. Down-regulation of tyrosinase, TRP-1, TRP-2 and MITF expressions by citrus press-cakes in murine B16 F10 melanoma[J]. Asian Pac J Trop Biomed, 2013, 3: 617-622. DOI:10.1016/S2221-1691(13)60125-2 |
| [38] |
Kim B, Lee JY, Lee HY, et al. Hesperidin suppresses melanosome transport by blocking the interaction of Rab27A-melanophilin[J]. Biomol Ther (Seoul), 2013, 21: 343-348. DOI:10.4062/biomolther.2013.032 |
| [39] |
Lee HJ, Lee WJ, Chang SE, et al. Hesperidin, a popular antioxidant inhibits melanogenesis via Erk1/2 Mediated MITF degradation[J]. Int J Mol Sci, 2015, 16: 18384-18395. DOI:10.3390/ijms160818384 |
| [40] |
Byun EB, Kim HM, Song HY, et al. Hesperidin structurally modified by gamma irradiation induces apoptosis in murine melanoma B16BL6 cells and inhibits both subcutaneous tumor growth and metastasis in C57BL/6 mice[J]. Food Chem Toxicol, 2019, 127: 19-30. DOI:10.1016/j.fct.2019.02.042 |
| [41] |
Xicota L, Rodriguez-Morato J, Dierssen M, et al. Potential role of (-)-epigallocatechin-3-gallate (EGCG) in the secondary prevention of Alzheimer disease[J]. Curr Drug Targets, 2017, 18: 174-195. |
| [42] |
Walker JM, Klakotskaia D, Ajit D, et al. Beneficial effects of dietary EGCG and voluntary exercise on behavior in an Alzheimer's disease mouse model[J]. J Alzheimers Dis, 2015, 44: 561-572. DOI:10.3233/JAD-140981 |
| [43] |
Gillespie K, Kodani I, Dickinson DP, et al. Effects of oral consumption of the green tea polyphenol EGCG in a murine model for human Sjogren's syndrome, an autoimmune disease[J]. Life Sci, 2008, 83: 581-588. DOI:10.1016/j.lfs.2008.08.011 |
| [44] |
Du GJ, Zhang Z, Wen XD, et al. Epigallocatechin gallate (EGCG) is the most effective cancer chemopreventive polyphenol in green tea[J]. Nutrients, 2012, 4: 1679-1691. DOI:10.3390/nu4111679 |
| [45] |
Taniguchi S, Fujiki H, Kobayashi H, et al. Effect of (-)-epigallocatechin gallate, the main constituent of green tea, on lung metastasis with mouse B16 melanoma cell lines[J]. Cancer Lett, 1992, 65: 51-54. DOI:10.1016/0304-3835(92)90212-E |
| [46] |
Zhang J, Lei Z, Huang Z, et al. Epigallocatechin-3-gallate (EGCG) suppresses melanoma cell growth and metastasis by targeting TRAF6 activity[J]. Oncotarget, 2016, 7: 79557-79571. DOI:10.18632/oncotarget.12836 |
| [47] |
Lozano C, Torres JL, JuliàL, et al. Effect of new antioxidant cysteinyl-flavanol conjugates on skin cancer cells[J]. FEBS Lett, 2005, 579: 4219-4225. DOI:10.1016/j.febslet.2005.06.051 |
| [48] |
Franke AA, Halm BM, Kakazu K, et al. Phytoestrogenic isoflavonoids in epidemiologic and clinical research[J]. Drug Test Anal, 2009, 1: 14-21. DOI:10.1002/dta.12 |
| [49] |
Record IR, Broadbent JL, King RA, et al. Genistein inhibits growth of B16 melanoma cells in vivo and in vitro and promotes differentiation in vitro[J]. Int J Cancer, 1997, 72: 860-864. DOI:10.1002/(SICI)1097-0215(19970904)72:5<860::AID-IJC24>3.0.CO;2-B |
| [50] |
Tsao R. Chemistry and biochemistry of dietary polyphenols[J]. Nutrients, 2010, 2: 1231-1246. DOI:10.3390/nu2121231 |
| [51] |
Farina HG, Pomies M, Alonso DF, et al. Antitumor and antiangiogenic activity of soy isoflavone genistein in mouse models of melanoma and breast cancer[J]. Oncol Rep, 2006, 16: 885-891. |
| [52] |
Yan CH, Han R. Effects of genistein on experimental metastasis of B16-Bl6 mouse melanoma cells[J]. Acta Pharm Sin(药学学报), 1999, 34: 814-817. |
| [53] |
Kwon JE, Lee JW, Park Y, et al. Biotransformation of Pueraria lobata extract with Lactobacillus rhamnosus vitaP1 enhances anti-melanogenic activity[J]. J Microbiol Biotechnol, 2018, 28: 22-31. DOI:10.4014/jmb.1705.05087 |
| [54] |
Han E, Chang B, Kim D, et al. Melanogenesis inhibitory effect of aerial part of Pueraria thunbergiana in vitro and in vivo[J]. Arch Dermatol Res, 2015, 307: 57-72. DOI:10.1007/s00403-014-1489-z |
| [55] |
Danciu C, Borcan F, Bojin F, et al. Effect of the isoflavone genistein on tumor size, metastasis potential and melanization in a B16 mouse model of murine melanoma[J]. Nat Prod Commun, 2013, 8: 343-346. |
| [56] |
Lila MA. Anthocyanins and human health: an in vitro investigative approach[J]. J Biomed Biotechnol, 2004, 2004: 306-313. DOI:10.1155/S111072430440401X |
| [57] |
Huang HP, Shih YW, Chang YC, et al. Chemoinhibitory effect of mulberry anthocyanins on melanoma metastasis involved in the Ras/PI3K pathway[J]. J Agric Food Chem, 2008, 56: 9286-9293. DOI:10.1021/jf8013102 |
| [58] |
Wang E, Liu Y, Xu C, et al. Antiproliferative and proapoptotic activities of anthocyanin and anthocyanidin extracts from blueberry fruits on B16-F10 melanoma cells[J]. Food Nutr Res, 2017, 61: 1325308. DOI:10.1080/16546628.2017.1325308 |
| [59] |
Zhao G, Han X, Zheng S, et al. Curcumin induces autophagy, inhibits proliferation and invasion by downregulating AKT/mTOR signaling pathway in human melanoma cells[J]. Oncol Rep, 2016, 35: 1065-1074. DOI:10.3892/or.2015.4413 |
| [60] |
Liao W, Xiang W, Wang FF, et al. Curcumin inhibited growth of human melanoma A375 cells via inciting oxidative stress[J]. Biomed Pharmacother, 2017, 95: 1177-1186. DOI:10.1016/j.biopha.2017.09.026 |
| [61] |
Philip S, Kundu GC. Osteopontin induces nuclear factor kappa B-mediated promatrix metalloproteinase-2 activation through I kappa B alpha/IKK signaling pathways, and curcumin (diferulolylmethane) down-regulates these pathways[J]. J Biol Chem, 2003, 278: 14487-14497. DOI:10.1074/jbc.M207309200 |
| [62] |
Menon LG, Kuttan R, Kuttan G. Anti-metastatic activity of curcumin and catechin[J]. Cancer Lett, 1999, 141: 159-165. DOI:10.1016/S0304-3835(99)00098-1 |
| [63] |
Mirzaei H, Naseri G, Rezaee R, et al. Curcumin: a new candidate for melanoma therapy?[J]. Int J Cancer, 2016, 139: 1683-1695. DOI:10.1002/ijc.30224 |
| [64] |
Ko JH, Sethi G, Um JY, et al. The role of resveratrol in cancer therapy[J]. Int J Mol Sci, 2017, 18: 2589. DOI:10.3390/ijms18122589 |
| [65] |
Zhao H, Han L, Jian Y, et al. Resveratrol induces apoptosis in human melanoma cell through negatively regulating Erk/PKM2/Bcl-2 axis[J]. OncoTargets Ther, 2018, 11: 8995-9006. DOI:10.2147/OTT.S186247 |
| [66] |
Wu F, Cui L. Resveratrol suppresses melanoma by inhibiting NF-κB/miR-221 and inducing TFG expression[J]. Arch Dermatol Res, 2017, 309: 823-831. DOI:10.1007/s00403-017-1784-6 |
| [67] |
Gong C, Xia H. Resveratrol suppresses melanoma growth by promoting autophagy through inhibiting the PI3K/AKT/mTOR signaling pathway[J]. Exp Ther Med, 2020, 19: 1878-1886. |
| [68] |
Asensi M, Medina I, Ortega A, et al. Inhibition of cancer growth by resveratrol is related to its low bioavailability[J]. Free Radic Biol Med, 2002, 33: 387-398. DOI:10.1016/S0891-5849(02)00911-5 |
| [69] |
Salado C, Olaso E, Gallot N, et al. Resveratrol prevents inflammation-dependent hepatic melanoma metastasis by inhibiting the secretion and effects of interleukin-18[J]. J Transl Med, 2011, 9: 59. DOI:10.1186/1479-5876-9-59 |
| [70] |
Fulda S, Debatin KM. Sensitization for tumor necrosis factorrelated apoptosis-inducing ligand-induced apoptosis by the chemopreventive agent resveratrol[J]. Cancer Res, 2004, 64: 337-346. DOI:10.1158/0008-5472.CAN-03-1656 |
| [71] |
Osmond GW, Augustine CK, Zipfel PA, et al. Enhancing melanoma treatment with resveratrol[J]. J Surg Res, 2012, 172: 109-115. DOI:10.1016/j.jss.2010.07.033 |
| [72] |
Kim MY. Nitric oxide triggers apoptosis in A375 human melanoma cells treated with capsaicin and resveratrol[J]. Mol Med Rep, 2012, 5: 585-591. |
| [73] |
Guan H, Singh NP, Singh UP, et al. Resveratrol prevents endothelial cells injury in high-dose interleukin-2 therapy against melanoma[J]. PLoS One, 2012, 7: e35650. DOI:10.1371/journal.pone.0035650 |
| [74] |
Szekeres T, Fritzer-Szekeres M, Saiko P, et al. Resveratrol and resveratrol analogues--structure-activity relationship[J]. Pharm Res, 2010, 27: 1042-1048. DOI:10.1007/s11095-010-0090-1 |
| [75] |
Cao M, Yu HS, Song XB, et al. Advances in the study of derivatization of ginsenosides and their anti-tumor structureactivity relationship[J]. Acta Pharm Sin(药学学报), 2012, 47: 836-843. |
| [76] |
Wu R, Ru Q, Chen L, et al. Stereospecificity of ginsenoside Rg3 in the promotion of cellular immunity in hepatoma H22-bearing mice[J]. J Food Sci, 2014, 79: H1430-H1435. DOI:10.1111/1750-3841.12518 |
| [77] |
Meng L, Ji R, Dong X, et al. Antitumor activity of ginsenoside Rg3 in melanoma through downregulation of the ERK and Akt pathways[J]. Int J Oncol, 2019, 54: 2069-2079. |
| [78] |
Wang M, Yan SJ, Zhang HT, et al. Ginsenoside Rh2 enhances the antitumor immunological response of a melanoma mice model[J]. Oncol Lett, 2017, 13: 681-685. DOI:10.3892/ol.2016.5490 |
| [79] |
Fei XF, Wang BX, Tashiro S, et al. Apoptotic effects of ginsenoside Rh2 on human malignant melanoma A375-S2 cells[J]. Acta Pharmacol Sin, 2002, 23: 315-322. |
| [80] |
Lv DL, Chen L, Ding W, et al. Ginsenoside G-Rh2 synergizes with SMI-4a in anti-melanoma activity through autophagic cell death[J]. Chin Med, 2018, 13: 11. DOI:10.1186/s13020-018-0168-y |
| [81] |
Chakravarti RN, Chakravarti D. Andrographolide, the active constituent of Andrographis paniculata Nees; a preliminary communication[J]. Ind Med Gaz, 1951, 86: 96-97. |
| [82] |
Mishra SK, Tripathi S, Shukla A, et al. Andrographolide and analogues in cancer prevention[J]. Front Biosci (Elite Ed), 2015, 7: 255-266. |
| [83] |
Liu G, Chu H. Andrographolide inhibits proliferation and induces cell cycle arrest and apoptosis in human melanoma cells[J]. Oncol Lett, 2018, 15: 5301-5305. |
| [84] |
Ren KK, Wang HZ, Xie LP, et al. The effects of oridonin on cell growth, cell cycle, cell migration and differentiation in melanoma cells[J]. J Ethnopharmacol, 2006, 103: 176-180. DOI:10.1016/j.jep.2005.07.020 |
| [85] |
Zhang CL, Wu LJ, Zuo HJ, et al. Cytochrome c release from oridonin-treated apoptotic A375-S2 cells is dependent on p53 and extracellular signal-regulated kinase activation[J]. J Pharmacol Sci, 2004, 96: 155-163. DOI:10.1254/jphs.FPJ04008X |
| [86] |
Li CY, Wang Q, Shen S, et al. Oridonin inhibits migration, invasion, adhesion and TGF-β1-induced epithelial-mesenchymal transition of melanoma cells by inhibiting the activity of PI3K/Akt/GSK-3β signaling pathway[J]. Oncol Lett, 2018, 15: 1362-1372. |
| [87] |
Mouawad R, Sebert M, Michels J, et al. Treatment for metastatic malignant melanoma: old drugs and new strategies[J]. Crit Rev Oncol Hematol, 2010, 74: 27-39. DOI:10.1016/j.critrevonc.2009.08.005 |
| [88] |
Imenshahidi M, Hosseinzadeh H. Berberis vulgaris and berberine: an update review[J]. Phytother Res, 2016, 30: 1745-1764. DOI:10.1002/ptr.5693 |
| [89] |
Zou K, Li Z, Zhang Y, et al. Advances in the study of berberine and its derivatives: a focus on anti-inflammatory and anti-tumor effects in the digestive system[J]. Acta Pharmacol Sin, 2017, 38: 157-167. DOI:10.1038/aps.2016.125 |
| [90] |
Liu X, Ji Q, Ye N, et al. Berberine inhibits invasion and metastasis of colorectal cancer cells via COX-2/PGE2 Mediated JAK2/STAT3 signaling pathway[J]. PLoS One, 2015, 10: e0123478. DOI:10.1371/journal.pone.0123478 |
| [91] |
Kim HS, Kim MJ, Kim EJ, et al. Berberine-induced AMPK activation inhibits the metastatic potential of melanoma cells via reduction of ERK activity and COX-2 protein expression[J]. Biochem Pharmacol, 2012, 83: 385-394. DOI:10.1016/j.bcp.2011.11.008 |
| [92] |
Hamsa TP, Kuttan G. Berberine inhibits pulmonary metastasis through down-regulation of MMP in metastatic B16F-10 melanoma cells[J]. Phytother Res, 2012, 26: 568-578. DOI:10.1002/ptr.3586 |
| [93] |
Mackraj I, Govender T, Gathiram P. Sanguinarine[J]. Cardiovasc Ther, 2008, 26: 75-83. |
| [94] |
De Stefano I, Raspaglio G, Zannoni GF, et al. Antiproliferative and antiangiogenic effects of the benzophenanthridine alkaloid sanguinarine in melanoma[J]. Biochem Pharmacol, 2009, 78: 1374-1381. DOI:10.1016/j.bcp.2009.07.011 |
| [95] |
Serafim TL, Matos JA, Sardão VA, et al. Sanguinarine cytotoxicity on mouse melanoma K1735-M2 cells--nuclear vs. mitochondrial effects[J]. Biochem Pharmacol, 2008, 76: 1459-1475. DOI:10.1016/j.bcp.2008.07.013 |
| [96] |
Burgeiro A, Bento AC, Gajate C, et al. Rapid human melanoma cell death induced by sanguinarine through oxidative stress[J]. Eur J Pharmacol, 2013, 705: 109-118. DOI:10.1016/j.ejphar.2013.02.035 |
| [97] |
Jiang H, Hou C, Zhang S, et al. Matrine upregulates the cell cycle protein E2F-1 and triggers apoptosis via the mitochondrial pathway in K562 cells[J]. Eur J Pharmacol, 2007, 559: 98-108. DOI:10.1016/j.ejphar.2006.12.017 |
| [98] |
Yang Y, Xiu J, Zhang X, et al. Antiviral effect of matrine against human enterovirus 71[J]. Molecules, 2012, 17: 10370-10376. DOI:10.3390/molecules170910370 |
| [99] |
Suo Z, Liu Y, Ferreri M, et al. Impact of matrine on inflammation related factors in rat intestinal microvascular endothelial cells[J]. J Ethnopharmacol, 2009, 125: 404-409. DOI:10.1016/j.jep.2009.07.023 |
| [100] |
Gao HY, Li GY, Lou MM, et al. Hepatoprotective effect of matrine salvianolic acid B salt on carbon tetrachloride-induced hepatic fibrosis[J]. J Inflamm (Lond), 2012, 9: 16. DOI:10.1186/1476-9255-9-16 |
| [101] |
Li X, Chu W, Liu J, et al. Antiarrhythmic properties of long-term treatment with matrine in arrhythmic rat induced by coronary ligation[J]. Biol Pharm Bull, 2009, 32: 1521-1526. DOI:10.1248/bpb.32.1521 |
| [102] |
Zhang H, Chen L, Sun X, et al. Matrine: a promising natural product with various pharmacological activities[J]. Front Pharmacol, 2020, 11: 588. DOI:10.3389/fphar.2020.00588 |
| [103] |
Jin H, Sun Y, Wang S, et al. Matrine activates PTEN to induce growth inhibition and apoptosis in V600EBRAF harboring melanoma cells[J]. Int J Mol Sci, 2013, 14: 16040-16057. DOI:10.3390/ijms140816040 |
 2021, Vol. 56
2021, Vol. 56


