2. 华南理工大学生物科学与工程学院, 广东 广州 510006;
3. 广东省人民医院(广东省医学科学院)广东省冠心病防治研究重点实验室, 广东 广州 510080
2. School of Biology and Biological Engineering, South China University of Technology, Guangzhou 510006, China;
3. Guangdong Provincial Key Laboratory of Coronary Heart Disease Prevention, Guangdong Provincial People's Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, China
近年来, 由于城市化水平快速提高和经济飞速增长, 很多人形成了久坐不动的生活方式, 人们的饮食习惯也随着环境变化而发生改变, 出现了长期营养过剩的状态。同时伴随人口老龄化情况的加剧, 我国心血管疾病(cardiovascular disease, CVD)的患病率和死亡率在逐年上升。预计这种上升趋势在未来10年都会一直持续。在死亡率方面, 中国五分之二的死亡归因于CVD, 高于癌症或其他疾病的死亡率。JAMA Cardiology的一篇关于CVD的文献报道[1], 在中国, CVD导致的死亡人数从1990年的251万增加到2016年的399万, 年龄标准化死亡率从1990年的431.6/10万人降低到2016年的307.9/10万人, 下降了28.7%, 而1990至2016年这段时间CVD的年龄标准化患病率总体上显著提高了14.7%。来自Circulation的美国心脏协会的一份2020最新报告也显示[2], 2017年, 在全球由CVD导致的死亡人数约1 780万人, 与2007年相比增加了21.1%;而CVD的粗患病率为4.856亿, 与2007年相比增加了28.5%。2017年, 按年龄调整的死亡率为233.1/10万人, 比2007年下降10.3%;按年龄调整的患病率为6 081.6/10万人, 比2007年上升了0.2%。CVD仍然是我国乃至全球导致死亡的最主要原因[3]。
CVD是一种慢性疾病, 涉及人体多个循环系统, 其中动脉粥样硬化(atherosclerosis, AS)是CVD的主要病理基础[4]。AS是指体内的一些如胆固醇等的脂肪物质在供应心脑的动脉血管壁形成堆积, 时间一长则造成慢性沉积, 越来越大体积的堆积物容易形成粥样斑块进而造成局部的损伤。如果未能及时发现处理, 局部损伤会进一步扩大加重, 导致动脉壁的基质增厚、血管管径变细、血液通过量减少、心肌缺血、血管弹性降低。CVD引起的多种突发事件主要是由于AS造成的。当人类自身遗传因素与人常坐少动、营养过剩的生活状态相结合后, 极易导致人体的胆固醇和甘油三酯(TG)的代谢出现紊乱, 如果不注意调理, 患CVD的可能性也将大大增加。
如今, 多项临床和流行病学研究将脂蛋白异常与动脉粥样硬化性心血管疾病(ASCVD)联系起来[5]。总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)水平升高已被公认为CVD的主要危险因素[6]。有数据显示, LDL-C降低1 mmol·L-1(~40 mg·dL-1)会导致ASCVD事件减少22%[7]。AS发病机制中的一个关键过程是高胆固醇巨噬细胞在动脉壁上的积聚。有研究表明高密度脂蛋白胆固醇(HDL-C)水平与心血管疾病风险之间存在很强的负相关关系, 即HDL-C水平降低会增加CVD风险[8]。TG是极低密度脂蛋白(VLDL)和其他残余脂蛋白(如乳糜粒、中密度脂蛋白, 统称为富含TG的脂蛋白胆固醇)的主要成分, 可以导致AS, 高TG水平也会增加CVD风险[9]。有统计显示, 中国成人血脂异常的总体患病率高达40.4%, 较10年前呈大幅度上升; 预计2010~2030年我国的心血管病例将增加约920万, 这是由于胆固醇水平升高所导致的[10]。据中国成人血脂异常2013~2014年的某项调查[11], 对象为中国的10多万名18岁的成年人, 结果显示在全国范围内, TC、HDL-C、LDL-C以及TG的平均水平分别为4.70、1.35、2.88和1.14 mmol·L-1, TC的水平比2002年监测到的3.81mmol·L-1和2010年监测到的4.04 mmol·L-1的结果明显升高。目前中国成年人的血脂水平异常偏高, 在城市成年人中的肥胖或中枢性肥胖者更为常见。患有ASCVD或患病风险很高的人中有很大一部分没有达到LDL-C指标。根据ASCVD风险分层, 有必要改善脂质水平以降低LDL水平达到更好的治疗。
目前常用于治疗高胆固醇血症的主要药物是他汀类药物, 这类药物能够对胆固醇生物合成途径中的限速酶3-羟基-3-甲基戊二酰辅酶A (HMG-CoA)还原酶有很好的抑制作用[12]。虽然他汀类降脂药物使用十分普遍, 使心血管事件大幅减少, 总体上安全有效, 但是依旧存在一些不良反应, 如肌病或肌痛、肝转氨酶无症状增加和肝毒性等[13]。尽管这些不良反应很少出现严重情况或危及生命, 但它们确实降低了患者的依从性或治疗的持续性, 因此损害了预期的治疗效益。所以仅靠他汀类药物往往不足以将血浆LDL-C水平降低到低于目标值。现常将三磷酸腺苷柠檬酸裂解酶(ATP citrate lyase, ACLY, 又称ACL)作为降血脂干预的靶点[7, 14-16]。下面将以ACLY为主展开论述, 在简要介绍了ACLY的结构和机制作用后, 综述了一些可用于CVD中达到降低血脂的作用的ACLY抑制剂。
1 ACLYACLY是许多组织中合成胞内乙酰辅酶A的主要酶。它是一种胞浆酶, 能够催化依赖ATP和依赖辅酶A (CoA)的柠檬酸(Krebs循环的代谢产物)转化为草酰乙酸酯和高能生物合成前体乙酰辅酶A, ATP也在此过程中水解成ADP和无机磷酸盐[17]。乙酰辅酶A是胆固醇的二碳单位供体, 它可为关键的生化反应提供燃料, 如合成脂肪酸、胆固醇和乙酰胆碱, 也支持组蛋白和与代谢相关的酶的乙酰化[7, 18]。在自养原核生物中, ACLY是反向Krebs循环(也称还原性三羧酸循环)的标志性酶, 该循环将两个二氧化碳分子固定在乙酰辅酶A上[19]。在人类中, ACLY在肝脏和脂肪组织以及胆碱能神经元中强烈表达[20], 它成为碳水化合物和脂质代谢联系的桥梁。
1.1 ACLY结构ACLY属于酰基辅酶A合成酶(核苷二磷酸形成)超家族, ACLY蛋白是由4个相同亚基组成的同源四聚体, 可分为6个结构域, 每个多肽链包含1 101个氨基酸残基[20]。ACLY结构域示意图见图 1。它的每个亚基是由N端的柠檬基-CoA合成酶(CCS)模块和C端的柠檬基-CoA裂解酶(CCL)结构域组成的, 其中CCS模块部分又包含CCSα和CCSβ两个区域[21]。靠近N端处为由结构域3、4、5组成的CCSβ亚基, 结构域3和4上采用了ATP-grasp折叠的方式, 能够结合ATP, 结构域5也包含柠檬酸的结合位点; 与CCSβ亚基相连的是CCSα亚基, 它由结构域1、2组成, 结构域1上含有CoA结合位点, 结构域2包含催化机制所需的磷酸化组氨酸残基(His760), 可以调节酶的活性, His760是催化反应的关键位点; 结构域5与2之间可相互作用, 形成N端含有磷酸化组氨酸残基的两个“幂螺旋”之一; 结构域5和1之间有一段残基可以在3个丝氨酸或苏氨酸残基上磷酸化; 靠近C端的CCL模块包含4个类似柠檬酸合成酶(CS)的CoA结合域[22]。人类ACLY的结构图如图 2[23]所示, 这是它与柠檬酸结合形成复合物的一个结构。蛋白质显示为带状图, 其中的柠檬酸则显示为洋红色的棒状模型。绿色部分为结构域4, 由残基2~31和108~243形成; 结构域3包括残基32~107, 为红色部分; 黄色部分为结构域5, 包括残基244~425;结构域1包括残基487~624, 为青色; 结构域2则是蓝色部分, 包括残基625~820。电子密度中看到的末端残基用它们的残基编号标记(图 1中也有相应标注以及对应颜色的结构域)。由结构域3和4形成的ATP-grasp折叠在图的底部, 预计ATP/ADP将绑定到背面。
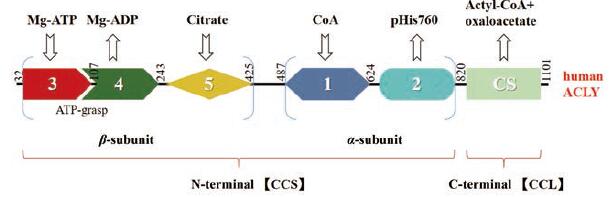
|
图 1 The structure domain of ATP citrate lyase (ACLY) |
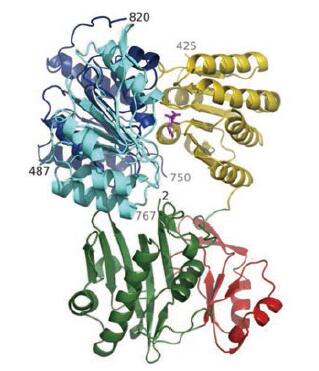
|
Figure 2 The structure of human ACLY |
Sun等[23]在研究人类的ACLY的晶体结构过程中, 成功结晶了酶的一种截断形式, 从这些研究中获得的X射线晶体学数据揭示了ACLY大约三分之二的结构。他们确定了被定义为柠檬酸结合位点的一个环, 这个环由残基Ser343-Thr348形成。柠檬酸含有3个羧基和1个羟基, 因它含有1个前手性中心, 可以区分两个末端羧基, 分别为pro-R和pro-S[24]。柠檬酸分子的pro-R和pro-S羧基在非酶促反应中无法区分, ACLY允许pro-S羧基具有反应性, 但使pro-R羧基保持不活跃状态, 这导致反应中间体柠檬基-磷酸和柠檬基-CoA具有S构型[23]。当柠檬酸与ACLY结合时, Ser343-Thr348残基通过氢键与柠檬酸前手性中心的羟基和羧基相互作用, pro-R羧基与Arg379形成强烈的离子相互作用且两者之间存在盐桥。中心的-COOH基团与Thr348的侧链以及Asn346和Thr348的主链通过氢键, 而羟基与Thr348的侧链与Gly309的主链相互作用。蛋白质与柠檬酸中心羧基和羟基的作用不能互换。这两个取代基在手性中心的取向迫使pro-R羧基指向Arg-379, 柠檬酸的pro-S羧基暴露并自由地与磷酸组氨酸残基反应。一旦柠檬酸被磷酸化, CoA的游离硫醇就会与这个pro-S羧基反应生成柠檬基-CoA。
1.2 ACLY生化反应作用机制ACLY催化的酶促反应主要是通过以下4个步骤[25](图 3, 未标序号的为总反应式): ①ACLY在活性位点的组氨酸残基上与ATP发生磷酸化反应, 形成了ACL-P, Mg-ATP与游离酶进行结合, 引起Mg-ADP的释放, 这个游离酶可以催化保守的组氨酸残基的磷酸化, 初始磷酸化过程发生在His760上, His760是人类亚型中的磷酸盐受体[17]; ②磷酸基从His760转移到柠檬酸上, 再由磷酸酶催化柠檬酸磷酸酯的形成[23]; ③在②形成的柠檬酸磷酸酯被CoA的硫醇基团攻击, CoA在攻击中可在柠檬酸根和CoA之间形成柠檬基-CoA硫酯键, 并释放无机磷酸(Pi)[26]; ④酶结合的中间体柠檬酰基-CoA在逆向Claisen反应中被裂解, 从酶活性位点释放乙酰辅酶A和草酰乙酸[22]。图 3以方程的形式展示了4个步骤过程, 图 4直观显示了ACLY的生化反应机制。
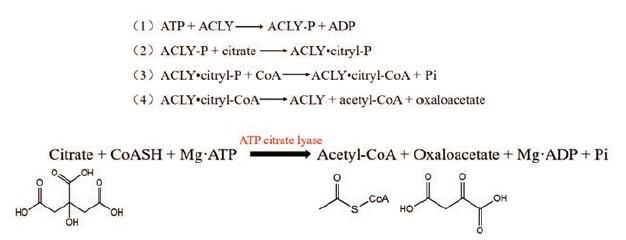
|
Figure 3 The enzyme reaction catalyzed by ACLY |
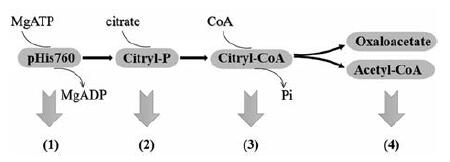
|
Figure 4 Biochemical reaction mechanism of ACLY |
ACLY在脂质代谢中起着十分重要的作用。ACLY是一种胞浆酶, 在肝脏和白色脂肪等组织中表达最高[27]。ACLY是胞浆中乙酰辅酶A的主要贡献者。肝脏是脂蛋白合成的重要器官, ACLY作为脂蛋白合成的重要酶, 它可为脂肪酸合成途径和甲羟戊酸途径提供胞内乙酰辅酶A[28]。脂质的生物合成始于线粒体, 但乙酰辅酶A无法穿过线粒体膜, 所以它不能离开线粒体而产生乙酰基, 而乙酰基正是启动脂质形成过程中所必需的。在柠檬酸合酶的帮助下, 来自非脂质营养物质代谢的乙酰辅酶A与草酰乙酸酯(通过三羧酸循环)缩合形成柠檬酸, 再由柠檬酸转运载体输出到细胞质中。随后, 胞浆中的ACLY将柠檬酸裂解成乙酰辅酶A, 为胆固醇和脂肪酸的合成提供原料。细胞内乙酰辅酶A在乙酰辅酶A羧化酶(ACC)的作用下转化为丙二酰辅酶A后进入脂肪酸合成途径, 或通过一系列缩合反应进入甲羟戊酸途径, 再被HMG-CoA还原酶(HMGR)还原为甲羟戊酸, 这两个步骤均为限速步骤[16], 如图 5所示。ACC是从头合成脂肪酸的限速酶, 它可使乙酰辅酶A发生羧化反应生成丙二酰辅酶A, 再通过从头合成脂肪酸的4个反应周期, 合成棕榈酸, 这种修饰会导致脂肪酸的产生。在甲羟戊酸途径中, ACLY提供的乙酰辅酶A主要用于胆固醇合成: 乙酰辅酶A和乙酰乙酰辅酶A经HMG-CoA合成酶催化缩合形成HMG-CoA, 再被3-羟基-3-甲基戊二酸-辅酶A还原酶(HMG-CoA还原酶)还原为甲羟戊酸[29]; 甲羟戊酸通过需要ATP的3个连续反应转化为3-异戊烯基焦磷酸酯; 多个延伸步骤包括重复添加额外的5-碳模块生成角鲨烯, 角鲨烯环化形成羊毛甾醇; 羊毛甾醇脱去3个甲基加上1个双键的还原和另1个双键的迁移等一系列过程后, 最终生成胆固醇[14]。甲羟戊酸不仅是胆固醇生物合成途径中HMG-CoA还原酶的产物, 也是合成几个重要的生物中间体和产物的基础, 包括异戊二烯类化合物、辅酶Q10和羟甲基戊二酰辅酶A还原酶[30]。当养分供应超过生物合成和能量需求时, 细胞利用这一途径将脂类酯转化成胆固醇酯和甘油三酯的形式来储存能量。
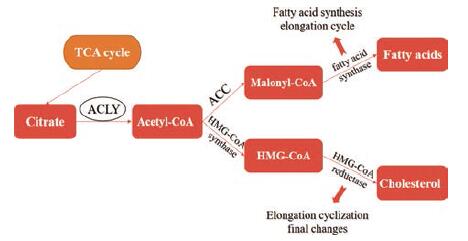
|
Figure 5 The role of ACLY in lipid synthesis and the schematic diagram of the expected effect of inhibiting ACLY |
ACLY不仅与脂代谢紧密相关, 它还参与了葡萄糖的代谢。众所周知, 肿瘤细胞中伴随着能量代谢的改变, 代谢失调对肿瘤的发生发展也有着极大的影响[31]。葡萄糖糖酵解和脂质的从头合成都是肿瘤细胞重要的特征。ACLY可通过靶向下游效应器来影响葡萄糖的代谢[24]。葡萄糖的糖酵解过程可以提供生物所需的能量, 特别是在癌细胞中, 它十分依赖糖酵解过程来获取能量, 表现为葡萄糖的摄取增加以及糖酵解活跃, 这称为“Warburg effect”[32]。葡萄糖的分解代谢升高会导致糖酵解最终产物丙酮酸的过量产生, 丙酮酸有两个去向: 一是被乳酸脱氢酶转化为乳酸, 二是进入线粒体后引起线粒体中柠檬酸浓度的上升, 柠檬酸被载体运输到细胞质中, 被ACLY裂解生成乙酰辅酶A。ACLY是长链脂肪酸合成的上游酶, 可为脂肪酸的合成提供所需的乙酰辅酶A。由此可见, ACLY将糖酵解的分解代谢途径和脂肪酸的生物合成两个过程很好地联系起来, 中间产物柠檬酸既是糖酵解代谢产物的抑制剂, 也是乙酰辅酶A从头合成脂肪酸的前提。因此, ACLY的活性会影响葡萄糖的酵解产生ATP和脂质合成两大过程。已有研究证明, ACLY在永生化细胞和各种肿瘤中的表达相对于正常细胞普遍上调, 出现异常的高表达, 包括在乳腺、结肠、肝脏、肺、胃和前列腺肿瘤以及胶质母细胞瘤中, 且ACLY在上述类型的癌症中表现为负面的预后因子[33-37]。在培养的癌细胞中, ACLY表达增加也会促进癌细胞的增殖以及延长存活时间[33, 38]。所以, ACLY现也作为癌症治疗的一个有效靶点[24, 25, 39]。
ACLY在糖酵解过程中作为级联反应的最终酶, 在脂质合成过程中作为起点。ACLY是脂质合成的起点, 可以通过靶向上游效应器来影响脂质的合成[24]。考虑到ACLY在脂肪生成中的生理作用以及同时影响脂质和胆固醇的合成, 该酶一直被认为是治疗高脂血症和高胆固醇血症的药物靶点。本文进一步总结ACLY抑制剂在降低血脂方面的作用。目前, ACLY仍然是这一领域的潜在靶点。下面按照化合物的报道时间对一些ACLY抑制剂进行介绍。
2 ACLY抑制剂最早发现的ACLY抑制剂是(-)-羟基柠檬酸(图 6, 化合物1), 是羟基柠檬酸(HCA)的其中一种立体异构体, 它是首次从藤黄果皮中分离出来的[40]。它是一种很强竞争的ACLY抑制剂, 在1969年就有文献进行报道, 可以从(-)-羟基柠檬酸的研究中得出一些关于抑制ACLY作用的信息。其生物学特性的表现归因于在哺乳动物胆固醇生物合成途径中位于HMG-CoA还原酶上游的ACLY的特异性抑制。许多研究表明该化合物具有减少脂肪生成和抑制脂肪酸合成的能力, 它在体内或体外都得到了广泛研究。HCA对大鼠肝脏ACLY的Ki值为8 μmol·L-1, 但也能抑制其他几个靶点, 如乙酰辅酶A羧化酶、异柠檬酸脱氢酶、乌头酸酶、柠檬酸合成酶、丙酮酸脱氢酶和磷酸果糖激酶等[41]。后有研究表明, (-)-羟基柠檬酸的抑制效率与它的立体结构有关, 羟基柠檬酸有4种立体异构, 其中只有化合物1[(2S, 3S) 2-羟基柠檬酸]对大鼠或人的ACLY有抑制作用[40, 42]。化合物1比其内酯形式更有活性, 其内酯形式对大鼠肝脏ACLY的Ki值在50~100 μmol·L-1[43]。从人肝脏提取的ACLY异构体上, HCA对柠檬酸(Ki=0.3 mmol·L-1)具有弱竞争性抑制作用[44]。已经证明, 与其Ki相比, 在相对较高的浓度(IC50=0.1~0.5 mmol·L-1)下, HCA对HepG2细胞的胆固醇合成有抑制作用, 从而影响胆固醇的稳态, 进而增加LDL受体的活性和HMG-CoA还原酶的水平[45]。HCA的降血脂作用在动物模型中得到证实, 在这些动物模型中, HCA能够减少脂肪酸和胆固醇的合成进而降低了TG水平[42-44]。
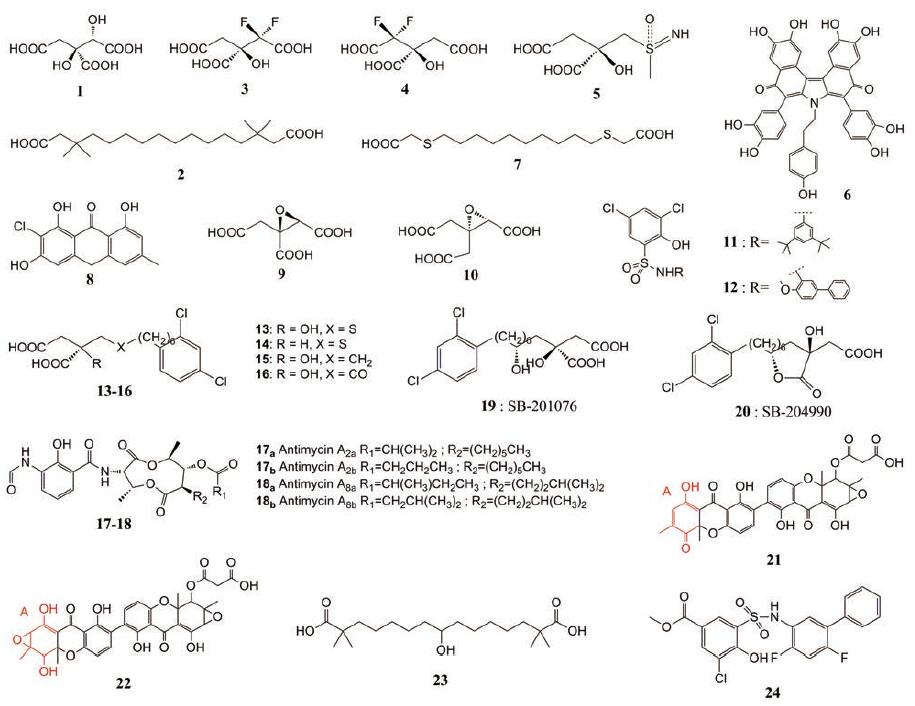
|
Figure 6 ACLY inhibitors (compounds 1-24) |
1987年, 文献[46]报道了一类长链二羧酸及其衍生物, MEDICA化合物是一类β, β'-甲基取代的α, ω-二羧酸, 根据碳原子数定义为MEDICA 6~16。MEDICA16 (图 6, 化合物2)是具有降血脂作用的β, β'-二甲基十六烷二酸, 有报道称它也是一种ACLY抑制剂, 其Ki值为16 μmol·L-1, 有抑制大鼠肝脏脂质合成的能力, 并伴随着胞浆乙酰辅酶A的减少, 从而显著降低胆固醇。MEDICA16还是CoA的竞争性抑制剂(Ki=3 μmol·L-1)[47]。它是通过对柠檬酸的主要竞争性机制和对CoA的非竞争性机制来发挥其抑制作用。这种长链脂肪酸的合成是基于与长链脂肪酸的相似性, 因为它与正常脂肪酸的行为相似, 只是碳链第3位的二甲基取代阻止了β-氧化, 以作为一种非代谢脂肪酸类似物[48]。在初步评价后, 发现MEDICA16在体外通过与柠檬酸竞争性抑制大鼠肝脏ACLY, 减少培养的大鼠肝细胞脂肪酸和胆固醇的合成, 可分别导致大鼠体内的胆固醇和HDL降低60%和45%[49]。然而, MEDICA16对ACLY没有选择性, 因为它的二酸形式和CoA-单硫酯都证明也能抑制肝脏乙酰辅酶A羧化酶, 因此便于观察到降血脂作用[46, 50]。
有研究报道, (3R)-或(3S)-2, 2-二氟柠檬酸对映体[图 6, 化合物3为(3R)-2, 2-二氟柠檬酸, 化合物4为(3S)-2, 2-二氟柠檬酸]也可作为ACLY抑制剂, 如其名所知, 在柠檬酸盐结构中插入氟原子可以合成这类化合物[25]。氟原子可作为氢或羟基的替代, 因为它尺寸小且相似的碳氢键距离, 而且氟的电子性质使它能够很好地作为氢键的受体。当氟原子位于潜在的碳负离子位置附近时, 氟原子在反应中可能被消除, 会在活性位点内形成烷基化基团, 它可能攻击活性区域内的基团, 从而使酶发生不可逆的失活。研究者测定了这两个化合物对ACLY的抑制作用(ATP浓度在0.05~3.0 mmol·L-1, 柠檬酸浓度为1 mmol·L-1, CoA浓度为200 μmol·L-1)。结果显示, (+)-2, 2-二氟柠檬酸的Ki值为0.7 μmol·L-1, 而(-)-2, 2-二氟柠檬酸Ki为3.2 μmol·L-1[51], 说明(+)-二氟柠檬酸是一种对柠檬酸盐更具竞争性的抑制剂, 而(-)-二氟柠檬酸对以柠檬酸为底物的乌头酸酶的抑制作用更强。它们以ATP或CoA为底物的抑制模式为非竞争性或混合型, 且抑制常数较弱。预期(-)-二氟柠檬酸盐将具有细胞毒性, 而(+)-二氟柠檬酸盐可能会降低细胞中乙酰辅酶A的水平。
Dolle和McNair等[52]由ACLY催化逆Claisen反应过程的机制联想到了谷氨酰胺合成酶催化反应, 两个反应具有某些相似之处, 这两种酶都使用了磷酸-羧酸酐作为催化过程中羧酸活化的方法。以这种相似行为作为指导, 他们研究并描述了几个ACLY抑制剂的合成并对其进行了酶学的评价, 目的是寻找降血脂干预的靶点。与谷氨酰胺合成酶抑制剂的设计类似[53], 化合物5 (图 6)也被设计为潜在的紧密结合ACLY的抑制剂, 末端的羧基被亚磺酰亚胺基取代。化合物5是一种柠檬酸类似物, 它是一对对映异构体中的一个, 表现出微弱的抑制作用(Ki=250 μmol·L-1)[52]。当其代替柠檬酸盐作为底物时, 也观察到适度的ATP酶活性。另一个对映异构体无抑制酶活性。
在ACLY的活性天然产物的筛选过程中, 从海绵Iotrochota sp.的一种提取物中, 分离得到了一种对ACLY具有抑制作用的紫色化合物——purpurone (图 6, 化合物6)。提取物要用甲醇(含HCl)进行温和的酸水解, 才能分离出纯活性成分, 分离出的水乙醇提取物有较好的ACLY抑制活性。Purpurone抑制ACLY呈剂量依赖性, IC50为7 μmol·L-1[54]。有研究者发现, 测试细胞毒性时, 在100μg·mL-1的情况下此物质对HepG2细胞没有毒性, 且细胞ATP水平没有降低, 初步数据表明, 该化合物有降低脂肪酸的作用[54]。近些年, 快速合成purpurone的方法也被人提出, 这也便于更好地研究新的ACLY抑制剂[55]。
二羧酸, 3-噻二羧酸[1, 10双(羧甲硫基)癸烷](图 6, 化合物7), 是一种新型的二羧酸衍生物, 也可抑制ACLY和脂肪酸合成酶活性[56]。它是硫取代脂肪酸类似物, 相较于MEDICA16, 此化合物β位的双甲基取代被硫原子取代, 由于其对乙酰胆碱酯酶、脂肪酸合成酶和HMG-CoA还原酶的抑制活性, 降低了肾病高脂血症动物模型中的TG和胆固醇的水平[57]。经3-硫代二羧酸处理后, 大鼠血浆TG和胆固醇水平均降低, 胆固醇生物合成限制酶HMG-CoA还原酶活性降低58%, 因此认为3-硫代二羧酸可通过减少LDL-C的过量产生而改善实验性肾病的高脂血症[56]。
从一种土壤真菌代谢物中分离出来的2-氯-1, 3, 8-三羟基-6-甲基蒽-9(10H)-酮(图 6, 化合物8)是一种天然的化合物, 对于这类化合物的寻找和筛选, 都是基于它能够降低血清中TG和LDL-C的水平这一目的。蒽酮(化合物8)是一种有效的大鼠肝脏ACLY抑制剂, 经苹果酸脱氢酶(MDH)偶联酶法计算, 其IC50值为283 nmol·L-1[58]。酶学特性决定了其相对于底物柠檬酸的竞争行为和对CoA及ATP的混合非竞争性抑制。
通过共价修饰活性中心试剂, 该研究组还开发了新一类柠檬酸类似物[图 6, 化合物9为顺式环氧(-)-5, 化合物10为反式环氧(+)-6]作为ACLY抑制剂, 是环氧化物潜在活性位点定向的代表性化合物[59]。化合物是基于经典的酶促机制来设计的, 其中活性位点亲核试剂(硫醇)被认为与催化反应密切相关。考虑到催化的机制涉及活性位点亲核硫醇基团的参与, 酸酐被产生共价结合的柠檬酸酶加合物的活性位点的亲核试剂攻击, 与无机磷酸(Pi)的释放一致。柠檬酸衍生物的设计目的是共价修饰活性部位, 基于环氧化物衍生物与底物柠檬酸有着高度相似性, 以及它有着通过打开环氧化物环来共价修饰活性部位的亲核巯基, 从而使酶不可逆失活的潜在能力。在进行潜在抑制剂抗大鼠ACLY的动力学结果评价中, 化合物9 (Ki=18 μmol·L-1)对大鼠的ACLY有轻度的可逆抑制作用, 比化合物10 (Ki=400 μmol·L-1)的效果增强了22倍[59]。
文献[60]报道2-羟基-N-芳基苯磺酰胺类化合物可作为为ACLY抑制剂。为了找到能在动物模型中评估抑制ACLY效能的口服活性化合物, 通过不懈努力, 3, 5-二氯-N-(3, 5-二叔丁基苯基)-2-羟基苯磺酰胺(图 6, 化合物11)被鉴定为ACLY的温和抑制剂(IC50=1.1 μmol·L-1)[61]。随后对基于2-羟基-N-苯基苯磺酰胺药效基团的化合物进行了相似性挖掘, 在10 μmol·L-1下发现了多个超过50%抑制作用的化合物。其中化合物12 (图 6)的抑制作用最强, IC50为0.13 μmol·L-1, 是一种中等效力的细胞通透性ACLY抑制剂, 由3, 5-二氯-2-羟基苯磺酰氯和4-甲氧基-(1, 1'-联苯)-3-胺在一定条件下反应得到。在HepG2细胞中, 该化合物对总脂合成有抑制作用, IC50值为8 μmol·L-1。在进行细胞毒性实验中, 化合物12在50 μmol·L-1以下无细胞毒性, 这表明了所观察到的脂质合成抑制不是化合物诱导的细胞毒性所致。还有研究[60]发现, 当以高脂饮食喂养的小鼠服用化合物12时, 可观察到小鼠的血浆胆固醇、TG水平均有所下降。可表明化合物12是2-羟基-N-芳基苯磺酰胺类化合物中最有效的ACLY抑制剂。
上文提到MEDICA16, 它对ACLY抑制活性可能是因为它能够模拟酶结合的柠檬酰辅酶A加合物。对于这样的拟态, 一个羧酸基团可以与柠檬酸结合位点结合, 而脂溶性烷基和其他羧酸基团可以与CoA结构域相结合。Gribble等[62]认为通过在这些分子中加入更多的“类柠檬酸”特征, 再加上能更有效地与CoA结合位点相互作用的修饰, 可以设计出更有效的ACLY抑制剂。作为识别与CoA结合位点更有效结合的结构修饰的一种手段, 考虑了ACLY和HMG-CoA还原酶的CoA位点之间存在结构相似性的可能性。HMG-CoA还原酶是甲羟戊酸途径中一种依赖于NADH的酶, 也是哺乳动物胆固醇生物合成中的关键调节酶, HMG-CoA还原酶将HMG-CoA转化为甲羟戊酸, 同时在此过程中释放CoA。随着临床有效抑制剂的发现和商业化开发, 其抑制剂也在治疗高胆固醇血症中取得了重大进展。大多数HMG-CoA抑制剂都含有一个疏水部分, 它将化合物锚定在活性部位, 连接极性的两个基团, HMG-CoA发生酶促反应后, CoA产物仅结合在亲水性区域, 与酶的疏水部分的排斥作用促进了产物的排出[63]。ACLY也出现类似的情况, 反应机制的最后阶段依赖于酶结合的柠檬酰辅酶A加合物释放类似的产物乙酰辅酶A。基于将亲脂基团连接到“类柠檬酸头部”的概念, 他们开发了一系列2-取代丁二酸作为ACLY的抑制剂, 进一步开展了ACLY抑制剂作为潜在降脂剂的研究工作。
化合物13~16 (图 6)是4个效果较好的ACLY抑制剂, 都属于丁二酸衍生物, 有实验表明它们对大鼠ACLY的抑制常数Ki分别为3.3、2.6、2.9和1.2 μmol·L-1[62]。其中, 化合物13表现出对柠檬酸呈竞争性抑制机制, 而对CoA呈非竞争性抑制机制。由结构可看出, 这几个化合物的共同特点为均含有一个2, 4-二氯苯环, 其中一个氯原子的邻位则连接了含多个原子的间隔基长链。其中, 化合物14相比于其他3个化合物, 无叔羟基, 但化合物13、14、15三个化合物的Ki值相差不大, 说明间隔物的性质与抑制效力和叔羟基团的存在无关。化合物16的抑制能力最好, 可被酶催化生成草酰乙酸酯, 它与化合物13和15的不同之处在于羰基间隔物。进一步的研究表明, 这些化合物通过与柠檬酸位点上的丁二酸部分结合而与ACLY相互作用, 它们的亲和力受到了亲脂部分与相邻疏水结合区相互作用的调节。然而丁二酸衍生物不能抑制HepG2细胞中胆固醇或脂肪酸的合成, 因为这些极性化学物质受到了羧基的限制导致细胞渗透性很差。
抗霉素是从链霉菌中分离提取而出的, 其中被分离出的具有生物活性的结晶被命名为antimycin A[64]。Schilling等[65]在1970年发现了已知成分antimycin A1~A4。Antimycin A7和A8是Barrow等[66]于1997年发现的, 该文也报道了antimycin A系列化合物对ALCY的抑制作用。在分离的化合物中, 抗霉菌素A2和A8是两种最有效的ACLY抑制剂, A2(图 6, 化合物17a和17b即包括A2a和A2b)的Ki值为4.2 μmol·L-1, A8(图 6, 化合物18a和18b即包括A8a和A8b)的Ki值约为4 μmol·L-1。抗霉素A的每种化合物都是由两个密切相关的异构体混合而成, 特征是存在一个羧基苯酚酰胺、一个双内酯九元环和两个不同长度碳链的烷基侧链。异构体结构上的不同之处在于双内酯九元环上的酯取代基上的烷基链部分: 图中的R1在化合物17中表现为丙基或异丙基, 它在化合物18中表现为异丁基或仲丁基。
丁二酸衍生物缺乏细胞渗透性, 这个问题通过开发它们的前药得到了很好的解决[61]。Pearce等[67]报道了SB-201076 (图 6, 化合物19)是ACLY有效的抑制剂, 而SB-201076的细胞穿透剂—γ-内酯前药, 即SB-204990 (图 6, 化合物20)也有很好的降血脂作用。SB201076的结构与化合物15很相似, 只增加了一个羟基, 对大鼠ACLY[Ki=(1±0.05) μmol·L-1]和重组人ACLY[Ki=(1±0.1) μmol·L-1]抑制作用相同。SB-201076对ACLY的抑制作用主要是与柠檬酸的竞争性作用, 但有少量的非竞争性成分。口服SB-201076可剂量依赖性地使鼠血浆胆固醇降低46%以及甘油三酯水平降低80%, 约一周后出现效果; 在狗身上也得到类似结果, 但用时更长且效果略差, 约15天, 狗体内的胆固醇浓度降低了23%, TG水平降低了38%[68]。由于SB-201076是通过内酯水解在细胞内形成的, SB-204990在无细胞环境下对ACLY无活性。然而在30 μmol·L-1的SB-204990作用下, 对HepG2细胞胆固醇合成和脂肪酸合成有强烈的抑制作用, 分别降低91%和82%, 但较高浓度时也对细胞有毒性[67]。SB-204990并不直接抑制ACLY, 而是在肝细胞内被吸收并水解为有效的ACLY抑制剂SB-201076。SB-204990在降低HepG2细胞胆固醇和脂肪酸合成方面也比羟基柠檬酸高约30倍, 从而为研究ATP柠檬酸裂解酶抑制剂的降血脂作用提供了有用的物质。
2001年, 日本的某项专利报道了两种ACLY抑制剂(图 6, 化合物21和22), 它们是由Islundicum青霉产生的治疗高脂血症的次生代谢物ACLY抑制剂。该类物质能抑制低浓度的脂合酶, 阻碍ACLY, 发挥降低血清脂质(TG和胆固醇)的作用。化合物21和22具有相同的骨架, 环A (红色部分)的取代基不同。在对大鼠肝脏酸性磷酸酶的酶学测定中, 化合物21对ACLY的抑制浓度为4.0μg·mL-1, 化合物22对ACLY的抑制浓度为6.4μg·mL-1, 都具有较好的抑制效果[69]。
ETC-1002 (8-羟基-2, 2, 14, 14-四甲基十五烷-碘酸)是一种能够有效降低LDL-C, 调节ASCVD患者血脂的ACLY抑制剂[70, 71], 英文名为bempedoic acid (图 6, 化合物23)。该分子于2004年首次报道, 被命名为ESP55016[14]。Esperion Therapeutics公司在2019年的美国心脏学会(AHA)年会上用4项Ⅲ期的临床数据分析结果表明, 对于具有ASCVD或者患有高胆固醇血症的患者, 基于使用他汀药物疗法且患者接受最高耐受的基础上, bempedoic acid能够降低LDL-C水平约18%[72]; 而对于一些不耐受他汀药物的患者, bempedoic acid相对于安慰剂也能够使LDL-C水平降低25%[15]。在编号为NCT01751984[73]的一项临床试验中, 在对他汀类药物不耐受的患者中检测他们服用ETC-1002的效果。根据结果分析得出, 相对于安慰剂组, 服用ETC-1002能显著降低LDL-C、TC、载脂蛋白B以及超敏C反应蛋白(hs-CRP)水平, 但对于HDL-C和TG水平并无影响。在动物模型中, ETC-1002可以预防血脂异常和动脉粥样硬化[74, 75]。有实验表明, bempedoic acid能够抑制大鼠原代肝细胞中脂肪酸和甾醇的合成, 诱导细胞内乙酰辅酶A、HMG-CoA、丙二酰辅酶A减少, 也对降低肥胖和代谢综合征大鼠的血浆非HDL-C、游离脂肪酸水平有良好的效果[76, 77]。2020年2月21日, FDA批准了Esperion公司的降胆固醇新药NEXLETOL(bempedoic acid)。
ETC-1002通过直接抑制ACLY进而降低细胞内乙酰辅酶A的浓度, 随着细胞内乙酰辅酶A水平的下降, 细胞内胆固醇浓度下降, 这种变化已知由甾醇反应元件结合蛋白(SREBP)/裂解激活蛋白系统感知[78]。在细胞核中, SREBP结合了几个目标基因的睾酮反应元件, 调节包括低密度脂蛋白受体(LDL-R)等基因的转录。细胞内胆固醇水平的降低也刺激LDL-R膜蛋白的表达。总之, ETC-1002能上调LDL-R的活性使其表达增加导致循环中的LDL摄取增加, 因而能够显著降低血浆LDL-C的生成[79]。使用ETC-1002治疗的优点在于不会因服用他汀类药物而出现可能的肌痛症状。肌痛源于肌肉HMG-CoA还原酶的抑制[80]。ETC-1002需要被ACSVL1激活, 这种激活主要发生在ACSVL1高表达的肝脏中, 而ACSVL1在骨骼肌中较为缺乏, ETC-1002并不会发生激活, 从而避免了他汀类药物的肌肉毒性。所以, ETC-1002与他汀类药物区别的一个重要特征在于它对肝脏的特异性作用。
Kenneth Verstraete团队[22]于2019年报道了ACLY全酶四聚体的结构, 让人们对氧化Krebs循环柠檬酸合成酶的起源有了更深入的了解, 也为研究人类ACLY活性奠定了很好的分子基础。同年, Tong团队[21]基于人类ACLY的结构, 通过冷冻电子显微镜观察了一种抑制剂NDI-091143与人的全长ACLY同源四聚体结合后发生相互作用形成的复合物的结构特征及ACLY所产生的构象变化, 揭示了一种能有效抑制ACLY的变构机制。Tong团队经筛选后发现了一系列小分子ACLY抑制剂, 其中NDI-091143 (化合物24, 图 6)比2-羟基-N-芳基苯磺酰胺类化合物具有更好的抑制效果, NDI-091143的抑制常数Ki为7.0 nmol·L-1, 用ADP-Glo分析法测得的IC50为2.1 nmol·L-1。他们根据电子显微镜观察到的结果分析发现, NDI-091143与ACLY的柠檬酸结构域(图 1中的结构域5)结合, 但是结合位点不同于柠檬酸与ACLY的结合位点, 而是处于柠檬酸结构域核心的一个疏水空腔中。结合后构象发生了改变, NDI-091143为了使ACLY中的柠檬酸结构域稳定不发生过大变化, 间接阻断柠檬酸去结合或识别结构域上的位点, 这就是他们发现的新的变构机制, 能有效抑制ACLY的催化。上述行为也说明了NDI-091143与柠檬酸之间存在竞争性。变构位点及机制的发现也为开发和研究新的ACLY抑制剂提供了更好的基础。
3 小结虽然现在常用的降血脂药物的有效性和安全性已经得到了一定的保证, 但是依旧还有一些患者使用后达不到预期的LDL-C目标值, 仍有CVD风险存在。目前需要一种降血脂的药物, 针对一些不耐受他汀类药物或者只耐受低剂量的患者服用, 在LDL-C治疗目标达不到时补充它们的效果, 达到更加有效且安全的作用。鉴于ACLY在调节细胞脂质合成的关键底物可用性方面的核心作用, ACLY是这类药物开发的一个非常有吸引力的靶点。ACLY处于脂质和胆固醇合成的上游位置, 即作用于HMGCR的上游, 是第一个触发这两个生物合成过程的酶, 体现了ACLY抑制剂在降脂方面的显著治疗地位。Ference等[81]的孟德尔随机化研究也表明了ACLY评分与LDL-C水平密切相关, LDL-C水平每降低10 mg·dL-1, ACLY评分与主要心血管事件风险降低17.7%。这在遗传学角度为ACLY抑制剂用于降血脂方面的研究奠定了有力基础。
许多ACLY抑制剂被评估为在阻断或减少脂肪酸或胆固醇合成的治疗中有很好的潜在作用。已经有多个动物实验和人类临床试验证明, ACLY抑制剂可以显著改善血脂紊乱情况, 也在抑制动脉粥样硬化病变有着良好的效果[7]。这些抑制剂具有与他汀类药物相当的效果, 并且比其他非他汀类降脂药物(尤其在降低LDLC方面)有一些潜在的优势。已有临床证据显示[14, 15, 82], 在服用他汀药物最大的耐受剂量的治疗后仍达不到LDL-C目标时, bempedoic acid作为单一疗法或与ezetimibe或他汀类药物联用对降低LDL-C有着显著的效果, 若对于他汀类药物不耐受或不能使用的患者单独使用bempedoic acid或者联合其他降脂药物如ezetimib也是有良好作用的。如今, bempedoic acid已获得美国FDA的批准, 这也是20年来美国首次批准的新型口服降脂药物, 这说明ACLY抑制剂在降低血脂方面具有良好的发展前景。
以ACLY作为潜在靶点开发新的抑制剂, 可以从多方面进行考虑。一方面可以从其结构出发, 与其他通路上作用于血脂的靶点相结合, 设计双靶标抑制剂以达到更好的多重抑制效果; 另一方面可以通过分子对接等手段进行虚拟药物筛选, 并基于已报道的能有效抑制ACLY的变构机制及位点, 以期找到有效的小分子能作为ACLY的高亲和力抑制剂; 对于一些已证明有抑制活性但是因细胞通透性或者细胞毒性的限制而无法使用的, 可以考虑在结构上进行适当的改造。当然, 药物的有效性、安全性还是需要临床试验来进一步证明。ACLY在脂代谢中处于战略性地位, 它很可能为血脂异常患者降低其血脂提供一个独特有效的治疗效果。本文从ACLY的结构、生化反应作用机制等出发, 探讨了ACLY与脂质代谢的关系, 并简述了一些ACLY抑制剂的来源以及其设计思路。如今已有一些研究调查了ACLY的药理或遗传抑制是否可以在不增加不良作用的情况下降低血浆LDL-C的水平。未来的研究还需根据ACLY的作用机制, 探讨ACLY在代谢途径调节中的作用及其治疗潜力, 研究设计开发出更多安全高效的抑制剂从而达到更好的降血脂效果。
作者贡献:第一作者陈诗宇负责稿件的撰写和相关图的绘制; 并列第一作者赖伟华负责文献的调研整理和稿件的修改等工作; 通讯作者钟诗龙负责稿件整体的思路构想和稿件内容最终的修改定稿等工作。
利益冲突:本文的研究内容无任何利益冲突。
| [1] |
Liu S, Li Y, Zeng X, et al. Burden of cardiovascular diseases in China, 1990-2016: findings from the 2016 global burden of disease study[J]. JAMA Cardiol, 2019, 4: 342-352. DOI:10.1001/jamacardio.2019.0295 |
| [2] |
Virani SS, Alonso A, Benjamin EJ, et al. Heart disease and stroke statistics-2020 update: a report from the American Heart Association[J]. Circulation, 2020, 141: e139-e596. |
| [3] |
Ma LY, Chen WW, Gao RL, et al. China cardiovascular diseases report 2018: an updated summary[J]. J Geriatr Cardiol, 2020, 17: 1-8. |
| [4] |
Kong YY, Li GQ, Zhang WJ, et al. Nicotinamide phosphoribosyltransferase aggravates inflammation and promotes atherosclerosis in ApoE knockout mice[J]. Acta Pharmacol Sin, 2019, 40: 1184-1192. DOI:10.1038/s41401-018-0207-3 |
| [5] |
Afshinnia F, Pennathur S. Lipids and cardiovascular risk with CKD[J]. Clin J Am Soc Nephrol, 2020, 15: 5-7. DOI:10.2215/CJN.13531119 |
| [6] |
Ito F, Ito T. High-density lipoprotein (HDL) triglyceride and oxidized HDL: new lipid biomarkers of lipoprotein-related atherosclerotic cardiovascular disease[J]. Antioxidants (Basel), 2020, 9: 362. DOI:10.3390/antiox9050362 |
| [7] |
Feng X, Zhang L, Xu S, et al. ATP-citrate lyase (ACLY) in lipid metabolism and atherosclerosis: an updated review[J]. Prog Lipid Res, 2020, 77: 101006. DOI:10.1016/j.plipres.2019.101006 |
| [8] |
Bartlett J, Predazzi IM, Williams SM, et al. Is isolated low highdensity lipoprotein cholesterol a cardiovascular disease risk factor? New insights from the framingham offspring study[J]. Circ Cardiovasc Qual Outcomes, 2016, 9: 206-212. DOI:10.1161/CIRCOUTCOMES.115.002436 |
| [9] |
Generoso G, Janovsky CCPS, Bittencourt MS. Triglycerides and triglyceride-rich lipoproteins in the development and progression of atherosclerosis[J]. Curr Opin Endocrinol Diabetes Obes, 2019, 26: 109-116. DOI:10.1097/MED.0000000000000468 |
| [10] |
Zhu JR, Gao RL, Zhao SP, et al. Guidelines for the prevention and treatment of dyslipidemia in Chinese adults (revised in 2016)[J]. Chin Circ J(中国循环杂志), 2016, 16: 15-35. |
| [11] |
Zhang M, Deng Q, Wang L, et al. Prevalence of dyslipidemia and achievement of low-density lipoprotein cholesterol targets in Chinese adults: a nationally representative survey of 163641 adults[J]. Int J Cardiol, 2018, 260: 196-203. DOI:10.1016/j.ijcard.2017.12.069 |
| [12] |
Taylor FC, Huffman M, Ebrahim S. Statin therapy for primary prevention of cardiovascular disease[J]. JAMA, 2013, 310: 2451-2452. DOI:10.1001/jama.2013.281348 |
| [13] |
Bair TL, May HT, Knowlton KU, et al. Predictors of statin intolerance in patients with a new diagnosis of atherosclerotic cardiovascular disease within a large integrated health care institution: the IMPRES study[J]. J Cardiovasc Pharmacol, 2020, 75: 426-431. DOI:10.1097/FJC.0000000000000808 |
| [14] |
Lemus HN, Mendivil CO. Adenosine triphosphate citrate lyase: emerging target in the treatment of dyslipidemia[J]. J Clin Lipidol, 2015, 9: 384-389. DOI:10.1016/j.jacl.2015.01.002 |
| [15] |
Burke AC, Huff MW. ATP-citrate lyase: genetics, molecular biology and therapeutic target for dyslipidemia[J]. Curr Opin Lipidol, 2017, 28: 193-200. DOI:10.1097/MOL.0000000000000390 |
| [16] |
Pinkosky SL, Groot PHE, Lalwani ND, et al. Targeting ATPcitrate lyase in hyperlipidemia and metabolic disorders[J]. Trends Mol Med, 2017, 23: 1047-1063. DOI:10.1016/j.molmed.2017.09.001 |
| [17] |
Sun T, Hayakawa K, Fraser ME. ADP-Mg(2+) bound to the ATPgrasp domain of ATP-citrate lyase[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2011, 67: 1168-1172. DOI:10.1107/S1744309111028363 |
| [18] |
Sivanand S,Rhoades S,Jiang Q,et al. Mol Cell[J]. Nuclear acetyl-CoA production by ACLY promotes homologous recombination, 2017, 67: 252-265.e6. |
| [19] |
Hügler M, Sievert SM. Beyond the Calvin cycle: autotrophic carbon fixation in the ocean[J]. Ann Rev Mar Sci, 2011, 3: 261-289. DOI:10.1146/annurev-marine-120709-142712 |
| [20] |
Chypre M, Zaidi N, Smans K. ATP-citrate lyase: a mini-review[J]. Biochem Biophys Res Commun, 2012, 422: 1-4. DOI:10.1016/j.bbrc.2012.04.144 |
| [21] |
Wei J, Leit S, Kuai J, et al. An allosteric mechanism for potent inhibition of human ATP-citrate lyase[J]. Nature, 2019, 568: 566-570. DOI:10.1038/s41586-019-1094-6 |
| [22] |
Verschueren KHG, Blanchet C, Felix J, et al. Structure of ATP citrate lyase and the origin of citrate synthase in the Krebs cycle[J]. Nature, 2019, 568: 571-575. DOI:10.1038/s41586-019-1095-5 |
| [23] |
Sun T, Hayakawa K, Bateman KS, et al. Identification of the citrate-binding site of human ATP-citrate lyase using X-ray crystallography[J]. J Biol Chem, 2010, 285: 27418-27428. DOI:10.1074/jbc.M109.078667 |
| [24] |
Granchi C. ATP citrate lyase (ACLY) inhibitors: an anti-cancer strategy at the crossroads of glucose and lipid metabolism[J]. Eur J Med Chem, 2018, 157: 1276-1291. DOI:10.1016/j.ejmech.2018.09.001 |
| [25] |
Zu XY, Zhang QH, Liu JH, et al. ATP citrate lyase inhibitors as novel cancer therapeutic agents[J]. Recent Pat Anticancer Drug Discov, 2012, 7: 154-167. DOI:10.2174/157489212799972954 |
| [26] |
Fan F, Williams HJ, Boyer JG, et al. On the catalytic mechanism of human ATP citrate lyase[J]. Biochemistry, 2012, 51: 5198-5211. DOI:10.1021/bi300611s |
| [27] |
Wang Q, Li S, Jiang L, et al. Deficiency in hepatic ATP-citrate lyase affects VLDL-triglyceride mobilization and liver fatty acid composition in mice[J]. J Lipid Res, 2010, 51: 2516-2526. DOI:10.1194/jlr.M003335 |
| [28] |
Wei X, Schultz K, Bazilevsky GA, et al. Molecular basis for acetyl-CoA production by ATP-citrate lyase[J]. Nat Struct Mol Biol, 2020, 27: 33-41. DOI:10.1038/s41594-019-0351-6 |
| [29] |
Singh P, Saxena R, Srinivas G, et al. Cholesterol biosynthesis and homeostasis in regulation of the cell cycle[J]. PLoS One, 2013, 8: e58833. DOI:10.1371/journal.pone.0058833 |
| [30] |
Gunasekaran B, Shukor MY. HMG-CoA reductase as target for drug development[J]. Methods Mol Biol, 2020, 2089: 245-250. |
| [31] |
Kuhajda FP. Fatty-acid synthase and human cancer: new perspectives on its role in tumor biology[J]. Nutrition, 2000, 1: 202-208. |
| [32] |
Unterlass JE, Curtin NJ. Warburg and Krebs and related effects in cancer[J]. Expert Rev Mol Med, 2019, 21: e4. DOI:10.1017/erm.2019.4 |
| [33] |
Hatzivassiliou G, Zhao F, Bauer DE, et al. ATP citrate lyase inhibition can suppress tumor cell growth[J]. Cancer Cell, 2005, 8: 311-321. DOI:10.1016/j.ccr.2005.09.008 |
| [34] |
Turyn J, Schlichtholz B, Dettlaff-Pokora A, et al. Increased activity of glycerol 3-phosphate dehydrogenase and other lipogenic enzymes in human bladder cancer[J]. Horm Metab Res, 2003, 35: 565-569. DOI:10.1055/s-2003-43500 |
| [35] |
Szutowicz A, Kwiatkowski J, Angielski S. Lipogenetic and glycolytic enzyme activities in carcinoma and nonmalignant diseases of the human breast[J]. Br J Cancer, 1979, 39: 681-687. DOI:10.1038/bjc.1979.120 |
| [36] |
Beckner ME, Fellows-Mayle W, Zhang Z, et al. Identification of ATP citrate lyase as a positive regulator of glycolytic function in glioblastomas[J]. Int J Cancer, 2010, 126: 2282-2295. |
| [37] |
Xin M, Qiao Z, Li J, et al. miR-22 inhibits tumor growth and metastasis by targeting ATP citrate lyase: evidence in osteosarcoma, prostate cancer, cervical cancer and lung cancer[J]. Oncotarget, 2016, 7: 44252-44265. DOI:10.18632/oncotarget.10020 |
| [38] |
Bauer DE, Hatzivassiliou G, Zhao F, et al. ATP citrate lyase is an important component of cell growth and transformation[J]. Oncogene, 2005, 24: 6314-6322. DOI:10.1038/sj.onc.1208773 |
| [39] |
Cheng C, Geng F, Cheng X, et al. Lipid metabolism reprogramming and its potential targets in cancer[J]. Cancer Commun (Lond), 2018, 38: 27. DOI:10.1186/s40880-018-0301-4 |
| [40] |
Watson JA, Fang M, Lowenstein JM. Tricarballylate and hydroxycitrate: substrate and inhibitor of ATP: citrate oxaloacetate lyase[J]. Arch Biochem Biophys, 1969, 135: 209-217. DOI:10.1016/0003-9861(69)90532-3 |
| [41] |
Cheema-Dhadli S, Halperin ML, Leznoff CC. Inhibition of enzymes which interact with citrate by(-) hydroxycitrate and 1,2,3,-tricarboxybenzene[J]. Eur J Biochem, 1973, 38: 98-102. DOI:10.1111/j.1432-1033.1973.tb03038.x |
| [42] |
Hamilton JG, Sullivan AC, Kritchevsky D, et al. Hupolipidemic activity of(-)-hydroxycitrate[J]. Lipids, 1977, 12: 1-9. DOI:10.1007/BF02532964 |
| [43] |
Sullivan AC, Singh M, Srere PA, et al. Reactivity and inhibitor potential of hydroxycitrate isomers with citrate synthase, citrate lyase, and ATP citrate lyase[J]. J Biol Chem, 1977, 252: 7583-7590. DOI:10.1016/S0021-9258(17)41006-4 |
| [44] |
van Loon LJ, van Rooijen JJ, Niesen B, et al. Effects of acute(-)-hydroxycitrate supplementation on substrate metabolism at rest and during exercise in humans[J]. Am J Clin Nutr, 2000, 72: 1445-1450. DOI:10.1093/ajcn/72.6.1445 |
| [45] |
Berkhout TA, Havekes LM, Pearce NJ, et al. The effect of(-)-hydroxycitrate on the activity of the low-density-lipoprotein receptor and 3-hydroxy-3-methylglutaryl-CoA reductase levels in the human hepatoma cell line Hep G2[J]. Biochem J, 1990, 272: 181-186. DOI:10.1042/bj2720181 |
| [46] |
Atkinson LL, Kelly SE, Russell JC, et al. MEDICA 16 inhibits hepatic acetyl-CoA carboxylase and reduces plasma triacylglycerol levels in insulin-resistant JCR: LA-cp rats[J]. Diabetes, 2002, 51: 1548-1555. DOI:10.2337/diabetes.51.5.1548 |
| [47] |
Kanao T, Fukui T, Atomi H, et al. Kinetic and biochemical analyses on the reaction mechanism of a bacterial ATP-citrate lyase[J]. Eur J Biochem, 2002, 269: 3409-3416. DOI:10.1046/j.1432-1033.2002.03016.x |
| [48] |
Bar-Tana J, Ben-Shoshan S, Blum J, et al. Synthesis and hypolipidemic and antidiabetogenic activities of beta, beta, beta', beta'-tetrasubstituted, long-chain dioic acids[J]. J Med Chem, 1989, 32: 2072-2084. DOI:10.1021/jm00129a010 |
| [49] |
Rose-Kahn G, Bar-Tana J. Inhibition of lipid synthesis by beta beta'-tetramethyl-substituted, C14-C22, alpha, omega-dicarboxylic acids in cultured rat hepatocytes[J]. J Biol Chem, 1985, 260: 8411-8415. DOI:10.1016/S0021-9258(17)39489-9 |
| [50] |
Rose-Kahn G, Bar-Tana J. Inhibition of rat liver acetyl-CoA carboxylase by beta, beta'-tetramethyl-substituted hexadecanedioic acid (MEDICA 16)[J]. Biochim Biophys Acta, 1990, 1042: 259-264. DOI:10.1016/0005-2760(90)90018-S |
| [51] |
Saxty BA, Novelli R, Dolle RE, et al. Synthesis and evaluation of (+) and (-)-2,2-difluorocitrate as inhibitors of rat-liver ATPcitrate lyase and porcine-heart aconitase[J]. Eur J Biochem, 1991, 202: 889-896. DOI:10.1111/j.1432-1033.1991.tb16448.x |
| [52] |
Dolle RE, McNair D, Hughes MJ, et al. ATP-citrate lyase as a target for hypolipidemic intervention. Sulfoximine and 3-hydroxy-beta-lactam containing analogues of citric acid as potential tight-binding inhibitors[J]. J Med Chem, 1992, 35: 4875-4884. DOI:10.1021/jm00104a014 |
| [53] |
Brusilow WS, Peters TJ. Therapeutic effects of methionine sulfoximine in multiple diseases include and extend beyond inhibition of glutamine synthetase[J]. Expert Opin Ther Targets, 2017, 21: 461-469. DOI:10.1080/14728222.2017.1303484 |
| [54] |
Chan GW, Francis T, Thureen DR. Purpurone, an inhibitor of ATP-citrate lyase: a novel alkaloid from the marine sponge Iotrochota sp[J]. J Org Chem, 1993, 58: 2544-2546. DOI:10.1021/jo00061a031 |
| [55] |
Li Q, Fan A, Lu Z, et al. One-pot AgOAc-mediated synthesis of polysubstituted pyrroles from primary amines and aldehydes: application to the total synthesis of purpurone[J]. Org Lett, 2010, 12: 4066-4069. DOI:10.1021/ol101644g |
| [56] |
al-Shurbaji A, Skorve J, Berge RK, et al. Effect of 3-thiadicarboxylic acid on lipid metabolism in experimental nephrosis[J]. Arterioscler Thromb, 1993, 13: 1580-1586. DOI:10.1161/01.ATV.13.11.1580 |
| [57] |
Berge RK, Aarsland A, Kryvi H, et al. Alkylthioacetic acid (3-thia fatty acids)-a new group of non-β-oxidizable, peroxisomeinducing fatty acid analogues. I. A study on the structural requirements for proliferation of peroxisomes and mitochondria in rat liver[J]. Biochim Biophys Acta, 1989, 1004: 345-356. DOI:10.1016/0005-2760(89)90083-0 |
| [58] |
Oleynek JJ, Barrow CJ, Burns MP, et al. Anthrones, naturally occurring competitive inhibitors of adenosine-triphosphate-citrate lyase[J]. Drug Dev Res, 1995, 36: 35-42. DOI:10.1002/ddr.430360106 |
| [59] |
Dolle RE, Gribble A, Wilkes T, et al. Synthesis of novel thiolcontaining citric acid analogs. Kinetic evaluation of these and other potential active-site-directed and mechanism-based inhibitors of ATP citrate lyase[J]. J Med Chem, 1995, 38: 537-543. DOI:10.1021/jm00003a016 |
| [60] |
Li JJ, Wang H, Tino JA, et al. 2-Hydroxy-N-arylbenzenesulfonamides as ATP-citrate lyase inhibitors[J]. Bioorg Med Chem Lett, 2007, 17: 3208-3211. DOI:10.1016/j.bmcl.2007.03.017 |
| [61] |
Gribble AD, Ife RJ, Shaw A, et al. ATP-citrate lyase as a target for hypolipidemic intervention. 2. Synthesis and evaluation of (3R,5S)-omega-substituted-3-carboxy-3,5-dihydroxyalkanoic acids and their gamma-lactone prodrugs as inhibitors of the enzyme in vitro and in vivo[J]. J Med Chem, 1998, 41: 3582-3595. DOI:10.1021/jm980091z |
| [62] |
Gribble AD, Dolle RE, Shaw A, et al. ATP-citrate lyase as a target for hypolipidemic intervention. Design and synthesis of 2-substituted butanedioic acids as novel, potent inhibitors of the enzyme[J]. J Med Chem, 1996, 39: 3569-3584. DOI:10.1021/jm960167w |
| [63] |
Istvan ES, Deisenhofer J. Structural mechanism for statin inhibition of HMG-CoA reductase[J]. Science, 2001, 292: 1160-1164. DOI:10.1126/science.1059344 |
| [64] |
Cheng H, Nie R, Wang WQ, et al. Research progress on structural modification of antimycin A[J]. Chin J Org Chem(有机化学), 2017, 37: 1368-1381. |
| [65] |
Schilling G, Berti D, Kluepfel D. Antimycin A components. II. Identification and analysis of antimycin A fractions by pyrolysisgas liquid chromatography[J]. J Antibiot (Tokyo), 1970, 23: 81-90. DOI:10.7164/antibiotics.23.81 |
| [66] |
Barrow CJ, Oleynek JJ, Marinelli V, et al. Antimycins, inhibitors of ATP-citrate lyase, from a Streptomyces sp[J]. J Antibiot (Tokyo), 1997, 50: 729-733. DOI:10.7164/antibiotics.50.729 |
| [67] |
Pearce NJ, Yates JW, Berkhout TA, et al. The role of ATP citrate-lyase in the metabolic regulation of plasma lipids. Hypolipidaemic effects of SB-204990, a lactone prodrug of the potent ATP citrate-lyase inhibitor SB-201076[J]. Biochem J, 1998, 334: 113-119. DOI:10.1042/bj3340113 |
| [68] |
Gribble AD, Groot PHE, Shaw AN, et al. Phenylderivate as inhibitors of ATP citrate lyase: US, 5447954[P]. 1995-9-5.
|
| [69] |
Atsushi H, Koichiro T, Shigeru U, et al. ATP-citrate lyase inhibiting substances of BE-063437 type and method for producing the same: JP, 2001261682[P]. 2001-09-26.
|
| [70] |
Burke AC, Telford DE, Huff MW. Bempedoic acid: effects on lipoprotein metabolism and atherosclerosis[J]. Curr Opin Lipidol, 2019, 30: 1-9. DOI:10.1097/MOL.0000000000000565 |
| [71] |
Pinkosky SL, Newton RS, Day EA, et al. Liver-specific ATPcitrate lyase inhibition by bempedoic acid decreases LDL-C and attenuates atherosclerosis[J]. Nat Commun, 2016, 7: 13457. DOI:10.1038/ncomms13457 |
| [72] |
Ray KK, Laufs U, Cosentino F, et al. The year in cardiology: cardiovascular prevention[J]. Eur Heart J, 2020, 41: 1157-1163. DOI:10.1093/eurheartj/ehz929 |
| [73] |
Thompson PD, Rubino J, Janik MJ, et al. Use of ETC-1002 to treat hypercholesterolemia in patients with statin intolerance[J]. J Clin Lipidol, 2015, 9: 295-304. DOI:10.1016/j.jacl.2015.03.003 |
| [74] |
Samsoondar JP, Burke AC, Sutherland BG, et al. Prevention of diet-induced metabolic dysregulation, inflammation, and atherosclerosis in ldlr(-/-) mice by treatment with the ATP-citrate lyase inhibitor bempedoic acid[J]. Arterioscler Thromb Vasc Biol, 2017, 37: 647-656. DOI:10.1161/ATVBAHA.116.308963 |
| [75] |
Burke AC, Telford DE, Sutherland BG, et al. Bempedoic acid lowers low-density lipoprotein cholesterol and attenuates atherosclerosis in low-density lipoprotein receptor-deficient (LDLR(+/-) and LDLR(-/-)) yucatan miniature pigs[J]. Arterioscler Thromb Vasc Biol, 2018, 38: 1178-1190. DOI:10.1161/ATVBAHA.117.310676 |
| [76] |
Filippov S, Pinkosky SL, Newton RS. LDL-cholesterol reduction in patients with hypercholesterolemia by modulation of adenosine triphosphate-citrate lyase and adenosine monophosphateactivated protein kinase[J]. Curr Opin Lipidol, 2014, 25: 309-315. DOI:10.1097/MOL.0000000000000091 |
| [77] |
Bove M, Cicero AFG, Borghi C, et al. Emerging drugs for the treatment of hypercholesterolemia[J]. Expert Opin Emerg Drugs, 2019, 24: 63-69. DOI:10.1080/14728214.2019.1591372 |
| [78] |
Sharpe LJ, Brown AJ. Controlling cholesterol synthesis beyond 3-hydroxy-3-methylglutaryl-CoA reductase (HMGCR)[J]. J Biol Chem, 2013, 288: 18707-18715. DOI:10.1074/jbc.R113.479808 |
| [79] |
Ballantyne CM, Davidson MH, Macdougall DE, et al. Efficacy and safety of a novel dual modulator of adenosine triphosphatecitrate lyase and adenosine monophosphate-activated protein kinase in patients with hypercholesterolemia[J]. J Am Coll Cardiol, 2013, 62: 1154-1162. DOI:10.1016/j.jacc.2013.05.050 |
| [80] |
Elam MB, Majumdar G, Mozhui K, et al. Patients experiencing statin-induced myalgia exhibit a unique program of skeletal muscle gene expression following statin re-challenge[J]. PLoS One, 2017, 12: e0181308. DOI:10.1371/journal.pone.0181308 |
| [81] |
Ference BA, Ray KK, Catapano AL, et al. Mendelian randomization study of ACLY and cardiovascular disease[J]. N Engl J Med, 2019, 380: 1033-1042. DOI:10.1056/NEJMoa1806747 |
| [82] |
Ray KK, Bays HE, Catapano AL, et al. Safety and efficacy of bempedoic acid to reduce LDL cholesterol[J]. N Engl J Med, 2019, 380: 1022-1032. DOI:10.1056/NEJMoa1803917 |
 2021, Vol. 56
2021, Vol. 56


