2. 浙江省医学科学研究院, 浙江 杭州 310013
2. Zhejiang Academy of Medical Sciences, Hangzhou 310013, China
高脂血症(hyperlipidemia)是一种体内血脂异常的疾病, 常表现为总胆固醇(total cholesterol, TC)和/或甘油三酯(triglycerides, TG)异常升高, 并伴有高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)水平异常等征状[1], 高脂血症作为一种脂质代谢失调疾病, 可引发多种心血管疾病, 如冠心病、脑卒中、动脉粥样硬化等[2]。目前, 他汀类药物是临床一线用药, 对于降低TC和LDL-C具有较好疗效, 但长期服用他汀类药物具有肌肉毒性和肝脏毒性[3]。中药因其疗效稳定、作用温和等优点日益受到研究者关注。然而, 中药由于成分复杂, 作用靶点较多[4], 降脂作用机制目前并不明确, 限制了其在临床上的使用。脂质组学是对细胞、组织、生物流体中的脂质进行定性定量分析的一门学科[5]。采用脂质组学方法, 研究中药降脂前后生物体内的脂质变化, 有利于探究中药降脂作用。作者总结了近年来脂质组学方法在研究中药降脂作用中的应用, 拟为未来采用脂质组学方法进行中药降脂作用研究提供参考依据。
1 高脂血症及中药治疗高脂血症威胁着人类健康, 它是体内脂肪代谢或转运异常所导致的血浆中一种或几种脂质高于正常的疾病, 常分为高胆固醇血症、高甘油三酯血症和混合型高脂血症(同时表现高胆固醇血症和高甘油三酯血症)[1], 是导致各种心血管疾病的重要危险因素[2]。高脂血症常伴有LDL-C和/或HDL-C水平异常[1]。
目前临床上应用的化药降脂药有他汀类、贝特类、胆酸鳌合剂和烟酸等, 尤以他汀类、贝特类为常用[6]。他汀类主要降低TC、LDL-C, 是临床上一线药物, 贝特类升高HDL-C和降TG作用优于他汀类[3], 但是这些降脂药都具有一定的不良反应[7]。鉴于中医中药能从整体对生物系统进行调控, 具有降脂疗效确切、不良反应少、作用温和等优点[8], 不少学者热衷于中药降脂的研究。
降脂中药的应用形式有单味中药、中药复方[9]。单味中药治疗高血脂症的研究非常多, 如泽泻[10]、麦冬[11]、姜黄[12]、云南茜草[13]、刺五加[14]、银杏叶[15]、绞股蓝[16]、三七[17]、黄连[18]等都证实有降脂作用。运用中药复方治疗高脂血症的研究亦较多, 如血脂康、地奥心血康、复方丹茶胶囊、复方芪参降脂饮、加味复方血脂清、通脉降脂口服液等[9]。
2 脂质组学脂质组学是研究生物体系中脂质及脂质相互作用的一门学科, 近年来在疾病诊断和治疗、营养与健康、食品科学研究中得到了广泛应用。脂质组学分析方法包括色谱法、核磁共振波谱法、基于质谱的分析方法。
2.1 脂质与脂质组学广义上, 脂质可定义为疏水性或两亲性小分子[19], 它由极性不同、理化性质不同和生物活性不同的多种亚类构成[20]。脂质的结构和性质复杂多样[21], 2005年, LIPID MAPS定义了一种系统的命名规则, 将脂质分为八类: 脂肪酸类、甘油脂类、甘油磷脂类、鞘脂类、糖脂类、固醇脂类、聚酮类以及孕烯醇酮脂类[19]。脂质在人体中发挥着重要的生物作用, 如储存能量、氧化供能、参与构成生物膜、参与细胞信号的转导[22, 23]等。
2003年, 文献[24]中正式定义了“脂质组学”这一术语。脂质组学是对生物系统中脂质的大规模研究, 包括细胞、组织、生物或生态系统中的脂质, 是“代谢组学”的一个分支[5]。由于脂质对人类的健康发挥着重要的作用[25], 脂质的失调与人类疾病有着密切的关系[26, 27, 28], 依托于质谱技术革新[29], 脂质组学近年来得到快速发展。
2.2 脂质组学分析方法 2.2.1 色谱法在质谱技术未成熟之前, 薄层色谱法、气相色谱法和高效液相色谱法在很长一段时间都用于分析各种类型的脂质[30]。其中, 气相色谱法是脂肪酸分析的常规方法, 但是这些方法的灵敏度往往较差, 通量较低[20], 在应用中受到限制。
2.2.2 核磁共振波谱法核磁共振波谱法(nuclear magnetic resonance spectroscopy, NMR)中的1H NMR和13C NMR可用于阐明经过纯化的脂质的分子结构[30], 1H NMR适用于分析生物流体、细胞、组织中的多种脂质, 该方法可用于脂质定量且可重复性好。Srivastava等[31]使用1H NMR法对杜兴氏肌营养不良症患者血清和血浆中的磷脂、TG、TC进行了定性和定量分析。由于NMR呈线性响应, 单个内标就足以定量分析所有脂质。
31P NMR适用于检测组织和体液中的磷脂, 由于其线性响应和检测速度相对较快的优点, 在保持样品高通量的同时能保证分析的准确性与选择性, 但是, 检测水溶液中的脂质时存在谱线变宽和分辨率变差的问题。Kato等[32]采用31P NMR方法, 使用单一内标, 对猪脑、酵母菌和大豆的极性脂质提取物中的磷脂进行了绝对定量分析。在磷脂样品中加入乙二胺四乙酸和胆酸钠复合溶剂后, NMR的谱线宽得到改善、分辨信号更强, 有利于磷脂的分析。
使用NMR方法, 能直接测量脂质样品且不破坏样品, 能使用单一内标对脂质进行定量, 但是某些条件下脂质的NMR谱线变宽、分辨率变差限制了其应用。使用NMR对脂质进行检测时, 由于分析物未经色谱分离, 高丰度脂质如胆碱等在NMR谱图中占主导地位, 导致低丰度脂质的检测受限。而且, 与质谱相比, NMR只具备中等灵敏度, 因此使用受限。
2.2.3 基于质谱的分析方法目前, 脂质组学的研究主要依托于质谱技术, 质谱(mass spectrometry, MS)具有质量精度高、覆盖度高、样品消耗少等优点, 因此得到广泛应用[33]。基于质谱的脂质组学分析方法包括直接输注质谱法、色谱质谱联用法、质谱成像法[34, 35]。
直接输注质谱法指不经任何分离技术, 样品直接输入质谱仪进行分析的方法。直接输注最初是用来高效地输送脂质样品、避免因浓度变化、色谱异常、离子对的改变等引起的差异, 亦称作鸟枪脂质组学[36]。鸟枪脂质组学原则上最大限度地利用每个脂类和每个脂质分子独特的化学和物理性质, 对生物样品中经有机溶剂提取后的脂质进行高通量分析[35]。鸟枪脂质组学方法提供了稳定的电离环境, 有利于脂质的准确定量, 但是, 由于未经色谱分离, 鸟枪脂质组学方法对于低丰度、电离较弱的脂质的分析并不理想[37]。
色谱质谱联用法利用色谱的分离能力和质谱的高灵敏度实现对脂质的深度分析[34]。气相色谱质谱联用(gas chromatography-mass spectrometry, GC-MS)方法适用于易挥发的或衍生化之后易挥发的脂质分子的分析, 如脂肪酸类物质[38]。液相色谱质谱联用(liquid chromatography-mass spectrometry, LC-MS)方法是目前使用最广泛的脂质组学分析方法。LC-MS的主要优势在于其相对广泛的分离模式, 几乎对现有所有类型的脂质及其异构体都能够进行分离分析。通过正相液相色谱和亲水性液相色谱, 极性部分或“头基”不同的脂质得到分离。通过反相液相色谱, 酰基链疏水性不同的脂质得到分离[39], 反相液相色谱是目前最常用的分离模式。目前LC-MS的趋势是使用超高效液相色谱(ultra high performance liquid chromatography, UHPLC)与质谱联用[34], 其分析时间短, 灵敏度更高, 分离度更好。
质谱成像法中基质辅助激光解吸/电离质谱法最常用, 适用于分析生物组织和细胞, 能提供关于单个脂质化合物的空间分布信息[40]。
2.3 基于质谱的脂质组学分析流程质谱方法是迄今为止最常用的脂质组学分析方法, 基于质谱的脂质组学的工作流程分为样品前处理、数据采集、数据处理三大步骤[41]。
2.3.1 样品前处理供脂质分析的生物样品有血液、尿液、唾液、组织、细胞培养液等[35], 提取样品中脂质时, 通常用到单一有机溶剂萃取、液液萃取和固相萃取等方法, 液液萃取是脂质提取时使用最为广泛的方法, 主要包括Floch法[42]、Bligh-Dyer法[43]和甲基叔丁基醚(methyl-tert-butyl ether, MTBE)法[44]等, 适用于提取各种类型脂质。
2.3.2 数据采集脂质组学数据采集可分为非靶向和靶向采集策略[34]。非靶向脂质组学策略无偏倚地对生物样品中整体脂质的变化进行分析, 依托于高分辨质谱仪, 能对整体脂质进行定性和相对定量, 最大程度地反映样品中脂质的变化规律和趋势, 适用于建立脂质轮廓谱。在非靶向脂质组学研究中, 通常联合使用高分辨质谱检测器, 采用数据独立采集或数据依赖性采集方法进行质谱分析[45-47]。
靶向脂质组学策略主要针对某一类或某几类目标脂质进行准确的定性定量分析, 具有高灵敏度和高特异性的特点, 常用于关键代谢通路或靶标的分析或验证。在靶向脂质定性和定量研究中, 基于超高效液相色谱串联三重四极杆质谱的分析方法最常使用, 在该分析方法中, 通常使用多反应监测(multiple reaction monitoring, MRM)模式进行数据采集[48, 49]。
2.3.3 脂质结构鉴定各类脂质化学结构各异, 在鉴定脂质结构时应确定其基本骨架、脂肪酰基链的组成和不饱和度并区分其异构体。在基于质谱的脂质组学中, 一般将样品直接输注质谱仪或预先进行色谱分离再进行质谱分析, 采用碰撞诱导解离或高能碰撞解离对脂质分子进行碎裂, 采用不同的扫描模式, 获取其前体离子和产物离子信息, 将其多级碎裂谱图与标准品谱图进行比对, 或者输入到现有的脂质谱图数据库中进行匹配, 从而推断出该脂质的类别和结构信息。
由于脂质具有不同的亚类, 结构复杂多样, 存在由于酰基链连接位置不同而形成的异构体, 双键的数量和位置不同而形成的异构体, 官能团立体异构, 区分和确定这些结构成为脂质鉴定的难点之一。
对于这些异构体, 可以通过分析二级质谱图中特征碎片离子的相对强度进行区分或鉴定, 通过此方法可区分sn位脂酰基位置异构的溶血磷脂[50]; 通过光化学Paternò-Büchi反应和串联质谱法可对脂质分子中的双键的位置和数量进行鉴定[51]。此外, 在鉴定脂质结构时, 有必要排除同位素峰, 降低鉴定的假阳性率。
2.3.4 数据处理脂质组学数据处理可分为质谱数据的处理和统计分析两大部分。质谱数据处理包括多个步骤, 如峰过滤、峰对齐和数据归一化等[52], 最终报告包括提取的质荷比、保留时间以及所有检测到的峰的面积[53-55]。然后, 对这些数据进行统计分析, 包括统计学检验分析和多元统计分析[54], 以此筛选差异代谢物进行脂质网络通路的生物信息学分析, 大多数已存在的通路工具如KEGG、Ingenuity和MetaCore等都适用于输出脂质代谢的网络通路[52]。
3 脂质组学在中药降脂作用研究中的应用虽然中药降脂疗效稳定, 不良反应小, 已有较多应用, 但是缺乏客观可视的证据证明中医药的疗效, 缺少现代语言阐明其物质基础和作用机制[56], 给中药降脂研究带来了很多困难。中药降脂过程中, 生理病理状态发生动态变化, 脂质组也随之发生动态变化[57], 脂质组学能提供药物作用前后的脂质变化情况, 由此揭示可能的药物作用机制[58], 为药物治疗提供潜在的作用靶点, 为深入研究中药降脂提供有效方法。
3.1 基于鸟枪脂质组学方法的中药降脂作用研究Shon等[59]基于鸟枪脂质组学方法揭示了人参皂苷compound K (CK)对高脂饮食诱导的肥胖小鼠的降脂作用。该研究者提取人参皂苷CK组分, 应用于高脂血症的小鼠, 取各组小鼠血清通过MTBE液液萃取法提取脂质, 直接输注到电喷雾-离子阱质谱进行分析, 检测正常饮食喂养的小鼠和高脂饮食喂养的小鼠血清中的脂质代谢物, 共检测到250个代谢物。通过多变量分析筛选出33个差异代谢物, 属于TG、胆固醇酯(cholesteryl ester, CE)、磷脂酰胆碱(phosphatidylcholine, PC)和溶血磷脂酰胆碱(lysophosphatidylcholine, LPC)四大类。总碳数高(大于50)和总碳数低(小于50)的甘油三酯与高脂饮食诱发的肥胖症分别呈负相关和正相关。将人参皂苷CK喂给食用高脂饮食的肥胖小鼠时, 小鼠的体重、肝重、肾脂肪重量、皮下脂肪重量、TC、TG、LDL-C显著降低, 肝脏组织中脂滴数量明显降低, 人参皂苷CK能回调LPC和CE类脂质到正常水平, 研究者进一步筛选出了4种潜在的生物标志物, 如图 1所示, LPC 20:4、LPC 22:6、CE 20:3和CE 20:4, 它们是人参皂苷CK降脂的重要标志物, 与小鼠生化指标有强烈的相关性。

|
Figure 1 Box-and-whisker plots showing compounds, the levels of which differed significantly among the normal diet (ND), high-fat diet(HFD), and high-fat diet+compound K-reinforced ginsenosides (HFD+CK) groups.The Y-axis indicates the mass peak intensity.n=7, x±s.**P < 0.01, ***P < 0.001 vs ND[59] |
非靶向脂质组学方法能无偏倚地对样本中的脂质进行分析, 覆盖面广, 鉴定脂质数量多, 有利于分析整体脂质谱以筛选出生物标志物, 在中药降脂研究中得到了广泛应用, 是目前研究中药降脂作用的主流脂质组学分析方法。
Deng等[60]采用基于超高效液相色谱-质谱(ultra high performance liquid chromatography-mass spec‐trometry, UHPLC-MS)的非靶向脂质组学方法分析了参苓白术散治疗高脂血症大鼠时肝脏脂质的变化。参苓白术散是由10种中药组成的复方颗粒, 口服给药于高脂饮食喂养的Wistar大鼠, 机体生化指标及组织学变化结果表明参苓白术散对非酒精性脂肪肝有一定的保护作用。参苓白术散显著降低了大鼠的体重、肝重, 升高了因高脂饮食降低的肝血流量, 减少了脂肪蓄积, 改善了肝组织形态, 改善了由高脂饮食引起的反常的脂质生化指标。采用液液萃取的方法提取大鼠肝脏中的脂质, 采用UHPLC-MS质谱联用技术在正负离子模式下进行分析, 鉴定了1 055种脂质化合物, 参苓白术散调控了被高脂饮食改变的30种差异性脂质, 差异性脂质分别属于甘油磷脂类、甘油脂类、鞘脂类。通路分析表明, 甘油磷脂代谢和甘油脂质代谢是参苓白术散抗非酒精性脂肪肝、发挥降脂作用的潜在通路。
Zhai等[61]利用脂质组学、血清药物化学和网络药理学方法探究了青钱柳叶改善小鼠血脂异常的作用机制, 如图 2所示。青钱柳叶是一种凉茶, 具有降血脂作用[62], 研究者将青钱柳叶提取物口服给药于高脂饮食喂养的C57BL/6J小鼠, 采用Floch液液萃取法提取血清中的脂质, 进行LC-MS分析, 发现在青钱柳叶治疗之后, 30种脂质, 包括胆固醇酯、甘油二酯、磷脂酰乙醇胺、磷脂酰胆碱和鞘磷脂的含量水平得到调控, 青钱柳叶治疗的小鼠的血清和肝脏中TG、TC、LDL-C和HDL-C的水平得到改善。基于KEGG数据库的通路分析表明, 青钱柳叶调节脂质的代谢途径包括花生四烯酸代谢、胆汁酸生物合成、脂肪酸生物合成、甘油磷脂代谢、糖脂代谢、亚油酸代谢和饱和脂肪酸氧化等途径。研究者同时测定了青钱柳叶中的14种活性成分, 通过网络药理学预测了青钱柳叶活性成分发挥作用的蛋白靶点, 有ALOX12、APP、BCL2、CYP2C9、PTPN1, 并预测了代谢谱中脂质相关的蛋白靶点, 有PLD2、PLA2G (s)和PI3K (s), 结果表明青钱柳叶可能通过作用于以上蛋白靶点治疗糖尿病导致的血脂异常。
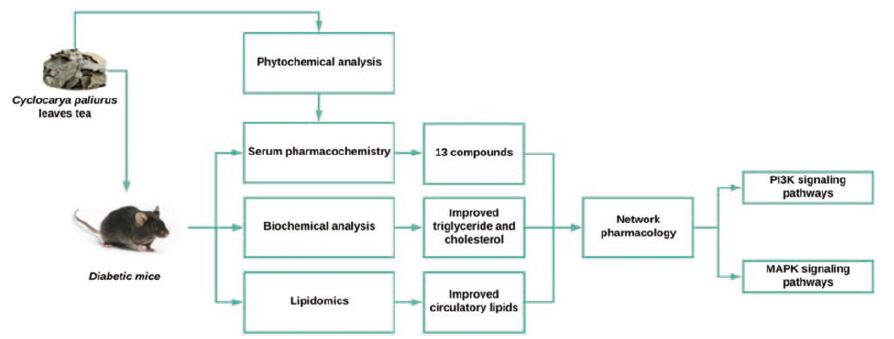
|
Figure 2 Work flow of the evaluation of the effects and mechanisms of Cyclocarya paliurus leaves tea on dyslipidemia in diabetic mice[61] |
Miao等[63]采用基于超高效液相色谱-四极杆时间飞行高清质谱串联的技术对血浆脂质样品进行了分析, 通过色谱、质荷比、离子淌度三个维度的分离, 研究了高脂饮食诱导的大鼠脂质代谢产物的变化, 并探讨了茯苓治疗大鼠高脂血症的作用机制。将茯苓灌胃于高脂饮食喂养的大鼠, 采用甲醇/氯仿混合溶剂提取血浆脂质进行LC-MS分析。与高脂组相比, 茯苓降低了大鼠血浆中的TC、TG和LDL-C水平, 提高了HDL-C水平, 有效逆转了脂质的反常。与正常组相比, 从高脂组血浆中发现了22个差异脂质, 包括11个脂肪酸、5个固醇、2个甘油磷脂、2个鞘脂、1个甘油酯和1个孕烯醇酮脂化合物, 茯苓回调了其中的19个脂质, 其中7个恢复或接近正常水平, 茯苓治疗可显著改善高脂血症及脂质代谢物的异常。
Zhang等[64]研究了雷公藤红素对脂质代谢的调节作用, 雷公藤红素是从雷公藤提取物中分离的蛋白酶体抑制剂, 能调节肥胖相关的代谢失调。研究者采用超高效液相色谱-电喷雾四极杆飞行时间质谱法技术对雷公藤红素处理的3T3-L1脂肪细胞和小鼠血清进行了脂质组学分析, 采用液液萃取方法提取细胞和血清中的脂质, 从3T3-L1细胞中鉴定出86个差异代谢物, 包括43个磷脂酰胆碱、10个鞘磷脂、16个磷脂酰乙醇胺和其他脂质分子。在雷公藤红素作用下, 3T3-L1脂肪细胞中的大多数脂质均显著降低, 雷公藤红素显著抑制了3T3-L1细胞向脂肪细胞的分化。雷公藤红素处理可以降低正常小鼠血清中溶血磷脂酰胆碱、磷脂酰胆碱、鞘磷脂的水平, 雷公藤红素增强了小鼠的脂质代谢。脂质组学分析表明雷公藤红素通过调节与脂质生物合成和代谢相关的基因来促进体内脂质的稳态, 可用于修复肥胖相关代谢疾病中的脂质代谢异常。
3.2.2 基于靶向LC-MS脂质组学方法的中药降脂作用研究Shi等[65]采用UHPLC-MS靶向脂质组学方法分析了小鼠血清中脂质的变化, 探究了苦丁茶中的三萜皂苷成分对高脂饮食引起的高脂血症的预防作用。苦丁茶显著降低了高脂饮食小鼠血清中的TC、LDL-C、动脉粥样硬化指数。研究者基于质谱MRM模式对血清中溶血磷脂类脂质(lysoglycerophospholipids, Lyso-GPLs)进行了靶向分析。Lyso-GPLs类脂质分为溶血磷脂酰胆碱(lysophosphatidylcholine, LPC)、溶血磷脂酸(lysophosphatidic acid, LPA)、溶血磷脂酰乙醇胺(lysophosphatidylethanolamine, LPE)、溶血磷脂酰丝氨酸(lysophosphatidylserine, LPS)、溶血磷脂酰肌醇(lysophosphatidylinosito, LPI)和溶血磷脂酰甘油酯(lysophosphatidylglycerol, LPG)等6类, 该研究总共鉴定了153种Lyso-GPLs脂质, 包括85个LPC、15个LPA、23个LPE、5个LPS、19个LPI和6个LPG类脂质。根据小鼠血清中6类Lyso-GPLs的相对定量分布, 苦丁茶中的三萜皂苷类成分逆转了高脂血症小鼠中的脂质异常变化趋势, 苦丁茶增加了LPE/LPG的比例, 降低了LPA/LPI的比例, 提高了多不饱和Lyso-GPLs的比例, 增加了含有15-C和22-C脂肪酰基链的LysoGPLs的比例, 为探究苦丁茶预防脂质代谢疾病的机制提供了研究基础。
Jin等[66]采用靶向脂质组学方法研究了中药姜黄对饮食介导的高脂血症小鼠的干预作用, 该研究使用液相色谱串联四级杆飞行时间质谱(liquid chromatog‐raphy-quadrupole time of flight mass spectrometry, LC-QTOF-MS/MS)和液相色谱串联三重四级杆线性离子阱质谱(liquid chromatography-quadrupole linear ion trap mass spectrometry, LC-QTRAP-MS/MS)两大质谱平台靶向分析了血清中LPC类脂质, 实现了对高、低丰度LPC类脂质的全面分析。该实验通过LC-QTOF-MS/MS对小鼠血清中LPC类脂质进行了表征, 一共鉴定了74个LPC类脂质化合物, 再通过LC-QTRAP-MS/MS对其中的59个LPC类脂质进行了相对定量分析。结果表明, 姜黄在降脂过程中, 具有更高不饱和度脂肪酸侧链的LPC的含量发生了显著变化。
3.3 基于GC-MS脂质组学方法的中药降脂作用研究LC-MS法在测定一些小分子化合物如脂肪酸、氨基酸等碳水化合物时受到一定限制。GC-MS可以同时对多种生化物质进行分析, 包括氨基酸、有机酸、碳水化合物和脂肪酸。较多可用的数据库也是基于GC-MS进行脂质组学研究的优势。高脂血症患者体内脂肪酸的改变先于TG、TC, 脂肪酸的轮廓谱分析可能具有更大的意义。
Wang等[67]基于GC-MS技术分析了中药绞股蓝治疗的高脂血症大鼠的脂肪酸代谢谱。绞股蓝在中国被广泛用于治疗高脂血症、脂肪肝和肥胖症等疾病, 该研究基于GC-MS脂质组学方法, 着重分析了高脂血症大鼠血浆和肝脏中脂肪酸在治疗前后的代谢谱差异, 以探究绞股蓝的降脂作用。研究者对大鼠血浆和肝脏样品中的脂质进行衍生化, 即甲基酯化处理, 再进行GC-MS分析, 共鉴定出了23个脂肪酸化合物, 从血浆中鉴定出的脂肪酸甲酯化衍生物如图 3所示。研究者在血浆和肝脏中各发现了5个差异性脂肪酸代谢物, 并发掘了6个潜在生物标志物, C16:0、C18:2、C18:1、C18:0、C20:4和C22:6脂肪酸。基于GC-MS技术的脂质组学分析表明, 绞股蓝降低了饱和脂肪酸的水平, 显著提高了花生四烯酸和二十二碳六烯酸的水平, 表明绞股蓝可能通过促进不饱和脂肪酸的合成和饱和脂肪酸的代谢来调节高脂饮食介导的脂质代谢异常。
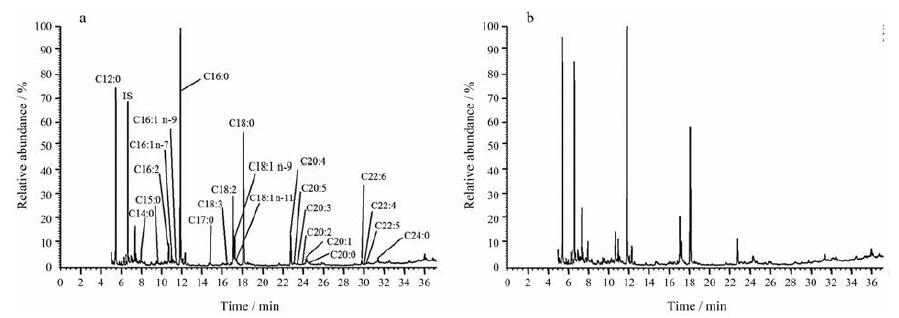
|
Figure 3 GC/MS profiles of fatty acid methyl esters from the plasma of normal diet group (a) and high-fat diet group (b).The qualitative results are marked in (a) and components in (a) could also be found in (b) according to their retention time and mass spectra[67] |
Tao等[68]对辅助降糖片干预的大鼠血清样本进行了非靶向GC-MS代谢组学分析, 探究了辅助降糖片治疗的2型糖尿病导致的糖脂代谢紊乱大鼠的血清代谢特征。2型糖尿病患者常伴有高脂血症等并发症, 辅助降糖片是由6种中药组成的中药复方, 可改善其血脂异常, 将其应用于2型糖尿病大鼠, 显著降低了大鼠血清中TC、TG、LDL-C的水平, 升高了HDL-C的水平。研究者取血清样本进行衍生化处理, GC-MS分析表明辅助降糖片治疗后, 大鼠血清中4种不饱和脂肪酸(棕榈酸、9-十八烯酸、油酸和花生四烯酸)和2种短链脂肪酸(草酸和3-羟基丁酸酯)表现出差异, 表明辅助降糖片可以改善糖脂代谢失调, 逆转2型糖尿病大鼠血清代谢物的异常水平。基于非靶向代谢组学的GC-MS与多元统计分析方法有利于阐明中药制剂的治疗机制, 通过优化的复方中药配比找出受中药调控较多的脂质, 有利于深层次探索中药降脂机制、缩小治疗靶点区域, 专注于中药降脂的精确靶点。
3.4 基于NMR-质谱联用技术的脂质组学方法的中药降脂作用研究Cai等[69]运用基于1H NMR和LC-MS技术的血浆、肝脏和肾脏代谢组学阐明了南葶苈子油的降血脂作用。南葶苈子油显著降低了高脂饮食喂养的大鼠血浆中异常升高的TC、LDL-C和HDL-C水平。NMR分析共鉴定出21个代谢差异物, LC-MS鉴定出13个代谢差异物, 与高脂组相比, 南葶苈子油有回调血浆中C16-二氢鞘氨醇、C18-二氢鞘氨醇、LPC (18:1)、TG(22:5)、神经酰胺ceramide (d18:1/14:0), 肝脏中LPC(16:0)、磷脂酰胆碱类脂质和肾脏中LPC (18:0)等脂质的趋势。南葶苈子油主要通过调节体内脂质代谢和氨基酸代谢来降低血脂水平。
4 展望高脂血症是一种体内脂质紊乱的疾病, 从脂质组学入手, 能快速直接地找出与中药降血脂密切相关的代谢物变化。然而, 脂质组学技术旨在对生物体中的脂质进行定性定量分析, 最终只能停留在代谢物变化的层面, 对降脂机制的解释是有限的, 当全面挖掘出与中药降血脂密切相关的脂质之后, 应进行下游的系统生物学分析, 这是加深机制研究的必经之路, 也是其难点。脂质组学作为代谢组学的一个分支, 是最接近生物表型的研究, 可以作为打开其他组学研究的突破口。将脂质生物标志物投射到相关代谢通路中, 找到其相关联的蛋白、基因, 可以指导下一步靶向性的蛋白或者基因组学的分析。脂质组学结果可以作为物质基础支持后续生物功能的研究。同理, 如果研究者先进行了中药降脂机制的蛋白组学或基因组学分析, 脂质组学技术也可以用来做最后代谢物层面的验证, 对中药降脂机制进行验证。
目前, 在脂质组学中主要采用LC-MS法进行分析, LC-MS能检测多种脂质, 包括固醇类、磷脂、溶血磷脂、鞘脂、甘油三酯、甘油二酯、脂肪酸等。GC-MS法一般用于分析非极性化合物如甘油三酯、衍生化之后的脂质和甾醇类脂质。由于脂质的结构复杂多变, 无法用单一一种检测方式实现较多脂质的检测, 在实际分析样品的过程中, 可以对感兴趣的脂质采取有针对性的检测方法, 如优化样品提取方法, 增强对感兴趣脂质的提取率; 采取多种分析平台, 高分辨质谱能获得丰富的脂质信息, 如准确分子量、前体离子和特征产物离子对、化合物保留时间等, QTRAP串联质谱仪选择性好、灵敏度高, 可用于脂质准确定量和低丰度脂质的检测, 结合使用基于高分辨质谱的非靶向脂质组学方法和基于低分辨质谱的靶向脂质组学方法, 可以大大提高脂质覆盖度。此外, 根据脂质分子性质优化质谱检测条件, 结合正负离子采集模式, 采用多种互补的扫描模式如前体离子、产物离子、中性丢失扫描模式等, 有利于加强对不同类别脂质的检测, 提高脂质的覆盖度和分析通量。提高准确度对于脂质的检测十分重要, 首先应提高定性的准确性, 根据已有的脂质谱图信息, 参考标准品或可靠的脂质数据库和文献, 进行科学的鉴定和结构表征, 排除脂质鉴定的假阳性。在对脂质定量时, 应该选择合适的内标物质, 对建立的分析方法进行严格的方法验证, 在分析实际样品时应增加对质控样品的分析。
未来, 整合脂质组学和基因组学、转录组学、蛋白组学、代谢组学的多组学研究有可能成为发展趋势。多组学研究能得到关于脂质代谢和脂质信号转导的更多信息, 有利于建立中药降脂过程中基因、转录因子、蛋白质、脂质之间的相互联系, 在生物系统中捕捉与中药调控最密切的生物途径或作用靶点, 精准靶向有关的药理活性位点, 充分挖掘中药的降脂机制。
作者贡献:王美琴负责综述的撰写与修改; 胡冰莹、王润婧负责综述部分内容的撰写与修改; 燕攀负责综述的修改; 杜支凤、姜宏梁负责综述撰写的指导和修改。
利益冲突:无任何利益冲突。
| [1] |
Hlaing TT, Park A. Hyperlipidaemia[J]. Medicine, 2013, 41: 607-609. DOI:10.1016/j.mpmed.2013.07.004 |
| [2] |
Bertolotti M, Maurantonio M, Gabbi C, et al. Review article: hyperlipidaemia and cardiovascular risk[J]. Aliment Pharmacol Ther, 2005, 22(Suppl 2): 28-30. |
| [3] |
Yi SH, Yi SZ. Clinical rational use of lipid-lowering drugs: research advances[J]. J Int Pharm Res(国际药学研究杂志), 2012, 39: 210-214. |
| [4] |
Xiang C, Li Y, Li K. Hypothesis on "one output multi-source" of traditional Chinese medicine complex system[J]. Acta Pharm Sin(药学学报), 2019, 54: 801-807. |
| [5] |
Cajka T, Fiehn O. Toward merging untargeted and targeted methods in mass spectrometry-based metabolomics and lipidomics[J]. Anal Chem, 2016, 88: 524-545. DOI:10.1021/acs.analchem.5b04491 |
| [6] |
Sun JF. Clinical application of hypolipidemic drugs and analysis of national drug use[J]. World J Complex Med(世界复合医学), 2018, 4: 100-102. |
| [7] |
Cao Y, Mei YR, Xu HX. Progress in clinical research of Chinese medicine treatment of hyperlipidemia[J]. Mod Diagn Treat(现代诊断与治疗), 2017, 28: 1397-1398, 1538. |
| [8] |
Xiong LW, He S, Liu WT. Research progress of knee osteoarthritis treated by Chinese medicine[J]. Henan Tradit Chin Med(河南中医), 2015, 35: 439-442. |
| [9] |
Dou XB, Wo XD, Fan CL. Progress of research in treatment of hyperlipidemia by monomer or compound recipe of Chinese herbal medicine[J]. Chin J Integr Med, 2008, 14: 71-75. DOI:10.1007/s11655-008-0071-y |
| [10] |
Li S, Jin SN, Song CW, et al. The metabolic change of serum lysophosphatidylcholines involved in the lipid lowering effect of triterpenes from Alismatis rhizoma on high-fat diet induced hyperlipidemia mice[J]. J Ethnopharmacol, 2016, 177: 10-18. DOI:10.1016/j.jep.2015.11.017 |
| [11] |
Shi LL, Wang J, Wang Y, et al. MDG-1, an ophiopogon polysaccharide, alleviates hyperlipidemia in mice based on metabolic profile of bile acids[J]. Carbohydr Polym, 2016, 150: 74-81. DOI:10.1016/j.carbpol.2016.05.008 |
| [12] |
Li ZY, Ding LL, Li JM, et al. 1H-NMR and MS based metabolomics study of the intervention effect of curcumin on hyperlipidemia mice induced by high-fat diet[J]. PLoS One, 2015, 10: e0120950. DOI:10.1371/journal.pone.0120950 |
| [13] |
Gao Y, Su YP, Huo YY, et al. Identification of antihyperlipidemic constituents from the roots of Rubia yunnanensis Diels[J]. J Ethnopharmacol, 2014, 155: 1315-1321. DOI:10.1016/j.jep.2014.07.027 |
| [14] |
Nishida M, Kondo M, Shimizu T, et al. Antihyperlipidemic effect of Acanthopanax senticosus (Rupr. et Maxim) Harms leaves in high-fat-diet fed mice[J]. J Sci Food Agric, 2016, 96: 3717-3722. DOI:10.1002/jsfa.7557 |
| [15] |
Yao P, Song FF, Li K, et al. Ginkgo biloba extract prevents ethanol induced dyslipidemia[J]. Am J Chin Med, 2007, 35: 643-652. DOI:10.1142/S0192415X07005132 |
| [16] |
Lu YL, Du YM, Qin L, et al. Gypenosides altered hepatic bile acids homeostasis in mice treated with high fat diet[J]. Evid Based Complement Alternat Med, 2018, 2018: 8098059. |
| [17] |
Xia W, Sun CH, Zhao Y, et al. Hypolipidemic and antioxidant activities of sanchi (radix notoginseng) in rats fed with a high fat diet[J]. Phytomedicine, 2011, 18: 516-520. DOI:10.1016/j.phymed.2010.09.007 |
| [18] |
Shen N, Li CN, Yi H, et al. Advances of the mechanism study on berberine in the control of blood glucose and lipid as well as metabolism disorders[J]. Acta Pharm Sin(药学学报), 2010, 45: 699-704. |
| [19] |
Fahy E, Subramaniam S, Murphy RC, et al. Update of the LIPID MAPS comprehensive classification system for lipids[J]. J Lipid Res, 2009, 50(Suppl): S9-S14. |
| [20] |
Hu T, Zhang JL. Mass-spectrometry-based lipidomics[J]. J Sep Sci, 2018, 41: 351-372. DOI:10.1002/jssc.201700709 |
| [21] |
Burdge GC, Calder PC. Introduction to fatty acids and lipids[J]. World Rev Nutr Diet, 2015, 112: 1-16. |
| [22] |
Fahy E, Cotter D, Sud M, et al. Lipid classification, structures and tools[J]. Biochim Biophys Acta, 2011, 1811: 637-647. DOI:10.1016/j.bbalip.2011.06.009 |
| [23] |
Dowhan W, Bogdanov M, Mileykovskaya E. Biochemistry of Lipids, Lipoproteins and Membranes[M]. 6th Ed. Boston: Elsevier, 2016: 1-40.
|
| [24] |
Han XL, Gross RW. Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry: a bridge to lipidomics[J]. J Lipid Res, 2003, 44: 1071-1079. DOI:10.1194/jlr.R300004-JLR200 |
| [25] |
ChiurchiùV, Leuti A, Maccarrone M. Bioactive lipids and chronic inflammation: managing the fire within[J]. Front Immunol, 2018, 9: 38. DOI:10.3389/fimmu.2018.00038 |
| [26] |
Ference BA, Graham I, Tokgozoglu L, et al. Impact of lipids on cardiovascular health: JACC health promotion series[J]. J Am Coll Cardiol, 2018, 72: 1141-1156. DOI:10.1016/j.jacc.2018.06.046 |
| [27] |
Wang B, Tontonoz P. Phospholipid remodeling in physiology and disease[J]. Annu Rev Physiol, 2019, 81: 165-188. DOI:10.1146/annurev-physiol-020518-114444 |
| [28] |
Patel D, Witt SN. Ethanolamine and phosphatidylethanolamine: partners in health and disease[J]. Oxid Med Cell Longev, 2017, 2017: 4829180. |
| [29] |
Vaz FM, Pras-Raves M, Bootsma AH, et al. Principles and practice of lipidomics[J]. J Inherit Metab Dis, 2015, 38: 41-52. DOI:10.1007/s10545-014-9792-6 |
| [30] |
Wenk MR. The emerging field of lipidomics[J]. Nat Rev Drug Discov, 2005, 4: 594-610. DOI:10.1038/nrd1776 |
| [31] |
Srivastava NK. Proton nuclear magnetic resonance (1H NMR) spectroscopy-based analysis of lipid components in serum/plasma of patients with Duchenne Muscular Dystrophy (DMD)
[J]. Methods Mol Biol, 2018, 1687: 195-204. |
| [32] |
Kato T, Nishimiya M, Kawata A, et al. Quantitative 31P NMR method for individual and concomitant determination of phospholipid classes in polar lipid samples[J]. J Oleo Sci, 2018, 67: 1279-1289. DOI:10.5650/jos.ess18062 |
| [33] |
Yang K, Han XL. Lipidomics: techniques, applications, and outcomes related to biomedical sciences[J]. Trends Biochem Sci, 2016, 41: 954-969. DOI:10.1016/j.tibs.2016.08.010 |
| [34] |
Li M, Zhou ZG, Nie HG, et al. Recent advances of chromatography and mass spectrometry in lipidomics[J]. Anal Bioanal Chem, 2011, 399: 243-249. DOI:10.1007/s00216-010-4327-y |
| [35] |
Züllig T, Trötzmüller M, Köfeler HC. Lipidomics from sample preparation to data analysis: a primer[J]. Anal Bioanal Chem, 2020, 412: 2191-2209. DOI:10.1007/s00216-019-02241-y |
| [36] |
Han XL, Gross RW. Shotgun lipidomics: electrospray ionization mass spectrometric analysis and quantitation of cellular lipidomes directly from crude extracts of biological samples[J]. Mass Spectrom Rev, 2005, 24: 367-412. DOI:10.1002/mas.20023 |
| [37] |
Han XL. Lipidomics[M]. New Jersey: John Wiley & amp; Sons, 2016: 53-88.
|
| [38] |
Zhang Q, Wang GJ, A JY, et al. Application of GC/MS-based metabonomic profiling in studying the lipid-regulating effects of Ginkgo biloba extract on diet-induced hyperlipidemia in rats[J]. Acta Pharmacol Sin, 2009, 30: 1674-1687. DOI:10.1038/aps.2009.173 |
| [39] |
Anesi A, Guella G. A fast liquid chromatography-mass spectrometry methodology for membrane lipid profiling through hydrophilic interaction liquid chromatography[J]. J Chromatogr A, 2015, 1384: 44-52. DOI:10.1016/j.chroma.2015.01.035 |
| [40] |
Sparvero LJ, Amoscato AA, Dixon CE, et al. Mapping of phospholipids by MALDI imaging(MALDI-MSI): realities and expectations[J]. Chem Phys Lipids, 2012, 165: 545-562. DOI:10.1016/j.chemphyslip.2012.06.001 |
| [41] |
Wang JN, Wang CY, Han X. Tutorial on lipidomics[J]. Anal Chim Acta, 2019, 1061: 28-41. DOI:10.1016/j.aca.2019.01.043 |
| [42] |
Folch J, Lees M, Sloane Stanley GH. A simple method for the isolation and purification of total lipides from animal tissues[J]. J Biol Chem, 1957, 226: 497-509. DOI:10.1016/S0021-9258(18)64849-5 |
| [43] |
Bligh EG, Dyer WJ. A rapid method of total lipid extraction and purification[J]. Can J Biochem Physiol, 1959, 37: 911-917. DOI:10.1139/o59-099 |
| [44] |
Matyash V, Liebisch G, Kurzchalia TV, et al. Lipid extraction by methyl-tert-butyl ether for high-throughput lipidomics[J]. J Lipid Res, 2008, 49: 1137-1146. DOI:10.1194/jlr.D700041-JLR200 |
| [45] |
Southam AD, Weber RJM, Engel J, et al. A complete workflow for high-resolution spectral-stitching nanoelectrospray directinfusion mass-spectrometry-based metabolomics and lipidomics[J]. Nat Protoc, 2016, 12: 310-328. |
| [46] |
Nazari M, Muddiman DC. Enhanced lipidome coverage in shotgun analyses by using gas-phase fractionation[J]. J Am Soc Mass Spectrom, 2016, 27: 1735-1744. DOI:10.1007/s13361-016-1446-5 |
| [47] |
Koelmel JP, Kroeger NM, Gill EL, et al. Expanding lipidome coverage using LC-MS/MS data-dependent acquisition with automated exclusion list generation[J]. J Am Soc Mass Spectrom, 2017, 28: 908-917. DOI:10.1007/s13361-017-1608-0 |
| [48] |
Skotland T, Ekroos K, Kauhanen D, et al. Molecular lipid species in urinary exosomes as potential prostate cancer biomarkers[J]. Eur J Cancer, 2017, 70: 122-132. DOI:10.1016/j.ejca.2016.10.011 |
| [49] |
Weir JM, Wong G, Barlow CK, et al. Plasma lipid profiling in a large population-based cohort[J]. J Lipid Res, 2013, 54: 2898-2908. DOI:10.1194/jlr.P035808 |
| [50] |
Han X, Gross RW. Structural determination of lysophospholipid regioisomers by electrospray ionization tandem mass spectrometry[J]. J Am Chem Soc, 1996, 118: 451-457. DOI:10.1021/ja952326r |
| [51] |
Murphy RC, Okuno T, Johnson CA, et al. Determination of double bond positions in polyunsaturated fatty acids using the photochemical Paternò-Büchi reaction with acetone and tandem mass spectrometry[J]. Anal Chem, 2017, 89: 8545-8553. DOI:10.1021/acs.analchem.7b02375 |
| [52] |
Han XL. Lipidomics[M]. New Jersey: John Wiley & amp; Sons, 2016: 121-150.
|
| [53] |
Boccard J, Veuthey JL, Rudaz S. Knowledge discovery in metabolomics: an overview of MS data handling[J]. J Sep Sci, 2010, 33: 290-304. DOI:10.1002/jssc.200900609 |
| [54] |
Checa A, Bedia C, Jaumot J. Lipidomic data analysis: tutorial, practical guidelines and applications[J]. Anal Chim Acta, 2015, 885: 1-16. DOI:10.1016/j.aca.2015.02.068 |
| [55] |
Katajamaa M, Oresic M. Data processing for mass spectrometrybased metabolomics[J]. J Chromatogr A, 2007, 1158: 318-328. DOI:10.1016/j.chroma.2007.04.021 |
| [56] |
Wang Y, Yu HL, Ping GL. Primary discussion of the keys on the modernization of Chinese medicine[J]. World J Integr Tradit West Med(世界中西医结合杂志), 2014, 9: 768-770. |
| [57] |
Li SH, Huang MH, Lin P. Discussion on the relationship between traditional Chinese medicine state and lipidomics[J]. China J Tradit Chin Med Pharm(中华中医药杂志), 2019, 34: 129-131. |
| [58] |
Zhang SM, Qi DM, Cao YM, et al. Lipidomics study on intervention by Uncaria on hepatic metabolic disorder in spontaneously hypertensive rats[J]. Acta Pharm Sin(药学学报), 2019, 54: 1636-1644. |
| [59] |
Shon JC, Shin HS, Seo YK, et al. Direct infusion MS-based lipid profiling reveals the pharmacological effects of compound Kreinforced ginsenosides in high-fat diet induced obese mice[J]. J Agric Food Chem, 2015, 63: 2919-2929. DOI:10.1021/jf506216p |
| [60] |
Deng YJ, Pan MX, Nie H, et al. Lipidomic analysis of the protective effects of Shenling Baizhu San on non-alcoholic fatty liver disease in rats[J]. Molecules, 2019, 24: 3943. DOI:10.3390/molecules24213943 |
| [61] |
Zhai LX, Ning ZW, Huang T, et al. Leaves tea improves dyslipidemia in diabetic mice: a lipidomics-based network pharmacology study[J]. Front Pharmacol, 2018, 9: 973. DOI:10.3389/fphar.2018.00973 |
| [62] |
Kurihara H, Asami S, Shibata H, et al. Hypolipemic effect of Cyclocarya paliurus (Batal) Iljinskaja in lipid-loaded mice[J]. Biol Pharm Bull, 2003, 26: 383-385. DOI:10.1248/bpb.26.383 |
| [63] |
Miao H, Zhao YH, Vaziri ND, et al. Lipidomics biomarkers of diet-induced hyperlipidemia and its treatment with Poria cocos[J]. J Agric Food Chem, 2016, 64: 969-979. DOI:10.1021/acs.jafc.5b05350 |
| [64] |
Zhang T, Zhao Q, Xiao XR, et al. Modulation of lipid metabolism by celastrol[J]. J Proteome Res, 2019, 18: 1133-1144. DOI:10.1021/acs.jproteome.8b00797 |
| [65] |
Shi QX, Jin SN, Xiang XL, et al. The metabolic change in serum lysoglycerophospholipids intervened by triterpenoid saponins from Kuding tea on hyperlipidemic mice[J]. Food Funct, 2019, 10: 7782-7792. DOI:10.1039/C9FO02142F |
| [66] |
Jin SN, Song CW, Li S, et al. Preventive effects of turmeric on the high-fat diet-induced hyperlipidaemia in mice associated with a targeted metabolomic approach for the analysis of serum lysophosphatidylcholine using LC-MS/MS[J]. J Funct Foods, 2014, 11: 130-141. DOI:10.1016/j.jff.2014.09.016 |
| [67] |
Wang M, Wang YN, Zhao M, et al. Metabolic profiling analysis of fatty acids from hyperlipidemic rats treated with Gynostemma pentaphyllum and atorvastatin based on GC/MS[J]. Anal Methods, 2014, 6: 8660-8667. DOI:10.1039/C4AY01405G |
| [68] |
Tao Y, Chen X, Cai H, et al. Untargeted serum metabolomics reveals Fu-Zhu-Jiang-Tang tablet and its optimal combination improve an impaired glucose and lipid metabolism in typeⅡdiabetic rats[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1040: 222-232. DOI:10.1016/j.jchromb.2016.11.012 |
| [69] |
Cai Y, Zhao M, Guan ZB, et al. Metabolomics analysis of the therapeutic mechanism of Semen Descurainiae Oil on hyperlipidemia rats using1H-NMR and LC-MS[J]. Biomed Chromatogr, 2019, 33: e4536. |
 2021, Vol. 56
2021, Vol. 56


