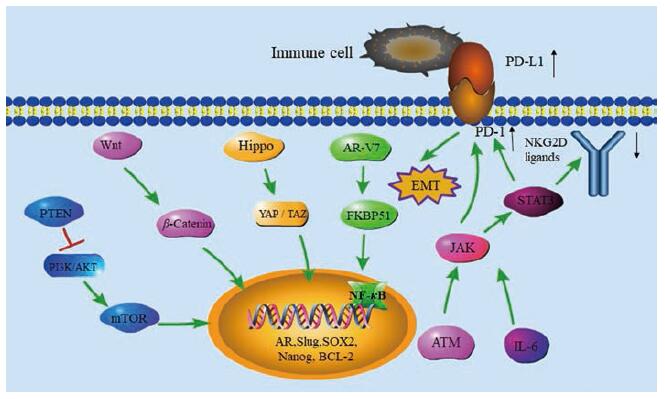
前列腺癌(prostate cancer, PCa)是男性泌尿生殖系统常见的恶性肿瘤之一, 发病率在世界范围内居男性恶性肿瘤的第二位。尽管当前我国的PCa发病率低于欧美等发达国家, 但随着人民生活方式的西化、生活环境的恶化以及人口老龄化的加剧, 近年来我国PCa的发病率快速上升, 增长率为全球之首, 已成为男性中发病率排名第五位的恶性肿瘤[1]。虽然在临床上大多采用雄激素剥夺治疗方法并且行之有效, 但患者在接受去势治疗18~36个月后往往会出现治疗抵抗, 并发展为去势抵抗性前列腺癌(castration-resistance prostate cancer, CRPC)[2]。这种类型的癌细胞会更难杀死, 并且易于转移到骨和肺等部位, 并对大多数化疗药物和放疗方法产生抗性, 即使短暂控制住了癌细胞的生长, 很快也会复发并迅速扩散[3]。抗雄治疗后产生的治疗抵抗一直是PCa治疗中的瓶颈, 晚期PCa患者可能面临无药可用的困境。研究表明有多种机制能促进CRPC的产生, 首要的是改变雄激素受体(androgen receptor, AR)的信号传导, 例如通过AR基因扩增和突变增加体内AR的表达水平[4], 形成AR的剪接突变体使其在不依赖雄激素的情况下进行信号传导[5], 或者改变AR辅助共激活因子的表达促进AR在低水平雄激素下对雄激素的敏感性增加等。对于所有CRPC患者而言, AR仍具有活性[6], 但即使继续抑制AR活性或者阻断雄激素的产生也依然对PCa的抑制作用有限, 不能有效阻断癌细胞的增殖和转移。因此研究者开始对CRPC形成中独立于雄激素信号通路的其他分子机制进行探究(图 1), 期望找寻其他潜在的有效分子靶标, 进一步开发新的靶标药物(表 1)或者应用联合用药策略用于CRPC的治疗或者辅助治疗, 以期能有效提高临床抑瘤率和患者总生存期。本文针对这部分内容的研究进展进行汇总和剖析, 以期为后续的研究提供借鉴。
|
Figure 1 The androgen independent signaling pathways in castration-resistant prostate cancer.PTEN: Phosphatase and tensin homologue deleted on chromosome 10;PI3K: Phosphatidylinositol-3-kinase; AKT: Protein kinase B; mTOR: Mammalian target of rapamycin; YAP: Yes-associated protein; TAZ: Tafazzin; AR-V7:Androgen receptor variant-7;FKBP51:FK506-binding protein 51;NF-κB: Nuclear factor kappa-B; AR: Androgen receptor; SOX2:Sex determining region Y-box 2;BCL-2: B-cell lymphoma-2;EMT: Epithelial-mesenchymal tran‐sition; JAK/STAT3:The Janus kinase/signal transducer and activator of tranions 3;ATM: Ataxia telangiectasia-mutated; IL-6:Interleukin-6;PD-L1:Programmed cell death 1 ligand 1;PD-1:Programmed cell death-1;NKG2D: NK group 2, member D |
| 表 1 The related drugs of androgen independent signaling pathway. mTORC1/2: Mammalian target of rapamycin complex 1/2; PSA: Prostate specific antigen; TEAD: Transcription enhancing association domain; NK cells: Natural killer cells |
磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(phosphati‐dylinositol-3-kinase/protein kinase B/mammalian target of rapamycin, PI3K/AKT/mTOR)信号通路通过调节细胞增殖、存活、迁移和血管生成推动CRPC的进程[7]。PI3K的活性产物能激活AKT, 而mTOR是AKT的下游靶标。研究发现, 在CRPC中, PI3K级联信号能将细胞外信号如胰岛素、表皮生长因子和转化生长因子等[8]转至细胞内靶部位, 促进PI3K的激活和级联信号的传导, 使得癌细胞利用此途径来适应去雄治疗引起的细胞应激。PI3K/AKT/mTOR和AR信号之间有直接联系, 人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome 10, PTEN)缺失后可激活PI3K/AKT信号通路, 使AR活性增加。Carver等[9]发现抑制PI3K通路可以通过解除对受体酪氨酸激酶的反馈抑制从而激活AR信号, 抑制AR信号则可通过降低AKT磷酸酶的水平从而激活AKT信号, 这两条致癌途径相互交叉调节维持肿瘤细胞的存活, 因此若能联合抑制PI3K通路和AR信号则能明显抑制PCa的进展。此外, 也有研究发现PI3K/AKT途径可以通过干扰其他信号途径促进PCa的发展并产生对药物的耐药性[10], 例如AKT通过影响Wnt/β-连环蛋白(β-catenin)途径干扰AR的转录, 即AKT可抑制β-catenin降解, 促进其在细胞核的积累, 进而增强AR的转录活性[11], 促进PCa的进程。
研究发现, 天然化合物异鼠李素是一种选择性PI3K/AKT/mTOR途径抑制剂, 可显著抑制雄激素非依赖性前列腺癌细胞DU145和PC3的生长, 但对雄激素依赖性前列腺癌细胞LNCa P和正常人前列腺上皮细胞PREC几乎没有抑制作用[12]。NVP-BEZ235是PI3K和哺乳动物雷帕霉素靶蛋白复合体1/2 (mTOR complex1/2, mTORC1/2)双重抑制剂, 其与多西他赛联合治疗具有协同抗肿瘤作用, 是对CRPC有效的治疗策略[13]。Ipatasertib (GDC-0068)是对AKT 3个亚型均有效的ATP竞争性抑制剂, 其优先靶向磷酸化AKT, 使前列腺特异抗原(prostate specific antigen, PSA)的水平下降, 对CRPC患者发挥抗癌效应, 目前Ib或II期临床试验正在进行中[14]。Everolimus是美国食品和药品管理局批准的mTOR抑制剂, George等[15]对转移性去势耐药前列腺癌(metastatic castration-resistance prostate cancer, m CRPC)患者进行单药的II期临床试验发现, 虽然下游的mTOR药效学生物标记物持续受到抑制, 但肿瘤增殖标记物Ki-67随着治疗的进行而增加, 并出现严重的毒性反应, 表明单药everolimus对m CRPC患者临床疗效不明显。Gross等[16]用everolimus与多西紫杉醇和贝伐单抗联合应用治疗CRPC表现出明显抗癌作用, 但同时其血液学方面的毒性明显增加, 这是未来其应用于临床亟需攻克的问题之一。虽然PI3K/AKT/mTOR可能成为CRPC治疗的有效靶标, 但相关药物的研究依然有许多问题亟待解决。
1.2 Wnt/β-catenin信号通路Wnt蛋白是一种分泌糖蛋白, β-catenin是Wnt途径重要的信号传导因子, 其活性受Wnt通路中的相关蛋白调控。据报道[17], Wnt信号激活后可介导β-catenin与雄激素受体的羧基端配体结合域结合, 在双氢睾酮存在时与AR蛋白共定位于细胞核, 增加PCa细胞中AR基因的转录活性。在临床上恩杂鲁胺可用于CRPC患者的治疗, 但易产生耐药性, 研究表明Wnt/β-catenin途径的异常激活增加了患者对恩杂鲁胺的耐药性[18]。同时有报道称Wnt信号转导能促进上皮细胞-间充质细胞转化(epithelialmesenchymal transition, EMT)的发生, 研究发现其可能的机制是在CRPC细胞中, cAMP依赖性蛋白激酶II型β调节亚基(protein kinase, cAMP-dependent, regulatory, type II, beta, PRKAR2B)激活Wnt/β-catenin信号传导通路, β-catenin核易位促进锌指转录因子Slug的表达, 进而触发EMT和侵袭性基因的过表达[19], 驱动癌细胞的增殖分化。
Wnt/β-catenin是治疗CRPC的有效靶点, 研究表明雄激素非依赖性PCa细胞更容易激活Wnt基因, 抑制Wnt/β-catenin信号通路增强了癌细胞对第二代抗雄激素药物苯扎鲁胺的敏感性。联合使用苯扎鲁胺和Wnt/β-catenin信号抑制剂对雄激素依赖和雄激素非依赖性PCa细胞的增殖均有明显的抑制作用[20]。小分子化合物CWP232291通过影响Wnt依赖性转录活性来抑制β-catenin的表达, 并下调PCa细胞中AR及其剪接变异体的表达, 在CRPC异种移植小鼠模型上, 能观察到明显的抗肿瘤作用[21]。柴胡皂甙-d (saikosaponin-d, SSD)是一种治疗慢性PCa的新化合物, 能阻断Wnt/β-catenin信号通路, 抑制CRPC患者EMT的产生和癌症干细胞(cancer stem cell, CSC)的分化[22]。针对Wnt通路的小分子治疗药物的研究目前仍处于初步阶段, 需进一步研究抑制Wnt通路的潜在抗肿瘤机制, 进而推动对其抑制剂的研发。
1.3 Hippo信号通路Hippo-YAP (Yes-associated protein, YAP)/TAZ (tafazzin, TAZ)信号传导异常存在于多种癌症类型中。当Hippo途径活跃时, 转录共激活因子YAP和其旁系同源TAZ活性被抑制; 而当Hippo途径失活时, YAP和TAZ易位进入细胞核, 能被其他转录因子在其靶基因的启动子处募集, 增强靶基因的转录活性[23]。例如, 在雄激素非依赖性条件下, YAP能与PSA启动子中的雄激素反应元件结合, 使PSA异常表达, 若YAP基因沉默则抑制了AR目标基因PSA和FK506结合蛋白5 (FK506-binding protein 5, FKBP5)等的转录[24]。Zhang等[25]发现当YAP表达增强时LNCa P细胞在雄激素剥夺条件下能正常增殖, 表明YAP的过表达能将LNCa P细胞从雄激素敏感型转化为去势抵抗型, 增强癌细胞的侵袭能力。在PCa中, 研究发现AR能抑制LNCa P细胞中YAP的转录活性, 因为AR能招募DNA甲基转移酶3A (DNA methyltransferase 3A, DNMT3a)等相关酶到YAP启动子处, 促进DNA甲基化, 抑制YAP基因转录。相反在去势时AR被抑制而促进YAP转录激活, 使转录增强缔合域(transcription enhancing association domain, TEAD)依赖的干性基因SOX2 (sex determining region Y-box 2)和Nanog转录活性增加, 维持PCa细胞的自我更新和去分化[26], 促进CRPC的进展。
YAP/TAZ在癌症生物学许多方面具有重要的作用。研究确定了许多参与细胞周期进程控制的基因是YAP/TAZ的直接靶基因, 此外YAP/TAZ诱导表达的受体是传统生物药物的理想靶标, 这些因素决定Hippo通路可作为抗癌药物的理想靶点[27]。研究表明YAP/TAZ主要通过与TEAD结合而起到转录共激活因子的作用, 因此靶向Hippo途径的最直接方法是抑制这种相互作用。Verteporfin能抑制YAP/TAZ-TEAD的相互作用, 同时抑制YAP-AR的相互作用和耐药的C4-2细胞的生长[28]。Vestigial-like 4是一种肿瘤抑制因子, 与YAP竞争性结合TEAD, 通过负向调节YAP-TEAD复合物的形成, 抑制Hippo途径[29], 但是其安全性和有效性依然有很多的未知性, 需要进一步的探索。他汀类药物具有多种生物活性, 对恶性肿瘤具有较高的治疗潜力。最近, 他汀类药物已被确定为YAP的有效抑制剂, 能促进YAP/TAZ的靶基因表达降低, 同时能抑制CSC的产生[30]。
2 免疫和炎症相关致癌信号通路及其相关药物 2.1 FKBP51/NF-κB信号传导FK506结合蛋白51(FK506-binding protein 51, FKBP51)是一种支架蛋白, 调节细胞的分化凋亡和端粒酶活性等[31]。核转录因子κB (nuclear factor kappa-B, NF-κB)是重要的转录因子家族, 参与调控与细胞的生长凋亡、免疫应答和炎症反应等相关的基因表达。研究表明在细胞外组蛋白的作用下, NF-κB途径介导的炎症反应显著促进PCa细胞的迁移和EMT的产生[32]。Catz等[33]研究发现NF-κB传导通路的激活能抑制PCa细胞的凋亡, 因为在抗凋亡基因B淋巴细胞瘤-2 (B-cell lymphoma-2, BCL-2)启动子中存在NF-κB位点, 当激活NF-κB信号传导后, 会促进BCL-2基因转录水平的增加。有报道称NF-κB能与AR协同作用促进CRPC的发生, 基因测序实验证实了AR是NF-κB的下游基因, 同时NF-κB可以上调多种肿瘤促进细胞因子和趋化因子的表达, 例如肿瘤坏死因子α、白细胞介素-8、趋化因子CXCL12 (C-X-C motif chemokine 12)和CCL2[chemokine (C-C motif) ligand2]等, 在雄激素剥夺治疗时, 这些细胞因子与低浓度的雄激素协同作用可促进AR信号传导[34]。FKBP51可与核因子κB激酶抑制剂(inhibitor of NF-κB kinaseα, IKKα)相互作用激活NF-κB信号通路, Yu等[35]采用免疫组织化学方法检测发现, 在CRPC组织中雄激素受体剪接突变体7 (androgen receptor variant-7, AR-V7)、FKBP51和NF-κB信号传导相关蛋白的表达水平呈正相关, 表明FKBP51蛋白在雄激素缺乏的情况下受AR-V7的调节, 而不是由全长AR调控。
目前许多抑制NF-κB通路的化合物正在研究中, 以期能达到抑制CRPC的目的。Zou等[36]发现重楼皂苷I可以抑制NF-κB/p65和DNA甲基转移酶1蛋白的表达, 促进PC3细胞的凋亡和抑制细胞增殖。CX4945是酪蛋白激酶2的合成抑制剂, 研究表明其能在mRNA和蛋白水平下调AR-V7的表达, 同时能减弱NF-κB通路的活性, 恢复CRPC细胞对比卡鲁胺的敏感性[37]。BAY 11-7082通过降低NF-κB抑制蛋白α(inhibitor α of NF-κB, IκBα)磷酸化水平抑制NF-κB活性, 并能与其他药物协同促进PC-3细胞的凋亡[38]。同时有研究表明在对癌细胞进行光热治疗时[39], DU145细胞经BAY 11-7082处理后, 可以通过IκBα/AR信号通路响应光热疗法, 促进雄激素非依赖性PCa细胞的凋亡。
2.2 IL-6/JAK/STAT3信号通路白细胞介素-6 (inter‐leukin-6, IL-6)是一种多肽糖蛋白的细胞炎症因子, 参与多种免疫反应。近些年来研究表明在大多数CRPC患者中IL-6的表达水平明显升高, 且能与肿瘤微环境相互作用, 激活AR的活性[40], 促进CRPC进展。研究表明, Janus激酶/信号转导与转录激活子3 (the Janus kinase/signal transducer and activator of tranions 3, JAK/STAT3)信号通路能促进肿瘤的发展和转移, 并且参与PCa从激素依赖性到激素非依赖性的转变[41]。神经内分泌分化(neuroendocrine differentiation, NED)是CRPC发展的潜在机制之一, 外源性IL-6是诱导NED产生的关键细胞因子, 然而Ge等[42]证明有自分泌IL-6功能的LNCaP细胞对外源性IL-6诱导的NED具有抵抗性, 研究认为长期自分泌的IL-6刺激细胞因子信号传导抑制因子7(suppressor of cytokine signaling 7, SOCS7)和细胞因子诱导的SH2蛋白(cytokine-inducible SH2 protein, CIS)表达水平升高, 然后直接与JAKs结合, 降低其酪氨酸激酶活性, 阻止JAK2/STAT3途径激活, 从而产生抵抗性。Xu等[43]证明IL-6通过调节JAK/STAT3信号传导能改变CRPC细胞中的细胞程序性死亡配体1(programmed cell death 1 ligand 1, PD-L1)和自然杀伤细胞(natural killer cell, NK)的活化型受体NKG2D(NK group 2, member D)的配体水平, 促进PD-L1的表达上调和NKG2D激活配体如UL16结合蛋白1 (UL16binding protein 1, ULBP1)、ULBP2、ULBP3、MHC I类分子相关蛋白A (MHC class I polypeptiderelated sequence A, MICA)和MICB的表达下调, 帮助肿瘤细胞逃避NK细胞介导的细胞毒性作用。若使用JAK或STAT3抑制剂能明显降低PD-L1的表达和增加NKG2D配体水平, 增加对癌细胞的毒性, 抑制其增殖。而JAK/STAT3途径触发PD-L1/NKG2D配体表达改变的详细机制还未阐明。
靶向IL-6或其下游信号是针对CRPC患者的新治疗策略。研究发现在PCa细胞中, JAK2是激活STAT5a/b信号的主要酪氨酸激酶, 而AZD1480是JAK2激酶的竞争性抑制剂, 能抑制PCa细胞中STAT5a/b磷酸化, 阻断JAK2/STAT5a/b信号通路, 抑制原发性PCa和CRPC的进展[44]。STAT3能与AR结合促进AR激活, 加利来酸内酯(GPA500)是STAT3的DNA结合抑制剂, 研究表明GPA500能破坏STAT3与AR之间的相互作用, 抑制AR活性。在LNCa P和CRPC细胞中, 恩杂鲁胺和GPA500的联用可在抑制AR活性和细胞增殖方面具有累加作用, 为组合疗法提供了依据[45]。CNTO 328(siltuximab)是IL-6的单克隆抗体, I期临床试验表明其无明显的不良反应, 并且能有效阻断JAK/STAT3信号传导[46]。CNTO 328与多西紫杉醇联合用药的I期临床试验结果表明, 对于CRPC患者联合用药是安全的, 并显示出一定的疗效[47]。在PCa中SOCS3处于沉默状态, Ad-SOCS3是一种腺病毒载体, 能促进SOCS3的过表达, 抑制CRPC细胞中IL-6的产生和人γ干扰素诱导的PD-L1的表达, 并增加癌细胞对NK细胞的敏感性, 表明Ad-SOCS3基因治疗和NK细胞免疫治疗相结合是晚期CRPC治疗的有利选择[48]。
2.3 ATM-JAK-PD-L1信号通路共济失调毛细血管扩张(ataxia telangiectasia-mutated, ATM)基因是一种DNA修复基因, 有研究表明, 与激素依赖性PCa患者的前列腺组织样品相比, CRPC患者的前列腺组织样品中ATM表达水平显著提高[49]。JAK是一种非受体型酪氨酸蛋白激酶, 与细胞因子相互作用传递信号。PD-L1是一种细胞表面糖蛋白, 属于共刺激分子B7家族, 在许多恶性肿瘤中广泛表达, 其诱导的外源刺激可激活EMT产生和致癌细胞内蛋白的表达[50]。EMT在促进肿瘤恶化和介导治疗抵抗中具有重要的作用[51], 阻断AR信号传导能通过多种机制诱导EMT的产生。Zhang等[49]研究发现, 在ATM基因敲除的CRPC细胞中EMT相关基因的表达水平降低, 并且细胞增殖能力也降低, 进一步研究其潜在机制发现, ATM基因敲除的CRPC细胞中的JAK2和PD-L1的表达降低, 若抑制JAK信号通路可显著抑制PD-L1的表达, 而抑制STAT3不影响PD-L1的表达。此外, 若在癌细胞中加入PD-L1抗体和JAK抑制剂, 则细胞迁移能力明显降低, EMT相关标志物的表达明显下降, 因此证明了ATM-JAK-PD-L1信号通路能通过促进EMT的产生促进CRPC的进展。
研究结果显示, 通过抑制ATM-JAK-PD-L1信号通路, 可有效抑制CRPC中EMT的发生和癌细胞的转移, 为CRPC的靶向治疗提供了新思路。例如, 奥拉帕利是PARP抑制剂, 对存在乳腺癌易感基因及ATM等DNA修复基因缺陷的PCa患者疗效显著, 可以改善m CRPC患者的中位无进展生存期, 而durvalumab是一种人Ig G1-K单克隆抗体, 可选择性与人PD-L1结合, 临床试验结果表明奥拉帕利与durvalumab联合用药显示出一定的抑癌疗效[52]。
2.4 PD-1/PD-L1信号通路肿瘤诱导的免疫抑制状态在包括PCa在内的癌症发病机制中起着至关重要的作用。细胞程序性死亡蛋白-1 (programmed cell death-1, PD-1)是T细胞调节剂家族的成员, 在活化的T细胞、B细胞和巨噬细胞的表面表达。它的配体PD-L1在肿瘤细胞、巨噬细胞和T细胞等细胞上表达。在肿瘤微环境中, 肿瘤细胞上表达的PD-L1与已活化T细胞上的PD-1结合, 向这些T细胞传递抑制信号, 阻止它们杀死靶肿瘤细胞, 对免疫系统产生负调节作用。抑制PD-1和PD-L1之间的相互作用可以增强体外T细胞的活性, 并介导临床抗肿瘤效应[53]。在PCa细胞中几种高免疫原性肿瘤相关抗原异常过表达, 这些抗原代表了免疫治疗方法的潜在靶点。PCa组织的特征是在肿瘤内和周围微环境中有T细胞的大量炎性浸润, 免疫系统的先天和适应性分支都参与针对前列腺细胞的防御机制[54], 表明免疫疗法对CRPC是可行的。
近些年来针对PCa的免疫检查点抑制疗法快速发展, 通过阻断免疫检查点恢复和增强免疫细胞介导的抗肿瘤免疫以实现持久的肿瘤消退成为抗癌研究的热点。对于PCa, 靶向细胞毒性T淋巴细胞相关抗原4和PD-1/PD-L1是免疫治疗的有效策略。2018年的II期临床试验单机构研究报告表明, 在曾接受恩杂鲁胺治疗的m CRPC患者中, 加入派姆单抗(pembrolizumab), 18%的患者PSA与基线相比降低了至少50%, 总生存期达到22.2个月。MDX-1106是另一种PD-1抗体, 对其进行了难治性实体肿瘤单剂量I期临床试验研究, 结果表明间歇给药具有良好的耐受性, 能通过增强免疫系统活性发挥抗肿瘤作用[55]。髓样抑制细胞(myeloidderived suppressor cell, MDSC)在肿瘤免疫逃逸中起重要作用, 产生的白细胞介素-23是CRPC病程发展的驱动因素。Lu等[56]发现靶向MDSC的治疗与PD-L1/PD-1轴阻断相结合可产生协同免疫反应, 对原发性PCa和m CRPC均表现出强大的协同作用。
3 总结与展望经过雄激素剥夺治疗的PCa患者通常会在数年后复发, 并且逐渐发展为CRPC。目前治疗CRPC的药物主要有化疗药物、内分泌药物、免疫药物和针对骨转移的药物, 尽管这些治疗方法能在一定程度上控制CRPC的病程发展, 但仍迫切需要找出新的有效治疗靶点, 开发新的治疗方法, 提高患者的生存率和生存质量。靶向治疗CRPC是未来可行的治疗策略, 许多研究学者正在为此不断探索, 其中靶向AR的治疗方案已经在PCa的早期和中期临床治疗中获益, 但是其在疾病发展至去势抵抗后的疗效差强人意, 因此更多的非雄激素导向的其他信号通路被纳入研究者的视野, 包括经典的致癌信号通路和免疫炎症致癌信号通路等。随着这些非雄激素靶向的信号通路在CRPC发生发展中的作用机制被揭示, 更多的独立于AR外的靶点药物以期被开发应用于CRPC的治疗或者辅助治疗, 有望为目前临床CRPC治疗“无药”和“少药”的困境打开新的局面。
作者贡献:薛梦侠负责综述的撰写; 古悦负责相关文献的资料收集; 孙建国负责综述的审核; 王广基和彭英负责指导综述的写作与修改; 全体作者都阅读并同意最终的版本。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Feng X, Huang X. Research progress in formation mechanism of castration resistant prostate cancer[J]. Med Recapitulate(医学综述), 2019, 25: 3019-3023. |
| [3] |
Karantanos T, Corn PG, Thompson TC. Prostate cancer progression after androgen deprivation therapy: mechanisms of castrate resistance and novel therapeutic approaches[J]. Oncogene, 2013, 32: 5501-5511. DOI:10.1038/onc.2013.206 |
| [4] |
Linja MJ, Savinainen KJ, Saramäki OR, et al. Amplification and overexpression of androgen receptor gene in hormone-refractory prostate cancer[J]. Cancer Res, 2001, 61: 3550-3555. |
| [5] |
Guo Z, Yang X, Sun F, et al. A novel androgen receptor splice variant is up-regulated during prostate cancer progression and promotes androgen depletion-resistant growth[J]. Cancer Res, 2009, 69: 2305-2313. DOI:10.1158/0008-5472.CAN-08-3795 |
| [6] |
Coogan CL, McKiel CF. Percutaneous cryoablation of the prostate: preliminary results after 95 procedures[J]. J Urol, 1995, 154: 1813-1817. DOI:10.1016/S0022-5347(01)66791-0 |
| [7] |
Braglia L, Zavatti M, Vinceti M, et al. Deregulated PTEN/PI3K/AKT/mTOR signaling in prostate cancer: still a potential druggable target?[J]. Biochim Biophys Acta Mol Cell Res, 2020, 1867: 118731. DOI:10.1016/j.bbamcr.2020.118731 |
| [8] |
Zhang L, Lin W, Chen X, et al. Tanshinone IIA reverses EGFand TGF-β1-mediated epithelial-mesenchymal transition in HepG2cells via the PI3K/Akt/ERK signaling pathway[J]. Oncol Lett, 2019, 18: 6554-6562. |
| [9] |
Carver BS, Chapinski C, Wongvipat J, et al. Reciprocal feedback regulation of PI3K and androgen receptor signaling in PTENdeficient prostate cancer[J]. Cancer Cell, 2011, 19: 575-586. DOI:10.1016/j.ccr.2011.04.008 |
| [10] |
Yan Y, Huang H. Interplay among PI3K/AKT, PTEN/FOXO and AR signaling in prostate cancer[J]. Adv Exp Med Biol, 2019, 1210: 319-331. |
| [11] |
Wang Y, Kreisberg JI, Ghosh PM. Cross-talk between the androgen receptor and the phosphatidylinositol 3-kinase/Akt pathway in prostate cancer[J]. Curr Cancer Drug Targets, 2007, 7: 591-604. DOI:10.2174/156800907781662248 |
| [12] |
Cai F, Zhang Y, Li J, et al. Isorhamnetin inhibited the proliferation and metastasis of androgen-independent prostate cancer cells by targeting the mitochondrion-dependent intrinsic apoptotic and PI3K/Akt/mTOR pathway[J]. Biosci Rep, 2020, 40: BSR20192826. DOI:10.1042/BSR20192826 |
| [13] |
Yasumizu Y, Miyajima A, Kosaka T, et al. Dual PI3K/mTOR inhibitor NVP-BEZ235 sensitizes docetaxel in castration resistant prostate cancer[J]. J Urol, 2014, 191: 227-234. DOI:10.1016/j.juro.2013.07.101 |
| [14] |
Batra A, Winquist E. Emerging cell cycle inhibitors for treating metastatic castration-resistant prostate cancer[J]. Expert Opin Emerg Drugs, 2018, 23: 271-282. DOI:10.1080/14728214.2018.1547707 |
| [15] |
e15-79. e22.
|
| [16] |
Gross ME, Dorff TB, Quinn DI, et al. Safety and efficacy of docetaxel, bevacizumab, and everolimus for castration-resistant prostate cancer(CRPC)[J]. Clin Genitourin Cancer, 2018, 16: e11-e21. DOI:10.1016/j.clgc.2017.07.003 |
| [17] |
Khurana N, Sikka SC. Interplay between SOX9, Wnt/β-catenin and androgen receptor signaling in castration-resistant prostate cancer[J]. Int J Mol Sci, 2019, 20: 2066. DOI:10.3390/ijms20092066 |
| [18] |
Zhang Z, Cheng L, Li J, et al. Inhibition of the Wnt/β-catenin pathway overcomes resistance to enzalutamide in castrationresistant prostate cancer[J]. Cancer Res, 2018, 78: 3147-3162. DOI:10.1158/0008-5472.CAN-17-3006 |
| [19] |
Sha J, Han Q, Chi C, et al. PRKAR2B promotes prostate cancer metastasis by activating Wnt/β-catenin and inducing epithelialmesenchymal transition[J]. J Cell Biochem, 2018, 119: 7319-7327. DOI:10.1002/jcb.27030 |
| [20] |
Lee E, Ha S, Logan SK. Divergent androgen receptor and betacatenin signaling in prostate cancer cells[J]. PLoS One, 2015, 10: e0141589. DOI:10.1371/journal.pone.0141589 |
| [21] |
Pak S, Park S, Kim Y, et al. The small molecule WNT/β-catenin inhibitor CWP232291 blocks the growth of castration-resistant prostate cancer by activating the endoplasmic reticulum stress pathway[J]. J Exp Clin Cancer Res, 2019, 38: 342. DOI:10.1186/s13046-019-1342-5 |
| [22] |
Zhong D, Zhang HJ, Jiang YD, et al. Saikosaponin-d: a potential chemotherapeutics in castration resistant prostate cancer by suppressing cancer metastases and cancer stem cell phenotypes[J]. Biochem Biophys Res Commun, 2016, 474: 722-729. DOI:10.1016/j.bbrc.2016.05.017 |
| [23] |
Ehmer U, Sage J. Control of proliferation and cancer growth by the Hippo signaling pathway[J]. Mol Cancer Res, 2016, 14: 127-140. DOI:10.1158/1541-7786.MCR-15-0305 |
| [24] |
Collak FK, Demir U, Sagir F. YAP1 is involved in tumorigenic properties of prostate cancer cells[J]. Pathol Oncol Res, 2020, 26: 867-876. DOI:10.1007/s12253-019-00634-z |
| [25] |
Zhang L, Yang S, Chen X, et al. The hippo pathway effector YAP regulates motility, invasion, and castration-resistant growth of prostate cancer cells[J]. Mol Cell Biol, 2015, 35: 1350-1362. DOI:10.1128/MCB.00102-15 |
| [26] |
Jiang N, Ke B, Hjort-Jensen K, et al. YAP1 regulates prostate cancer stem cell-like characteristics to promote castration resistant growth[J]. Oncotarget, 2017, 8: 115054-115067. DOI:10.18632/oncotarget.23014 |
| [27] |
Zanconato F, Battilana G, Cordenonsi M, et al. YAP/TAZ as therapeutic targets in cancer[J]. Curr Opin Pharmacol, 2016, 29: 26-33. DOI:10.1016/j.coph.2016.05.002 |
| [28] |
Kuser-Abali G, Alptekin A, Lewis M, et al. YAP1 and AR interactions contribute to the switch from androgen-dependent to castration-resistant growth in prostate cancer[J]. Nat Commun, 2015, 6: 8126. DOI:10.1038/ncomms9126 |
| [29] |
Gao J, Zhang Y, Chen H, et al. Computational insights into the interaction mechanism of transcription cofactor vestigial-like protein 4 binding to TEA domain transcription factor 4 by molecular dynamics simulation and molecular mechanics generalized born/surface area calculation[J]. J Biomol Struct Dyn, 2019, 37: 2538-2545. DOI:10.1080/07391102.2018.1491889 |
| [30] |
Tang Z, Ma Q, Wang L, et al. A brief review: some compounds targeting YAP against malignancies[J]. Future Oncol, 2019, 15: 1535-1543. DOI:10.2217/fon-2019-0035 |
| [31] |
Zgajnar NR, De Leo SA, Lotufo CM, et al. Biological actions of the Hsp90-binding immunophilins FKBP51 and FKBP52[J]. Biomolecules, 2019, 9: 52. DOI:10.3390/biom9020052 |
| [32] |
Chen L, Yang F, Li T, et al. Extracellular histone promotes prostate cancer migration and epithelial-mesenchymal transition through NF-κB-mediated inflammatory responses[J]. Chemotherapy, 2019, 64: 177-186. DOI:10.1159/000504247 |
| [33] |
Catz SD, Johnson JL. Transcriptional regulation of bcl-2 by nuclear factor kappa B and its significance in prostate cancer[J]. Oncogene, 2001, 20: 7342-7351. DOI:10.1038/sj.onc.1204926 |
| [34] |
Thapa D, Ghosh R. Chronic inflammatory mediators enhance prostate cancer development and progression[J]. Biochem Pharmacol, 2015, 94: 53-62. DOI:10.1016/j.bcp.2014.12.023 |
| [35] |
Yu J, Sun L, Hao T, et al. Restoration of FKBP51 protein promotes the progression of castration resistant prostate cancer[J]. Ann Transl Med, 2019, 7: 729. DOI:10.21037/atm.2019.11.127 |
| [36] |
Zou P, Zhang Q, Zhou J, et al. Inhibitory effect of polyphyllin I on the proliferation of prostate cancer PC3 cells via ERK1/2/P65/DNMT1 and its molecular mechanism[J]. NatI J Androl(中华男科学杂志), 2018, 24: 199-205. |
| [37] |
Deng C, Chen J, Guo S, et al. CX4945 suppresses the growth of castration-resistant prostate cancer cells by reducing AR-V7expression[J]. World J Urol, 2017, 35: 1213-1221. DOI:10.1007/s00345-016-1996-y |
| [38] |
Zheng X, Chang RL, Cui XX, et al. Inhibition of NF-kappaB by(E)3-[(4-methylphenyl)-sulfonyl]-2-propenenitrile(BAY11-7082; BAY)is associated with enhanced 12-O-tetradecanoylphorbol-13-acetate-induced growth suppression and apoptosis in human prostate cancer PC-3 cells[J]. Int J Oncol, 2008, 32: 257-264. |
| [39] |
Kong C, Hao M, Chen X, et al. NF-κB inhibition promotes apoptosis in androgen-independent prostate cancer cells by the photothermal effect via the IκBα/AR signaling pathway[J]. Biomater Sci, 2019, 7: 2559-2570. DOI:10.1039/C8BM01007B |
| [40] |
Malinowska K, Neuwirt H, Cavarretta IT, et al. Interleukin-6stimulation of growth of prostate cancer in vitro and in vivo through activation of the androgen receptor[J]. Endocr Relat Cancer, 2009, 16: 155-169. DOI:10.1677/ERC-08-0174 |
| [41] |
Tam L, McGlynn LM, Traynor P, et al. Expression levels of the JAK/STAT pathway in the transition from hormone-sensitive to hormone-refractory prostate cancer[J]. Br J Cancer, 2007, 97: 378-383. DOI:10.1038/sj.bjc.6603871 |
| [42] |
Ge D, Gao AC, Zhang Q, et al. LNCaP prostate cancer cells with autocrine interleukin-6 expression are resistant to IL-6-induced neuroendocrine differentiation due to increased expression of suppressors of cytokine signaling[J]. Prostate, 2012, 72: 1306-1316. DOI:10.1002/pros.22479 |
| [43] |
Xu L, Chen X, Shen M, et al. Inhibition of IL-6-JAK/Stat3signaling in castration-resistant prostate cancer cells enhances the NK cell-mediated cytotoxicity via alteration of PD-L1/NKG2D ligand levels[J]. Mol Oncol, 2018, 12: 269-286. DOI:10.1002/1878-0261.12135 |
| [44] |
Gu L, Liao Z, Hoang DT, et al. Pharmacologic inhibition of Jak2-Stat5 signaling by Jak2 inhibitor AZD1480 potently suppresses growth of both primary and castrate-resistant prostate cancer[J]. Clin Cancer Res, 2013, 19: 5658-5674. DOI:10.1158/1078-0432.CCR-13-0422 |
| [45] |
Thaper D, Vahid S, Kaur R, et al. Galiellalactone inhibits the STAT3/AR signaling axis and suppresses enzalutamide-resistant prostate cancer[J]. Sci Rep, 2018, 8: 17307. DOI:10.1038/s41598-018-35612-z |
| [46] |
Karkera J, Steiner H, Li W, et al. The anti-interleukin-6 antibody siltuximab down-regulates genes implicated in tumorigenesis in prostate cancer patients from a phase I study[J]. Prostate, 2011, 71: 1455-1465. DOI:10.1002/pros.21362 |
| [47] |
Hudes G, Tagawa ST, Whang YE, et al. A phase 1 study of a chimeric monoclonal antibody against interleukin-6, siltuximab, combined with docetaxel in patients with metastatic castrationresistant prostate cancer[J]. Invest New Drugs, 2013, 31: 669-676. DOI:10.1007/s10637-012-9857-z |
| [48] |
Yoneda T, Kunimura N, Kitagawa K, et al. Overexpression of SOCS3 mediated by adenovirus vector in mouse and human castration-resistant prostate cancer cells increases the sensitivity to NK cells in vitro and in vivo[J]. Cancer Gene Ther, 2019, 26: 388-399. DOI:10.1038/s41417-018-0075-5 |
| [49] |
Zhang L, Xu LJ, Zhu J, et al. ATM-JAK-PD-L1 signaling pathway inhibition decreases EMT and metastasis of androgenindependent prostate cancer[J]. Mol Med Rep, 2018, 17: 7045-7054. |
| [50] |
Ritprajak P, Azuma M. Intrinsic and extrinsic control of expression of the immunoregulatory molecule PD-L1 in epithelial cells and squamous cell carcinoma[J]. Oral Oncol, 2015, 51: 221-228. DOI:10.1016/j.oraloncology.2014.11.014 |
| [51] |
Shibue T, Weinberg RA. EMT, CSCs, and drug resistance: the mechanistic link and clinical implications[J]. Nat Rev Clin Oncol, 2017, 14: 611-629. DOI:10.1038/nrclinonc.2017.44 |
| [52] |
Karzai F, VanderWeele D, Madan RA, et al. Activity of durvalumab plus olaparib in metastatic castration-resistant prostate cancer in men with and without DNA damage repair mutations[J]. J Immunother Cancer, 2018, 6: 141. DOI:10.1186/s40425-018-0463-2 |
| [53] |
Fankhauser CD, Schüffler PJ, Gillessen S, et al. Comprehensive immunohistochemical analysis of PD-L1 shows scarce expression in castration-resistant prostate cancer[J]. Oncotarget, 2017, 9: 10284-10293. |
| [54] |
Modena A, Ciccarese C, Iacovelli R, et al. Immune checkpoint inhibitors and prostate cancer: a new frontier?[J]. Oncol Rev, 2016, 10: 293. |
| [55] |
Brahmer JR, Drake CG, Wollner I, et al. Phase I study of single-agent anti-programmed death-1(MDX-1106)in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immunologic correlates[J]. J Clin Oncol, 2010, 28: 3167-3175. DOI:10.1200/JCO.2009.26.7609 |
| [56] |
Lu X, Horner JW, Paul E, et al. Effective combinatorial immunotherapy for castration-resistant prostate cancer[J]. Nature, 2017, 543: 728-732. DOI:10.1038/nature21676 |
 2021, Vol. 56
2021, Vol. 56


