2. 江苏省中医药研究院, 江苏 南京 210028
2. Jiangsu Province Academy of Traditional Chinese Medicine, Nanjing 210028, China
脏器纤维化是器官损伤后, 在组织修复过程中细胞外基质(extracellular matrix, ECM)生成和降解失衡导致结缔组织成分过度沉积, 进而形成损伤后愈合瘢痕组织的病理生理过程。与脏器纤维化相关的死亡率达到全世界自然死亡的1/3, 而用于治疗纤维化的方法非常有限, 且疗效并不理想。其中肝纤维化和(或)肾纤维是较常见的脏器纤维化, 故而研发安全有效的肝肾纤维化治疗药物是当前的热点问题[1]。虽然肝纤维化与肾纤维化的发病病因、病变部位及临床表现不一, 但它们具有共同或相似的病理特点和发病机制, 即病理形态上均表现为ECM异常增多与过度沉积, 发病机制主要是病理损伤时ECM生成细胞在脂质过氧化产物、细胞因子与异常胞外基质环境等刺激下激活或转分化, 转变为肌成纤维细胞, 大量增殖并生成ECM成分导致胶原异常沉积。各类慢性疾病引发的损伤/炎症也是肝/肾纤维化发生发展的主要诱因, 此外急性损伤所诱发的氧化应激和炎症等“后遗效应”, 令急性病与慢性病之间的差距正在缩短, 表明急性损伤可能也是纤维化的诱发因素之一。肝硬化患者并发急性肾损伤所引发的肝肾综合征是肝硬化患者死亡的主要原因之一[2]。糖尿病除了引起的肾脏疾病外, 也是肝病最常见的病因。这包括肝酶异常、非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)、肝硬化、肝细胞癌和急性肝衰竭。其中, 肝硬化已经成为糖尿病相关死亡的第四大原因[3]。因此, 同时存在肝纤维化与肾纤维化符合临床发病规律, 然而对于肝肾相关疾病相互影响的具体机制尚未清晰, 深入研究肝-肾轴有望解决这一学术问题。
肝肾纤维化亦与肠道菌群相关——肠道菌群是评估宿主健康和疾病的重要指标, 近年研究表明肠道微生物群的改变与肾脏/肝脏纤维化的发生发展密切相关, 靶向肠-肝-肾轴在防治以及诊断肝肾纤维化方面具有巨大的研究前景及潜力, 本文基于肠-肝-肾轴对肝肾纤维化的相关性进行综述, 希望能够推动对肝肾纤维化机制的研究, 为相关诊疗方案提供理论依据。
1 肝-肾轴与肝肾纤维化器官间的串扰是近年来的热点问题。在西医中, 轴即器官之间通过内分泌、神经或直接的细胞-细胞信号等途径影响彼此的功能, 肝-肾轴则是以此方式促进或延缓肝肾纤维化的发展[4]。
1.1 肝-肾轴理论的现代研究在肝/肾硬化阶段, 器官移植是目前最有效的治疗手段。肾损伤是肝移植术后常见并发症, 且术后肾损伤将极大地降低患者生存率, 故而进行肝移植前后对肾功能进行评估是国内专家学者的共识。与其他病因诱发的肝硬化相比, 非酒精性脂肪性肝炎(non-alco-holic steatohepatitis, NASH)相关性肝硬化患者发生肾衰竭风险高, 同时进行肝肾移植的必要性更高[5]。此外, 术前患者患有糖尿病/高血压, 在患者术后使用的钙调磷酸酶抑制剂具有肾毒性, 以及肝移植时为避免大出血而引起缺血再灌注(ischemia reperfusion, I/R)损伤等均能增加肾脏损伤风险[6, 7]。而肾移植术后肝损伤也是临床常见的现象, 在临床上肾衰竭患者同时进行肝肾移植的情况亦时有发生。
肝病与肾病间亦有直接联系, 慢性肾病(chronic kidney disease, CKD)进程中促纤维化因子、活性氧(reactive oxygen species, ROS)的累积和全身炎症的增加促进肾纤维化的发生, 并造成肝损伤导致慢性肝病(chronic liver disease, CLD); CLD过程中产生的相关因子亦会导致肝纤维化, 并引起肾损伤导致CKD。NAFLD虽然不能直接导致慢性肾病(chronic kidney disease, CKD), 但NAFLD已成为CKD快速发展的独立风险因素[8, 9]。酒精性肝病(alcohol liver disease, ALD)肝损伤加重会减轻胰岛素灭活, 胰岛素能促进瘦素分泌, 瘦素在胰岛素抵抗以及糖代谢紊乱中发挥着十分重要的作用, 因此, ALD将进一步加重脂肪肝引起肝纤维化; 与之相似的是, 糖尿病肾病对肝炎的发生有直接影响, 糖尿病肾病小鼠的血糖升高, 使肝糖原储存增加, 出现肝脂质代谢异常, 增加了脂肪肝风险, 最终可发展为肝炎甚至肝硬化[10]。这些学术观点共同说明肝肾二者在发病学上有紧密联系, 但目前其具体机制尚未清晰, 还需进一步深入挖掘。
1.2 肝-肾轴与肝肾纤维化发病机制的研究实际临床中, 患者存在肝肾综合征(hepatorenal syndrome, HRS)或胆汁淤积引起的肝纤维化与肾纤维化、原发性/继发性肾病综合征等疾病间接证明了肝-肾轴的重要性, 表明肝肾二者具有相同的疾病易感性或关联性(图 1)[4, 11, 12]。
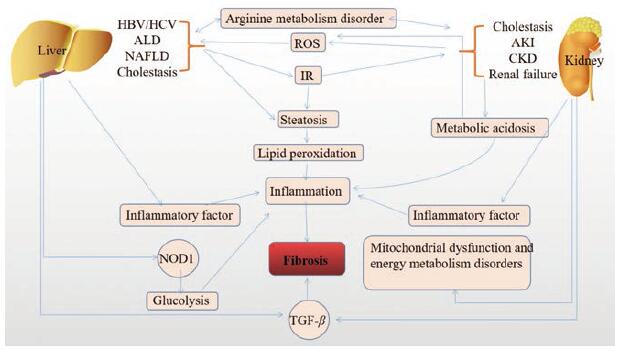
|
Figure 1 A schematic diagram of liver-kidney axis in the process of hepatorenal fibrosis.HBV/HCV: Hepatitis B virus/hepatitis C virus; ALD: Alcohol liver disease; NAFLD: Non-alcohol fatty liver disease; ROS: Reactive oxygen species; IR: Insulin resistance; AKI: Acute kid-ney injury; CKD: Chronic kidney disease; NOD1:Nod-like receptor-X1;TGF-β: Transforming growth factor-β |
肝肾综合征是指在严重肝病时发生的急性肾功能衰竭, 其中急性肾损伤(acute kidney injury, AKI)是肝硬化腹水患者的常见并发症, AKI患者肝功能不全在临床上亦时有发生[11, 12]。在755例超声诊断的NAFLD患者中, 高纤维化(FIB)-4评分与普遍的CKD风险增加相关[4]。至于胆汁淤积引起肝肾综合征, Varga等[13, 14]在通过胆总管结扎(bile duct ligation, BDL)建立胆汁淤积模型时发现, BDL术后在造成肝纤维化的同时诱导肾脏胶原沉积, 这可能与精氨酸代谢紊乱相关。通过BDL模型造成肝肾纤维化后发现线粒体功能障碍和能量代谢紊乱是胆汁淤积相关肾损伤的基本机制[15]。Ghallab等[16]研究发现通过BDL结扎1~3天后, 少量分散的肝细胞发生胆汁性微梗死(微梗死即肉眼无法直接观察到, 仅能通过病理观测到的梗死灶), 随后发生更大的梗死, 累及邻近的肝细胞, 使胆汁从过量的胆道泄漏到血液中, 从而减轻肝脏受到的胆汁酸毒性影响; 在小鼠尿液中检测到胆汁酸含量显著上升, 可能与肾脏通过提高多药耐药相关蛋白(multidrug resistance-associated protein, Mrp) 2和Mrp4蛋白表达量, 以增加胆汁酸的摄取量相关, 这对于肝脏是一个重要的保护作用, 直至胆性肾病发生。这也表明通过给予患者利尿剂对于胆汁淤积具有治疗效果。此外, 胆汁酸通过激活法尼酯X受体(farnesoid X receptor, FXR)和G蛋白偶联受体胆汁酸受体1 (又称TGR5)以及与脂质、胆固醇和碳水化合物代谢相关的转录因子, 调控参与炎症和肾纤维化的基因, 也表明通过靶向胆汁酸FXR受体对肾纤维化进行治疗存在可能[17]。
1.2.2 肝-肾轴在肾病综合征中的体现继发性肾病综合征常由乙型肝炎介导, 慢性乙型肝炎或丙型肝炎患者同时患CKD概率高, 且CKD发病以及尿蛋白、尿酸的升高等均与血清中乙肝病毒(hepatitis B virus, HBV)或HCV病毒含量相关[18]。临床上, 确有部分乙肝病毒相关性肾炎患者在肝硬化同时也有不同程度的肾小管间质纤维化。患者携带HBV显著增加发生胰岛素抵抗(insulin resistance, IR)的风险, 导致糖尿病以及后续动脉粥样硬化风险增加, 还提高了转化生长因子-β(transforming growth factor-β, TGF-β)水平, 导致细胞凋亡, 增加了肾纤维化风险[19]。乙肝病毒性肾炎患者在肾脏发现乙肝病毒标志物HBs Ag和HBc Ag, 证明乙肝病毒免疫复合物可在肾脏沉积或HBV能直接攻击肾脏, 所发生的病毒性肾炎与因此引发的免疫反应相关[20, 21]。乙肝病毒性肾炎患者的白细胞表面抗原HLA-A3和HLA-A10比正常人高, 证明乙肝致肾炎还可能与遗传因素相关[21]。此外, 治疗HBV的一线用药阿德福韦酯会在肾小管汇集, 转运至肾上皮细胞, 对肾脏造成损伤[22]。HBV感染过程中的脂质变性是一个典型特征, 可能引起脂质过氧化, 增加血浆中炎症标志物, 后续导致肾脏损伤。
糖尿病是肾纤维化的主要原因之一, 而Tang等[3]通过db/db小鼠建立2型糖尿病(type 2 diabetes, T2D)模型, 发现肾纤维化发生后出现了肝纤维化, 通过抑制钠-葡萄糖转运受体2 (sodium-glucose cotransporter 2, SGLT2)能延缓肝肾纤维化的进程。肝脏作为胰岛素抵抗发生的重要靶器官, 胰岛素抵抗引起的糖代谢异常, 会加重酒精性脂肪肝, 亦能发展为T2D或促进其恶化[23]。表明SGLT2抑制剂与胰岛素联合使用能缓解T2D导致的肝肾纤维化, 靶向肝脏治疗胰岛素抵抗是治疗糖尿病的方式之一。此外, 胰高血糖素能通过肌醇三磷酸受体1 (inositol triphosphate receptor 1, INSP3R1)增加肝脂肪甘油三酯脂肪酶(adipose triac-ylglyceride lipase, ATGL)活性、肝内脂解、肝乙酰辅酶A含量及丙酮酸羧化酶通量来刺激糖异生, 同时增加线粒体脂质氧化, 促进T2D的发生[24]。肾衰竭患者长期血液透析后发生代谢性酸中毒以及全身性炎症, 肾纤维化过程中产生的炎症/促炎因子(IL-1β和TNF-α等)、纤维化相关因子[TGF-βs和α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)等]以及ROS均会对肝脏造成影响[25]。此外, 肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)的任何扰动都会加重肝脏功能障碍。且RAAS的过度激活与NAFLD、肝纤维化以及肝硬化相关[4, 26]。
2 肠-肝轴与肝纤维化发病机制的研究肝脏作为富集大量免疫细胞及肠道菌群分泌的内毒素的免疫中枢, 肝纤维化的发生无疑与肠道关系紧密[27]。肠-肝轴一方面通过肠-肝循环直接相互影响, 由于体内生态失调、肠道屏障受损和免疫状态改变, 使细菌产物可通过门静脉到达肝脏, 在门静脉被特异性受体识别, 激活免疫系统, 导致促炎反应[28]。通过动物实验发现肠道菌群失衡和细菌易位(bacterial translo-cation, BT)在肝纤维化的发病中起重要作用, 且肝纤维化不同发病原因、不同阶段均会导致肠道菌发生相应的独特变化, 与临床患者的研究检查结果相似(表 1[29-44]), 这也表明肠道菌发展为肝纤维化诊断方法的潜力。Philips等[45]报道了粪便微生物移植(fecal mi-crobiome transplantation, FMT)对8例重度NASH患者的治疗效果: 肝脏疾病的严重程度在FMT后的第1周内显著降低, 并且在1年的随访中效果持续, 生存率显著提高。粪便微生物组分析显示, 1年后厚壁菌门的丰度较高, FMT后变形菌门减少, 放线菌门增加。上皮细胞甲烷代谢和细菌侵袭降低, 胆汁分泌改善至接近正常水平。上述结果表明, 肝脏疾病的严重程度可以通过肠道菌群的特定变化体现, 靶向肠-肝轴研究将拓宽对肝纤维化发病机制的思路, 为肝纤维化的诊疗提供新策略。
| 表 1 The correlation between intestinal flora imbalance and the etiology and development stage of liver fibrosis |
此外, 肠道菌群作为胆汁酸代谢的调节剂也于纤维化过程中发挥着重要的作用, 能将初级胆汁酸代谢为次级胆汁酸, 进一步通过FXR诱发炎症、影响免疫反应, 促进肝纤维化的进程; 与之相对应的是胆汁酸代谢可通过FXR影响肠道通透性和门脉高压[46]。其中, 胆汁淤积性肝病是诱发肝硬化的因素之一, 胆汁淤积几乎100%能造成肝硬化, 但是目前对胆汁淤积与肝硬化之间的联系及机制尚不清楚。传统认为, 胆汁酸具有细胞毒性, 但细胞培养中的胆汁酸浓度大大超过了病理生理范围; 也有观点认为肝中胆汁淤积可导致肝细胞凋亡[47]。鹅去氧胆酸[48]通过TGR5/EGFR信号通路诱导形成ROS, 同时促进巨噬细胞释放三磷酸腺苷(adenosine triphosphate, ATP), 通过P2X7受体外排K+; 释放的ATP和K+可能是促进巨噬细胞NLRP3炎症小体激活和炎症因子IL-1β(interleukin-1β, IL-1β)释放的原因, 而炎症损伤是诱发纤维化的重要过程。Liao等[49]也发现在Mdr2相关的原发性胆管炎中发生肠道屏障功能障碍及增加细菌易位的概率, 同时内毒素通过门静脉转移至肝脏激活NLRP3炎症小体引起肝损伤, 进一步促进肝病发展。在BDL造成的肝纤维化模型组中[50]发现, 野生型小鼠与TLR4-KO小鼠发生了相似的肝损伤, 但TLR4-KO小鼠肝纤维化程度显著降低, 表明胆汁淤积时TLR4信号通路的缺失有保肝作用。此外, 在肝星状细胞(hepatic stellate cells, HSCs)中TLR4的激活一方面上调了趋化因子的分泌, 进而诱导枯否细胞的趋化; 另一方面下调了TGF-β伪受体[骨形态发生蛋白和激活素膜结合抑制剂(bone morpho-genetic protein and activin membrane-bound inhibitor, BAMBI)]比值, 从而提高HSCs对TGF-β的敏感性, 使枯否细胞无限制的激活。通过图 2可以看出, 胆汁淤积性肝纤维化的发病原因与HSCs中TLR4信号通路的激活相关。
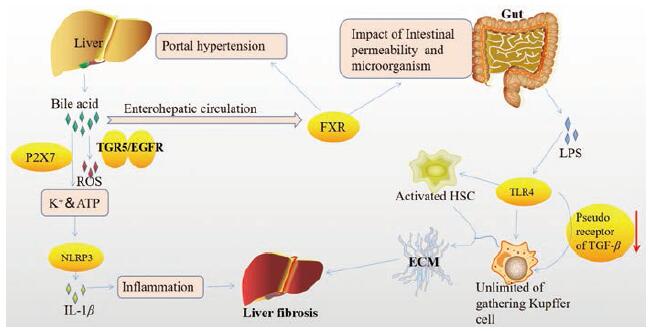
|
Figure 2 The presence of the enteric-hepatic axis in the process of hepatic fibrosis due to cholestasis.ATP: Adenosine triphosphate; IL-1β: Interleukin-1β; TGR5/EGFR: G protein coupled bile acid receptor Gpbar1/epidermal growth factor receptor; FXR: Farnesoid X receptor; LPS: Lipopolysaccharide; TLR4:Toll-like receptor 4 |
肠-肝轴的另一方面则通过肠道吸收摄取物质, 循环至肝脏处进行代谢间接相互影响, 或者通过肠道菌群的特定变化以及相关代谢产物或分泌细胞因子与肝脏相互作用。有研究[51]表明, 肝细胞生长因子(hepa-tocyte growth factor, HGF)水平随着酒精性肝硬化的发展明显提高, 但目前对HGF在酒精性肝硬化方面研究有所欠缺。NAFLD的发病机制主要是与免疫反应及氧化应激相关, 可进一步发展为NASH, 其中有20%的NASH患者发展为肝硬化[52]。NASH发展为肝硬化会显著增加患者死亡率, 而在NASH纤维化过程中除了减肥和控制代谢之外暂无有效的治疗方案。研究发现, 特异性敲除小鼠肝脏Nemo (即IKKγ基因, Nemo△hepa)可以诱导造成类似于NASH的慢性肝损伤, Nemo△hepa & MyD88-/-双敲除的小鼠几乎没有炎症, 疾病进展相较于对照组(Nemo△hepa)也有所减缓, 特异性敲除肝脏My D88小鼠则与Nemo△hepa相近, 证明小鼠NASH的发病进展与非肝实质My D88依赖的TLRs信号通路诱发的炎症相关[23]。另有研究[53]发现, Nod样受体X1 (Nod-like receptor-X1, NLRX1, 即NOD1)是治疗NAFLD的新靶点, 通过敲除NOD1来提高线粒体脂肪酸依赖的氧合酶来减少脂肪变性, 降低糖酵解等限制肝细胞能量代谢, 以减少肝纤维化的发生及预防肾损伤。因此, 在结合研究疾病发展与肠道菌群动态变化相关性的基础上, 研发通过检测肠道菌来诊断疾病的病因及发展阶段, 发展出非侵入性的疾病诊断方法, 对疾病的早发现、早治疗具有积极意义。且证明深入研究肠-肝轴对于肝纤维化发生发展机制将会有新的见解, 为治疗肝纤维化提供新思路、新策略。
3 肠-肾轴与肾纤维化发病机制的研究与肠-肝轴相似, 近期研究表明肠道菌群与肾纤维化间也存在一定的串扰关系(图 3)。Yoshifuji等[54]采用5/6肾切除诱导晚期肾纤维化模型, 发现拟杆菌(Bacteroides, Bact)和普氏杆菌(Prevotella)数量较多, 乳酸杆菌(Lactobacillus, Lact)减少明显, 而补充Lact能激活识别Lact的TLR2以改善肾脏损害和肠道变化。在腺嘌呤诱导的小鼠肾衰竭模型中, 通过给予利那洛肽(用于治疗成人慢性特发性便秘和便秘型肠易激综合症)可以改善小鼠肾纤维化水平, 减少F4/80(巨噬细胞表面标志蛋白)阳性细胞在结肠的含量, 降低三甲胺-N-氧化物(trimethylamine-N-oxide, TMAO)水平, 病理改善可能与梭菌目菌的变化相关[55]。Gupta等[56]发现肠道微生物胆碱三甲胺裂解酶抑制剂(碘甲基胆碱)抑制胆碱饮食引起的肾小管间质纤维化和促纤维化基因表达, 该研究揭示了一种以肠道微生物TMAO途径为靶点的新方法, 既能在体内防止肾功能衰退和小管间质纤维化, 同时还能限制药物全身暴露和潜在的宿主不良反应。Zou等[57]也发现通过大黄剂灌肠(结肠)可以加速肠道动力学, 改善肠道屏障功能, 调节肠道菌群, 减少肠道源性尿毒症毒素(如吲哚酚硫酸盐)的产生和吸收, 从而延缓肾脏纤维化等肾脏疾病进程。Ding等[58]发现服用益生菌VSL#3通过IL-10/GSK3β/PTEN上调肾I/R损伤后肠道屏障相关蛋白(ZO-1、Occludin和Claudin-1), 减少肠道屏障破坏, 降低循环内毒素水平。表明一方面终末期肾病会影响肠道菌群的组成和代谢, 另一方面微生物代谢产物是尿毒症的毒素来源, 包括硫酸吲哚酯(indoles sulfate, IS)、对甲酚硫酸盐(para-cresol sulfate)和TMAO[59, 60]。此外, 近期有研究[61]首次发现健康人肾脏中存在细菌定植, 并且健康人与肾癌患者(无尿路感染)肾脏定植的细菌具有显著差异(P < 0.000 1), 这一发现为肠-肾轴理论扫平了障碍, 证明了肠-肾间的相互作用, 但目前对于肠-肾轴的研究深度不及肠-肝轴。
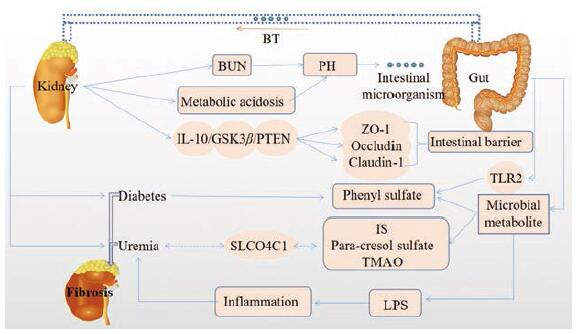
|
Figure 3 Diagram of the enterorenal axis in renal fibrosis.BT: Bacterial translocation; BUN: Blood urea nitrogen; TMAO: Trimethyl-amine-N-oxide; IL10/GSK3β/PTEN: Interleukin-10/glycogen synthase kinase-3β/phosphatase and tensin homologue; IS: Indoles sulfate; TLR2:Toll-like receptor 2 |
糖尿病是肾纤维化的主要原因, Kikuchi等[62]用非靶向代谢组学证明肠道微生物衍生代谢物苯基硫酸盐(phenyl sulfate)的水平随着糖尿病的进展而升高, 在蛋白尿情况稍好的大鼠肾脏中尿毒症毒素转运体有机阴离子转运多态(organic anion transporting polypep-tide, OATP: 人类肾脏中唯一的OATP即为SLCO4C1)表达则有所下降。其还证明抑制酪氨酸酚裂解酶可以减少糖尿病小鼠的白蛋白尿, 验证了肠-肾之间的相互作用。在人类患者中也有相似的情况: 苯硫酸盐水平与患者白蛋白尿基础水平显著相关, 并能预测未来两年内白蛋白尿的进展程度。Tao等[63]对14名2型糖尿病患者粪便进行检测后发现, 与健康人相比, 肾病患者的普氏菌丰度下降, 大肠杆菌则有所增加。终末期肾病具有全身性慢性炎症的表现, 部分归因于肠道上皮完整性丧失导致肠道BT, 且循环系统中脂多糖(lipopolysaccharide, LPS)增加也有助于维持慢性炎症。目前, 对终末期肾病治疗最有效的手段是肾移植, 研究发现肾移植术前s CD14水平较高与术后急性排异现象发生率较低相关, 其原因则可能是在肾移植后LPS水平可维持稳定, 同时有脂蛋白与LPS结合降低LPS活性以及患者长期暴露于内毒素导致的免疫耐受等有效减少了慢性炎症水平, 从而降低急性排异反应发生率[64]。在肾病中氨浓度增加导致体内pH值改变可能是肠道微生物变化的原因之一, 而肠道中LPS异常进入循环系统导致了全身性的炎症以及尿毒症, 表明肠-肾轴中肾脏与肠道菌群间是相互影响的[59, 65]。
4 肠-肝-肾轴与肝肾纤维化并存发病机制的研究肠道在肝-肾轴间扮演着十分重要的角色, 分别与肝肾有紧密的联系, 除了肝-肾直接相互作用外, 通过肠道微生物群进行间接的相互作用也对肝肾纤维化的发生发展有巨大的贡献。Iebba等[66]研究表明, 肝硬化患者的内毒素来源于肠道微生物, 外周血和门脉血中共检测到16种变形杆菌, 表明除了肠道位置菌群发生改变外还可能通过血液循环影响其余脏器, 这是肠-肝-肾轴的联系之一。且研究发现, 在高脂饮食诱导NASH模型中肠道血管屏障被破坏, 所引起的BT在NASH早期已经发生, 也表明肝纤维化发生的早期就可能发生肾损伤[67]。细菌感染(肠道BT)常导致肝硬化患者肾功能衰竭, 据报道患病率约为34%[68]。肝硬化患者由于免疫功能受损和肠道通透性增加, 导致门脉高压背景下的细菌移位, 从而增加了感染的风险。严重失代偿性肝、肾功能衰竭最可怕的并发症之一是肝肾综合征, 其中器官移植可能是目前唯一的治疗方法[68]。Kromrey等[69]采用静脉注射1×106~1×107菌落形成单位(colony-forming units, CFU)金葡球菌造成60%~80%小鼠肝肾脓肿, 未发现其他脏器出现脓肿, 表明细菌感染后肝肾组织病变的概率更大, 通过注射金葡球菌可建立肝肾损伤模型。Baranova等[70]对h SR-BI/II转基因小鼠注射LPS后, 发现转基因小鼠炎症因子[IL-1β、IL-6、趋化因子(C-X-C基序)配体1蛋白[chemokine (C-X-C motif) ligand 1 protein, CXCL1]和肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)]水平比野生型小鼠高2~3倍, 注射LPS后ROS生成增加, MAPK通路被激活, 其中肝组织中ERK1/2和肾组织中JNK活化显著; 炎症小体NLRP3也被激活, 诱导肝肾炎症发生, 表明LPS能破坏肝脏已建立的免疫耐受稳态, 造成肝肾炎症, 且具有进一步引起纤维化的潜力。在BDL模型中[71], 胆汁酸在组织内的淤积造成肝肾综合征, 与此同时转运蛋白Mrp1~5 m RNA在肝肾中上调, Mrp1~3 m RNA在肠道中上调, 其中Mrp1、3、4和5蛋白在肝脏中表达上调。组织中的胆汁酸在转运蛋白表达增加后依旧在组织中累积, 可能是由于转运蛋白的增加不足以补偿BDL后胆汁在组织中的淤积, 清除在组织中的胆汁酸有望解决胆汁淤积造成的肝肾损伤。胆汁淤积模型小鼠对LPS的敏感度更高, 胆汁酸与FXR通过调控NLRP3炎症小体可能在脓毒血症并发胆汁淤积的死亡率增高中具有重要的作用[72]。
肠-肝-肾轴实际上是肠-肝-肾器官之间通过各种途径影响彼此的功能, 在病理情况下在肠-肝-肾间出现异常串扰, 例如肠道病变时肠道上皮细胞受损, 肠道屏障受损可能引起BT和炎症性肠病等情况, 进一步诱发全身炎症, 促进肝/肾疾病进程。在肝/肾发生病变的同时, 也会作用于肠道发生BT, 进一步促进肝/肾疾病发展。此外, 肝病与肾病之间也有相互促进作用, 其中NAFLD会促进CKD的发生与发展, 肝硬化会导致肾功能衰竭的风险, 以及RAAS的异常会导致肝功能受损甚至肝纤维化等。因此, 肝肾纤维化与肠-肝-肾轴间具有紧密的联系, 加强对于肠-肝-肾轴与肝肾纤维化的相关性研究, 将推动对肝肾纤维化的发生机制的了解, 为探索肝肾纤维化的治疗策略提供新思路。
5 对研究肝/肾纤维化相关模型的建议在实验室进行疾病相关研究时, 建立符合临床疾病的模型是研究发病机制最基础的一步。目前, 对于肾纤维化模型绝大部分由肾毒性药物(马兜铃酸、布洛芬和庆大霉素等)和手术(单侧输尿管结扎和缺血再灌注损伤)等方法诱导, 动物在诱导后的短时间内出现死亡或发生纤维化病变, 建模过程中对于纤维化疾病的潜伏期和并发症等研究不足[73]。肾纤维化是在慢性肾病进展过程中结缔组织异常增生的病理过程, 其具有病程长、存在潜伏期及并发症等特点, 如慢性肾病还常伴有并发症的肝病: 糖尿病肾病在发展到晚期肾纤维化阶段会出现严重的肝损伤。因此, 笔者认为目前实验室纤维化模型采用的诱导方法未将疾病潜伏期、并发症纳入考察, 这不利于肾纤维化发病机制的研究。相比较而言, 采用病毒诱导的纤维化模型可能更加适合研究慢性肾病引发的肾纤维化在发病潜伏期时的预防与治疗, Roediger等[73]发现小鼠在感染了非典型肾细小病毒(mouse kidney parvovirus, MKPV) 200天后出现肾间质纤维化, 而在100天左右时才出现体重明显减轻的情况, 对于肾病患者无症状表现期的相关研究具有显著意义; Wang等[74]通过西方饮食诱导2型糖尿病的同时导致脂肪肝的发生等方式来研究肾纤维化的并发症则是一个良好的方式。此外, 以高脂饮食和右旋糖酐硫酸酯钠(dextran sulfate sodium, DSS)诱导则能增加肠道炎症以增加LPS易位, 促进肝脏炎症与肝纤维化的发生[75]。因而, 结合西方饮食与DSS共同诱导对于研究肝肾纤维化及其与肠道的关联性不失为一种良好造模的方法。对于肝纤维化而言, 采用人源化小鼠感染乙肝病毒不失为一种研究慢性肝病潜伏期问题的方法, 此外亦将肝病的并发症纳入考察, 如应采用BDL诱发肝纤维化的同时造成肾脏胶原沉积。对于体外模型而言, 由于肝/肾纤维化是体内器官层面的病变, 单一细胞系建模不足以体现病变的状态, 亦不利于挖掘疾病机制, 因而在以细胞系建立模型时, 通过将与纤维化发生机制相关的细胞进行共培养来建模, 能在一定程度上模拟体内环境, 值得深入研究。但由于细胞所处环境简单, 与体内复杂且稳定的环境不同, 产生无临床意义结果的概率更大。
笔者认为进行脏器纤维化的体内外实验研究时, 对所发现具有潜力的血液/尿液新标志物、治疗靶点等以实际临床患者的血检/活检结果加以验证后, 能使实验室模型符合临床疾病的发生发展规律, 并为由此得出治疗方法的临床可操作性提供有力证据。对作为当前基础生物学以及临床研究的重要工具——体外类器官模型来说(organoid, 一种以干细胞体外培养而成的具备微观三维结构的组织, 具有一定器官结构以及功能, 具备比采用细胞模型更合理的原生条件, 目前应用于肝、肾、肠、胰岛等方面), 以其接近生理三维的特点, 作为体内外实验的补充进行疾病机制/药效学的研究将推进对疾病发展和药物损伤等一系列病理生理活动的相关认知[76, 77]。目前已有研究[78]成功通过建立肝脏类器官体外模型用于检测促/抗肝纤维化的药物, 且药物作用在小鼠体内得到证实。因此, 随着技术的突破与研究的深入, 其作为动物模型以及细胞模型的补充应用于研究脏器纤维化将带来重大突破, 研究策略可通过细胞、类器官和啮齿类动物体内研究三层次进行, 并考虑到肠肝肾三者的相互关联性: 以肝纤维化研究为例, 肠、肝、肾三者相互影响促进肝纤维化的进程, 肠道通过微生物群直接或间接地影响疾病发展进程, 故而将微生物/微生物代谢物作为刺激因素参与肝肾纤维化的造模过程是可取的; 此外, 肝脏本身亦非单一类型细胞作用的结果。因此, 采用不同的刺激因素(如LPS、双链DNA和肽聚糖等)进行造模, 并将与肝纤维化发生相关的细胞进行共培养以研究各细胞间的相互作用或药效作用是否与不同细胞组成相关等, 如将在肝纤维化发生中起关键作用的HSC与其他相关细胞(肝细胞、枯否细胞和树突状细胞等)进行共培养, 考察星状细胞能否与其他细胞相互作用促进ECM的合成。之后, 通过类器官对细胞共培养得出的结果进行验证, 并开发类器官共培养的方法, 将肝/肾类器官进行共培养以验证并发症的具体发病机制。最后, 再通过体内实验证实前期实验结论, 并对肝/肾纤维化早期无症状阶段(即潜伏期)和并发症等问题进行相关研究, 证实相应靶点的治疗潜力。最后, 若能通过临床患者活检取出的组织进行相应免疫组化验证则更佳(图 4)。
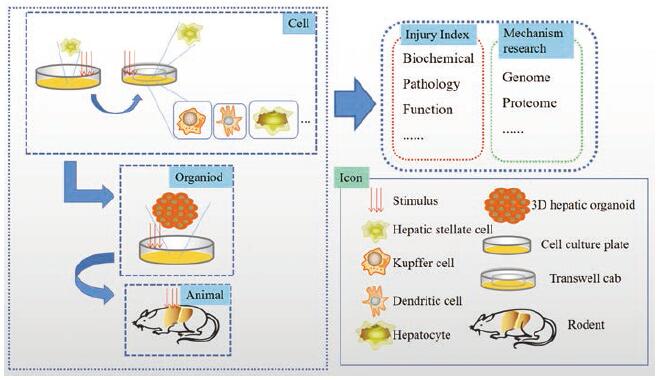
|
Figure 4 Analysis of research strategy of liver fibrosis |
目前, 对于纤维化患者的确诊通常是通过活检来确认, 但是活检是一种侵入性、昂贵的检测方法, 且可能由于取样位置的原因而造成误诊。因此, 发展一种新型的、非侵入性的检测方法就显得尤为重要。而针对肠-肝-肾轴, 有极大的可能发展出一种非侵入性的准确检测方法: 通过检测肠道菌群的丰度来对肝肾疾病的不同病因、不同阶段患者进行预测评估(表 2)。笔者认为, 这应该是未来肠-肝-肾轴与肝肾疾病相关性理论在诊断上的应用。
| 表 2 Analysis of related liver and kidney fibrosis with gut-liver-kidney axis. NASH: Non-alcoholic steatohepatitis; NLRX1: Nod-like receptor-X1; T2D: Type 2 diabetes; HGF: Hepatocyte growth factor; TNF-α: Tumor necrosis factor-α; α-SMA: α-Smooth muscle actin |
肝肾纤维化之间及其与肠道之间存在固有联系, 肠-肝-肾轴实际上是肠-肝-肾器官之间通过各种途径进行相互交流(图 5)。包括(1)不同病因、不同阶段肝纤维化患者肠道菌群的变化, 证实可以通过特定微生物群的丰度来诊断肝纤维化的阶段或发病原因——肠-肝轴。(2)通过采用分离自肠道后培养增殖的细菌来建立肾纤维化模型, 表明肠道与肾纤维化的相关性——肠-肾轴。(3)靶向肠道治疗, 改善肠道菌群紊乱以防治/延缓肝肾纤维化进程等说明靶向肠道菌群对于肝肾纤维化治疗作用的潜力。(4)通过胆管结扎在造成肝纤维化的同时造成肾纤维化, 或通过2型糖尿病在造成肾纤维化的同时, 造成肝纤维化等证明肝肾纤维化相互促进——肝-肾轴。(5)通过作用于肾的药物以治疗肝纤维化, 或通过作用于肝的药物以治疗肾纤维化以证明肝-肾轴应用于肝肾纤维化的治疗潜力。因此, 通过深入研究肠-肝-肾轴能为肝肾纤维化的发生发展机制提供新思路, 为肝肾纤维化的诊疗手段提供新策略。
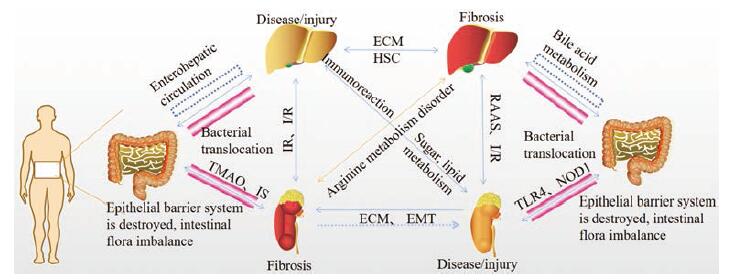
|
Figure 5 Diagram of correlation between enterohepatic and renal axis and pathogenesis of hepatorenal fibrosis.ECM: Extracellular matrix; HSC: Hepatic stellate cell; I/R: Ischemia-reperfusion; EMT: Epithelial-mesenchymal transition; RAAS: Renin-angiotensin-aldoste-rone system |
由于肝肾纤维化机制的相关研究不够透彻, 在目前临床中, 器官移植仍是晚期肝肾纤维化治疗的最佳方案。而器官移植本身也存在一定的弊端, 包括所捐献肝肾来源不多, 手术成功之后患者需长期服用免疫抑制剂以避免排异现象。此外, 手术过程中造成I/R损伤, 术后并发症等情况不可避免, 因此肝肾纤维化需要更完善的治疗方案。深入了解肠-肝-肾轴后, 或可通过靶向肠道, 通过改变肠道微生物群来治疗肝肾纤维化, 为延缓甚至逆转纤维化提供新治疗策略。而由于肝纤维化和肾纤维化的形成和发展是极其复杂的过程, 是多种因素共同作用的结果, 针对这一方面, 中药所含有的有效成分不单一且具有多环节、多层次、多靶点的综合药理作用能发挥出更好的治疗效果, 使得中医药在治疗肝肾纤维化中具有显著优势。
作者贡献:王明亮负责选题、图表制作和文章撰写。丁永芳和印鑫负责文章的撰写和修改。邵久针、庄子锐和张婷参与了文章的修改并检查了图表内容。苏鹏亮对稿件版本进行了评论。彭蕴茹研究员负责文章的选题和思路, 提出框架及文章的修改, 为该文章的主要负责人。所有作者批阅并准许了最终稿件。
利益冲突:本文无利益冲突。
| [1] |
Luo M, Peng H, Chen P, et al. The immunomodulatory role of interleukin-35 in fibrotic diseases[J]. Expert Rev Clin Immunol, 2018, 15: 431-439. |
| [2] |
Bräsen JH, Mederacke YS, Schmitz J, et al. Cholemic nephropathy causes acute kidney injury and is accompanied by loss of aquaporin 2 in collecting ducts[J]. Hepatology, 2019, 69: 2107-2119. DOI:10.1002/hep.30499 |
| [3] |
Tang L, Wu Y, Tian M, et al. Dapagliflozin slows the progression of the renal and liver fibrosis associated with type 2 diabetes[J]. Am J Physiol Endocrinol Metab, 2017, 313: E563-E576. DOI:10.1152/ajpendo.00086.2017 |
| [4] |
Raj D, Tomar B, Lahiri A, et al. The gut-liver-kidney axis: novel regulator of fatty liver associated chronic kidney disease[J]. Pharmacol Res, 2020, 152: 104617. DOI:10.1016/j.phrs.2019.104617 |
| [5] |
Musso G, De Michieli F, Bongiovanni D, et al. New pharmacologic agents that target inflammation and fibrosis in nonalcoholic steatohepatitis-related kidney disease[J]. Clin Gastroenterol Hepatol, 2017, 15: 972-985. DOI:10.1016/j.cgh.2016.08.002 |
| [6] |
Bahirwani R, Reddy KR. Outcomes after liver transplantation: chronic kidney disease[J]. Liver Transpl, 2009, 15: S70-S74. DOI:10.1002/lt.21900 |
| [7] |
Leithead JA, Armstrong MJ, Corbett C, et al. Hepatic ischemia reperfusion injury is associated with acute kidney injury following donation after brain death liver transplantation[J]. Transpl Int, 2013, 26: 1116-1125. DOI:10.1111/tri.12175 |
| [8] |
Chen PC, Kao WY, Cheng YL, et al. The correlation between fatty liver disease and chronic kidney disease[J]. J Formos Med Assoc, 2020, 119: 42-50. DOI:10.1016/j.jfma.2019.02.010 |
| [9] |
Jang HR, Kang D, Sinn DH, et al. Nonalcoholic fatty liver disease accelerates kidney function decline in patients with chronic kidney disease: a cohort study[J]. Sci Rep, 2018, 8: 4718. DOI:10.1038/s41598-018-23014-0 |
| [10] |
Vanni E, Bugianesi E, Kotronen A, et al. From the metabolic syndrome to NAFLD or vice versa?[J]. Dig Liver Dis, 2010, 42: 320-330. DOI:10.1016/j.dld.2010.01.016 |
| [11] |
Lane K, Dixon JJ, Macphee IAM, et al. Renohepatic crosstalk: does acute kidney injury cause liver dysfunction?[J]. Nephrol Dial Transplant, 2013, 28: 1634-1647. DOI:10.1093/ndt/gft091 |
| [12] |
Wadei HM. Hepatorenal syndrome: a critical update[J]. Semin Respir Crit Care Med, 2012, 33: 55-69. DOI:10.1055/s-0032-1301735 |
| [13] |
Varga ZV, Erdelyi K, Paloczi J, et al. Disruption of renal arginine metabolism promotes kidney injury in hepatorenal syndrome in mice[J]. Hepatology, 2018, 68: 1519-1533. DOI:10.1002/hep.29915 |
| [14] |
Sheen JM, Huang LT, Hsieh CS, et al. Bile duct ligation in developing rats: temporal progression of liver, kidney, and brain damage[J]. J Pediatr Surg, 2010, 45: 1650-1658. DOI:10.1016/j.jpedsurg.2009.12.019 |
| [15] |
Heidari R, Mandegani L, Ghanbarinejad V, et al. Mitochondrial dysfunction as a mechanism involved in the pathogenesis of cirrhosis-associated cholemic nephropathy[J]. Biomed Pharmacother, 2019, 109: 271-280. DOI:10.1016/j.biopha.2018.10.104 |
| [16] |
Ghallab A, Hofmann U, Sezgin S, et al. Bile microinfarcts in cholestasis are initiated by rupture of the apical hepatocyte membrane and cause shunting of bile to sinusoidal blood[J]. Hepatology, 2019, 69: 666-683. DOI:10.1002/hep.30213 |
| [17] |
Herman-Edelstein M, Weinstein T, Levi M. Bile acid receptors and the kidney[J]. Curr Opin Nephrol Hypertens, 2018, 27: 56-62. DOI:10.1097/MNH.0000000000000374 |
| [18] |
Cai MS, Wang M, Chan L, et al. Analysis of prevalence and risk factors of renal injury in chronic hepatitis C patients[J]. Chin J Practical Int Med(中国实用内科杂志), 2010, 2: 122-124. |
| [19] |
Qu C, Zheng D, Li S, et al. Tyrosine kinase SYK is a potential therapeutic target for liver fibrosis[J]. Hepatology, 2018, 68: 1125-1139. DOI:10.1002/hep.29881 |
| [20] |
Liu ZY, Zhang WM, Peng XZ. Clinicopathological study on hepatitis B virus-associated glomerulonephritis in 83 children[J]. J Jiangxi Univ TCM(江西中医药大学学报), 2018, 30: 41-43. |
| [21] |
Shi XZ. The Establishment of Mice Model of Hepatitis B Virus Associated-glomerulonephritis(乙型肝炎病毒相关性肾炎小鼠模型的建立)[D]. Wuhan: Huazhong University of Science and Technology, 2010.
|
| [22] |
Zhang P. The Research of Early Renal Impairment in Adefovir Dipivoxil for Long-term Treatment in Chronic Hepatitis B Patients(长期应用阿德福韦酯对慢性乙型肝炎患者早期肾脏损害的临床研究)[D]. Chongqing: Army Medical University, 2017.
|
| [23] |
Mohs A, Kuttkat N, Otto T, et al. MyD88-dependent signaling in non-parenchymal cells promotes liver carcinogenesis[J]. Carcinogenesis, 2020, 41: 171-181. DOI:10.1093/carcin/bgy173 |
| [24] |
Perry RJ, Zhang D, Guerra MT, et al. Glucagon stimulates gluconeogenesis by INSP3R1-mediated hepatic lipolysis[J]. Nature, 2020, 579: 279-283. DOI:10.1038/s41586-020-2074-6 |
| [25] |
Kanasaki K, Taduri G, Koya D. Diabetic nephropathy: the role of inflammation in fibroblast activation and kidney fibrosis[J]. Front Endocrinol(Lausanne), 2013, 4: 7. |
| [26] |
Møller S, Bendtsen F, Henriksen JH. Determinants of the reninangiotensin-aldosterone system in cirrhosis with special emphasis on the central blood volume[J]. Scand J Gastroenterol, 2006, 41: 451-458. DOI:10.1080/00365520500292962 |
| [27] |
Heymann F, Tacke F. Immunology in the liver--from homeostasis to disease[J]. Nat Rev Gastroenterol Hepatol, 2016, 13: 88-110. DOI:10.1038/nrgastro.2015.200 |
| [28] |
Arab JP, Martin-Mateos RM, Shah VH. Gut-liver axis, cirrhosis and portal hypertension: the chicken and the egg[J]. Hepatol Int, 2018, 12: 24-33. DOI:10.1007/s12072-017-9798-x |
| [29] |
Lv LX, Fang DQ, Shi D, et al. Alterations and correlations of the gut microbiome, metabolism and immunity in patients with primary biliary cirrhosis[J]. Environ Microbiol, 2016, 18: 2272-2286. DOI:10.1111/1462-2920.13401 |
| [30] |
Fouts DE, Torralba M, Nelson KE, et al. Bacterial translocation and changes in the intestinal microbiome in mouse models of liver disease[J]. J Hepatol, 2012, 56: 1283-1292. DOI:10.1016/j.jhep.2012.01.019 |
| [31] |
Cabrera-Rubio R, Patterson AM, Cotter PD, et al. Cholestasis induced by bile duct ligation promotes changes in the intestinal microbiome in mice[J]. Sci Rep, 2019, 9: 12324. DOI:10.1038/s41598-019-48784-z |
| [32] |
Chen Y, Yang F, Lu H, et al. Characterization of fecal microbial communities in patients with liver cirrhosis[J]. Hepatology, 2011, 54: 562-572. DOI:10.1002/hep.24423 |
| [33] |
Úbeda M, Lario M, Muñoz L, et al. Obeticholic acid reduces bacterial translocation and inhibits intestinal inflammation in cirrhotic rats[J]. J Hepatol, 2016, 64: 1049-1057. |
| [34] |
Cuenca S, Sanchez E, Santiago A, et al. Microbiome composition by pyrosequencing in mesenteric lymph nodes of rats with CCl4-induced cirrhosis[J]. J Innate Immun, 2014, 6: 263-271. DOI:10.1159/000356454 |
| [35] |
Yan AW, Fouts DE, Brandl J, et al. Enteric dysbiosis associated with a mouse model of alcoholic liver disease[J]. Hepatology, 2011, 53: 96-105. DOI:10.1002/hep.24018 |
| [36] |
Yang X, He F, Zhang Y, et al. Inulin ameliorates alcoholic liver disease via suppressing LPS-TLR4-Mψ axis and modulating gut microbiota in mice[J]. Alcohol Clin Exp Res, 2019, 43: 411-424. DOI:10.1111/acer.13950 |
| [37] |
Zeng Y, Chen S, Fu Y, et al. Gut microbiota dysbiosis in patients with hepatitis B virus-induced chronic liver disease covering chronic hepatitis, liver cirrhosis and hepatocellular carcinoma[J]. J Viral Hepat, 2020, 27: 143-155. DOI:10.1111/jvh.13216 |
| [38] |
Ley RE, Backhed F, Turnbaugh P, et al. Obesity alters gut microbial ecology[J]. Proc Natl Acad Sci U S A, 2005, 102: 11070-11075. DOI:10.1073/pnas.0504978102 |
| [39] |
Zhao CW, Sun QH, Zhang YC, et al. Gut microbiota and chronic liver disease[J]. Chin J Gastroenterol Hepatol(胃肠病学和肝病学杂志), 2019, 28: 267-271. |
| [40] |
Yatsunenko T, Rey FE, Manary MJ, et al. Human gut microbiome viewed across age and geography[J]. Nature, 2012, 486: 222-227. DOI:10.1038/nature11053 |
| [41] |
Le Roy T, Llopis M, Lepage P, et al. Intestinal microbiota determines development of non-alcoholic fatty liver disease in mice[J]. Gut, 2013, 62: 1787-1794. DOI:10.1136/gutjnl-2012-303816 |
| [42] |
Boursier J, Mueller O, Barret M, et al. The severity of nonalcoholic fatty liver disease is associated with gut dysbiosis and shift in the metabolic function of the gut microbiota[J]. Hepatology, 2016, 63: 764-775. DOI:10.1002/hep.28356 |
| [43] |
Leung C, Rivera L, Furness JB, et al. The role of the gut microbiota in NAFLD[J]. Nat Rev Gastroenterol Hepatol, 2016, 13: 412-425. DOI:10.1038/nrgastro.2016.85 |
| [44] |
Lau LHS, Wong SH. Microbiota, obesity and NAFLD[J]. Adv Exp Med Biol, 2018, 1061: 111-125. |
| [45] |
Philips CA, Pande A, Shasthry SM, et al. Healthy donor fecal microbiota transplantation in steroid-ineligible severe alcoholic hepatitis: a pilot study[J]. Clin Gastroenterol Hepatol, 2017, 15: 600-602. DOI:10.1016/j.cgh.2016.10.029 |
| [46] |
Arab JP, Martin-Mateos RM, Shah VH. Gut-liver axis, cirrhosis and portal hypertension: the chicken and the egg[J]. Hepatol Int, 2018, 12: 24-33. DOI:10.1007/s12072-017-9798-x |
| [47] |
Qiao L, Han SI, Fang Y, et al. Bile acid regulation of C/EBPβ, CREB, and c-Jun function, via the extracellular signal-regulated kinase and c-Jun NH2-terminal kinase pathways, modulates the apoptotic response of hepatocytes[J]. Mol Cell Biol, 2003, 23: 3052-3066. DOI:10.1128/MCB.23.9.3052-3066.2003 |
| [48] |
Gong Z, Zhou J, Zhao S, et al. Chenodeoxycholic acid activates NLRP3 inflammasome and contributes to cholestatic liver fibrosis[J]. Oncotarget, 2016, 7: 83951-83963. DOI:10.18632/oncotarget.13796 |
| [49] |
Liao L, Schneider KM, Galvez EJC, et al. Intestinal dysbiosis augments liver disease progression via NLRP3 in a murine model of primary sclerosing cholangitis[J]. Gut, 2019, 68: 1353-1355. DOI:10.1136/gutjnl-2019-318487 |
| [50] |
Seki E, De Minicis S, Osterreicher CH, et al. TLR4 enhances TGF-beta signaling and hepatic fibrosis[J]. Nat Med, 2007, 13: 1324-1332. DOI:10.1038/nm1663 |
| [51] |
Prystupa A, Kicinski P, Sak J, et al. Proinflammatory cytokines (IL-1alpha, IL-6) and hepatocyte growth factor in patients with alcoholic liver cirrhosis[J]. Gastroenterol Res Pract, 2015, 6: 532615. |
| [52] |
Bataller R, Rombouts K, Altamirano J, et al. Fibrosis in alcoholic and nonalcoholic steatohepatitis[J]. Best Pract Res Clin Gastroenterol, 2011, 25: 231-244. DOI:10.1016/j.bpg.2011.02.010 |
| [53] |
Kors L, Rampanelli E, Stokman G, et al. Deletion of NLRX1 increases fatty acid metabolism and prevents diet-induced hepatic steatosis and metabolic syndrome[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864: 1883-1895. DOI:10.1016/j.bbadis.2018.03.003 |
| [54] |
Yoshifuji A, Wakino S, Irie J, et al. Gut Lactobacillus protects against the progression of renal damage by modulating the gut environment in rats[J]. Nephrol Dial Transplant, 2016, 31: 401-412. DOI:10.1093/ndt/gfv353 |
| [55] |
Nanto HF, Kanemitsu Y, Fukuda S, et al. The guanylate cyclase C agonist linaclotide ameliorates the gut-cardio-renal axis in an adenine-induced mouse model of chronic kidney disease[J]. Nephrol Dial Transplant, 2020, 35: 250-264. |
| [56] |
Gupta N, Buffa JA, Roberts AB, et al. Targeted inhibition of gut microbial trimethylamine N-oxide production reduces renal tubulointerstitial fibrosis and functional impairment in a murine model of chronic kidney disease[J]. Arterioscler Thromb Vasc Biol, 2020, 40: 1239-1255. DOI:10.1161/ATVBAHA.120.314139 |
| [57] |
Zou C, Lu ZY, Wu YC, et al. Colon may provide new therapeutic targets for treatment of chronic kidney disease with Chinese medicine[J]. Chin J Integr Med, 2013, 19: 86-91. DOI:10.1007/s11655-013-1351-8 |
| [58] |
Ding C, Han F, Xiang H, et al. Probiotics ameliorate renal ischemia-reperfusion injury by modulating the phenotype of macrophages through the IL-10/GSK-3β/PTEN signaling pathway[J]. Pflugers Arch, 2019, 471: 573-581. DOI:10.1007/s00424-018-2213-1 |
| [59] |
Evenepoel P, Poesen R, Meijers B. The gut-kidney axis[J]. Pediatr Nephrol, 2017, 32: 2005-2014. DOI:10.1007/s00467-016-3527-x |
| [60] |
Chen YY, Chen DQ, Chen L, et al. Microbiome-metabolome reveals the contribution of gut-kidney axis on kidney disease[J]. J Transl Med, 2019, 17: 5. DOI:10.1186/s12967-018-1756-4 |
| [61] |
Heidler S, Lusuardi L, Madersbacher S, et al. The microbiome in benign renal tissue and in renal cell carcinoma[J]. Urol Int, 2019, 12: 1-6. |
| [62] |
Kikuchi K, Saigusa D, Kanemitsu Y, et al. Gut microbiomederived phenyl sulfate contributes to albuminuria in diabetic kidney disease[J]. Nat Commun, 2019, 23, 10: 1835. |
| [63] |
Tao S, Li LZ, Li L, et al. Understanding the gut-kidney axis among biopsy-proven diabetic nephropathy, type 2 diabetes mellitus and healthy controls: an analysis of the gut microbiota composition[J]. Acta Diabetol, 2019, 56: 581-592. DOI:10.1007/s00592-019-01316-7 |
| [64] |
Carron C, Pais de Barros JP, Gaiffe E, et al. End-stage renal disease-associated gut bacterial translocation: evolution and impact on chronic inflammation and acute rejection after renal transplantation[J]. Front Immunol, 2019, 10: 1630. DOI:10.3389/fimmu.2019.01630 |
| [65] |
Vaziri ND, Wong J, Pahl M, et al. Chronic kidney disease alters intestinal microbial flora[J]. Kidney Int, 2012, 83: 308-315. |
| [66] |
Iebba V, Guerrieri F, Di GV, et al. Combining amplicon sequencing and metabolomics in cirrhotic patients highlights distinctive microbiota features involved in bacterial translocation, systemic inflammation and hepatic encephalopathy[J]. Sci Rep, 2018, 8: 8210. DOI:10.1038/s41598-018-26509-y |
| [67] |
Mouries J, Brescia P, Silvestri A, et al. Microbiota-driven gut vascular barrier disruption is a prerequisite for non-alcoholic steatohepatitis development[J]. J Hepatol, 2019, 71: 1216-1228. DOI:10.1016/j.jhep.2019.08.005 |
| [68] |
Peng JL, Techasatian W, Hato T, et al. Role of endotoxemia in causing renal dysfunction in cirrhosis[J]. J Investig Med, 2020, 68: 26-29. DOI:10.1136/jim-2019-001056 |
| [69] |
Kromrey ML, Göhler A, Friedrich N, et al. Monitoring of abdominal Staphylococcus aureus infection using magnetic resonance imaging: a murine animal model for hepatic and renal abscesses[J]. Eur J Clin Microbiol Infect Dis, 2017, 36: 373-378. DOI:10.1007/s10096-016-2811-9 |
| [70] |
Baranova IN, Souza AC, Bocharov AV, et al. Human SR-BI and SR-BII potentiate lipopolysaccharide-induced inflammation and acute liver and kidney injury in mice[J]. J Immunol, 2016, 196: 3135-3147. DOI:10.4049/jimmunol.1501709 |
| [71] |
Slitt AL, Allen K, Morrone J, et al. Regulation of transporter expression in mouse liver, kidney, and intestine during extrahepatic cholestasis[J]. Biochim Biophys Acta, 2007, 1768: 637-647. DOI:10.1016/j.bbamem.2006.10.008 |
| [72] |
Hao H, Cao L, Jiang C, et al. Farnesoid X receptor regulation of the NLRP3 inflammasome underlies cholestasis-associated sepsis[J]. Cell Metab, 2017, 25: 856-867. DOI:10.1016/j.cmet.2017.03.007 |
| [73] |
Roediger B, Lee Q, Tikoo S, et al. An atypical parvovirus drives chronic tubulointerstitial nephropathy and kidney fibrosis[J]. Cell, 2018, 175: 530-543. DOI:10.1016/j.cell.2018.08.013 |
| [74] |
Wang D, Luo YH, Wang XX, et al. The sodium-glucose cotransporter 2 inhibitor dapagliflozin prevents renal and liver disease in western diet induced obesity mice[J]. Int J Mol Sci, 2018, 19: 137. DOI:10.3390/ijms19010137 |
| [75] |
Gäbele E, Dostert K, Hofmann C, et al. DSS induced colitis increases portal LPS levels and enhances hepatic inflammation and fibrogenesis in experimental NASH[J]. J Hepatol, 2011, 55: 1391-1399. DOI:10.1016/j.jhep.2011.02.035 |
| [76] |
Tuveson D, Clevers H. Cancer modeling meets human organoid technology[J]. Science, 2019, 364: 952-955. DOI:10.1126/science.aaw6985 |
| [77] |
Fatehullah A, Tan SH, Barker N. Organoids as an in vitro model of human development and disease[J]. Nat Cell Biol, 2016, 18: 246-254. DOI:10.1038/ncb3312 |
| [78] |
Leite SB, Roosens T, El Taghdouini A, et al. Novel human hepatic organoid model enables testing of drug-induced liver fibrosis in vitro[J]. Biomaterials, 2016, 78: 1-10. DOI:10.1016/j.biomaterials.2015.11.026 |
 2021, Vol. 56
2021, Vol. 56


