2. 苏州大学, 江苏 苏州 215123;
3. 中国科学院大连化学物理研究所, 辽宁 大连 116023
2. Soochow University, Suzhou 215123, China;
3. Dalian Institute of Chemical Physics, Chinese Academy of Science, Dalian 116023, China
恶性肿瘤是现今威胁人类健康与生命的重大疾病之一, 死亡率较高[1]。常规的治疗手段如手术、化疗、放疗、生物治疗等虽有一定效果, 但均有些弊端[2]。声动力疗法(sonodynamic therapy, SDT), 即患者口服或注射声敏剂, 能够特异性地聚集在肿瘤部位, 然后对该部位给予一定的超声照射, 进而激活声敏剂, 致使肿瘤细胞损伤及其死亡[3, 4]。该方法具有特异性强、穿透力强和不良反应少等特点, 在临床治疗中有良好的应用前景[5, 6]。
目前, 用于声动力疗法的体外模型主要有二维培养细胞模型和动物模型。然而, 动物模型和人之间差异较大, 不能准确地反映药物在人体内的作用效果。在肿瘤不断发展过程中, 始终贯穿着与微环境的相互作用和适应性调节, 因此二维培养不足以准确模拟肿瘤细胞的体内环境, 需要三维肿瘤模型研究药物抗癌活性[7-9]。
3D生物打印是一种集生物学、机械学、材料学及计算机学等多种学科于一体的综合性技术, 可根据需要精确定位三维组织中细胞和细胞外基质, 重现体内组织三维微环境[10, 11]。由于3D生物打印技术高效率、低成本、高通量和高精准度的优点, 应用不同种类的生物墨水对细胞类型和细胞外基质成分进行空间分布, 精确模拟组织的几何结构以及肿瘤微环境, 构建体外三维肿瘤模型[12, 13], 应用于肿瘤表型研究[14, 15]和体外药物抗癌活性研究[16]。
3D打印以蜂窝状结构模拟肝组织的几何结构, 用于构建含活细胞的三维仿生肝组织[17]甚至模拟人工肝表现毒素清除功能[18]。本研究首先应用3D生物打印技术构建了三维肝肿瘤组织, 以海藻酸/明胶/羟乙基纤维素复合生物材料作为生物墨水模拟细胞外基质, HepG2细胞作为肿瘤细胞, 蜂窝状结构模拟组织几何结构, 并检测了打印的HepG2细胞活力; 其次, 自主搭建了微型超声装置, 估算并确定了实验超声强度; 最后, 声敏药物二氢卟酚e6 (Ce6)作用于打印的HepG2肿瘤组织, 比较了Ce6对2D培养和打印的HepG2细胞声动力抗癌活性大小。
材料与方法药品与试剂 实验所用的HepG2细胞购自中国科学院细胞库; LO2细胞、LX2细胞和HUVEC细胞是大连医科大学赠予; MEM (minimum essential medium)培养基、DMEM (Dulbecco's modified eagle medium)培养基、胎牛血清(FBS)、谷氨酰胺(glutamax)、非必需氨基酸、丙酮酸钠和青霉素/链霉素(ThermoFisher Scientific公司); 明胶(gelatin, Gel, G1890)、海藻酸钠(sodium alginate, SA, A0682)、羟乙基纤维素(hydroxyethyl cellulose, HEC, 434965)、氯化钠(NaCl, S7653)和氯化钙(CaCl2, C7902) (Sigma-Aldrich公司); Ce6 (北京百灵威科技有限公司); Live-Dead试剂盒和MTT (江苏凯基生物技术股份有限公司)。
仪器 3D生物打印机型号HoriTM (大连芯鸿生物科技有限公司); 等离子体机型号PDC-002 (美国迈可诺技术有限公司); 倒置荧光显微镜型号IX71 (美国奥林巴斯有限公司); 酶标仪型号H1MFD (美国基因有限公司)。
细胞培养 HepG2细胞的培养液是MEM, 其中含有10% FBS、1% glutamax、1%非必需氨基酸、1%丙酮酸钠及1%青霉素/链霉素。LO2细胞、LX2细胞和HUVEC细胞的培养液是DMEM, 添加10% FBS和1%青霉素/链霉素。细胞于37 ℃、5% CO2的培养箱孵育培养, 每两天换液1次。
生物墨水制备 称取明胶4 g、海藻酸钠0.8 g和羟乙基纤维素0.5 g, 暴露在紫外线中超过24 h, 于70 ℃磁力搅拌完全溶解在0.9% (质量体积比) NaCl水溶液30 mL中, 最终形成SA/Gel/HEC生物墨水。室温冷却2 h, 70 ℃水浴1 h, 如此往复3次, 紫外线灯照射过夜, 储存于4 ℃中, 使用前37 ℃水浴1 h。
生物相容性检测 制备直径为1cm、高度为3 mm的圆柱样凝胶样品, 并将其浸没在2 mL含血清培养液中24 h。收集浸提液, 并与培养液按不同比例混合, 将其配制为体积百分比分别是0%、5%、10%、25%、50%和100%的浸提液。HepG2细胞种植在96孔板中, 每孔4 000个细胞, 用不同浓度的浸提液培养24、48和72 h。
生物打印肝肿瘤 HepG2细胞悬液和SA/Gel/HEC以1:10的比例混合形成细胞数为每毫升107个的生物墨水。3ds MAX 2015软件设计蜂窝状三维结构, 置于切片软件Repetier-host 2.1.6进行层层切片, 保存为gcode文件导出至SD卡。将SD卡装载至打印机, 生物墨水加入生物打印机墨盒中。选取200 μm的打印喷头, 设置打印温度为22 ℃, 打印速度为5 mm·s-1。打印完成后, 浸没在1.5% (质量体积比) CaCl2的PBS溶液中1 min, MEM空培养基漂洗3次, 加入MEM培养液, 放置在培养箱中培养。
超声装置搭建 采用频率1.7 MHz的超声雾化器、控制电板、功率旋钮和10 kΩ的电阻等搭建微型超声装置。超声过程中细胞的载体是2层经等离子体机键合而成的聚二甲基硅氧烷(polydimethylsiloxane, PDMS)芯片。PDMS芯片放置在超声装置上, 在芯片小孔中加入150 μL超纯水作为超声介质, 超声时间60 s, 超声功率旋钮示数是20%、30%、40%、50%、60%、70%和80%分别进行超声, 每次超声前更换芯片小孔中和超声介质的水, 每组测量8个数据, 计算平均值, 根据超声产生的热量, 计算得出超声强度。
Ce6浓度选取实验 将质量浓度为14.3、28.6、35.75及71.5 μg·mL-1的Ce6作用于96孔板培养的HepG2细胞、LO2细胞、LX2细胞和HUVEC细胞, 24 h后检测细胞活性。
超声实验 单独超声组:二维培养HepG2细胞和LO2细胞, 以不超声作为空白对照。加药超声组:二维培养HepG2细胞和3D打印HepG2细胞, Ce6质量浓度为14.3和28.6 μg·mL-1, 以加药不超声作为相应空白对照。超声完成后, 继续培养24 h。
细胞活力检测 打印的HepG2细胞在培养的第1、4、7和11天, 吸除培养液, 更换为Live-Dead试剂盒中的calcein-AM和PI, 避光作用30 min, PBS漂洗3次, 于荧光显微镜下观察细胞存活情况, 并用Image J 1.8.0分析细胞存活率。
MTT检测 生物相容性检测、打印细胞增殖、Ce6浓度选取实验和超声实验细胞活性均用MTT法检测。实验终点时, 吸弃培养液, 加入MTT工作液避光作用4 h, 吸弃MTT, 加入DMSO溶解结晶, 用酶标仪检测490 nm处吸光值。
数据分析 采用IBM SPSS Statistics 22.0进行统计处理, P < 0.05具有统计学差异。
结果 1 SA/Gel/HEC对HepG2细胞生物相容性从图 1中可看出, HepG2细胞在SA/Gel/HEC不同浓度浸提液中24、48和72 h的MTT吸光度值均没有统计学差异。SA/Gel/HEC不同浓度浸提液的相对增殖率(relative proliferation rate, RGR)是以0%浸提液的细胞MTT吸光度值作为100%计算而得, 如表 1所示。医疗器械生物学评价(GB/T 16886.5-2003)中, 根据RGR大小对细胞毒性分级(cytotoxic classification, CTS)进行了分类: 100% < RGR, CTS为0级; 75% < RGR < 100%, CTS为1级; 50% < RGR < 75%, CTS为2级; 25% < RGR < 50%, CTS为3级; 1% < RGR < 25%, CTS为4级; RGR < 1%, CTS为5级。48和72 h的RGR大于100%, CTS均为0级; 24 h细胞毒性分级均在1级以下, 说明SA/Gel/HEC对培养HepG2来说, 符合国家医用生物材料细胞毒性要求, 生物相容性良好, 满足生物打印中对生物墨水的基本要求。
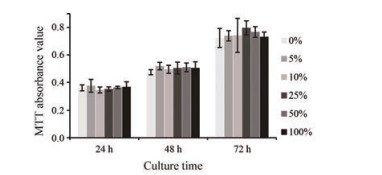
|
Figure 1 MTT absorbance value of HepG2 cells with different extract concentrations of SA/Gel/HEC. SA: Sodium alginate; Gel: Gelatin; HEC: Hydroxyethyl cellulose. n = 4, x±s |
| Table 1 RGR and CTS of HepG2 cells with different extract concentrations. RGR: Relative proliferation rate; CTS: Cytotoxic classification. n = 4, x±s |
打印的三维HepG2肿瘤组织的几何结构是蜂窝状结构, 如图 2A~D所示, 细胞在第1、4、7和11天的活性均超过95% (图 2E), 在第7天可观察到细胞开始聚团生长(红色箭头指示), 培养11天以后, 出现球状HepG2细胞, 表明打印的HepG2细胞可以形成肿瘤微球, 不再是单一的细胞, 生物打印的HepG2细胞更接近体内肿瘤微环境。作者计算了培养11天以后细胞活性图像中所有微球面积与总细胞面积比例, 并取平均值, 得到HepG2细胞的肿瘤微球形成率为60%。图 2F显示了打印HepG2细胞的MTT检测吸光度值随着培养时间的推移不断上升, 为期11天的培养时间内, 增殖情况良好。
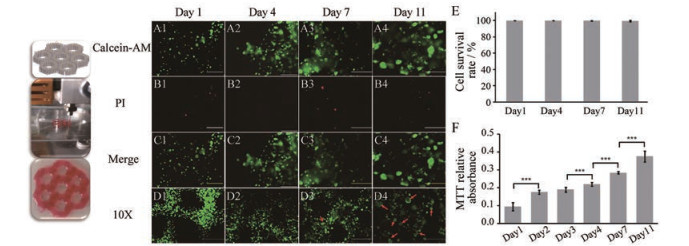
|
Figure 2 Bioprinted HepG2 cells. A1-D4: Live-dead image. A: live cells; B: dead cells; C: Merge image; D: Live cells with 10× objective lense, red arrow indicates tumor microsphere; E: Cell viability; F: MTT absorbance for HepG2 proliferation. Scale bar = 200 μm. n = 4, x±s. ***P < 0.001 |
搭建的超声装置如图 3A所示, 工作区分为芯片区和超声旋钮区, 其中芯片区的PDMS芯片分为2层, 上层PDMS中心有直径为8 mm的贯穿圆孔, 下层是0.7 cm厚的PDMS基板。图 3B显示了不同超声强度下超声60 s的温度效应测试结果, 随着超声旋钮功率示数的上升, 温度逐渐上升。根据超声作用全部转化为热量推算而得的超声强度如图 3C所示, 旋钮示数超过40%, 超声强度即显示显著性差异, 表明此超声装置不同的功率旋钮示数可以代表不同的超声声强, 最高超声强度为0.4 W·cm-2。旋钮示数为50%和60%的超声强度, 对正常肝细胞LO2作用1 min, 没有造成损伤, 然而HepG2的MTT吸光度值明显降低, 如图 4所示, 显示了低强度超声对癌细胞生长的抑制作用。
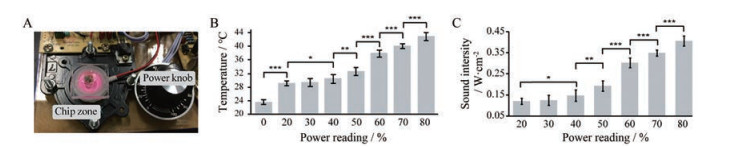
|
Figure 3 Micro ultrasonic device. A: Practicality picture; B: Temperature change caused by ultrasound; C: Ultrasonic intensity corresponding to different power indications. n = 4, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 |
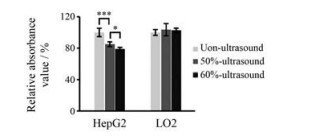
|
Figure 4 Effect of ultrasound alone on HepG2 and LO2 cells. n = 4, x±s. *P < 0.05, ***P < 0.001 |
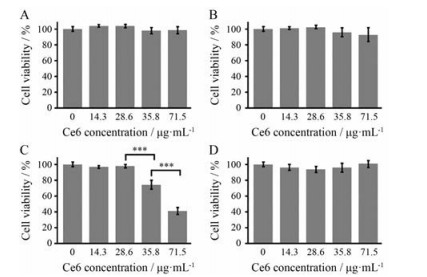
肝癌组织中有正常肝细胞、肝肿瘤细胞、成纤维细胞及血管内皮细胞等多种细胞, 声敏剂Ce6的体外作用浓度应选择对细胞活性没有抑制作用的浓度范围。本研究将不同浓度的Ce6单独作用于LO2细胞、HepG2细胞、LX2细胞和HUVEC细胞, MTT法检测24 h后细胞活性, 结果如图 5所示。35.8和71.5 μg·mL-1 Ce6会影响肝成纤维细胞系LX2细胞, 细胞活性明显降低; 而14.3和28.6 μg·mL-1 Ce6与对照组相比, 没有显著性差异, 表明不影响这4种细胞的生长。因此, 在超声实验中Ce6的质量浓度选用14.3和28.6 μg·mL-1。
|
Figure 5 Effect of chlorine e6 (Ce6) alone with different concentrations on liver tumor associated cells. A: Normal hepatocytes LO2 cells; B: Liver tumor HepG2 cells; C:Liver tumor associated fibroblasts LX2 cells; D:Vascular endothelial cells HUVEC cells. n = 4, x±s. ***P < 0.001 |
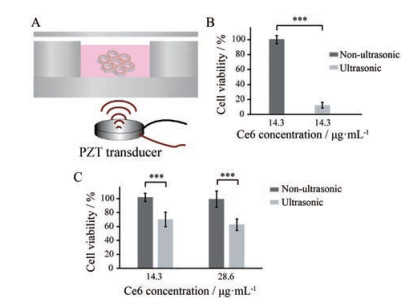
如图 6A所示, 3D打印的HepG2肿瘤三维组织放置在芯片中, 添加培养液, 芯片下方即为超声源。Ce6作为声敏剂, 对2D培养HepG2细胞(图 6B)和3D打印的HepG2细胞(图 6C)的声动力抗癌活性, 与未超声情况进行对比, 可看出功率为60%的超声(声强为0.15 W·cm-2)对2D和3D打印的HepG2细胞增殖均有明显的抑制作用。图 6C表明, Ce6浓度的升高, 没有引起打印的HepG2细胞吸光度值的明显升高或降低, 即对声动力疗法抗癌活性没有显著性影响。超声对2D培养的HepG2细胞的抗癌活性为88.9%, 而对3D打印的HepG2细胞的抗癌活性为32.5%, 相较于2D培养的抗癌活性降低了63.4%, 表明3D打印的HepG2细胞的声动力抗癌敏感性降低。
|
Figure 6 Sonodynamic anticancer activity of Ce6 on HepG2 cells. A: Diagram of sonodynamic therapy for bioprinted HepG2 tumor tissue; B: Anticancer activity of Ce6 on 2D cultured HepG2 cells; C: Anticancer activity of Ce6 on bioprinted HepG2 cells. n = 4, x±s. ***P < 0.001 |
Ce6及其衍生物作为无细胞毒性光敏剂, 被应用于肝肿瘤的光动力治疗(photodynamic therapy, PDT)[19]。同时, Ce6也可用于SDT的声敏剂, 结合低强度的超声可抑制人癌细胞系迁移生长[20-22], 对动物肿瘤模型中的肿瘤组织生长有抑制作用[23, 24]。自制的微型超声装置产生的超声强度小于3 W·cm2, 属于低强度的超声[25], 在超声治疗的范畴, 对正常肝细胞LO2细胞没有损伤, 却可以抑制癌细胞有丝分裂。实验结果表明Ce6结合0.15 W·cm2的低超声强度, 可抑制2D培养和3D打印的HepG2肝肿瘤细胞的生长。
临床试验的抗癌药物中只有7.5%最终获得批准[26], 对抗肿瘤新药研发有很大的挑战性。这是因为体内的肿瘤微环境复杂[27], 在肿瘤发生发展的过程中, 是多细胞且有细胞外基质参与影响的, 临床前的体外活性评价模型不足以体现准确的药物效果。明胶是胶原的衍生物, 海藻酸钠含有糖胺聚糖结构, 羟乙基纤维素凝胶可形成弹性纤维网络, 因此海藻酸/明胶/羟乙基纤维素是胶原/糖胺聚糖/弹性纤维的相似复合生物材料, 作为生物墨水可以重现肿瘤间质的细胞外基质主要成分。为了获得Ce6在临床肿瘤治疗中更具准确性和指导意义的体外实验结果, Farrakhova等[28]以HTB-43肿瘤微球模型作为口烟鳞状细胞癌模型, 考察了Ce6在肿瘤中的分布及富集程度; A549细胞的肿瘤微球被用来评价Ce6共轭物的PDT体外抗癌活性[29]。3D生物打印技术构建的HepG2肝肿瘤模型, 可以形成多细胞的肿瘤微球, 且含有模拟细胞外基质的生物材料, 相较贴壁或悬浮的2D培养HepG2细胞而言, 更接近体内肝肿瘤微环境。与针对2D培养的HepG2细胞的抗癌活性相比, 3D的HepG2肿瘤的Ce6声动力抗癌活性的敏感度较2D培养有所降低, 可能是因为打印后形成了HepG2肿瘤微球, 微球增加了其耐声敏药性。而耐药性是癌症治疗中的一大阻碍[30], 因此在抗癌药物的体外活性评价更需要能够反映肿瘤耐药性这一特征的肿瘤模型。
综上所述, 生物打印的HepG2细胞可形成肝肿瘤微球, 且对于Ce6声动力疗法有一定的耐药性, 这揭示了体外3D肿瘤模型在声动力疗法发展中的潜力。然而, SDT抗肿瘤机制尚不清楚, Ce6结合超声抗生物打印的HepG2肿瘤的其他生物学行为和具体机制还需进一步的研究探索。
作者贡献: 李晓瑞负责实验操作、数据整理分析和文章撰写; 邓权锋负责仪器搭建和软件操作; 罗勇负责文章修改, 并给予基金支持; 林炳承和赵伟杰负责项目管理; 张秀莉为项目监督。
利益冲突: 作者声明本研究无任何利益冲突。
| [1] |
Torre LA, Siegel RL, Ward EM, et al. Global cancer incidence and mortality rates and trends-an update[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25: 16-27. |
| [2] |
Zhou Y, Dai JY, Bi LJ. Research progress of sonodynamic therapy[J]. Med Recapitul (医学综述), 2019, 25: 2588-2592. |
| [3] |
Rosenthal I, Sostaric JZ, Riesz P. Sonodynamic therapy - a review of the synergistic effects of drugs and ultrasound[J]. Ultrason Sonochem, 2004, 11: 349-363. |
| [4] |
Trendowski M. The promise of sonodynamic therapy[J]. Cancer Metast Rev, 2014, 33: 143-160. DOI:10.1007/s10555-013-9461-5 |
| [5] |
Bilmin K, Kujawska T, Grieb P. Sonodynamic therapy for gliomas. Perspectives and prospects of selective sonosensitization of glioma cells[J]. Cells (Basel), 2019, 8: 1428. |
| [6] |
Lafond M, Yoshizawa S, Umemura S. Sonodynamic therapy: advances and challenges in clinical translation[J]. J Ultras Med, 2019, 38: 567-580. |
| [7] |
van den Brand D, Massuger LF, Brock R, et al. Mimicking tumors: toward more predictive in vitro models for peptide- and protein-conjugated drugs[J]. Bioconjug Chem, 2017, 28: 846-856. |
| [8] |
Fong ELS, Harrington DA, Farach-Carson MC, et al. Heralding a new paradigm in 3D tumor modeling[J]. Biomaterials, 2016, 108: 197-213. |
| [9] |
Yamada KM, Cukierman E. Modeling tissue morphogenesis and cancer in 3D[J]. Cell, 2007, 130: 601-610. |
| [10] |
Murphy SV, Atala A. 3D bioprinting of tissues and organs[J]. Nat Biotechnol, 2014, 32: 773-785. |
| [11] |
Liaw C, Ji S, Guvendiren M. Engineering 3D hydrogels for personalized in vitro human tissue models[J]. Adv Healthc Mater, 2018. DOI:10.1002/adhm.201701165 |
| [12] |
Knowlton S, Onal S, Yu CH, et al. Bioprinting for cancer research[J]. Trends Biotechnol, 2015, 33: 504-513. |
| [13] |
Zhang YS, Duchamp M, Oklu R, et al. Bioprinting the cancer microenvironment[J]. ACS Biomater Sci Eng, 2016, 2: 1710-1721. |
| [14] |
Swaminathan S, Hamid Q, Sun W, et al. Bioprinting of 3D breast epithelial spheroids for human cancer models[J]. Biofabrication, 2019, 11: 25003. |
| [15] |
Langer EM, Allen-Petersen BL, King SM, et al. Modeling tumor phenotypes in vitro with three-dimensional bioprinting[J]. Cell Rep, 2019, 26: 608-623. |
| [16] |
Wang Y, Shi W, Kuss M, et al. 3D bioprinting of breast cancer models for drug resistance study[J]. ACS Biomater Sci Eng, 2018, 4: 4401-4411. |
| [17] |
Wu Y, Lin ZY, Wenger AC, et al. 3D bioprinting of liver-mimetic construct with alginate/cellulose nanocrystal hybrid bioink[J]. Bioprinting, 2018, 9: 1-6. |
| [18] |
Gou ML, Qu X, Zhu W, et al. Bio-inspired detoxification using 3D-printing hydrogel nanocomposites[J]. Nat Commun, 2014, 5: 3774. |
| [19] |
Iqbal S, Fakhar-e-Alam M, Atif M, et al. Empirical modeling of Zn/ZnO nanoparticles decorated/conjugated with fotolon (chlorine e6) based photodynamic therapy towards liver cancer treatment[J]. Micromachines (Basel), 2019, 10: 60. |
| [20] |
Xu P, Yao J, Li Z, et al. Therapeutic effect of doxorubicin-chlorin e6-loaded mesoporous silica nanoparticles combined with ultrasound on triple-negative breast cancer[J]. Int J Nanomed, 2020, 15: 2659-2668. |
| [21] |
Zheng RN, Zhang WM, Wang XJ, et al. The sonodynamic effects of chlorin e6 on the proliferation of human lung adenocarcinoma cell SPCA-1[J]. Chin J Lung Cancer (中国肺癌杂志), 2010, 13: 201-205. |
| [22] |
Gao HJ, Zhang WM, Wang XH, et al. The sonodynamic effect of chlorin-e6 on the proliferation of human breast cancer cells MDA-MB-231[J]. Tumor (肿瘤), 2010, 30: 175-179. |
| [23] |
Cui XY, Zhu SJ, Cui LX, et al. Sonodynamic therapy with chlorin e6 for ehrlich ascites tumor-bearing mice[J]. Acta Lab Animal Sci Sin (中国实验动物学报), 2011, 19: 451-455. |
| [24] |
Liu D, Zhang WM, Wang XH, et al. The sonodynamic effects of chlorin e6 on S180 sarcoma in mice[J]. Chin J Ultrasound Med (中国超声医学杂志), 2012, 28: 961-963. |
| [25] |
Yu TH, Wang ZB, Mason TJ. A review of research into the uses of low level ultrasound in cancer therapy[J]. Ultrason Sonochem, 2004, 11: 95-103. |
| [26] |
Toniatti C, Jones P, Graham H, et al. Oncology drug discovery: planning a turnaround[J]. Cancer Discov, 2014, 4: 397-404. |
| [27] |
Chen FF, Li XX, Li S, et al. Advances in tumor microenvironment and related targeted drugs[J]. Acta Pharm Sin (药学学报), 2018, 53: 676-683. |
| [28] |
Farrakhova DS, Yakovlev DV, Maklygina YS, et al. The research of chlorine e6 distribution and accumulation in multicellular tumor spheroid model[J]. Opt Quant Electron, 2020. DOI:10.1007/s11082-020-2218-9 |
| [29] |
Kumari P, Paul M, Bhatt H, et al. Chlorin e6 conjugated methoxy-poly(ethylene glycol)-poly(d, l-lactide) glutathione sensitive micelles for photodynamic therapy[J]. Pharm Res, 2020, 37: 18. |
| [30] |
He QY. Tumor heterogeneity and drug resistance of targeted antitumor agents[J]. Acta Pharm Sin (药学学报), 2016, 51: 197-201. |
 2020, Vol. 55
2020, Vol. 55


