2. 山西大学, 化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
3. 中国科学院过程工程研究所, 北京 100190;
4. 山西省晋城市陵川县农业综合开发中心, 山西 晋城 048300
2. Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education of Shanxi University, Taiyuan 030006, China;
3. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
4. Agricultural Comprehensive Development Center of Lingchuan County of Jincheng City of Shanxi Province, Jincheng 048300, China
柴胡(Bupleurum chinense)始载于《神农本草经》[1], 原名茈胡, 距今已有两千多年历史, 列为上品, 是中医常用的一味解表药, 为伞形科植物柴胡或狭叶柴胡的干燥根, 性苦辛, 微寒, 归肝胆经, 具有解表退热、疏肝解郁、升举阳气等功效。柴胡作为一种常用的中药材, 由于市场用量较大, 在我国各省区都有柴胡属植物的种植, 导致柴胡商品药材的种源混乱, 质量受到明显影响, 不能保证柴胡的临床药效[2], 为保证柴胡的临床用药效果以及患者的生命安全, 故对中药柴胡的鉴别研究具有重要意义。
目前医药市场上对柴胡的鉴别有性状鉴别、薄层色谱分析和气相色谱-质谱(GC-MS)等研究方法。从性状鉴别来看, 药典收载的正品北柴胡, 野生品表面颜色较深, 具纵皱纹、支根痕及皮孔, 根头膨大下部多分枝, 质硬而韧不易折断, 断面呈片状纤维性, 气微香; 正品红柴胡颜色较浅, 根较细, 下部多不分枝, 质稍软易折断, 断面略平坦纤维性较差, 具败油气[3]。目前日本的三岛柴胡已在我国部分地区有所引种, 市场上也有所流通, 其质硬易折断等与我国药典收载的正品红柴胡难以区别。此外, 藏柴胡根呈圆锥形或圆柱形, 微有分支, 近根头部残留茎基, 茎基部有密集的节, 表面具细纵皱纹, 可见皮孔及支根痕, 质柔韧不易折断, 断面略显纤维性, 这与正品北柴胡又存在极大的相似性[4]。在性状鉴别中, “颜色较深”“多分支”“气微香”这些表观现象存在极大的主观意向, 没有标准依据。此外, Ding等[5]采用薄层色谱方法对不同种属柴胡进行鉴别, 但是分离效果并不明显, 需要结合液相色谱进行判别。Zhang等[6]采用药典方法提取了不同种柴胡的挥发油成分, 基于GC-MS技术对其研究寻找差异代谢物, 但是该方法显示不同柴胡的挥发油组成成分差异不大, 仅在含量上有所差异。
近年来随着碳水化合物研究的发展, 柴胡多糖的研究受到越来越多的重视[7, 8]。现代药理研究发现, 柴胡多糖具有抗辐射、抗病毒、抗溃疡、降血脂、增强免疫力等药理作用, 在中医中具有重要的临床价值, 尤其在升阳举陷(提升免疫)方面具有重要作用, 应该将其作为柴胡品种的鉴别标准[9]。然而, 由于多糖分离制备的困难以及糖链序列和分支结构尚无法准确测定, 限制了其应用。近年来, 随着色谱填料技术的发展, 多糖分子质量分布特征可以通过糖谱形式直接表征。该方法避免了直接测定多糖结构的技术瓶颈, 可以从整体表征中药材多糖的结构特点[10]。而指纹图谱是具有普遍意义且规范化的图谱, 具有系统性、整体性、稳定性和特征性等特征, 是综合可量化的一种质量控制手段[11]。因此, 建立柴胡的糖特征图谱, 通过不同柴胡的图谱差异可为不同种源柴胡的鉴别提供新思路。
在本研究中, 收集了北柴胡(Bupleurum chinense DC.)、红柴胡(Bupleurum scorzonerifolium Willd)、三岛柴胡(Bupleurum falcatum)和藏柴胡[Bupleurum marginatum Will ex DC. var. stenophyllum (Wolff) Shan et Li]四种易混药材, 采用高效液相色谱仪-蒸发光检测器(HPLC-ELSD)建立不同品种柴胡药材的多糖特征图谱, 并通过总多糖的酸降解方法, 结合柱前衍生化[12], 采用高效液相色谱仪-紫外检测器(HPLC-UV)建立不同柴胡药材的单糖特征图谱, 通过糖谱分析, 结合多元统计分析和聚类分析等类似评估来处理数据, 找出不同种柴胡糖类成分的相似性和差异性, 以便对不同柴胡进行区分。本方法不仅具有样品消耗少, 实验过程简单和耗时短的优点, 还为不同种柴胡的鉴别提供了新的策略。
材料与方法材料 本实验所需植物材料包括不同批次的北柴胡(编号1~12, 命名为BCH)、红柴胡(编号13~24, 命名为HCH)、三岛柴胡(编号25~36, 命名为SDCH)和藏柴胡(编号37~48, 命名为ZCH), 药材源于安徽亳州中药材交易中心、河南省禹州中药材专业市场、河北省安国中药材专业市场和江西樟树中药材市场, 每个市场取每种药材三批, 药材均由山西大学秦雪梅教授鉴定。
仪器与试剂 Waters 2695型高效液相色谱仪(2489紫外检测器, 6000蒸发光散射检测器, 美国Waters公司); CPA225D型十万分之一分析天平(德国Sartorius公司); Neofuge 13R高速冷冻离心机(上海力申科学仪器有限公司); SC-3610低速离心机(安徽中科中佳科学仪器有限公司); ZX-LGJ-18普通型冷冻干燥机(上海知信实验仪器技术有限公司); RE-52型旋转蒸发器(上海亚荣生化仪器厂)。
系列相对分子质量(Mr)右旋糖酐对照品(Mr: 180、2 500、4 600、7 100、21 400、41 100、84 400和133 800, 中国食品药品检定研究院, 批号: 140637~140644-2000-01);甘露糖、葡萄糖醛酸、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖(批号为2000-03, 纯度大于98%;山西玖玖商贸有限公司); 三氟乙酸(TFA, 批号为20171126, 纯度大于99%;中国上海阿拉丁); 1-苯基-3-甲基-5-吡唑啉酮(PMP, 批号为20150911, 纯度大于99%;国药集团化学试剂有限公司); 分析级无水乙醇(批号: 2019091042)、甲醇(批号: 2019052062)、氯仿(批号: 2018101428)和正丁醇(批号: 2018111237)均为天津市大茂化学试剂厂; 色谱级乙腈(批号: 20190425)和甲醇(批号: 20181214)均为美国Thermo公司。
HPLC分析条件 HPLC-ELSD检测条件:色谱柱为TSK gel GMPWXL凝胶柱(300 mm×7.8 mm, 13 μm) (日本Tosoh Corporation公司); ELSD漂移管温度105 ℃; 载气为空气; 流速2.5 L·min-1; 流动相为纯水, 纯水等度洗脱; 流速1.0 mL·min-1; 柱温为30 ℃; 进样量20 μL。
HPLC-UV检测条件:色谱柱为Venusil XBP C18 (250 mm×4.6 mm, 5 μm; 中国天津博纳艾杰尔科技有限公司); 流动相为A相为磷酸二氢钠缓冲液(pH 6.7, 50 mmol·L-1); B相为乙腈; A:B = 82:18等度洗脱; 流速为1.0 mL·min-1; 柱温为35 ℃; 检测波长250 nm; 进样量20 μL。
柴胡中多糖的提取和TFA水解 参考文献方法[13-17], 四种柴胡分别粉碎过100目筛, 精密称取2.0 g脱脂, 加无水乙醇60 mL加热到80 ℃回流2 h, 减压回收乙醇; 药渣加水90 mL (料液比1:45)浸泡20 min后, 95 ℃下提取1.5 h, 两次, 抽滤合并滤液, 浓缩至水料比为2:1即4 mL, 冷却, 加醇使含醇量达到90%, 静置12 h离心, 3 000 r·min-1, 10~15 min, 弃上清, 得柴胡粗多糖; 加20 mL蒸馏水将粗多糖沉淀全部溶解, 加Sevage试剂(氯仿-正丁醇=4:1) 20 mL剧烈振摇20~30 min, 离心, 上清液加Sevage试剂5 mL, 同上反复操作3次, 得柴胡精多糖溶液, 冷冻干燥得精多糖粉末, 备用, 通过冻干粉与干燥柴胡粉末重量的比率计算得率。
取柴胡精多糖粉末10 mg, 加2 mol·L-1三氟乙酸6 mL, 于10 mL安瓿瓶中溶解混匀, 密封, 置于110 ℃烘箱中加热水解3 h, 冷却至室温, 转移至圆底烧瓶中浓缩至干, 减压条件下反复加入甲醇2 mL复溶蒸干, 重复三次除去残余的TFA, 最后将水解产物溶于1 mL纯水溶液中, 备用。
柴胡多糖分子质量的测定 参考文献方法[13-17], 四种柴胡分别粉碎过100目筛, 精密称取2.0 g脱脂, 加无水乙醇60 mL加热到80 ℃回流2 h, 减压回取8个已知相对分子质量的右旋糖酐对照品, 分别加流动相稀释成约5 mg·mL-1的单标溶液作为对照品溶液, 分别进样。以保留时间为横坐标, 以lg Mr为纵坐标, 作图得到右旋糖酐对照品线性回归方程lg Mr = -1.014 x + 13.912, 相关系数为0.991 4。
供试品溶液的配置:取柴胡精多糖粉末, 加纯水配置成5 mg·mL-1的供试品溶液, 即得。
柴胡单糖对照品的衍生化 参考文献方法[13-17], 四种柴胡分别粉碎过100目筛, 精密称取2.0 g脱脂, 加无水乙醇60 mL加热到80 ℃回流2 h, 减压回衍生化方法结合Bai等[18]的方法稍作修改, 分别精密称取甘露糖、葡萄糖醛酸、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖对照品0.022 5、0.024 3、0.022 8、0.026 5、0.049 5、0.022 5、0.075 1和0.041 0 g, 将各单糖对照品称至同一个10 mL离心管中, 加超纯水5 mL, 溶解并混匀, 即得混合对照品溶液。取上述混合对照品1 mL, 加入超纯水4 mL, 将混合对照品稀释5倍, 即得最终的混合对照品溶液。取最终的混合对照品溶液0.2 mL至2 mL EP管中, 加入0.5 mol·L-1 PMP溶液0.24 mL及0.3 mol·L-1氢氧化钠溶液0.2 mL, 充分振摇, 放至恒温金属浴中, 70 ℃、300 r·min-1反应70 min, 冷却至室温, 加入0.3 mol·L-1盐酸溶液0.2 mL进行中和, 加入氯仿1 mL萃取, 离心, 弃去有机层, 重复萃取3次, 得上层水液, 经0.45 μm微孔滤膜滤过, 备用。
供试品溶液的配置:精密吸取不同种柴胡多糖水解液0.2 mL, 按“单糖对照品的衍生化”项下方法处理后, 即得。
数据处理 参考文献方法[13-17], 四种柴胡分别粉碎过100目筛, 精密称取2.0 g脱脂, 加无水乙醇60 mL加热到80 ℃回流2 h, 减压回在HPLC-ELSD多糖特征图谱中, 两个谱图之间的相似性被表示为cos θ式(1)和R式(2)。
| $ \begin{aligned} \cos \theta=\frac{A \cdot B}{|A| \cdot|B|} &=\frac{\sum_{i=1}^{n} A_{i} B_{i}}{\sqrt{\sum_{i=1}^{n} A_{i}^{2}} \times \sqrt{\sum_{i=1}^{n} B_{i}^{2}}} \\ &[\theta \in(0, \pi / 2] \end{aligned} $ | (1) |
| $ R=\frac{\sum_{i=1}^{n}\left(A_{i}-\bar{A}\right)\left(B_{i}-\bar{B}\right)}{\sqrt{\sum_{i=1}^{n}\left(A_{i}-\bar{A}\right)^{2}} \times \sqrt{\sum_{i=1}^{n}\left(B_{i}-\bar{B}\right)^{2}}} $ | (2) |
其中, 1 ≤ i ≤ n, n为两个不同样品特征图谱中共有峰的色谱峰数, Ai、Bi分别代表两个不同样品中i成分的峰面积或峰高值,
运用SIMCA13.0软件对多糖特征图谱和单糖特征图谱进行多元统计分析。构建PLS模型对数据进行预测, 四种柴胡样本的训练集和验证集如表 1所示。先将32批训练集导入系统中进行PLS分析, 然后将48批样品全部导入系统, 同时考察验证集与训练集之间的预测关系。运用SPSS 25.0软件对柴胡单糖的种类及量进行聚类分析。
| Table 1 Source and distribution of different batches of Bupleurum. BCH: Bupleurum chinense DC.; HCH: Bupleurum scorzonerifolium Willd; SDCH: Bupleurum falcatum; ZCH: Bupleurum marginatum Will ex DC. var stenophyllum (Wolff) Shan et Li |
不同种柴胡中柴胡多糖得率存在一定差异, BCH的平均得率为5.9% (5.2%~6.4%), HCH的平均得率为9.9% (9.5%~10.4%), SDCH的平均得率为13.3% (12.1%~14.3%), ZCH的平均得率为9.5% (9.0%~10.2%)。从提取多糖的得率来看, 三岛柴胡的得率最高, 而北柴胡的得率最低。
2 柴胡多糖分子质量的确定 2.1 HPLC-ELSD多糖特征图谱分析采用高效液相色谱法对提取所得到的48批柴胡多糖进行分子质量分布分析, 每种柴胡的前8批样品图重合结果如图 1所示, 图 1中色谱峰上的数据为各切割部分的最高点的相对分子质量。三岛柴胡多糖样品的HPLC-ELSD图谱按图 1的峰起伏切割成4个部分, 其余三种柴胡多糖样品的图谱按图 1的峰起伏切割成2个部分, 但是每个部分的峰面积占总峰面积的百分比不同, 表明不同柴胡的分子质量分布存在差异。

|
Figure 1 Chromatogram of refined polysaccharide from BCH (A), HCH (B), SDCH (C), ZCH (D) by HPLC-ELSD |
一般来说, 不同的提取方法可能导致不同的分子质量分布。从图 1中可以看出, 在相同的提取条件下, 来自BCH和HCH的柴胡多糖具有相似的分子质量分布, 可分为2个部分, 其中较大分子质量约为500 kDa, 较小分子质量约为3 000 Da; ZCH的柴胡多糖的分子质量虽然也可以分为2个部分, 但是较大分子质量大于900 kDa, 较小分子质量约为4 000 Da; 区别最大的是SDCH中的柴胡多糖, 其分子质量可以分为4个部分, 最大分子质量大于2 MDa (超出线性范围), 较大分子质量约为400 kDa, 较小分子质量约为5 000 Da, 最小分子质量约为100 Da。
此外, 每个部分的峰面积占总峰面积的百分比具有显著差异, HCH和ZCH中柴胡多糖较大分子质量约占总多糖的75%, 较小分子质量约占总多糖的25%;而BCH中柴胡多糖较大分子质量约占总多糖的90%, 较小分子质量约占总多糖的10%; SDCH中大于2 MDa的分子质量约占总体的20%, 较大分子质量超过总体的50%, 较小分子质量约占总体的25%。
2.2 HPLC-ELSD多糖特征图谱相似性评估基于HPLC-ELSD特征图谱中获得的样本变量, 由图 1可以清楚的看出三岛柴胡的显著差异性, 其余3种柴胡通过计算组内与组间的cos θ值和R值, 对特征图谱的相似性进行评估, 计算得BCH、HCH和ZCH的平均cos θ值均大于0.999 9, 且R值也均大于0.999 9, 说明组内相似性极高。而BCH和HCH之间的cos θ值和R值分别为0.970 1和0.981 6; BCH和ZCH之间的cos θ值和R值分别为0.968 7和0.990 4; HCH和ZCH之间的cos θ值和R值分别为0.982 4和0.984 3。结果表明, 相同品种柴胡多糖之间的相似性高于不同品种之间的相似性。
2.3 多元统计分析PCA的得分散点图能直观地显示不同样品之间的整体差异, 反映数据的原始状态, 观察到实验样品的自然分布和组别关系, 但不能忽略组内误差, 消除与研究目的无关的随机误差[19]。为了保留数据的整体特征与变化规律, 确定不同品种柴胡之间的化学差异成分, 可以采用有监督的OPLS-DA分析对数据进行进一步分析[20]。采用PLS可进行建模和预测, 统计其判别的准确率。
图 2A为所有柴胡样品数据导入SMICA软件中分析得到PLS散点图, 横纵坐标分别是t1的得分值(t[1])和t2的得分值(t[2]), 由图可以看出北柴胡和三岛柴胡可以明显区分, 且不同种类的柴胡区分程度与训练集结果相似, 验证集的柴胡与训练集的柴胡聚集在一起, 说明所建立模型可以判别不同种类的柴胡。图 2B和2C显示了PLS模型中作为训练集与验证集的4种柴胡之间的真实值与估计值之间的关系。图 2B中训练集以真实值为纵坐标、估计值为横坐标, 且两者之间的差异用评估均方差(RMSEE)表示, RMSEE的值为0.262 737, 可将四种柴胡明显分开, 线性方程为y = 1 x + 6.967 75×10-8, R2值为0.951 678。为了验证PLS训练集模型, 将4种柴胡的验证集带入训练集所创建的模型中进行验证。预测4种不同柴胡的模型能力, 由验证集产生的预测均方差(RMSEP)表示。图 2C中显示了4种柴胡中验证集样品的分析情况, 图中线性方程为y = 0.938 144 x + 0.079 675, R2值为0.963 1, 可以看出RMSEP值为0.240 195, 且4种柴胡也明显地被预测出来。由于RMSEP值与RMSEE值相差不大, 这也说明所建模型的效果非常好。
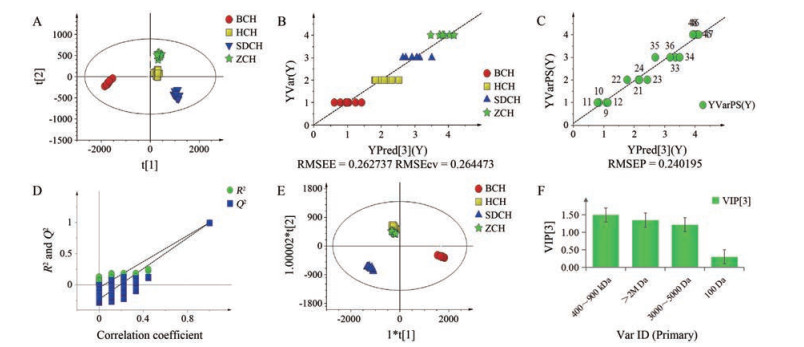
|
Figure 2 PLS-derived score plot of overall samples (A), PLS-derived relationship between true value and estimate value of training set (B) and validation set (C), permutations (D), OPLS-DA (E) scores plots and VIP-plots (F) of Bupleurum samples based on polysaccharide specific chromatogram. RMSEE: Root mean square error of estimation; RMSEcv: Root mean square error of cross-validation; RMSEP: Root mean square error of prediction; YVarPS: Validation set sample; VIP: Variable importance value |
图 2D为4种柴胡HPLC-ELSD多糖特征图谱峰面积进行有监督的偏最小二乘判别分析(PLS-DA), 排列实验表明随机变量y变量产生的R2、Q2均小于原始值(其中, R2和Q2值分别表示对数据的解释程度和对模型的预测能力), 证明模型有效可靠。进行有监督的正交偏最小二乘判别分析(OPLS-DA) (图 2E)发现北柴胡和三岛柴胡可以明显区分, 但是红柴胡和藏柴胡比较接近。从VIP值的图 2F可以看出, 使这4种柴胡区分的主要多糖为组分2部分, 即分子质量片段为400~900 kDa的部分。
3 柴胡单糖组成的测定 3.1 HPLC-UV单糖特征图谱分析用PMP柱前衍生化-高效液相色谱法测定了8种标准单糖混合物色谱图(图 3)和不同柴胡单糖特征图谱(图 4)。将单糖混合对照品图谱与样品柴胡单糖特征图谱进行对比, 发现4种柴胡单糖的HPLC-UV单糖特征图谱具有相似的保留时间, 可以确定4种柴胡都是由甘露糖、葡萄糖醛酸、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖7种单糖组成的, 而各单糖的相对峰面积有所区别, 表明4种柴胡多糖具有不同的单糖物质的量比。

|
Figure 3 HPLC chromatograms of monosaccharide reference substances. 1: Mannose; 2: Glucose acid; 3: Rhamnose; 4: Galacturonic acid; 5: Glucose; 6: Galactose; 7: Arabinose; 8: Fucose |
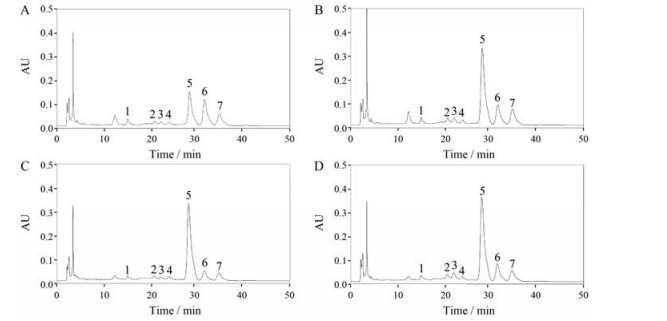
|
Figure 4 Monosaccharide chromatograms of BCH (A), HCH (B), SDCH (C), ZCH (D) by HPLC. 1: Mannose; 2: Glucose acid; 3: Rhamnose; 4: Galacturonic acid; 5: Glucose; 6: Galactose; 7: Arabinose |
图 5A为不同柴胡所有样品数据导入SMICA软件中分析得到PLS散点图, 由图可以看出4种柴胡可以明显区分, 比多糖分离效果要好很多, 由图可知不同种类的柴胡区分程度与训练集结果一致, 验证集的柴胡与训练集的柴胡聚集在一起, 说明所建立模型可以判别不同种类的柴胡。图 5B和5C显示了PLS模型中作为训练集与验证集的4种柴胡之间的真实值与估计值之间的关系。图 5B中训练集以真实值为纵坐标、估计值为横坐标, 且两者之间的差异用RMSEE表示, RMSEE的值为0.071 582, 可将4种柴胡明显分开, 线性方程为y = 1 x - 3.33293×10-8, R2值为0.996 669。为了验证PLS训练集模型, 将4种柴胡的验证集带入训练集所创建的模型中进行验证。预测4种不同柴胡的模型能力, 由验证集产生的RMSEP表示。图 2C中显示了四种柴胡中验证集样品的分析情况, 图中线性方程为y = 0.990 885 x + 0.018 835, R2值为0.997 753, 可以看出RMSEP值为0.054 128, 且4种柴胡也明显地被预测出来。由于RMSEP值与RMSEE值相差不大, 这也说明所建模型的效果非常好。此外, 图 5结果表明单糖谱图对柴胡品种的鉴别效果比图 2中多糖谱图对柴胡种类鉴别的效果好。
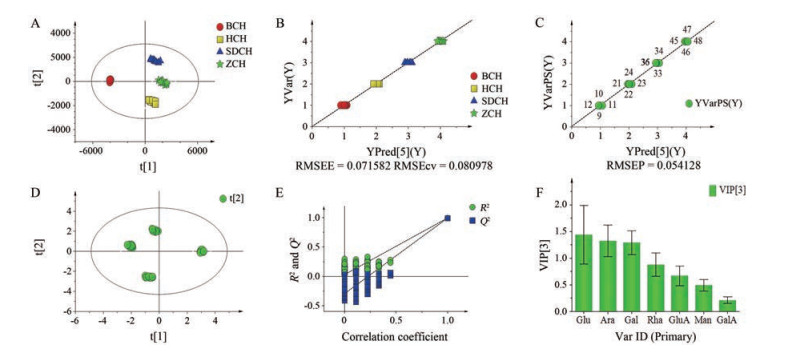
|
Figure 5 PLS-derived score plot of overall samples (A), PLS-derived relationship between true value and estimate value of training set (B) and validation set (C), PCA (D), permutations (E) and VIP-plots (F) of Bupleurum samples based on monosaccharides specific chromatogram |
图 5D为4种柴胡HPLC-UV单糖特征图谱峰面积所得的PCA得分散点图, 观察4组样本的分离趋势, 4种柴胡可以明显区分, 比多糖谱图分离更明显。如图 5E进行有监督的PLS-DA分析, 排列实验表明随机变量y产生的R2、Q2均小于原始值, 由图可知左边所有Q2和R2均低于右边原始值, 且Q2所在蓝色回归线与左侧纵坐标相交于零以下, 由此得出模型成立。最后进行有监督的OPLS-DA分析发现4种柴胡可以明显区分, 并与PCA分离效果一致, 由VIP值(图 5F)可知使4种柴胡分开的主要成分为葡萄糖、阿拉伯糖和半乳糖(VIP > 1), 但最明显的为葡萄糖。
以阿拉伯糖的物质的量为1 mol, 计算其他组分单糖的物质的量比, 其中葡萄糖最大, 其次是半乳糖和阿拉伯糖。从BCH、HCH、SDCH和ZCH中各种单糖相对于阿拉伯糖的物质的量来看, BCH、HCH、SDCH和ZCH中葡萄糖与阿拉伯糖的比值依次是: 3.369~4.137、5.949~6.988、12.791~16.492、9.281~11.728。此外, 三岛柴胡中半乳糖醛酸含量(大于0.6)比其他3种柴胡的甘露糖(小于0.6)多, 藏柴胡中鼠李糖含量(大于1.0)比其他3种柴胡的鼠李糖(小于1.0)多, 北柴胡中半乳糖含量(大于4.0)比其他3种柴胡的半乳糖(小于4.0)多。综上推测, 测定柴胡中葡萄糖与阿拉伯糖的量, 求算其物质的量比值, 即可对这4种柴胡进行鉴别。
3.3 聚类分析将柴胡中的单糖特征图谱数据标准化后导入SPSS 25.0软件进行聚类分析, 结果如图 6所示。由图可知, 根据柴胡单糖的特征图谱可以很好地区分北柴胡与其他3种柴胡, 红柴胡和藏柴胡相对不易区分, 与PCA和OPLS-DA结果一致。

|
Figure 6 Hierarchical cluster analysis on carbohydrates from different Bupleurum samples based on monosaccharides fingerprint |
结果表明, 基于单糖含量的相对值, 4种柴胡仍然具有显著的差异, 图 6直观地显示了北柴胡与其他3种柴胡之间的差异。单糖组成的测定需要完全酸水解, 然后进行柱前衍生化, 操作流程耗时短, 所需样品量少, 且结果分离效果明显。由此可见, 基于单糖特征图谱分析对柴胡的鉴别是可靠的, 是确定柴胡多糖中单糖组成和含量比的有效方法。
结论柴胡属是伞形科的大属之一, 据中国植物志记载, 我国共有柴胡属植物36个种, 其中有17个变种。由于我国柴胡属植物种类繁多, 应用广泛, 造成柴胡品种的混乱, 随着柴胡多糖药理活性认识的逐步深入, 应该考虑作为柴胡的鉴别和评价指标加以应用。因此本实验以北柴胡、红柴胡、三岛柴胡和藏柴胡为研究对象, 通过测定48批柴胡样品, 对柴胡的多糖分子质量和单糖组成进行检测, 鉴别4种柴胡, 此法为柴胡的品种鉴别提供实验依据。
从提取多糖的得率来判断, 三岛柴胡的得率最高, 而北柴胡的得率最低。从柴胡的多糖特征图谱来看, 通过分子质量分布可以将三岛柴胡明显区别, 通过不同分子质量的占比可以将北柴胡区分, 经过相似分布所对应的分子质量不同可以将红柴胡和藏柴胡加以区别:三岛柴胡多糖具有4种分子质量分布: 2 MDa、400 kDa、5 000 Da和100 Da, 其中400 kDa分子质量的多糖占总多糖的一半以上; 北柴胡中400 kDa分子质量的多糖约占总多糖的90%, 3 000 Da分子质量的多糖约占总多糖的10%;红柴胡中3 000 Da分子质量的多糖约占总多糖的25%, 550 kDa分子质量的多糖约占总多糖的75%, 藏柴胡中4 000 Da分子质量的多糖约占总多糖的25%, 900 kDa分子质量的多糖约占总多糖的75%。
从柴胡的单糖特征谱图来分析, 虽然4种柴胡的单糖组成相同, 都是由甘露糖、葡萄糖醛酸、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成的, 但在比例上存在一定差异, 其中葡萄糖与阿拉伯糖的比例悬殊最大, 北柴胡、红柴胡、三岛柴胡和藏柴胡中葡糖糖与阿拉伯糖的比值依次是: 3.0~4.5、5.5~7.0、12.0~17.0、9.0~12.0, 因此测定柴胡中可溶性的葡萄糖和阿拉伯糖, 求算其单糖谱图中峰面积的相对比例, 即可判断柴胡的种类, 这为不同柴胡的鉴别提供了有效的方法。
本实验利用多糖和单糖特征图谱技术, 找出了4种柴胡多糖的分子质量分布和单糖组成比例上的差异, 并发现了影响不同柴胡最重要的单糖成分, 这为不同柴胡的鉴别提供了重要依据, 同时也为探明柴胡中碳水化合物的物质奠定了基础。
作者贡献: 石丽霞负责文中实验设计和实施、数据收集、结果分析和文章撰写等工作; 李科负责提供文章思路, 在文章写作方面进行指导和修改; 秦雪梅和李震宇负责对文章进行修改完善; 崔连杰负责实验实施以及数据收集的部分工作; 李树颖和曹宇欣负责谱图检测分析中的指导; 王盛金主要负责对柴胡种源的收集与鉴别。
利益冲突: 本文研究内容无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 1. 2015 Ed. Beijing: China Medical Science Press, 2015: 280-281.
|
| [2] |
Wu Y. ITS Sequence Research Bupleurum, Drug Source Investigation and Commodity Identification (柴胡ITS序列研究、药源调查及商品鉴定)[D]. Beijing: Beijing University of Chinese Medicine, 2005.
|
| [3] |
Diao XB, Wang HY, Sun Q. Character identification of qualified goods and unqualified goods of Bupleurum[J]. Qilu Pharm Aff (齐鲁药事), 2008, 27: 38-40. |
| [4] |
Wang H, Liu X. Research progress on Bupleurum marginatum var. stenophyllum[J]. World Latest Med Inf (世界最新医学信息文摘), 2019, 19: 110-113. |
| [5] |
Ding C, Xv Y, Ma XX. Identification on five kinds of easily confused Bupleurum medicinal materials[J]. J Chin Med Mat (中药材), 2016, 39: 1975-1981. |
| [6] |
Zhang SS, Xing J, Li ZY, et al. Metabolic essential oil of different radix Bupleuri by GC-MS[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2014, 20: 84-87. |
| [7] |
Yin J, Zhuang H, Huang L, et al. Mechanism of Bupleurum polysaccharide on LPS-induced cardiomyocyte injury[J]. Chin J Immunol (中国免疫学杂志), 2020, 36: 47-51. |
| [8] |
Yang RG, Zhao FF, Li X. Study on the anti-nasopharyngeal carcinoma effect of Bupleurum chinense polysaccharide on macrophages and its mechanism[J]. J Chin Med Mat (中药材), 2019, 42: 886-890. |
| [9] |
Yan ML, Yang L, Hou AJ, et al. Research progress on chemical composition and pharmacological effect of Bupleurum chinense[J]. Inf Tradit Chin Med (中医药信息), 2018, 35: 103-109. |
| [10] |
Li SP, Wu DT, Zhao J. Saccharide mapping and its application in quality control of polysaccharides from Chinese medicines[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 3505-3513. |
| [11] |
Lin W. Study on Fingerprints Technique for Quality Control of Some Chinese Traditional Medicines and Foodstuffs (指纹图谱技术在某些中药和食品质量控制中的应用)[D]. Nanchang: Nanchang University, 2012.
|
| [12] |
Zhang P, Wang ZF, Xie MM, et al. Detection of carbohydrates using a precolumn derivatization reagent 1-(4-isopropyl) phenyl-3-methyl-5-pyrazolone by high-performance liquid chromatography coupled with electrospray ionization mass spectrometry[J]. J Chromatogr B, 2010, 878: 1135-1144. DOI:10.1016/j.jchromb.2010.03.027 |
| [13] |
Li XN, Yu H, Gong QF, et al. Optimization of extraction process of total polysaccharides in Bupleuri Radix and its content difference in different processed products of Bupleuri Radix[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2016, 22: 27-30. |
| [14] |
Lin H, Li XF, Luo KP, et al. The optimization of extraction technology using "combination optimization method" and the content determination of Caihu polysaccharide[J]. Pharm Clin Chin Mater Med (中药与临床), 2017, 8: 37-41. |
| [15] |
Deng HS, Yang LN. Optimization of polysaccharide extraction from Bupleuri Radix using response surface methodology[J]. Mod Chin Med (中国现代中药), 2018, 20: 742-747. |
| [16] |
Hu HT, Wang YX, Zhang J, et al. Product analysis of Plantago asiatica L. polysaccharide by acid hydrolysis[J]. Food Sci (食品科学), 2014, 35: 60-64. |
| [17] |
Yang F, Xiao CY, Qu J, et al. Structural characterization of low molecular weight polysaccharide from Astragalus membranaceus and its immunologic enhancement in recombinant protein vaccine against systemic candidiasis[J]. Carbohydr Polym, 2016, 145: 48-55. DOI:10.1016/j.carbpol.2016.03.024 |
| [18] |
Bai WD, Fang XD, Zhao WH, et al. Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography[J]. J Food Drug Anal, 2015, 23: 645-651. DOI:10.1016/j.jfda.2015.04.011 |
| [19] |
A JY. Analysis of metabolomic data: principal component analysis[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2010, 15: 481-489. |
| [20] |
Worley B, Powers R. PCA as a practical indicator of OPLS-DA model reliability[J]. Curr Metab, 2016, 4: 97-103. DOI:10.2174/2213235X04666160613122429 |
 2020, Vol. 55
2020, Vol. 55


