2. 河南省中药开发工程技术研究中心, 河南 郑州 450046
2. The Engineering and Technology Center for Chinese Medicine Development of Henan Province China, Zhengzhou 450046, China
皂角刺(Gleditsiae spina)为豆科皂荚属植物皂荚(Gleditsia sinensis Lam.)的干燥棘刺, 又称皂刺, 皂针, 天丁等, 广泛分布于我国河南、河北、江苏及湖北等省, 全年可采收。皂角刺始载于《本草衍义补遗》, “治痈疽已溃, 能引至溃处”, 2015版《中国药典》记载其味辛, 性温, 归肝、胃经, 具有消肿托毒、排脓、杀虫等功效, 用于痈疽初起或脓成不溃, 外治疥癣麻风, 多用于治疗阑尾炎、坐骨神经痛、盆腔感染等[1]。现代研究表明, 皂角刺主要含有黄酮类、酚酸类、萜类等成分, 具有抗宫颈癌[2]、乳腺癌[3]、细胞保护[4]等作用。本实验室前期对皂角刺进行了系统的化学成分分离, 从乙酸乙酯部位分离鉴定了18个化合物[5]。为进一步研究其所含成分, 明确其药效物质基础, 本实验对皂角刺提取物乙酸乙酯部位所含化学成分进行分离纯化, 从中得到7个木脂素类化合物。利用MS、UV、1D和2D NMR等波谱技术对结构进行鉴定, 分别为(7R, 8S, 7'E, 7''S, 8''R)-buddlenol P (1)、(+)-丁香脂素(2)、(+)-异落叶松脂素(3)、(7S, 8R)-cedrusin (4)、(7S, 8R)-4, 9, 9'-三羟基-3, 3'-二甲氧基-7, 8-二氢苯骈呋喃-1'-丙基新木脂素(5)、3', 4-O-dimethylcedrusin (6)和蛇菰宁(7) (图 1)。其中化合物1为新化合物, 化合物2~7为首次从皂荚属中分离得到。采用MTT法探究化合物2~7对脂多糖(LPS)诱导的大鼠肾小管上皮细胞损伤的干预作用, 化合物2、3和7对LPS诱导的NRK-52e细胞损伤具有保护作用。

|
Figure 1 Structures of compounds 1-7 |
化合物1 黄色粉末, 易溶于甲醇, [α]D20+52.6 (c 0.04 MeOH); HR-ESI-MS给出准分子离子峰m/z 545.178 7 [M+Na]+ (Calcd. For C29H30O9Na 545.178 2), 结合1H和13C NMR推测化合物的分子式为C29H30O9。UV(MeOH) λmax (logε)/nm: 203 (2.58)、227 (2.28)、284 (1.71)、341 (2.14)。IR谱提示结构中含有羟基(3 397 cm-1)、羰基(1 664 cm-1)和共轭双键(1 594、1 513、1 464 cm-1)等官能团。1H NMR (CD3OD, 500 MHz)谱中, 低场区出现1个醛基氢质子信号[δH 9.57 (1H, s, H-9')]、2个双键氢质子信号[δH 7.61 (1H, d, J = 15.7 Hz, H-7'), 6.68 (1H, d, J = 15.7 Hz, H-8')]、9个芳香氢质子信号[δH 7.26 (1H, brs, H-6'), 7.24 (1H, brs, H-2'), 7.22 (2H, d, J = 8.2 Hz, H-2'', 6''), 7.05 (1H, d, J = 8.2 Hz, H-5), 7.00 (1H, brs, H-2), 6.89 (1H, d, J = 8.2 Hz, H-6), 6.73 (2H, d, J = 8.2 Hz, H-3'', 5'')], 提示结构中存在1个1, 3, 4, 5-四取代苯环、1个1, 3, 4-三取代苯环和1个1, 4-二取代苯环; 高场区出现2个甲氧基氢质子信号[δH 3.91 (3H, s, 3'-OCH3), 3.83 (3H, s, 3-OCH3)]和7个连氧碳上的氢信号[δH 5.64 (1H, d, J = 6.2 Hz, H-7), 4.85 (1H, overlapped, H-7''), 4.27 (1H, m, H-8''), δH 3.87 (2H, m, H-9), 3.68 (1H, dd, J = 11.8, 2.6 Hz, H-9''a), 3.43 (1H, dd, J = 11.8, 5.0 Hz, H-9''b)]。13C NMR (CD3OD, 125 MHz)谱中, 共出现29个碳信号, 结合DEPT 135谱和HSQC谱, 提示其中包括1个醛基碳信号[δC 196.2 (C-9')]、1个1, 3, 4, 5-四取代苯环上的碳信号[δC 152.9 (C-4'), 146.1 (C-3'), 131.0 (C-5'), 129.8 (C-1'), 120.0 (C-6'), 114.3 (C-2')]、1个1, 3, 4-三取代苯环上的碳信号[δC 152.0 (C-3), 149.6 (C-4), 136.9 (C-1), 119.6 (C-6), 119.2 (C-5), 111.2 (C-2)]、1个1, 4-二取代苯环上的碳信号[δC 158.2 (C-4''), 133.0 (C-1''), 129.3 (C-2'', 6''), 116.0 (C-3'', 5'')]、5个连氧碳信号[δC 89.7 (C-7), 87.4 (C-8''), 74.0 (C-7''), 64.6 (C-9), 61.8 (C-9'')]和2个甲氧基碳信号[δC 56.8 (3'-OCH3), 56.6 (3-OCH3)]。化合物1与文献报道的已知化合物buddlenol A核磁数据比较[6], 仅在5和3''位缺少2个甲氧基信号。借助于1D和2D NMR数据(图 2), 对化合物1的1H和13C NMR信号进行了全归属(表 1)。根据氢谱中H-7'与H-8'的偶合常数(J = 15.7 Hz)推测双键为反式构型。由氢谱中H-7与H-8的偶合常数(J = 6.2 Hz)推测H-7、H-8的相对构型为反式。CD光谱中, 在280 nm处出现负的Cotton效应, 确定7、8位的构型为7R、8S[7]。由于7''位氢信号被水峰掩盖, 补测以DMSO为溶剂的氢谱图, 由H-7''与H-8''的偶合常数为4.2 Hz, 及C-8''与C-7''的化学位移之差为13.4, 推测H-7''、H-8''的相对构型为erythro (赤式)[7, 8], 且CD谱中在237 nm处出现负的Cotton效应, 确定7''、8''位的构型为7''S、8''R[7]。综合上述分析确定化合物1的结构, 命名为(7R, 8S, 7'E, 7''S, 8''R)-buddlenol P。
| Table 1 1H NMR (500 MHz in CD3OD) and 13C NMR (125 MHz in CD3OD) spectral data of compound 1 |
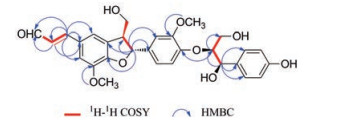
|
Figure 2 The key 1H-1H COSY and HMBC correlations of compound 1 |
化合物2~7为已知化合物, 经核磁波谱分析并与文献数据进行比较, 鉴定为(+)-丁香脂素(2)[9]、(+)-异落叶松脂素(3)[10]、(7S, 8R)-cedrusin (4)[11]、(7S, 8R)-4, 9, 9'-三羟基-3, 3'-二甲氧基-7, 8-二氢苯骈呋喃-1'-丙基新木脂素(5)[12, 13]、3', 4-O-dimethylcedrusin (6)[14]、蛇菰宁(7)[15]。
2 化合物活性检测采用MTT法探究化合物2~7对LPS诱导的NRK-52e细胞损伤的干预作用, 结果表明, 化合物2、3和7对LPS诱导的NRK-52e细胞损伤具有保护作用(表 2)。
| Table 2 The effect of compounds 2, 3 and 7 on NRK-52e cell injury induced by LPS |
N-1001型旋转蒸发仪、A-1000S型水流抽气机、N-1111型冷冻水循环装置(上海埃朗仪器有限公司); 电热鼓风干燥箱(上海一恒科学仪器有限公司); 赛谱锐思LC52型高压制备液相色谱仪(赛谱锐思北京科技有限公司); UV200型紫外检测器; Autopol IV全自动旋光仪(美国鲁道夫公司); Bruker AVANCE III 500型核磁共振仪、Bruker maxis HD型飞行时间质谱(德国布鲁克公司); 二氧化碳培养箱(上海STIK); 超净工作台(苏州集团); 酶标仪(美国BIO-RAD公司); YMC-Pack ODS-A色谱柱(250 mm×20 mm, 5 μm, 日本YMC有限公司); 柱色谱填料Sephadex LH-20 (美国Pharmacia Biotech公司); Toyopearl HW-40C (日本TOSOH公司); ODS (40~60 μm, 日本YMC有限公司); MCI Gel CHP-20、大孔树脂Diaion HP-20 (日本三菱化学公司); 薄层色谱硅胶GF254、柱色谱硅胶(200~300目, 青岛海洋化工厂); 甲醇(色谱纯, 天津四友精细化学品有限公司); 乙腈(色谱纯, 美国天地有限公司TEDIA); 所用其他分析纯试剂均为天津市富宇精细化工有限公司及天津市致远化学试剂有限公司生产; 培养皿、96孔板(ACEA, 美国); NRK-52e细胞(中国科学院上海细胞库), 胰蛋白酶、DMEM高糖培养基(Gibco); 胎牛血清(浙江天杭生物科技有限公司); DMSO (Solarbio); LPS (Sigma, 美国); 水为超纯水, PBS缓冲液等为自配。
皂角刺于2017年3月采自河南洛阳嵩县九皋镇, 经河南中医学大学董诚明教授鉴定为豆科皂荚属植物皂荚(Gleditsia sinensis Lam.)的干燥棘刺, 标本(20170309)存放于河南中医药大学中药化学实验室。
1 提取分离皂角刺16.5 kg, 用50%含水丙酮组织破碎提取3次, 过滤, 合并滤液, 减压浓缩, 低温减压浓缩得总浸膏1.6 kg。浸膏加6 L水混悬后, 依次用石油醚(5×6 L)、乙酸乙酯(5×6 L)以及水饱和的正丁醇(5×6 L)进行萃取, 减压回收溶剂浓缩得到石油醚部位(15.1 g)、乙酸乙酯部位(300.9 g)、正丁醇部位(150.5 g)及水部位(992.8 g)。乙酸乙酯部位通过硅胶柱(100~200目)色谱分离, 二氯甲烷-甲醇(100:0→0:100)梯度洗脱, 薄层检识合并得到10个流分A1~A10。A5 (54.0 g)上MCI Gel CHP-20柱, 甲醇-水(10:90→100:0)梯度洗脱, 薄层检识合并得到14个流分A5-1~A5-14。A5-3 (1.6 g)上Sephadex LH-20凝胶柱, 甲醇-水(30:70)等度洗脱得到17个流分A5-3-1~A5-3-17。A5-3-9 (127.4 mg)经半制备高效液相色谱(甲醇-水35:65)制备得到化合物4 (7.8 mg)和5 (4.2 mg)。A5-3-16 (90.3 mg)经半制备高效液相色谱(甲醇-水29:71)制备得到化合物6 (10.2 mg)。A5-6 (7.1 g)经ODS中压柱甲醇-水(10:90→100:0)梯度洗脱, 薄层检识合并得到7个流分A5-6-1~A5-6-7。A5-6-3 (1.0 g)通过硅胶柱(300~400目)色谱分离, 二氯甲烷-甲醇(100:1)等度洗脱, 薄层检识合并得到9个流分A5-6-3-1~A5-6-3-9。A5-6-3-7 (54.9 mg)经半制备高效液相色谱(乙腈-水28:72)制备得到化合物1 (9.1 mg)。A5-10 (10.0 g)通过硅胶柱(300~400目)色谱分离, 二氯甲烷-甲醇(100:1→100:5)梯度洗脱, 薄层检识合并得到11个流分A5-10-1~A5-10-11。A5-10-4 (489.3 mg)上Toyopearl HW-40 C凝胶柱, 二氯甲烷-甲醇(1:1)等度洗脱, 薄层检识合并得到3个流分A5-10-4-1~A5-10-4-3。A5-10-4-1 (93.0 mg)经半制备高效液相色谱(甲醇-水32:68)制备得到化合物7 (14.5 mg)。A5-10-4-2 (145.9 mg)经半制备高效液相色谱(乙腈-水23:77)制备得到化合物2 (11.9 mg)和3 (5.8 mg)。
2 结构鉴定化合物1 黄色粉末, 易溶于甲醇, [α]D20+52.6 (c 0.04 MeOH); HR-ESI-MS测出分子离子峰m/z 545.178 7 [M+Na]+ (C29H30O9Na Calcd. 545.178 2); UV (MeOH) λmax (logε)/nm: 203 (2.58), 227 (2.28), 284 (1.71), 341 (2.14); IRνmax: 3 397, 2 933, 1 664, 1 594, 1 513, 1 464, 1 424, 1 331, 1 264, 1 215, 1 137, 1 026, 947, 835 cm-1。1H NMR (CD3OD, 500 MHz)和13C NMR (CD3OD, 125 MHz)数据见表 1。
3 化合物2~7对LPS诱导的NRK-52e细胞损伤的干预作用取培养于含10% FBS的DMEM高糖培养基中的对数生长期NRK-52e细胞, 以每孔2 000个细胞的密度接种于96孔板。24 h后分为正常对照组(CON)、模型组(LPS, 1 μg·mL-1)和给药组(化合物2~7分别为10 μmol·L-1 + LPS, 1 μg·mL-1), 培养24 h后, 每孔加入MTT溶液(5 mg·mL-1) 20 μL, 继续培养4 h, 小心吸净培养液, 每孔加入DMSO 150 μL, 振荡10 min使其完全溶解。酶标仪490 nm测定各孔吸光度值(OD), 计算细胞活力。
作者贡献: 何晨是本文的第一作者, 负责皂角刺化学成分的分离鉴定、文献的调研整理及初稿的撰写; 曹彦刚博士负责实验把关及稿件修改等工作; 齐曼、任英杰、刘晏灵和王梦娜帮助皂角刺成分分离; 冯卫生教授是本文的通信作者, 负责实验设计和把关、稿件修改等工作。
利益冲突: 本文研究内容无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典一部)[S]. Part 1. Beijing: China Medical Science Press, 2015: 177.
|
| [2] |
Long L, Geng GX, Li QW. Effect of Gleditsia sinensis stings on growth inhibition and expression of PCNA and p53 in mice bearing uterine cervical carcinoma (U14)[J]. China J Chin Mater Med (中国中药杂志), 2006, 31: 150-152. |
| [3] |
Zhao B, Li HR, Du GJ. Experimental study on the anti-tumor activities of Spina Gleditsiae combined with Cortex cinnamomi[J]. J Henan Univ (Med Sci) (河南大学学报:医学版), 2013, 32: 88-92. |
| [4] |
Zhang L, Wang HH, Xu RH, et al. Study on protective effect of extracts from Gleditsiae Spina on PC-12 cells injury induced by corticosterone[J]. Chin Med Mat (中药材), 2020, 43: 1477-1481. |
| [5] |
Qi M, Zheng XK, Cao YG, et al. Chemical constituents from ethyl acetate extract of Gleditsiae Spina[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 5510-5515. |
| [6] |
Yang XW, Zhao PJ, Ma YL, et al. Mixed lignan-neolignans from Tarenna attenuata[J]. J Nat Prod, 2007, 70: 521-525. DOI:10.1021/np0603931 |
| [7] |
Wang LY, Chen MH, Wu J, et al. Bioactive glycosides from the twigs of Litsea cubeba[J]. J Nat Prod, 2017, 80: 1808-1818. DOI:10.1021/acs.jnatprod.6b01189 |
| [8] |
Gan ML, Zhang YL, Lin S, et al. Glycosides from the root of Iodes cirrhosa[J]. J Nat Prod, 2008, 71: 647-654. |
| [9] |
Ji HL, Sai M, Zhou SY, et al. A new dihydroflavone from Mirabilis himalaica[J]. Acta Pharm Sin (药学学报), 2018, 53: 97-99. |
| [10] |
Zhang J, Sun GB, Lei QF, et al. Chemical constituents of Aconiti Lateralis Radix Praeparata[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2014, 20: 108-111. |
| [11] |
Kim TH, Ito H, Hayashi K, et al. Aromatic constituents from the heartwood of Santalum album L.[J]. Chem Pharm Bull, 2005, 53: 641-644. |
| [12] |
Feng WS, Chen H, Zheng XK. Chemical constituents of Selaginella sinensis[J]. Chin Tradit Herb Drugs (中草药), 2008, 39: 654-656. |
| [13] |
Feng WS, Bi YF, Zheng XK, et al. Studies on the lignan chemical constituents from pine needles of Pinus massoniana Lamb.[J]. Acta Pharm Sin (药学学报), 2003, 38: 199-202. |
| [14] |
Luc P, Tess DB, Alex DG, et al. NMR study of some dihydrobenzofuran lignans[J]. Magn Reson Chem, 1993, 31: 692-693. |
| [15] |
Xu MM, Duan YH, Xiao HH, et al. Lignans isolated from stems of Sambucus williamsii and their proliferation effects on UMR 106 cells[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 2684-2688. |
 2020, Vol. 55
2020, Vol. 55


