2. 厅市共建中枢神经系统药物四川省重点实验室, 四川 泸州 646000
2. Central Nervous System Drug Key Laboratory of Sichuan Province, Luzhou 646000, China
胰腺癌是全球癌症相关死亡的第四大原因, 其特点是预后差、早期复发和快速转移。胰腺癌的传统治疗方法包括手术、化疗、放疗和姑息治疗。近年来, 尽管诊断和治疗措施有所改善, 但5年存活率仍低于8%[1]。目前, 胰腺癌的化疗药物仍然以吉西他滨作为一线药物, 但其存在毒副作用及抗药性的问题。近年来, 利用吉西他滨联合表皮生长因子受体(epidermal growth factor receptor, EGFR)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等靶向药物治疗取得了一定进展[2]; 单克隆抗体和细胞因子等免疫治疗手段也尝试应用于胰腺癌的治疗[3], 但这些新的治疗措施对改善胰腺癌患者的生存率尚未获得显著的临床效果。因此, 发展胰腺癌新的治疗策略具有重要意义[4]。
siRNA分子通过碱基互补配对与mRNA结合, 诱导mRNA的降解和/或阻断蛋白质的合成。siRNA药物可以通过阻断转录后过程或抑制致病基因的翻译, 对遗传性疾病、自身免疫性疾病和癌症等的治疗都具有广泛的应用前景。2018年, 美国FDA批准了第一种基于RNA治疗的siRNA药物patisiran[5]。目前siRNA药物已成为国内外的研究热点, 与其他抗癌药物相比, siRNA靶向治疗对基因异常表达具有较高的特异性。然而, siRNA属于极性大分子、半衰期短、膜穿透能力弱, 因此开发高效、低毒的细胞递送载体对siRNA药物具有重要意义。外泌体是从活细胞中释放出来的磷脂双分子层纳米囊泡(40~100 nm), 具有重要的生物学功能[6]。近年来外泌体作为蛋白、DNA及RNA载体的研究受到广泛重视, 多种外泌体负载的siRNA药物对肿瘤细胞具有良好的抑制作用[7]。Alvarez-Erviti等[8]首次利用神经元特异性肽修饰外泌体, 采用电穿孔的方法使外泌体成功负载BACE1 siRNA, 特异性靶向小鼠神经元细胞, 可以显著降低BACE1基因的表达。B淋巴细胞瘤-2 (Bcl-2)是一种癌基因, 在细胞凋亡和转移中起重要作用[9]。Bcl-2的高表达能够抑制细胞色素c (cyt-c)结合凋亡诱导因子1 (Apaf1)和caspase-9形成凋亡体并激活下游caspase级联反应引起的线粒体凋亡。Bcl-2还可以通过刺激各种信号元件如激酶、转录因子、细胞表面受体和基质降解酶, 促进细胞迁移和侵袭[10]。前期研究表明, Bcl-2在胰腺癌细胞中高表达, 抑制Bcl-2可以抑制胰腺癌细胞生长[11]。本研究制备了负载Bcl-2 siRNA的外泌体(exosome-coated Bcl-2 siRNA, exosiBcl-2), 研究了其对胰腺癌细胞生长的抑制作用, 结果表明exosiBcl-2可以显著抑制胰腺癌细胞Miapaca-2生长。
材料与方法药品与试剂 DMEM培养基、胎牛血清系美国HyClone公司产品; SBI无外泌体血清系美国SBI公司产品; 单克隆抗体CD9、CD63、CD81、TSG101购自Abcam公司; Bcl-2 siRNA与带红色荧光标签的cy3-Bcl-2 siRNA购自上海吉凯基因化学技术有限公司。MTS试剂盒购自美国Sigma公司; Western blot凝胶试剂盒系苏州凯基生物技术公司产品; 总RNA提取试剂盒及qRT-RCR引物购自北京天根公司; BCA试剂盒购自美国Thermo公司。其他化学试剂均为分析试剂级。
细胞株 人胰腺癌细胞株Miapaca-2和人胚肾细胞HEK293购均自ATCC (American Type Culture Collection)。
外泌体的制备 采用超速离心法对HEK293上清培养液中的外泌体进行分离。HEK293细胞正常培养至密度为60%, 换为无外泌体的血清, 待密度至85%左右, 收集细胞上清, 4 ℃、2 000 ×g离心15 min。上清液再于4 ℃、16 500 ×g离心30 min, 经0.22 μm的滤膜过滤, 去除大于200 nm的颗粒杂质。4 ℃、100 000 ×g超速离心70 min, 重复2次, 收集下层外泌体, 用100 μL PBS重悬, 于-80 ℃保存。
电转制备exosiBcl-2 Bcl-2 siRNA的序列设计如下[12]: sense 5'-GUA CAU CCA UUA UAA GCU G-dTdT-3'; antisense 5'-CAG CUU AUA AUG GAU GUA C-dTdT-3'。为了方便检测, 同时合成了带红色荧光标签cy3的Bcl-2 siRNA, 即cy3-Bcl-2 siRNA。将外泌体与Bcl-2 siRNA按照质量比为5:1加入电转杯中, 于400 V、125 μF电转2 s (Bio-Rad Gene Pulser Xcell电穿孔仪)。电转后的混合物以135 000 ×g、4 ℃离心70 min, 获得的exosiBcl-2用PBS (100 μL)重悬, 于-80 ℃保存。
粒径检测 将分离得到的外泌体和exosiBcl-2, 分别取10 μL于不同的EP管中, 用PBS稀释后, 混匀加入比色皿中, 利用马尔文Nano-ZS90纳米颗粒计数仪测定外泌体和exosiBcl-2的粒径。
Western blot 外泌体经BCA蛋白定量, 采用Western blot检测CD9、CD63、CD81、TSG101表达水平。Miapaca-2细胞(2×105个)接种到6孔板中, 培养24 h, 采用exosiBcl-2处理细胞, 继续培养48 h, 用RIPA裂解液裂解, 离心提取蛋白。采用BCA法测定各组蛋白浓度, 每组样品取40 μg蛋白上样, SDS-PAGE分离蛋白, 电转移至PVDF膜上; 用5%脱脂奶粉室温摇床封闭1 h, TBST洗膜1次加入一抗(Bcl-2和Bax), 4 ℃孵育过夜, TBST洗膜3次, 每次5 min, 加入二抗室温孵育1 h, TBST洗3次, 每次5 min。用ECL化学发光法检测蛋白表达。使用Image J软件分析蛋白的相对表达量。
外泌体形态观察 采用负染色法观察外泌体形态。取外泌体样品10 μL, 添加到带碳膜的铜网上, 滤纸吸走浮液、静置30 min。配制2%醋酸双氧铀, 取10 μL对外泌体进行染色20 min。去离子水清洗5次, 每次2 min, 透射电镜下观察样品形态。
ExosiBcl-2在细胞内的分布测定 采用共聚焦显微镜检测exosiBcl-2在细胞内的分布。将Miapaca-2细胞(1.5×105个)接种于共聚焦培养皿中, 加入cy3-exosiBcl-2处理24 h, 加入免疫染色固定液孵育10 min, 用免疫染色洗涤液洗涤4次, 每次5 min; 将绿色荧光探针(Actin-Tracker Green)用免疫荧光染色二抗稀释液稀释(1:200), 加200 μL至共聚焦培养皿, 室温孵育30 min, 染色完成后, 洗涤液洗4次, 每次5 min; 加入DAPI工作液室温孵育10 min; PBS洗涤4次, 使用激光共聚焦显微镜观察。
转染效率分析 采用流式细胞技术测定exosiBcl-2的转染效率。取对数期生长的Miapaca-2细胞, 胰蛋白酶消化后, 悬浮计数, 将细胞悬液以2×105个/孔接种至6孔板中。过夜培养24 h后, 以cy3-exosiBcl-2处理细胞, 于37 ℃、5% CO2条件下转染24 h, 胰酶消化, 800 ×g离心5 min收集细胞, 重悬于500 μL的PBS中。使用流式细胞仪分析, 统计cy3荧光为阳性的细胞比例, 得到转染效率。
MTS检测exosiBcl-2对胰腺癌细胞增殖的影响 取对数生长期的Miapaca-2细胞, 胰蛋白酶消化, 细胞计数, 以培养液稀释为终浓度为每毫升3×104个的细胞悬液, 每孔100 μL接种于96孔板中, 37 ℃、5% CO2过夜培养24 h, 用exosiBcl-2处理细胞, 于37 ℃培养0、24、48、72、96、120和144 h后, 每孔加入MTS试剂孵育1 h, 用全波长酶标仪于490 nm测定吸光值。
统计学分析 所得数据用均数±标准差(x±s)表示, 用Excel和GraphPad Prism 8.0统计软件进行数据统计和分析, 组间的均数比较用t检验, 以P < 0.05为差异有统计学意义。应用GraphPad Prism 8.0对数据进行分析作图。
结果 1 外泌体和exosiBcl-2的鉴定从HEK293细胞上清培养液中提取外泌体, 外泌体产量约为150 mg·L-1。采用电转法制备exosiBcl-2, 用Malvern Zetasizer激光粒度仪测定粒径, 结果表明外泌体粒径为66.1 ± 10.7 nm, exosiBcl-2粒径为67.3 ± 9.7 nm (图 1A和B)。透射电子显微镜下观察结果表明, 外泌体膜结构完整, 呈内凹的杯状结构, 符合外泌体的结构和表征(图 1C和D)。Western blot结果显示, 外泌体特征蛋白CD9、CD63、CD81和TSG101的表达富集(图 1E)。使用琼脂糖凝胶测定exosiBcl-2中Bcl-2 siRNA的负载率, 如图 1F所示, 提示当siRNA与外泌体的质量比在5:1, 脉冲时间为2 s, 400 V和125 μF条件时, Bcl-2 siRNA在外泌体中的负载率约为63.1%。

|
Figure 1 Characteristic analysis of exosomes and exosiBcl-2 by transmission electron microscopy (TEM), Malvern zetasizer laser analyzer and Western blot. Exosomes were extracted from the cultured medium of HEK293 cells by ultracentrifugation, and exosiBcl-2 was synthesized by electroporation. The size distribution of exosomes (A) and exosiBcl-2 (B) were analyzed by Malvern zetasizer laser analyzer. The morphology of exosomes (C) and exosiBcl-2 (D) was observed by TEM. Western blot analysis was performed to determine the expression of the characteristic proteins including CD9, CD63, CD81, and TSG101 (E). The loading rate of Bcl-2 siRNA was analyzed by agarose electrophoresis (F) |
本研究首先采用共聚焦显微镜观察exosiBcl-2在Miapaca-2细胞中的分布, 结果表明, 转染cy3-exosiBcl-2的细胞中红色荧光强度显著增加(图 2), 说明exosiBcl-2广泛分布于细胞内。

|
Figure 2 The distribution of exosiBcl-2 in Miapaca-2 cells. Miapaca-2 cells were treated with exosiBcl-2 for 24 h, and the fluorescence intensity was analyzed using Confocal microscopy approach. Green fluorescence (actin-tracker green) represented the actin and blue fluorescence (DAPI) indicated the nucleus, while the red fluorescence represented distribution of cy3-exosiBcl-2. Scale Bar = 50 μm |
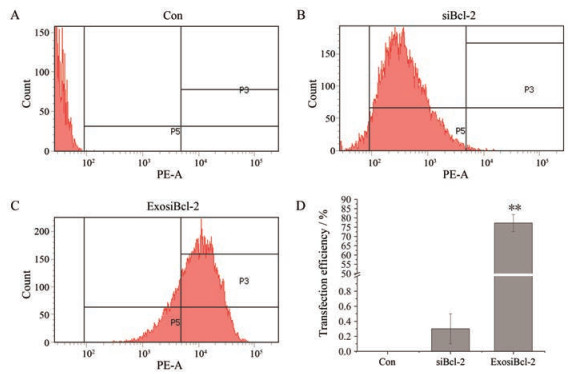
进一步利用流式细胞术测定了Bcl-2 siRNA转染效率。如图 3所示, 与siBcl-2对照组相比, 转染24 h后, exosiBcl-2在Miapaca-2中的转染效率为77.2%, 转染效率显著提高(P < 0.01)。
|
Figure 3 Analysis of transfection efficiency of exosiBcl-2 in Miapaca-2 cells. Miapaca-2 cells were cultured at 37 ℃ for 24 h, and exosiBcl-2 (100 nmol·L-1) was added. After incubated for 24 h, cells were collected by centrifugation at 1 000 ×g for 10 min, and the transfection efficiency of exosiBcl-2 in Miapaca-2 cells transfected with control (A), siBcl-2 (B), exosiBcl-2 (C) was analyzed by flow cytometry. (D) indicated the quantitative analysis of transfection efficiency. n = 3, x±s. **P < 0.01 vs siBcl-2 group |
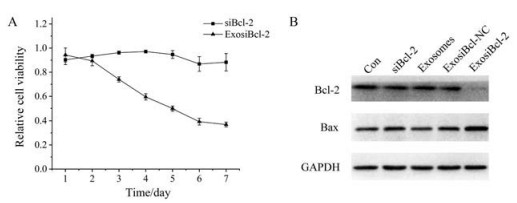
ExosiBcl-2 (100 nmol·L-1)处理Miapaca-2细胞, 采用MTS法测定其对胰腺癌细胞生长的影响, 如图 4所示, 随着时间增加, 经exosiBcl-2处理, Miapaca-2细胞活力逐步降低, 第7天的抑制率达到63%。采用Western blot测定Bcl-2相关凋亡蛋白的表达, 结果显示, exosiBcl-2处理可以导致抗凋亡蛋白Bcl-2表达下降, 促凋亡蛋白Bax表达增加, 提示exosiBcl-2可以通过影响Bcl-2/Bax的表达, 从而抑制胰腺癌细胞生长。
|
Figure 4 ExosiBcl-2 inhibited the growth of Miapaca-2 cells via downregulating Bcl-2. Miapaca-2 cells were treated with exosiBcl-2 and the cell proliferation activity was evaluated by MTS analysis (A). Western blot was performed to determine the expression of Bcl-2 and Bax protein (B) |
本研究通过电穿孔的方法制备了exosiBcl-2, 并在体外评估了其抗胰腺癌作用。结果表明, exosiBcl-2可以高效进入肿瘤细胞, 并抑制胰腺癌细胞Miapaca-2的生长。进一步的研究表明, exosiBcl-2可以通过下调抗凋亡蛋白Bcl-2, 上调促凋亡蛋白Bax发挥抑制肿瘤细胞生长的作用。
基于siRNA的靶向治疗具有多种优点, 包括高特异性、低毒性和高效性。但是, 由于siRNA属于极性大分子, 难以进入细胞, 因此发展安全有效的载体是siRNA药物成功的关键[5]。多年来, 已经开发了多种载体, 包括脂质体介导的siRNA纳米制剂[13]、聚乙烯亚胺(PEI)和聚乙二醇(PEG)介导的siRNA纳米颗粒[14]。本课题组前期研究表明, PEI包裹的miR-125b可以显著抑制肿瘤细胞生长[15]。由于PEI对人正常细胞具有毒性, 使用PEI作为siRNA的载体不能满足临床应用的要求[16]。与其他大分子纳米载体相比, 外泌体具有组织相容性好和低免疫原性等优点。此外, 可以通过对外泌体表面跨膜蛋白的特异性修饰实现体内靶向治疗。Ohno等[17]通过对外泌体膜蛋白的修饰, 特异性表达GE11, 表明外泌体经修饰后负载的miRNA let-7a能够靶向EGFR高表达的乳腺癌细胞。本实验室正在进行修饰外泌体的研究, 以增加exosiBcl-2的靶向性能。
肿瘤转移是肿瘤细胞从原发部位向远处器官逐渐定植的过程, 是导致癌症患者死亡的主要因素[18]。Bcl-2在促进肿瘤细胞转移中起重要作用。Bcl-2家族成员可以通过刺激各种信号传导因子, 如黏着斑激酶(FAK)和促分裂原活化蛋白激酶(MAPK)来促进细胞迁移和侵袭[10]。ExosiBcl-2对胰腺癌的抗转移作用需要更多的实验证实。
作者贡献:左玲、刘明华负责实验设计, 左玲和乔淦进行具体实验, 郭铭悦参与了实验数据分析, 林秀坤进行实验评估和指导。
利益冲突:文章内容不涉及相关利益冲突, 该研究未涉及任何厂家及相关雇主或其他经济组织直接或间接的经济或利益的赞助。
| [1] |
Golan T, HammeL P, Reni M, et al. Maintenance olaparib for germline BRCA-mutated metastatic pancreatic cancer[J]. N Engl J Med, 2019, 381: 317-327. DOI:10.1056/NEJMoa1903387 |
| [2] |
Schultheis B, Reuter D, Ebert MP, et al. Gemcitabine combined with the monoclonal antibody nimotuzumab is an active first-line regimen in KRAS wildtype patients with locally advanced or metastatic pancreatic cancer:a multicenter, randomized phase Ⅱb study[J]. Ann Oncol, 2017, 28: 2429-2435. DOI:10.1093/annonc/mdx343 |
| [3] |
Foley K, Kim V, Jaffee E, et al. Current progress in immunotherapy for pancreatic cancer[J]. Cancer Lett, 2016, 381: 244-251. DOI:10.1016/j.canlet.2015.12.020 |
| [4] |
Seufferlein T, Ettrich TJ. Treatment of pancreatic cancer-neoadjuvant treatment in resectable pancreatic cancer (PDAC)[J]. Transl Gastrointest Cancer, 2019, 4: 21. |
| [5] |
Jain S, Pathak K, Vaidya A. Molecular therapy using siRNA:recent trends and advances of multi target inhibition of cancer growth[J]. Int J Biol Macromol, 2018, 116: 880-892. DOI:10.1016/j.ijbiomac.2018.05.077 |
| [6] |
Thery C, Amigorena S, Raposo G, et al. Isolation and characteri-zation of exosomes from cell culture supernatants and biological fluids[J]. Curr Protoc Cell Biol, 2006. DOI:10.1002/0471143030.cb0322s30 |
| [7] |
Van DB, Jasper G, Schlee M, et al. siRNA delivery with exosome nanoparticles[J]. Nat Biotechnol, 2011, 29: 325-326. DOI:10.1038/nbt.1830 |
| [8] |
Alvarez-Erviti L, Seow Y, Yin H, et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J]. Nat Biotechnol, 2011, 29: 341-345. DOI:10.1038/nbt.1807 |
| [9] |
Adams JM, Cory S. The Bcl-2 arbiters of apoptosis and their growing role as cancer targets[J]. Cell Death Differ, 2017, 25: 27-36. |
| [10] |
Zuo J, Ishikawa T, Boutros S, et al. Bcl-2 overexpression induces a partial epithelial to mesenchymal transition and promotes squamous carcinoma cell invasion and metastasis[J]. Mol Cancer Res, 2010, 8: 170-182. DOI:10.1158/1541-7786.MCR-09-0354 |
| [11] |
Westphal S, Kalthoff H. Apoptosis:targets in pancreatic cancer[J]. Mol Cancer, 2003, 2: 6. DOI:10.1186/1476-4598-2-6 |
| [12] |
Beh CW, Seow WY, Wang Y, et al. Efficient delivery of Bcl-2-targeted siRNA using cationic polymer nanoparticles:downregulating mRNA expression level and sensitizing cancer cells to anticancer drug[J]. Biomacromolecules, 2009, 10: 41-48. DOI:10.1021/bm801109g |
| [13] |
Eloy JO, Petrilli R, Raspantini GL, et al. Targeted liposomes for siRNA delivery to cancer[J]. Curr Pharm Des, 2018, 24: 2664-2672. DOI:10.2174/1381612824666180807121935 |
| [14] |
Song F, Sakurai N, Okamoto A, et al. Design of a novel PEGylated liposomal vector for systemic delivery of sirna to solid tumors[J]. Biol Pharm Bull, 2019, 42: 996-1003. DOI:10.1248/bpb.b19-00032 |
| [15] |
Rytblat I, Wu N, Xu HL, et al. In vitro studies of polyethyleneimine coated miRNA microspheres as anticancer agents[J]. Nano Res, 2016, 9: 1609-1617. DOI:10.1007/s12274-016-1055-4 |
| [16] |
Xiong MP, Forrest ML, Ton G, et al. Poly(aspartate-g-PEI800), a polyethylenimine analogue of low toxicity and high transfection efficiency for gene delivery[J]. Biomaterials, 2007, 28: 4889-4900. DOI:10.1016/j.biomaterials.2007.07.043 |
| [17] |
Ohno S, Takanashi M, Sudo K, et al. Systemically injected exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells[J]. Mol Ther, 2013, 21: 185-191. DOI:10.1038/mt.2012.180 |
| [18] |
Robert J. Biology of cancer metastasis[J]. Bull Cancer, 2013, 100: 333-342. DOI:10.1684/bdc.2013.1724 |
 2020, Vol. 55
2020, Vol. 55


