2. 中国科学院昆明动物研究所, 云南省活性多肽研究与利用重点实验室/中国科学院动物模型与人类疾病机理重点实验室, 云南 昆明 650223;
3. 昆明理工大学医学院, 云南 昆明 650500;
4. 昆明医科大学药学院暨云南省天然药物药理重点实验室, 云南 昆明 650500
2. Key Laboratory of Bioactive Peptides of Yunnan Province/Key Laboratory of Animal Models and Human Disease Mechanisms of the Chinese Academy of Sciences, Kunming Institute of Zoology, Chinese Academy of Sciences, Kunming 650223, China;
3. College of Medicine, Kunming University of Science and Technology, Kunming 650500, China;
4. School of Pharmaceutical Science and Yunnan Key Laboratory of Pharmacology for Natural Products, Kunming Medical University, Kunming 650500, China
寨卡病毒(Zika virus, ZIKV)是一种新发的蚊媒传播的RNA病毒, 1947年首次在乌干达恩德培附近的寨卡森林中的恒河猴血清中分离得到[1]。与登革病毒(dengue virus, DENV)、西尼罗病毒(West Nile virus, WNV)、黄热病毒(yellow fever virus, YFV)和日本脑炎病毒(Japanese encephalitis virus, JEV)等重要医学病毒一样, ZIKV是属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus)的单股正链RNA病毒, 主要通过蚊子叮咬传播[2]。ZIKV感染人体后, 一般表现为无症状感染且具有自限性, 少数感染者表现发热、头痛、关节痛、皮疹和结膜炎等临床症状[3, 4]。然而, 近年的研究表明ZIKV感染与神经系统疾病直接相关, 例如成人感染可导致格林-巴利综合征(Guillain-Barré syndrome, GBS), 孕妇感染还可导致胎儿先天性小头畸形[5-8]。2016年2月, 寨卡疫情被世界卫生组织宣布为“国际关注的突发公共卫生事件”。虽然我国尚无本地病例, 但已有多起输入病例报道[9], 与我国相邻的东南亚是蚊媒病毒感染性疾病疫情的多发区域, 广泛分布着ZIKV的主要传播媒介埃及伊蚊与白纹伊蚊, 需高度警惕ZIKV对我国的潜在威胁。
ZIKV基因组全长约11 kb, 包含1个开放阅读框(open reading frame, ORF)编码1个多聚蛋白[10]。宿主和病毒蛋白酶将单个病毒多聚蛋白加工成3种结构蛋白, 即衣壳(capsid, C)、前膜(pre-membrane, prM)和包膜(envelope, E)蛋白, 以及7种非结构蛋白(non-structural protein, NS), 即NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5[11]。结构蛋白在病毒颗粒形成、病毒结合、融合和进入宿主细胞等环节发挥重要作用, 非结构蛋白主要参与病毒复制、释放和逃逸宿主免疫反应[12]。ZIKV通过特异性受体介导的内吞作用进入细胞, 在此过程中, 酪氨酸蛋白激酶受体AXL、Tyro3、DC-SIGN和TIM-1等细胞表面受体介导并促进了ZIKV进入宿主细胞[13], 形成包裹ZIKV颗粒的内体。然后, 内体中的酸性环境触发病毒E蛋白发生构象变化进而诱导E蛋白和内体发生膜融合, 从而使病毒基因组RNA释放到细胞质[14, 15]。
环索奈德(ciclesonide)是一种美国食品药品管理局(Food and Drug Administration, FDA)批准用于临床的吸入型糖皮质激素, 常用于治疗成人和青少年的持续性哮喘[16], 但至今未见环索奈德抗病毒活性的研究报道。本研究中, 作者发现环索奈德具有显著抗ZIKV活性并对其作用机制进行了初步研究, 期望为开发有效的抗ZIKV药物提供科学依据。
材料与方法化合物 环索奈德由江苏理工学院张大为博士提供; 表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)购自上海麦克林生化科技有限公司。化合物溶于100%二甲基亚砜(dimethyl sulfoxide, DMSO)中, 保存于4 ℃备用。
细胞和病毒 Vero、A549、C6/36和Huh-7等细胞为本实验室保存, 细胞培养于10%胎牛血清(fetal bovine serum, FBS)的DMEM (Dulbecco's modified eagle medium)或RPMI1640 (Roswell park memorial institute medium 1640)中。ZIKV亚洲株SZ-WIV01G (GenBank: KU963796, 简称SZ01)由武汉病毒研究所张波研究员惠赠。ZIKV非洲株MR766 (GenBank: LC002520)由厦门大学程通副教授惠赠。DENV-2 (dengue virus 2, GenBank: KM204118.1)由中国医学科学院医学生物研究所孙强明研究员惠赠。
主要试剂 培养基、磷酸盐缓冲盐水(phosphate buffered saline, PBS, Thermo Fisher公司); 低熔点琼脂糖、SDS (sodium dodecyl sulfate) (Amresco公司); 结晶紫(北京索莱宝公司); MTT [3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide] (Sigma公司); DMF (N, N-dimethyl formamine) (西陇化工股份有限公司); RNA提取试剂盒Roche high pure viral RNA kit (Roche公司); 一步法定量试剂盒RNA-directTM Real-time PCR Master Mix (TOYOBO公司); 引物及TaqMan探针(Takara公司); ZIKV E蛋白抗体(Sinobiological公司); GAPDH (glyceraldehyde-3-phosphate dehydrogenase)抗体(北京康为世纪公司)。
病毒扩增和测定 ZIKV感染C6/36白纹伊蚊细胞2~4 h, 感染复数为0.01。PBS洗涤除去游离ZIKV病毒颗粒, 细胞在80%融合度下使用含3% FBS的RPMI1640培养基培养5~7天。观察细胞发生明显病变时, 收集细胞上清液, 4 ℃、1 500×g离心10 min去除细胞碎片。病毒保存于-80 ℃备用。病毒滴度通过噬斑法测定, 计算噬斑形成单位/毫升(plaque forming unit per mL, PFU·mL-1)。
噬斑测定 实验方法参照[17], Vero细胞接种到12孔板上至95%~100%汇合, 用PBS洗涤细胞2次。ZIKV或DENV-2 (50 PFU)感染2 h, PBS洗涤细胞3次, 加入1 mL含有化合物的培养基(4% FBS DMEM)和1 mL琼脂糖并混合均匀。待其凝固完全后, 将培养板倒置于37 ℃孵育4天。加入4%多聚甲醛固定15 min, PBS洗涤3次, 然后加入0.8%结晶紫染色10 min, 再次洗涤并干燥。使用酶联荧光点分光计(Immunospot S6 Universal)进行图像采集, 并计数噬斑。基于斑块的数量绘制剂量效应曲线, 计算半数有效浓度(50% effective concentration, EC50)。
化合物毒性测定 将细胞接种在96孔板中并培养过夜, 加入不同浓度的化合物。在37 ℃培养箱中孵育72 h后, 加入20 μL 5 mg·mL-1 MTT, 37 ℃孵育4 h。随后, 加入100 μL的12% SDS-50% DMF溶液并在37 ℃孵育过夜。待结晶甲臜完全溶解后, 使用Elx800酶标仪测量吸光度(A)值, 波长为570 nm, 参比波长为630 nm, 计算半数致死浓度(50% cytotoxic concentration, CC50)。
实时荧光定量PCR 采用试剂盒Roche high pure viral RNA kit提取病毒上清中的RNA, Trizol法提取细胞内的RNA, 具体实验步骤遵循试剂盒说明书。利用实时荧光定量PCR (quantitative real-time polymerase chain reaction, qRT-PCR)检测感染后上清液中释放的子代ZIKV RNA。ZIKV SZ01 (500 PFU)在37 ℃下感染细胞2 h, PBS洗涤3次去除游离病毒, 然后加入不同浓度的化合物, 并使用DMSO和未感染的细胞分别作为阳性和阴性对照。感染72 h后, 收获细胞上清液, 使用Roche high pure viral RNA kit提取病毒RNA。使用一步法试剂盒RNA-directTM Real-time PCR Master Mix和TaqMan探针定量检测所产生的病毒RNA。
Western blot实验 Vero细胞接种在12孔板中并培养过夜。细胞与ZIKV MR766 (500 PFU)在37 ℃孵育2 h, 然后加入DMSO或不同浓度的环索奈德继续培养至48 h, 提取细胞内总的蛋白质。SDS-PAGE (polyacrylamide gel electrophoresis)分离总蛋白质, 转移到聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上, 并与ZIKV E抗体一起孵育。用化学发光底物呈现特异性信号, 并使用Tanon-5200 Multi Imaging System记录和定量抗体信号。
分时给药实验 Vero细胞接种在24孔板中并培养过夜。细胞与ZIKV SZ01 (multiplicity of infection, MOI = 1)在4 ℃孵育1 h, 4 ℃预冷的PBS洗涤2次以去除未结合的病毒。分别在感染后(0、1、2、4、6和12 h)加入环索奈德, 然后分别在4、6和12 h撤去化合物。阳性对照组加入等量的DMSO, 其余孔用新鲜培养基代替并保持至实验结束。感染24 h后, 收集细胞上清并提取RNA, 通过实时荧光定量PCR进行检测。
病毒结合 Vero细胞接种在12孔板中并培养过夜。在有或没有环索奈德的情况下, 将预冷的细胞与ZIKV SZ01 (MOI = 1)在4 ℃孵育1 h, EGCG为阳性药物对照。感染1 h后, PBS洗涤去游离病毒和残留化合物, 收集细胞用于随后的实时荧光定量PCR。
病毒内化 Vero细胞接种到12孔板上培养至95%~100%汇合, PBS洗涤2次。细胞与ZIKV SZ01 (300 PFU)在4 ℃孵育1 h。PBS洗涤细胞2次, 加入DMSO或环索奈德37 ℃孵育1 h。PBS洗涤细胞2次, 并用300 μL柠檬酸缓冲液(pH = 3.0)处理1 min。除去柠檬酸缓冲液, 立即用含琼脂的DMEM培养基覆盖细胞, 用于随后的噬斑测定。
数据分析 根据实验结果绘制剂量反应曲线, 按Reed & Muench法计算出化合物的EC50和CC50。实验数据和作图均使用GraphPad Prism8软件进行处理, 表示为x±s, 组间比较采用独立性t检验, P < 0.05被认为其差异具有统计学意义。
结果 1 环索奈德抑制ZIKV不同毒株的感染噬斑测定法测定环索奈德(图 1A)对ZIKV抑制活性。结果表明, 环索奈德能显著抑制ZIKV 2种毒株SZ01和MR766的感染并呈现量效关系(图 1B、C)。环索奈德对ZIKV SZ01的EC50值为(0.40 ± 0.22) μmol·L-1, 对ZIKV MR766的EC50值为(1.59 ± 1.08) μmol·L-1。环索奈德对Vero细胞的CC50为(64.70 ± 7.33) μmol·L-1 (图 1D)。通过CC50/EC50计算出环索奈德的治疗指数(therapeutic index, TI)分别为162和41。
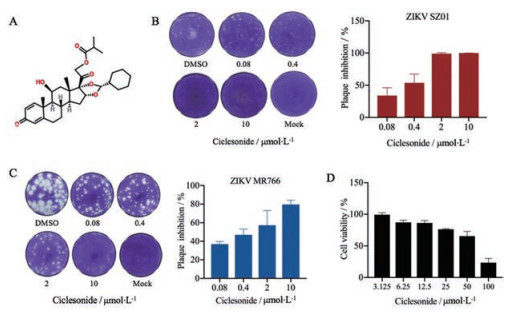
|
Figure 1 The inhibition of Zika virus (ZIKV) infection and cytotoxicity of ciclesonide. A: Structure of ciclesonide; B, C: The effect of ciclesonide on plaque formation induced by ZIKV SZ01 (B) and MR766 (C) in Vero cells by plaque assay; D: Cytotoxicity of ciclesonide in Vero cells by 3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide (MTT) assay. n = 3, x±s. DMSO group: Virus infected cells; Mock group: Non-infected cells |
为进一步确定环索奈德抗ZIKV活性, 首先通过实时荧光定量PCR检测了环索奈德处理后对ZIKV复制的影响。结果显示, 环索奈德以剂量依赖性方式抑制ZIKV复制(图 2A)。随后, 通过Western blot法检测了环索奈德对ZIKV E蛋白表达的影响。结果显示, 随着环索奈德浓度的增加, ZIKV E蛋白的表达逐渐被抑制(图 2B)。RNA水平和蛋白水平检测结果进一步表明环索奈德具有显著的抗ZIKV感染和复制作用。
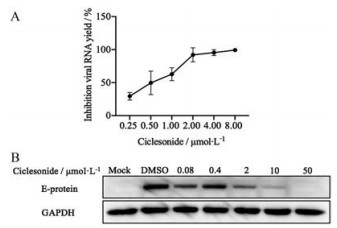
|
Figure 2 Ciclesonide inhibits ZIKV replication. A: The effect of ciclesonide on virus RNA yield of ZIKV SZ01 in Vero cells was quantified by quantitative real-time polymerase chain reaction (qRT-PCR); B: The effect of ciclesonide on protein E expression of ZIKV MR766 in Vero cells was evaluated by Western blot. n =3, x±s. GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
Vicenti等[18]研究表明, ZIKV可感染A549和Huh7细胞并有效复制。环索奈德在Vero细胞中具有较好的抗ZIKV活性, 为观察环索奈德在人源细胞中的抗病毒活性, 通过实时荧光定量PCR实验, 检测了环索奈德在Huh-7和A549细胞中的抗ZIKV活性。结果显示环索奈德在50 μmol·L-1时显著抑制A549细胞中的ZIKV复制(图 3A)。环索奈德(50 μmol·L-1)对A549细胞几乎没有毒性, 而对Huh-7细胞则有较高的毒性。
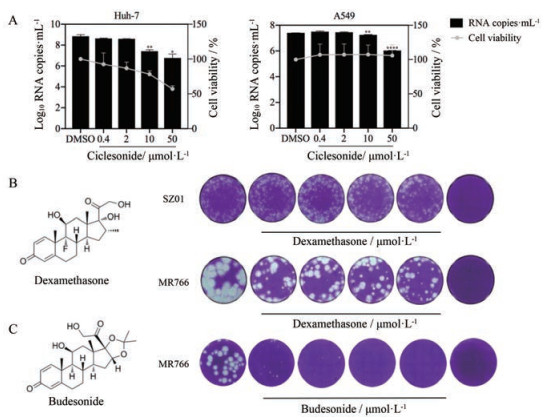
|
Figure 3 Ciclesonide inhibits ZIKV infection in different cell types. A: The effect of ciclesonide on the virus production of A549 and Huh-7 cells infected with ZIKV SZ01 was quantified by qRT-PCR; B, C: The effect of dexamethasone (B) or budesonide (C) on plaques induced by ZIKV SZ01 or MR766 in Vero cells was detected by plaque assay. n = 3, x±s. *P < 0.05, **P < 0.01, ****P < 0.0001 vs DMSO group |
环索奈德属于糖皮质激素, 针对其抗病毒作用是否是糖皮质激素所共有的性质, 作者通过噬斑法检测了同属于糖皮质激素且应用较广泛的地塞米松(dexamethasone)对ZIKV的抑制作用。结果显示, 地塞米松无论是对ZIKV SZ01还是MR766均未表现出明显的抗病毒活性(图 3B), 表明环索奈德可能不是通过激素途径发挥抗病毒作用的。另外, 还研究了环索奈德的结构类似物布地奈德(budesonide)对ZIKV MR766的抑制作用, 结果显示布地奈德以剂量依赖性抑制ZIKV MR766的复制(图 3C), 提示环索奈德和布地奈德可能存在着一定的构效关系。
4 环索奈德抑制ZIKV生命周期的RNA合成阶段在黄病毒感染复制的生命周期过程中, 0~2 h为结合进入阶段, 2~6 h为病毒翻译阶段, 6~12 h为RNA合成阶段, 12 h以后可以检测到子代病毒组装和释放[19, 20]。为确定可能受环索奈德影响的ZIKV生命周期阶段, 进行了分时给药实验(图 4A)。结果显示, 在ZIKV感染后6 h, 加入50 μmol·L-1环索奈德可显著抑制ZIKV的产生(图 4B), 表明环索奈德主要作用于病毒RNA合成阶段。
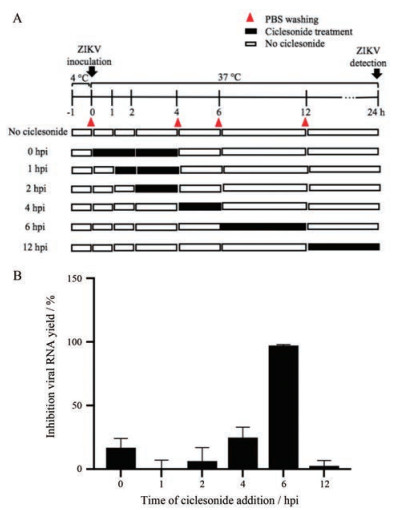
|
Figure 4 Ciclesonide mainly acts on the inhibition of the ZIKV SZ01 RNA synthesis stage. A: Schematic diagram of time of drug addition assay; B: The detection of the action stage of ciclesonide in Vero cells using time of drug addition assay was quantified by qRT-PCR. Each group was compared with DMSO. hpi: Hours post-infection |
为进一步阐明环索奈德是否影响病毒的结合和内化, 首先检测了环索奈德对病毒结合宿主细胞的影响。结果显示, 100 μmol·L-1 EGCG (已知的ZIKV结合抑制剂, 图 5A)和ZIKV共处理组与仅用ZIKV处理组之间观察到ZIKV RNA的显著差异, 这与文献报道一致[21]; 而50 μmol·L-1环索奈德和ZIKV共处理组与仅用ZIKV处理组之间未观察到ZIKV RNA的显著差异(图 5B)。这些结果表明环索奈德不影响ZIKV与宿主细胞的结合。
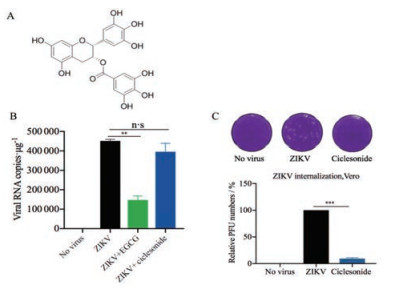
|
Figure 5 The effect of ciclesonide on viral binding and internalization. A: Structure of the epigallocatechin gallate (EGCG); B: The effect of ciclesonide on binding to the host cells (Vero cells) which infected with ZIKV SZ01 was quantified by qRT-PCR; C: The effect of ciclesonide on internalization of ZIKV SZ01 in Vero cells was detected by plaque assay. n = 3, x±s. n·s: The difference is not statistically significant; **P < 0.01, ***P < 0.001 |
已有研究表明氯喹可抑制ZIKV的内化[22], 参照此方法, 检测了环索奈德对病毒内化的影响。与仅感染ZIKV的细胞相比, 50 μmol·L-1环索奈德能够抑制约90%噬斑的形成(图 5C), 表明环索奈德能够抑制ZIKV的内化。
6 环索奈德抑制DENV-2的复制DENV和ZIKV同属于黄病毒属, 且其感染后症状有相似之处, 因此检测了环索奈德的抗DENV2活性。随着环索奈德浓度的升高, 噬斑的形成逐渐被抑制, 环索奈德对DENV2的EC50值为(1.52 ± 0.62) μmol·L-1, 表明环索奈德也能够抑制DENV2的复制(图 6)。

|
Figure 6 The effect of ciclesonide on the infection of dengue virus 2 (DENV2) in Vero cells was detected by plaque assay |
ZIKV感染是全球重大公共卫生问题。自2015年ZIKV在巴西大面积爆发后, 虽然已经筛选出了多种能够抑制ZIKV感染的活性小分子[23, 24], 但截至目前尚无有效的抗ZIKV药物和疫苗批准上市。为了有效地控制病毒的感染和传播, 研发强效且安全的抗ZIKV药物具有十分重要的现实意义。环索奈德是由德国Altana公司开发的一种泼尼松龙的衍生物, FDA已批准临床用于治疗哮喘、季节性变应性鼻炎和嗜酸性食管炎[25, 26]。至今未见环索奈德抗病毒活性的研究报道。
本文发现环索奈德具有抗ZIKV活性, 其对ZIKV亚洲株和非洲株的治疗指数分别为162和41。环索奈德不仅能够抑制ZIKV所诱导的噬斑的形成, 还能够通过减少病毒产生和ZIKV包膜蛋白的表达显著抑制ZIKV感染。另外, 环索奈德处理还可抑制不同细胞系中的ZIKV感染。目前, 已发现多种靶向病毒结合、内吞、灭活或针对ZIKV复制的小分子抑制剂, 如多酚提取物、抗菌肽、阿莫地喹等。本文初步研究了环索奈德抗ZIKV活性机制, 分时给药实验结果显示环索奈德主要抑制ZIKV RNA合成阶段。通过进一步研究发现, 环索奈德不影响ZIKV结合而影响内化, 但其详细机制仍有待进一步研究。此外, 耐药性是抗ZIKV药物研发需要特别关注的问题[27], 环索奈德抗ZIKV耐药突变株活性有待于验证。
孕妇感染ZIKV可导致胎儿严重的小头畸形, 因此阻止ZIKV垂直传播是感染孕妇治疗的主要目标。未怀孕的个体, 例如具有高并发症风险的个体, 也可能会受益于抗ZIKV药物。与其他已知的蚊媒病毒不同, ZIKV还可通过垂直传播和性途径传播[28]。值得关注的是, 尽管ZIKV可能通过血液途径垂直传播, 但与被感染的男性进行性行为后上升的感染也可能会将病毒转移至发育中的胎儿。因此, 研发可用于非妊娠人群的药物是防止ZIKV对公众健康造成危害的重要组成部分。环索奈德是一种广泛使用的抗哮喘药物, 其临床安全性已知, 因此它有可能用于治疗非孕妇个体中的其他感染。构建动物模型开展体内实验来评估环索奈德对ZIKV引起的先天性感染和胎儿死亡的保护效果很有必要。作者之前曾对环索奈德的体内实验进行过初步研究, 也成功建立了小鼠模型, 但由于环索奈德临床试验给药方式大都以气雾喷入给药, 给药方式执行难度较大。另外, 环索奈德水溶性较差, 口服生物利用度极低(仅有1%), 静脉给药未能找到低毒且能溶解完全的溶剂, 腹腔给药的抗病毒体内药效结果不理想。
综上所述, 环索奈德在细胞水平上具有显著抗ZIKV活性, 机制初步研究表明环索奈德靶向病毒RNA合成阶段和病毒内化。本研究为深入研究环索奈德的精确靶点、构效关系以及研发有效的ZIKV防治药物奠定了基础。
作者贡献:姚债文和汪芳负责实验方案实施及实验数据采集整理; 陈秀秀和郑昌博负责指导实验操作; 杨柳萌负责材料支持; 熊思东和郑永唐负责实验设计和指导, 以及研究经费支持。
利益冲突:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
| [1] |
Pierson TC, Diamond MS. The emergence of Zika virus and its new clinical syndromes[J]. Nature, 2018, 560: 573-581. DOI:10.1038/s41586-018-0446-y |
| [2] |
Lazear HM, Diamond MS. Zika virus:new clinical syndromes and its emergence in the Western Hemisphere[J]. J Virol, 2016, 90: 4864-4875. DOI:10.1128/JVI.00252-16 |
| [3] |
Joob B, Wiwanitkit V. Comment on article:"Zika, afebrile disease?"[J]. Rev Med Inst Mex Seguro Soc, 2019, 56: 516. |
| [4] |
Chang DF, Wang X, He C, et al. Advances in study of Zika virus[J]. Prog Microbiol Immunol (微生物学免疫学进展), 2019, 47: 59-64. |
| [5] |
Oehler E, Watrin L, Larre P, et al. Zika virus infection complicated by Guillain-Barré syndrome-case report, French Polynesia, December 2013[J]. Euro Surveill, 2014, 19: 20720. |
| [6] |
Cao-Lormeau VM, Blake A, Mons S, et al. Guillain-Barré syndrome outbreak associated with Zika virus infection in French Polynesia:a case-control study[J]. Lancet, 2016, 387: 1531-1539. DOI:10.1016/S0140-6736(16)00562-6 |
| [7] |
Rivera-Correa J, de Siqueira IC, Mota S, et al. Anti-ganglioside antibodies in patients with Zika virus infection-associated Guillain-Barré syndrome in Brazil[J]. PLoS Negl Trop Dis, 2019, 13: e0007695. DOI:10.1371/journal.pntd.0007695 |
| [8] |
Garcez PP, Loiola EC, Madeiro da Costa R, et al. Zika virus impairs growth in human neurospheres and brain organoids[J]. Science, 2016, 352: 816-818. DOI:10.1126/science.aaf6116 |
| [9] |
Zhou R, Shi X, Tian DF, et al. Establishment and application of a high-throughput screening model for Zika virus inhibitors[J]. Chin Med Biotechnol (中国医药生物技术), 2019, 14: 14-20. |
| [10] |
Agrelli A, de Moura RR, Crovella S, et al. Mutational landscape of Zika virus strains worldwide and its structural impact on proteins[J]. Gene, 2019, 708: 57-62. DOI:10.1016/j.gene.2019.05.039 |
| [11] |
Abrams RPM, Solis J, Nath A. Therapeutic approaches for Zika virus infection of the nervous system[J]. Neurotherapeutics, 2017, 14: 1027-1048. DOI:10.1007/s13311-017-0575-2 |
| [12] |
Chen XX, Luo RH, Zheng CB, et al. The anti-ZIKV activity of tenofovir disoproxil fumarate in vitro[J]. Acta Pharm Sin (药学学报), 2019, 54: 1582-1587. |
| [13] |
Li Z, Jia RF, Zhan P, et al. Progress on the discovery and development of anti-Zika virus agents[J]. Acta Pharm Sin (药学学报), 2020, 55: 627-639. |
| [14] |
Fernandez-Garcia MD, Mazzon M, Jacobs M, et al. Pathogenesis of flavivirus infections:using and abusing the host cell[J]. Cell Host Microbe, 2009, 5: 318-328. DOI:10.1016/j.chom.2009.04.001 |
| [15] |
Cortese M, Goellner S, Acosta EG, et al. Ultrastructural characterization of Zika virus replication factories[J]. Cell Rep, 2017, 18: 2113-2123. DOI:10.1016/j.celrep.2017.02.014 |
| [16] |
Liddell BS, Oberlin JM, Hsu DP. Inhaled corticosteroid related adrenal suppression detected by poor growth and reversed with ciclesonide[J]. J Asthma, 2017, 54: 99-104. DOI:10.1080/02770903.2016.1196370 |
| [17] |
Liu HM. Screeing and Mechanisms Investigation of Inhibitors against Zika Virus (抗寨卡病毒药物筛选及作用机制的研究)[D]. Guangzhou: Southern Medical University, 2019.
|
| [18] |
Vicenti I, Boccuto A, Giannini A, et al. Comparative analysis of different cell systems for Zika virus (ZIKV) propagation and evaluation of anti-ZIKV compounds in vitro[J]. Virus Res, 2018, 244: 64-70. DOI:10.1016/j.virusres.2017.11.003 |
| [19] |
Sreekanth GP, Panaampon J, Suttitheptumrong A, et al. Drug repurposing of N-acetyl cysteine as antiviral against dengue virus infection[J]. Antiviral Res, 2019, 166: 42-55. DOI:10.1016/j.antiviral.2019.03.011 |
| [20] |
Chan JF, Chik KK, Yuan S, et al. Novel antiviral activity and mechanism of bromocriptine as a Zika virus NS2B-NS3 protease inhibitor[J]. Antiviral Res, 2017, 141: 29-37. DOI:10.1016/j.antiviral.2017.02.002 |
| [21] |
Clain E, Haddad JG, Koishi AC, et al. The polyphenol-rich extract from psiloxylon mauritianum, an endemic medicinal plant from reunion island, inhibits the rarly stages of dengue and Zika virus infection[J]. Int J Mol Sci, 2019, 20: 1860. DOI:10.3390/ijms20081860 |
| [22] |
Li C, Zhu X, Ji X, et al. Chloroquine, a FDA-approved drug, prevents Zika virus infection and its associated congenital microcephaly in mice[J]. EBioMedicine, 2017, 24: 189-194. DOI:10.1016/j.ebiom.2017.09.034 |
| [23] |
Li YZ, Qi SJ, Xu YH, et al. Virtual screening, design, synthesis and biological activity of Zika virus inhibitors[J]. Chin J Org Chem (有机化学), 2019, 39: 786-792. DOI:10.6023/cjoc201807053 |
| [24] |
Xu M, Lee EM, Wen Z, et al. Identification of small-molecule inhibitors of Zika virus infection and induced neural cell death via a drug repurposing screen[J]. Nat Med, 2016, 22: 1101-1107. DOI:10.1038/nm.4184 |
| [25] |
Chopra D, Bhandari B, Wardhan N. Ciclesonide-a novel corticosteroid for the management of asthma[J]. Curr Clin Pharmacol, 2012, 7: 73-77. DOI:10.2174/157488412800228901 |
| [26] |
Jacobs RL. Ciclesonide for the treatment of seasonal allergic rhinitis[J]. Expert Rev Clin Immunol, 2011, 7: 735-741. DOI:10.1586/eci.11.70 |
| [27] |
Lin G. Construction of Zika Virus Mutant Strain and Preliminary Screening of Attenuated Strain (寨卡病毒突变株的构建和减毒株的初步筛选)[D]. Beijing: Peking Union Medical College, 2019.
|
| [28] |
Nicastri E, Castilletti C, Liuzzi G, et al. Persistent detection of Zika virus RNA in semen for six months after symptom onset in a traveller returning from Haiti to Italy, February 2016[J]. Euro Surveill, 2016, 21: 30314. |
 2020, Vol. 55
2020, Vol. 55


