2. 中国药科大学中药学院, 江苏 南京 211198
2. School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 211198, China
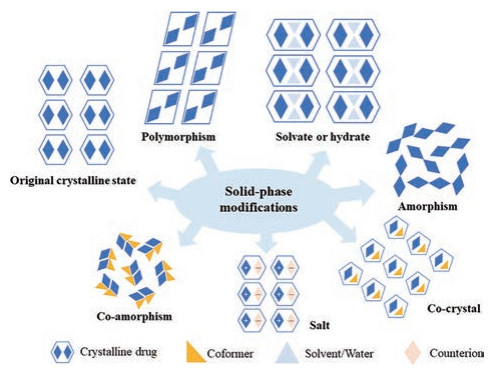
由于具有良好的物理稳定性和可加工性, 市场上大多数活性药物成分以固体形式存在, 它们可以是无定形状态, 也可以是结晶状态。无定形态药物呈现短程有序、长程无序的分子排列, 而晶态药物则具有周期性和长程有序的结构特征。根据晶态药物中分子构象、分子排列方式及组分种类等的不同, 可将其进一步划分为多晶型、溶剂化物、盐型、共晶及共无定形等固体形态(图 1)[1, 2]。其中, 具有相同化学组成但分子构象或排列不同的晶体称为多晶型, 更广义的“多晶型”还包括无定形和溶剂化物[3]。溶剂化物也被称为假多晶型, 除药物分子外, 溶剂分子以化学计量比或非化学计量比的方式存在于晶格中, 当溶剂分子为水时, 则称为水合物[4]。若用常温条件下非挥发性成分代替溶剂化物中的溶剂分子, 则可形成共晶[5, 6]。当药物分子和另一组分产生明显的电荷转移, 则形成盐型[7]。药物不同固体形态由于晶体结构的差异可具有显著不同的物理化学性质, 如光谱性质(基团振动、电子跃迁)、热力学性质(熔点、自由能、化学势能)和药学性质(溶解度、溶出速率、吸湿性、机械性质)等[8, 9]。药品的工艺、生产、储存和质量评估等环节与药物药学性质密切相关。例如溶解度和溶出速率等影响药物的释放及吸收; 吸湿性会影响粉末流动性和易水解药物的化学稳定性; 药物及辅料的机械性质对处方工艺中混合、制粒和压片等步骤均有影响。
|
Figure 1 The common solid-state strategies and their components |
药物晶体工程学技术的研究方向之一即是在不改变药物分子结构的前提下, 通过晶体结构改造优化药物的药学性质[10]。不同于药物化学中的基团修饰, 晶体学方法对药物分子结构影响较小, 只改变其内在晶格排列方式或空间结构, 因此可以在改善药学性质的同时保留原有的药效活性。早在20世纪50年代, 成盐技术便被用于提高难溶性酸性或碱性药物的水溶性[11, 12]。相对于其他固态形态, 溶剂化物晶格中含有一定量的溶剂分子, 如甲醇、丙酮、乙酸乙酯等[13-15], 存在潜在的安全性隐患; 且在温度、湿度和压力等外界条件下溶剂化物易失去溶剂分子, 表现出较差的物理稳定性, 这限制了其在改善药物药学性质缺陷方面的应用[16, 17]。近年来, 多晶型、无定形、共无定形及共晶等也已逐渐被应用于药剂学领域, 以期改善药物药学性质缺陷。本文从多晶型、无定形/共无定形和共晶等方面综述了晶体工程学技术在改善药物溶解/溶出度、吸湿性及机械性质方面的应用, 为晶体学手段改善药物相关药学性质的应用提供参考和借鉴。
1 多晶型对药物药学性质的影响 1.1 多晶型对药物溶解/溶出度的影响多晶型是具有相同分子结构的物质以不同晶体结构存在的形态, 主要体现在分子堆积或分子构象等方面存在差异。这种内部结构的差异会导致不同晶型间表面化学性质不同, 从而引起溶解度及溶出速率的差异。非洛地平存在4种晶型(晶型Ⅰ、晶型Ⅱ、晶型Ⅲ和晶型Ⅳ), 不同晶型间溶解度和特性溶出速率与其主要晶面暴露基团的极性密切相关。非洛地平多晶型的主要晶面极性基团的占比大小顺序为晶型Ⅱ (~53%) > 晶型Ⅰ (~46%) =晶型Ⅳ (~46%) > 晶型Ⅲ (~44%), 这导致晶型Ⅱ的溶解度与特性溶出速率最优[18]。此外, 多晶型溶解性还与晶格能差异有关。通常, 晶格能高的晶型为热力学稳定态, 具有较差的溶解性。氢氯噻嗪晶型Ⅰ与晶型ⅠA属于构象多晶型。前者晶格能为-125.73 kcal·mol-1, 为稳定晶型; 后者晶格能为-123.49 kcal·mol-1, 为亚稳晶型。晶格能差异导致前者溶解焓大于后者溶解焓(11.362 kJ·mol-1 vs 7.746 kJ·mol-1), 从而表现出较差的溶解性[19]。亚稳晶型受外界因素(湿度、压力、温度等)影响, 往往可转变为稳定晶型, 从而导致药物溶解性降低, 进一步造成药物制剂体内吸收差异而影响疗效, 如HIV蛋白酶抑制剂利托那韦胶囊, 在1998年出现了溶出度不合格的现象, 最终导致该产品撤市。研究发现, 在储存过程中原利托那韦(晶型Ⅰ)会向热力学更稳定的新晶型(晶型Ⅱ)转变, 导致溶解溶出度降低[20]。为了避免药物在制剂、储存过程中发生晶型转变, 往往倾向于选择热力学最稳定的晶型进行产品开发。然而, 对于BCS II类药物, 也会选择亚稳晶型以改善溶解度及提高生物利用度, 如卡马西平存在3种多晶型(晶型Ⅰ、晶型Ⅱ和晶型Ⅲ)和1种二水合物。不同晶型间的溶解度与溶出速率大小顺序为:晶型Ⅲ > 晶型Ⅰ > 晶型Ⅱ > 二水合物。卡马西平水合物为最稳定晶型, 且晶型Ⅲ的高吸湿性导致其极易发生晶型转变形成二水合物而丧失其溶解溶出优势。综合考虑溶解性与稳定性之间的关系, 《美国药典》将晶型Ⅰ (亚稳晶型)收录为标准晶型[21]。
1.2 多晶型对药物吸湿性的影响药物多晶型之间分子构象、堆积方式及分子间相互作用等内部因素的差异会影响其吸湿性, 如甲磺酸阿帕替尼两种晶型吸湿性存在显著差异。晶型Ⅰ在0~30%相对湿度(relativehumidity, RH)范围内吸湿增重约3.59%, 而晶型Ⅱ在0~75% RH范围内没有发生明显的吸湿增重, 在75%~80% RH范围内吸收增重可达3.53%, 这是由于两种晶型中分子堆积方式不同, 导致晶型Ⅱ具有更高的密度和堆积系数, 不利于水分子的渗透[22]。但是, 大部分药物多晶型之间晶格排列和氢键构象等因素的可变化程度有限, 因此单纯地通过改变晶型来调控药物吸湿性的几率和程度是相对有限的, 结构较相似的多晶型之间吸湿性的差异并不大, 如石杉碱甲A晶型Ⅰ与晶型Ⅱ具有相似的晶体结构, 二者在动态蒸汽吸附实验中表现出相似的吸湿行为[23]。
1.3 多晶型对药物机械性质的影响药物晶体的机械性质对片剂开发过程有着深远的影响, 尤其是高剂量药物, 其片剂性能严重依赖药物晶体本身的机械性质。粉体颗粒在压片过程中会经历粒子重排、滑移和粒子形变等一系列变化。粒子变形机制包括弹性形变(可逆形变)与塑性形变(不可逆形变), 这些形变有利于增加粒子间的结合面积(bonding area, BA), 当压力卸载时(压力达到最大值)粒子间的结合面积达到最大值。对于弹性材料而言, 当压力卸载后, 粒子发生弹性恢复并回到压缩前的状态, 此时粒子间的结合面积降低至最小值, 粒子不足形成完整、致密的片子, 表现出较差的可压片性; 对于塑性材料而言, 当压力卸载后, 粒子间可保留较大的结合面积, 粒子可形成完整、致密的片子。因此, 塑性形变更有利于形成具有一定强度的片子[24-27]。晶体粒子的塑性形变与其晶格堆积特征有关, 如滑移、错位移动、孪晶、扭结和晶格稳定性扰乱等, 其中沿着特定的滑移面产生相对移动是晶体塑性的重要原因[28]。晶体塑性可通过粉体的可压缩性来定量评估, 通常塑性越高, 粉体在相同压力下压制成片剂的孔隙率越低, 可压缩性越好[29]。
多晶型中晶体结构及分子堆积方式的不同导致了不同晶型间分子相互作用强弱、晶面间距和晶面附着能等参数的差异, 从而表现出不同的滑移面与机械性质。结合能量计算和可视化模型分析等表征手段可以辅助分析多晶型间机械性质存在差异的内在机制。如通过分析氟芬那酸晶型Ⅲ与晶型Ⅰ的晶体结构可知, 晶型Ⅲ主要晶面的晶面间距大于晶型Ⅰ, 这导致晶型Ⅲ主要晶面间更易滑动, 从而表现出更优的可压缩性[30]。经能量框架和分子间相互作用构象分析表明, N-(3-乙炔基苯基)-3-氟苯甲酰胺晶型Ⅰ和晶型Ⅲ结构中N-H…O氢键作用力和π…π堆积色散力的强度显著高于晶型Ⅱ, 且分子堆积更为致密, 阻碍了平面层状结构产生相对滑动, 因此, 晶型Ⅱ具有更优的塑性及可压片性[31]。类似的情况也出现在吲哚美辛(晶型α、晶型γ)和非布索坦(晶型Q、晶型H1)中, 其中塑性较高的晶型α和晶型Q结构中存在容易产生相对移动的平行柱状堆积结构, 而且平面层间的相互作用强度较弱[28]。
2 无定形/共无定形对药物理化性质的影响 2.1 无定形/共无定形对溶解/溶出度的影响无定形态的表观溶解度与溶出速率通常显著高于相应的晶态, 这是由于: ①与晶态相比, 无定形态过高的自由能降低了药物溶解时分子流动性升高所需增加的能量[18]; ②无定形态缺失三维长程有序结构, 通常有较大的自由体积, 这可增加药物分子与溶剂分子的接触面积[32]; ③无定形态的分子间相互作用力也相应减弱, 表现出更高的分子流动性和更活跃的热力学性质[33, 34]。无定形的“增溶效应”可能是有时限的, 呈现在溶出曲线上是一种溶液浓度先升高后降低的趋势。这是由于无定形较高的表观溶解度可产生溶液过饱和现象, 为相应晶态的成核与晶体生长提供了必要的热力学驱动力[35]。因此, 溶液浓度降低的快慢与晶态结晶速率相关, 如吲哚美辛无定形的表观溶解度在10 min达到25 μg·mL-1, 而在50 min时降至10 μg·mL-1, 到120 min时无定形的溶解度与γ晶型的溶解度接近, 约为5 μg·mL-1 [36]。类似的现象也出现在阿托伐他汀钙无定形[37]和伊曲康唑无定形中[38]。
从体内吸收的角度考虑, 延长无定形这种短暂的“增溶效应”并维持长时间的过饱和态将更有利于提高药物的生物利用度, 可通过固体分散体技术抑制无定形在溶出时的重结晶现象。固体分散体中药物分子呈无定形态与聚合物载体实现分子水平的混合。在溶出过程中, 聚合物载体可通过增加介质黏度, 降低药物分子流动性, 达到抑制无定形药物在溶出过程中重结晶的现象。然而固体分散体中无定形态药物处于热力学不稳定态, 容易在储存过程中向其热力学稳定的晶态药物转变, 且其载体多为吸湿性聚合物, 这将会加速无定形态药物的转晶。另外, 固体分散体中聚合物的占比较高, 这使其不适用于高剂量药物[39, 40]。此外, 与合适的小分子配体形成共无定形是维持药物高过饱和态的有效方法。与固体分散体不同的是, 共无定形中药物与配体分子间的摩尔比通常为1:1、1:2和2:1等, 这使其适用于高剂量药物, 且药物与配体分子间的氢键、π-π堆积等非共价相互作用能提高共无定形物理稳定性[39]。作者所在课题组首次发现盐酸鲁拉西酮无定形在溶出过程中可形成粘弹性凝胶, 导致药物溶出低于盐酸鲁拉西酮晶态, 丧失了无定形态应有的溶出优势。而将盐酸鲁拉西酮与半胱氨酸制备成共无定形后, 难溶性盐酸鲁拉西酮的表观溶解度提升至晶态的50倍, 且这种过饱和状态可以维持至少72 h。经液态核磁表征和荧光淬灭实验证实盐酸鲁拉西酮和半胱氨酸在溶出介质中可形成1:1的可溶性络合物, 而且在盐酸鲁拉西酮苯并异噻唑环上的N2原子与半胱氨酸的NH3+基团之间可能发生了电子转移, 这种分子间的强相互作用是维持盐酸鲁拉西酮高过饱和态的重要原因[41]。由此可见, 实现药物和配体在溶液中有效的分子间相互作用可能是维持无定形过饱和态的途径之一。此外, 共无定形溶解度/溶出速率与配体溶解性密切相关, 高溶解性配体往往更能提高药物溶解度/溶出速率[39, 42]。为提高萘普生-色氨酸及萘普生-精氨酸二元共无定形体系的溶出速率, Jensen等[43]选择高水溶性氨基酸-脯氨酸为配体, 经球磨法制备得到摩尔比为1:1:1的三元共无定形体系(萘普生-色氨酸-脯氨酸以及萘普生-精氨酸-脯氨酸共无定形), 大大提高了萘普生的溶出速率。
2.2 无定形/共无定形对药物吸湿性的影响表面性质(表面自由能、表面极性基团分布)是影响固体吸湿性的重要因素[44]。相较于晶态物质, 无定形态表面的暴露基团具有更高的自由度, 且分子排列的取向具有随机性, 表现出较高的表面自由能, 从而导致其吸湿性高于晶态物质。塞来昔布晶态的总表面自由能低于其无定形态(42.6 mJ·m2 vs 50 mJ·m2), 这是由于无定形态具有较高的极性表面自由能, 极性表面自由能的增加促进无定形态与水分子发生相互作用, 进而表现出更高的吸湿性[45]。水分子可通过氢键、范德华力、离子-偶极等与无定形表面基团发生相互作用, 故无定形表面极性基团分布会影响其吸湿性。Bianco等[44]通过喷雾干燥法制备得到了不同比例磺胺噻唑和磺胺噻唑钠混合物的无定形物, 且磺胺噻唑钠的占比会显著影响无定形物表面基团的极性指数(与表面极性基团占比有关), 从而影响无定形物的吸湿性。
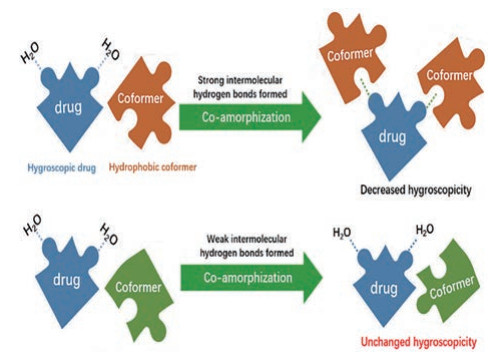
无定形吸湿后, 一方面可能会引起固态药物表面结构的变化。如无定形乳糖仅在低于20% RH的湿度下, 吸附水分后表面自由能的变化是可逆的, 而在更高的湿度下, 吸附水分后表面自由能的变化是不可逆的, 这表明此时无定形乳糖表面结构发生变化(无定形未转晶)[46]; 另一方面, 无定形易受水分子塑化作用, 导致其玻璃化转变温度(glass transition temperature, Tg)降低, 分子流动性增加从而引起转晶现象, 如氯雷他定无定形在高湿条件下(25 ℃/60% RH)放置7天后开始转晶, 表现出较差的物理稳定性[47]。为避免无定形吸湿后引起的转晶现象, 通常选择共无定形技术提高其物理稳定性, 其机制为: ①由于药物分子与配体分子间存在非共价相互作用, 共无定形Tg往往高于单独药物无定形Tg, 从而表现出较高的物理稳定性, 如氯雷他定无定形Tg为41.84 ℃, 而氯雷他定-柠檬酸共无定形Tg为58.73 ℃, 共无定形在25 ℃/60% RH条件下的物理稳定性优于氯雷他定无定形[47]; ②形成共无定形后, 原本强吸湿药物结构中可与水分子产生氢键的基团一部分与配体分子形成氢键, 固体表面与水分子产生氢键的基团数量减少, 从而吸湿性得到改善。反之, 若药物分子与配体分子间无氢键相互作用, 则共无定形对药物吸湿性影响不大(图 2), 如伊曲康唑-克霉唑共无定形、氯雷他嗪-酮康唑共无定形中, 药物与小分子配体间不存在氢键相互作用, 这两种共无定形体系的吸湿性基本与其单独无定形的吸湿性一致[48]。分子间相互作用的建立需要给予固态混合体系一定的能量以突破能态壁垒, 通常采用机械研磨、液态辅助研磨和有机溶剂溶解等方式[49]; ③小分子配体与药物间相互作用越强, 共无定形的物理稳定性往往越高, 但分子间相互作用并不是共无定形较高物理稳定性的必要条件, 如瑞格列奈-他达拉非共无定形在加速条件(40 ℃/75% RH)下的物理稳定性优于瑞格列奈无定形, 但瑞格列奈-他达拉非共无定形体系中并不存在分子间相互作用[50]。
|
Figure 2 Schematic diagram of the decreased hygroscopicity by co-amorphization |
由于无定形不具有长程有序的周期性晶格排列, 无法通过晶体结构变化分析粉体的机械性质, 通常可采用结合面积(bonding area, BA)-结合强度(bonding strength, BS)模型进行分析。在BA-BS模型中, 片剂抗张强度是相邻颗粒间BA与BS相互作用的综合结果, 在外界其他条件不变的情况下, 较硬的材料在压力下不易变形而产生较小的BA, 然而较硬的材料往往具有更高的BS; 相比之下, 较软的材料更容易发生形变产生较高的BA, 但产生的BS往往较小[27]。有效地评估材料的BA与BS, 对于从机制上分析粉体之间不同的压片行为以及确定可压片性不佳的原因具有重要的意义。颗粒间结合强度是分子水平作用力的宏观体现, 如分子型固体中的范德华力和氢键; 离子型固体中的库仑力、离子键、离子-偶极子和离子-诱导偶极等。分子间力的大小呈现距离依赖性, 并随分子间距离的增加而迅速减小(vdW∝r-6), 当两个相邻表面之间的距离超过几纳米时, 范德华力便可忽略不计, 因此, 松散的药物粉末往往具有较差的机械强度是由于相邻颗粒间距为纳米级别, 而片剂具有较高的机械强度是由于受外界压力后颗粒表面分子间距显著降低[25]。Adeleye等[51]研究发现曲马多片剂的硬度随压力的增加而增加, 这是由于更高的压力导致粒子间紧密接触, 粒子间BS增加。
同种物质无定形态和晶态固体的机械性质存在明显差异, 如葡萄糖晶体经过高温脱水后增加了颗粒中无定形区域, 从而具有更优越的可压片性, 这种差异主要是源于无定形葡萄糖颗粒更容易在机械压力下发生变形, 从而产生更高的结合面积[52]。此外, 无定形与相应晶态材料的颗粒间作用力强弱、颗粒形貌和颗粒粒径分布等不同, 也会导致两种固体形态机械性质的差异, 如晶态螺旋藻素衍生物颗粒间与分子间的相互作用强于其无定形态。因此, 相同压力下, 晶态螺旋藻素衍生物片剂具有更高的孔隙率[53]。
在分析无定形药物的可压片性时应注意机械压力下无定形的转晶现象, 如吲哚美辛无定形片剂在100 MPa的机械压力下会立即转晶, 而且转晶的程度随压力增加而增大。由于侧壁位置容易产生摩擦, 因此药片侧壁处的结晶度明显大于片芯[54]。这种压力介导的无定形转晶现象也为评价无定形药物的机械性质带来一定难度, 有时可使用硬脂酸镁充分润滑中模内壁减少摩擦或无定形颗粒表面涂布特殊材料的方法抑制压力下转晶[55]。
3 共晶对药物理化性质的影响 3.1 共晶对药物溶解/溶出度的影响相对于无定形与共无定形, 共晶因具有较好的物理稳定性而被广泛应用于改善难溶性药物溶解度与溶出速率。晶体药物的溶解度与其晶格能及溶质-溶剂分子间相互作用密切相关。晶格能影响溶解热力学能态变化, 而溶质-溶剂分子间相互作用取决于药物分子在溶剂中的溶剂化能。共晶通过降低药物晶格能与增加药物溶剂化能两个方面达到改善难溶性药物溶解性的目的[56, 57]。
此外, 共晶溶解性与配体分子密切相关, 体现在配体分子溶解性以及药物与配体分子在溶剂中的相互作用两个方面, 如以烟酰胺、水杨酸和糖精等水溶性小分子为配体制备卡马西平共晶体系并对其在水中及有机溶剂中的溶解性进行考察。结果表明, 不同配体分子形成的共晶水溶性不同, 为卡马西平原料药的2~152倍; 而在有机溶剂中各配体溶解度与卡马西平溶解度差异不大, 共晶在有机溶剂中的溶解度仅为卡马西平原料药的0.1~4.4倍[56]。另外, “Spring and parachute”模型常用来解释共晶的过饱和粉末溶出行为。药物和配体的分子间往往通过氢键形成共晶。在溶出过程中, 这种弱相互作用在共晶与溶出介质接触的短时间内发生解离, 随后高水溶性的配体分子优先溶解于介质中, 导致共晶晶体结构破坏, 药物分子形成由随机取向分子构成的团簇状态。这种分子团簇是一种类似于“无定形”的高能状态, 表现在溶出曲线上为产生较高的表观溶解度, 即“spring up”效应; 高于晶体热力学平衡溶解度的过饱和状态为已溶解药物发生重结晶提供了驱动力, 在没有有效抑制成核的情况下, 药物会发生快速转晶, 表现在溶出曲线上是过饱和曲线快速回落至热力学稳态, 即“spring down”效应(图 3); 在药物重结晶过程中, 药物固体可能以一种亚稳态多晶型的形式存在, 并根据Ostwald定律逐渐转变为热力学稳定状态; 这种亚稳态到稳定态的相转变通常需要足够长的时间, 使得药物在一段时间内保持逐渐下降的过饱和度, 称为“parachute”现象(图 3)[58, 59]。塞来昔布-烟酰胺共晶在37 ℃、0.01 mol·L-1 HCl的溶出过程中首先形成塞来昔布亚稳晶型(晶型Ⅰ), 随后亚稳晶型转变为稳定晶型(晶型Ⅲ)[60]。作者所在课题组根据荧光淬灭法和相-溶解度实验证实了布洛芬-烟酰胺共晶在溶出过程中, 布洛芬分子与烟酰胺分子在介质中存在络合作用, 形成Ap型络合物, 使得布洛芬-烟酰胺共晶在实现“spring up”之后可维持长时间的过饱和状态而不发生“spring down”或“parachute”现象。因此, 将其称为“spring and hover”模型(图 3)[61]。

|
Figure 3 The spring and parachute or hover concept |
吸湿性与材料表面的基团分布密切相关。形成共晶后, 药物晶格结构中引入了配体分子, 在改变分子排列和晶格结构的同时, 相应的表面性质也会产生变化。通过对共晶进行表面性质分析可阐明其改善药物吸湿性的机制。对于易吸湿的药物, 可以选择合适的疏水性配体与其形成共晶, 通过与极性基团形成相互作用, 竞争性地阻碍易吸湿药物与水分子产生氢键结合, 如左氧氟沙星与异丙氨基酚形成共晶后可改善左氧氟沙星的吸湿性。在共晶中, 异丙氨基酚的羟基与左氧氟沙星的N原子通过O-H…N氢键连接, 这种氢键可以减少易吸湿左氧氟沙星与水分子的接触, 从而改善其吸湿性[62], 又如分别以没食子酸(gallic acid, ga)和3, 4-二羟基苯甲酸(3, 4-dihydroxybenzoic acid, pa)为配体制备奥拉西坦(oxiracetam, OX)共晶, 并考察配体对共晶吸湿性的影响。结果表明, OX-pa共晶的吸湿性高于OX-ga共晶, 这与OX配体分子氢键连接方式相关[63]。
共晶组分中的疏水分子形成的框架结构可以对易吸湿分子形成包裹作用, 进而改善药物的吸湿性, 如二甲双胍(metformin, MET)具有极强的吸湿性, 临界相对湿度为60%, 当湿度高于60%时, MET因吸收大量水分而发生潮解。将MET与格列齐特(gliclazide, GLI)制备成共晶后, 当湿度为80%时, 共晶吸湿增重仅为3.3%。晶体结构分析表明, MET-GLI共晶中MET分子排列于GLI分子形成的通道中。晶面分析表明, 共晶主要晶面上分布着疏水的GLI分子。因此, GLI分子形成的疏水框架可以降低水分子与MET的接触几率, 从而改善MET的吸湿性[64]。
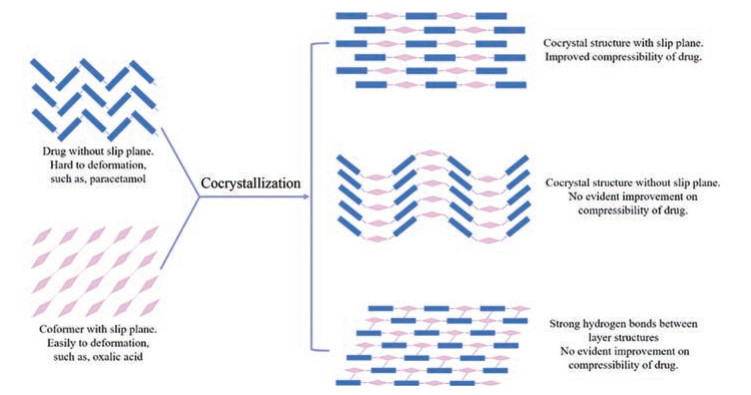
3.3 共晶对药物机械性质的影响晶体结构变化是影响机械性质的内在原因, 氢键连接、晶格堆积、色散力相互作用和滑移面等不同造成了不同材料间机械性质的差异[65, 66]。共晶是一种改善粉体机械性质的有效方式, 合理筛选配体分子和制备方法可通过改变分子间相互作用及晶体拓扑结构(作用力强度和空间分布)达到改善药物机械性质的目的[67]。从晶体结构的角度分析, 容易产生相对滑动的晶格堆积和分子排列方式可能会增加材料的塑性(如平面层状结构或堆叠柱状结构导致的滑移面)[68, 69]。选择晶体结构中有明显滑移面的组分制备成共晶可能是改善药物可压缩性的有效方法, 但也存在一定偶然性, 如扑热息痛晶型Ⅰ的结构中无滑移面存在, 分子间由氢键连接并保持曲折的形状, 因此其可压缩性较差。草酸分子通过氢键连接形成平行的层状结构, 具有优越的可压缩性。将扑热息痛和草酸制备成共晶后, 扑热息痛分子与相邻的4个草酸分子通过氢键相连, 在共晶晶格中排列成扁平的层状结构, 改善了扑热息痛的可压缩性[26]。然而, 并非所有的共晶组合均可以改善可压缩性, 如果形成的共晶结构中无滑移面存在, 药物的可压缩性可能没有改善(图 4)。此外, 层状结构间的作用力强弱也会影响材料的机械强度, 如在伏立康唑盐酸盐和伏立康唑-草酸共晶的纳米压痕实验表明, 由于伏立康唑盐酸盐滑移面之间的强离子键阻碍其在机械压力下发生层面间相对滑动, 因此伏立康唑盐酸盐的硬度和弹性显著高于伏立康唑-草酸共晶[70]。
|
Figure 4 The relationships between powder compressibility and the slip plane in cocrystal structure |
值得注意的是, 并非所有的共晶均比原料药具有更好的机械性能[71]。无水茶碱的晶体结构中没有层状结构。茶碱-没食子酸甲酯共晶虽然形成了二维层状结构, 但共晶的可压片性却不如无水茶碱, 这是由于无水茶碱分子堆叠成“柱状”结构, “分子柱”侧面之间容易产生相对滑动, 因而塑性较好。而没食子酸甲酯由于存在三维氢键网格结构, 弹性复原率较高且塑性极差, 二者的共晶虽然存在层状结构, 但产生相对滑动的阻力依然高于无水茶碱, 因此共晶的塑性低于无水茶碱而高于没食子酸甲酯[67]。此外, 吡罗昔康-糖精共晶晶体结构中虽然存在平面层状结构, 但是吡罗昔康分子中的苯环和一部分磺胺环形成的“弯曲结构”突出于其余结构形成的平面, 整体形成了“不均匀的平面”结构。这种“不均匀平面”结构和大量氢键网格结构使得晶体在受到外部应力时难以产生层面间相对滑动, 因此形成共晶后塑性并未得到改善[72]。由此可见, 在分析共晶晶体结构与可压片性间关系时应当充分考虑具体案例中分子排列堆积方式、分子间相互作用力以及层状结构平面间作用力等多种因素。
4 总结与展望材料的结构影响性质, 性质决定功能, 晶体材料内部的周期性排列规律与其性质密切相关, 这种规律常作为改善相关性质的依据和基础。同样的, 晶体药物的分子结构和晶体结构决定了其药学相关的理化性质, 如溶解度受晶格能、分子极性影响; 吸湿性与固体表面极性基团分布和晶格堆积紧密程度相关; 机械性质则可通过改变分子排列方式、分子间氢键连接强度进行调节。本文对多晶型、无定形/共无定形、共晶在改善药学相关理化性质提高成药性方面进行了系统的综述。晶体工程作为一种可以从分子水平改变药物晶体结构和分子间相互作用的技术手段, 旨在筛选优势药用晶型、与功能性小分子配体结合形成性质更佳的新型固体组合, 为制剂产品开发和工艺优化等方面提供了更加经济环保、性能稳健的途径。
作者贡献:翁兴业负责文献调研及起草、撰写文章; 庞遵霆负责文献调研及起草、撰写文章; 钱帅、魏元锋和高缘负责撰写及修改文章; 张建军负责修改文章。
利益冲突:作者排名顺序无争议, 稿件不涉及泄密和知识产权争议。
| [1] |
Newman A, Wenslow R. Solid form changes during drug development:good, bad, and ugly case studies[J]. AAPS Open, 2016. DOI:10.1186/s41120-016-0003-4 |
| [2] |
Karagianni A, Malamatari M, Kachrimanis K. Pharmaceutical cocrystals:new solid phase modification approaches for the formulation of APIs[J]. Pharmaceutics, 2018, 10: 18. DOI:10.3390/pharmaceutics10010018 |
| [3] |
Yang X, Lu J, Wang X, et al. In situ monitoring of the solution-mediated polymorphic transformation of glycine:characterization of the polymorphs and observation of the transformation rate using Raman spectroscopy and microscopy[J]. J Raman Spectrosc, 2008, 39: 1433-1439. DOI:10.1002/jrs.2016 |
| [4] |
Tian F, Qu H, Zimmermann A, et al. Factors affecting crystallization of hydrates[J]. J Pharm Pharmacol, 2010, 62: 1534-1546. DOI:10.1111/j.2042-7158.2010.01186.x |
| [5] |
Grothe E, Meekes H, Vlieg E, et al. Solvates, salts, and cocrystals:a proposal for a feasible classification system[J]. Cryst Growth Des, 2016, 16: 3237-3243. DOI:10.1021/acs.cgd.6b00200 |
| [6] |
Qiu PS, Gao J, Qian S, et al. Enhanced dissolution and intestinal absorption of adefovir dipivoxil by cocrystal formation with acetaminophen[J]. Acta Pharm Sin (药学学报), 2018, 53: 993-1001. |
| [7] |
Évora AOL, Bernardes CES, Piedade MFM, et al. Energetics of glycine cocrystal or salt formation with two regioisomers:fumaric acid and maleic acid[J]. Cryst Growth Des, 2019, 19: 5054-5064. |
| [8] |
Surov AO, Vasilev NA, Churakov AV, et al. Solid forms of ciprofloxacin salicylate:polymorphism, formation pathways, and thermodynamic stability[J]. Cryst Growth Des, 2019, 19: 2979-2990. DOI:10.1021/acs.cgd.9b00185 |
| [9] |
Datta S, Grant DJ. Crystal structures of drugs:advances in determination, prediction and engineering[J]. Nat Rev Drug Discov, 2004, 3: 42-57. DOI:10.1038/nrd1280 |
| [10] |
Gunnam A, Nangia AK. High-solubility salts of the multiple sclerosis drug teriflunomide[J]. Cryst Growth Des, 2019, 19: 5407-5417. DOI:10.1021/acs.cgd.9b00914 |
| [11] |
Nelson E. Solution rate of theophylline salts and effects from oral administration[J]. J Am Pharm Assoc, 1957, 46: 607-614. DOI:10.1002/jps.3030461012 |
| [12] |
Nelson E. Comparative dissolution rates of weak acids and their sodium salts[J]. J Am Pharm Assoc, 1958, 47: 297-299. DOI:10.1002/jps.3030470422 |
| [13] |
Dudek MK, Paluch P, Śniechowska J, et al. Crystal structure determination of an elusive methanol solvate-hydrate of catechin using crystal structure prediction and NMR crystallography[J]. Cryst Eng Comm, 2020, 3: 12-18. |
| [14] |
Alkhamis KA, Salem MS, Obaidat RM. Comparison between dehydration and desolvation kinetics of fluconazole monohydrate and fluconazole ethylacetate solvate using three different methods[J]. J Pharm Sci, 2006, 95: 859-870. DOI:10.1002/jps.20605 |
| [15] |
Malwade CR, Qu HY. Antisolvent crystallization of indomethacin from a ternary solvent system with high productivity, better polymorphism, and particle size control[J]. Org Process Res Dev, 2019, 23: 968-976. DOI:10.1021/acs.oprd.9b00052 |
| [16] |
Malaj L, Censi R, Martino P. Mechanisms for dehydration of three sodium naproxen hydrates[J]. Cryst Growth Des, 2009, 9: 2128-2136. DOI:10.1021/cg800684v |
| [17] |
Zimmermann A, Tian F, de Diego HL, et al. Structural characterisation and dehydration behaviour of siramesine hydrochloride[J]. J Pharm Sci, 2009, 98: 3596-3607. DOI:10.1002/jps.21679 |
| [18] |
Kumar D, Thipparaboina R, Shastri NR. Can vacuum morphologies predict solubility and intrinsic dissolution rate? A case study with felodipine polymorph form IV[J]. J Comput Sci, 2015, 10: 178-185. DOI:10.1016/j.jocs.2015.03.009 |
| [19] |
Saini A, Chadha R, Gupta A, et al. New conformational polymorph of hydrochlorothiazide with improved solubility[J]. Pharm Dev Technol, 2016, 21: 611-618. DOI:10.3109/10837450.2015.1041040 |
| [20] |
John B, Stephen S, Rodger H, et al. Ritonavir:an extraordinary example of conformational polymorphism[J]. Pharm Res, 2001, 18: 859-866. DOI:10.1023/A:1011052932607 |
| [21] |
Chieng N, Rades T, Aaltonen J. An overview of recent studies on the analysis of pharmaceutical polymorphs[J]. J Pharm Biomed Anal, 2011, 55: 618-644. DOI:10.1016/j.jpba.2010.12.020 |
| [22] |
Zhu B, Wang JR, Ren G, et al. Polymorphs and hydrates of apatinib mesylate:insight into the crystal structures, properties, and phase transformations[J]. Cryst Growth Des, 2016, 16: 6537-6546. DOI:10.1021/acs.cgd.6b01230 |
| [23] |
Zhang Q, Lu LY, Dai WJ, et al. New polymorphs of huperzine A:preparation, structures, and physicochemical properties of anhydrous crystal forms[J]. Cryst Growth Des, 2013, 13: 2198-2207. DOI:10.1021/cg400313a |
| [24] |
Wang CG, Sun CC. The landscape of mechanical properties of molecular crystals[J]. Cryst Eng Comm, 2020, 22: 1149-1153. DOI:10.1039/C9CE01874C |
| [25] |
Sun CC. Decoding powder tabletability:roles of particle adhesion and plasticity[J]. J Adhes Sci Technol, 2011, 25: 483-499. DOI:10.1163/016942410X525678 |
| [26] |
Ahmed H, Shimpi MR, Velaga SP. Relationship between mechanical properties and crystal structure in cocrystals and salt of paracetamol[J]. Drug Dev Ind Pharm, 2017, 43: 89-97. DOI:10.1080/03639045.2016.1220568 |
| [27] |
Osei-Yeboah F, Chang SY, Sun CC. A critical examination of the phenomenon of bonding area-bonding strength interplay in powder tableting[J]. Pharm Res, 2016, 33: 1126-1132. DOI:10.1007/s11095-016-1858-8 |
| [28] |
Wang CG, Sun CC. Identifying slip planes in organic polymorphs by combined energy framework calculations and topology analysis[J]. Cryst Growth Des, 2018, 18: 1909-1916. DOI:10.1021/acs.cgd.8b00202 |
| [29] |
Cheng H, Wei Y, Wang S, et al. Improving tabletability of excipients by metal-organic framework-based cocrystallization:a study of mannitol and CaCl2[J]. Pharm Res, 2020, 37: 130-144. DOI:10.1007/s11095-020-02850-8 |
| [30] |
Jain A, Shah HS, Johnson PR, et al. Crystal anisotropy explains structure-mechanics impact on tableting performance of flufenamic acid polymorphs[J]. Eur J Pharm Biopharm, 2018, 132: 83-92. DOI:10.1016/j.ejpb.2018.09.006 |
| [31] |
Bhandary S, Mangalampalli K, Ramamurty U, et al. Crystal structure-mechanical property correlations in N-(3-ethynylphenyl)-3-fluorobenzamide polymorphs[J]. Cryst Growth Des, 2017, 18: 47-51. |
| [32] |
Tobyn M, Brown J, Dennis AB, et al. Amorphous drug-PVP dispersions:application of theoretical, thermal and spectroscopic analytical techniques to the study of a molecule with intermolecular bonds in both the crystalline and pure amorphous state[J]. J Pharm Sci, 2009, 98: 3456-3468. DOI:10.1002/jps.21738 |
| [33] |
Kanaujia P, Poovizhi P, Ng WK, et al. Amorphous formulations for dissolution and bioavailability enhancement of poorly soluble APIs[J]. Powder Technol, 2015, 285: 2-15. DOI:10.1016/j.powtec.2015.05.012 |
| [34] |
Laitinen R, Lobmann K, Strachan CJ, et al. Emerging trends in the stabilization of amorphous drugs[J]. Int J Pharm, 2013, 453: 65-79. DOI:10.1016/j.ijpharm.2012.04.066 |
| [35] |
Skrdla PJ, Floyd PD, Dell'Orco PC. Predicted amorphous solubility and dissolution rate advantages following moisture sorption:case studies of indomethacin and felodipine[J]. Int J Pharm, 2019, 555: 100-108. DOI:10.1016/j.ijpharm.2018.11.042 |
| [36] |
Babu NJ, Nangia A. Solubility advantage of amorphous drugs and pharmaceutical cocrystals[J]. Cryst Growth Des, 2011, 11: 2662-2679. DOI:10.1021/cg200492w |
| [37] |
Kim JS, Kim MS, Park HJ, et al. Physicochemical properties and oral bioavailability of amorphous atorvastatin hemi-calcium using spray-drying and SAS process[J]. Int J Pharm, 2008, 359: 211-219. DOI:10.1016/j.ijpharm.2008.04.006 |
| [38] |
Yang W, Johnston KP, Williams RO. Comparison of bioavailability of amorphous versus crystalline itraconazole nanoparticles via pulmonary administration in rats[J]. Eur J Pharm Biopharm, 2010, 75: 33-41. DOI:10.1016/j.ejpb.2010.01.011 |
| [39] |
Shi Q, Moinuddin SM, Cai T. Advances in coamorphous drug delivery systems[J]. Acta Pharm Sin B, 2019, 9: 19-35. DOI:10.1016/j.apsb.2018.08.002 |
| [40] |
Ma XY, Williams RO. Characterization of amorphous solid dispersions:an update[J]. J Drug Deliv Sci Tec, 2019, 50: 113-124. DOI:10.1016/j.jddst.2019.01.017 |
| [41] |
Heng W, Su M, Cheng H, et al. Incorporation of complexation into a coamorphous system dramatically enhances dissolution and eliminates gelation of amorphous lurasidone hydrochloride[J]. Mol Pharm, 2020, 17: 84-97. DOI:10.1021/acs.molpharmaceut.9b00772 |
| [42] |
Kasten G, Lobmann K, Grohganz H, et al. Co-former selection for co-amorphous drug-amino acid formulations[J]. Int J Pharm, 2019, 557: 366-373. DOI:10.1016/j.ijpharm.2018.12.036 |
| [43] |
Jensen KT, Lobmann K, Rades T, et al. Improving co-amorphous drug formulations by the addition of the highly water soluble amino acid, proline[J]. Pharmaceutics, 2014, 6: 416-435. DOI:10.3390/pharmaceutics6030416 |
| [44] |
Bianco S, Tewes F, Tajber L, et al. Bulk, surface properties and water uptake mechanisms of salt/acid amorphous composite systems[J]. Int J Pharm, 2013, 456: 143-152. DOI:10.1016/j.ijpharm.2013.07.076 |
| [45] |
Puri V, Dantuluri AK, Kumar M, et al. Wettability and surface chemistry of crystalline and amorphous forms of a poorly water soluble drug[J]. Eur J Pharm Sci, 2010, 40: 84-93. DOI:10.1016/j.ejps.2010.03.003 |
| [46] |
Newell HE, Buckton G. The use of inverse phase gas chromatography to study the change of surface energy of amorphous lactose as a function of relative humidity and the processes of collapse and crystallisation[J]. Int J Pharm, 2001, 217: 45-56. DOI:10.1016/S0378-5173(01)00589-0 |
| [47] |
Wang J, Chang R, Zhao Y, et al. Coamorphous loratadine-citric acid system with enhanced physical stability and bioavailability[J]. AAPS Pharm Sci Tech, 2017, 18: 2541-2550. DOI:10.1208/s12249-017-0734-0 |
| [48] |
Mizoguchi R, Waraya H, Hirakura Y. Application of co-amorphous technology for improving the physicochemical properties of amorphous formulations[J]. Mol Pharm, 2019, 16: 2142-2152. DOI:10.1021/acs.molpharmaceut.9b00105 |
| [49] |
Telang C, Mujumdar S, Mathew M. Improved physical stability of amorphous state through acid base interactions[J]. J Pharm Sci, 2009, 98: 2149-2159. DOI:10.1002/jps.21584 |
| [50] |
Su ML, Xia YM, Shen YJ, et al. A novel drug-drug coamorphous system without molecular interactions:improve the physicochemical properties of tadalafil and repaglinide[J]. RSC Adv, 2020, 10: 565-583. DOI:10.1039/C9RA07149K |
| [51] |
Adeleye OA, Femi-Oyewo MN, Odeniyi MA. Effect of compression pressure on mechanical and release properties of tramadol matrix tablets[J]. Curr Issues Pharm Med Sci, 2015, 28: 120-125. |
| [52] |
Paluch KJ, Tajber L, Corrigan OI, et al. Impact of alternative solid state forms and specific surface area of high-dose, hydrophilic active pharmaceutical ingredients on tabletability[J]. Mol Pharm, 2013, 10: 3628-3639. DOI:10.1021/mp400124z |
| [53] |
Hancock BC, Carlson GT, Ladipo DD, et al. Comparison of the mechanical properties of the crystalline and amorphous forms of a drug substance[J]. Int J Pharm, 2002, 241: 73-85. DOI:10.1016/S0378-5173(02)00133-3 |
| [54] |
Thakral NK, Mohapatra S, Stephenson GA, et al. Compression-induced crystallization of amorphous indomethacin in tablets:characterization of spatial heterogeneity by two-dimensional X-ray diffractometry[J]. Mol Pharm, 2015, 12: 253-263. DOI:10.1021/mp5005788 |
| [55] |
Li Y, Yu J, Hu S, et al. Polymer nanocoating of amorphous drugs for improving stability, dissolution, powder flow, and tabletability:the case of chitosan-coated cndomethacin[J]. Mol Pharm, 2019, 16: 1305-1311. DOI:10.1021/acs.molpharmaceut.8b01237 |
| [56] |
Good DJ, Rodríguez-Hornedo N. Solubility advantage of pharmaceutical cocrystals[J]. Cryst Growth Des, 2009, 9: 2252-2264. DOI:10.1021/cg801039j |
| [57] |
Thakuria R, Delori A, Jones W, et al. Pharmaceutical cocrystals and poorly soluble drugs[J]. Int J Pharm, 2013, 453: 101-125. DOI:10.1016/j.ijpharm.2012.10.043 |
| [58] |
Dhara D, Bavishi CH. Spring and parachute:how cocrystals enhance solubility[J]. Prog Cryst Growth Charact Mater, 2016, 62: 1-8. |
| [59] |
Guzman HR, Tawa M, Zhang Z, et al. Combined use of crystalline salt forms and precipitation inhibitors to improve oral absorption of celecoxib from solid oral formulations[J]. J Pharm Sci, 2007, 96: 2686-2702. DOI:10.1002/jps.20906 |
| [60] |
Remenar JF, Peterson ML, Stephens PW, et al. Celecoxib:nicotinamide dissociation: using excipients to capture the cocrystal's potential[J]. Mol Pharm, 2007, 4: 386-400. DOI:10.1021/mp0700108 |
| [61] |
Wei YY, Zhang L, Wang N, et al. Mechanistic study on complexation-induced spring and hover dissolution behavior of ibuprofen-nicotinamide cocrystal[J]. Cryst Growth Des, 2018, 18: 7343-7355. DOI:10.1021/acs.cgd.8b00978 |
| [62] |
Shinozaki T, Ono M, Higashi KK, et al. A novel drug-drug cocrystal of levofloxacin and metacetamol:reduced hygroscopicity and improved photostability of levofloxacin[J]. J Pharm Sci, 2019, 108: 2383-2390. DOI:10.1016/j.xphs.2019.02.014 |
| [63] |
Wang ZZ, Chen JM, Lu TB. Enhancing the hygroscopic stability of S-oxiracetam via pharmaceutical cocrystals[J]. Cryst Growth Des, 2012, 12: 4562-4566. DOI:10.1021/cg300757k |
| [64] |
Putra QD, Furuishi T, Yonemochi E, et al. Drug-drug multicomponent crystals as an effective technique to overcome weaknesses in parent drugs[J]. Cryst Growth Des, 2016, 16: 3577-3581. DOI:10.1021/acs.cgd.6b00639 |
| [65] |
Mishra MK, Ramamurty U, Desiraju GR. Mechanical property design of molecular solids[J]. Curr Opin Solid State Mater Sci, 2016, 20: 361-370. DOI:10.1016/j.cossms.2016.05.011 |
| [66] |
Reddy CM, Rama KG, Ghosh S. Mechanical properties of molecular crystals-applications to crystal engineering[J]. Cryst Eng Comm, 2010, 12: 2296-2306. DOI:10.1039/c003466e |
| [67] |
Singaraju AB, Nguyen K, Gawedzki P, et al. Combining crystal structure and interaction topology for interpreting functional molecular solids:a study of theophylline cocrystals[J]. Cryst Growth Des, 2017, 17: 6741-6751. DOI:10.1021/acs.cgd.7b01339 |
| [68] |
Sun CC, Hou H. Improving mechanical properties of caffeine and methyl gallate crystals by cocrystallization[J]. Cryst Growth Des, 2008, 8: 1575-1579. DOI:10.1021/cg700843s |
| [69] |
Chow SF, Chen M, Shi L, et al. Simultaneously improving the mechanical properties, dissolution performance, and hygroscopicity of ibuprofen and flurbiprofen by cocrystallization with nicotinamide[J]. Pharm Res, 2012, 29: 1854-1865. DOI:10.1007/s11095-012-0709-5 |
| [70] |
Kumar SS, Thakuria R, Nangia A. Pharmaceutical cocrystals and a nitrate salt of voriconazole[J]. Cryst Eng Comm, 2014, 16: 4722-4731. DOI:10.1039/C3CE42324G |
| [71] |
Hiendrawan S, Veriansyah B, Widjojokusumo E, et al. Physicochemical and mechanical properties of paracetamol cocrystal with 5-nitroisophthalic acid[J]. Int J Pharm, 2016, 497: 106-113. DOI:10.1016/j.ijpharm.2015.12.001 |
| [72] |
Chattoraj S, Shi L, Chen M, et al. Origin of deteriorated crystal plasticity and compaction properties of a 1:1 cocrystal between piroxicam and saccharin[J]. Cryst Growth Des, 2014, 14: 3864-3874. DOI:10.1021/cg500388s |
 2020, Vol. 55
2020, Vol. 55


