1972年, Theodore Friedmann和Richard Roblin两位科学家首次提出使用基因疗法作为治疗人类遗传疾病的手段[1]。基因治疗系指利用合适的载体将目的基因导入患者体内病灶细胞的细胞质或细胞核中发挥作用, 以达到治疗疾病的目的。基因治疗通常包括基因纠正、基因补偿、基因沉默及基因激活等[2]。目前, 基因治疗主要分为体外疗法(ex vivo)和体内疗法(in vivo)两大类, 其中体外疗法指将有基因缺陷的细胞取出, 在体外进行基因改造后回输到患者体内, 使携带有外源性目的基因的细胞在体内表达治疗产物以达到治疗目的[3]。CAR-T (chimeric antigen receptor T cells)疗法作为一种典型的细胞免疫类体外疗法已经在血液癌的临床治疗方面得到了广泛应用。其中, 最具里程碑意义的是2017年美国食品药品监督管理局(FDA)首次批准的用于肿瘤免疫治疗的CAR-T产品——Kymriah[4]。尽管体外疗法受到了广泛关注, 但是在临床应用中受到细胞和疾病种类的限制而阻碍了其进一步发展。体内基因疗法则指将外源性治疗基因(如质粒DNA、siRNA和mRNA等)直接递送到病灶部位而发挥基因治疗的作用[5]。相比于体外疗法, 体内法较为简便易行, 仅需通过静脉注射等途径便能直接将外源性基因运送到靶部位, 且其应用范围较广。然而, 由于基因稳定性较差, 在体内传输过程中易受核酸酶的降解, 故为了实现更为有效的体外基因疗法, 需选择安全高效的基因载体将目的基因精准递送至靶部位[6]。
近年来, 开发安全、低毒且能使基因高效转染的载体成为研究热点。目前基因载体主要有病毒型载体和非病毒型载体两大类[7, 8]。其中, 病毒型载体具有很强的基因转染效率, 但由于免疫原性较高、导向性差、基因装载能力低且存在潜在的致瘤性等缺点而限制了其应用[9]。相比于病毒型载体, 非病毒型载体因具有易制备、低毒性和低免疫原性等特性而备受关注[10]。其中, 阳离子聚合物具有合成简单、核酸装载量高等优点而被广泛应用于载体研究中[11]。
聚乙烯亚胺(polyethylenimine, PEI)作为阳离子聚合物的典型代表, 是一种最为常用的非病毒型基因载体[12], 可通过静电作用达到携载基因的目的。PEI可分为直链型(linear PEI, LPEI)和分支型(branched PEI, BPEI)两种结构(图 1)。通常在分子量相近的条件下, BPEI的基因压缩能力强于LPEI, 主要是由于在BPEI结构中, 每两个碳原子上就含有伯胺、仲胺及叔胺基团, 带有很强的正电荷, 更容易与基因通过静电作用结合。PEI的基因递送效率不仅与分支程度有关[13], 也与其分子量有关。研究表明, PEI的分子量与基因转染效率呈正相关性, 而与细胞毒性呈负相关性[14]。其中, 分子质量为25 kDa的大分子量PEI由于其较高的转染效率被称为基因转染的“黄金标准”, 但因其强电荷性和不可降解性也导致了很强的细胞毒性。相反, 小分子量PEI虽易降解但转染效率较为低下[15]。因此, 开发安全高效的PEI基因载体尤为重要, 使其在提高基因转染能力的同时降低细胞毒性[16]。本文就PEI基因载体在体内递送过程及所遇到的问题、基因载体的表面修饰和智能型基因载体的研究进展及应用等方面进行综述, 为设计安全、高效的基因载体提供参考。
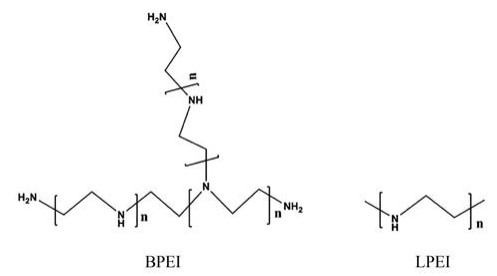
|
Figure 1 The structures of branched PEI (BPEI) and linear PEI (LPEI). PEI: Polyethylenimine |
基因的体内递送过程非常复杂, 且面临多重困难。因此, 选择适当的载体是基因递送成功的关键。首先, 基因载体需有能力将基因压缩成适当粒径的纳米粒, 以防止基因在递送过程中被体外或体内的核酸酶降解失活; 随后, 进入体循环的基因载体需要从血管中渗出而后聚集于靶区。正常的血管内皮组织由于结构紧密、间隙较小, 从而限制了大分子物质穿过血管壁的能力。在肿瘤及动脉粥样硬化等病理条件下会出现血管壁变薄、结构完整性变差等现象, 使大分子物质的通透性及滞留性增加, 此现象称为高渗透长滞留效应(EPR效应)[11]。研究发现, 粒径在200 nm左右的纳米粒易通过EPR效应透过血管壁[17]。基因载体成功渗透进入靶区后一般通过内吞方式入胞, 其内吞入胞速率和胞内累积量与基因载体的粒径、电荷及表面性质有关。研究表明[18, 19], 粒径为50 nm左右的纳米粒具备最快的细胞摄取速率, 主要由于该粒径下单个纳米粒与细胞膜作用时可产生足够的能量促进粒子的胞内摄取。由于细胞膜表面带有负电荷, 因此带正电荷的基因载体与细胞的相互作用更强, 入胞量更多[20]。此外, 载体的表面性质, 如亲疏水性, 在与细胞膜的相互作用中也起到了一定作用。研究发现纳米材料的摄入随着载体材料疏水性的增加而增加[21]。为了进一步提高纳米粒的胞内摄取量, 可在基因载体表面修饰特异性的配体或抗体, 再通过配体-受体介导或抗原抗体结合的方式提高载体的靶向摄取能力。基因载体内吞入胞后通常会经过溶酶体, 由于溶酶体内含大量核酸酶且其内环境酸性较强(pH = 4~6), 很容易使基因遭到降解作用。因此, 为了实现有效地基因递送, 进入细胞后的基因载体需快速逃逸溶酶体。通常, 基因载体可通过增加溶酶体渗透压而使溶酶体胀破或破坏溶酶体膜结构, 使之形成孔隙或失稳两种方式, 达到溶酶体逃逸的目的[22]。经溶酶体逃逸后, 基因递送的最后一步是将所包覆的基因快速释放至细胞质或细胞核中。其中, 对于RNA类核酸而言, 其在细胞质中就能进行翻译而发挥自身功能; 而DNA则需进入到细胞核中再发挥作用[23]。
PEI作为一种常用的基因载体材料以其独特的途径进行基因递送。由于其结构中含有大量氨基而带有很强的正电荷, 在压缩基因时, 其可通过静电结合作用与负电荷的目的基因形成表面带正电荷的基因复合物。正电荷型复合物可通过静电作用与带负电的细胞膜结合, 进而通过内吞作用入胞。通常内吞作用主要包括网格蛋白介导、小窝蛋白介导、巨胞饮作用及颗粒状物质(> 200 nm)的吞噬作用[24]。PEI基因复合物的内吞方式与其粒径大小及靶细胞的类型有关。Rejman等[25]发现小分子量PEI主要通过网格蛋白与小窝蛋白介导的内吞作用进入细胞, 而大分子量的PEI (> 1 μm)主要通过巨噬细胞的吞噬作用进入细胞。Vongersdorff等[26]发现PEI复合物在HH-7与COS-7细胞中, 以网状蛋白介导的内吞方式为主要途径。然而在HeLa细胞中, 以小窝蛋白介导的细胞摄取为主要方式。
通过不同内吞作用摄取入胞的PEI基因复合物将部分被转运到溶酶体。溶酶体中高浓度的核酸酶和酸性环境容易导致复合物中基因的降解。为了将基因完整地递送到细胞质及细胞核中, 基因载体必须快速逃逸溶酶体并迅速将基因释放出来。PEI基因复合物可同时通过溶酶体胀破及膜结构失稳两种方式逃逸溶酶体。在生理条件下其分子中只有约20%左右的氨基被质子化, 当载体进入酸性溶酶体环境中, 剩余部分的氨基可以大量捕获质子, 导致大量的氯离子内流进入溶酶体中使得其渗透压增加, 进而导致溶酶体膜破裂而释放出基因载体[27]。在该过程中, PEI具备不断吸收质子的特点, 因此又将此过程称为“质子海绵效应”。与此同时, PEI还能与溶酶体膜中负电性的磷脂作用, 破坏溶酶体膜结构而形成孔隙, 进而帮助小分子聚合物流出。基因复合物逃离溶酶体后, 需将携带的目的基因释放进入细胞质或细胞核中。
尽管PEI的许多特性表明其作为基因载体具有很大潜力, 但在临床应用中仍存在巨大挑战。因为PEI进入细胞后难以降解, 长期蓄积会产生较大的细胞毒性。一方面, 由于PEI在体内递送过程中很容易与负电荷型血清成分发生非特异性结合作用而在血管中生成血栓物质, 进而扰乱血浆膜结构, 最终产生毒性并触发免疫反应[28]; 另一方面, 其细胞毒性可能来源于大量PEI分子簇聚集于细胞膜外而导致的细胞坏死[29]。一般认为, PEI会产生瞬时和延时两种毒性。在基因转染前, 游离PEI分子通过膜失稳作用导致细胞的瞬时死亡。而经细胞内吞入胞后, PEI可通过诱导细胞凋亡而产生延时毒性[30]。此外, 对线粒体的去极化作用也可能是PEI产生毒性的原因[31]。
2 PEI基因载体的表面修饰为了克服PEI的各种问题, 目前可通过对PEI聚合物表面进行一定程度的修饰来提高其生物相容性、靶向性和缓冲能力, 同时改善降解性, 增加PEI的转染效率并降低其毒性。
2.1 提高生物相容性由于PEI聚合物表面具有高密度型正电荷, 使其在循环中极易与血清物质发生非特异性结合, 或被免疫细胞识别清除, 导致生物相容性较差。目前提高PEI聚合物的生物相容性最常用的方法为通过表面修饰法屏蔽基因复合物表面多余的正电荷。聚乙二醇(polyethylene glycol, PEG)是一种生物可降解型亲水性聚合物, 是目前用于提高PEI生物相容性最为常用的一种材料, 其可在一定程度上屏蔽基因复合物表面的正电荷, 用于提高基因复合物的生物相容性[32]。此外, PEG上存在大量羟基, 易与水分子间形成氢键, 在载体表面形成水化层。由于水化层及空间位阻的作用, 阻止了纳米粒之间及纳米粒与血液组分发生聚集, 从而避免网状内皮系统的识别与吞噬, 达到“隐形”效果, 以延长基因复合物在血液循环的时间[33]。PEG的存在使得聚合物具备更好的溶解性、更低的表面电荷和细胞毒性及聚集性[34]。Wang等[35]使用双氨基甲酸酯交联PEI800 Da得到衍生物, 并在其表面修饰PEG用以降低毒性。体外细胞毒性实验表明, 该载体材料对血管平滑肌的细胞毒性明显降低。体内外转染实验表明, 该载体具备更高的基因转染效率。Cai等[36]发现接枝PEG的PEI载体具备更好的生物相容性, 但随着PEG接枝率的增加, 基因载体的转染效率随之降低, 其原因可能是PEG的屏蔽作用导致了基因载体的细胞摄取量减少及溶酶体/内涵体的逃逸能力降低, 即所谓的“PEG困境”[37]。因此, 在应用过程中, 需要选择合适的接枝率以平衡基因载体的细胞毒性与转染效率, 还可以在载体表面修饰可脱去的PEG壳层以克服“PEG困境”。Nie等[38]通过静电作用将PEI与DNA压缩得到纳米核心, 再使用pH敏感的腙键将PEG连接在胆固醇上作为脂质材料, 用于包载基因复合物。该载体在溶酶体/内涵体的pH酸性环境下, 腙键发生断裂后导致PEG层脱落, 基因载体解除屏蔽后产生更强的溶酶体逃逸能力, 其基因转染效率约是非pH敏感型载体的40倍。除PEG外, 多糖聚合物, 如海藻酸[39]、透明质酸(hyaluronic acid, HA)[40]、硫酸软骨素[41]、硫酸肝素[42]和聚γ聚谷氨酸[43]等也可以作为屏蔽PEI聚合物表面正电荷所用的修饰材料。
除此以外, 改变PEI载体材料的疏水性在一定程度上也能提高其生物相容性。通过引入疏水性的基团及两亲性嵌段共聚物可增加PEI的疏水性、降低载体材料的电荷密度并提高细胞膜的融合性[44, 45]。Yuan等[46]使用疏水性的生育酚交联小分子量PEI形成新的载体材料, 该载体材料在HeLa细胞及HEK293细胞中表现出更低的细胞毒性及更高的转染效率。
2.2 改善PEI降解性为了减少PEI的蓄积毒性, 目前可通过两种方法改善PEI聚合物的降解性: ①将PEI与生物可降解型材料(如壳聚糖[47]、淀粉[48]、环糊精[49]和聚氨基酸[50]等)进行偶联, 采用化学交联法将小分子量PEI交联成生物可降解型大分子量PEI。Noga等[51]将不同的羟乙基淀粉分子偶联到LPEI上, 制备基因载体, 并对所得到的载体进行细胞相容性测定。研究发现, 与未经修饰的小分子量PEI相比, 该载体具备较低的细胞毒性和溶血率。Wang等[52]采用2-羟丙基-γ环糊精修饰小分子量PEI600 Da, 再与MC-10寡肽进行偶联得到基因载体。体内研究结果表明, 与PEI25 kDa相比, 该载体具有极低的细胞毒性; ②通过可裂解的化学键将小分子量PEI交联成大分子量PEI以压缩基因。交联的大分子量PEI载体材料进入体内后, 在特定的细胞内环境或细胞器中发生裂解从而使得自身发生降解。相比于大分子量PEI, 小分子量PEI在体内具有更好的降解性和更低的细胞毒性。Giron-Gonzalez等[53]将安全无毒的柠檬酸作为交联剂, 通过酰胺反应将小分子量PEI交联成大分子量PEI。待载体材料进入体内后, 酰胺键发生裂解, 使大分子量PEI降解为小分子量PEI, 同时释放出包载的目的基因。小分子量PEI在体内发生代谢, 从而降低了载体在体内的蓄积及细胞毒性。与脂质体2000和PEI25 kDa相比, 该载体材料的毒性极其微小, 且其转染效率显著提升。
2.3 提高靶向性在基因的递送过程中, PEI可与靶细胞以外的其他带有负电荷的细胞膜及血液中含负电荷的蛋白质等发生非特异性的结合而导致脱靶现象, 从而影响基因转染效率。为了避免体内的非特异性结合, 使用特定细胞或组织的特异性配体或抗体对PEI载体表面进行修饰, 通过配体或抗体介导的主动靶向作用提高基因载体在靶区的蓄积量。此外, 对于携载质粒DNA的载体而言, 由于DNA需在细胞核中才能发挥作用, 因此除了靶向特定细胞外, 还需要具备靶向细胞核的能力。
2.3.1 细胞靶向性与正常的细胞及体内微环境不同, 肿瘤等病理环境中会出现细胞表面受体上调、细胞因子分泌增多及免疫反应增强等现象。由于肿瘤细胞需要快速的分裂增殖, 其表面会高度表达某些受体, 如转铁蛋白受体[54]、表皮生长因子受体[55]、整合素[56]和叶酸受体[57]等。根据这些特点, 可通过在基因载体表面修饰与受体具有高度亲和性的靶向性配体来提高载体的肿瘤靶向性。目前较为常用的配体类型主要有内源性配体、抗体和碳水化合物[58]。
内源性配体主要包括转铁蛋白(transferrin, Tf)[59]、表皮生长因子[60]、RGD肽[61]和叶酸(folic acid, FA)[62]等。Tf在体内参与铁的运输, 是体内不可缺少的成分。转铁蛋白受体在肿瘤表面高表达, 使用Tf修饰的基因载体可与其特异性结合。Zhu等[63]将Tf与交联后的小分子量PEI进行偶联得到肿瘤靶向型载体, 结果表明, 该靶向型载体对肿瘤细胞的靶向性及转染效率得到很大提升。Gersdorff等[64]将表皮生长因子共价连接在PEI上形成多聚物并在其表面继续包覆一层PEG。与无配体修饰的基因载体相比, 该载体与HH-7肝癌细胞和肾癌细胞间的结合能力提高了约2~3倍, 同时其基因转染率提高了10~50倍。此外, Kunath等[65]将RGD肽连接在PEI25 kDa聚合物表面。研究发现, 制得的基因载体在αvβ3整合素阳性表达的细胞中具备更强的基因转染效率, 与单纯的PEI25 kDa相比, 其基因转染效率提高了50倍。由于叶酸受体在子宫内膜癌及卵巢癌中表达率高达90%以上[66], 将FA作为配体对PEI进行修饰也可提高载体在此类肿瘤细胞中的靶向性[67]。
除使用受体-配体特异性识别作用外, 病理环境中病变细胞的免疫原性增加, 其表面表达一些特异性抗原, 通过抗原-抗体反应也可制备靶向型PEI基因载体。人表皮生长因子受体2是一种在细胞膜表面表达的受体酪氨酸激酶, 属于乳腺癌、胰腺癌、胃癌和卵巢癌等多种恶性肿瘤的表面标志物[68]。其中, 曲妥珠单抗是该受体的特异性抗体。Chiu等[69]采用曲妥珠单抗对PEI25 kDa进行表面修饰。研究结果表明, 其在高表达人表皮生长因子受体2的细胞中具备较高的基因转染效率。此外, 其他常用于靶向性修饰的抗体主要有CD3单抗和G250单抗等[70]。
2.3.2 细胞核靶向性前已述及, DNA需要进入细胞核才能发挥作用。然而, 经过体内各种屏障后基因载体到达细胞核的量很少而且由于缺乏对细胞核的靶向性, 导致细胞核膜上的蓄积量极为有限[25]。因此, 提高DNA入核量是增加基因转染效率的又一关键因素。在细胞中, 核定位信号可引导外源物质到达核膜形成核孔复合物, 核孔复合物继续通过能量依赖性的方式进行核转运, 从而将外源性物质递送至细胞核。细胞在有丝分裂期核膜的完整性降低[71], 因此外源基因可以在细胞分裂过程中穿透核膜进入细胞核。而对于大多数未处于分裂期的细胞, 外源基因只能在核定位信号或核转运受体的帮助下通过核孔复合物进入细胞核。早期为提升基因的转染效率, 多使用核定位信号、转录因子和组蛋白等对基因载体进行核靶向性修饰[72], 但由于修饰物的空间构象和表面密度分布较难控制而未能达到提高转染效率的目的。近年来发现细胞核上表达一种糖皮质激素转运受体, 此种受体属于细胞核的核转运受体[73], 在载体上修饰糖皮质激素类配体, 如地塞米松等不仅可以提高细胞核的靶向性, 还可以促进细胞核孔的扩张, 进而加速大分子物质进入细胞核, 提高细胞核转运能力[74]。
2.4 提高基因载体缓冲能力基因载体的质子缓冲能力是影响其转染效率的关键因素, 对于阳离子型基因载体而言, 具备较强的质子缓冲能力意味着可以较快速地逃逸溶酶体, 以此保护基因免受核酸酶或酸性环境的降解作用从而提高基因转染能力。PEI因“质子海绵”效应而具备较强的缓冲能力。为了进一步提高PEI基因载体的性能, 研究者在PEI上修饰含有叔胺或咪唑环等基团以增强载体的缓冲能力。Ihm等[75]合成了尿苷酸修饰的PEI载体材料, 尿苷酸中含有咪唑环, 由于咪唑环中含有能质子化和去质子化的仲胺(pKa 6.0), 缓冲能力恰好在溶酶体/内涵体的pH值范围内。与PEI25 kDa相比, 由于尿苷酸中咪唑环的引入使得基因载体的质子缓冲能力得到提高, 进一步提高了基因转染效率。此外, 壳聚糖[76]和氯喹[77]等的引入也可提高基因载体的缓冲能力和转染效率。
3 智能响应型PEI基因载体尽管采用PEG修饰和配体修饰等方法可在一定程度上提高基因载体的降解性、生物相容性和靶向性, 但仍然存在一些问题, 如载体与基因之间较强的静电作用力虽然可以保证基因在体循环中保持稳定, 但进入靶细胞后却无法快速地将基因释放出来[78]。此外, 配体修饰的PEI载体一般只能将载体靶向递送到特定的细胞, 但进入细胞后却无法准确控制基因载体在亚细胞结构中的递送和释放行为。因此, 为了克服这些问题进而实现更为有效的基因递送效率, 近年来涌现了一大批智能响应型基因载体。当前, 刺激响应型PEI纳米载体已经发展成为一种优质的智能递送系统。主要可分为内源性刺激响应型载体、外源性刺激响应型载体及双重刺激响应型载体等。
3.1 内源性刺激响应型PEI载体内源性刺激响应型载体是根据病理变化导致的病理环境与正常组织之间的差异, 如pH梯度、氧化还原状态差异及酶表达差异等设计的一种载体, 其响应性的控制因素存在于体内。该类载体可促使基因精确快速释放至靶点并降低对正常组织的毒副作用[79]。研究发现, 某些病理环境如肿瘤、炎症等部位通常表现出弱酸性、低氧环境[80]、血管异常和温度异常等情况[81]。依据不同病理环境的特点, 目前报道的基于PEI聚合物的内源性刺激响应型载体主要可分为pH响应型、活性氧(reactive oxygen species, ROS)响应型、氧化还原响应型及生物响应型载体[82]。
3.1.1 pH响应型PEI载体研究表明, 在诸如癌症、炎性感染等特殊的病理环境下pH值明显低于正常组织(pH 7.4)[83], 其中肿瘤组织的pH值通常处于6.5~7.2内[84]。肿瘤组织与正常组织间显著的pH值差异可作为PEI基因载体响应性释放的“触发器”[85]。Gou等[86]使用戊二醛作为交联剂, 将小分子量PEI交联成pH敏感型大分子量PEI, 用于压缩pDNA制备基因复合物。当该载体进入细胞溶酶体后, 溶酶体中较低的pH环境导致大分子量PEI间的亚胺键断裂, 从而释放出目的基因。体外安全性及生物相容性评价表明, 该基因载体的细胞毒性明显低于PEI25 kDa基因复合物。体内外转染实验表明, 基因复合物的转染效率远高于裸pDNA和PEI25 kDa的基因复合物。此外, 除递送基因外, pH响应型PEI载体还可同时递送基因与化疗药物。Long等[87]利用琥珀酰亚胺基6-烟酰肼丙酮肼修饰PEI25 kDa后, 通过腙键将基因载体共轭连接多柔比星, 用于基因与药物的共递送。该载体在酸性肿瘤环境中, 酸敏感型腙键发生断裂, 从而促进化疗药物的解离及目的基因的释放。
目前主要通过两种方法构建pH响应型PEI基因载体。一种方法为在载体聚合物表面通过物理或化学方法引入质子化基团, 该质子化基团在正常的生理条件下是去质子化或去电离的, 但在pH酸性环境下基团发生质子化或出现电荷翻转, 使得基因载体变构或解离从而释放基因[88]。含有此类质子化基团的聚合物包括阴离子聚合物(聚丙烯酸、聚甲基丙烯酸和聚乙基丙烯酸等)和阳离子聚合物(聚β-氨基酯、聚赖氨酸和聚组氨酸等); 另一种方法为采用酸敏感型化学键将小分子量PEI交联成大分子量聚合物, 如腙键、缩酮键、缩醛键、酯键和亚胺键等[89]。这些化学键在正常的生理条件下稳定存在而在酸性条件下发生裂解从而释放基因。Guo等[90]通过酰胺反应将pH敏感型阴离子聚合物1, 2-环己烷二甲酸酐修饰在PEI表面, 再将负电荷的FA修饰在其表面, 并利用该材料对PEI/DNA二元复合物进行二次压缩, 形成三元复合物(图 2)。该复合物在生理pH值条件下表面携带负电荷, 可以屏蔽PEI所携带的正电荷, 在肿瘤组织的酸性微环境中酰胺键发生断裂, 外层材料脱落, 复合物发生电荷翻转, 而将携带正电荷的二元复合物裸露出来。接着, 通过正负电荷的静电吸附作用及在二元复合物表面残余的FA所介导的靶向作用进入肿瘤细胞。体外转染实验表明, 该三元复合物的肿瘤转染效率高于单纯的PEI聚合物。Lu等[91]通过亚胺键将小分子量PEI交联为大分子量PEI用于压缩anti-miR155, 并在其外层包覆载脂蛋白A-1修饰的脂质双层膜, 以实现动脉粥样硬化斑块靶向递送。
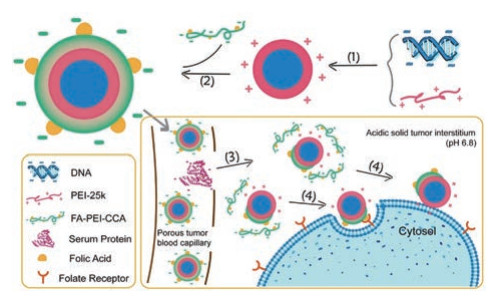
|
Figure 2 The preparation, in vivo delivery and cell uptake mechanism of the FA/PEI/DNA. FA: Folic acid. (Adapted from Ref. 90 with permission. Copyright © 2017 Elsevier B.V. All rights reserved) |
ROS是体内一类氧化性极强的单电子还原产物, 主要包括OH•、NO•、O2-及H2O2等。研究发现, 在多种病理状态下, 如阿尔茨海默症、帕金森综合征、心血管疾病、炎症及癌症等病灶部位都会产生过量ROS[92]。过量的ROS使细胞发生氧化应激反应而造成一定的细胞毒性。与正常的细胞相比(~20 μmol·L-1), 癌细胞中ROS的水平更高(~100 μmol·L-1)[93]。利用病变部位与正常组织间ROS水平的差异, 设计ROS响应型PEI载体有助于将目的基因精准并迅速释放至靶部位。其中, H2O2是ROS的主要组成部分, 其可作为氧化应激的主要标志物, 由于H2O2的强氧化性, 可将载体的还原性基团氧化从而释放目的基因[93]。Zheng等[94]通过ROS响应性的硫醇缩酮基团的二烯烃与PEI伯胺基的加成反应将小分子量PEI600 Da交联成大分子量PEI, 用于包载DNA形成基因载体复合物。该复合物进入细胞后, 胞内高水平的ROS导致硫醇缩酮键断裂, 使得大分子量PEI降解为小分子量PEI并释放出目的基因。与PEI25 kDa相比, 此基因载体具备更低的细胞毒性。体内外转染实验表明, 该载体的转染效率是PEI600 Da的520倍。Lin等[95]通过硫缩醛键将小分子量PEI600 Da交联为生物可降解型大分子量PEI。该载体进入肿瘤细胞后, 肿瘤细胞内高ROS环境导致硫代缩醛键发生断裂, 基因载体裂解从而释放出基因。Zhang等[96]通过二硒键将小分子量PEI600 Da交联成大分子量PEI载体用于包载TNF-α siRNA, 并在其表面修饰羧化的聚甘露糖作为巨噬细胞的靶向性配体。在炎性巨噬细胞内高浓度ROS的条件下, 二硒键断裂并伴随着基因的快速释放。体内实验结果表明, 与PEI25 kDa和非ROS响应型载体相比, 该载体的基因沉默效率提高了2~3倍, 与此同时还具有较好的细胞安全性。此外, 硼酸酯键[97]、氨基丙烯酸酯键[98]和硫醚[99]等都可用于ROS响应型基因载体的设计。
3.1.3 谷胱甘肽(glutathione, GSH)响应型PEI载体GSH是一种含有巯基的多肽, 由谷氨酸-半胱氨酸-甘氨酸等氨基酸分子组成, 在细胞中主要起到防止血红蛋白氧化、清除自由基和保护细胞膜等作用, 是细胞中主要的还原性物质[100]。研究发现, 细胞内的谷胱甘肽浓度(2~10 mmol·L-1)是细胞外谷胱甘肽浓度(2~20 μmol·L-1)的100 ~1 000倍[101]。由于肿瘤细胞繁殖速度极快, 代谢能力旺盛, 导致胞内GSH浓度显著提升, 其含量大约为正常细胞的7~10倍[102]。基于肿瘤细胞与正常细胞、细胞内外等GSH的浓度差异, 可设计GSH响应型基因载体以提高基因递送效率。其中, 二硫键是应用最广泛的还原性键[103]。通常, 二硫键在血液循环及细胞外的低GSH环境中稳定存在, 当在细胞内或肿瘤部位等高GSH环境中, 二硫键被还原成巯基导致基因载体结构改变或解离以释放出目的基因。Taranejoo等[104]将乙二醇壳聚糖通过还原响应性二硫键共价连接到枝化程度较高的PEI2 500 Da上, 合成了氧化还原响应型载体材料, 使用该载体材料对DNA进行压缩形成基因复合物。结果表明, 与单纯的PEI2 500 Da和PEI25 kDa相比, 该载体具备更高的缓冲能力和转染效率及更低的细胞毒性。Dai等[105]通过二硫键交联小分子量PEI800 Da用于压缩miRNA, 该载体通过内吞作用进入细胞后, 细胞中较高浓度的GSH导致二硫键发生断裂并触发基因的快速释放。实验结果表明, 该载体的基因转染是小分子量PEI800 Da的5倍, 具有与PEI25 kDa相当的转染效率, 但显现出更低的细胞毒性。
3.1.4 生物分子响应型PEI载体正常生理/病理体内含有不同种类的内源性生物分子, 如酶、ATP、葡萄糖及抗原等[106]。根据生理及病理状态下内源性生物分子的表达差异也可作为刺激响应信号。酶作为一种温和且高效的催化剂广泛参与人体各种生物化学反应。以肿瘤细胞为例, 其胞内高表达蛋白酶[107]、脂肪酶[108]和透明质酸酶[109]等, 可根据酶在细胞不同部位表达差异制备酶敏感型基因载体。Yin等[110]使用二硫键交联小分子量PEI并在其表面修饰HA得到基因载体材料。该载体可通过HA与CD44受体间的高度亲和性实现肿瘤靶向性。当基因载体进入细胞后, 在透明质酸酶的作用下HA发生降解, 暴露出PEI从而快速逃逸溶酶体至细胞质。接着, 交联型PEI聚合物在GSH的作用下发生断裂, 使得siRNA快速释放出来。
ATP是细胞内进行能量传递的载体, 在胞内具有很高的浓度(1~10 m mol·L-1), 大约是胞外浓度的2.5~25倍(< 0.4 mmol·L-1)[111]。根据细胞内外高浓度梯度的ATP含量差异可设计响应型基因载体。在前期研究中[112], 作者合成了苯硼酸(PBA)和α-环糊精(α-cyclodextrin, α-CD)两种修饰型小分子量PEI, 接着利用α-CD和PBA间的主客作用力将小分子量PEI交联成ATP响应型超分子聚合物。由于PBA在水溶液中以亲水性离子型结构和疏水性分子型结构可逆共存, 在胞内高浓度ATP环境下, ATP的顺式二元醇结构与亲水性PBA分子具有很强的亲和性, 生成稳定的硼酸酯键, 导致PBA由疏水性持续转变为亲水性, 而从α-CD的疏水空腔中解离出来, 进而导致超分子聚合物发生裂解并释放siRNA (图 3)。体外ATP响应性实验结果证明, 超分子聚合物在ATP作用下可快速释放出siRNA。且该载体材料具有更低的细胞毒性及更高的转染效率。
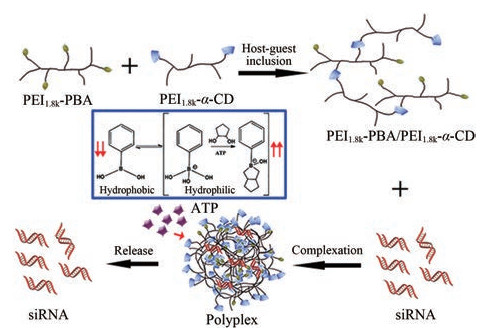
|
Figure 3 Illustration of self-assembly of PEI1.8k-PBA/PEI1.8k-α-CD supramolecular polymer and release of siRNA via the disassembly of polyplexes in the presence of ATP. PBA: Phenylboric acid; α-CD: α-Cyclodextrin. (Adapted from Ref. 112 with permission. Copyright © 2018 American Chemical Society) |
葡萄糖是存在于人体内的重要营养物质, 是为身体提供能量不可缺少的物质之一。在糖尿病等病理条件下, 可将葡萄糖作为响应性信号。葡萄糖响应型PEI载体的开发主要是依据葡萄糖氧化酶对葡萄糖的催化氧化反应进行设计[89]。Yoshida等[113]在大分子量的PEI表面修饰氯化血红素, 通过静电作用将DNA和葡萄糖氧化酶进行层层组装, 形成基因载体。该载体进入体内后, 葡萄糖氧化酶与高浓度葡萄糖反应后可将其分解为H2O2和葡萄糖酸, H2O2再与铁卟啉发生反应, 最终导致基因载体裂解并释放基因。体外研究表明, 此载体在不同的葡萄糖浓度中均具有较好的响应性。
3.2 外源性刺激响应型PEI载体近些年, 将光、电、磁场和超声等外部条件作为刺激信号设计刺激响应型PEI基因载体也受到了极大的关注。与内源性刺激信号相比, 外源性刺激信号具备更强的可控制性。根据外源性刺激信号的类型, 可分为光刺激响应型、热刺激响应型和磁响应型PEI载体等。这些刺激响应型基因载体能够在外源刺激信号的作用下发生化学结构或物理性质的变化, 从而促进目的基因的释放。
3.2.1 光刺激响应型PEI载体光作为外源刺激信号具备使用简单、环保等多种优势, 更为重要的是其在空间及时间上具备较强的可控性, 能最大限度保护机体正常的细胞及组织免受损伤[114]。根据波长可将光分为3个主要波段:紫外区域(10~400 nm)、可见光区域(400~750 nm)及近红外区域(750~1 100 nm)[115]。考虑到基因递送过程的安全性及有效性, 通常采用紫外及近红外光作为“触发器”设计光刺激响应型载体。
光敏基团是设计光响应型纳米载体的关键因素, 也是基因载体接受光刺激的结构基础。此类光敏基团可在一定波长的光刺激下发生光氧化、光降解和光致异构化等[116]。Jiang等[117]使用含有光敏基团2-硝基苯基的交联剂与PEI600 Da通过Michael加成反应合成光敏感的载体材料。使用该载体材料压缩DNA后再在其表面包覆HA壳层。该载体可通过与癌细胞表面高表达的CD44受体的特异性识别作用到达癌细胞并内吞入胞。成功逃逸溶酶体后, 在外界给予紫外光照射下(365 nm), 载体光敏基团发生断裂, 促进目的基因释放。研究结果表明, 该载体的血液稳定性较高且细胞毒性较低, 转染效率比PEI25 kDa高出1~2个数量级。此类光敏基团除了2-硝基苯基外, 还包括芘类[118]及其衍生物、香豆素[119]衍生物和邻硝基苄基[120]等。此外, 一些光敏感的化学材料可通过光热转换效应影响基因载体在体内的转运过程从而增强基因的转染效率。Lee等[121]采用光敏型交联剂邻硝基苄基氨基甲酸乙酯交联小分子量PEI用于包载DNA。研究发现, 精准的光降解可显著改善该光敏型基因载体在HeLa细胞的转染效率。
3.2.2 热刺激响应型PEI载体研究发现, 炎症或肿瘤组织及微环境中的温度(40~45 ℃)一般略高于人体正常体温(37 ℃)[82], 利用这种病理性变化导致局部的热差异可作为刺激信号, 用于设计温度敏感型基因载体。然而病理组织的局部高热现象并不是持续稳定的, 为了提高温度刺激响应性的可控性及稳定性, 通常使用外部热源给予稳定的热刺激以替代体内病理性热差异。
热敏感性载体材料是热刺激响应型基因载体设计的关键因素, 优良的热敏感性载体材料能够在正常体温下有效并持续包载基因, 而在接受热刺激时准确并快速释放基因[122]。临界溶液温度是热敏聚合物发生相分离时的温度, 也是其作为基因载体的重要理化特性。通常热敏聚合物的水溶液在上临界溶解温度(upper critical solution temperature, UCST)或下临界溶解温度(lower critical solution temperature, LCST)时会发生相变化。具备LCST的热敏聚合物在临界溶解温度以下是可溶的、以上呈不溶性。相反, 具备UCST的聚合物在临界溶液温度以下不溶而以上呈可溶性[123]。在热敏性材料中, 聚N-异丙基丙烯酰胺[poly(N-isopropylacrylamide), PNIPAM]是研究较为广泛的一种材料, 其属于LCST类的非离子型聚合物, 临界溶液温度为32 ℃。当温度高于LCST时, 该热敏聚合物呈疏水性, 此时聚合物能更好地结合基因并保护其不被降解; 当温度低于LCST时, 聚合物呈亲水性, 水溶性的增加使得热敏聚合物结构变得松散而导致基因从载体中释放出来[124]。为获得温度敏感型PEI基因载体, 通常使用PNIPAM对PEI进行修饰[125]。Zhang等[126]在采用PNIPAM对PEI25 kDa进行修饰, 当温度高于PNIPAM的LCST时, 该载体的细胞摄取能力增加, 此时的转染效率远高于温度低于LCST时的转染效率。
3.2.3 磁响应型PEI载体磁响应性是制备外源性刺激响应型基因载体的另一种有效策略, 由于其与身体几乎不发生任何理化反应, 因此具有很高的安全性。磁响应型基因载体被广泛应用于肿瘤的靶向治疗中, 通过磁场的引导作用, 可将基因载体准确地递送至肿瘤靶部位并且增强磁性纳米粒在肿瘤部位的蓄积量, 从而提高肿瘤的治疗效果。通常, 磁响应型基因载体结构包括磁性纳米粒核心和阳离子聚合物外壳。使用较为广泛的磁性纳米粒有Fe3O4和Fe2O3[127]。为了达到负载基因的目的, 通常在其表面修饰阳离子聚合物。Guruprasath等[128]将PEI1.8 kDa偶联到超顺磁性纳米粒Fe3O4表面形成具有磁响应性载体材料, 随后在该材料表面修饰细胞白介素-4结合肽用于包载siRNA以获得基因沉默效率。实验结果表明, 该基因载体可通过磁响应性进行更准确的基因递送并为疾病的治疗提供精准的核磁成像信息。Lo等[129]使用硫酸软骨素-PEI共聚物对超顺磁性氧化铁纳米粒进行包裹形成磁响应性载体材料用于目的基因的递送。结果表明, 该纳米粒在磁场作用下, 仅在20 min内就表现出有效的磁感应强度, 且在肿瘤部位能大量的聚集并产生较高的转染效率。Jia等[130]将超顺磁性氧化铁纳米粒作为载体的核心, 并在其表面修饰小分子量PEI10 kDa, 从而用于负载siRNA。该载体可通过网状内皮系统的吞噬作用被动地运输到巨噬细胞中。由于该载体具备磁性, 在递送基因的同时可以对巨噬细胞进行成像与跟踪, 在自身免疫性疾病和动脉粥样硬化等疾病的治疗中得到广泛的研究。
3.3 双重响应型PEI载体人体是一个极为复杂的内环境, 通过基因载体将目的基因成功释放至靶部位需要克服多重障碍。为了使载体具备逐级响应能力以准确快速释放目的基因至靶部位, 通常需要使用多种触发因素进行组合, 设计多重响应型载体以实现基因的精准递送。根据需要可将不同的内源性刺激和外源性刺激信号进行组合, 如pH/GSH、pH/ATP、pH/温度、磁场/GSH、磁场/pH、光/GSH和酶/GSH等[131-133]。
由于病理组织与正常组织在内源性成分上存在巨大差异, 通常设计多重内源性刺激响应型载体。Xu等[134]通过二硫键将环糊精接枝在小分子量PEI1.8 kDa上用于共载基因与莫能菌素, 并通过静电作用力在载体表面继续修饰RGD-γ聚谷氨酸, 赋予载体高效的肿瘤靶向性。在肿瘤酸性环境中, γ-聚谷氨酸发生构象变化, 从而脱去靶向性外壳。待载体进入细胞质后, 在高浓度GSH的作用下, 连接环糊精与PEI1.8 kDa的二硫键发生断裂, 进而促进了药物及基因的释放。研究表明, 该pH/GSH双重响应型载体对肿瘤的生长有较好的抑制作用。Wang等[135]将多柔比星与对羧基苯肼修饰的PEI25 kDa通过腙键进行偶联用于共载质粒DNA和药物, 并在其表面包覆靶向性分子HA, 以获得pH/透明质酸酶敏感型载体。Kim等[136]分别制备了PBA和半乳糖修饰的PEI1.8 kDa, 通过PBA与半乳糖间生成的硼酸酯键将小分子量PEI交联成大分子量基因载体(图 4)。该载体可在溶酶体酸性环境和在细胞质中高浓度ATP的作用下发生响应性降解, 这种双重刺激响应性使得载体具备较高的转染效率及较低的细胞毒性。
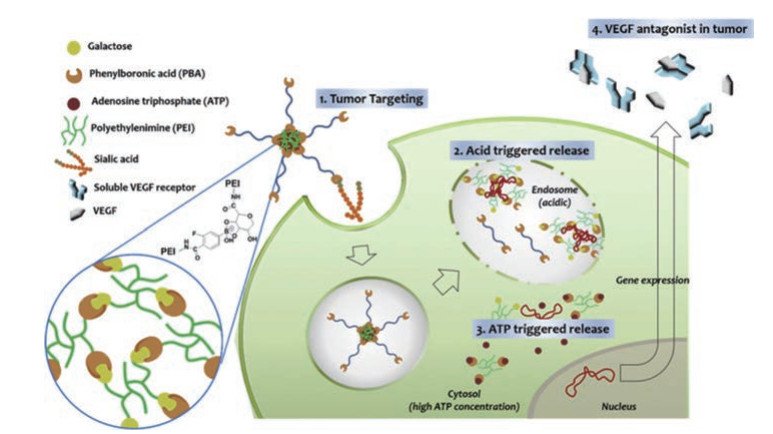
|
Figure 4 Schematic illustration of anti-angiogenic gene delivery mediated by PBA-PEG-cross PEI vector with multi-step: tumor targeting by PBA moity (1), intracellular pH and ATP dual-responsive gene release (2, 3), expression of soluble VEGF antagonist for anti-angiogenic tumor growth inhibition (4). VEGF: Vascular endothelial growth factor. (Adapted from Ref. 136 with permission. Copyright © 2015 Elsevier Ltd. All rights reserved) |
为了进一步提高载体的靶向蓄积能力, 可使用可控性较强的外源性刺激与内源性刺激相结合的方式进行基因递送。Wang等[137]将金纳米棒与小分子量PEI通过二硫键交联制备光/GSH双重响应型载体。金纳米棒在红外光的照射下可产生光热效应, 进而导致溶酶体破裂而促进基因载体的溶酶体逃逸, 随后在细胞质中高浓度GSH的作用下二硫键发生断裂, 最终使得基因载体解离并释放目的基因。研究结果表明, 与单纯的大分子量PEI25 kDa载体相比, 此载体在具备较低的细胞毒性的同时, 基因转染效率提高了32倍。此外, He等[138]将光敏剂共轭连接在PEI600 Da, 并将其包覆在纳米粒上, 接着继续在该纳米粒上修饰含有二硒键的聚合物材料。该载体进入细胞后, 在808 nm近红外光的照射下, 纳米粒核心发射出540 nm光激活光敏剂以促进ROS的产生, 产生的ROS可降解二硒键, 从而使得涂层裂解并促进目的基因的释放。Zhang等[139]使用小分子量PEI1.8 kDa与PEG-PBA修饰聚多巴胺纳米粒制备pH/光响应型基因载体。当该载体内吞入胞并进入内涵体时, PBA与聚多巴胺核心之间的硼酸酯键断裂, 载体发生解离的同时促进基因的释放。与此同时, 在808 nm近红外光照射下, 纳米粒所产生的光热效应能够破坏内涵体膜结构, 帮助基因及载体快速逃逸内涵体。研究结果表明, 该载体的基因转染效率是脂质体2000/DNA复合物的2倍。Mok等[140]使用磁响应性氧化铁作为载体核心并在其表面包覆PEI25 kDa、siRNA和氯霉素3种分子形成基因载体, 再采用酸敏感的柠檬酸酐键封闭PEI中伯胺基团以增强载体生物相容性, 并赋予基因载体pH/磁双重响应性。结果表明, 该载体具有长期稳定性及良好的磁性能, 在酸性pH条件下对C6胶质瘤细胞表现出明显的抗肿瘤作用及基因沉默效率。
4 结语综上所述, PEI以其良好的基因压缩能力和溶酶体逃逸能力在基因载体的应用方面得到了广泛的研究。近年来, 通过对PEI进行表面修饰, 一定程度上提高了其生物相容性、靶向性及质子缓冲能力, 改善了其降解性。此外, 研究者们进一步设计了多种智能响应型载体, 从而更加精确地控制了基因的释放。尽管如此, 将PEI应用于临床仍然存在巨大的挑战, 仍需进一步对基于PEI的基因载体进行改造, 使其兼具更精确的基因释放、更高的转染效率及更低的细胞毒性。
作者贡献:江翠平和刘强参与综述的撰写与修改; 王媛、肖海燕和赵海越参与文献检索及部分内容撰写工作。
利益冲突:全体作者声明无任何利益冲突。
| [1] |
Friedmann T, Roblin R. Gene therapy for human genetic disease?[J]. Science, 1972, 175: 949-955. DOI:10.1126/science.175.4025.949 |
| [2] |
Xu JJ, Wang S, Kou PX, et al. Research progress of tumor gene therapy[J]. Chin J General Pract (中华全科医学), 2017, 15: 655-658. |
| [3] |
Gowing G, Svendsen S, Svendsen CN. Ex vivo gene therapy for the treatment of neurological disorders[J]. Prog Brain Res, 2017, 230: 99-132. DOI:10.1016/bs.pbr.2016.11.003 |
| [4] |
Philippidis A. Kymriah, first CAR-T cancer immunotherapy approved by FDA[J]. Clinic Omics, 2017, 4: 8. |
| [5] |
Fraldi A, Serafini M, Sorrentino NC, et al. Gene therapy for mucopolysaccharidoses:in vivo and ex vivo approaches[J]. Ital J Pediatr, 2018, 44: 130. DOI:10.1186/s13052-018-0565-y |
| [6] |
Ibraheem D, Elaissari A, Fessi H. Gene therapy and DNA delivery systems[J]. Int J Pharm, 2014, 459: 70-83. DOI:10.1016/j.ijpharm.2013.11.041 |
| [7] |
Yang LP, Cao L, Zhao T, et al. The progress of multifunctional envelope-type nano device[J]. Acta Pharm Sin (药学学报), 2018, 53: 50-56. |
| [8] |
Qin LH, Cao DW, Pan SR, et al. Construction of serum-resistant cationic polymer α-CD-PAMAM and evaluation of its performances as gene delivery vector[J]. Acta Pharm Sin (药学学报), 2017, 52: 139-145. |
| [9] |
Chen Y, Hu JF, Zhang CL, et al. Synthesis and evaluation of a dendritic poly (L-glutamic acid) -graft-polyethylenimine copolymer as an efficient gene delivery vector[J]. Acta Pharm Sin (药学学报), 2019, 54: 173-180. |
| [10] |
Tong HJ, Fernandes JC, Liu L, et al. Progress and prospects of chitosan and its derivatives as non-viral gene vectors in gene therapy[J]. Curr Gene Ther, 2009, 9: 495-502. DOI:10.2174/156652309790031111 |
| [11] |
Jiang C, Chen J, Li Z, et al. Recent advances in the development of polyethylenimine-based gene vectors for safe and efficient gene delivery[J]. Expert Opin Drug Deliv, 2019, 16: 363-376. DOI:10.1080/17425247.2019.1604681 |
| [12] |
Yang D, Zhou Q, Fan GT. Research advances of polyethylenimine as gene transfection vector[J]. Chin Med Biotechnol (中国医药生物技术), 2007, 2: 308-309. |
| [13] |
Patnaik S, Gupta KC. Novel polyethylenimine-derived nanoparticles for in vivo gene delivery[J]. Expert Opin Drug Deliv, 2013, 10: 215-228. DOI:10.1517/17425247.2013.744964 |
| [14] |
Zhang YH, Chen Y, Zhang YM, et al. Recycling gene carrier with high efficiency and low toxicity mediated by L-cystine-bridged bis(beta-cyclodextrin)s[J]. Sci Rep, 2014, 4: 7471. |
| [15] |
Li JM, Wang YY, Zhang W, et al. Low-weight polyethylenimine cross-linked 2-hydroxypopyl-beta-cyclodextrin and folic acid as an efficient and nontoxic siRNA carrier for gene silencing and tumor inhibition by VEGF siRNA[J]. Int J Nanomed, 2013, 8: 2101-2117. |
| [16] |
Ihm JE, Krier I, Lim JM, et al. Improved biocompatibility of polyethylenimine (PEI) as a gene carrier by conjugating urocanic acid:in vitro and in vivo[J]. Macromol Res, 2015, 23: 387-395. DOI:10.1007/s13233-015-3047-8 |
| [17] |
Doura T, Tamanoi F, Nakamura M. Miniaturization of thiol-organosilica nanoparticles induced by an anionic surfactant[J]. J Colloid Interface Sci, 2018, 526: 51-62. DOI:10.1016/j.jcis.2018.04.090 |
| [18] |
Chithrani BD, Chan WCW. Elucidating the mechanism of cellular uptake and removal of protein-coated gold nanoparticles of different sizes and shapes[J]. Nano Lett, 2007, 7: 1542-1550. DOI:10.1021/nl070363y |
| [19] |
Shi W, Wang J, Fan X, et al. Size and shape effects on diffusion and absorption of colloidal particles near a partially absorbing sphere:implications for uptake of nanoparticles in animal cells[J]. Phys Rev E Stat Nonlin Soft Matter Phys, 2008, 78: 061914. DOI:10.1103/PhysRevE.78.061914 |
| [20] |
Frohlich E. The role of surface charge in cellular uptake and cytotoxicity of medical nanoparticles[J]. Int J Nanomed, 2012, 7: 5577-5591. |
| [21] |
Han S, Wan H, Lin D, et al. Contribution of hydrophobic/hydrophilic modification on cationic chains of poly(ε-caprolactone)-graft-poly(dimethylamino ethylmethacrylate) amphiphilic co-polymer in gene delivery[J]. Acta Biomater, 2014, 10: 670-679. DOI:10.1016/j.actbio.2013.09.035 |
| [22] |
Martens TF, Remaut K, Demeester J, et al. Intracellular delivery of nanomaterials:how to catch endosomal escape in the act[J]. Nano Today, 2014, 9: 344-364. DOI:10.1016/j.nantod.2014.04.011 |
| [23] |
Lechardeur D, Lukacs GL. Intracellular barriers to non-viral gene transfer[J]. Curr Gene Ther, 2002, 2: 183-194. DOI:10.2174/1566523024605609 |
| [24] |
Lu J, Zhao Y, Zhou X, et al. Biofunctional polymer-lipid hybrid high density lipoprotein-mimicking nanoparticles loading anti-miR155 for combined antiatherogenic effects on macrophages[J]. Biomacromolecules, 2017, 18: 2286-2295. DOI:10.1021/acs.biomac.7b00436 |
| [25] |
Rejman J, Bragonzi A, Conese M. Role of clathrin- and caveolae-mediated endocytosis in gene transfer mediated by lipo- and polyplexes[J]. Mol Ther, 2005, 12: 468-474. DOI:10.1016/j.ymthe.2005.03.038 |
| [26] |
Vongersdorff K, Sanders N, Vandenbroucke R, et al. The internalization route resulting in successful gene expression depends on both cell line and polyethylenimine polyplex type[J]. Mol Ther, 2006, 14: 745-753. DOI:10.1016/j.ymthe.2006.07.006 |
| [27] |
Pei D, Buyanova M. Overcoming endosomal entrapment in drug delivery[J]. Bioconjug Chem, 2018, 30: 273-283. |
| [28] |
Lee Y, Miyata K, Oba M, et al. Charge-conversion ternary polyplex with endosome disruption moiety:a technique for efficient and safe gene delivery[J]. Angew Chem, 2008, 47: 5163-5166. DOI:10.1002/anie.200800963 |
| [29] |
Neu M, Fischer D, Kissel T. Recent advances in rational gene transfer vector design based on poly(ethylene imine) and its derivatives[J]. J Gene Med, 2005, 7: 992-1009. DOI:10.1002/jgm.773 |
| [30] |
Beyerle A, Irmler M, Beckers J, et al. Toxicity pathway focused gene expression profiling of PEI-based polymers for pulmonary applications[J]. Mol Pharm, 2010, 7: 727-737. DOI:10.1021/mp900278x |
| [31] |
Grandinetti G, Ingle NP, Reineke TM. Interaction of poly(ethylenimine)-DNA polyplexes with mitochondria:implications for a mechanism of cytotoxicity[J]. Mol Pharm, 2011, 8: 1709-1719. DOI:10.1021/mp200078n |
| [32] |
Shi S, Guo Q, Kan B, et al. A novel poly(ε-caprolactone)-pluronic-poly(ε-caprolactone) grafted polyethyleneimine (PCFC-g-PEI), part 1, synthesis, cytotoxicity, and in vitro transfection study[J]. BMC Biotechnol, 2009, 9: 65. DOI:10.1186/1472-6750-9-65 |
| [33] |
Suk JS, Xu Q, Kim N, et al. PEGylation as a strategy for improving nanoparticle-based drug and gene delivery[J]. Adv Drug Deliv Rev, 2015, 99: 28-51. |
| [34] |
Somani S, Laskar P, Altwaijry N, et al. PEGylation of polypropylenimine dendrimers:effects on cytotoxicity, DNA condensation, gene delivery and expression in cancer cells[J]. Sci Rep, 2018, 8: 9410. DOI:10.1038/s41598-018-27400-6 |
| [35] |
Wang Y, Zhao D, Wei X, et al. PEGylated polyethylenimine derivative-mediated local delivery of the shSmad3 inhibits intimal thickening after vascular injury[J]. Biomed Res Int, 2019, 2019: 8483765. |
| [36] |
Cai J, Chen J, Huang P, et al. Study on PEGylated polyethylenimine as a non-viral gene delivery vector[J]. Chin J Pharm (中国医药工业杂志), 2006, 38: 22-26. |
| [37] |
Hatakeyama H, Akita H, Harashima H. The polyethyleneglycol dilemma:advantage and disadvantage of PEGylation of liposomes for systemic genes and nucleic acids delivery to tumors[J]. Biol Pharm Bull, 2013, 36: 892-899. DOI:10.1248/bpb.b13-00059 |
| [38] |
Nie Y, Günther M, Gu Z, et al. Pyridylhydrazone-based PEGylation for pH-reversible lipopolyplex shielding[J]. Biomaterials, 2011, 32: 858-869. DOI:10.1016/j.biomaterials.2010.09.032 |
| [39] |
Patnaik S, Aggarwal A, Nimesh S, et al. PEI-alginate nanocomposites as efficient in vitro gene transfection agents[J]. J Control Release, 2006, 114: 398-409. DOI:10.1016/j.jconrel.2006.06.025 |
| [40] |
Yao J, Fan Y, Du R, et al. Amphoteric hyaluronic acid derivative for targeting gene delivery[J]. Biomaterials, 2010, 31: 9357-9365. DOI:10.1016/j.biomaterials.2010.08.043 |
| [41] |
Lo YL, Lo PC, Chiu CC, et al. Folic acid linked chondroitin sulfate-polyethyleneimine copolymer based gene delivery system[J]. J Biomed Nanotechnol, 2015, 11: 1385-1400. DOI:10.1166/jbn.2015.2081 |
| [42] |
Jeon O, Yang HS, Lee TJ, et al. Heparin-conjugated polyethylenimine for gene delivery[J]. J Control Release, 2008, 132: 236-242. DOI:10.1016/j.jconrel.2008.05.017 |
| [43] |
Haiping J, Sujuan W, Xuefei Z, et al. New path to treating pancreatic cancer:TRAIL gene delivery targeting the fibroblast-enriched tumor microenvironment[J]. J Control Release, 2018, 286: 254-263. DOI:10.1016/j.jconrel.2018.07.047 |
| [44] |
Yang S, Guo Z, Yang X, et al. Enhanced survivin siRNA delivery using cationic liposome incorporating fatty acid-modified polyethylenimine[J]. Chem Res Chin Univ, 2015, 31: 401-405. DOI:10.1007/s40242-015-5060-z |
| [45] |
Lin L, Gou ZP, Chen J, et al. Synthesis and characterization of polyphenylalanine grafted low molecular weight PEI as efficient gene carriers[J]. Acta Polym Sin (高分子学报), 2017, 48: 191-198. |
| [46] |
Yuan CC, Zhong SY, Wang YH, et al. Low molecular weight PEI of α-tocopherol-modification as gene delivery vectors[J]. Sci Technol Eng (科学技术与工程), 2018, 18: 35-39. |
| [47] |
Taranejoo S, Chandrasekaran R, Cheng W, et al. Bioreducible PEI-functionalized glycol chitosan:a novel gene vector with reduced cytotoxicity and improved transfection efficiency[J]. Carbohydr Polym, 2016, 153: 160-168. DOI:10.1016/j.carbpol.2016.07.080 |
| [48] |
Yamada H, Loretz B, Lehr CM. Design of starch-graft-PEI polymers:an effective and biodegradable gene delivery platform[J]. Biomacromolecules, 2014, 15: 1753-1761. DOI:10.1021/bm500128k |
| [49] |
Zhang Y, Jiang Q, Bi B, et al. A bioreducible supramolecular nanoparticle gene delivery system based on cyclodextrin-conjugated polyaspartamide and adamantyl-terminated polyethylenimine[J]. J Mater Chem B, 2018, 6: 797-808. DOI:10.1039/C7TB02170D |
| [50] |
Li Y, Zhang X, Zhang J, et al. Synthesis and characterization of a hyperbranched grafting copolymer PEI-g-PLeu for gene and drug co-delivery[J]. J Mater Sci Mater Med, 2018, 29: 47. DOI:10.1007/s10856-018-6057-1 |
| [51] |
Noga M, Edinger D, Wagner E, et al. Characterization and compatibility of hydroxyethyl starch-polyethylenimine copolymers for DNA delivery[J]. J Biomater Sci Polym Ed, 2014, 25: 855-871. DOI:10.1080/09205063.2014.910152 |
| [52] |
Wang H, Li X, Ling C, et al. Cationic starch/pDNA nanocomplexes assembly and their nanostructure changes on gene transfection efficiency[J]. Sci Rep, 2017, 7: 14844. DOI:10.1038/s41598-017-14551-1 |
| [53] |
Giron-Gonzalez MD, Salto-Gonzalez R, Lopez-Jaramillo FJ, et al. Polyelectrolyte complexes of low molecular weight PEI and citric acid as efficient and nontoxic vectors for in vitro and in vivo gene delivery[J]. Bioconjug Chem, 2016, 27: 549-561. DOI:10.1021/acs.bioconjchem.5b00576 |
| [54] |
Adachi M, Kai K, Yamaji K, et al. Transferrin receptor 1 overexpression is associated with tumour de-differentiation and acts as a potential prognostic indicator of hepatocellular carcinoma[J]. Histopathology, 2019, 75: 63-73. DOI:10.1111/his.13847 |
| [55] |
Normanno N, De Luca A, Bianco C, et al. Epidermal growth factor receptor (EGFR) signaling in cancer[J]. Gene, 2006, 366: 2-16. DOI:10.1016/j.gene.2005.10.018 |
| [56] |
Ribeiro RSG, Belderbos S, Danhier P, et al. Targeting tumor cells and neovascularization using RGD-functionalized magnetoliposomes[J]. Int J Nanomed, 2019, 14: 5911-5924. DOI:10.2147/IJN.S214041 |
| [57] |
Sun Y, Zhao Y, Teng S, et al. Folic acid receptor-targeted human serum albumin nanoparticle formulation of cabazitaxel for tumor therapy[J]. Int J Nanomed, 2018, 14: 135-148. DOI:10.2147/IJN.S181296 |
| [58] |
Chen XA, Deng YB. Progress of nanometer vector polyethylenimine applied in gene therapy[J]. J Biomed Eng (生物医学工程学杂志), 2011, 28: 195-198. |
| [59] |
Jhaveri A, Deshpande P, Pattni B, et al. Transferrin-targeted, resveratrol-loaded liposomes for the treatment of glioblastoma[J]. J Control Release, 2018, 277: 89-101. DOI:10.1016/j.jconrel.2018.03.006 |
| [60] |
Ayyappan S, Prabhakar D, Sharma N. Epidermal growth factor receptor (EGFR)-targeted therapies in esophagogastric cancer[J]. Anticancer Res, 2013, 33: 4139-4155. |
| [61] |
Lei Y, Wang J, Xie C, et al. Glutathione-sensitive RGD-poly(ethylene glycol)-ss-polyethylenimine for intracranial glioblastoma targeted gene delivery[J]. J Gene Med, 2013, 15: 291-305. |
| [62] |
Li Z, Liu X, Chen X, et al. Targeted delivery of Bcl-2 conversion gene by MPEG-PCL-PEI-FA cationic copolymer to combat therapeutic resistant cancer[J]. Mater Sci Eng C, 2017, 76: 66-72. DOI:10.1016/j.msec.2017.02.163 |
| [63] |
Zhu XW, Su TJ, Zhang YH, et al. In vitro gene transfection of human transferrin coupled crosslinked PEI as tumor targeted gene vector[J]. J Biol (生物学杂志), 2013, 30: 14-17. |
| [64] |
Gersdorff KV, Ogris M, Wagner E. Cryoconserved shielded and EGF receptor targeted DNA polyplexes:cellular mechanisms[J]. Eur J Pharm Biopharm, 2005, 60: 279-285. DOI:10.1016/j.ejpb.2004.08.014 |
| [65] |
Kunath K, Merdan T, Hegener O, et al. Integrin targeting using RGD-PEI conjugates for in vitro gene transfer[J]. J Gene Med, 2003, 5: 588-599. DOI:10.1002/jgm.382 |
| [66] |
Leroueil PR, Dimaggio S, Leistra AN, et al. Characterization of folic acid and poly(amidoamine) dendrimer interactions with folate binding protein:a force-pulling study[J]. J Phys Chem B, 2015, 119: 11506-11512. DOI:10.1021/acs.jpcb.5b05391 |
| [67] |
Wang Y, Sun G, Gong Y, et al. Functionalized folate-modified graphene oxide/PEI siRNA nanocomplexes for targeted ovarian cancer gene therapy[J]. Nanoscale Res Lett, 2020, 15: 57. DOI:10.1186/s11671-020-3281-7 |
| [68] |
Iqbal N, Iqbal N. Human epidermal growth factor receptor 2(HER2) in cancers:overexpression and therapeutic implications[J]. Mol Biol Int, 2014, 2014: 852748. |
| [69] |
Chiu SJ, Ueno NT, Lee RJ. Tumor-targeted gene delivery via anti-HER2 antibody (trastuzumab, Herceptin) conjugated polyethylenimine[J]. J Control Release, 2004, 97: 357-369. DOI:10.1016/j.jconrel.2004.03.019 |
| [70] |
Lai WF, Wong WT. Design of polymeric gene carriers for effective intracellular delivery[J]. Trends Biotechnol, 2018, 36: 713-728. DOI:10.1016/j.tibtech.2018.02.006 |
| [71] |
Shi B, Zheng M, Tao W, et al. Challenges in DNA delivery and recent advances in multifunctional polymeric DNA delivery system[J]. Biomacromolecules, 2017, 18: 2231-2246. DOI:10.1021/acs.biomac.7b00803 |
| [72] |
Wang YJ, Zhou Q, Cao S, et al. Efficient gene therapy with a combination of ultrasound‑targeted microbubble destruction and PEI/DNA/NLS complexes[J]. Mol Med Rep, 2016, 68. |
| [73] |
Zhang MP, Ding BY, Chen RB, et al. Application of polyethyleneimine and its derivatives in non-viral gene therapy[J]. Clin J Chin Med (中医临床研究), 2015, 7: 126-128. |
| [74] |
Fan Y, Yao J, Zhou JP. Preparation of nucleus-targeting polyethyleneimine-dexamethasone conjugates and their application for gene delivery[J]. Chem J Chin Univ (高等学校化学学报), 2011, 32: 220-226. |
| [75] |
Ihm JE, Krier I, Lim JM. Improved biocompatibility of polyethylenimine (PEI) as a gene carrier by conjugating urocanic acid:in vitro and in vivo[J]. Macromol Res, 2015, 23: 387-395. DOI:10.1007/s13233-015-3047-8 |
| [76] |
Huang G, Chen Q, Wu W, et al. Reconstructed chitosan with alkylamine for enhanced gene delivery by promoting endosomal escape[J]. Carbohydr Polym, 2019, 227: 115339. |
| [77] |
Hu Y, Wang HF, Song HQ, et al. Peptide-grafted dextran vectors for efficient and high-loading gene delivery[J]. Biomater Sci, 2019, 7: 1543-1553. DOI:10.1039/C8BM01341A |
| [78] |
Deng QR, Li XD, Zhu LP, et al. Serum-resistant, reactive oxygen species (ROS)-potentiated gene delivery in cancer cells mediated by fluorinated, diselenide-crosslinked polyplexes[J]. Biomater Sci, 2017, 5: 1174-1182. DOI:10.1039/C7BM00334J |
| [79] |
Liu MR, Du HL, Zhang WJ, et al. Internal stimuli-responsive nanocarriers for drug delivery:design strategies and applications[J]. Mater Sci Eng C, 2017, 71: 1267-1280. DOI:10.1016/j.msec.2016.11.030 |
| [80] |
Dehnel N, Moral J, Namgaladzel D, et al. Cancer cell and macrophage cross-talk in the tumor microenvironment[J]. Curr Opin Pharm, 2017, 35: 12-19. DOI:10.1016/j.coph.2017.04.007 |
| [81] |
Yahara T, Koga T, Yoshida S, et al. Relationship between microvessel density and thermographic hot areas in breast cancer[J]. Surg Today, 2003, 33: 243-248. DOI:10.1007/s005950300055 |
| [82] |
Liao LF, Jiang G. Research progress for stimuli-responsive combination therapy system based on nanocarriers[J]. Chin J Hosp Pharm (中国医院药学杂志), 2019, 39: 109-113. |
| [83] |
Kanamala M, Wilson WR, Yang MM, et al. Mechanisms and biomaterials in pH-responsive tumour targeted drug delivery:a review[J]. Biomaterials, 2016, 85: 152-167. DOI:10.1016/j.biomaterials.2016.01.061 |
| [84] |
Huang DC, Qian HL, Qiao HS, et al. Bioresponsive functional nanogels as an emerging platform for cancer therapy[J]. Expert Opin Drug Deliv, 2018, 15: 703-716. DOI:10.1080/17425247.2018.1497607 |
| [85] |
Che HL, van Hest JCM. Stimuli-responsive polymersomes and nanoreactors[J]. J Mater Chem B, 2016, 4: 4632-4647. DOI:10.1039/C6TB01163B |
| [86] |
Guo X, Yuan Z, Xu Y, et al. A Low-molecular-weight polyethylenimine/pDNA-VEGF polyplex system constructed in a one-pot manner for hindlimb ischemia therapy[J]. Pharmaceutics, 2019, 11: 171. DOI:10.3390/pharmaceutics11040171 |
| [87] |
Long RM, Dai QL, Zhou X, et al. Bacterial magnetosomes-based nanocarriers for co-delivery of cancer therapeutics in vitro[J]. Int J Nanomed, 2018, 13: 8269-8279. DOI:10.2147/IJN.S180503 |
| [88] |
Benns JM, Choi JS, Mahato RI, et al. pH-sensitive cationic polymer gene delivery vehicle:N-Ac-poly(L-histidine)-graft-poly(L-lysine) comb shaped polymer[J]. Bioconjug Chem, 2000, 11: 637-645. DOI:10.1021/bc0000177 |
| [89] | |
| [90] |
Guo AJ, Wang Y, Xu SH, et al. Preparation and evaluation of pH-responsive charge-convertible ternary complex FA-PEI-CCA/PEI/DNA with low cytotoxicity and efficient gene delivery[J]. Colloids Surf B, 2017, 152: 58-67. DOI:10.1016/j.colsurfb.2017.01.007 |
| [91] |
Lu J, Zhao Y, Zhou XJ, et al. Biofunctional polymer lipid hybrid high-density lipoprotein mimicking nanoparticles loading anti-miR155 for combined antiatherogenic effects on macrophages[J]. Biomacromolecules, 2017, 18: 2286-2295. DOI:10.1021/acs.biomac.7b00436 |
| [92] |
Tan DQ, Suda T. Reactive oxygen species and mitochondrial homeostasis as regulators of stem cell fate and function[J]. Antioxid Redox Signal, 2018, 29: 149-168. DOI:10.1089/ars.2017.7273 |
| [93] |
Xu XD, Saw PE, Tao W, et al. ROS-responsive polyprodrug nanoparticles for triggered drug delivery and effective cancer therapy[J]. Adv Mater, 2017, 29: 201700141. |
| [94] |
Zheng N, Xie D, Zhang ZY, et al. Thioketal-crosslinked:ROS-degradable polycations for enhanced in vitro and in vivo gene delivery with self-diminished cytotoxicity[J]. J Biomater Appl, 2019, 34: 326-338. DOI:10.1177/0885328219845081 |
| [95] |
Lin GQ, Yi WJ, Liu Q, et al. Aromatic thioacetal-bridged ROS-responsive nanoparticles as novel gene delivery vehicles[J]. Molecules, 2018, 23: 2061. DOI:10.3390/molecules23082061 |
| [96] |
Zhang WX, Zhou Y, Li XD, et al. Macrophage-targeting and reactive oxygen species (ROS)-responsive nanopolyplexes mediate anti-inflammatory siRNA delivery against acute liver failure (ALF)[J]. Biomater Sci, 2018, 6: 1986-1993. DOI:10.1039/C8BM00389K |
| [97] |
Ruan C, Liu L, Wang Q, et al. Reactive oxygen species-biodegradable gene carrier for the targeting therapy of breast cancer[J]. ACS Appl Mater Interfaces, 2018, 10: 10398-10408. DOI:10.1021/acsami.8b01712 |
| [98] |
Wang LH, Wu T, Wu DC, et al. Bioreducible gene delivery vector capable of self-scavenging the intracellular-generated ROS exhibiting high gene transfection[J]. ACS Appl Mater Interfaces, 2016, 8: 19238-19244. DOI:10.1021/acsami.6b04327 |
| [99] |
Zintchenko A, Ogris M, Wagner E. Temperature dependent gene expression induced by PNIPAM-based copolymers:potential of hyperthermia in gene transfer[J]. Bioconjug Chem, 2006, 17: 766-772. DOI:10.1021/bc050292z |
| [100] |
Schafer FQ, Buettner GR. Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple[J]. Free Radical Biol Med, 2001, 30: 1191-1212. DOI:10.1016/S0891-5849(01)00480-4 |
| [101] |
Cheng R, Feng F, Meng FH, et al. Glutathione-responsive nano-vehicles as a promising platform for targeted intracellular drug and gene delivery[J]. J Control Release, 2011, 152: 2-12. DOI:10.1016/j.jconrel.2011.01.030 |
| [102] |
Chen GJ, Ma B, Wang YY, et al. A universal GSH-responsive nanoplatform for the delivery of DNA, mRNA, and Cas9/sgRNA ribonucleoprotein[J]. ACS Appl Mater Interfaces, 2018, 10: 18515-18523. DOI:10.1021/acsami.8b03496 |
| [103] |
Chen HC, Liu DY, Guo ZJ. Endogenous stimuli-responsive nanocarriers for drug delivery[J]. Chem Lett, 2016, 45: 242-249. DOI:10.1246/cl.151176 |
| [104] |
Taranejoo S, Chandrasekaran R, Cheng WL, et al. Bioreducible PEI-functionalized glycol chitosan:a novel gene vector with reduced cytotoxicity and improved transfection efficiency[J]. Carbohydr Polym, 2016, 153: 160-168. DOI:10.1016/j.carbpol.2016.07.080 |
| [105] |
Dai Y, Zhang XJ. MicroRNA delivery with bioreducible polyethylenimine as a non-viral vector for breast cancer gene therapy[J]. Macromol Biosci, 2019, 19: e1800445. DOI:10.1002/mabi.201800445 |
| [106] |
Saravanakumar K, Hu XW, Ali DM, et al. Emerging strategies in stimuli-responsive nanocarriers as the drug delivery system for enhanced cancer therapy[J]. Curr Pharm Des, 2019, 25: 2609-2625. DOI:10.2174/1381612825666190709221141 |
| [107] |
Yuan ZQ, Gobeil PAM, Campo MS, et al. Equine sarcoid fibroblasts over-express matrix metalloproteinases and are invasive[J]. Virology, 2010, 396: 143-151. DOI:10.1016/j.virol.2009.10.010 |
| [108] |
Yu JE, Han SY, Wolfson B, et al. The role of endothelial lipase in lipid metabolism, inflammation, and cancer[J]. Histol Histopathol, 2018, 33: 1-10. |
| [109] |
Gao J, Yu H, Chen FY, et al. A hyaluronidase/ATP tandem stimuli-responsive supramolecular assembly[J]. Chem Commun, 2019, 55: 14387-14390. DOI:10.1039/C9CC08199B |
| [110] |
Yin T, Liu J, Zhao Z, et al. Smart nanoparticles with a detachable outer shell for maximized synergistic antitumor efficacy of therapeutics with varying physicochemical properties[J]. J Control Release, 2016, 243: 54-68. DOI:10.1016/j.jconrel.2016.09.036 |
| [111] |
Qian CG, Chen YL, Zhu S, et al. ATP-responsive and near-infrared-emissive nanocarriers for anticancer drug delivery and real-time imaging[J]. Theranostics, 2016, 6: 1053-1064. DOI:10.7150/thno.14843 |
| [112] |
Jiang CP, Qi ZT, Jia HB, et al. ATP-responsive low-molecular-weight polyethylenimine-based supramolecular assembly via host-guest interaction for gene delivery[J]. Biomacromolecules, 2019, 20: 1132-1133. DOI:10.1021/acs.biomac.9b00091 |
| [113] |
Yoshida K, Kashimura Y, Kamijo T, et al. Decomposition of glucose-sensitive layer-by-layer films using hemin, DNA, and glucose oxidase[J]. Polymers, 2020, 12: 319. DOI:10.3390/polym12020319 |
| [114] |
Jochum FD, Theato P. Temperature- and light-responsive smart polymer materials[J]. Chem Soc Rev, 2013, 42: 7468-7483. DOI:10.1039/C2CS35191A |
| [115] |
Jia S, Fong WK, Graham B, et al. Photoswitchable molecules in long-wavelength light-responsive drug delivery:from molecular design to applications[J]. Chem Mater, 2018, 30: 2873-2887. DOI:10.1021/acs.chemmater.8b00357 |
| [116] |
Fomina N, McFearin C, Sermsakdi M, et al. UV and near-IR triggered release from polymeric nanoparticles[J]. J Am Chem Soc, 2010, 132: 9540-9542. DOI:10.1021/ja102595j |
| [117] |
Jiang BC, He H, Yao L, et al. Harmonizing the intracellular kinetics toward effective gene delivery using cancer cell-targeted and light-degradable polyplexes[J]. Biomacromolecules, 2017, 18: 877-885. DOI:10.1021/acs.biomac.6b01774 |
| [118] |
Menon S, Das S. Photoresponsive self-assembling structures from a pyrene-based triblock copolymer[J]. Polym Chem, 2011, 49: 4448-4457. DOI:10.1002/pola.24886 |
| [119] |
Wang H, Miao WJ, Wang F, et al. A Self-assembled coumarin-anchored dendrimer for efficient gene delivery and light-responsive drug delivery[J]. Biomacromolecules, 2018, 19: 2194-2201. DOI:10.1021/acs.biomac.8b00246 |
| [120] |
Tung ST, Cheng HT, Inthasot A, et al. Interlocked photo-degradable macrocycles allow one-off photo-triggerable gelation of organo- and hydrogelators[J]. Chemistry, 2018, 24: 1522-1527. DOI:10.1002/chem.201705753 |
| [121] |
Lee H, Kim Y, Schweickert PG, et al. A photo-degradable gene delivery system for enhanced nuclear gene transcription[J]. Biomaterials, 2014, 35: 1040-1049. DOI:10.1016/j.biomaterials.2013.10.030 |
| [122] |
Zhou Q, Zhang L, Yang TH, et al. Stimuli-responsive polymeric micelles for drug delivery and cancer therapy[J]. Int J Nanomed, 2018, 13: 2921-2942. DOI:10.2147/IJN.S158696 |
| [123] |
Sponchioni M, Palmiero UC, Moscatelli D. Thermo-responsive polymers:applications of smart materials in drug delivery and tissue engineering[J]. Mater Sci Eng C, 2019, 102: 589-605. DOI:10.1016/j.msec.2019.04.069 |
| [124] |
Raza A, Rasheed T, Nabeel F, et al. Endogenous and exogenous stimuli-responsive drug delivery systems for programmed site-specific release[J]. Molecules, 2019, 24: 1117. DOI:10.3390/molecules24061117 |
| [125] |
Kuo CY, Liu TY, Wang KS, et al. Magnetic and thermal-sensitive poly(N-isopropylacrylamide)-based microgels for magnetically triggered controlled release[J]. J Visual Exp, 2017, 125: 55648. |
| [126] |
Zhang HZ, Li QB, Zhang YY, et al. A nanogel with passive targeting function and adjustable polyplex surface properties for efficient anti-tumor gene therapy[J]. Rsc Adv, 2016, 6: 84445-84456. DOI:10.1039/C6RA13707E |
| [127] |
Gupta AK, Naregalkar RR, Vaidya VD, et al. Recent advances on surface engineering of magnetic iron oxide nanoparticles and their biomedical applications[J]. Nanomedicine, 2007, 2: 23-39. DOI:10.2217/17435889.2.1.23 |
| [128] |
Guruprasath P, Kim J, Gunassekaran GR, et al. Interleukin-4 receptor-targeted delivery of Bcl-xL siRNA sensitizes tumors to chemotherapy and inhibits tumor growth[J]. Biomaterials, 2017, 142: 101-111. DOI:10.1016/j.biomaterials.2017.07.024 |
| [129] |
Lo YL, Chou HL, Liao ZX, et al. Chondroitin sulfate-polyethylenimine copolymer-coated superparamagnetic iron oxide nanoparticles as an efficient magneto-gene carrier for microRNA-encoding plasmid DNA delivery[J]. Nanoscale, 2015, 7: 8554-8565. DOI:10.1039/C5NR01404B |
| [130] |
Jia N, Wu HA, Duan JL, et al. Polyethyleneimine-coated iron oxide nanoparticles as a vehicle for the delivery of small interfering RNA to macrophages in vitro and in vivo[J]. J Visual Exp, 2019. DOI:10.3791/58660 |
| [131] |
Karimi M, Zangabad PS, Ghasemi A, et al. Temperature-responsive smart nanocarriers for delivery of therapeutic agents:applications and recent advances[J]. ACS Appl Mater Interfaces, 2016, 8: 21107-21133. DOI:10.1021/acsami.6b00371 |
| [132] |
Morey M, Pandit A. Responsive triggering systems for delivery in chronic wound healing[J]. Adv Drug Del Rev, 2018, 129: 169-193. DOI:10.1016/j.addr.2018.02.008 |
| [133] |
Wang DL, Jin Y, Zhu XY, et al. Synthesis and applications of stimuli-responsive hyperbranched polymers[J]. Prog Polym Sci, 2017, 64: 114-153. DOI:10.1016/j.progpolymsci.2016.09.005 |
| [134] |
Xu F, Zhong H, Chang Y, et al. Targeting death receptors for drug-resistant cancer therapy:codelivery of pTRAIL and monensin using dual-targeting and stimuli-responsive self-assembling nanocomposites[J]. Biomaterials, 2018, 158: 56. DOI:10.1016/j.biomaterials.2017.12.018 |
| [135] |
Wang T, Yu X, Han L, et al. Tumor microenvironment dual-responsive core-shell nanoparticles with hyaluronic acid-shield for efficient co-delivery of doxorubicin and plasmid DNA[J]. Int J Nanomed, 2017, 12: 4773-4788. DOI:10.2147/IJN.S134378 |
| [136] |
Kim J, Lee YM, Kim H, et al. Phenylboronic acid-sugar grafted polymer architecture as a dual stimuli-responsive gene carrier for targeted anti-angiogenic tumor therapy[J]. Biomaterials, 2016, 75: 102-111. DOI:10.1016/j.biomaterials.2015.10.022 |
| [137] |
Wang F, Shen Y, Zhang W, et al. Efficient, dual-stimuli responsive cytosolic gene delivery using a RGD modified disulfide-linked polyethylenimine functionalized gold nanorod[J]. J Control Release, 2014, 196: 37-51. DOI:10.1016/j.jconrel.2014.09.026 |
| [138] |
He Y, Guo S, Wu L, et al. Near-infrared boosted ROS responsive siRNA delivery and cancer therapy with sequentially peeled upconversion nano-onions[J]. Biomaterials, 2019, 225: 119501. DOI:10.1016/j.biomaterials.2019.119501 |
| [139] |
Zhang P, Xu Q, Li X, et al. pH-responsive polydopamine nanoparticles for photothermally promoted gene delivery[J]. Mater Sci Eng C, 2020, 108: 110396. DOI:10.1016/j.msec.2019.110396 |
| [140] |
Mok H, Veiseh O, Fang C, et al. pH-sensitive siRNA nanovector for targeted gene silencing and cytotoxic effect in cancer cells[J]. Mol Pharm, 2010, 7: 1930-1939. DOI:10.1021/mp100221h |
 2020, Vol. 55
2020, Vol. 55


