2. 军事科学院军事医学研究院毒物药物研究所, 北京 100850
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China
3D打印技术(3D printing technology)也被称作快速成型技术, 后被规范称为增材制造(additive manufacturing), 是20世纪80年代兴起的新型制造技术, 其成型原理包括粉液粘结型、挤出型、熔融丝沉积型及立体光固化成型等[1-3]。区别于传统的减材制造, 3D打印技术是通过对原材料的层层叠加而成最终产品, 不需要考虑设备或原材料几何形状的影响, 它通过计算机辅助设计将二维的成像或图像, 转换为三维打印数据用打印机进行打印。近20年来, 3D打印技术在生物医学工程、建筑工程和航天航空等领域取得了实际的应用, 然而3D打印在制药领域仍处于起步阶段[4]。2015年FDA批准上市的药物左乙拉西坦(Spritam®)速溶片, 拉开了这种新型制造技术在药物制剂研究的序幕。与人们设想的一样, 3D打印灵活可控, 尤其在复杂结构设计和特殊功能实现上, 既能节约成本, 又能满足用药人群的精准需求[4, 5]。粉液粘结型3D打印技术近年来广泛应用于药物制剂的研究, 与其他类型的3D打印技术相比, 更加简便、灵活和易操作。同时, 该技术与传统湿法制粒技术相似, 对原辅料性质没有苛刻的要求, 只要药物混粉在暴露环境下的稳定性良好、原辅料粒径适中(一般小于100 μm), 流动性满足铺粉要求即可。此外, 粉液粘结型3D打印技术是最有可能实现批量生产的打印方式。打印机工作原理如图 1所示。在该示意图中, 首先铺粉辊以适当的速度向前铺粉, 同时辊轴也在逆前进方向自身转动。这样可以将粉料更均匀地铺在粉床上, 然后打印头按照计算机设计好的路径以精确的速度, 将打印液或含药打印液喷射到粉床上, 完成这一过程后打印平台即粉床下降一定高度, 铺粉辊重复铺粉, 打印头重复喷射。如此反复, 按照“分层制造、逐层叠加”的原理制备出所需产品[6-9]。未喷射打印液区域的粉末, 可作为打印成品的支撑材料。在随后的产品后处理过程中进行回收再利用。
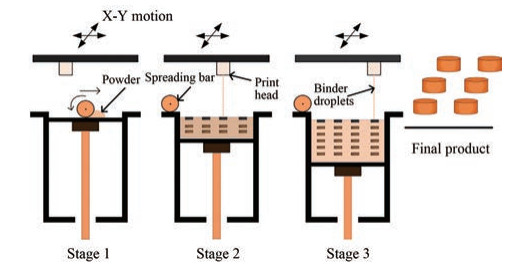
|
Figure 1 Schematic representation of drop-on-powder three-dimensional printing |
基于粉液粘结的打印原理, 首先可调的运行参数较多, 如打印头的运行速度、喷液量、打印头距粉床的高度、粉末铺层厚度和打印液喷涂次数等; 其次材料的性质也是非常重要的可调参数, 如粉体的粒径、粉体的流动性会影响铺粉的效果从而影响成品的最终成型性。打印液的理化性质, 如打印液的黏度、密度和表面张力等会影响打印头喷液的连贯性, 也会影响打印产品的最终成型性[10]。
1 喷液方式和打印头的分类比利时物理学家Plateau和英国物理学家Rayleigh早在18世纪开始液滴喷射技术研究, 直到1946年才有人根据液滴喷射技术原理发明了第一个压电式的按需喷射喷头并获得发明专利[11]。在20世纪80~90年代, 一些科技公司才将喷头商品化。发展至今, 喷头喷液方式可分为两类:连续喷液方式和按需喷射方式[11, 12]。
1.1 连续喷液方式喷嘴喷射液滴时, 墨水在供墨装置的作用下进入喷头, 喷头将墨水连续发射出去, 经过墨滴发生器, 将墨水流断裂成墨水滴。随后, 从电极板之间通过, 因此每个液滴会在电极板中有选择地带上相应的电荷(极化)。在静电板的作用下, 选择落在基板上或回收循环。其过程如图 2所示[13]。这种喷液方式能形成高速墨滴, 提高打印速度, 但是连续喷墨的喷头需要充电装置和液滴回收装置, 使得墨盒结构复杂, 成本升高。该喷射方式在3D打印领域并没有得到实际应用和商业化开发。目前各大打印头生产厂家供应的打印头大部分为按需喷射打印头。
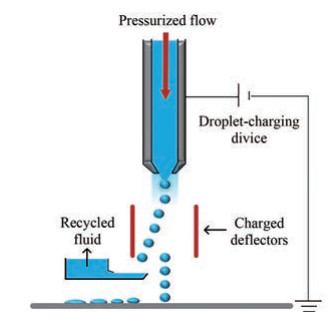
|
Figure 2 Schematic representation of continuous jet |
当控制器发出1次喷射信号时, 喷头会产生1滴液滴; 当产生连续喷射信号时, 也会产生连续的液滴或液流。根据其产生液滴或液流的方式不同, 又将按需喷射分为热泡式和压电式。
1.2.1 热泡式打印头热泡式打印头利用接收到的电脉冲信号迅速加热墨盒中电阻器, 使得靠近电阻处的0.1mm的液体薄层迅速受热形成气泡, 如图 3a所示。这个气泡将液体挤出打印头, 随后气泡破裂, 产生负压, 液腔中重新填满液体。虽然打印液接触高温的面积较小, 且接触时间较短, 但是对于热不稳定的打印液处方受热降解还是具有一定的风险。此外, 热泡式打印头需要使用高蒸气压或挥发性溶剂, 这可能会限制其在制药领域的应用[14-16]。
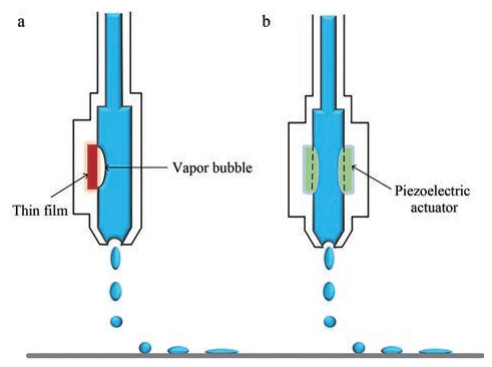
|
Figure 3 Schematic of drop on demand printing with thermal (a) and piezoelectric actuation (b) |
压电打印头利用压电元件, 如晶体或陶瓷, 在施加电压时产生机械运动, 如图 3b所示。元件通过形变产生压力, 挤压液滴, 使液滴克服其表面张力从喷嘴喷出。当撤销施加的电压时, 元件产生的形变会消失, 从而使得液腔重新充满液体[14]。压电打印已被证明可以更好地控制液滴的形成, 相对于热泡式喷头, 它更适合用于药物开发[15, 17]。
1.3 打印液体的理化性质对打印成型的影响打印液体的性能与成型机制密切相关, 主要从3个方面影响打印成型, 即打印过程中液滴的产生、液滴在粉床上的撞击、反弹和扩散, 以及打印完成后的干燥和固化。液滴的形成, 除上述所示的形成方式不同, 其打印液的黏度、密度和表面张力会影响液滴形成过程的连贯性和稳定性, 从而影响打印效果。液滴形成过程是复杂的。在许多研究中用一些数学模型来预测流体的行为, 如雷诺数(Re)、韦伯数(We)和奥内佐格数(Oh)[18, 19]。Re是衡量流体惯性力与黏性力相对大小的一个无量纲相对参数; We则代表着惯性力和表面张力的效应之比, 一般韦伯数越小, 代表表面张力起到的作用越大; Oh用来度量流体的黏性力、表面张力和惯性力相互关系的无量纲数。油墨的印刷性由Oh的倒数Z值进行度量。
| $ {{\rm{Re}} = \frac{{v\rho a}}{\eta }} $ | (1) |
| $ {{\rm{We}} = \frac{{{v^2}\rho a}}{\gamma }} $ | (2) |
| $ {{\rm{Oh}} = \frac{\eta }{{\sqrt {\gamma \rho a} }} = \frac{{\sqrt {{\rm{We}}} }}{{{\rm{Re}}}}} $ | (3) |
| $ {Z = \frac{1}{{{\rm{Oh}}}}} $ | (4) |
一般来说, Z值在1~10之间, 打印液可打印液体, ν为液滴速度, η为打印液动态黏度, γ为打印液表面张力, ρ为打印液密度, α为液滴直径。在低黏度的流体中, 一般Z > 10, 这种情况下会有卫星液滴的形成, 会导致打印分辨率和精密度降低。Jang等[20]研究发现, 当Z < 14时, 卫星液滴可与原液滴在沉积前融合, 对打印效果不会造成影响。
液滴冲击到粉末材料表面这个过程非常复杂, 在整个过程中会涉及到惯性力、表面张力和黏性力之间的相互作用[21, 22]。液体性质、液滴的大小、液滴冲击粉材的速度, 粉体材料性质和粉床表面的粗糙度差异, 均会导致液体撞击粉材的行为不同, 这种行为一般包括扩散、回弹和铺展等。如黏度大的液体, 其回弹行为会减弱。
液体的性质也会影响其产品干燥固化的成型性, 选用的溶剂为挥发性溶剂, 干燥时间短; 打印液的黏度大, 其成品的固化效果好, 不易破损。这也是为大多数打印液采用挥发性有机溶剂作为基础溶剂的原因, 但同时也要添加一定比例的粘合剂的原因。
1.4 粉体性质对打印成型的影响首先, 粉体的粒径要适中, 粒径过大, 可能会造成粉层铺不平整, 如普通3D打印机的粉层厚度为100 μm, 如果粉料粒径大于100 μm可能会造成颗粒刮蹭, 而不能达到满意的铺粉效果。粉末粒度过小, 将会导致颗粒间的范德华力增大, 从而导致颗粒聚成团状, 还会导致打印过程中粉末飞扬, 堵塞打印喷头[9]; 其次, 要考虑粉体的稳定性, 尤其是含药粉体, 因为在打印过程中粉体是反复循环使用的, 应考察粉体长期处于暴露环境下的稳定性。例如, 粉体吸湿会导致粉体变质和结块, 从而不能保障粉体的良好性质, 影响打印效果。
1.5 打印参数对打印成型的影响打印参数包括铺粉层厚、打印液喷涂量或喷涂次数、打印头运行速度和打印头距粉层的高度等。这些参数的设定要依据打印液和粉体进行适应性调整。当粉体颗粒细、密度小时, 过于飞扬堵塞打印头, 除了对粉体处方进行调整外, 也可以提高打印头距粉床的高度等方法来解决问题。
打印液体、打印粉体、打印参数三者之间相辅相成, 相比于一般制剂过程的参数筛选, 处方调整要更加复杂。因为三者之间是相互关联无法彻底分开, 难以进行单一因素考察。
2 粉液粘结型3D打印在固体药物制剂中的应用在近几十年里, 3D打印技术发展迅猛, 直到2015年FDA批准了全球第一个打印药物后, 才将更多的目光转移到药物制剂研究中。基于3D打印的灵活性, 在复杂制剂和特殊功能的实现上, 人们针对3D打印技术在制剂领域的开发, 有了更多的想法和思路。在药物制剂领域, 3D打印技术具有空间分布精确、释药精准和药物剂量个性化等优势, 可以弥补传统制药技术的不足。本文针对粉液粘结型3D打印技术在速释制剂、缓控释制剂和植入剂等几种常见剂型中的应用进行了概括。
2.1 速释制剂速释制剂吸收好、起效快和生物利用度高, 患者依从性好。传统的制备工艺主要有压片法、冷冻干燥法和湿法制粒压片等, 这些传统制备手段工序复杂、成本高。同时往往也无法满足迅速崩解、溶出和良好的机械性能等条件[23]。3D打印原理为粉液粘结, 层层叠加, 无需压片直接成形, 所以成品具有很高孔隙率, 这些空隙形成毛细管通道, 遇水迅速吸收, 实现快速崩解。这是3D打印特有优势, 同时程序简单、操作灵活方便。
Lin等[24]采用粉液粘结型3D打印, 尝试制备了速效救心口崩片。首先设计的片剂模型为传统圆形片剂, 直径17 mm、厚度1.4 mm; 再筛选出合适的粉体材料即适宜比例川穹提取物和冰片, 液体为不同比例的乙醇溶液。在低浓度乙醇溶液(50%)时, 出现卷边的现象导致打印出的片剂有层与层之间的错位; 在高浓度乙醇(95%)时, 乙醇挥发过快, 打印出的片剂因黏度不够而出现分层。最终选择75%乙醇溶剂为打印液, 打印出的片剂表面完整光洁、色泽均匀、边缘整齐, 在口腔内迅速崩解。该打印片剂的重量差异(RSD)为3.7%, 符合药典要求。在水中崩解时间为43.3 s, 但其平均硬度只有3.89 kg, 显然该处方或模型设计还需要调整, 以同时满足崩解时限和机械强度的要求。Yu等[25]设计了一种特殊结构模型, 用3D打印方法制备了一种快速崩解的对乙酰氨基口崩片。内部为未喷打印液的松散粉末, 被一定厚度的外壳结构所包裹。这样的模型设计更加有利于片剂的快速崩解[26]。粉末材料为一定比例的主药对乙酰氨基酚(APAP)、乳糖、聚乙烯吡咯烷酮K30 (PVP K30)、甘露醇和胶态二氧化硅。在粉体材料的选择上, 考虑到中空模型设计不利于保障片剂的机械强度, 故加入了PVP K30作为固体粘合剂, 增加片剂粉末之间的黏合力, 同时还在粉体中加入了胶态二氧化硅增加了粉体的流动性。打印液的基础溶剂选择75%乙醇溶液, 还加入了亚甲基蓝和PVP K30, 同样PVP K30也是为了增加打印液黏度。打印出的片剂平均崩解时间为(21.8 ± 5.4) s、硬度为(54.5 ± 4.2) kg, 2 min内药物释放达到98%。Lin等[27]通过对片剂模型的调整, 制备了3D打印氯氮平口腔崩解片, 实现了片剂具有一定机械强度的同时能够快速崩解的目的。氯氮平是被认为治疗精神分裂症效果最佳的药物[28], 开发这种口服速释制剂能够实现发病时的快速给药, 同时也可以提高患者依从性[29]。Lin等[27]还根据打印层数-含药量回归方程计算目标剂量下对应的片剂体积, 根据该方程实现个性化剂量打印。
2.2 缓控释制剂缓释制剂可以在减少服药次数、用药总剂量的同时保持平稳的血药浓度, 避免峰谷现象, 提高长期用药患者的依从性、降低用药的不良反应。
Yu等[30]采用粉液粘结3D打印机制备了具有梯度控释的给药系统(DDS), 以双氯芬酸钠为模型药物, 该模型纵向设计上下两层用乙基纤维素(EC)粉末铺层, 作为片剂的阻释层。中间铺层粉末为一定比例的乳糖、HPMC和PVP混粉。将主药双氯芬酸钠溶解在打印液里, 将该模型横向由里向外分为4个区域, 打印液喷涂次数逐渐减少, 实现该给药系统药物浓度的梯度变化。模型如图 4所示。该给药系统利用纵向上下面的阻释作用, 变三维自然释药为径向二维可控释药。并通过增大径向药物浓度来弥补释药面积减小所带来的影响, 以实现单位时间内获得相同的释药量, 从而起到控释的作用, 结果显示, 12 h内药物以零级释药的方式释放了98.14% (R = 0.998)。同年Yu等[31]以对乙酰氨基酚为模型药, 制备了圆环状类似甜甜圈的制剂模型, 同样实现了药物的零级释放行为, 该模型通过改变环形的厚度和高度来改变溶出时间。通过3D打印对药物制剂的研究, 让复杂药物传递系统的制备变得更加简单、实际和可行。
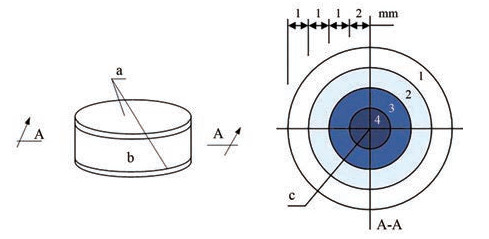
|
Figure 4 Design of controlled-release drug delivery system (DDS) with drug gradients. a: Release retardant layer; b: Drug loaded region; c: Gradient distribution of drug |
植入式给药相对于传统给药剂型具有定位给药、不良反应少、用药次数少和提高治疗效果等优点。一般植入剂的制备方法是将药物与赋形剂经一定工艺制备固体控释制剂[4]。植入剂所用的辅料应具有生物相容性, 可用生物降解材料, 也可用不能生物降解材料(如硅橡胶), 无法降解的材料在预定时间后应取出[32]。传统的制备方法有直接灌装法、溶剂浇铸法、压膜成形法和熔融成形法等。这些制备方法的缺点是无法精确控制植入剂的内部结构, 所以对疗效的发挥有一定的影响[33, 34]。而用3D打印可实现多种材料精确成形和局部微细控制, 得到具有复杂精细的内部腔室结构的装置, 从而对药物释放行为进行控制[35]。
随着人口老龄化越来越严重, 骨科植入的应用越来越广泛[36], 虽然随着技术和生产的发展, 制备骨科植入物的能力也显著提高, 但是植入造成的院内获得性细菌感染也成为导致植入失败的主要原因[37, 38]。Gu等[39]采用3D打印喷墨技术将抑菌活性成分利福平、骨修复成分磷酸钙[40]和可降解载体聚乳酸-羟基乙酸共聚物(PLGA)的混合物作为打印液, 喷涂成微型图案, 作为植入剂的抑菌涂层。考察了该植入剂的抑菌效果及骨细胞在植入剂上的生长情况, 与不含药的植入剂对比, 含药组在24 h后没有检测到任何细菌。不含药组在10 h就检测出细菌。在植入剂对成骨细胞生长影响的实验中, 发现成骨细胞在骨植入剂表面的增殖速度比非植入剂表面的增殖速度快, 证明了植入剂不仅能够起到有效的抑菌效果, 同时还能促进骨细胞的生长增殖。Wu等[41]利用3D打印技术, 制备具有多层同心圆柱体结构的载药人工骨, 并将利福平和异烟肼由内到外按特定顺序载入植入物上, 所制备的载药人工骨呈多孔结构, 孔隙率为(61.76 ± 2.53) %、微孔孔径为50~100 μm, 体外药物呈序贯释放, 双药释放峰值依次交替出现, 持续释放时间超过50天, MTT检测细胞毒性0级, 扫描电镜观察到细胞生长分化良好, 并有大量细胞黏附于载药人工骨表面, 说明该植入体的生物相容性良好, 为骨结核的治疗提供了新的医学思路。Huang等[42]采用粉液粘结型3D打印技术制备了3种不同结构的左氧氟沙星植入剂, 普通片型、包囊型和储库型, 与采用传统压制法制备的片型植入剂进行比较, 3D打印植入剂孔隙率更大, 孔径分布更均匀; 体外释放结果表明, 采用3D打印技术制备的包囊型和储库型植入剂比传统植入剂能维持更长时间的有效药物浓度, 可实现长效缓释。
2.4 其他粉液粘结型3D打印的优势之一便是可以实现高载药量, Sophia等[43]以不同等级的羟丙基纤维素(HPC)为粘结剂, 制备出了载药量高达70%的咖啡因片剂。他们在粉体中加入固体粘合剂, 而打印液为一定浓度的乙醇水溶液, 其原因是为了避免加入粘合剂或原料药使打印液黏度增加, 堵塞打印头[44]。该研究考察了4种不同的HPC作为干法粘合剂用于粉液粘结3D打印的性能, 在开发出适用于所有HPC等级的高载药配方后, 对工艺进行优化, 直到获得可接受的片剂。结果表明, 粘合剂的黏度和粒度对片剂性能有明显影响。
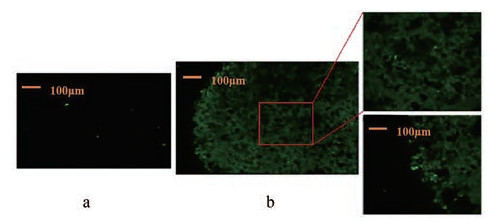
某些药物药效作用强, 不需要大剂量使用, 可考虑将少量药物溶于打印液中, 均匀打印至片剂中, 这是一种可行的方法, 但是个别溶解度低的药物, 可能会在打印过程中析出, 导致堵塞打印喷头。Shi等[45]利用粉液粘结型3D打印制备了不同直径(10和13 mm)的抗癌载药片剂, 如图 5所示。将抗癌药物5-氟尿嘧啶溶解在含Soluplus (聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物)和聚乙二醇(PEG)的聚合物中, 制成载药的溶液, 涂布在3D打印的载体片剂上。其中药物颗粒均匀地分散在打印片剂的整个表面上。为了评价药物分布均匀性, 利用反向荧光显微镜进行分析, 从图 6可以看出, 未使用药物溶液涂布的片剂没有荧光痕迹(图 6a), 而使用药物溶液涂布的片剂, 荧光在片剂上均匀分布(图 6b)。这种将3D打印产品当载体的方式, 适合很多低剂量、难溶性药物。同时还可以利用打印载体的灵活性、空间结构可复杂性, 调节药物的释放和负载。

|
Figure 5 Schematic diagram of the printing process of drop-on-powder three-dimensional printing process. (Adapted from Ref. 45 with permission. Copyright © 2019 Pharmaceutics) |
|
Figure 6 Confocal microscopic images of tablets without drug solution (a) and with drug solution (b). (Adapted from Ref. 45 with permission. Copyright © 2019 Pharmaceutics) |
3D打印制剂与传统制剂相比, 具有极高可控性和灵活性。可控性具体表现在对复杂空间结构、精密制备过程的掌控; 灵活性则表现在剂量灵活、需求灵活和结构灵活等。
3D打印制剂可通过控制制剂的外部形状及内部结构制备出多种释放机制的制剂, 改变药物的存在状态及分布情况。如速释制剂, 利用粉液粘结型3D打印技术的高孔隙率特点实现难溶药物的口服吸收问题; 通过改变制剂的打印材料和空间结构实现药物的缓控释放。同时3D打印还可实现剂量的个性化调控, 适用于特殊人群的给药或毒性大、治疗窗窄的药物[46]; 可根据患者的种族、性别、年龄和体重等生理因素, 用3D打印实现个性化剂量打印, 避免采用徒手分劈或剪药器、磨粉分包药品等分剂量手段导致的剂量不准确、药品污染和药品浪费等现象[47]。这是传统制药工艺所无法比拟的优势。3D打印依据其粉液粘结、层层叠加的原理, 可实现药物的高载药量制备, 减少用药次数、单次用药量, 从而大大提高患者的顺应性。已有使用3D打印技术制备了极低剂量的产品, 规格低至3 ng, RSD仅为10%[48], 证明3D打印技术有望用于传统工艺难以实现的极低剂量规格产品的制备。3D打印在儿童用药中有着广阔前景, 除了可实现儿童个性化剂量给药外, 3D打印还可以精确控制片剂的外观, 打印出特有形状和颜色的卡通制剂, 提高临床上儿童用药的依从性[49]。
虽然3D打印具有许多传统制剂无法比拟的优势, 但在制剂领域的研究仍处于起步阶段, 也会面临诸多挑战。首先是制造设备的限制, 3D打印技术国内起步较晚, 设备相对单一、简单, 很多功能的协调性较差。进口设备相对先进, 但是由于技术封锁, 无法进行参数调整严重影响着制剂产业化; 其次就是打印喷头的喷射流畅性, 因为在整个打印过程中打印头一直持续喷射, 工作量最大, 如何实现打印液与打印头高度匹配, 并保证打印头能够一直保持均一连续喷射的良好工作状态成为了一个巨大的挑战[4]; 最后粉液粘结型3D打印材料长期暴露于空间中, 药粉的长期稳定、回收再利用也是值得关注和解决的问题。与传统的制剂相比, 目前3D打印制剂制备的高成本也成为制约其发展的一个重要因素。
4 结语与展望3D打印药物灵活可控, 为药物制剂的开发提供了很多新的思路和方法, 尤其是在药物传递系统的筛选、开发和制造中具有广阔的发展空间。粉液粘结型3D打印技术可根据打印材料、打印流体成分与比例、工艺参数的调节来改变最终成品的外观、形状和内部结构, 制备能够更好地控制药物释放速率、释放周期和释药位置的药物传递系统, 如更符合“时辰药理学”的脉冲制剂、缓控释制剂等, 以减少毒副作用并增加患者依从性[50]。同时3D打印的个性化给药优势, 也为人们实现个性化医疗提供了一种技术支持, 在未来医生可根据患者的诊断情况开具电子处方, 直接传输到药房或门诊, 药师可根据电子处方现场打印适合该患者的剂型或剂量的药物, 以更好地解决复杂的给药方案及特殊患者群体的用药需求。当然, 目前3D打印还面临着诸多制约和挑战, 但在未来的发展过程中, 将会逐步得到解决, 3D打印技术必将为药物制剂研发开启新的篇章。
作者贡献:陈如心具体完成撰写任务; 王增明、韩晓璐完成文献检索和筛选; 刘中成、郑爱萍确定文章方向及内容组成, 并对文章撰写质量进行把关和审校。
利益冲突:文章内容不涉及相关利益冲突, 未涉及任何厂家及相关经济组织直接或间接的经济或利益的赞助。内容不涉及泄密, 无与他人课题或专利技术的争执, 无一稿两投, 无作者署名争议。
| [1] |
Norman J, Madurawe RD, Moore CM, et al. A new chapter in pharmaceutical manufacturing:3D-printed drug products[J]. Adv Drug Deliv Rev, 2017, 108: 39-50. DOI:10.1016/j.addr.2016.03.001 |
| [2] |
Wang X, Zhang C, Ping QN. Advances of 3D printing technology in advanced pharmaceutical preparations[J]. J Chin Pharm Univ (中国药科大学学报), 2016, 47: 140-147. |
| [3] |
Ventola CL. Medical applications for 3D printing:current and projected uses[J]. Pharm Ther, 2014, 39: 704-711. |
| [4] |
Shi J, Wang ZM, Zheng AP. Applications and challenges of 3D printing technique in manufacturing pharmaceutical preparations[J]. Prog Pharml Sci (药学进展), 2019, 43: 164-173. |
| [5] |
Liu Z, Sun PJ. The first 3D print antiepileptic drugs-spritam[J]. J Pharm Res (药学研究), 2015, 34: 556-558. |
| [6] |
Wang YG, Wang X. 3D Printing Technology (3D打印技术)[M]. Wuhan: Huazhong University of Science and Technology Press, 2014: 3-61.
|
| [7] |
Yu DG, Zhu LM, Branford-White CJ, et al. Three-dimensional printing in pharmaceutics:promises and problems[J]. J Pharm Sci, 2008, 97: 3666-3690. DOI:10.1002/jps.21284 |
| [8] |
Katstra WE, Palazzolo RD, Rowe CW, et al. Oral dosage forms fabricated by three dimensional printing[J]. J Control Release, 2000, 66: 1-9. DOI:10.1016/S0168-3659(99)00225-4 |
| [9] |
Dong X, Zhao HT, Li L, et al. Researching and applying of colorful powder binding 3D printer[J]. Tech Automat Appl (自动化技术与应用), 2017, 36: 92-95. |
| [10] |
Prasad LK, Smyth H. 3D printing technologies for drug delivery:a review[J]. Drug Devel Ind Pharm, 2016, 42: 1019-1031. DOI:10.3109/03639045.2015.1120743 |
| [11] |
Hansell CW. Jet sprayer actuated by supersonic waves[P]. 1946-04-01.
|
| [12] |
Xiao B. Research on Key Technology of Tablet Production 3D Printing Equipment (片剂生产型三维打印设备关键技术研究)[D]. Wuhan: Huazhong University of Science and Technology, 2013.
|
| [13] |
Gong XD. Principle of ink-jet printer nozzle and analysis of its common faults[J]. Print World (印刷世界), 2011, 12: 37-38. |
| [14] |
Alomari M, Mohamed FH, Basit AW, et al. Personalised dosing:printing a dose of one's own medicine[J]. Int J Pharm, 2015, 494: 568-577. DOI:10.1016/j.ijpharm.2014.12.006 |
| [15] |
Hon KKB, Li L, Hutchings IM. Direct writing technology-advances and developments[J]. CIRP Ann Manuf Technol, 2008, 57: 601-620. DOI:10.1016/j.cirp.2008.09.006 |
| [16] |
Fromm JE. Numerical calculation of the fluid dynamics of dropon-demand jets[J]. IBM J Res Dev, 1984, 28: 322-333. DOI:10.1147/rd.283.0322 |
| [17] |
Sumerel J, Lewis J, Doraiswamy A, et al. Piezoelectric ink jet processing of materials for medical and biological applications[J]. Biotechnol J, 2006, 1: 976-987. DOI:10.1002/biot.200600123 |
| [18] |
Derby B. Inkjet printing of functional and structural materials:fluid property requirements, feature stability, and resolution[J]. Annu Rev Mater Res, 2010, 40: 395-414. DOI:10.1146/annurev-matsci-070909-104502 |
| [19] |
Mckinley GH, Renardy M. Wolfgang von ohnesorge[J]. Phys Fluids, 2011, 23: 127101. DOI:10.1063/1.3663616 |
| [20] |
Jang D, Kim D, Moon J. Influence of fluid physical properties on ink-jet printability[J]. Langmuir, 2009, 25: 2629-2635. DOI:10.1021/la900059m |
| [21] |
Liu DD, Tan HW, Tran T. Droplet impact on heated powder bed[J]. Soft Matter, 2018, 14: 9967-9972. DOI:10.1039/C8SM01858H |
| [22] |
Lee ACS, Sojka PE. Drop impact and agglomeration under static powder bed conditions[J]. Aiche J, 2012, 58: 78-86. |
| [23] |
Ping QN, Tu XD, Zhang JS, et al. Pharmaceutics (药剂学)[M]. 4th ed. Beijing: People's Medical Publishing House, 2013: 722.
|
| [24] |
Lin QF, Yang F, Fang KY, et al. Study on the preparation of Suxiao Jiuxin orally disintegrating tablets by 3D printing[J]. J Guangdong Pharm Univ (广东药学院学报), 2016, 32: 1-4. |
| [25] |
Yu DG, Branford-White C, Yang YC, et al. A novel fast disintegrating tablet fabricated by three-dimensional printing[J]. Drug Dev Ind Pharm, 2009, 35: 1530-1536. DOI:10.3109/03639040903059359 |
| [26] |
John BS. Controlled delivery oral dosage forms in thenew millennium[J]. Pharm Manuf Pack Sourcer, 2000, 44: 1. |
| [27] |
Lin MM, Chen PH, Tian P, et al. Optimization and evaluation of the structural design of clozapine orally disintegrating tablets by three dimensional printing[J]. Chin New Drug J (中国新药杂志), 2019, 28: 739-744. |
| [28] |
Fu WH. Preparation of clozapine oral disintegrating tablets[J]. Chin J Modern Appl Pharm (中国现代应用药学), 2007, 24: 299-301. |
| [29] |
Jiang LH. Comparison study of clozapine orally disintegrating tablets and clozapine in the treatment of schizophrenia[J]. Guide China Med (中国医药指南), 2013, 11: 478-479. |
| [30] |
Yu DG, Liu J, Yang Y, et al. Studies on preparation of controlled-release delivery systems with drug gradients using three dimensional printing technique[J]. Chin Pharm J (中国药学杂志), 2006, 41: 1080-1083. |
| [31] |
Yu DG, Branford-White C, Ma ZH, et al. Novel drug deliverydevices for providing linear release profiles fabricated by 3DP[J]. Int J Pharm, 2009, 370: 160-166. DOI:10.1016/j.ijpharm.2008.12.008 |
| [32] |
Lin XM, Guo NZ, Yang HX, et al. Progress in quality control of implantations[J]. Chin New Drug J (中国新药杂志), 2019, 28: 528-535. |
| [33] |
Huang WD. Research on Implantable Drug Delivery System Based on 3D Printing Technology (基于三维打印技术的植入式给药系统研究)[D]. Wuhan: Huazhong University of Science and Technology, 2007: 35-48.
|
| [34] |
Lin S, Chao PY, Chien YW, et al. In vitro and in vivo evaluations of biodegradable implants for hormone replacement therapy:effect of system design and PK-PD relationship[J]. AAPS PharmSciTech, 2001, 2: 3. |
| [35] |
Huang WD, Wu WG, Zheng QX, et al. Advances in the research of implantable drug delivery system[J]. Huangshi Inst Tech (黄石理工学院学报), 2008, 24: 26-30. |
| [36] |
Mah TF, O'Toole GA. Mechanisms of biofilm resistance to antimicrobial agents[J]. Trends Microbiol, 2001, 9: 34-39. DOI:10.1016/S0966-842X(00)01913-2 |
| [37] |
Borriello G, Werner E, Roe F, et al. Oxygen limitation contributes to antibiotic tolerance of Pseudomonas aeruginosa in biofilms[J]. Antimicrob Agents Chemother, 2004, 48: 2659-2664. DOI:10.1128/AAC.48.7.2659-2664.2004 |
| [38] |
Lewis K. Persister cells, dormancy and infectious disease[J]. Nat Rev Microbiol, 2007, 5: 48-56. DOI:10.1038/nrmicro1557 |
| [39] |
Gu Y, Chen X, Lee JH, et al. Inkjet printed antibiotic-and calcium-eluting bioresorbable nanocomposite micropatterns for orthopedic implants[J]. Acta Biomater, 2012, 8: 424-431. DOI:10.1016/j.actbio.2011.08.006 |
| [40] |
Sun JS, Tsuang YH, Liao CJ, et al. The effects of calciumphosphate particles on the growth of osteoblasts[J]. J Biomed Mater Res, 1997, 37: 324-334. DOI:10.1002/(SICI)1097-4636(19971205)37:3<324::AID-JBM3>3.0.CO;2-N |
| [41] |
Wu WG, Zheng QX, Guo XD. Experimental study of a rifampicine-isoniazid-controlled release drug implant[J]. Chin J Biomed Eng (中国生物医学工程学报), 2010, 29: 137-143. |
| [42] |
Huang WD, Zheng QX, Sun WQ, et al. Levofloxacin implants with predefined microstructure fabricated by three-dimensional printing technique[J]. Int J Pharm, 2007, 339: 33-38. DOI:10.1016/j.ijpharm.2007.02.021 |
| [43] |
Sophia I, Alexander H, Simona I, et al. Powder bed 3D-printing of highly loaded drug delivery devices with hydroxypropyl cellulose as solid binder[J]. Int J Phaem, 2018, 555: 198-206. |
| [44] |
Kolakovic R, Viitala T, Ihalainen P, et al. Printing technologies in fabrication of drug delivery systems[J]. Expert Opin Drug Del, 2013, 10: 1711-1723. DOI:10.1517/17425247.2013.859134 |
| [45] |
Shi KJ, Tan DK, Nokhodchi A, et al. Drop-on-powder 3D printing of tablets with a anti-cancer drug, 5-fluorouracil[J]. Pharmaceutics, 2019, 11: 150. DOI:10.3390/pharmaceutics11040150 |
| [46] |
Ma W. Overview of 3D printing technology in pharmaceutical preparations research[J]. Pharm Today (今日药学), 2018, 28: 204-206. |
| [47] |
Lin W, Pi XY, Lv JQ, et al. Precise dosage of commercial warfarin sodium tablets and hydrochlorothiazide tablets by 3D printing[J]. Acta Pharm Sin (药学学报), 2018, 53: 1901-1907. |
| [48] |
Prakash K, Baishakhi D, Assaleh FH, et al. Top-down and bottom-up approaches in 3D printing technologies for drug delivery challenges[J]. Crit Rev Ther Drug Carrier Syst, 2015, 32: 61-87. DOI:10.1615/CritRevTherDrugCarrierSyst.2014011157 |
| [49] |
Jamróz W, Szafraniec J, Kurek M, et al. 3D printing in pharmaceutical and medical applications-recent achievements and challenges[J]. Pharm Res, 2018, 35: 176. DOI:10.1007/s11095-018-2454-x |
| [50] |
Zhao J, Jiang ML, Ding Y. Research progress and engineering prospect on the formulation design of 3D printing technology[J]. Acta Pharm Sin (药学学报), 2018, 53: 1303-1310. |
 2020, Vol. 55
2020, Vol. 55


