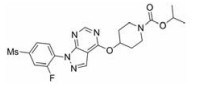
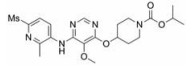
糖尿病(diabetes mellitus, DM)是一种慢性代谢性疾病[1], 常由胰岛细胞分泌胰岛素不足引起。国际糖尿病联盟(IDF)的最新数据显示, 2019年全球糖尿病患者已达4.63亿人, 预计到2030年患病人数接近5.78亿, 到2045年, 这一数字将跃升至7亿[2]。在我国, 成人糖尿病患病率也显著增加, 从1980年0.67%的患病率增加到了2013年的10.4%, 而未诊断糖尿病比例高达63%[3]。糖尿病患者由于能量转化过程存在障碍, 在进食和/或禁食状态下无法使血糖维持在正常范围内, 长期的高血糖水平会对血管、神经和肾脏等其他器官产生极其不利的影响, 增加诱发并发症的风险, 所以糖尿病患者常伴有溃疡[4]、周围神经病变[5]、肾病[6]等严重的疾病。另外, 糖尿病还能促进其他疾病如肿瘤的发生发展, 增加其发病风险和死亡率[7]。糖尿病主要分为1型糖尿病和2型糖尿病, 其中, 以2型糖尿病患者居多, 约占患病总数的90%。传统抗糖尿病药物种类较少, 包括磺酰脲类、双胍类、格列奈类、噻唑烷二酮类、α-葡萄糖苷酶抑制剂和胰岛素等, 这些药物具有较好的临床疗效, 但也会带来体重增加、低血糖、心力衰竭等不良反应。随着糖尿病药物的不断开发, 目前已发现不良反应较少的药物, 如胰高糖素样肽-1 (glucagon-like peptide 1, GLP-1)类似物、二肽基肽酶-4 (dipeptidyl peptidase-4, DPP-4)抑制剂、钠-葡萄糖协同转运体(sodium-glucose cotransporter, SGLT2)抑制剂、糖原合酶激酶-3 (glycogen synthase kinase 3, GSK-3)抑制剂等[8]。
近年来, 基于糖尿病的新靶点药物开发成为研究的热点, 如G蛋白偶联受体119 (G-protein coupled receptor 119, GPR119)、蛋白酪氨酸磷酸酶-1B (protein tyrosine phosphatase-1B, PTP1B)、胰高血糖素受体(glucagon receptor, GCGr)、G蛋白偶联受体40 (G-protein coupled receptor 40, GPR40)、GSK-3、糖原磷酸化酶(glycogen phosphorylase, GP)、11β-羟基类固醇脱氢酶1 (11β-hydroxysteroid dehy drogenase 1, 11β-HSD1)等, 这些新靶点为抗糖尿病药物的研发提供了更多的方向[9]。其中, GPR119由于其确切的作用机制, 成为研发新型抗2型糖尿病药物的重要潜在靶点。
1 GPR119GPR119属于A类(类视紫红质) G蛋白偶联受体家族中的一员, 在人胰岛β细胞和胃肠内分泌L细胞中高度表达, 被激动后使细胞内cAMP的浓度增加, 进一步促进胰岛素、胰高血糖素样肽-1、葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide, GIP)和YY多肽(polypeptide YY, PYY)的分泌, 从而调节血糖水平[10-12]。GPR119内源性配体包括两大类, 一类为磷脂, 例如溶血磷脂酰胆碱(lysophosphatidylcholine, LPC)、溶血磷脂酰乙醇胺(lysophosphatidylethanolamine, LPE)和溶血磷脂酰肌醇(lysophosphatidylinositol, LPI)等[13]; 另一类为脂肪酸的酰胺衍生物, 例如油酰乙醇胺(oleoylethanolamide, OEA)、N-油酰多巴胺(N-oleoyldopamine, OLDA)、2-油酰甘油(2-oleoylglycerol, 2-OG)等[14, 15]。
GPR119激动剂在糖和脂代谢中起着重要的作用, 被认为是预防或治疗2型糖尿病和肥胖潜在的口服药物[16, 17]。随着对GPR119激动剂的深入研究, 人们发现它不仅能预防或治疗其他代谢性疾病, 如高胆固醇血症、血脂异常、脂肪肝、非酒精性脂肪肝和动脉粥样硬化等[18-24], 而且能影响破骨细胞的分化和融合, 是骨吸收相关疾病的潜在治疗药物[25, 26]。有研究报道GPR119激动剂还能增强酪氨酸激酶抑制剂(TKIs)的抗癌作用, 也许可以参与癌症化疗的治疗[27]。由此可见, GPR119激动剂极具发展潜力, 若能应用于临床治疗将会产生重要的价值。
2 基于GPR119的抗糖尿病药物GPR119激动剂具有多种药理功能, 但目前主要应用于2型糖尿病。继Arena公司发现了首个具有内在活性的GPR119小分子激动剂后[28], GPR119激动剂的合成陆续有报道。到目前为止, 部分GPR119激动剂进入了临床研究阶段[17, 29-31] (表 1), 如DA-1241 (Ⅰ期临床), 能够通过抑制肝脏糖异生和刺激GLP-1分泌来增强胰岛素分泌, 对葡萄糖和脂质代谢具有长期有益作用[32]。MBX-2982 (Ⅱ期临床)在Ⅱ期临床试验中取得良好的结果, 在人体葡萄糖激酶活性试验中, 发现MBX-2982还能够通过激活葡萄糖激酶来调节血糖水平[33]。尽管GPR119激动剂的发展已经进入了临床研究阶段, 但由于临床疗效不佳或反复给药后产生快速耐受性等原因, 部分药物已经停止继续研究[34-37]。
| Table 1 GPR119 agonists in clinical phases |
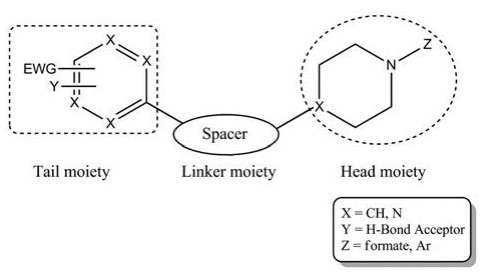
典型的GPR119受体激动剂通常由头部、中间母核和尾部这三部分组成(图 1), 尾部为芳环或芳杂环, 常被吸电子基团(electron-withdrawing group, EWG)和氢键受体基团Y取代, 头部为取代的脂肪环结构, 以取代的哌啶环较为多见, 氮原子上形成氨基甲酸酯或被杂环Z取代, 用桥环进行构象限制可提高受体激动活性, 中间母核则将头部和尾部两部分连接起来[17]。根据结构中部连接部分母核类型的不同, GPR119激动剂主要分为五元环类、六元环类、双杂环类、三元环和线性类。
|
Figure 1 Typical structure of GPR119 agonists |
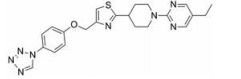
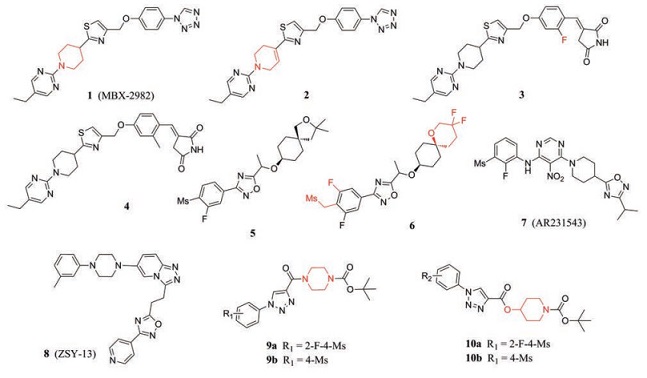
MBX-2982是Metabolex公司发现的GPR119激动剂, 在Ⅱ期临床试验中取得了良好的结果。Zuo等[38]以MBX-2982 (1, EC50 = 3.9 nmol·L-1)为先导化合物, 将2-(哌啶基)噻唑结构替换为2-(四氢吡啶基)噻唑结构, 得到了一系列2-(四氢吡啶基)噻唑衍生物。其中, 化合物2 (EC50 = 4.9 nmol·L-1, IA = 110.30%)具有良好的药理活性, 并且显示出一定的降血糖作用, 可能对改善饮食诱导肥胖(diet-induced obesity, DIO)小鼠的基础代谢率有作用。结果显示, 化合物2的激动效应略弱于MBX-2982, 但在理化性质(clogP = 3.03)、可溶性(0.056 mg·mL-1)和膜透性方面均优于MBX-2982。
Kim等[39]在合成的一系列MBX-2982类似物中, 发现几个包含吡咯烷-2, 5-二酮结构的衍生物显示出更优的GPR119激动活性。其中, 化合物3 (hGPR119 EC50 = 49 nmol·L-1, IA = 94%)和化合物4 (hGPR119 EC50 = 18 nmol·L-1, IA = 90%)表现出良好的体外活性, 降糖作用与MBX-2982相近, 但在人和大鼠肝脏微粒体中的代谢稳定性均优于MBX-2982。此外, 化合物3和4的细胞毒作用和对细胞色素P450 (cytochrome P450, CYP)的抑制作用并不明显, 也没有显示与hERG基因(human ether-à-go-go-related gene, hERG)结合。
Harada等[40]在前期合成的一系列右侧为螺环环己烷结构的GPR119激动剂中, 选择与血浆蛋白结合程度较低的化合物5 (EC50 = 89 nmol·L-1, IA = 109%)作为先导化合物进行结构优化, 得到了化合物6 (EC50 = 6 nmol·L-1, IA = 112%)。化合物6左侧苯环上为3, 5-二氟和4-甲基磺基甲基, 而右侧引入了一个二氟基团, 这几部分结构与其激动活性和代谢稳定性的提高密切相关。结果显示, 该化合物无CYP抑制活性, 且在大鼠体内显示持久有效的降糖效果。
Bashetti等[41]以Arena公司开发的第一个小分子GPR119激动剂AR231543 (EC50 = 4.78 nmol·L-1)和有效的GPR119激动剂ZSY-13的核心结构为线索, 设计了一系列包含哌嗪基或哌啶基的三氮唑衍生物, 发现9a (EC50 = 4.21 ± 0.13 nmol·L-1, IA = 92%)、9b (EC50 = 3.12 ± 0.42 nmol·L-1, IA = 97%)、10a (EC50 = 3.59 ± 1.01 nmol·L-1, IA = 93%)、10b (EC50 = 3.67 ± 1.01 nmol·L-1, IA = 96%)具有GPR119激动活性, 药理活性与AR231543相近。随后将进一步研究这些衍生物的体内外GLP-1激动活性。
|
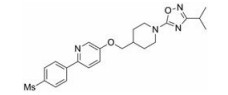
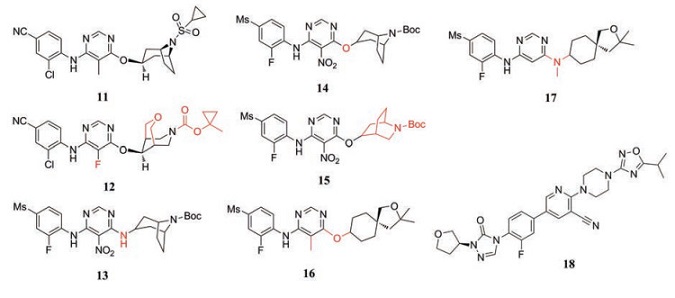
默克公司前期研究开发了一系列以5-甲基嘧啶为母核的GPR119激动剂, 其中化合物11 (hEC50 = 3 nmol·L-1, IA = 96%; mEC50 = 135 nmol·L-1, IA = 105%)的体外活性最优, 达到纳摩尔级别, 但其降糖效果并不理想, 且亲脂性高而溶解性差。为提高药效和改善理化性质, 研究人员将化合物11嘧啶上的甲基替换为氟, 右侧哌啶上的乙烯桥替换为氧双环体系, 结构改造后得到了化合物12 (hEC50 = 10 nmol·L-1, IA = 109%; mEC50 = 58 nmol·L-1, IA = 99%)。该化合物显示出优越的体内外活性和选择性, 对瘦弱、高糖和糖尿病小鼠均表现较好的降血糖效果, 且具有良好的清除率、口服生物利用度(> 35%)、AUC和半衰期, 因此被选为临床前候选化合物MK-8282进一步研究[42]。
Yang等[43, 44]前期合成了包含氮杂双环体系的GPR119激动剂, 发现含有endo-氮杂双环的化合物13 (EC50 = 1.5 nmol·L-1, IA = 99%)和化合物14 (EC50 = 1.5 nmol·L-1, IA = 116%)显示出完全激动的效果。该课题组通过保留5-硝基嘧啶并用构象受限的多种氮杂环醚或胺取代哌替啶来对化合物进行优化, 合成了一系列具有endo/exo氮杂环片段的5-硝基嘧啶衍生物。其中化合物15 (EC50 = 1.2 nmol·L-1, IA = 112.2%)显示出良好的药理活性和完全激动作用, 但由于嘧啶环上硝基的存在, 该化合物往往表现出肝毒性[45]。
Harada等[46]以配体亲脂性效率(ligand-lipophilicity efficiency, LLE)作为选择指标, 确定化合物16 (EC50 = 13 nmol·L-1, IA = 91%, LLE = 4.0)为先导化合物。通过结构修饰后得到了具有口服活性的化合物17 (EC50 = 19 nmol·L-1, IA = 120%, LLE = 4.0), 该化合物对6种CYP异构体无抑制活性, 在大鼠体内表现出良好的药代动力学特性和降糖活性。
Han等[47]设计合成了一系列三唑酮衍生物作为GPR119激动剂, 其中化合物18 (EC50 = 2.8 nmol·L-1)以优于MBX-2982的强效激动活性和降血糖效果在该系列衍生物中脱颖而出。该化合物在细胞水平上刺激GLP-1与GSIS分泌的效果与MBX-2982类似, 单次和重复口服给药均可改善饮食诱导肥胖(diet-induced obesity, DOI)小鼠的葡萄糖耐受性, 并且与DPP-4抑制剂联合用药时发挥更好降血糖效果。结果表明, 化合物17与DPP-4抑制剂联合用药可能是治疗2型糖尿病的有效治疗方案。
2.3 双杂环类Fang等[48]合成了一系列新嘧啶并嘧啶衍生物以解决该课题组前期合成的硝基嘧啶衍生物存在的肝毒性问题, 其中化合物19 (EC50 = 2.2 nmol·L-1, IA = 87.5%)和化合物20 (EC50 = 8.1 nmol·L-1, IA = 83.8%)表现出强效的激动活性, 但降糖效果并不理想。为提高化合物的体内外活性, 研究人员[49]采用骨架跃迁策略将母核替换为嘧啶并[5, 4-b][1, 4]噁嗪, 得到的化合物21 (EC50 = 13 nmol·L-1, IA = 83.9%, ClogP = 4.0)具有较强的激动活性, 且亲脂性适中。进一步结构修饰后的化合物22 (EC50 = 12 nmol·L-1, IA = 146.3%, ClogP = 3.8)激动活性与化合物21相近, 而内在活性更强, 小鼠口服葡萄糖耐量试验(oral glucose tolerance test, oGTT)结果显示, 口服剂量为30 mg·kg-1时, 化合物22的降糖效果优于维格列汀。
|
Matsuda等[50]基于配体的药物设计方法确定了新型1H-吡唑并[3, 4-c]吡啶衍生物23 (hEC50 = 8.1 nmol·L-1, ClogP = 2.21)为先导化合物, 设计合成了一系列类似物, 并进行了构效关系研究。最终发现左侧苯环及右侧哌啶结构修饰后的化合物24 (hEC50 = 4 nmol·L-1, ClogP = 2.25)显示很强的GPR119激动活性, 且膜渗透性高。但是, 尽管该化合物的清除率和分布容积较低, 在大鼠体内的生物利用度却较差。他们认为溶解度差可能是造成生物利用度低的原因, 并基于降低熔点和分子亲脂性的策略进行结构改造以提高溶解度。相比于化合物24 (S = 0.71 μmol·L-1), 优化后的化合物25 (hEC50 = 65 nmol·L-1, S = 15.9 μmol·L-1)溶解度得到了大大提高, 然而其在大鼠体内的生物利用度仍不足以推进体内疗效研究[51]。
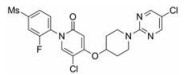
Koshizawa等[52]对含有新型双环嘧啶连接片段的GPR119激动剂产生了兴趣, 认为呋喃并[3, 2-d]嘧啶是有前景的结构, 于是选择呋喃并[3, 2-d]嘧啶衍生物26 (EC50 = 129 nmol·L-1, IA = 123%)作为先导化合物进行优化。采用构像限制策略对化合物26进行结构改造后得到了激动活性更高的化合物27 (EC50 = 53 nmol·L-1, IA = 123%), 紧接着探索右侧哌啶上取代基对疗效和代谢稳定性的影响, 发现为5-氯嘧啶取代基的化合物28 (EC50 = 42 nmol·L-1, IA = 117%)表现出较强的激动活性。此外, 化合物28的肝微粒体清除率优于化合物27, 在10 mg·kg-1的口服剂量下使C57BL/6N小鼠血糖AUC下降33%。
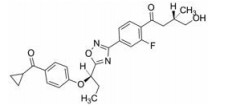
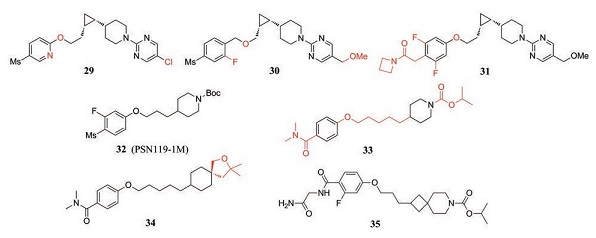
2.4 三元环和线性类基于联合用药比单独用药疗效更佳的想法, 默克公司以化合物29 (hEC50 = 3.3 nmol·L-1, IA = 69%)为先导化合物合成了一系列类似物, 并寻找适合与固定剂量DPP-4抑制剂联合使用的GPR119激动剂。在具有GPR119激动活性的苯氧基类似物中, 化合物30 (hEC50 = 2.1 nmol·L-1, IA = 88%; mEC50 = 1.9 nmol·L-1, IA = 97%)显示出良好的疗效、选择性和更优的理化性质[53]。然而, 该化合物预计每日给药剂量为300 mg, 与每日给药剂量为200 mg的西格列汀相结合的给药方案大大降低了患者的顺从性。为降低给药剂量, 以提高化合物的激动活性和改善整体药动学特性为目标对化合物30优化后得到了化合物31 (hEC50 = 0.2 nmol·L-1, IA = 91%; mEC50 = 0.8 nmol·L-1, IA = 116%)。该化合物显示强效的GPR119激动活性, 预计每日给药剂量远低于化合物30, 在大鼠和恒河猴肝微粒体中的稳定性和其生物利用度都有明显提高[54]。由此可见, 化合物31有望发展成为治疗2型糖尿病的新型药物。
Harada等[55]对中间连接部分长度能够灵活调节的化合物PSN119-1M产生了极大的兴趣, 并以此为基础进行结构改造。研究发现, 当中间为5个碳长度的醚链时化合物的激动活性最优, 左侧苯环4位上为二甲氨基甲酰基时其溶解度更好, 而叔丁氧羰基由异丙氧基羰基取代能降低化合物的亲脂性和保证抗酸稳定性。由此得到的化合物33 (EC50 = 10 nmol·L-1, IA = 102%, ClogP = 5.1)具有较强的激动活性和良好的溶解度, 但特异性较低, 具有CYP抑制作用。最后通过提高分子的三维度来降低化合物的脱靶风险以解决CYP抑制问题, 因此得到了右侧为螺环结构的化合物34 (EC50 = 4 nmol·L-1, IA = 104%, ClogP = 5.1)。该化合物已无CYP抑制活性, 且显示出很强的GPR119激动活性。后续研究发现[56], 化合物34的降糖效果与MBX2982相似, 且强于GSK1292263, 重复给药时能够改善葡萄糖代谢和胰岛素敏感性而不产生快速耐受性。

|
|
Matsuda等[57]研发了一类新型7-氮杂螺[3.5]壬烷GPR119激动剂, 其中化合物35 (EC50 = 48 nmol·L-1, F = 88.6%)显示良好的药理活性和口服生物利用度, 且对糖尿病大鼠具有良好的降糖作用。但是, 该化合物的溶解度很低, 仍需进一步优化。
3 小结综上所述, 基于GPR119靶点的2型糖尿病药物的研发工作已开展了十几年, 少部分GPR119药物已经进入了临床研究阶段。尽管各大制药公司与科研工作者不断努力, 但至今还没有一个临床候选药物能够成功上市, GPR119激动剂的开发进入了瓶颈期[58]。虽然很多强效激动剂在体外药理实验对受体的亲和力达到纳摩尔级别, 具有较强的内在活性, 甚至在动物实验中也表现出不错的降血糖活性, 但由于人类的GPR119序列与啮齿动物有一定的差异, 在临床试验中并未能转化成相应的治疗效果。此外, 部分GPR119激动剂还会使机体产生快速耐受性, 这可能是由激动剂引起的受体脱敏所造成。为克服这些问题, 糖尿病新药需要满足持久强效的药效、较高的安全性以及对心血管等其他器官有利的要求。这就需要继续开发不同结构类型的GPR119激动剂并合成大量的化合物, 经过严格的筛选, 也许能找到符合要求的药物。有文献报道将GPR119激动剂与其他降血糖药物联合使用进行临床试验[42, 47, 53, 59-61], 或应用多靶点药物设计的策略[62], 寻找能够同时作用于GPR119和DPP-4双靶点的药物[63-67], 这可能为解决GPR119单一靶点存在的问题提供思路。
作者贡献:石素梅负责查阅文献, 撰写及修改草稿; 房元英和刘荣华协助指导手稿撰写; 杨尊华提供撰写思路并修改草稿。
利益冲突:所有作者均无相关利益冲突。
| [1] |
National Diabetes Statistics Report[EB/OL]. United States: Centers for Disease Control and Prevention, 2019[2020-07-29]. https://www.cdc.gov/dotw/diabetes/index.html.
|
| [2] |
Saeedi P, Petersohn I, Salpea P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:results from the International Diabetes Federation Diabetes Atlas, 9(th) edition[J]. Diabetes Res Clin Pract, 2019, 157: 107843. DOI:10.1016/j.diabres.2019.107843 |
| [3] |
Guidelines for the prevention and control of type 2 diabetes in China (2017 Edition)[J]. Chin J Pract Intern Med (中国实用内科杂志), 2018, 38: 292-344.
|
| [4] |
Hurlow JJ, Humphreys GJ, Bowling FL, et al. Diabetic foot infection:a critical complication[J]. Int Wound J, 2018, 15: 814-821. DOI:10.1111/iwj.12932 |
| [5] |
Juster-Switlyk K, Smith AG. Updates in diabetic peripheral neuropathy[J]. f1000research, 2016, 5. (https://f1000research.com/articles/5-738/v1).
|
| [6] |
John S. Complication in diabetic nephropathy[J]. Diabetes Metab Syndr, 2016, 10: 247-249. DOI:10.1016/j.dsx.2016.06.005 |
| [7] |
Yu J, Hua F, Hu Z. Advances in the studies of the link between diabetes and cancer[J]. Acta Pharm. Sin (药学学报), 2016, 51: 1017-1024. |
| [8] |
Wang T, Yin X. Advances in therapeutics of type 2 diabetes mellitus[J]. Prog Pharm Sci (药学进展), 2016, 40: 323-330. |
| [9] |
Zhang S, Xiong L, Yang Z, et al. Research progress of novel targets for discovery of anti-type 2 diabetes agents[J]. Chin J New Drugs (中国新药杂志), 2019, 28: 1718-1726. |
| [10] |
Chu ZL, Jones RM, He H, et al. A role for beta-cell-expressed G protein-coupled receptor 119 in glycemic control by enhancing glucose-dependent insulin release[J]. Endocrinology, 2007, 148: 2601-2609. DOI:10.1210/en.2006-1608 |
| [11] |
Chu ZL, Carroll C, Alfonso J, et al. A role for intestinal endocrine cell-expressed g protein-coupled receptor 119 in glycemic control by enhancing glucagon-like peptide-1 and glucose-dependent insulinotropic peptide release[J]. Endocrinology, 2008, 149: 2038-2047. DOI:10.1210/en.2007-0966 |
| [12] |
Shah U, Kowalski TJ. GPR119 agonists for the potential treatment of type 2 diabetes and related metabolic disorders[J]. Vitam Horm, 2010, 84: 415-448. DOI:10.1016/B978-0-12-381517-0.00016-3 |
| [13] |
Soga T, Ohishi T, Matsui T, et al. Lysophosphatidylcholine enhances glucose-dependent insulin secretion via an orphan G-protein-coupled receptor[J]. Biochem Biophys Res Commun, 2005, 326: 744-751. DOI:10.1016/j.bbrc.2004.11.120 |
| [14] |
Chu ZL, Carroll C, Chen R, et al. N-Oleoyldopamine enhances glucose homeostasis through the activation of GPR119[J]. Mol Endocrinol, 2010, 24: 161-170. DOI:10.1210/me.2009-0239 |
| [15] |
Syed SK, Bui HH, Beavers LS, et al. Regulation of GPR119 receptor activity with endocannabinoid-like lipids[J]. Am J Physiol Endocrinol Metab, 2012, 303: E1469-E1478. DOI:10.1152/ajpendo.00269.2012 |
| [16] |
Fyfe MC, McCormack JG, Overton HA, et al. GPR119 agonists as potential new oral agents for the treatment of type 2 diabetes and obesity[J]. Expert Opin Drug Discov, 2008, 3: 403-413. DOI:10.1517/17460441.3.4.403 |
| [17] |
Ritter K, Buning C, Halland N, et al. G Protein-coupled receptor 119(GPR119) agonists for the treatment of diabetes:recent progress and prevailing challenges[J]. J Med Chem, 2016, 59: 3579-3592. DOI:10.1021/acs.jmedchem.5b01198 |
| [18] |
Abdel-Magid AF. Treatment of diabetes, obesity, dyslipidemia, and related disorders with GPR119 agonists[J]. ACS Med Chem Lett, 2019, 10: 14-15. DOI:10.1021/acsmedchemlett.8b00622 |
| [19] |
Hu YW, Yang JY, Ma X, et al. A lincRNA-DYNLRB2-2/GPR119/GLP-1R/ABCA1-dependent signal transduction pathway is essential for the regulation of cholesterol homeostasis[J]. J Lipid Res, 2014, 55: 681-697. DOI:10.1194/jlr.M044669 |
| [20] |
Bahirat UA, Shenoy RR, Goel RN, et al. APD668, a G protein-coupled receptor 119 agonist improves fat tolerance and attenuates fatty liver in high-trans fat diet induced steatohepatitis model in C57BL/6 mice[J]. Eur J Pharmacol, 2017, 801: 35-45. DOI:10.1016/j.ejphar.2017.02.043 |
| [21] |
Yang JW, Kim HS, Im JH, et al. GPR119:a promising target for nonalcoholic fatty liver disease[J]. FASEB J, 2016, 30: 324-335. DOI:10.1096/fj.15-273771 |
| [22] |
Yang JW, Kim HS, Choi YW, et al. Therapeutic application of GPR119 ligands in metabolic disorders[J]. Diabetes Obes Metab, 2018, 20: 257-269. DOI:10.1111/dom.13062 |
| [23] |
Chen Z, Wang L, Hu R. Effect of GPR119 on lipid metabolism related gene expression[J]. China Mod Med (中国当代医药), 2017, 24: 138-139. |
| [24] |
Chen Z, Wang L, Zhong J, et al. Mechanism of GPR119 in regulating lipid metabolism and anti-atherosclerosis by hypoxia-inducible factor-1α/vascular endothelial growth factor pathway[J]. Chin J Endocronol Matab (中华内分泌代谢杂志), 2019, 35: 1055-1056. |
| [25] |
Kim HJ, Yoon HJ, Park JW, et al. G protein-coupled receptor 119 is involved in RANKL-induced osteoclast differentiation and fusion[J]. J Cell Physiol, 2019, 234: 11490-11499. DOI:10.1002/jcp.27805 |
| [26] |
Kim HJ, Lee DK, Jin X, et al. Oleoylethanolamide exhibits GPR119-dependent inhibition of osteoclast function and GPR119-independent promotion of osteoclast apoptosis[J]. Mol Cells, 2020, 43: 340-349. |
| [27] |
Im JH, Kang KW, Kim SY, et al. GPR119 agonist enhances gefitinib responsiveness through lactate-mediated inhibition of autophagy[J]. J Exp Clin Cancer Res, 2018, 37: 295. DOI:10.1186/s13046-018-0949-2 |
| [28] |
Semple G, Fioravanti B, Pereira G, et al. Discovery of the first potent and orally efficacious agonist of the orphan G-protein coupled receptor 119[J]. J Med Chem, 2008, 51: 5172-5175. DOI:10.1021/jm8006867 |
| [29] |
Matsumoto K, Yoshitomi T, Ishimoto Y, et al. DS-8500a, an orally available G protein-coupled receptor 119 agonist, upregulates glucagon-like peptide-1 and enhances glucose-dependent insulin secretion and improves glucose homeostasis in type 2 diabetic rats[J]. J Pharmacol Exp Ther, 2018, 367: 509-517. DOI:10.1124/jpet.118.250019 |
| [30] |
Bahirat UA, Shenoy RR, Talwar R, et al. Co-administration of APD668, a G protein-coupled receptor 119 agonist and linagliptin, a DPPIV inhibitor, prevents progression of steatohepatitis in mice fed on a high trans-fat diet[J]. Biochem Biophys Res Commun, 2018, 495: 1608-1613. DOI:10.1016/j.bbrc.2017.12.004 |
| [31] |
ClinicalTrials.gov. The clinical trials of GPR119 agonists[EB/OL]. United States: U.S. National Library of Medicine, 2008[2020-8-1]. https://clinicaltrials.gov/.
|
| [32] |
Kim JH, Kim Y, Kim R, et al. 1162-P:DA-1241, a novel GPR119 agonist, improves hyperglycaemia by inhibiting hepatic gluconeogenesis and enhancing insulin secretion via stimulation of GLP-1 secretion[J]. Diabetes, 2019. DOI:10.2337/db19-1162-P |
| [33] |
Spasov AA, Kosolapov VA, Babkov DA, et al. Effect of GRP119 receptor agonist, compound MBX-2982, on activity of human glucokinase[J]. Bull Exp Biol Med, 2017, 163: 695-698. DOI:10.1007/s10517-017-3881-0 |
| [34] |
Katz LB, Gambale JJ, Rothenberg PL, et al. Effects of JNJ-38431055, a novel GPR119 receptor agonist, in randomized, double-blind, placebo-controlled studies in subjects with type 2 diabetes[J]. Diabetes Obes Metab, 2012, 14: 709-716. DOI:10.1111/j.1463-1326.2012.01587.x |
| [35] |
Kang SU. GPR119 agonists:a promising approach for T2DM treatment? A SWOT analysis of GPR119[J]. Drug Discov Today, 2013, 18: 1309-1315. DOI:10.1016/j.drudis.2013.09.011 |
| [36] |
Nunez DJ, Bush MA, Collins DA, et al. Gut hormone pharmacology of a novel GPR119 agonist (GSK1292263), metformin, and sitagliptin in type 2 diabetes mellitus:results from two randomized studies[J]. PLoS One, 2014, 9: e92494. DOI:10.1371/journal.pone.0092494 |
| [37] |
Scheen AJ. Investigational insulin secretagogues for type 2 diabetes[J]. Expert Opin Investig Drugs, 2016, 25: 405-422. DOI:10.1517/13543784.2016.1152260 |
| [38] |
Zuo Z, Chen M, Shao X, et al. Design and biological evaluation of tetrahydropyridine derivatives as novel human GPR119 agonists[J]. Bioorg Med Chem Lett, 2020, 30: 126855. DOI:10.1016/j.bmcl.2019.126855 |
| [39] |
Kim H, Cho SJ, Yoo M, et al. Synthesis and biological evaluation of thiazole derivatives as GPR119 agonists[J]. Bioorg Med Chem Lett, 2017, 27: 5213-5220. DOI:10.1016/j.bmcl.2017.10.046 |
| [40] |
Harada K, Mizukami J, Watanabe T, et al. Optimization of oxadiazole derivatives with a spirocyclic cyclohexane structure as novel GPR119 agonists[J]. Bioorg Med Chem Lett, 2019, 29: 2100-2106. DOI:10.1016/j.bmcl.2019.07.004 |
| [41] |
Bashetti N, Shanmukha KJ, Seelam NV, et al. One-pot synthesis of novel tert-butyl-4-substituted phenyl-1H-1, 2, 3-triazolo piperazine/piperidine carboxylates, potential GPR119 agonists[J]. Bioorg Med Chem Lett, 2019, 29: 126707. DOI:10.1016/j.bmcl.2019.126707 |
| [42] |
Neelamkavil SF, Stamford AW, Kowalski T, et al. Discovery of MK-8282 as a potent g-protein-coupled receptor 119 agonist for the treatment of type 2 diabetes[J]. ACS Med Chem Lett, 2018, 9: 457-461. DOI:10.1021/acsmedchemlett.8b00073 |
| [43] |
Yang Z, Fang Y, Pham TA, et al. Synthesis and biological evaluation of 5-nitropyrimidine analogs with azabicyclic substituents as GPR119 agonists[J]. Bioorg Med Chem Lett, 2013, 23: 1519-1521. DOI:10.1016/j.bmcl.2012.12.011 |
| [44] |
Fang Y, Yang Z, Gundeti S, et al. Novel 5-nitropyrimidine derivatives bearing endo-azabicyclic alcohols/amines as potent GPR119 agonists[J]. Bioorg Med Chem, 2017, 25: 254-260. DOI:10.1016/j.bmc.2016.10.030 |
| [45] |
Yang Z, Fang Y, Park H. Synthesis and biological evaluation of pyrimidine derivatives with diverse azabicyclic ether/amine as novel GPR119 agonist[J]. Bioorg Med Chem Lett, 2017, 27: 2515-2519. DOI:10.1016/j.bmcl.2017.03.092 |
| [46] |
Harada K, Mizukami J, Watanabe T, et al. Lead generation and optimization of novel GPR119 agonists with a spirocyclic cyclohexane structure[J]. Bioorg Med Chem Lett, 2019, 29: 373-379. DOI:10.1016/j.bmcl.2018.12.041 |
| [47] |
Han T, Lee BM, Park YH, et al. YH18968, a novel 1, 2, 4-triazolone G-protein coupled receptor 119 agonist for the treatment of type 2 diabetes mellitus[J]. Biomol Ther (Seoul), 2018, 26: 201-209. DOI:10.4062/biomolther.2018.011 |
| [48] |
Fang Y, Xu J, Li Z, et al. Design and synthesis of novel pyrimido[5, 4-d]pyrimidine derivatives as GPR119 agonist for treatment of type 2 diabetes[J]. Bioorg Med Chem, 2018, 26: 4080-4087. DOI:10.1016/j.bmc.2018.06.035 |
| [49] |
Fang Y, Zhang S, Li M, et al. Optimisation of novel 4, 8-disubstituted dihydropyrimido[5, 4-b] [1, 4]oxazine derivatives as potent GPR 119 agonists[J]. J Enzyme Inhib Med Chem, 2020, 35: 50-58. DOI:10.1080/14756366.2019.1681988 |
| [50] |
Matsuda D, Kobashi Y, Mikami A, et al. Design and synthesis of 1H-pyrazolo[3, 4-c]pyridine derivatives as a novel structural class of potent GPR119 agonists[J]. Bioorg Med Chem Lett, 2016, 26: 3441-3446. DOI:10.1016/j.bmcl.2016.06.050 |
| [51] |
Matsuda D, Kobashi Y, Mikami A, et al. Novel 3H-[1, 2, 3]triazolo[4, 5-c]pyridine derivatives as GPR119 agonists:synthesis and structure-activity/solubility relationships[J]. Bioorg Med Chem, 2017, 25: 4339-4354. DOI:10.1016/j.bmc.2017.06.014 |
| [52] |
Koshizawa T, Morimoto T, Watanabe G, et al. Optimization of a novel series of potent and orally bioavailable GPR119 agonists[J]. Bioorg Med Chem Lett, 2017, 27: 3249-3253. DOI:10.1016/j.bmcl.2017.06.034 |
| [53] |
Liu P, Hu Z, DuBois BG, et al. Design of potent and orally active GPR119 agonists for the treatment of type Ⅱ diabetes[J]. ACS Med Chem Lett, 2015, 6: 936-941. DOI:10.1021/acsmedchemlett.5b00207 |
| [54] |
Zhu C, Wang L, Zhu Y, et al. Discovery of phenyl acetamides as potent and selective GPR119 agonists[J]. Bioorg Med Chem Lett, 2017, 27: 1124-1128. DOI:10.1016/j.bmcl.2017.01.091 |
| [55] |
Harada K, Mizukami J, Kadowaki S, et al. Design and synthesis of novel and potent GPR119 agonists with a spirocyclic structure[J]. Bioorg Med Chem Lett, 2018, 28: 1228-1233. DOI:10.1016/j.bmcl.2018.02.044 |
| [56] |
Tadaki H, Sasase T, Fukuda S, et al. Chronic treatment of JTP-109192, a novel G-protein coupled receptor 119 agonist, improves metabolic abnormalities in Zucker Fatty rats[J]. Clin Exp Pharmacol Physiol, 2019, 46: 910-919. DOI:10.1111/1440-1681.13152 |
| [57] |
Matsuda D, Kawamura M, Kobashi Y, et al. Design, synthesis and biological evaluation of novel 7-azaspiro[3.5]nonane derivatives as GPR119 agonists[J]. Bioorg Med Chem, 2018, 26: 1832-1847. DOI:10.1016/j.bmc.2018.02.032 |
| [58] |
Kato M, Furuie H, Kamiyama E, et al. Safety and pharmacokinetics of DS-8500a, a novel GPR119 agonist, after multiple oral doses in healthy Japanese males[J]. Clin Drug Investig, 2018, 38: 519-525. DOI:10.1007/s40261-018-0633-5 |
| [59] |
Ansarullah, Lu Y, Holstein M, et al. Stimulating beta-cell regeneration by combining a GPR119 agonist with a DPP-Ⅳ inhibitor[J]. PLoS One, 2013, 8: e53345. |
| [60] |
Park YH, Choi HH, Lee DH, et al. YH18421, a novel GPR119 agonist exerts sustained glucose lowering and weight loss in diabetic mouse model[J]. Arch Pharm Res, 2017, 40: 772-782. |
| [61] |
Yamada Y, Terauchi Y, Watada H, et al. Efficacy and safety of GPR119 agonist DS-8500a in Japanese patients with type 2 diabetes:a randomized, double-blind, placebo-controlled, 12-week study[J]. Adv Ther, 2018, 35: 367-381. DOI:10.1007/s12325-018-0668-2 |
| [62] |
Zhou J, Jiang X, Feng F, et al. Multi-target drug design strategy and its research progress[J]. Acta Pharm. Sin (药学学报), 2018, 53: 2012-2025. |
| [63] |
Jiang Q, Huan Y, Sun S, et al. Improved effect of novel structure compound SJ001 targeting dual DPP4 and GPR119 on KKAy glucose metabolism disorder in type 2 diabetic mice[C]//The 14th National Conference on Biochemistry and Molecular Pharmacology Proceedings (第十四届全国生化与分子药理学学术会议论文集). Inner Mongolia: Chinese Pharmacological Society, 2015: 78.
|
| [64] |
Li G, Huan Y, Yuan B, et al. Discovery of novel xanthine compounds targeting DPP-Ⅳ and GPR119 as anti-diabetic agents[J]. Eur J Med Chem, 2016, 124: 103-116. |
| [65] |
Huan Y, Jiang Q, Li G, et al. The dual DPP4 inhibitor and GPR119 agonist HBK001 regulates glycemic control and beta cell function ex and in vivo[J]. Sci Rep, 2017, 7: 4351. |
| [66] |
Fang Y, Zhang S, Wu W, et al. Design and synthesis of tetrahydropyridopyrimidine derivatives as dual GPR119 and DPP-4 modulators[J]. Bioorg Chem, 2020, 94: 103390. |
| [67] |
Li G, Meng B, Yuan B, et al. The optimization of xanthine derivatives leading to HBK001 hydrochloride as a potent dual ligand targeting DPP-Ⅳ and GPR119[J]. Eur J Med Chem, 2020, 188: 112017. |
 2020, Vol. 55
2020, Vol. 55