糖尿病是世界范围内的高发疾病, 其中我国患病人数最高, 20~79岁人群患者数量达1.164亿[1]。糖尿病患者中, 约20%可出现伤口愈合困难[2]。糖尿病伤口愈合困难导致的糖尿病足是最严重的并发症。全球糖尿病患者中糖尿病足的发病率约为6.4%, 1%的糖尿病患者由于足部病变而不得不截肢[1], 甚至导致死亡, 是花费最高的糖尿病并发症[3]。
1 糖尿病伤口愈合过程的特点伤口愈合通常经历如下阶段:止血、炎症、增殖、收缩和重塑[4]。正常伤口愈合级联的进行依赖生长因子、基质金属蛋白酶(matrix metalloproteinases, MMP)、细胞因子、炎性细胞、角质形成细胞、成纤维细胞和内皮细胞的协调和同步。临床及实验研究发现, 糖尿病伤口的愈合过程一般不严格遵循上述正常伤口愈合的过程, 在不同阶段均可出现停滞。
在正常情况下, 皮肤受损后, 血小板发生聚集, 趋化因子和生长因子释放, 形成凝血级联进行止血。伤口处的中性粒细胞清理碎片和细菌, 随后巨噬细胞聚集并吞噬侵入细菌和受损组织。这一阶段通常持续72 h。糖尿病伤口的炎症细胞功能受损, 凋亡异常, 极易引发感染。炎症信号传导异常, 炎症介质增加, 伤口处于慢性炎症状态难以进入下一阶段[5]。在正常伤口增殖期, 伤口处成纤维细胞、角质细胞和内皮细胞增殖, 大量血管新生。蛋白多糖、玻尿酸、胶原和弹性纤维共同形成细胞外基质, 代替凝血级联覆盖伤口。多种细胞因子和生长因子在这一阶段发挥作用, 如转录生长因子-β家族、白介素(interleukin, IL)家族和血管新生因子。这一阶段通常持续几天或几周。糖尿病状态下高血糖、胰岛素抵抗、氧化应激水平升高引起伤口血管新生和细胞增生减少, 多种细胞因子及生长因子表达降低, 导致伤口难以愈合[6]。正常伤口愈合的最后阶段是重塑期, 在此阶段, 细胞凋亡和细胞新生达到平衡, 受损区域血液供应减少至正常, 细胞外基质中蛋白和胶原等成分趋于稳定, 这个过程将会持续几个月甚至几年[7]。而对于糖尿病伤口来说, 细胞凋亡的异常和胶原、蛋白生成转化的减少使得这一过程难以正常进行[8]。
2 影响糖尿病伤口愈合的机制在糖尿病状态下, 由胰岛素绝对或相对缺乏导致糖脂代谢紊乱, 进而带来一系列影响[9]。糖尿病状态下氧化应激水平升高, 贯穿伤口愈合的整个阶段, 是影响糖尿病伤口愈合的重要原因[2]。另外, 能量物质代谢异常可引起免疫细胞及信号转导等异常, 也是导致伤口慢性长期炎症进而影响愈合的重要因素[10]。在氧化应激、慢性炎症及其他因素的作用下, 糖尿病状态下的伤口还存在缺氧、血管新生异常、神经受损且表皮神经数量减少[11]、生长因子分泌减少、细胞外基质成分积累与基质金属蛋白酶重构失衡等问题。上述因素相互作用及促进, 共同导致糖尿病患者伤口愈合缓慢[2] (图 1)。
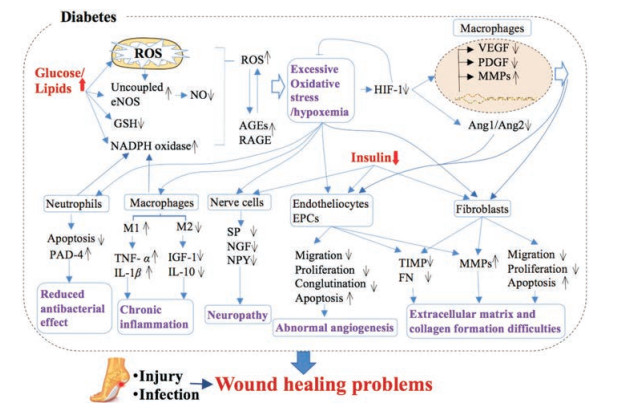
|
Figure 1 Mechanisms of diabetic wound healing difficulties. AGE/RAGE: Glycosylated end product/glycosylated end product receptor; Ang1/Ang2: Angiogenin 1/angiogenin 2; EPCs: Bone marrow endothelial progenitor cells; FN: Fibronectin; HIF-1: Hypoxia induction factor-1; IGF-1: Insulin-like growth factor-1; IL-1: Interleukin 1; IL-10: Interleukin 10; MMPs: Matrix metalloproteinases; NGF: Nerve growth factor; NO: Nitric oxide; NPY: Neuropeptide Y; PAD-4: Peptidylarginine deaminase-4; PDGF: Platelet-derived growth factor; ROS: Reactive oxygen species; SP: Substance P; TIMP: Metalloproteinase inhibitor; TNF-α: Tumor necrosis factor-α; VEGF: Vascular endothelial growth factor |
氧化还原在伤口愈合的过程中是必要的, 但糖尿病状态下过度的氧化还原及产物影响伤口的炎症、增殖和收缩各个阶段, 抑制了伤口的愈合。正常状态下, 炎症期伤口处中性粒细胞和巨噬细胞通过NADPH (nicotinamide adenine dinucleotide phosphate)氧化酶(NADPH oxidase, NOX)途径产生大量O2-和H2O2, 是杀死细菌并预防伤口感染等的主要机制。活性氧(reactive oxygen species, ROS)可刺激细胞因子和生长因子包括巨噬细胞集落刺激因子、血小板衍生生长因子(platelet-derived growth factor, PDGF)和肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)等的释放。在增殖阶段, 少量ROS可促进成纤维细胞的增殖和迁移、胶原和纤连蛋白(fibronectin, FN)的生成、刺激血管生成并促进上皮再生, 但高水平的ROS则会阻碍这一过程。伤口处的ROS受活性氧清除酶的调控, 如超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶以及小分子抗氧化剂。活性氧的生成与清除是保证伤口愈合有效性和及时性的必要条件, 抗氧化酶的失活、中和O2-的一氧化氮(nitric Oxide, NO)的显著减少或添加外源性H2O2都会导致氧化还原失衡[12]。
糖尿病创面的特点是高水平的ROS。在伤口愈合的整个阶段, 高糖、高脂等可导致能量代谢底物增加, 使电子传递链中电子给体产生过量超氧化物并促进氧化应激及相应产物的增加[13]。这些产物能够激活多元醇、己糖胺、二酰基甘油和蛋白激酶C (protein kinase C, PKC)等途径, 诱导晚期糖基化终末产物(glycosylated end product, AGEs)的生成[14], 一氧化氮合酶(endothelial nitric oxide synthase, eNOS)解偶联导致NO生成减少, 加剧了伤口愈合困难[15]。在伤口愈合的炎症期, 作为ROS主要来源的Nox活性也增加, 使伤口氧化应激水平进一步升高[12]。高血糖和AGEs的生成会阻碍巨噬细胞清除凋亡中性粒细胞的吞噬能力, 导致伤口中出现更多的促炎巨噬细胞, 从而促进持续的促炎状态。在伤口增殖期, AGEs可通过激活晚期糖基化终末产物受体(glycosylated end product receptor, RAGE), 抑制人真皮成纤维细胞的增殖并诱导凋亡, 同时抑制成纤维细胞、角质细胞和内皮细胞的迁移和黏附, 并促进成纤维细胞的衰老, 阻碍正常愈合中的纤维化[16]。AGEs与其受体RAGE结合产生O2-和H2O2, 加剧糖尿病患者线粒体中超氧化物的产生, 而线粒体产生的ROS进一步增加了RAGE的表达, 形成恶性循环。在糖尿病进程中活性氧的增加伴随着抗氧化作用的减少:在糖尿病患者和2型糖尿病db/db小鼠的伤口组织中, 自由基清除剂谷胱甘肽(glutathione, GSH)和NO显著减少, 糖尿病患者抗氧化酶的表达也减少, 创面的MnSOD (manganese-containing superoxide dismutase)活性增加[17], 氧化还原进一步失衡。在伤口收缩及重塑期, 细胞外基质(extracellular matrix, ECM)中细胞间隙的抗氧化酶水平较低, 容易受到氧化损伤。高水平ROS能显著损害ECM中的蛋白多糖, 同时通过糖基化和氧化反应介导AGE的积累, 进一步使得胶原蛋白、弹性蛋白和纤连蛋白糖基化, 同时氧化信号也调控MMP的表达, 从而影响ECM重构[18, 19]。
2.2 慢性炎症在正常伤口的炎症阶段, 中性粒细胞和单核细胞迅速迁移至受损部位, 并在几小时内释放细胞因子和生长因子。中性粒细胞通过释放大量高活性抗菌物质如活性氧、髓过氧化物酶(myeloperoxidase, MPO)和基质金属蛋白酶等吞噬微生物及死亡组织[20]。巨噬细胞M1表型在炎症初期可以杀死微生物, 释放促炎因子, 到炎症后期则会转换成M2表型, 释放抗炎因子和促愈合因子如胰岛素样生长因子-1 (insulin-like growth factor-1, IGF-1)和转化生长因子β (transforming growth factor-β, TGF-β), 完成伤口从炎症向增殖的转换[21]。
炎症对伤口的愈合发挥双向作用, 一定程度的炎症反应可促进伤口愈合。而无论1型或2型糖尿病患者均存在过度的炎症反应, 即炎症阶段过渡到增殖阶段困难, 可导致长期慢性炎症状态[5]。在2型糖尿病患者中, 长期糖脂代谢异常可导致炎症介质的释放, 从而吸引单核巨噬细胞及其他免疫细胞浸润, 且炎症细胞的凋亡延迟, 加剧炎症介质的产生, 导致全身低级别炎症状态[5]。在糖尿病患者伤口的炎症期, 中性粒细胞和巨噬细胞聚集缓慢, 炎症因子表达基线升高, 且巨噬细胞吞噬能力下降[22]。白细胞的吞噬能力受损, 炎症细胞因子在糖尿病创面中存在的时间远远超过正常时间, 以补偿白细胞活性的降低, 延长炎症期, 抑制肉芽组织的形成[23]。糖尿病可诱导巨噬细胞的促炎表型, 且难以从促炎表型转换为抗炎表型。在小鼠和人中表现为白介素-1β (interleukin 1β, IL-1β)、TNF-α和MMP-9高表达[24]及db/db小鼠抗炎因子表达降低[25]。糖尿病患者AGE与RAGE的结合可导致氧化应激水平升高, 凋亡水平增加, 中性粒细胞增殖和功能下降, 使伤口更容易感染。研究还发现, 链脲佐菌素(streptozocin, STZ)诱导的糖尿病小鼠和db/db小鼠都存在中性粒细胞肽酰精氨酸脱氨酶-4 (peptidylarginine deaminase-4, PAD-4)的表达上调, 其介导的组蛋白瓜氨酸化最终导致炎症反应的进一步增强, 干扰小鼠伤口愈合[26]。此外, 中性粒细胞为阻止微生物感染形成的污染而释放蛋白酶, 长期炎症状态下蛋白酶会破坏新的细胞外基质, 导致水肿和局部损伤并维持炎症级联[6]。
2.3 血管新生异常血管生成不足是造成糖尿病伤口愈合困难的重要原因。在正常伤口的增殖期, 血管数量达到顶峰, 远高于正常皮肤。接着促血管生成因子表达降低, 抗血管生成因子如色素内皮衍生因子(pigment epithelium-derived factor, PEDF)和快速发育生长因子同源蛋白2 (sprouty homolog 2, SPRY2)表达增加, 介导内皮细胞的凋亡, 血管系统从增殖期进入成熟期, 伤口处血管数量趋于正常皮肤[27]。
糖尿病血管的新生减少主要影响伤口愈合的增殖期。巨噬细胞是伤口中血管内皮生长因子(vascular endothelial growth factor, VEGF)和其他促血管生成介质的主要来源[28]。在糖尿病伤口的炎症期, 巨噬细胞表型改变, 不能促进组织修复等的缺陷可能与糖尿病伤口血管生成有关。在伤口增殖期, VEGF-A作为促血管生成因子, 其刺激后小鼠伤口愈合速度加快。但在db/db小鼠中, 由于低氧应答受损, 低氧诱导因子1 (hypoxia induction factor-1, HIF-1)表达降低, 下游Vegf-a mRNA表达水平降低, 且糖尿病足溃疡患者抗血管生成的因子PEDF的血清水平较高, 这些都可能会对伤口愈合产生负面影响[29]。Ang1/Ang2/Tie2 (angiogenin 1/angiogenin 2/tyrosine kinase receptor 2)是促进糖尿病创面血管成熟的通路, 在2型糖尿病患者中, Ang1与Ang2表达量都有所减少, 且Ang1与Ang2的比值降低, 使得糖尿病创面血管系统向成熟表型转变的可能受到干扰[30, 31]。PDGF是糖尿病状态下血管的成熟因子之一, 不仅可以稳定毛细血管, 也被证明可以提高糖尿病创面的愈合率, 重组PDGF也是目前唯一可用的治疗糖尿病溃疡的生长因子[32], 但在db/db小鼠中, PDGF及其受体表达水平较低。除了促血管生成因子和血管成熟因子发生变化外, 糖尿病状态还会导致骨髓内皮祖细胞(endothelial progenitor cells, EPCs)数量的减少。这种缺陷反过来又降低了糖尿病组织的基线血管分布, 并可能影响创面血管生成[33]。血管生成的减少引起慢性伤口长期缺血, 阻碍中性粒细胞介导的杀菌机制, 同时引起伤口部位缺氧, 诱发一系列反应。
2.4 组织低氧一定水平的低氧可促进伤口愈合, 如缺氧诱导的HIF-1适量表达有助于促进创面愈合。在创口炎症期, HIF-1促进巨噬细胞募集和分化[34, 35]。在伤口增殖期, HIF-1通过激活VEGF和Ang2等多种血管生成因子的转录促进血管向创面低氧区生长, 增加伤口处骨髓祖细胞的招募和迁移, 进一步促进新血管的生成和伤口愈合[36]。
糖尿病状态下, 氧化应激产物ROS及H2O2水平升高, 下调了HIF-1信号及靶标基因[37]。低氧诱导因子的缺乏及长期过度低氧状态主要影响伤口的炎症期和增殖期。研究发现, 自发性2型糖尿病db/db小鼠的伤口处HIF-1α和靶基因的表达都有所降低, 造成细胞低氧应答受损, 阻碍血管生成, 导致伤口愈合减缓[37]。在临床糖尿病足溃疡患者的活检中同样发现HIF-1α表达降低[38]。研究表明, 高血糖会导致HIF-1-甲氧基嘌呤的失稳, 还会导致HIF-1在Arg17和Arg23的螺旋-环-螺旋结构域修饰增加。这些修饰会干扰HIF-1α和HIF-1β的二聚化, 从而导致HIF-1蛋白和下游靶基因的表达降低。当伤口处于炎症期时, 长期过度缺氧会影响中性粒细胞及巨噬细胞的功能。大量研究显示, 感染与伤口氧合呈负相关, 可能是由于中性粒细胞内的髓过氧化物酶等抗菌酶的氧依赖活性较高, 使得缺氧状态下的伤口抗菌能力大大降低, 且伤口床内缺氧有助于细菌的定植[39]。另外高血糖和高血脂可直接引起血液黏度升高, 在小血管中停滞, 加之糖基化血红蛋白对氧的亲和力较高, 都会使得伤口组织难以获取氧而处于低氧状态。对增殖期的影响主要体现在HIF-1的减少造成血管新生和细胞增生的减少。
2.5 外周神经病变糖尿病患者的外周末梢神经病变可导致伤口愈合受阻。糖尿病外周神经病变是由多种因素作用下导致的, 如氧化应激[40]、低氧、AGEs、T淋巴细胞激活和神经生长因子(nerve growth factor, NGF)缺乏等[41]。
外周神经病变可分为感觉、运动和自主周围神经病变。感觉神经病变导致疼痛症状的缺乏; 运动神经病变导致足负荷不平衡, 重新分配的足部持续压力可造成局部缺血坏死, 进一步促进破损及溃疡的发生; 周围自主神经病变导致汗液分泌障碍, 皮肤干燥, 使保护功能降低及受伤风险增加[42, 43]。上述过程不仅可直接导致伤口形成, 还会进一步影响伤口愈合炎症期和增殖期。研究发现, 糖尿病患者和模型动物皮肤表面神经纤维均减少, 神经源性介质如P物质缺乏可导致损伤反应的减弱和神经炎症信号不足。神经肽Y (neuropeptide, NPY)能够调节血管收缩, 刺激血管平滑肌细胞增殖, 能抑制T细胞活化, 影响巨噬细胞的迁移, 从而调节炎症信号。但在糖尿病患者和糖尿病大鼠中, 皮肤中的神经肽Y表达都有所降低[44]。
2.6 细胞外基质异常细胞外基质积累及重塑的异常主要影响糖尿病伤口愈合的增殖期和重塑期。细胞外基质是促进伤口愈合的重要组织, 开始以纤维蛋白凝块形式存在, 接着肉芽组织形成填补缺损组织。成纤维细胞产生胶原纤维后变为纤维细胞, 肉芽组织成熟变为纤维结缔组织, 并发生玻璃样变化而变为瘢痕。细胞外基质是生长因子重要的靶组织, 也是细胞与细胞、细胞与基质、基质与蛋白之间相互作用的媒介[45]。
成纤维细胞是ECM的产生和重组的关键。在伤口增殖期糖尿病状态下, 过度氧化应激引起的H2O2升高会抑制成纤维细胞的增殖, 纤维母细胞迁移可被线粒体产生的过量O2-所抑制, 细胞内ROS的增加介导成纤维细胞的衰老和凋亡[46]。大多数氨基酸容易被自由基ROS修饰, 从而干扰蛋白质的结构和功能。胶原是ECM中最丰富的蛋白, 胶原蛋白的氧化会破坏其三重螺旋结构, 并导致分子间和分子内不适当的交联。糖尿病患者的I型胶原向III型胶原的转化减少, 胶原纤维蛋白间距增加, 伤口可承受的拉力降低, 导致其伤口更容易受到二次伤害而破裂。在糖尿病大鼠中, I、III、IV、V、VI、XIV和XVII型胶原的表达都有所降低[47]。纤连蛋白是肉芽组织的重要组成成分, 是I型胶原的前体。研究发现db/db小鼠皮肤中的纤连蛋白明显减少, 外用纤连蛋白基质类似物会促进小鼠伤口愈合[48]。糖尿病患者的纤连蛋白受AGE影响, 降低了其支持细胞黏附、扩散和迁移的能力, 并可与胶原蛋白和肝素结合[49]。当伤口处于重塑期时, 基质金属蛋白酶在ECM中发挥分解胶原、纤连蛋白及其他蛋白成分的作用, 氧化还原信号H2O2能诱导细胞中MMP-1和MMP-8的表达, 影响ECM的重构。基质金属蛋白酶在糖尿病患者及糖尿病大鼠模型的皮肤中活性高, 且与其抑制剂的失衡, 影响了糖尿病患者ECM的沉积, 促进了其分解[50]。除此之外, 糖尿病状态及其造成的氧化应激水平的升高而引起的糖基化反应会造成: ①胶原基质弹性降低, 降低肌成纤维细胞的收缩, 阻碍瘢痕形成; ②形成分子上的一系列连锁反应, 干扰其他基质成分, 影响正常基质聚集; ③阻碍基质金属蛋白酶的分解, 干扰基质重塑[51]。
2.7 细胞凋亡失调凋亡在伤口愈合的各个阶段均发挥作用。免疫细胞的凋亡是炎症结束和愈合开始的关键。在炎症期, 为防止进一步的炎症反应, 中性粒细胞发生凋亡并被巨噬细胞吞噬清除。随着伤口的成熟, 不同的细胞群需要被清除, 成纤维细胞发生凋亡, 形成相对无细胞的瘢痕组织, 其抗牵拉程度与未损皮肤相当。细胞凋亡还参与肉芽组织向瘢痕组织的演变, 在组织重塑中起重要作用。
在2型糖尿病慢性不愈合伤口患者中, 氧化应激产物活性氧和AGE的增加引起线粒体损伤, 导致半胱氨酸蛋白酶(cysteinyl aspartate specific proteinase, caspase)、FAS (factor associated suicide)、BAX (Bcl-2 associated X protein)等促凋亡蛋白表达增加, 而抗凋亡蛋白如B细胞淋巴瘤2蛋白(B cell lymphoma-2, Bcl-2)表达减少, 最终引起多种细胞如成纤维细胞和血管平滑肌细胞的凋亡[52]。研究发现, 在伤口愈合的炎症期, 非糖尿病小鼠炎症细胞在12 h检测到凋亡, 损伤第5天达到高峰, 而糖尿病小鼠则出现凋亡延迟[53]。充分的细胞凋亡可清除组织中不需要的细胞, 防止过度瘢痕化和增强炎症反应。在伤口处于增殖和重塑期时, 糖尿病状态下过度的细胞凋亡可导致结构重组不良, 可通过移除肉芽组织中的有效细胞(包括成纤维细胞、内皮细胞和小血管细胞), 使伤口暴露于感染中[52]。在这个过程中, 基质金属蛋白酶和金属蛋白酶-1组织抑制剂(tissue inhibitor of matrix metalloproteinases-1, TIMP-1)之间的平衡是炎症细胞及细胞外基质凋亡的关键。近期研究发现, 糖尿病大鼠糖尿病皮肤组织中TIMP-1表达水平显著降低, 而TIMP-1活性蛋白可以有效地阻止老化成纤维细胞的凋亡[54]。在创口闭合前后, 创面边缘表皮表达间隙连接蛋白(connexin, Cx), 在2个相邻细胞间形成通道以确保凋亡正确顺利进行, 而在糖尿病创面中的通道表达异常可能导致缝隙连接形成不当, 阻碍各种凋亡和炎症信号通过, 导致慢性糖尿病溃疡愈合延迟[55]。
2.8 其他因素糖尿病不仅会出现胰岛素的缺乏, 还存在生长因子水平与功能的异常。生长因子在开始和维持伤口愈合的不同阶段中起着至关重要的作用。任何生长因子受体和生长因子数量的改变都会导致糖尿病患者伤口愈合延迟。在糖尿病足溃疡的患者中存在多种细胞因子的改变, 可以通过调节细胞因子的水平来加速糖尿病患者伤口愈合的过程[56]。
3 治疗措施目前, 糖尿病患者的长期慢性伤口仍旧是临床治疗难点。临床的主要治疗措施包括在控制血糖的基础上预防伤口感染及促进伤口愈合。对于感染的控制主要为清创、使用敷料、全身及外用抗菌剂等。在促进糖尿病伤口愈合的药物方面, 主要包括生长因子、炎症调控药物、植物提取物、血液制品、生物疗法、伤口负压、高压氧疗法和皮肤替代疗法等[57]。PDGF是目前唯一美国食品药品监督管理局批准的治疗糖尿病足的生长因子, 但关于其在促进伤口愈合和防止截肢以及其安全性方面的有效性证据仍然有限。其他方法还有采用NO调节慢性创伤的炎症和组织重塑, 但治疗难度较大[58], 也有用干细胞疗法促进伤口血管新生, 但仍存在效果不确切的问题, 且治疗成本较高[59]。
4 结论与展望糖尿病作为一种长期慢性疾病, 其伴随的代谢异常等因素导致的伤口愈合困难是糖尿病患者常见的并发症。而造成糖尿病伤口愈合困难的机制较为复杂, 参与因素包括氧化应激水平升高、慢性炎症、血管新生异常、组织低氧、生长因子缺乏、外周神经病变、细胞外基质异常和细胞凋亡等。这些因素相互影响, 共同作用导致糖尿病创口难愈。另外, 细胞和细胞因子等在伤口愈合的不同阶段具有不同作用, 因此针对促进糖尿病伤口愈合的药物开发不仅需要考虑上述影响因素, 还需要针对不同阶段。综上, 对影响糖尿病伤口愈合机制的深入了解有助于开发更有效的促进伤口愈合的药物。
作者贡献:王诺琦负责论文的撰写; 杨秀颖和杜冠华负责论文的规划、指导及审阅。
利益冲突:利益冲突:所有作者均声明本论文与其他人或机构无任何利益冲突。
| [1] |
International Diabetes Federation: diabetes atlas IDF, 9th edition[EB/OL]. Brussels: International Diabetes Federation, 2019[2019-11-14]. https://www.diabetesatlas.org.
|
| [2] |
Patel S, Srivastava S, Singh MR, et al. Mechanistic insight into diabetic wounds:pathogenesis, molecular targets and treatment strategies to pace wound healing[J]. Biomed Pharmacother, 2019, 112: 108615. DOI:10.1016/j.biopha.2019.108615 |
| [3] |
Davis FM, Kimball A, Boniakowski A, et al. Dysfunctional wound healing in diabetic foot ulcers:new crossroads[J]. Curr Diab Rep, 2018, 18: 2. DOI:10.1007/s11892-018-0970-z |
| [4] |
Rodrigues M, Kosaric N, Bonham CA, et al. Wound healing:a cellular perspective[J]. Physiol Rev, 2019, 99: 665-706. DOI:10.1152/physrev.00067.2017 |
| [5] |
Boniakowski AE, Kimball AS, Jacobs BN, et al. Macrophage-mediated inflammation in normal and diabetic wound healing[J]. J Immunol, 2017, 199: 17-24. DOI:10.4049/jimmunol.1700223 |
| [6] |
Falanga V. Wound healing and its impairment in the diabetic foot[J]. Lancet, 2005, 366: 1736-1743. DOI:10.1016/S0140-6736(05)67700-8 |
| [7] |
Wang PH, Huang BS, Horng HC, et al. Wound healing[J]. J Chin Med Assoc, 2018, 81: 94-101. DOI:10.1016/j.jcma.2017.11.002 |
| [8] |
Jhamb S, Vangaveti VN, Malabu UH. Genetic and molecular basis of diabetic foot ulcers:clinical review[J]. J Tissue Viability, 2016, 25: 229-236. DOI:10.1016/j.jtv.2016.06.005 |
| [9] |
Cui X, Shang EX, Jiang S, et al. Interaction of Scutellaria-Coptis herb pair in improvement of glucose and lipid metabolism of type 2 diabetes rats based on response surface method[J]. Acta Pharm Sin (药学学报), 2018, 53: 630-635. |
| [10] |
Salazar JJ, Ennis WJ, Koh TJ. Diabetes medications:impact on inflammation and wound healing[J]. J Diabetes Complications, 2016, 30: 746-752. DOI:10.1016/j.jdiacomp.2015.12.017 |
| [11] |
Armstrong DG, Boulton A, Bus SA. Diabetic foot ulcers and their recurrence[J]. N Engl J Med, 2017, 376: 2367-2375. DOI:10.1056/NEJMra1615439 |
| [12] |
Kunkemoeller B, Kyriakides TR. Redox signaling in diabetic wound healing regulates extracellular matrix depositionv[J]. Antioxid Redox Signal, 2017, 27: 823-838. DOI:10.1089/ars.2017.7263 |
| [13] |
Yao D, Brownlee M. Hyperglycemia-induced reactive oxygen species increase expression of the receptor for advanced glycation end products (RAGE) and RAGE ligands[J]. Diabetes, 2010, 59: 249-255. DOI:10.2337/db09-0801 |
| [14] |
Wu H, Cai L, de Haan JB, et al. Targeting oxidative stress in diabetic complications:new insights[J]. J Diabetes Res, 2018, 2018: 1909675. |
| [15] |
Giacco F, Brownlee M. Oxidative stress and diabetic complications[J]. Circ Res, 2010, 107: 1058-1070. DOI:10.1161/CIRCRESAHA.110.223545 |
| [16] |
Ji XY, Chen Y, Ye GH, et al. Detection of RAGE expression and its application to diabetic wound age estimation[J]. Int J Legal Med, 2017, 131: 691-698. DOI:10.1007/s00414-016-1529-7 |
| [17] |
Marrotte EJ, Chen DD, Hakim JS, et al. Manganese superoxide dismutase expression in endothelial progenitor cells accelerates wound healing in diabetic mice[J]. J Clin Invest, 2010, 120: 4207-4219. DOI:10.1172/JCI36858 |
| [18] |
Elbatreek MH, Pachado MP, Cuadrado A, et al. Reactive oxygen comes of age:mechanism-based therapy of diabetic end-organ damage[J]. Trends Endocrinol Metab, 2019, 30: 312-327. DOI:10.1016/j.tem.2019.02.006 |
| [19] |
Chuang CY, Degendorfer G, Davies MJ. Oxidation and modification of extracellular matrix and its role in disease[J]. Free Radic Res, 2014, 48: 970-989. DOI:10.3109/10715762.2014.920087 |
| [20] |
Shukla SK, Sharma AK, Gupta V, et al. Pharmacological control of inflammation in wound healing[J]. J Tissue Viability, 2019, 28: 218-222. DOI:10.1016/j.jtv.2019.09.002 |
| [21] |
Parisi L, Gini E, Baci D, et al. Macrophage polarization in chronic inflammatory diseases:killers or builders?[J]. J Immunol Res, 2018, 2018: 8917804. |
| [22] |
Boniakowski AM, den Dekker AD, Davis FM, et al. SIRT3 regulates macrophage-mediated inflammation in diabetic wound repair[J]. J Invest Dermatol, 2019, 139: 2528-2537.e2. DOI:10.1016/j.jid.2019.05.017 |
| [23] |
Liu D, Yang P, Gao M, et al. NLRP3 activation induced by neutrophil extracellular traps sustains inflammatory response in the diabetic wound[J]. Clin Sci (Lond), 2019, 133: 565-582. DOI:10.1042/CS20180600 |
| [24] |
Mirza RE, Fang MM, Weinheimer-Haus EM, et al. Sustained inflammasome activity in macrophages impairs wound healing in type 2 diabetic humans and mice[J]. Diabetes, 2014, 63: 1103-1114. DOI:10.2337/db13-0927 |
| [25] |
Finley PJ, De Clue CE, Sell SA, et al. Diabetic wounds exhibit decreased Ym1 and arginase expression with increased expression of IL-17 and IL-20[J]. Adv Wound Care (New Rochelle), 2016, 5: 486-494. DOI:10.1089/wound.2015.0676 |
| [26] |
Wong SL, Demers M, Martinod K, et al. Diabetes primes neutrophils to undergo NETosis, which impairs wound healing[J]. Nat Med, 2015, 21: 815-819. DOI:10.1038/nm.3887 |
| [27] |
Pries AR, Secomb TW. Making microvascular networks work:angiogenesis, remodeling, and pruning[J]. Physiology (Bethesda), 2014, 29: 446-455. |
| [28] |
Zhang SH, Du JC, Li HY, et al. The protective effect of Qizhi hypoglycemic tablet on foot ulcer in streptozotocin-induced diabetes in rats[J]. Acta Pharm Sin (药学学报), 2019, 54: 2256-2266. |
| [29] |
Qi W, Yang C, Dai Z, et al. High levels of pigment epithelium-derived factor in diabetes impair wound healing through suppression of Wnt signaling[J]. Diabetes, 2015, 64: 1407-1419. DOI:10.2337/db14-1111 |
| [30] |
Isidori AM, Venneri MA, Fiore D. Angiopoietin-1 and angiopoietin-2 in metabolic disorders:therapeutic strategies to restore the highs and lows of angiogenesis in diabetes[J]. J Endocrinol Invest, 2016, 39: 1235-1246. DOI:10.1007/s40618-016-0502-0 |
| [31] |
Siddiqui K, Joy SS, Nawaz SS. Serum angiopoietin-2 levels as a marker in type 2 diabetes mellitus complications[J]. Int J Diabetes Dev Ctries, 2019, 39: 387-393. DOI:10.1007/s13410-018-0679-1 |
| [32] |
Hellberg C, Ostman A, Heldin CH. PDGF and vessel maturation[J]. Recent Results Cancer Res, 2010, 180: 103-114. |
| [33] |
Kolluru GK, Bir SC, Kevil CG. Endothelial dysfunction and diabetes:effects on angiogenesis, vascular remodeling, and wound healing[J]. Int J Vasc Med, 2012, 2012: 918267. |
| [34] |
Wang H, Feng Y, Jin X, et al. Augmentation of hypoxia-inducible factor-1-alpha in reinfused blood cells enhances diabetic ischemic wound closure in mice[J]. Oncotarget, 2017, 8: 114251-114258. DOI:10.18632/oncotarget.23214 |
| [35] |
Thangarajah H, Vial IN, Grogan RH, et al. HIF-1alpha dysfunction in diabetes[J]. Cell Cycle, 2010, 9: 75-79. DOI:10.4161/cc.9.1.10371 |
| [36] |
Yu WY, Sun W, Yu DJ, et al. Adipose-derived stem cells improve neovascularization in ischemic flaps in diabetic mellitus through HIF-1α/VEGF pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22: 10-16. |
| [37] |
Botusan IR, Sunkari VG, Savu O, et al. Stabilization of HIF-1alpha is critical to improve wound healing in diabetic mice[J]. Proc Natl Acad Sci U S A, 2008, 105: 19426-109431. DOI:10.1073/pnas.0805230105 |
| [38] |
Pichu S, Vimalraj S, Sathiyamoorthy J, et al. Association of hypoxia inducible factor-1 alpha exon 12 mutation in diabetic patients with and without diabetic foot ulcer[J]. Int J Biol Macromol, 2018, 119: 833-837. DOI:10.1016/j.ijbiomac.2018.08.011 |
| [39] |
Schreml S, Szeimies RM, Prantl L, et al. Oxygen in acute and chronic wound healing[J]. Br J Dermatol, 2010, 163: 257-268. DOI:10.1111/j.1365-2133.2010.09804.x |
| [40] |
Chun H, Park Y. Oxidative stress and diabetic neuropathy[M]//Preedy VR.Diabetes (Second Edition). Salt Lake City: Academic Press, 2020: 13-23.
|
| [41] |
Oza MJ, Kulkarni YA. Formononetin ameliorates diabetic neuropathy by increasing expression of SIRT1 and NGF[J]. Chem Biodivers, 2020, 17: e2000162. |
| [42] |
Volmer-Thole M, Lobmann R. Neuropathy and diabetic foot syndrome[J]. Int J Mol Sci, 2016, 17: 917-927. DOI:10.3390/ijms17060917 |
| [43] |
Lechleitner M, Abrahamian H, Francesconi C, et al. Diabetic neuropathy and diabetic foot syndrome (update 2019)[J]. Wien Klin Wochenschr, 2019, 131: 141-150. |
| [44] |
Tellechea A, Leal E, Veves A, et al. Inflammatory and angiogenic abnormalities in diabetic wound healing:role of neuropeptides and therapeutic perspectives[J]. Open Circ Vasc J, 2010, 3: 43-55. DOI:10.2174/1877382601003020043 |
| [45] |
Tracy LE, Minasian RA, Caterson EJ. Extracellular matrix and dermal fibroblast function in the healing wound[J]. Adv Wound Care (New Rochelle), 2016, 5: 119-136. DOI:10.1089/wound.2014.0561 |
| [46] |
Xuan YH, Huang BB, Tian HS, et al. High-glucose inhibits human fibroblast cell migration in wound healing via repression of bFGF-regulating JNK phosphorylation[J]. PLoS One, 2014, 9: e108182. DOI:10.1371/journal.pone.0108182 |
| [47] |
Minossi JG, Lima Fde O, Caramori CA, et al. Alloxan diabetes alters the tensile strength, morphological and morphometric parameters of abdominal wall healing in rats[J]. Acta Cir Bras, 2014, 29: 118-124. DOI:10.1590/S0102-86502014000200008 |
| [48] |
Roy DC, Mooney NA, Raeman CH, et al. Fibronectin matrix mimetics promote full-thickness wound repair in diabetic mice[J]. Tissue Eng Part A, 2013, 19: 2517-2526. DOI:10.1089/ten.tea.2013.0024 |
| [49] |
Maione AG, Smith A, Kashpur O, et al. Altered ECM deposition by diabetic foot ulcer-derived fibroblasts implicates fibronectin in chronic wound repair[J]. Wound Repair Regen, 2016, 24: 630-643. DOI:10.1111/wrr.12437 |
| [50] |
Li Z, Guo S, Yao F, et al. Increased ratio of serum matrix metalloproteinase-9 against TIMP-1 predicts poor wound healing in diabetic foot ulcers[J]. J Diabetes Complications, 2013, 27: 380-382. DOI:10.1016/j.jdiacomp.2012.12.007 |
| [51] |
Gkogkolou P, Böhm M. Advanced glycation end products:key players in skin aging[J]. Dermatoendocrinol, 2012, 4: 259-270. DOI:10.4161/derm.22028 |
| [52] |
Shaikh-Kader A, Houreld NN, Rajendran NK, et al. The link between advanced glycation end products and apoptosis in delayed wound healing[J]. Cell Biochem Funct, 2019, 37: 432-442. DOI:10.1002/cbf.3424 |
| [53] |
Bhan S, Mitra R, Arya AK, et al. A study on evaluation of apoptosis and expression of bcl-2-related marker in wound healing of streptozotocin-induced diabetic rats[J]. ISRN Dermatol, 2013, 2013: 739054. |
| [54] |
Lao G, Ren M, Wang X, et al. Human tissue inhibitor of metalloproteinases-1 improved wound healing in diabetes through its anti-apoptotic effect[J]. Exp Dermatol, 2019, 28: 528-535. DOI:10.1111/exd.13442 |
| [55] |
Wong P, Tan T, Chan C, et al. The role of connexins in wound healing and repair:novel therapeutic approaches[J]. Front Physiol, 2016, 7: 596. |
| [56] |
Zubair M, Ahmad J. Role of growth factors and cytokines in diabetic foot ulcer healing:a detailed review[J]. Rev Endocr Metab Disord, 2019, 20: 207-217. DOI:10.1007/s11154-019-09492-1 |
| [57] |
Ramirez-Acuña JM, Cardenas-Cadena SA, Marquez-Salas PA, et al. Diabetic foot ulcers:current advances in antimicrobial therapies and emerging treatments[J]. Antibiotics (Basel), 2019, 8: 193. DOI:10.3390/antibiotics8040193 |
| [58] |
Malone-Povolny MJ, Maloney SE, Schoenfisch MH. Nitric oxide therapy for diabetic wound healing[J]. Adv Healthc Mater, 2019, 8: e1801210. DOI:10.1002/adhm.201801210 |
| [59] |
Lopes L, Setia O, Aurshina A, et al. Stem cell therapy for diabetic foot ulcers:a review of preclinical and clinical research[J]. Stem Cell Res Ther, 2018, 9: 188. DOI:10.1186/s13287-018-0938-6 |
 2020, Vol. 55
2020, Vol. 55


