肠道菌群是人类肠道中的一个复杂群落, 由100万亿微生物组成, 数量众多, 约为人体细胞数量的10倍, 肠道微生物的直径为0.5~5 μm, 约为人体细胞直径的1/20。肠道菌群所含有的微生物基因组被称为肠道微生物组, 它们含有的基因总数约为人类基因组基因的100倍。人类微生物组计划和人类肠道宏基因组学等多项研究正在对人类微生物组进行编目。出生时, 宿主肠道处于相对无菌的状态, 随着后续在环境中持续的暴露, 数以万亿计的细菌逐渐在肠道内定植。个体间微生物种类和数量差别较大, 主要由外界环境和自身遗传学背景所决定[1]。肠道内的微生物群落与宿主构成了一个动态的共生生态系统, 对宿主的新陈代谢极其关键[2]。肠道菌与人类共同进化, 互惠共生, 通过影响宿主的营养、新陈代谢和免疫从而在维持人体正常生理功能中发挥重要作用[3], 被认为是一种具有代谢活性的内源性“器官”。肠道菌参与宿主中的补充代谢活动, 如分解难消化的植物多糖[4], 通过促进复杂碳水化合物的吸收来影响能量代谢, 也可以通过促进氨基酸(如赖氨酸和苏氨酸)[5]和各种维生素(如维生素K6和B族维生素)[6]的合成来促进固氮和微量营养素的平衡, 同时肠道菌也参与胆汁酸的生物转化等[7]。重要的是, 出生后肠道微生物的定植可以磨合宿主的免疫系统对外源物质的反应, 减少宿主对食物和环境抗原的过敏反应[8]。
近年来, 宿主与肠道微生物的相互作用越来越受到人们的关注, 人们已经确定这种复杂的相互作用对哺乳动物生理病理的诸多方面至关重要。肠道菌不断与宿主的重要器官系统, 如大脑、骨髓、血管收缩、肾脏、免疫系统和自主神经系统[9]等进行相互通信, 调节人体健康。肠道微生物群的组成和功能失衡不仅会扰乱肠道内环境的平衡, 而且会引起广泛的肠道外生理反应[10]。目前已有多种动物模型和人类研究数据支持肠道微生物群在人类健康和疾病中的重要作用, 如肥胖[11]、2型糖尿病[12]、炎症性肠病[13]和心血管病[14]等。靶向调控失调的肠道菌群可能成为预防和治疗疾病的潜在策略。
2 肠道菌与慢性肾病的关系慢性肾脏疾病(chronic kidney disease, CKD)是导致全球死亡的一大重要原因, 全球患病人口约10%[15]。慢性肾病日益成为一种全球性健康问题[16], 其传统诱发因素包括糖尿病、高血压及各类自身免疫性疾病等。近年来, 肠道菌群紊乱被逐渐认识到也是CKD的发病机制之一, 最常被报道的CKD特征菌群是较低水平的双歧杆菌科和乳杆菌科以及较高水平的肠杆菌科。本文回顾目前关于CKD中的肠道菌群失调及其代谢物影响CKD病理生理机制的一些研究进展。
一些研究证实肠道微生物群失调可能是肾脏疾病发病的关键因素。Werder等[17]采用自发性肾囊性疾病的小鼠品系, 发现在无菌环境中饲养的小鼠很少表现出这种疾病, 而传统饲养的小鼠都死于这种疾病。同样的, 在可自发发展为间质性肾炎的小鼠模型中, 研究人员将小鼠从特定的无病原体(SPF)环境转移到无菌环境中, 发现可显著降低这种疾病的发病率, 推测无菌环境的保护作用可能源自减少肠道压力, 减轻肠黏膜免疫系统的激活, 从而减少释放入循环系统的细胞因子和趋化因子, 缓解肾上皮细胞的压力[18]。
在其他CKD模型中, 肠道菌失调也被发现。Kikuchi等[19]在5/6肾切除模型中发现, 血清中尿毒素的水平与肠道菌群中梭菌属和拟杆菌属物种的丰度相关。这些物种都有一个编码色氨酸酶-酪氨酸苯酚裂解酶的基因, 这表明它们在产尿毒素的过程中起着重要的作用。在相同的模型中, Yoshifuji等[20]对其肠道菌物种组成进行深入分析, 发现175个细菌的操作分类学单位(OTUs)在两组间存在显著差异, 其中模型组以乳酸菌科的减少最为显著。研究人员又进一步证明, 乳酸菌可减轻与肾功能衰竭相关的全身性炎症和蛋白尿, 降低尿毒素的产生, 对CKD的进展起延缓作用。目前已有多种数据支持CKD中肠道菌群数量和种类存在失衡[21, 22], 例如在种水平和属水平上, Allobaculum、Escherichia_Shigella、Clostridium_sensu_stricto、Bacteroides、Parasutterella、Ruminococcus、Blautia和Enterorhabdus物种丰度的增加以及Lactobacillus和Bifidobacterium的减少; 在科水平上Lachnospiraceae、Enterobacteriaceae和Ruminococcaceae丰度的增加以及Prevotellaceae、Bacteroidaceae的减少。终末期肾病(end stage renal disease, ESRD)患者的肠道菌组成也有研究报道, 主要体现在患者的肠道菌绝对数量明显减少, 在菌属组成上, ESRD患者中Bacteroides存在富集, 同时一些产生丁酸盐的细菌包括Roseburia、Faecalibacterium、Clostridium、Coprococcus和Prevotella等丰度减少[23]。
血液透析(hemodialysis, HD)是急慢性肾功能衰竭患者肾脏替代治疗方式之一, 该过程也可引起菌群差异。通过对尿毒症HD患者的肠道菌进行分析, 研究人员在菌属方面观察到了一些数量和种类上的变化。更具体地说, HD患者的肠杆菌和肠球菌等需氧菌的数量是健康对照组的100倍左右, 产气荚膜梭菌的数量在HD患者中显著升高; 而厌氧菌双歧杆菌则在HD患者中显著降低[24]。Vaziri等[25]在HD患者中也观察到了菌群差异, 总共190个OTUs的丰度在两组间存在显著差异, 变形杆菌(主要为Gammaproteobacteria)、放线菌(Actinobacteria)和厚壁菌门(Firmicutes) (尤其是梭菌亚门)在HD患者中均有所增加。他们又进一步证明在ESRD患者体内, 具有脲酶、对甲酚和吲哚形成酶的细菌数量增加, 而具有短链脂肪酸形成酶的细菌如乳酸杆菌和普氏杆菌科数量减少。具体来讲, 12个具有脲酶的细菌为交替单胞菌科、梭状芽孢杆菌科、纤维素单胞菌科、皮肤单胞菌科、盐单胞菌科、肠杆菌科、甲基球菌科、莫拉菌科、微球菌科、多孢菌科、黄单胞菌科和假单胞菌科, 5个具有尿酸酶的细菌为纤维素单孢菌科、微球菌科、皮肤括约肌科、黄单孢菌科和多孢菌科, 3个具有吲哚和对甲酚形成酶(即色氨酸酶)的细菌为梭状芽孢杆菌科、疣状球菌科和肠杆菌科。
腹膜透析也是治疗晚期肾功能衰竭的方法之一, 该过程同样可引起菌群变化。通过Real-time PCR对晚期肾衰竭腹膜透析患者的肠道微生物组成进行分析, 发现患者体内厚壁菌门和放线菌门减少, 在科水平上肺炎克雷伯菌、双歧杆菌以及乳杆菌科定植率较低[26]。进一步对儿童ESRD腹膜透析患者的肠道菌进行研究, 发现厚壁菌门和放线菌门的肠道菌群相对较少, 而变形菌门明显增多, 又进一步证明变形杆菌(铁氧化菌)的增加与腹膜透析患者口服补铁有关[27]。此外, 腹膜透析患者肠道对腹膜透析液中葡萄糖的吸收增强, 促进葡萄糖发酵的肠杆菌科增多, 结合已有的研究, 研究人员认为肠杆菌科细菌的增加是导致腹膜透析患者腹膜炎发生的一个原因[28]。
由于免疫球蛋白A (immunoglobulin A, IgA)广泛存在于肠黏膜免疫系统中, 肠道菌群失调在IgA肾病(lgA nephropathy, IgAN)的发病过程中也起着重要作用。在相关研究中, Angelis等[29, 30]报告了IgAN患者和健康对照组之间肠道菌差异。研究发现厚壁菌门在IgAN患者样本中丰度较高, 尤其是在进展性IgAN中, 这是由于瘤胃球菌科、毛螺菌科、真杆菌科和链球菌科所占比例较高所致。而对于双歧杆菌, 健康对照组中比例明显高于患病组。慢性细菌感染和肠道菌群失调增强了上皮细胞分泌B细胞激活因子和诱导配体增殖的能力, 加速了IgA的过量产生, 此外细菌脂多糖与IgA低半乳糖化之间存在潜在的联系, 细菌脂多糖可以刺激全身炎症反应, 参与IgA的高产量和低半乳糖化, 这也是IgAN的重要发病机制之一。
在最近的研究中, 学者建立了肠道菌-代谢物-肾脏疾病这一主线, 深入探索三者之间的相关性。Wu等[31]通过研究不同分期的慢性肾病患者与健康对照组的肠道菌, 发现肠道菌群的组成和功能存在显著差异, 同时验证了菌属与代谢毒素的相关性。他们认为肠道微生物群可以作为诊断工具, 反映慢性肾病的疾病进展和循环毒素水平。Andrianova等[32]通过研究急性缺血性肾损伤大鼠肠道菌群的组成及其代谢物, 证实了菌属丰度与代谢物水平的相关性, 且研究结果表明肠道微生物群落中存在一些特定的成员, 它们的存在可能改善或加重缺血性肾损伤, 这些细菌种类可以为治疗包括急性肾损伤在内的肾脏疾病提供新的靶点。
总体而言,在慢性肾病发展过程中肠道菌群发生了显著改变。综合以上研究可以看出, 特定的肠道微生物或许可以作为肾病早期诊断和预后监测的有用生物标志物, 可为肾病的治疗提供新的靶点。
表 1[20, 21-23, 25, 26, 29]总结了上述各类慢性肾脏疾病在属水平上显著失调的菌属, 对这些差异菌的深入研究正在不断更新研究者的认知。
| 表 1 Gut microbiota involved in chronic kidney diseases. The abundance level was marked with (↑) up-regulated, and (↓) down-regulated. CKD: Chronic kidney disease; IgAN: IgA nephropathy; ESRD: End stage renal disease |
根据肠-肾轴理论, 慢性肾病中肠道微生态系统紊乱, 肠源性尿毒素蓄积, 从而破坏肠道上皮屏障功能, 使得肠源性尿毒素和条件致病菌移位而进入血液循环, 加剧CKD[33]。肠-肾轴可细分为代谢依赖通路和免疫依赖通路[34], 代谢依赖通路主要由肠道微生物群产生的代谢产物介导, 这些代谢产物具有调节宿主生理功能的作用。脂多糖(lipopolysaccharide, LPS)是革兰阴性菌外膜的组成部分, 也是内毒素(endotoxin)的主要成分, 在慢性肾病患者血浆中含量较高, 可造成宿主炎症反应。同时肠道菌的三大代谢产物对甲酚硫酸盐(p-cresol sulfate, PCS)、硫酸吲哚酚和氧化三甲胺(trimethylamine oxide, TMAO)被认为是最主要的肾毒性代谢物。因此在CKD患者中, 肠道菌群失调及肠屏障的通透性增强, 从而造成内毒素和细菌代谢性肾毒素进入血液循环和肾脏, 引发全身性及肾脏局部炎症, 加重CKD。下面将分述这几种重要的肾毒素代谢物参与CKD发生发展的分子机制。
3.1 内毒素内毒素是革兰阴性细菌细胞壁的核心成分, 通过与髓细胞分化抗原CD14结合[35], 造成微炎症状态, 引起一系列宿主反应, 其中脂多糖结合蛋白是细胞对内毒素反应的关键调节因子。内毒素能够刺激多种细胞, 特别是巨噬细胞和内皮细胞, 合成和分泌多种能够引起炎症反应的效应分子。最近的证据表明, 亚临床内毒素血症是慢性肾病患者的一个潜在炎症原因[36]。整体来看, 在慢性肾病中, 肠黏膜受损, 内毒素越过肠道屏障进入到血液, 到达肾脏, 被模式识别受体识别, 如Toll样受体(TLRs)、节点样受体(NLRs)以及可以激活局部免疫细胞反应的NLRP3炎性小体等, 从而激活免疫系统, 分泌促炎细胞因子和趋化因子, 引起肾脏局部炎症反应。肾脏中TLRs的持续激活在肾脏疾病和局部炎症的进展中起着关键的作用[37, 38]。
3.2 对甲酚硫酸盐和硫酸吲哚酚在慢性肾脏疾病中, 代谢变化和代谢物的尿排泄受阻都会导致体内的尿毒症毒素积累。PCS和硫酸吲哚酚(indoxyl sulfate, IS)属于研究比较广泛的尿毒症毒素。肠道微生物群对蛋白质的发酵作用会导致细菌产生不同的代谢物酚类和吲哚类。对甲酚(p-cresol)是酪氨酸和苯丙氨酸的肠道菌结肠发酵产物, 通过肝脏进一步代谢并偶联形成对甲酚硫酸盐; 而吲哚是通过具有色氨酸酶的肠道菌群转化而成, 随后在肝脏中被吸收并代谢为吲哚氧基硫酸盐(indoxyl-sulfate)。作为特征明显的白蛋白结合型尿毒症毒素, 对甲酚硫酸盐与硫酸吲哚酚主要通过肾小管分泌被肾脏清除[39]。相关研究表明, PCS和IS的积累与CKD的进展有关, 如Bammens等[40]证实了ESRD血液透析患者血清中对甲酚硫酸盐的游离水平与死亡率相关。硫酸吲哚酚和对甲酚硫酸盐在体内有多种作用, 它们可导致全身性炎症[41]和内皮功能障碍[42], 同时也可激活肾素-血管紧张素-醛固酮系统, 促进血管钙化[43]和血管硬化[44]等。在肾脏疾病中, 它们还可引起肾小管间质纤维化[45], 其中硫酸吲哚酚在肾脏疾病中还可以诱导内皮功能氧化应激, 增加内皮细胞微粒脱落[46]等。这些作用部分是通过细胞内氧化应激的增加和MAP激酶信号通路的激活来介导的。其中硫酸吲哚酚也可能通过激活芳基烃信号通路而发挥其毒性作用[47]。
众多研究已证实这两类代谢物的肾毒性作用。Motojima等[48]研究了IS的相关机制, 他们发现肾近端小管细胞基底外膜可通过有机阴离子转运蛋白介导摄取硫酸吲哚氧基, 从而激活NF-κB和I型纤溶酶原激活物抑制剂表达, 进而诱导肾毒性。在尿毒症大鼠模型中IS的肾毒性作用也被证实[49, 50], 给予大鼠硫酸吲哚氧基可介导肾小管间质纤维化相关基因的表达, 如转化生长因子β1 (TGFβ1)与组织基质金属蛋白酶抑制剂(tissue inhibitor of matrix metalloproteinases, TIMPs)等, 并伴有肾功能显著下降和肾小球硬化。对于PCS的肾毒性相关机制也有研究报道, 体外实验结果表明[51], 在慢性肾病中, 对甲酚硫酸盐可抑制内皮细胞黏附分子的表达, 并可诱导内皮细胞通透性的增加。在最近的研究中又进一步发现PCS可以通过激活NADPH氧化酶, 诱导氧化应激, 进而造成肾小管细胞损伤[52]。
以上研究可以发现, PCS与IS参与了肾病的发生发展, 有必要建立针对PCS和IS的新治疗策略。
3.3 TMAOTMAO是微生物胆碱和肉碱代谢的最终产物, 是三甲胺(trimethylamine, TMA)的一种低分子量胺氧代谢物。三甲胺通过一组肝脏酶-单氧化酶被氧化, 形成氧化三甲胺, 进入血液循环, 主要通过肾脏排出[53]。作为一种循环代谢物, TMAO参与动脉粥样硬化和心血管疾病的发展[14, 54], 同时TMAO已被证明会加速肾脏损伤, 促进进展性肾小管间质纤维化等。相关研究已表明, 其血液中的水平随着肾功能的降低而升高。TMAO的浓度随着CKD的进展而增加, ESRD患者的浓度大约是健康对照组的20倍。
近年来, TMAO影响肾脏功能的机制逐渐明确。动物研究结果首次揭示了饮食胆碱或饮食TMAO与进行性肾功能障碍之间的直接联系, 即使在已知对肾损伤有相对抵抗力的C57bL/6J小鼠中也有一致的结果[55]。暴露于高胆碱饮食或直接补充TMAO的饮食都导致早期肾损伤标志物肾损伤分子(kidney injury molecule 1, KIM-1)与血浆胱抑素C (cystatin C)水平升高, 并增强肾纤维化调节因子Smad3的磷酸化[56]。Manor等[57]通过对648位人类个体血浆中TMAO水平进行多组学关联分析, 明确了肠道微生物群组成与血浆TMAO水平显著相关, 同时发现一些肾脏标志物生长分化因子15 (growth differentiation factor 15, GDF-15)、KIM-1亦与TMAO密切关联。
3.4 短链脂肪酸相比之下, 肠道菌代谢物短链脂肪酸(short chain fatty acid, SCFA)对疾病的发展有很好的改善作用。短链脂肪酸(SCFAs)是膳食纤维微生物发酵的副产品, 根据最近的研究发现, SCFAs被认为是肠道内环境平衡的重要调节因子, 特别是乙酸、丙酸和丁酸, 在能量平衡、宿主营养和人体健康及炎症中发挥关键作用[58], 包括控制肠上皮细胞增殖和凋亡之间的平衡[59], 诱导肠上皮细胞分泌内源性抗菌肽[60], 诱导调节性T (Treg)细胞分化[61, 62], 调节细胞因子的产生[63]和维持肠屏障功能[64]等。最近的研究结果证实了产SCFA肠道菌群改变与肾脏疾病之间存在关联:肾病过程中肠道内SCFA产生菌数量减少[65]; 慢性肾病患者食用高纤维食物可增加产SCFA的菌属, 进而减少全身炎症、氧化应激和死亡率[66, 67]等。根据以上研究结果可以看出, SCFA与肾病密切相关, 可能具有肾脏保护和改善肾病的作用。
近年来, SCFA缓解肾损伤的机制正在被广泛研究。新出现的数据证实了SCFAs具有调节肠道以外全身性炎症的潜力, 在这种情况下, SCFAs能够通过降低树突状细胞的成熟能力和诱导CD4+和CD8+ T细胞增殖来调节肾组织的炎症过程; 另一方面SCFAs可以通过改善线粒体功能, 减少肾小管细胞的氧化应激, 从而减轻肾脏损伤[68]。Wang等[69]通过将丁酸钠注入到肾髓内区域, 发现可以改善血管紧张素-2诱导的肾小球硬化、肾纤维化和尿白蛋白水平的升高, 同时观察到肾素受体、血管紧张素原、肾素、血管紧张素-1转换酶和肾炎症标记物水平的降低。此外, 在脱氧皮质酮醋酸(DOCA)高血压模型中研究人员发现高纤维饮食可促进醋酸菌生长, 醋酸盐得到补充, 进而削弱肾脏纤维化[70]。最近丁酸盐的新机制被研究证实, 它可通过抑制组蛋白去乙酰化酶, 影响基因转录, 并通过G蛋白偶联受体109a (G protein receptor 109a, GPR109a)介导的机制保护机体免受蛋白尿肾病的发生[71]。
这些发现表明, SCFA可以调节免疫反应和改善肾脏病理损伤, 提示研究者改善饮食或许可以为肾病治疗提供很好的辅助。通过以上机制的研究, 加深了研究人员对肠-肾轴的理解, 为肾病治疗的靶点选择提供了一个全新的思路。
总体而言, 肠道菌改变与慢性肾病的发生发展密切相关。肠道菌群的多样性及其各种代谢产物在肾病中的作用正在被广泛研究, 这为开发新的治疗方法以改善患者的预后拓宽了空间。
4 展望图 1全面总结了“肠-肾轴”理论的核心内容, 系统地解释了肠道菌群对慢性肾病发生发展的影响。宿主与内源性微生物群之间的作用是双向的:一方面, 慢性肾病影响肠道菌群的组成和代谢; 另一方面, 菌群失调进一步导致微生物源性尿毒素和微炎症的增加。最近的研究已经提示, 肾病学家将肠道菌群作为治疗慢性肾病及其并发症的重要靶器官。相信随着更多的临床和基础研究进一步阐明微生物及其代谢产物在慢性肾病中的作用, 可能为预防与治疗慢性肾病开辟新的途径。
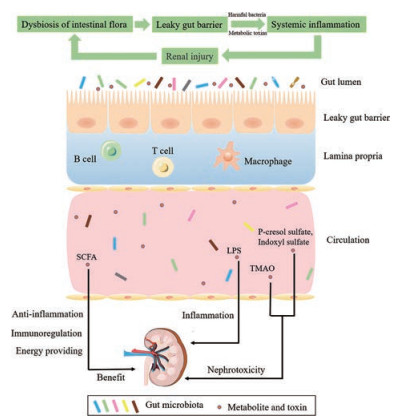
|
Figure 1 Two-way communication between intestinal microflora-metabolite and chronic kidney disease (CKD). CKD affects the composition and metabolism of intestinal flora. Dysbacteriosis further leads to an increase in urinary toxins and microinflammation |
作者贡献:李昭君负责文献检索和文章撰写; 陈晓光和张森进行文章的构思、布局和文章修改。
利益冲突:作者无利益冲突。
| [1] |
Ley RE, Peterson DA, Gordon JI. Ecological and evolutionary forces shaping microbial diversity in the human intestine[J]. Cell, 2006, 124: 837-848. DOI:10.1016/j.cell.2006.02.017 |
| [2] |
Bourlioux P, Koletzko B, Guarner F, et al. The intestine and its microflora are partners for the protection of the host:report on the Danone Symposium "The Intelligent Intestine, " held in Paris, June 14, 2002[J]. Am J Clin Nutr, 2003, 78: 675-683. DOI:10.1093/ajcn/78.4.675 |
| [3] |
Backhed F, Ley RE, Sonnenburg JL, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307: 1915-1920. DOI:10.1126/science.1104816 |
| [4] |
Hooper LV, Midtvedt T, Gordon JI. How host-microbial interactions shape the nutrient environment of the mammalian intestine[J]. Annu Rev Nutr, 2002, 22: 283-307. DOI:10.1146/annurev.nutr.22.011602.092259 |
| [5] |
Metges CC. Contribution of microbial amino acids to amino acid homeostasis of the host[J]. J Nutr, 2000, 130: 1857s-1864s. DOI:10.1093/jn/130.7.1857S |
| [6] |
Hill MJ. Intestinal flora and endogenous vitamin synthesis[J]. Eur J Cancer Prev, 1997, 6(Suppl 1): S43-S45. |
| [7] |
Hylemon PB, Harder J. Biotransformation of monoterpenes, bile acids, and other isoprenoids in anaerobic ecosystems[J]. FEMS Microbiol Rev, 1998, 22: 475-488. DOI:10.1111/j.1574-6976.1998.tb00382.x |
| [8] |
Braun-Fahrlander C, Riedler J, Herz U, et al. Environmental exposure to endotoxin and its relation to asthma in school-age children[J]. N Engl J Med, 2002, 347: 869-877. DOI:10.1056/NEJMoa020057 |
| [9] |
Bravo JA, Forsythe P, Chew MV, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve[J]. Proc Natl Acad Sci U S A, 2011, 108: 16050-16055. DOI:10.1073/pnas.1102999108 |
| [10] |
Marchesi JR, Adams DH, Fava F, et al. The gut microbiota and host health:a new clinical frontier[J]. Gut, 2016, 65: 330-339. DOI:10.1136/gutjnl-2015-309990 |
| [11] |
Ley RE, Turnbaugh PJ, Klein S, et al. Microbial ecology:human gut microbes associated with obesity[J]. Nature, 2006, 444: 1022-1023. DOI:10.1038/4441022a |
| [12] |
Qin J, Li Y, Cai Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490: 55-60. DOI:10.1038/nature11450 |
| [13] |
Frank DN, St Amand AL, Feldman RA, et al. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases[J]. Proc Natl Acad Sci U S A, 2007, 104: 13780-13785. DOI:10.1073/pnas.0706625104 |
| [14] |
Wang Z, Klipfell E, Bennett BJ, et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease[J]. Nature, 2011, 472: 57-63. DOI:10.1038/nature09922 |
| [15] |
Zhang L, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China:a cross-sectional survey[J]. Lancet, 2012, 379: 815-822. DOI:10.1016/S0140-6736(12)60033-6 |
| [16] |
Levin A, Tonelli M, Bonventre J, et al. Global kidney health 2017 and beyond:a roadmap for closing gaps in care, research, and policy[J]. Lancet, 2017, 390: 1888-1917. DOI:10.1016/S0140-6736(17)30788-2 |
| [17] |
Werder AA, Amos MA, Nielsen AH, et al. Comparative effects of germfree and ambient environments on the development of cystic kidney disease in CFWwd mice[J]. J Lab Clin Med, 1984, 103: 399-407. |
| [18] |
Hallman TM, Peng M, Meade R, et al. The mitochondrial and kidney disease phenotypes of kd/kd mice under germfree conditions[J]. J Autoimmun, 2006, 26: 1-6. DOI:10.1016/j.jaut.2005.10.006 |
| [19] |
Kikuchi M, Ueno M, Itoh Y, et al. Uremic toxin-producing gut microbiota in rats with chronic kidney disease[J]. Nephron, 2017, 135: 51-60. DOI:10.1159/000450619 |
| [20] |
Yoshifuji A, Wakino S, Irie J, et al. Gut Lactobacillus protects against the progression of renal damage by modulating the gut environment in rats[J]. Nephrol Dial Transplant, 2016, 31: 401-412. DOI:10.1093/ndt/gfv353 |
| [21] |
Feng YL, Cao G, Chen DQ, et al. Microbiome-metabolomics reveals gut microbiota associated with glycine-conjugated metabolites and polyamine metabolism in chronic kidney disease[J]. Cell Mol Life Sci, 2019, 76: 4961-4978. DOI:10.1007/s00018-019-03155-9 |
| [22] |
Sampaio-Maia B, Simões-Silva L, Pestana M, et al. The role of the gut microbiome on chronic kidney disease[J]. Adv Appl Microbiol, 2016, 96: 65-94. DOI:10.1016/bs.aambs.2016.06.002 |
| [23] |
Jiang S, Xie S, Lv D, et al. Alteration of the gut microbiota in Chinese population with chronic kidney disease[J]. Sci Rep, 2017, 7: 2870. DOI:10.1038/s41598-017-02989-2 |
| [24] |
Hida M, Aiba Y, Sawamura S, et al. Inhibition of the accumulation of uremic toxins in the blood and their precursors in the feces after oral administration of Lebenin, a lactic acid bacteria preparation, to uremic patients undergoing hemodialysis[J]. Nephron, 1996, 74: 349-355. DOI:10.1159/000189334 |
| [25] |
Vaziri ND, Wong J, Pahl M, et al. Chronic kidney disease alters intestinal microbial flora[J]. Kidney Int, 2013, 83: 308-315. DOI:10.1038/ki.2012.345 |
| [26] |
Wang IK, Lai HC, Yu CJ, et al. Real-time PCR analysis of the intestinal microbiotas in peritoneal dialysis patients[J]. Appl Environ Microbiol, 2012, 78: 1107-1112. DOI:10.1128/AEM.05605-11 |
| [27] |
Crespo-Salgado J, Vehaskari VM, Stewart T, et al. Intestinal microbiota in pediatric patients with end stage renal disease:a Midwest Pediatric Nephrology Consortium study[J]. Microbiome, 2016, 4: 50. DOI:10.1186/s40168-016-0195-9 |
| [28] |
Szeto CC, Chow VC, Chow KM, et al. Enterobacteriaceae peritonitis complicating peritoneal dialysis:a review of 210 consecutive cases[J]. Kidney Int, 2006, 69: 1245-1252. DOI:10.1038/sj.ki.5000037 |
| [29] |
Angelis MD, Montemurno E, Piccolo M, et al. Microbiota and metabolome associated with immunoglobulin A nephropathy (IgAN)[J]. PLoS One, 2014, 9: e99006. DOI:10.1371/journal.pone.0099006 |
| [30] |
Han L, Fang X, He Y, et al. ISN Forefronts Symposium 2015:IgA nephropathy, the gut microbiota, and gut-kidney crosstalk[J]. Kidney Int Rep, 2016, 1: 189-196. DOI:10.1016/j.ekir.2016.08.002 |
| [31] |
Wu IW, Lin CY, Chang LC, et al. Gut microbiota as diagnostic tools for mirroring disease progression and circulating nephrotoxin levels in chronic kidney disease:discovery and validation study[J]. Int J Biol Sci, 2020, 16: 420-434. DOI:10.7150/ijbs.37421 |
| [32] |
Andrianova NV, Popkov VA, Klimenko NS, et al. Microbiome-metabolome signature of acute kidney injury[J]. Metabolites, 2020, 10: 142. DOI:10.3390/metabo10040142 |
| [33] |
Evenepoel P, Poesen R, Meijers B. The gut-kidney axis[J]. Pediatr Nephrol, 2017, 32: 2005-2014. |
| [34] |
Yang T, Richards EM, Pepine CJ, et al. The gut microbiota and the brain-gut-kidney axis in hypertension and chronic kidney disease[J]. Nat Rev Nephrol, 2018, 14: 442-456. |
| [35] |
Pugin J, Heumann ID, Tomasz A, et al. CD14 is a pattern recognition receptor[J]. Immunity, 1994, 1: 509-516. DOI:10.1016/1074-7613(94)90093-0 |
| [36] |
Feroze U, Kalantar-Zadeh K, Sterling KA, et al. Examining associations of circulating endotoxin with nutritional status, inflammation, and mortality in hemodialysis patients[J]. J Ren Nutr, 2012, 22: 317-326. DOI:10.1053/j.jrn.2011.05.004 |
| [37] |
Leemans JC, Kors L, Anders HJ, et al. Pattern recognition receptors and the inflammasome in kidney disease[J]. Nat Rev Nephrol, 2014, 10: 398-414. |
| [38] |
Braga TT, Correa-Costa M, Guise YF, et al. MyD88 signaling pathway is involved in renal fibrosis by favoring a TH2 immune response and activating alternative M2 macrophages[J]. Mol Med, 2012, 18: 1231-1239. DOI:10.2119/molmed.2012.00131 |
| [39] |
Meijers BK, Bammens B, Verbeke K, et al. A review of albumin binding in CKD[J]. Am J Kidney Dis, 2008, 51: 839-850. DOI:10.1053/j.ajkd.2007.12.035 |
| [40] |
Bammens B, Evenepoel P, Keuleers H, et al. Free serum concentrations of the protein-bound retention solute p-cresol predict mortality in hemodialysis patients[J]. Kidney Int, 2006, 69: 1081-1087. DOI:10.1038/sj.ki.5000115 |
| [41] |
Maciel RA, Rempel LC, Bosquetti B, et al. p-Cresol but not p-cresyl sulfate stimulate MCP-1 production via NF-κB p65 in human vascular smooth muscle cells[J]. J Bras Nefrol, 2016, 38: 153-160. |
| [42] |
Six I, Gross P, Remond MC, et al. Deleterious vascular effects of indoxyl sulfate and reversal by oral adsorbent AST-120[J]. Atherosclerosis, 2015, 243: 248-256. DOI:10.1016/j.atherosclerosis.2015.09.019 |
| [43] |
Niwa T, Shimizu H. Indoxyl sulfate induces nephrovascular senescence[J]. J Ren Nutr, 2012, 22: 102-106. DOI:10.1053/j.jrn.2011.10.032 |
| [44] |
Jing YJ, Ni JW, Ding FH, et al. p-Cresyl sulfate is associated with carotid arteriosclerosis in hemodialysis patients and promotes atherogenesis in apoE-/- mice[J]. Kidney Int, 2016, 89: 439-449. DOI:10.1038/ki.2015.287 |
| [45] |
Sun CY, Hsu HH, Wu MS. p-Cresol sulfate and indoxyl sulfate induce similar cellular inflammatory gene expressions in cultured proximal renal tubular cells[J]. Nephrol Dial Transplant, 2013, 28: 70-78. DOI:10.1093/ndt/gfs133 |
| [46] |
Amabile N, Guerin AP, Leroyer A, et al. Circulating endothelial microparticles are associated with vascular dysfunction in patients with end-stage renal failure[J]. J Am Soc Nephrol, 2005, 16: 3381-3388. DOI:10.1681/ASN.2005050535 |
| [47] |
Shivanna S, Kolandaivelu K, Shashar M, et al. The aryl hydrocarbon receptor is a critical regulator of tissue factor stability and an antithrombotic target in uremia[J]. J Am Soc Nephrol, 2016, 27: 189-201. DOI:10.1681/ASN.2014121241 |
| [48] |
Motojima M, Hosokawa A, Yamato H, et al. Uremic toxins of organic anions up-regulate PAI-1 expression by induction of NF-κB and free radical in proximal tubular cells[J]. Kidney Int, 2003, 63: 1671-1680. DOI:10.1046/j.1523-1755.2003.00906.x |
| [49] |
Satoh M, Hayashi H, Watanabe M, et al. Uremic toxins overload accelerates renal damage in a rat model of chronic renal failure[J]. Nephron Exp Nephrol, 2003, 95: e111-e118. DOI:10.1159/000074327 |
| [50] |
Miyazaki T, Ise M, Seo H, et al. Indoxyl sulfate increases the gene expressions of TGF-beta 1, TIMP-1 and pro-alpha 1(I) collagen in uremic rat kidneys[J]. Kidney Int Suppl, 1997, 62: S15-S22. |
| [51] |
Dou L, Cerini C, Brunet P, et al. p-Cresol, a uremic toxin, decreases endothelial cell response to inflammatory cytokines[J]. Kidney Int, 2002, 62: 1999-2009. DOI:10.1046/j.1523-1755.2002.t01-1-00651.x |
| [52] |
Watanabe H, Miyamoto Y, Honda D, et al. p-Cresyl sulfate causes renal tubular cell damage by inducing oxidative stress by activation of NADPH oxidase[J]. Kidney Int, 2013, 83: 582-592. DOI:10.1038/ki.2012.448 |
| [53] |
Tang WH, Wang Z, Kennedy DJ, et al. Gut microbiota-dependent trimethylamine N-oxide (TMAO) pathway contributes to both development of renal insufficiency and mortality risk in chronic kidney disease[J]. Circ Res, 2015, 116: 448-455. DOI:10.1161/CIRCRESAHA.116.305360 |
| [54] |
Zhu W, Gregory JC, Org E, et al. Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk[J]. Cell, 2016, 165: 111-124. DOI:10.1016/j.cell.2016.02.011 |
| [55] |
Walkin L, Herrick SE, Summers A, et al. The role of mouse strain differences in the susceptibility to fibrosis:a systematic review[J]. Fibrogenesis Tissue Repair, 2013, 6: 18. DOI:10.1186/1755-1536-6-18 |
| [56] |
Runyan CE, Schnaper HW, Poncelet AC. Smad3 and PKCdelta mediate TGF-beta1-induced collagen I expression in human mesangial cells[J]. Am J Physiol Renal Physiol, 2003, 285: F413-F422. DOI:10.1152/ajprenal.00082.2003 |
| [57] |
Manor O, Zubair N, Conomos MP, et al. A multi-omic association study of trimethylamine N-oxide[J]. Cell Rep, 2018, 24: 935-946. DOI:10.1016/j.celrep.2018.06.096 |
| [58] |
Thorburn AN, Macia L, Mackay CR. Diet, metabolites, and "western-lifestyle" inflammatory diseases[J]. Immunity, 2014, 40: 833-842. DOI:10.1016/j.immuni.2014.05.014 |
| [59] |
Donohoe DR, Collins LB, Wali A, et al. The Warburg effect dictates the mechanism of butyrate-mediated histone acetylation and cell proliferation[J]. Mol Cell, 2012, 48: 612-626. DOI:10.1016/j.molcel.2012.08.033 |
| [60] |
Raqib R, Sarker P, Bergman P, et al. Improved outcome in shigellosis associated with butyrate induction of an endogenous peptide antibiotic[J]. Proc Natl Acad Sci U S A, 2006, 103: 9178-9183. DOI:10.1073/pnas.0602888103 |
| [61] |
Furusawa Y, Obata Y, Fukuda S, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells[J]. Nature, 2013, 504: 446-450. DOI:10.1038/nature12721 |
| [62] |
Park J, Kim M, Kang SG, et al. Short-chain fatty acids induce both effector and regulatory T cells by suppression of histone deacetylases and regulation of the mTOR-S6K pathway[J]. Mucosal Immunol, 2015, 8: 80-93. |
| [63] |
McDermott A, Huffnagle G. The microbiome and regulation of mucosal immunity[J]. Immunology, 2014, 142: 24-31. |
| [64] |
Kelly CJ, Zheng L, Campbell EL, et al. Crosstalk between microbiota-derived short-chain fatty acids and intestinal epithelial HIF augments tissue barrier function[J]. Cell Host Microbe, 2015, 17: 662-671. |
| [65] |
Wong J, Piceno YM, DeSantis TZ, et al. Expansion of urease- and uricase-containing, indole- and p-cresol-forming and contraction of short-chain fatty acid-producing intestinal microbiota in ESRD[J]. Am J Nephrol, 2014, 39: 230-237. |
| [66] |
Krishnamurthy VM, Wei G, Baird BC, et al. High dietary fiber intake is associated with decreased inflammation and all-cause mortality in patients with chronic kidney disease[J]. Kidney Int, 2012, 81: 300-306. |
| [67] |
Vaziri ND, Liu SM, Lau WL, et al. High amylose resistant starch diet ameliorates oxidative stress, inflammation, and progression of chronic kidney disease[J]. PLoS One, 2014, 9: e114881. |
| [68] |
Andrade-Oliveira V, Amano MT, Correa-Costa M, et al. Gut bacteria products prevent AKI induced by ischemia-reperfusion[J]. J Am Soc Nephrol, 2015, 26: 1877-1888. |
| [69] |
Wang L, Zhu Q, Lu A, et al. Sodium butyrate suppresses angiotensin Ⅱ-induced hypertension by inhibition of renal (pro) renin receptor and intrarenal renin-angiotensin system[J]. J Hypertens, 2017, 35: 1899-1908. |
| [70] |
Marques FZ, Nelson E, Chu PY, et al. High-fiber diet and acetate supplementation change the gut microbiota and prevent the development of hypertension and heart failure in hypertensive mice[J]. Circulation, 2017, 135: 964-977. |
| [71] |
Felizardo RJF, de Almeida DC, Pereira RL, et al. Gut microbial metabolite butyrate protects against proteinuric kidney disease through epigenetic- and GPR109a-mediated mechanisms[J]. FASEB J, 2019, 33: 11894-11908. |
 2020, Vol. 55
2020, Vol. 55


