2. 天津中医药大学, 天津 301617;
3. 成都中医药大学, 四川 成都 611137
2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
2015~2020年是中药和天然药物研究与发展极其重要的年度, 特别是屠呦呦青蒿素研究获得2015年度诺贝尔生理学或医学奖, 2016年获国家最高科学技术奖, 2019年获得共和国勋章、联合国教科文组织-赤道几内亚国际生命科学研究奖, 使全世界看到了中药和天然药物的巨大发展潜力。2019年, 屠呦呦研究员等5位专家在New England Journal of Medicine上提出了切实可行的应对“青蒿素抗药性”的合理方案, 随后在Lancet子刊再次阐述了方案的可行性及合理性[1]; 同时阐明了青蒿素耐药性的定义[2, 3]; 国际顶级医学类教科书《牛津医学教科书》 (第6版)章节: “传统医药的范例:中医药”, 2019年已正式出版。近年来, 青蒿素及其衍生物在抗寄生虫、抗癌、抗炎、治疗红斑狼疮等方面均具有良好的疗效[4, 5]; 双氢青蒿素对治疗系统性红斑狼疮效果明显, 其适应症临床试验已获国家药品监督管理局《药物临床试验批件》。
在这5年内, 国内外科学家在国际权威期刊上发表了大量中药与天然药物相关的学术论文, 并在化学、药物资源学、药理、制剂、新药开发等相关领域均取得重要成果。叶凯团队完成的罂粟全基因组序列和西班牙埃斯皮纳多大学完成杏仁全基因组测序均发表于Science, 张亮生团队破解睡莲基因组发表于Nature。英国约翰英纳斯中心在长春花中基因组中发现了用于合成抗癌药物长春花碱的最后几个未知的基因, 这项突破性研究发表于Science。加州大学伯克利分校以半乳糖为原料, 在酿酒酵母中完成了大麻素生物合成途径的异源重构, 实现了多种主要大麻素及其衍生物的生物全合成, 该成果发表于Nature。戴均贵、黄璐琦等团队成功在桑树细胞培养物中发现自然界首个催化分子间[4+2]环加成反应的单功能酶MaDA, 并建立了发现该酶目标识别策略, 该成果在Nature Chemistry发表。美国加州大学圣地亚哥分校在Nature报道了类似血小板纳米粒可显著提高多西紫杉醇和万古霉素治疗心血管疾病和全身性细菌感染的能力。由中国海洋大学、中国科学院上海药物研究所和上海绿谷制药联合研发的阿尔茨海默症治疗新药“甘露寡糖二酸” (GV-971)完成三期临床试验获得新药证书, 并被评为年度中国十大医学科技新闻; 由中国医学科学院、北京协和医学院药物研究所刘玉玲和申竹芳领衔研发用于治疗2型糖尿病的“桑枝总生物碱片”获得国家药监局批准上市, 该药是国内首个降血糖原创天然药物, 也是我国近十几年来首个批准的该领域的中药新药。房静远团队在柳叶刀子刊发表的中药提取物黄连素减少结直肠癌复发的研究、陈士林团队中草药DNA条形码为中草药建立基因身份证研究、尤启东团队主持的复杂结构天然产物抗肿瘤药物的研发及产业化研究、叶文才、王广基团队中药和天然药物的三萜及其皂苷成分研究与应用、屠鹏飞团队发表于PNAS揭示传统中药苏木的抗神经炎症活性成分苏木酮A的直接作用靶点蛋白为IMPDH2的研究等成果入选年度“中国十大医学进展”; 中药与天然药物在抗击新冠肺炎中还发挥了重要作用(图 1)。本文评述了2015~2020年国内外科学家在中药与天然药物的若干领域所取得的重要研究进展, 以期追踪和报道中药与天然药物领域发展的前沿和热点。

|
Figure 1 Highlights on the progress of traditional Chinese medicine and natural drugs during 2015-2020 |
自2015年以来, 不同新颖骨架结构的天然产物仍在不断推陈出新, 从结构类型上看, 杂萜等萜类、聚酮类、生物碱类、以及PKS-NRPS杂合型天然产物(图 2)成为了研究的亮点。这些天然产物大多具有良好的抗肿瘤、抗菌、抗炎等生物活性, 新天然产物也因其特有的骨架特征带来了巨大的研究潜力。具有代表性的新颖骨架天然产物及其生物活性如下:
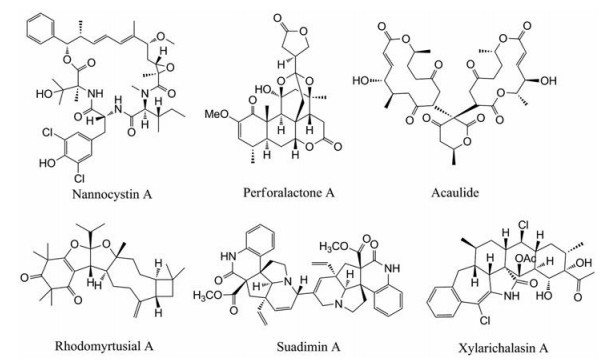
|
Figure 2 Representative compounds with novel skeletons from nature |
杂萜是化合物中部分结构来源于萜类生物合成的天然产物, 因其新颖、多样的结构骨架广泛存在于微生物(包括真菌和放线菌)、海绵、以及桃金娘科、杜鹃花科、唇形科等植物和一些大型真菌中(如灵芝等)[6-8]。从一种土曲霉(Aspergillus terreus)中得到了2个新型杂萜类次级代谢产物asperterpenes A和B, 这两个化合物对BACE1表现出优于临床BACE1抑制剂LY2811376的抑制活性(IC50值分别为78和59 nmol·L-1)[9]。从桃金娘(Rhodomyrtus tomentosa)的枝叶提取物中发现含有乙酰胆碱酯酶抑制活性的物质, 通过活性追踪与高效的LC-UV定向分离等方法, 从该提取物中获得3个具有6/5/5/9/4环系新颖骨架的间苯三酚杂萜类化合物rhodomyrtusials A和B, 它们具有较强的乙酰胆碱酯酶抑制活性(IC50值为8.8和6.0 μmol·L-1)[10]。从背柄紫灵芝(Ganoderma cochlear)中先后分离得到5对对映体结构的杂萜二聚体cochlearoids A-E和3个具有6/6/5/6/6/6新颖骨架的杂萜(±)-dispirocochlearoids A-C。T型钙通道(TTCC)抑制剂在治疗多种神经系统疾病方面具有巨大潜力, cochlearoids A和C则能够显著地抑制TTCC的活性; 而(±)-dispirocochlearoids A-C为COX-2的选择性抑制剂, 对小鼠的急性肺损伤还具有一定的抗炎活性[11, 12]。
1.1.2 以苦木素和柠檬苦素衍生物等为代表的植物萜类新骨架化合物从牛筋果(Harrisonia perforata)中分离得到化合物perforalactone A, 它是首次从植物源分到的笼状氧杂金刚烷骨架、且具有杀虫作用的20S新苦木素类化合物。Perforalactone A对苜蓿蚜(Aphis medicaginis)表现出显著的杀虫活性, 为烟碱受体(nAChR)拮抗剂(IC50值为15.8 nmol·L-1)[13]。从灰毛浆果楝(Cipadessa cinerascens)中分离到含有螺环结构的柠檬苦素类成分cipacinoid A, 该化合物具有中等的蛋白酪氨酸磷酸酶1B (PTP1B)抑制活性[14]。从落羽杉(Taxodium distichum)中得到2个独特的以四环十八烷为核心的C30-萜烯taxodisones A和B, 仿生物合成表明两个化合物源自二萜和单萜, 而非角鲨烯或氧化角鲨烯[15]。Pierisketolide A是从美丽马醉木(Pieris formosa)根部得到的一个A-homo-B-nor-ent-kauane骨架的二萜, 在10 mg·kg-1的剂量下具有镇痛作用, 抑制率达到45%[16]。从巴豆属巴豆腈(Croton kongensis)和曼哥龙巴豆(Croton mangelong)中分别得到新骨架二萜crokonoid A和大环二萜的对映异构体(+)mangelonoids A和(-)B, 其中crokonoid A对A549细胞具有较强的细胞毒性(IC50值为1.24 ± 0.56 μmol·L-1), 而mangelonoid A则具有抑制NF-κB的作用(IC50值为7.27 ± 1.30 μmol·L-1)[17, 18]。Artemisian B是从艾蒿(Artemisia argyi)中分离得到的1, 10-4, 5-二-断愈创木内酯与愈创木内酯二烯经[4+2]Diels-Alder加成形成的聚合体, 它可诱导细胞凋亡并引起细胞G2/M期停止, 从而对抗乳腺癌细胞MDA-MB-468的增殖(IC50值为3.21 μmol·L-1)[19]。
1.1.3 Neuamycin B等聚酮类新骨架化合物聚酮类化合物是由植物和微生物通过聚酮合酶的作用, 将低级羧酸进行一系列醇醛缩合反应而产生的一类天然产物。聚酮类化合物的结构骨架多样, 其显著的生物活性是新药研发的巨大宝库。从一种等足类动物共生真菌中分离得到一个具有成骨作用的新大环双内酯类次级代谢产物acaulide, 该化合物在0.4和2.0 μmol·L-1浓度下对脱氢皮质醇诱导的骨质疏松斑马鱼模型具有抗骨质疏松的作用[20]。从链霉菌属QL37中得到1个具有独特七环结构的芳香族聚酮类化合物lugdunomycin, 通过代谢组质谱分子网络分析, 解析出其他24种重排或者未重排的化合物, 并且其中的11个化合物为未见报道的新化合物[21]。从海洋放线菌小单孢菌(Micromonospora)中分离到一个28元大环内酯类化合物neuamycin B, 是胶质母细胞瘤强抑制剂(LD50值为6.4×10-8 μmol·L-1), 研究者利用基因组序列信息与NMR分析的结合方法确定了该化合物的立体构型[22]; 另一个来自Burkholderia gladioli的大环内酯类次级代谢产物gladiolin, 具有非常强的抗结核菌Mycobacteium tuberculosis的作用; Gladiolin能够抑制一种有效的结核分枝杆菌的靶点RNA聚合酶, 并对几种临床常见耐药结核分枝杆菌显示出良好的活性(MIC值为0.4~2.3 μg·mL-1), 具有较好的开发前景[23]。
1.1.4 Nannocystin A等PKS-NRPS型新骨架化合物研究人员发现了很多聚合酮酶-非核糖体多肽合成酶(PKS-NRPS)催化形成的杂合型化合物, 它们主要存在于植物、海洋沉积物与海藻、真菌等微生物中。PKS和NRPS能够催化不同来源的聚酮骨架和氨基酸而生成结构多样且生物活性显著的杂合型化合物。从一株罕见的黏细菌Nannocystis sp.中发现了一个新型的21元大环骨架化合物nannocystin A, 它是由三肽和带有环氧酰胺基团的聚酮组成, 利用NMR光谱、分子动力学计算、化学降解和X射线晶体学的方法确定了分子内9个立体中心的相对和绝对构型。研究者发现nannocystin A可以通过早期诱导细胞凋亡来抑制细胞增殖, 结构中的环氧部分对于该活性起到了重要作用[24]。基于基因组挖掘技术, 采用荧光叠氮化物探针的方法从蓝细菌Moorea producens ASI16Jul14-2中发现了3种炔化脂肽及其溴化类似物vatiamides A-F。这些化合物源自同一个非共线PKS/NRPS系统, 其形成的方式为微生物系统中的分子多样性提供了一种新型的组合能力[25]。从一株真菌Hymenochaete rubiginosa来源的链霉菌中分离得到一个新颖的多环肽类化合物tryptorubin A, 全基因组测序结果阐明了与该线性六肽主链相关的一对生物合成基因[26]。
1.1.5 以单萜喹啉生物碱和吲哚生物碱、二萜生物碱为代表的植物生物碱类新骨架化合物Suadimin A为首次报道的源自山橙(Melodinus suaveolens)的单萜喹啉型生物碱二聚体, 它具有显著的抗结核分枝杆菌H37Rv的活性(MIC90值为6.76 μmol·L-1)[27]。从尼泊尔虎皮楠(Daphniphyllum himalense)中分离得到化合物himalensine B, 该化合物对两种激酶PTP1B和IKK-β具有一定的抑制活性(抑制率分别为31%和29%)[28]。从Melodinus cochichinensis中得到的melocochines A和B是一对罕见的单萜吲哚型生物碱差向异构体, 二者可增强溶酶体的生物起源, 对溶酶体探针(LysoTracker)的染色强度分别为139.7%和119.0%[29]。Phlegmadine A是从Phlegmariurus phlegmaria分离到的一种新型含有独特环丁烷结构的石蒜碱型生物碱[30]。从附子(Aconitum carmichaelii)的水提取物中分离鉴定出了3个硫代C-20二萜生物碱类化合物, 分别是具有重排的atisane烷型骨架的aconicatisulfonines A和B, 以及aconicarmisulfonine A; 前者对乙酸引起的小鼠扭伤具有显著的镇痛作用[31, 32]。此外, 从银叶巴豆(Croton cascarilloides)中也分离鉴定了一种二萜生物碱类新骨架化合物cascarinoid A[33]。
1.1.6 源自真菌的asperflavipine A等细胞松弛素类新骨架化合物细胞松弛素是一类结构新颖且生物活性广泛的真菌次级代谢产物, 近5年发现了一些具有特殊结构特征的化合物。从黄柄曲霉(Aspergillus flavipes)中分离鉴定了一个具有5/6/11/5/6/5/6/5/6/5/5/11/6/5十四元环系的细胞松弛素杂四聚体(asperflavipine A)和一个5/6/11/5/5/6/5/11/6/5细胞松弛素asperchalasine A[34, 35]。Asperflavipine A包含了2个细胞松弛素和2个epicoccine结构单元, 是首个细胞松弛素杂四聚体, 它的发现揭示了细胞松弛素研究的新领域。Asperflavipine A具有中等的细胞毒性, 能够通过激活caspase-3以及降低PARP的活性诱导包括Jurkat、NB4、HL60等肿瘤细胞的凋亡。此外, 从马铃薯内生炭角菌Xylaria cf. curta中分离到了结构新颖的细胞松弛素curtachalasins A-E和一个卤代六环细胞松弛素xylarichalasin A, 其中curtachalasin C能逆转白色念珠菌抗氟康唑的抗药性[36-38]。
1.1.7 其他类型新骨架化合物从中药蛇床子(Cnidium monnieri)的果实中分离到一对外消旋二聚体(±)cnidimonin A, 它是由香豆素二聚体构成, 含有不同的结构单元(如黄酮醇、苯并呋喃和色酮), 该化合物显示出比其相应的旋光对映异构体更强的抗病毒HSV-1的作用(IC50值为1.23 μmol·L-1)[39]。从飞龙掌血(Toddalia asiatica)中得到2对低聚香豆素对映体spirotriscoumaris A和B, 二者均具有螺二烯酮骈合倍半萜的独特骨架, 外消旋混合物具有抗流感病毒H2N2的作用, 其活性较相应的旋光异构体强3~6倍(IC50值分别为3.13和2.87 μmol·L-1)[40]。从蜜茱萸(Melicope patulinervia)的叶子中分离到3对木脂素-间苯三酚杂合物的对映体(±)-melipatulinones A-C, 这些化合物均具有抑制胰脂肪酶的作用[41]。
1.2 结合次生代谢组学与基因组学, 以及活性天然产物作用靶标的化学蛋白质组学, 推动先导化合物研究次级代谢组学是对植物和微生物体内的次级代谢产物进行定性和定量的分析方法, 已成为发现潜在复杂植物和微生物次级代谢产物谱的重要技术手段(图 3)。基于LC-HR-MS和NMR等分析技术的次级代谢组学应用于代谢产物之间的化学筛选和快速对比, 能够高效地揭示一系列次级代谢组间的成分差异, 并定位各个实验组数据中的差异化合物[42-44]。
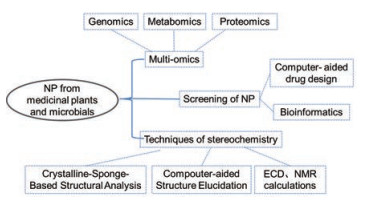
|
Figure 3 New technologies of natural products research |
LC-HR-MS较常用于次级代谢组学分析, 目前有一些数据库可用于搜索鉴定已知物并预测新天然产物(表 1)。其中, GNPS Web平台能够针对微生物次级代谢产物的高分辨率质谱数据对天然产物的结构进行鉴定, 并结合分子式的归属把MS/MS裂解谱图与数据库进行比较, 对不同类型的化合物分组, 最终将光谱转换成分子网络模式(molecular network)。在LC-MS代谢物谱分析中, 平台可利用数据采集DDA来运行LC-MS/MS[45]。Floros等[46]通过GNPS平台对1 000种随机选择的微生物次级代谢产物组的LC-MS/MS数据进行了评估, 并应用主成分分析(PCA)方法找到了不同的天然产物簇, 预测了这些菌株的生物合成潜力; 同时运用代谢组学的方法找出了76个分子家族来优选具有较好代谢水平的菌株, 再通过LC-HR-MS给出的高分辨分子质量、分子式、MS/MS裂解碎片等信息与数据库的相应数据进行比对, 从而推测未知分子离子峰为新天然产物。运用次级代谢组LC-HR-MS实验可以较全面地完成新天然产物的鉴定和已知化合物的去重工作[47]。Crusemann等[48]利用LC-MS/MS方法建立了146种海洋盐孢菌和链霉菌株的次级代谢产物图谱。该研究根据培养基、培养条件以及提取方法的不同对细菌次级代谢产物的产量进行综合评价, 从大约180万个MS/MS谱构建的分子网络中鉴定出15个分子家族的天然产物及其类似物, 提供了一种基于代谢物组成不同来比较菌株的方法。利用一种基于NMR分析的小分子精确识别技术(SMART 2.0)能够进行天然产物提取物的分析, 这样可提高发现和表征提取物中新天然产物的效率。Reher等[49]将SMART 2.0应用于丝状蓝细菌的提取物中, 基于NMR SMART 2.0和分子网络的MS/MS分析, 对具有细胞毒性的化合物进行优先排序, 再根据分析结果快速分离鉴定出了一种新型的大环内酯类成分。
| Table 1 Several main databases of natural products (NP) |
基因组挖掘技术可结合强大的分析系统来检测次级代谢产物在复杂代谢体系中潜在的微妙变化, 次级代谢组学对于以基因组研究为基础的新型次级代谢物的发现起到了重要作用。近年来, 对于微生物次级代谢组学与基因组联系的研究越来越多。由于高通量非靶向代谢组学能够产生大量的数据, 而这些数据集的开发和诠释通常需要生物信息学工具。因而, 研究微生物完整的代谢潜力也需要基于基因组的方法[50]。采用以抗性基因为导向的基因组挖掘技术, 成功地发现了一种新型天然产物除草剂aspterric acid (AA), 它能够利用靶向植物支链氨基酸合成途径(BCAA)中的二羟酸脱水酶(DHAD)来抑制植物的生长。该研究首次解析了DHAD全酶的结构及其与AA的结合机制, 并揭示了新型除草剂产生效能的分子机制。该研究为挖掘基因组寻找天然产物提供了新的方法和启示[51]。从昆虫微生物群中进行大规模的链霉菌分离, 再利用基因组学和代谢组学分析、以及体内感染模型测定等策略, 评估了昆虫链霉菌的独特进化谱系, 并筛选出了一种对多药耐药真菌病原体有效的新抗生素cyphomycin[52]。
近年来, 以亲和性蛋白质组学分析方法为主导的化学蛋白质组学, 已成为识别天然产物作用靶标较成熟的方法。Ismail等[53]开发了一套基于青蒿素活性的蛋白质谱分析探针, 通过定义青蒿素的蛋白质组, 在糖酵解和血红蛋白降解、抗氧化防御、蛋白质合成途径中显示出烷基化靶标, 以用于原位鉴定疟原虫蛋白质药物靶标。Li等[54]发现青蒿素能够结合gephyrin蛋白以激活GABAA受体, 并通过增强GABAA信号驱动体内胰腺α细胞向功能性β样细胞转化, 可能具有治疗糖尿病的潜力。Yi等[55]基于亲和性蛋白组学化学探针将肌动蛋白鉴定为小檗碱的靶标, 并发现小檗碱在体外生化水平和细胞水平上均能够显著地调节肌动蛋白生成。
1.3 DI-MS、CMC等技术改良及其在中药分析领域的应用与新药开发Direct infusion-mass spectrometry (DI-MS)可作为代谢组学的分析工具, Xu等[56]提出了一种DI-3D-MS新技术, 对伞形科的几种中药进行了化学组的比较, 并建立了数据库, 总结了伞形科植物中各类型香豆素分布。细胞膜色谱法(CMC)是从复杂系统中筛选作用于靶细胞膜潜在活性成分的理想方法。Ding等[57]开发了一种新型的(3-氨基丙基)三乙氧基硅烷(APTES)修饰的硅胶, 改善了CMC法使细胞膜被固定在硅胶表面上而不易脱落。作者以筛选丹参中的潜在活性成分进行考察, 建立了一种新型的APTES修饰的HepG2癌症干细胞膜色谱(CSCMC), 并应用于二维色谱系统中, 发现丹参酮IIA、隐丹参酮和二氢丹参酮I保留在该模型上, 并通过细胞增殖和凋亡试验证明对HepG2癌症干细胞有效性。Chen等[58]开发出一个表面等离子体共振(SPR)生物传感器的活性成分识别系统(SPR-AIRS), 并应用于筛选信号转导子和转录激活因子3 (STAT3)配体。该方法能够从复杂中药基质中识别活性STAT3配体的天然产物。
采用LC-UV或LC-MS/MS分析结合DNA条形码技术, Song等[59]对3种药用甘草(G. uralensis, G. glabra, G. inflata)进行了最大规模的药用植物靶向次级代谢组学分析, 对甘草中151个活性成分进行了定量分析, 包括17种黄酮苷、24种皂苷和110种游离酚类化合物。该报道涉及到有关甘草的生物合成、遗传、质量控制等多方面研究。Qiu等[60]利用UPLC-LTQ-Obitrap-MS分析并结合NMR验证质谱解析结构信息, 对人参茎叶中的总人参皂苷进行了全面的分析, 共鉴定了646种人参皂苷, 包括427种未分离到的成分, 优于传统方法。Shi等[61]开发出一种基于内源多重碰撞中性损失过滤(IMC-NLF)的非靶向代谢组学分析方法, 将其应用于鉴定和定量人参中的101个丙二酰基人参皂苷类成分, 包括人参中69个、西洋参52个、三七中44个; 同时统计了45批人参样品中81个丙二酰基人参皂苷的成分变化。采用中性丢失/前体离子扫描技术等质谱分析方法, Qiao等[62]对中药姜黄的成分进行了全面的系统分析, 从中发现了846种姜黄素衍生物, 包括许多潜在的新型化合物。由华中科技大学同济药学院、沈阳药科大学、军事医学研究院国家应急防控药物工程技术研究中心组成联合攻关小组, 系统性分析了新型冠状病毒(SARS-CoV-2)基因编码的蛋白作为主要或潜在的药物治疗靶点, 并通过计算机虚拟筛选方法发现了一系列具有抗病毒、抗菌和抗炎作用等的临床药物和天然产物对不同的靶蛋白表现出很高的亲和力, 为新型冠状病毒感染性疾病(COVID-19)的治疗提供新的可能。文章公布共享所有构建的新冠病毒靶点结构模型和筛选得到的候选药物, 以加速国内外同行开发治疗新冠肺炎的药物, 在国际上引起了较大的反响[63]。由中国医学科学院、北京协和医学院药物研究所研发用于治疗2型糖尿病的“桑枝总生物碱片”获得国家药监局批准上市, 该药是国内首个降血糖原创天然药物, 也是我国近十几年来首个批准的中药新药。桑枝总生物碱具有靶点清晰、物质基础明确和降糖作用显著等特点, 优于单纯糖苷酶抑制剂, 具有天然药物独特的多重药理作用优势。
2 药物资源研究 2.1 罂粟、人参、长春花、菊花、雷公藤、丹参等多种药用植物基因组测序推动复杂天然产物生物合成途径解析中国学者提出“本草基因组学”计划, 2015年在Science专刊发表“本草基因组学解析传统中医药”, 为传统中药研究与和现代生命科学结合提出了新的构架[64]。随着基因组测序及分析技术的进步, 近5年来药物基原物种的基因组学研究发展迅速, 越来越多的药用植物进行了全基因组测序, 为复杂天然产物生物合成途径解析提供了大量的基因信息(图 4)。叶凯研究组利用多种前沿基因组测序技术、复杂数学模型和基因深度挖掘等分析方法, 首次完成了罂粟(Papaver somniferum)全基因组测序, 组装获得11条染色体; 并首次发现罂粟合成吗啡(morphinan)等苄基异喹啉生物碱的15个基因在11号染色体上形成超级基因簇, 该基因簇在根、茎部特异表达且共表达, 同源分析表明细胞色素P450 (CYP450)加氧酶基因与还原酶基因融合形成“STORR”基因模块, 该基因模块对吗啡的生物合成起决定性作用[65]。中国中医科学院中药研究所李秋实等进一步利用Hi-C技术改进罂粟基因组组装结果, 使之前组装到scaffold上的基因重新组装到染色体上, 其中包括35个苄基异喹啉生物碱合成相关基因, 对苄基异喹啉生物碱合成关键基因的拷贝数变异分析发现, 那可丁(noscapine)的产生与11个基因的缺失有关, 帝巴因6-O-去甲基酶(thebaine 6-O-demethylase, T6ODM)基因簇的缺失可导致帝巴因(thebaine)合成增加, 吗啡合成减少[66]。
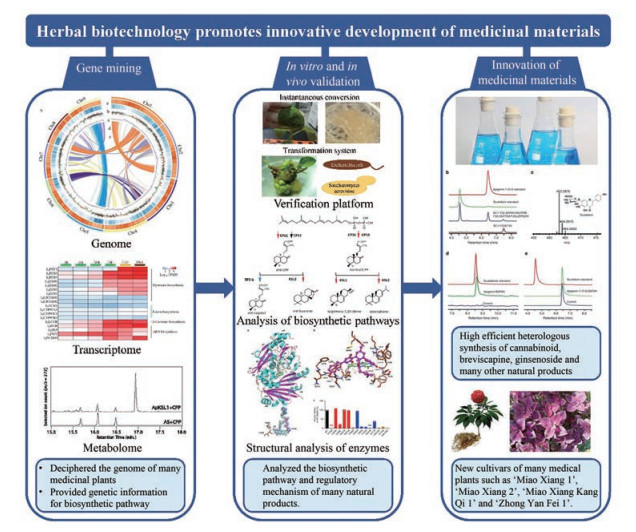
|
Figure 4 Research and application of biotechnology in the field of pharmacognosy |
陈士林、徐江团队突破人参(Panax ginseng)基因组重复序列较多(超过62%)的障碍, 成功破译人参的全基因组序列, 共预测42 006个编码蛋白, 与13种植物进行进化分析, 发现1 648个基因为人参特有的。鉴定出31个基因参与甲羟戊酸途径, 225个UDP-糖基转移酶(UGT)参与人参皂苷的合成和修饰[67]。韩国汉城国立大学进一步完善人参的基因组图谱, 并且利用人参基因组和转录组数据构建了人参基因组数据库[68]。杨生超研究组和董扬研究组以及高立志研究组分别完成三七(P notoginseng)基因组测序, 以背靠背的形式发表于Molecular Plant[69, 70]。杨生超研究组和董扬研究组预测到36 790个编码蛋白的基因, 发现了大量三七皂苷生物合成的候选基因, 包括萜烯合酶(TPS)和UGT等[69]。高立志研究组发现三七在历史上发生过多倍化事件, 导致三萜皂苷生物合成相关基因家族大量复制与扩增, 形成了众多的基因簇, 决定了三七皂苷的合成; 此外, 他们发现与三七皂苷生物合成相关的多数基因主要在花和叶里表达, 推测三七皂苷主要在花和叶片中合成, 然后再转运并储存在根部。这个发现颠覆了一直认为的三七皂苷在根里合成的观点[70]。人参和三七两种人参属植物的全基因组测序, 对解析人参皂苷代谢通路以及指导三七、人参和西洋参的育种、种植具有重要的意义。
Kellner等[71]完成了马达加斯加长春花(Catharanthus roseus)的基因组组装, 为解析长春花碱生物合成途径提供全面的基因资源, 鉴定出3个长春花碱生物合成途径中共表达基因簇, 该研究发现长春花碱生物合成具有前体和中间体协同合成的特征。在马达加斯加长春花基因组研究基础上, 鉴定出植物合成长春花碱(catharanthine)所必需的最后两个酶, 前二酮乙酸酯合成酶(precondylocarpine acetate synthase, PAS)和dihydroprecondylocarpine合成酶(dihydroprecondylocarpine synthase, DPAS), 阐明由花冠木碱生成水甘草碱(tabersonine)和长春花碱的代谢路径, 其中dihydroprecondylocarpine分子极其不稳定, 导致DPAS酶极难被发现, 因此, 长春花碱生物合成途径解析成为困扰全世界生物科学家60多年的难题。这项突破性研究成果使得长春花碱的异源生物合成成为可能。
雷公藤(Tripterygium wilfordii)由于生长缓慢且活性物质含量极低, 因此迫切需要解析雷公藤甲素和雷公藤红素的生物合成途径。高伟研究组联合黄璐琦研究组在雷公藤基因组测序、转录组测序以及代谢途径解析方面取得较大进展。他们揭示了雷公藤甲素从线性牻牛儿基牻牛儿基焦磷酸(geranylgeranyl pyrophosphat, GGPP)环化成松香烷型二萜烯中间体miltiradiene的生物过程。他们通过底物饲喂实验证实松香烷型二萜烯(miltiradiene)为合成雷公藤甲素的二萜烯中间体, 进一步筛选到萜类合酶基因TwTPS7v2和TwTPS9v2, 可催化GGPP形成二磷酸钴醛(CPP), TwTPS7v2可进一步催化CPP形成miltiradiene[72]。2019年, 他们又鉴定雷公藤红素生物合成途径中编码2, 3-氧化鲨烯环化酶(OSC)的关键基因, 并构建人工酵母细胞合成雷公藤红素的前体木栓酮。他们在雷公藤转录组数据中克隆到3个TwOSCs, 在酵母中异源表达证明TwOSC1和TwOSC3是催化木栓酮合成的候选基因, 他们还构建了过表达三萜合成上游基因以及TwOSC1的人工酵母细胞, 通过体系优化, 木栓酮产量最高达到37.07 mg·L-1[73]。他们首次成功构建了高质量的雷公藤基因组图谱, 是卫矛目植物的第一个基因组。通过基因组进化分析, 证明雷公藤发生了一次全基因组三倍化复制事件, 导致雷公藤甲素生物合成途径基因的拷贝数增加, 他们进一步通过基因组、转录组和代谢组等多组学联合分析手段, 成功筛选并鉴定细胞色素P450 (CYP728B70)基因, 这是CYP728家族第一个被明确功能的基因, 可催化miltiradiene发生三步氧化生成雷公藤甲素中间体dehydroabietic acid[74]。
黄璐琦团队完成天麻的全基因组测序(Gastrodia elata), 绘制了第一个完全依赖于菌根异养植物的高质量基因组图谱。基因组分析发现天麻经历了广泛的基因缺失, 其中3 586个基因家族发生了收缩, 丢失了2 961个基因, 可能是其适应完全异养生活方式的结果。由于没有光合作用的能力, 天麻完全依靠共生菌(蜜环菌)提供营养。研究团队发现独角金内酯是天麻与蜜环菌共生关系建立的重要信号, 天麻中独角金内酯生物合成和运输关键基因(类胡萝卜素裂解酶基因、ABC转运蛋白基因)、钙调素依赖性蛋白激酶DMI3基因的数量都增加了, 这些基因的扩增有助于天麻和蜜环菌的共生。此外, 精氨酸生物合成以及尿素代谢关键基因(谷氨酸N-乙酰转移酶基因、尿素酶基因)的数量也都增加, 这些基因在天麻氮素转运中发挥了关键的作用[75]。
昆明理工大学及其合作者利用二代Illumina测序技术和三代PacBio测序技术相结合, 成功完成了高度杂合的丹参(Salvia miltiorrhiza)基因组组装, 进一步分析预测了丹参基因组中的34 598个蛋白质编码基因和1 644个独特的基因家族[76]。中国中医科学院中药研究所对紫花和白花丹参(S. miltiorrhiza)的基因组进行了测定和分析, 系统进化分析表明丹参中显著扩张的基因家族主要参与二苯乙烯、二芳基庚烷、姜辣素的生物合成(KO00945)、萜类生物合成(KO00902)和甾体生物合成(KO00100), 这些基因家族的扩张可能与丹酚酸和丹参酮的合成相关。在基因组中鉴定出82个萜类合酶(terpene synthase, TPS)基因和437个CYP450基因, 并鉴定出4个萜类合酶/CYP450基因簇[77]。
宋驰等[78]利用纳米孔(nano-pore)测序技术突破复杂高等植物基因组测序, 首次完成了药用菊花野菊的全基因组测序, 同时还完成重要的药用菊花品种——杭白菊的全长转录组遗传信息发掘, 该研究对于阐释被子植物的进化尤其是菊科植物多样性具有极其重大的科学意义, 同时本项研究将极大地促进菊花药效成分、香气、花型及花色相关基因的深入挖掘和分子育种模式下的药用菊花品种选育。
同时, 国内外科学家还对博落回(Macleaya cordata)[79]、乌拉尔甘草(Glycyrrhiza uralensis)[80]、黄芩(Scutellaria baicalensis)[81]、黄花蒿(Artemisia annua)[82]、穿心莲(Andrographis paniculate)[83]、栀子(Gardenia jasminoides)等多种药用植物进行基因组测序, 对解析苄基异喹啉类生物碱、甘草次酸、汉黄芩素、青蒿素、穿心莲内酯、西红花苷等复杂天然产物的生物合成途径具有重要意义(表 2)[66-71, 74-96]。
| Table 2 Part of the genome of medicinal plants published from 2015 to 2020 |
据统计, 现今大约30%的化学药物都来自于天然产物。随着天然产物新的药理活性不断被发现, 导致对大麻素、人参皂苷、灯盏花素等天然产物的需求量持续增加。因此, 日益严重的药材资源短缺已成为制约中药和天然药发展的短板, 合成生物学的发展成为解决药材资源短缺问题的有效途径。
随着高纯度大麻二酚(cannabidiol, CBD)液体制剂Epidiolex®药物在美国上市, 并且成为治疗小儿癫痫的“孤儿药”, 大麻素的市场需求量迅速增加。Luo等[97]以酿酒酵母(Saccharomyces cerevisiae)为底盘细胞, 以半乳糖为原料, 通过设计天然的甲羟戊酸途径来提供高通量的焦磷酸香叶酯, 同时引入一条高效的乙酰-辅酶A生物合成途径, 导入大麻四酮合成酶(CsTKS)和橄榄酸环化酶(CsOAC)将乙酰辅酶A和丙二酰辅酶A合成大麻素生物合成途径的初始中间体橄榄酸。再引入新的橄榄酸酯香叶酰转移酶(GOT), 催化橄榄酸和焦磷酸香叶酯生产大麻素的直接前体大麻酚酸, 同时导入相应的大麻素合成酶基因, 分别合成四氢大麻酚(tetrahydrocannabinol, THC)或大麻二酚。该团队还通过给工程菌株饲喂不同的脂肪酸, 对受体结合亲和力和效力进行修饰等方法优化工程酵母中大麻素生物合成效率, 使大麻二酚的产量达到3 mg·L-1以上。大麻素合成生物学研究的突破为大麻素的工厂化生物合成奠定了坚实基础。
灯盏乙素(scutellarin)是灯盏细辛(Erigeron breviscapus)的黄酮提取物, 越来越多地用于治疗心脑血管疾病, 而灯盏细辛的植物供应已不能满足日益增长的市场需求。利用合成生物学合成灯盏花素是解决灯盏细辛资源紧张的有效手段。Liu等[98]从灯盏细辛基因组中鉴定出灯盏花素生物合成途径中的两个关键酶, 分别为黄酮苷7-O-葡萄糖醛酸基转移酶和黄酮-6-羟化酶, 然后将两个关键酶整合到酿酒酵母细胞中, 通过饲喂葡萄糖, 由酵母工程菌株合成灯盏花素。经过补料分批发酵等方法优化, 灯盏花素主要活性成分灯盏乙素和芹菜素-7-O-葡萄糖醛酸的产量分别达到108和185 mg·L-1。该研究不仅为灯盏乙素提供了新的来源, 而且为天然产物代谢工程研究提供了一个整合基因组学和合成生物学的研究范例。
人参皂苷是人参、西洋参以及三七等五加科人参属植物中主要活性物质, 主要为原人参二醇(PPD)和原人参三醇(PPT)的糖基化产物, 具有抗肿瘤、提高免疫力等药理活性, 但植物中人参皂苷含量较低, 远远不能满足市场需求, 因此, 人参皂苷的合成生物学研究成为研究热点之一。Wei等[99]从人参中分离了4个新的糖基转移酶基因(UGT), 其中, UGTPg100可特异性地催化PPT的C6位糖基化合成人参皂苷Rh1。通过将UGTPg1或UGTPg100转入生产PPT的酵母底盘细胞中, 构建生产人参皂苷F1和Rh1的工程酵母, 合成人参皂苷F1和人参皂苷Rh1的产量最高分别为42.1和92.8 mg·L-1。Wang等[100]在人参中克隆并鉴定了两个糖基转移酶, UGTPg45可以催化PPD的C3位糖基化生成人参皂苷Rh2, UGTPg29可催化Rh2的糖配基进一步糖基化。将两个糖基转移酶整合到生产PPD的酵母底盘细胞中, 建立以葡萄糖为原料生产Rh2和Rg3的酵母细胞工厂, Rh2和Rg3的最高产量分别为16.9和49.8 mg·L-1; UGTPg29的催化效率是UGTPg45的2 500多倍, 推测UGTPg45有可能是合成Rh2和Rg3的限速酶。Zhuang等[101]通过对糖基转移酶UGT51进行改造, 将突变后的糖基转移酶导入酿酒酵母, 使Rh2的产量提高到300 mg·L-1。Wang等[102]进一步设计优化PPD底盘细胞, 定向进化野生型糖基转移酶UGTPg45, 最终使Rh2的产量达到2.2 g·L-1。Wang等[103]在三七中鉴定出5种糖基转移酶, 其中包括一种新的催化人参皂苷R1合成的木糖转移酶, 将糖基转移酶Pn3-29转入生产PPD的酵母底盘细胞中, 建立人参皂苷K产量大于1 g·L-1的酵母细胞工厂。各种人参皂苷的合成生物学研究可以作为创造重要天然产物替代来源的基础, 从而保护自然植物资源。
通过在烟草中表达紫杉烯合成酶、紫杉烯-5α-羟化酶、细胞色素p450还原酶, 并成功获得了紫杉醇中间体。利用叶绿体代谢工程策略, 获得了紫杉醇的中间体紫杉烯和5α-羟基紫杉烯(产量分别为56.6和1.3 μg·g-1 FW)[104]。采用转录组学和蛋白质组学相结合的方法, Royer等[105]对中药金银花中的胡萝卜素类成分rhodoxanthin进行了生物合成途径的研究, 该研究鉴定了β-胡萝卜素羟化酶LHRS, 并证明LHRS能够催化β-胡萝卜素发生酮基化、去饱和和双键重排等一系列反应生成rhodoxanthin。Oyarce等[106]通过拟南芥异源表达姜黄生成姜黄素的酶diketide-CoA合成酶(DCS)和curcumin合成酶2 (CURS2), 使姜黄素掺入木质化细胞壁中产生姜黄素。Zhang等[107]首次鉴定了茶叶中嘌呤生物碱9-N-甲基转移酶-CkTcS, 并阐明了晶体结构, 证明了影响该酶活性的关键氨基酸位点。
通过转录组数据分析及活性筛选, Wang等[108]从黄芩(Scutellaria baicalensis)中挖掘得到了一条具有宽泛的底物杂泛性以及糖基供体杂泛性的黄酮类3-O-糖基转移酶UGT78B4, 并通过同源模建及分子对接对糖供体杂泛性的机制进行了探讨。He等[109]从金莲花(Trollius chinensis)中发现了第一条黄酮类8-C-糖基转移酶TcCGT1, 并报道了其晶体结构, 这也是第一个植物CGT结构。该研究中作者发现底物可通过自发脱质子进行糖基化反应的发生, 同时基于晶体结构及分子对接, 对C-糖基化机制及O-糖基化机制进行了研究, 并实现了将TcCGT1由CGT功能向OGT功能的改造。此外, He等[110]从乌拉尔甘草(Glycyrrhiza uralensis)中挖掘得到了第一条五环三萜类化合物的30/29-O-糖基转移酶UGT73F17。该酶具有很强的位点选择性, 能够利用多种糖基供体, 特异性催化五环三萜的C-30/C-29位的羧基, 使其发生糖基化。Zhang等[111]从光果甘草(G. glabra)中筛选得到了一条以弗洛丙酮为最佳催化结构单元的双C-糖基转移酶GgCGT。GgCGT是第一个具有晶体结构的双C-糖基转移酶。在该项研究中, 作者通过结构分析、定点突变等方式对糖基供体选择性机制以及双C-糖基化机制进行了研究。
Gao等[112]基于生物合成中间体分子探针技术, 利用分子探针从桑树(Morus alba)中挖掘得到了自然界中首个催化分子间[4+2]环加成反应的DA酶MaDA。MaDA可高效催化多种底物并生成相应的D-A类型化合物, 具有一定的底物杂泛性。DFT计算及MaDA晶体结构解析则进一步揭示了其催化分子间DA反应的分子机制。微生物中的天然产物生物合成酶同样引起了研究者的广泛关注。Chen等[113]从土曲霉(Aspergillus terreus)中发掘的异戊烯基转移酶AtaPT可催化芳香类化合物发生异戊烯基化, 其具有极为宽泛的底物杂泛性以及异戊烯基供体杂泛性。作者通过对AtaPT晶体结构的解析及定点突变等方式对其杂泛性机制进行了研究, 其中部分突变体成功改变了其底物杂泛性。Zhang等[114]从海洋放线菌中发现的具有抗幽门螺旋杆菌活性的聚酮化合物streptoseomycin的结构出发, 结合基因敲除、体内外酶催化反应、DFT计算等技术, 发现了自然界首例催化[6+4]环加成反应的酶, 并基于晶体结构分析及定点突变实验, 对其环加成的催化机制进行了深入探索。Chen等[115]对于从芒果Mangifera indica中发现的C-糖基转移酶MiCGT开展了深入研究。MiCGT以间苯二酚为催化C-糖基化反应的最小结构单元, 同时能够利用UDP-glucose与UDP-xylose为糖供体生成相应的碳苷产物。此外作者发现碳苷产物对于SGLT2具有良好的抑制活性, 表明CGT在活性化合物的合成中可起到重要作用。
除上述天然产物的合成生物学研究取得重大突破外, 有关原伊鲁烯、β-香树脂醇、甘草次酸、番茄红素、文朵灵、异胡豆苷、天麻素、大黄素等复杂天然产物的合成生物学研究也取得较大进展, 为中药事业的健康有序发展提供物质基础(表 3)[97-101, 103, 116-124]。
| Table 3 The main research of synthetic biology from 2015 to 2020 |
除了利用合成生物学合成重要天然产物, 还可在群体遗传学、基因组学研究和生物合成途径解析的基础上, 利用生物技术培育药用植物新品种、进行药材精准鉴定、实现药材野生资源保育等。培育高CBD、低THC含量的新品种是药用大麻的育种目标。大麻酚酸(CBGA)在四氢大麻酸合成酶(THCAS)和大麻二酚酸合成酶(CBDAS)的催化下分别生成四氢大麻酸(THCA)和大麻二酚酸(CBDA), 催化CBGA形成的芳香族戊烯基转移酶(AP)、以及THCAS和CBDAS是决定CBD含量的关键酶。Laverty等[125]对大麻的全基因组测序结果进行分析, 发现AP与一个已知的总大麻素含量的标记紧密连锁, 其他大麻素生物合成途径基因没有连锁。进一步分析发现, THCAS和CBDAS在大麻基因组上位于反转录转座子丰富的区域, 这些区域在药用大麻和工业大麻的等位基因之间高度不同源。杏仁中苦杏仁苷的有无是一个重要的育种目标, Sánchez-Pérez等[92]在杏仁(Prunus dulcis)基因组研究的基础上, 构建F1代杏仁苦味分离群体, 利用图位克隆方法, 鉴定到一个46 kb长的基因簇序列区域, 该区域存在5个编码bHLH转录因子的基因, 功能鉴定显示bHLH2能够控制PdCYP79D16和PdCYP71AN24的转录, 而这两个基因参与了苦杏仁苷的生物合成通路。bHLH2蛋白的二聚化结构域中一个非同义替换(亮氨酸替换为苯丙氨酸)可导致这两个基因的转录降低, 导致杏仁苦味消失。有关青蒿素生物合成转录调控机制研究发现, 响应茉莉酸信号的转录激活复合体可通过激活青蒿素合成关键酶基因双键还原酶2和醛脱氢酶1的表达, 从而正向调控青蒿素的生物合成[126]。这些研究结果不仅深入解析了植物中次生代谢物多样性的内在原因, 更为药用植物新品种培育提供了一个绿色通道。
在药用植物多组学研究基础上, 药用植物育种、快速鉴定以及药材道地性等方面均取得较大突破。开发出中草药DNA条形码高通量基因测序一体机, 可精准、快速、简易、稳定鉴定中草药样品。一批药用植物新品种获得新品种证书或国家新品种权证书。湖北中医药大学与其合作者将电化学传感器与DNA条形码技术结合, 研制出一种电化学草本传感器, 实现了快速、准确鉴别西红花及其混伪品[127]。2020年, 西安交通大学及其合作者采用群体基因组学的分析方法研究大黄(Rheum palmatumcomplex)的异域分化和种内多样化形成机制, 发现掌叶大黄起源于横断山区中部或秦巴山区, 该类群的异域分化和种内多样化主要受第四纪冰期避难所和我国西部地区的天空岛屿的影响。该研究结果为其他药用植物的种内多样性研究和同类型药材的道地性形成机制研究提供了重要的参考价值[128]。
3 药理毒理学研究 3.1 建立基于网络药理学探索中医药治疗复杂性疾病机制的新方法“网络药理学” (network pharmacology)即采用系统生物学、药物化学、药理学等多学科理论结合高通量多组学、生物信息学和网络分析技术, 构建“疾病-基因-药物-靶点”之间的生物网络模型, 发现药物对疾病网络的干预和影响, 预测其防治疾病的药效活性成分、作用靶点及分子机制(图 5)。李梢团队采用drugCIPHER算法预测了47种常用扶正中药所含1 446种成分的靶标谱, 采用基因表达高通量检测技术HTS2检测了其中166种中药成分干预420个肿瘤或免疫相关基因的表达谱, 同时分析了133种中药成分的公共活性数据, 从而综合绘制了扶正中药成分调节肿瘤和免疫相关生物网络的分子图谱。研究发现, 扶正中药成分的靶标显著富集在自然杀伤细胞、抗原提呈等免疫相关通路, 人参、黄芪和六味地黄丸所含成分能够显著上调自然杀伤细胞、T细胞等通路的基因表达, 且部分扶正中药成分能抑制细胞周期、凋亡等肿瘤信号通路的基因表达, 提示扶正中药在肿瘤预防、肿瘤免疫调节方面具有进一步研发的重要价值[129]。该研究团队还提出整合计算预测和实验分析结合的生物分子网络研究方法, 以网络为靶标发现多靶点药物, 为中药多成分的协同效应研究提供了新途径。该研究首先通过基于网络的全基因组致病基因预测方法CIPHER进行炎、癌相关基因预测, 结合疾病的公共基因表达谱数据库, 筛选消化系统炎癌转化的候选基因集, 构建炎癌转化关键分子网络; 再应用TGFβ1诱导的肠上皮细胞恶性转化细胞模型和CRISPR-Cas9组合干预策略, 识别炎癌转化关键分子网络中的差异遗传相互作用网络模块, 发现免疫-增殖和代谢-增殖协同模块可作为炎癌转化的早期生物标志物; 最后研究者筛选出了六味地黄丸及其类方中具有调节代谢-免疫等协同作用模块、抑制肠炎细胞恶性转化的中药活性成分, 为揭示中药多成分协同作用治疗肿瘤等复杂疾病的精准防治探索了一条新途径[130]。

|
Figure 5 Research highlights of TCM and natural drugs in the field of pharmacology and toxicology |
药物代谢酶(drug metabolizing enzymes, DMEs)的探针底物已成为新药发现、药物相互作用评价、精准医学领域中个性化诊疗研究中的工具分子。近年来, 针对人体重要的DMEs, 杨凌、葛广波研究团队先后设计研发了多种特异性强、灵敏度高且可用于复杂生物体系(如细胞和组织制备物)中目标酶活性实时检测的实用方法。2015年, 该团队基于CYP1A2催化活性空腔富含苏氨酸(如Thr-118及Thr-124)这一特征, 在1, 8-萘酰亚胺荧光母核上有意引入了氢键供体使之与苏氨酸形成强氢键作用, 进而研发出可被肝脏CYP1A2特异性识别和催化的底物NCMN, 实现了肝细胞及肝组织等复杂生物体系中CYP1A2活性的高效检测及超分辨荧光成像[131]。之后, 该团队还利用CYP1A1催化空腔的体积较CYP1A2更大(524 Å3 VS 375 Å3)这一结构特征, 采用酶催化位点局部改造(调整O-烷基的体积)的结构修饰策略, 借助计算机辅助设计技术对系列1, 8-萘酰亚胺衍生物进行了虚拟筛选和优化, 成功研发了首个CYP1A1亚型特异性的双光子荧光探针NBCeN, 实现了活细胞及活组织等复杂生物体系中CYP1A1活性的荧光检测和成像分析[132]。该团队还基于UGT1A1的底物偏好性和活性空腔多碱性氨基酸等特征, 通过对4-羟基萘酰亚胺类衍生物-UGT代谢行为的系统研究揭示了4-羟基萘酰亚胺类衍生物的结构-UGT酶催化选择性规律, 进而设计研发了首个UGT1A1的比率型荧光探针底物NCHN[133]。该探针被成功应用于生物样本中UGT1A1活性检测、体外快速筛选UGT1A1酶的抑制剂, 标志着UGT1A1-小分子药物相互作用研究进入了高通量时代。后续, 该团队发现UGT1A1具有多个配体结合位点, 而NCHN与胆红素的结合位点不同, 因此其无法完全替代胆红素用于UGT1A1-配体相互作用等研究。为此, 该团队基于UGT1A1的底物偏好性和光诱导电子转移原理, 设计研发新的可替代UGT1A1生理底物胆红素的高特异性和高亲和力的荧光探针底物NHPN, 其检测下限可达0.48 μg·mL-1, 是目前报道检测胆红素代谢酶UGT1A1活性的最灵敏的方法[134]。该探针底物为UGT1A1酶的诱导剂和激活剂的高效发现、UGT1A1-配体相互作用机制研究等提供了实用的工具分子和高通量筛选方法。此外, 该团队近年来还先后设计了羧酸酯酶1、羧酸酯酶2、二肽基肽酶-IV (DDP-IV)等丝氨酸水解酶的高特异性荧光探针底物, 实现了复杂生物体系(如活细胞及组织等)中目标酶活性的超灵敏实时检测, 源于天然的目标酶调控剂的高通量筛选和配体-靶酶相互作用的高效表征[135-141]。
借助上述光学底物, 该团队采用规模化筛选及谱效结合导向下的抑制剂发现策略, 从天然产物及中药提取物中发现了30余种药物代谢酶的强效或特异的抑制剂, 以及建立了抑制剂活性筛选的体外评价方法。例如, 该团队发现补骨脂提取物及其多种化学成分可强效抑制胆红素代谢酶UGT1A1, 进而揭示了补骨脂引发高胆红素血症及肝损伤的潜在机制与物质基础[142]。此外, 该团队还发现桑白皮、黄芩及甘草的化学成分可强效抑制肠道羧酸酯酶2和肠道菌β-葡萄糖醛酸水解酶, 揭示了上述中药减缓伊立替康水解产物SN38的肠道蓄积、进而缓解其肠道毒性的药代学机制[143]。
药代动力学对创新药物研发和临床应用具有重要作用。针对经典药代动力学研究在成药性评价中常出现药动/药效(PK/PD)不相关的问题, 我国学者提出了靶细胞PK/PD结合研究的新方法, 将药代动力学研究从宏观的血浆药物浓度拓展至细胞/亚细胞内药物浓度的经时过程, 提高精准转化, 利于创新药物研究。王广基团队建立MCF-7多细胞肿瘤球体为单元的PK/PD模型, 采用阿霉素为模型药物, 以引发肿瘤细胞多药耐药的关键靶点P-glycoprotein (P-gp)为切入点, 发现人参皂苷Rh2预处理停药后能够激活磷酸戊糖途径改善肿瘤细胞内氧化还原紊乱, 轻微下调P-gp表达, 促进阿霉素对卵巢癌球体的生长抑制及在其中的蓄积率。由此研究者提出了人参皂苷Rh2-阿霉素序贯治疗方案, 并证实了其在在体研究中具有较强的抗肿瘤作用[144]。同时针对天然药物、中药及复方具有丰富的临床数据信息和多成分的复杂体系, 但难以完整解析其物质基础和作用靶点机制的困境, 郝海平提出了“反向药代动力学”理念, 首先明确药物的ADME和PK/PD特性, 这些信息有助于提示药物的不同成分对于组织/器官/系统/受体的潜在靶向性, 进而选择与作用靶点相关的模型用于药物活性筛选、靶点识别和作用机制研究。研究团队应用细胞药代动力学方法发现, 中药白头翁的主要活性成分五环三萜类化合物23-羟基白桦酸(23-HBA)能够显著降低阿霉素代谢产物阿霉素醇进入心肌细胞线粒体及细胞核的速率和程度。通过在体和离体实验确证了23-HBA可减轻阿霉素诱导的小鼠心脏毒性并抑制了阿霉素的代谢, 从而减少了阿霉素醇在心脏选择性的蓄积, 其作用机制可能是23-HBA抑制阿霉素代谢催化反应的羰基还原酶1活性, 减少阿霉素醇在心肌细胞线粒体和细胞核的含量, 从而发挥抗心脏毒性作用。该研究从组织到亚细胞水平阐明了23-HBA通过影响阿霉素代谢和药代动力学特性, 发挥心脏保护作用的机制, 为使用反向药代动力学理论阐明靶标未知的药物, 特别是从中药中分离出的活性成分的机制提供了新的研究策略[145]。
代谢组学利用现代分析技术定量测定生物内源性代谢产物变化, 结合生物信息学方法阐明内源性小分子代谢物动态变化规律, 获得关键生物标志物, 其表征生物体的整体功能状态的理念契合于中医药的整体观和辨证论治诊疗思维。王喜军教授提出了中医方证代谢组学的研究思路, 整合代谢组学和中医药理论, 对中药药效物质、作用机制、方剂配伍规律、中药质量控制开展研究, 特别强调了基于质谱技术的代谢组学有助于阐明中药在系统药理学中的复杂性, 并增加其在临床中的价值, 已成为中医药基础研究的关键技术之一[146]。孔令义团队采用1H NMR谱学技术研究经典名方黄连解毒汤以及4种变方(即每次从全方中去除一味药物)对脓毒症大鼠的治疗作用, 发现黄连解毒汤全方具有最好的治疗效果。代谢组学分析显示乙酰胆碱、牛磺酸、丙氨酸等20种代谢产物在黄连解毒汤及其4种变方之间发生了特异性变化, 这种代谢谱特异性的变化与全方、变方不同治疗效果有关, 这也可能解释了黄连解毒汤通过活化胆碱能抗炎途径治疗脓毒症大鼠的生物学基础, 显示了采用代谢组学方法在阐明中医药治疗复杂疾病的作用机制方面具有重要的价值[147]。果德安团队应用液相色谱-高分辨率质谱(LC-HREM)联用技术根据特征碎片信息分析中药中特殊元素成分建立了同位素模式精过滤法(FIPF), 从葛根和粉葛中鉴定了9种硫衍生物, 并快速比较了55种市售样品含硫衍生物的情况。该团队提出的这种基于分离Mþ2离子的超高质量分辨率(100000 FWHM@400m/z)筛选硫衍生物的新方法, 不仅可以用于中药材质量优劣的鉴别, 也是在内源性代谢产物中筛查含硫基药物或先导化合物的工具[148]。Xbridge Amide色谱柱(1D)和亚乙基桥杂化(BEH)-C18色谱柱的离线全二维液相色谱(2D-LC)系统, 连接整合混合线性离子阱轨道阱组合质谱和核磁共振分析(LTQ-Orbitrap-MS/NMR)系统, 被应用于检测人参根茎和人参叶中的人参皂苷。结果显示2D-LC/LTQ-Orbitrap-MS/NMR系统检测出646种人参皂苷, 其中427种为潜在的新代谢产物, 显示出该方法在发现新的天然人参皂苷方面明显优于传统植物化学分析方法[60]。
3.3 何首乌肝毒性、马兜铃酸毒性为代表的安全性研究推动中药安全合理使用肖小河团队应用药物基因组学、代谢组学等方法, 开展了基于识别何首乌致肝损伤易感人群生物标志物的研究。通过临床数据的病证毒理学研究证实何首乌仅对少数特定人群具有肝损伤风险, 其诱发的特异质肝损伤与机体免疫相关遗传差异有关, HLA-B*35:01等位基因是何首乌致肝损伤易感人群的基因标志物, 揭示了何首乌肝损伤发生与机体遗传背景之间的关系[147]。在临床前瞻性研究中, 通过比对何首乌致肝损伤易感个体与耐受个体在摄入何首乌前后的代谢特征, 筛选出甘油磷脂代谢、鞘脂代谢、脂肪酸代谢、组氨酸代谢和芳香族氨基酸代谢等25种主要的差异代谢产物, 区分了易感和耐受个体的代谢特征, 有助于及早识别药物肝损伤的易感人群, 指导临床用药, 预防或避免肝损伤重症化的进展和不良结局的发生[149]。
马兜铃酸(aristolochic acids, AAs)致肝癌和生殖癌成为近年来AAs毒理学研究的热点。韩泽广团队发现马兜铃酸I (AAI)单独使用或AAI与四氯化碳(CCl4)合用均可诱发小鼠肝癌(肝细胞肝癌、肝内胆管细胞癌), 且与CCl4合用可升高小鼠肝癌的发病率。基因组测序数据分析显示, AAI引起小鼠肝癌中存在典型的DNA碱基A→T颠换, 导致小鼠Hras基因(Q61L, CAA→CTA)的激活突变, 是引起细胞恶性转化的关键。采用质谱方法随机检测62例人肝癌样本, 发现16例样本中存在AAI-DNA加合物, 且能够影响TP53、JAK1等多个重要基因突变。上述研究提示AAI致肝癌的机制可能是AAI-DNA加合物导致DNA损伤, 形成的A > T突变发生在Hras、TP53等基因诱发小鼠和人类肝癌的发生[150]。熊波团队发现AAI能够破坏猪卵母细胞的核及细胞质成熟, 干扰卵母细胞减数分裂进程和受精能力, 其机制可能是由于过度氧化应激诱发的DNA损伤和细胞凋亡。AAs毒理学的研究, 特别是致肝癌的研究, 有待于来自大样本临床流行病学、基于分子和基因水平揭示靶器官毒性机制等方面的进一步深化, 相关研究结果将有助于对AAs毒性较全面的科学认识[151]。
3.4 青蒿、海藻、苏木、雷公藤、乌头汤等方药的活性物质作用机制研究屠呦呦获得诺贝尔奖, 促使国内外掀起青蒿素拓展研究的热潮。青蒿素及其衍生物在体内和体外均对多种癌症表现出细胞毒性作用, 对于致癌和肿瘤转移形成也起到了一定的化学预防和治疗作用[152, 153]。Li等[154]为了解决青蒿素类药物生物利用度低的问题, 将二氢青蒿素(DHA)与抗癌化疗药马法兰合成药物偶联物(ARS4)并发现其具有显著的抗卵巢癌的体外与体内活性, 且作用强于母体药物DHA和马法兰(melphalan); 在体内ARS4能够抑制小鼠卵巢癌细胞的局部生长和腹膜内的扩散和转移, 而对正常细胞没有明显毒性。另有研究表明, 青蒿素衍生物青蒿琥酯(AS)还能够缓解一些自身免疫性疾病。如针对非肥胖型糖尿病小鼠, AS能够通过减少小鼠体内自身免疫性T细胞和增加保护性T细胞以预防I型糖尿病的发生[155]。
耿美玉团队报道了从海藻中提取的寡糖类分子, 在褐藻寡糖的基础上化学修饰得到的甘露寡糖二酸(GV-971), 能够重塑肠道菌群, 调节苯丙氨酸/异亮氨酸代谢通路, 抑制中枢神经炎症从而改善阿尔茨海默症小鼠认知功能障碍。临床试验同样发现GV-971能够改善肠道菌群失调和苯丙氨酸/异亮氨酸含量, 减轻神经炎症而逆转阿尔茨海默症患者的认知障碍[156]。
屠鹏飞团队将中药苏木的活性成分苏木酮A (sappanone A, SA)改造为化学探针, 利用反向药物寻靶策略“钩钓”药物靶点, 针对靶点阐明SA抗神经炎症的作用机制。研究发现活血化瘀中药苏木治疗缺血性脑中风疗效确切, 但其分子靶点和药理机制尚不清楚。SA是苏木中主要的抗炎活性成分, 能够直接作用于小胶质细胞肌苷-5'-单磷酸脱氢酶2 (IMPDH2) cys-140位点, 诱导其变构失活, 抑制靶点蛋白下游的炎症信号通路的活化, 发挥抗神经炎症的作用。该研究不仅阐明了SA的作用, 同时发现了潜在的抗神经炎症的作用新靶点, 有助于后续基于IMPDH2抗炎药物的设计与研发[157]。
雷公藤中主要活性成分之一雷公藤甲素(triptolide, TP)具有明确的抗肿瘤作用, 近年来改善溶解度和生物利用度, 减少不良反应, 增强联合用药的敏感性、抗多药耐药等是其抗肿瘤作用相关研究的焦点。谭蔚泓和王学强团队将TP与氨基酸修饰的核仁素特异性核酸适体AS1411偶联, AS1411改变了TP的内化途径, 并能够将TP选择性递送至三阴乳腺癌MDA-MB-231细胞, 原位释放的TP诱发溶酶体介导的细胞凋亡发挥作用。在MBA-MD-231乳腺癌细胞株异种移植小鼠模型中, AS1411能够改善TP的溶解性及对癌细胞的选择性, AS1411-TP偶联物能够明显抑制肿瘤生长且无明显的体内毒性[29]。陈钧和高小玲团队针对胰腺导管腺癌(PDAC)因伴有丰富的间质纤维而加剧肿瘤生长及易产生耐药性等问题, 分别设计了表面修饰靶向肿瘤相关成纤维细胞的五肽CREKA的负载α-倒捻子素(α-mangostin, α-M)的生物可降解聚合物纳米粒[CRE-NP(α-M)], 靶向肿瘤细胞NRP-1受体的CRPPR肽修饰负载TP的低pH响应DSPE-PEG胶束[CRP-MC(Trip)]。CRE-NP(α-M)能够抑制肿瘤相关成纤维细胞的活化, 减少细胞外基质产生, 调节肿瘤微环境。CRP-MC(Trip)在CRE-NP(α-M)预处理后顺序给药能够明显抑制原位种植肿瘤的生长。这种连续靶向递送药物系统以及顺序给药方案为克服PDAC的间质屏障, 提高化疗效果提供了一种有效的途径[158]。林娜团队通过冷冻干燥法制备了一种性质优良的肝癌靶向新型TP-半乳糖-壳聚糖纳米制剂, 可有效减缓TP的释放速度, 延长药物疗效。由于该纳米粒表面具有半乳糖基, 能够与肝实质细胞表面的去唾液酸蛋白特异性结合, 因而大大加强了TP-半乳糖-壳聚糖纳米粒的肝靶向给药能力, 并显著降低TP的生殖毒性和肝肾毒性。通过整合多组学及实验验证方法, 研究者进一步揭示了TP及TP-半乳糖-壳聚糖纳米粒可通过抑制TNF/NF-Κb/BCL2信号通路, 诱导肝癌细胞凋亡, 最终矫正失衡网络的抗肝癌作用机制[159]。许国旺和杨春章团队发现在异柠檬酸脱氢酶1 (IDH1)突变胶质瘤细胞中, TP作为Nrf2抑制剂, 能够通过下调谷胱甘肽(GSH)合成代谢相关基因GCLC、GCLM和SLC7A11表达而破坏GSH产生, 导致细胞内氧化损伤加剧从而介导细胞凋亡, 发挥抗肿瘤作用。在低级别胶质瘤和继发性胶质母细胞瘤病例中, 大约70%患者存在IDH1突变, IDH1突变引起细胞代谢系统改变, TP针对GSH代谢途径的干预作用可能是IDH1突变型胶质瘤治疗的新策略[160]。华子春团队发现TP能够通过减少黑素瘤中浸润的嗜中性粒细胞数量, 下调VEGF表达而抑制肿瘤血管生成, 改善经遗传改造鼠的伤寒沙门氏菌菌株VNP20009的肿瘤定植作用, 促进肿瘤细胞死亡, 抑制肿瘤生长。TP通过调节血管生成和宿主免疫反应来增强减毒沙门氏菌抗肿瘤作用, 为沙门氏菌介导的肿瘤治疗提供了新给药策略[161]。除抗肿瘤作用外, TP还能够通过调节神经免疫炎症反应在神经退行性疾病和慢性疼痛伴抑郁病症中发挥神经保护和抗抑郁作用[162, 163]。
雷公藤中另外一种主要活性成分雷公藤红素(celastrol)被认为是治疗肥胖的候选药物。张晓坤团队发现celastrol能够有效抑制喂食60 kcal%高脂饲料的肥胖小鼠体重增加, 其作用机制是celastrol结合于细胞核中的孤儿核受体Nur77, 促进其从细胞核转移至线粒体, 与肿瘤坏死因子受体相关因子2 (TRAF2)相互作用, 即通过TRAF2的LxxLL基序介导抑制TRAF2泛素化, 诱发Nur77 Lys63连接的泛素化。泛素化的Nur77在线粒体上与P62/SQSTM1泛素结合领域相互作用, 由此增强线粒体自噬敏感性, 促进受损线粒体被选择性清除, 从而抑制炎症和肥胖[164]。
房静远团队组织的多中心随机双盲安慰剂对照研究发现黄连提取物小檗碱(berberine, BBR)具有预防结直肠癌的癌前病变直肠腺瘤的复发的作用。研究纳入891例近期诊断腺瘤并进行腺瘤全切除手术的患者, 在2年的随访期中, 小檗碱治疗组和安慰剂组分别有155例(36%)和216例(47%)患者出现复发性腺瘤, 相对危险度0.77 (95% Cl 0.66~0.91; P = 0.001), 两组患者在随访肠镜检测中发现息肉样病变(包括腺瘤和锯齿状病变)的分别为小檗碱治疗组183例(43%)和安慰剂组255例(55%), 相对危险度0.77 (95% Cl 0.67~0.89; P = 0.002), 复发为高危的进展性腺瘤患者分别是小檗碱治疗组15例(3%)和安慰剂组26例(6%), 优势比0.52 (95% Cl 0.26~0.99; P = 0.05), 在2年随访过程中未发现结直肠腺癌, 无不良反应报告[165]。蒋建东等团队设计了负载小檗碱BBR的疏水α-生育酚内核和聚乙烯乙二醇-硫醇外壳的胶束(CTA-Mic)。研究发现BBR-CTA-Mic能够有效地促进肝脏沉积和BBR的肝细胞摄取, 改善高脂饮食喂养小鼠代谢谱, 上调小鼠肝脏中LDLR、p-AMPK和InsR等基因和蛋白表达, 降低血脂和血糖水平, 抑制炎症因子, 实现BBR在肝脏的有效积累促进其发挥抗动脉粥样硬化及调节代谢的作用, 并为天然药物的靶向治疗提供了新的方法[166]。
林娜团队采用“病(证)标志-药物靶标”关联网络全局解析策略, 阐释寒痹经方乌头汤“寒者热之”的中医治疗原理并发现塔拉定和芍药苷是该方缓解寒痹的代表性药效物质。按照“病证分子辨识-药物靶标预测-核心网络靶标筛选-关键药效物质鉴定-关键分子机制验证”的研究路径, 对比研究乌头汤候选靶标对寒、热病证分子网络的干预特点, 并发现其可调节产热/能量代谢和炎症/免疫相关的信号分子; 此外, 该团队进一步, 通过分子对接虚拟计算和表面等离子共振检测, 从该方具有良好成药性的潜在活性化合物群中筛选出塔拉定和芍药苷是与上述核心靶蛋白结合的最佳候选化合物, 并通过系列“药动-药效、体内-体外、正向-反向”实验得以验证[167]。由于乌头汤被誉为“痛痹要方”, 该团队又针对这一方剂的镇痛主效应, 应用生物分子网络研究发现方剂所含主要活性成分芍药苷与甘草苷可能是一种有开发前景的止痛药物组合。研究首先采用HPLC/ESI-LTQ-Qrbitrap-MS鉴定了乌头汤水提物中的77种化合物, 再通过ADME in silico预测其中具有良好成药性潜能的候选活性成分群及候选靶标谱, 构建了化合物成分-神经病理性疼痛相关基因-靶点多维网络, 整合了网络计算、分子对接和表面等离子共振检测, 最后通过药代动力学和在体/离体实验验证, 确定了芍药苷和甘草苷是乌头汤缓解神经病理性疼痛的主要药效活性成分, 其作用机制与负向调节CCL5-CCR5-GNAI1-SRC-PIK3CA-AKT趋化因子信号轴有关[168]。
孔令义和周湘团队发现甘草的天然产物甘草次酸(glycyrrhetinic acid, GA)是新型的线粒体靶向配体, 能够改善线粒体通透性, 提高线粒体药物吸收。研究者设计了负载阿霉素的GA功能化的氧化石墨烯(GO)给药载体(GA-GO), 与非GA功能化的纳米载体递送系统相比, GA-GO@DOX能够明显降低线粒体膜电位, 破坏Bax/Bcl-2平衡, 导致细胞色素c从线粒体膜释放并激活线粒体介导的细胞凋亡, 发挥抗肿瘤作用。值得注意的是, GA-GO在表现出其更好的诱导细胞凋亡和抗癌效果的同时, 也显示其低毒特性, 是一种有效的靶向线粒体的药物递送系统[169]。
4 药物制剂研究 4.1 仿生紫杉醇药物载体等纳米技术推动天然药物新剂型的蓬勃发展 4.1.1 以仿生紫杉醇纳米传输载体为代表的肿瘤靶向给药体系取得重要进展仿生药物传输体系模拟生物体系中的粒子如细胞、囊泡、病毒等, 为提高药物转运体系的生物相容性和疗效提供了极为广阔的空间[170], 其具有可延长血液循环时间、降低免疫原性和可实现主动靶向等优点。近5年来, 研究人员在仿生纳米药物研究领域取得众多突破性成果。2015年张良方等[171]采用血小板细胞膜分别包被载多西紫杉醇和万古霉素的聚(乳酸-乙醇酸) (PLGA)纳米粒, 分别用于大鼠动脉再狭窄和小鼠血液感染模型的靶向治疗, 取得显著的治疗效果。李亚平和王思玲等[172]将紫杉醇纳米粒用小鼠乳腺肿瘤4T1的细胞膜包敷, 获得的仿生纳米药物具有对小鼠转移性乳腺肿瘤4T1的高度靶向能力, 可降低巨噬细胞对纳米药物的吞噬, 并可显著减少肿瘤的肺转移能力, 相较于非仿生纳米紫杉醇, 仿生纳米紫杉醇使乳腺肿瘤的肺转移结节数量减少6.5倍。张灿团队将紫杉醇脂质体导入中性粒细胞, 利用中性粒细胞可穿过血脑屏障的性能及在术后产生的炎症因子风暴IL-8和CXCL1/KC作用下响应性释放出紫杉醇, 该团队将该紫杉醇脂质体用于治疗小鼠复发性神经胶质瘤, 可显著延长小鼠的生存时间[173]。最近, 郭培宣团队利用具有超级热力学稳定性的RNA四向连接(4WJ)纳米颗粒, 将紫杉醇溶解度提高了32 000倍。他们在RNA纳米颗粒上引入靶向乳腺癌的表皮生长因子受体(EGFR)核酸适配体, 可显著增加细胞对RNA-紫杉醇纳米颗粒的内吞, 且能明显抑制MDA-MB-231乳腺癌小鼠移植瘤的生长[174]。
相对于常规制剂, 尽管纳米药物制剂在动物模型上往往体现出显著的治疗效果, 但其在临床上的表现有时并不尽如人意。例如Shitara等[175]于日本针对741名晚期胃癌患者开展了III期临床研究, 该团队以常规紫杉醇制剂作为对照, 采用白蛋白结合紫杉醇纳米粒治疗此前对一线化疗不敏感的患者, 发现纳米紫杉醇治疗组患者的中位生存期仅稍好于常规紫杉醇制剂组。Untch等[176]在德国针对1 206例患有早期乳腺癌患者的治疗研究也表明, 尽管白蛋白结合紫杉醇纳米粒在抑制肿瘤转移方面的表现明显好于常规紫杉醇制剂, 但两个治疗组中患者的长期生存率并无显著性差异。提示由于动物模型常常不能真实反映人体的病理生理过程, 将纳米药物从动物水平的模拟推广/转化到人体临床应用的过程仍有相当长的距离, 同时也引起人们对纳米药物肿瘤靶向性的机制产生了质疑。
众所周知, 为从血液中快速获取氧气和营养物质以满足肿瘤细胞不断增殖的需要, 肿瘤新生血管具有很高的渗透性, 纳米药物能聚集到肿瘤是因为其能穿过肿瘤血管内皮细胞之间的间隙(内皮间隙, 尺寸从几十到2 000 nm), 并因肿瘤组织的淋巴循环缺损而被滞留下来, 即肿瘤的高通透滞留(enhanced permeability and retention, EPR)效应。EPR效应, 以及纳米药物制备技术、形状大小及表面性质调控方法的发展, 在过去30年推动了纳米医学尤其是在癌症领域的发展。近期, 加拿大多伦多大学Sindhwani等[177]用电镜对多种肿瘤的300多条血管的观察分析, 颠覆了学界对EPR效应的认知, 并通过ICP-MS、TEM和三维成像在活体和Zombie模型中系统研究, 发现内皮间隙并不是纳米颗粒进入实体肿瘤的原因, 取而代之的是, 绝大多数纳米颗粒是通过内皮细胞的主动转胞吞过程进入肿瘤。由于结论颠覆了以往认知, 该文一经发表便受到研究者广泛关注, Nature Materials刊登了关于该文的社论、新闻与观点、评论等三篇文章, 呼吁进一步探究肿瘤治疗的挑战与未来。对纳米药物主动转胞吞深入肿瘤的了解将开启增强肿瘤积聚的策略, 有助于制定策略来克服癌症纳米药物临床转化的不足。
4.1.2 以CRLX101为代表的喜树碱新型纳米药物喜树碱(camptothecin)是在生长于中国华南的尖叶喜树(Camptotheca acuminata)中发现的强效抗肿瘤药物, 其水溶性衍生物伊立替康和拓扑替康已被FDA批准用于结肠癌和卵巢癌的治疗。针对喜树碱及其衍生物新剂型的研究一直是制药公司和研究人员关注的重点。美国加州理工学院Mark E. Davis团队开发的CRLX101是一种喜树碱/聚乙二醇-环糊精(PEG-CD)纳米药物, 目前处于II期临床研究。Clark等[178]通过内窥镜技术及免疫组化分析了该纳米药物在9名胃癌患者中的药代动力学情况, 发现该纳米药物可在患者肿瘤组织中蓄积, 而肿瘤附近的非肿瘤组织未观察到纳米药物, 显示出该纳米药物对实体肿瘤良好的靶向作用。另外, 经过治疗后患者体内的肿瘤标志物碳酸酐酶IX和拓扑异构酶I表达显著降低。
结直肠肿瘤是最常见的肿瘤类型之一, 研究表明, 肠道菌群中的某些特定细菌在结直肠肿瘤的进展与治疗中均起至关重要的作用。如核梭杆菌(Fusobacterium nucleatum)会促使肿瘤细胞发生保护性自噬, 导致肿瘤细胞产生对化疗药物的耐受性。张先正报道了一种基于噬菌体介导的靶向性纳米伊立替康, 成功用于调控小鼠肠道菌群并有效提升了肿瘤化疗效果[179]。Liang等[180]将喜树碱与氟脲苷通过季戊四醇共价连接并与二硬脂酰基磷脂酰乙醇胺DSPE-聚乙二醇2000制备载药纳米囊, 该纳米囊可显著延长药物在动物体内的循环时间, 对小鼠PC-3前列腺癌移植瘤显示出优良的协同治疗效果。Wang等[181]采用喜树碱前体药物和纳米氧化铁等制备了pH和H2O2双重响应的纳米药物, 用于对小鼠肺癌模型的化学/化学动力联合治疗。Piao等[182]采用低聚RNA与喜树碱共价连接制备的纳米粒对小鼠鼻咽癌模型显示出显著增强的治疗效果。Cong等[183]设计制备了尺寸可变的叶酸修饰多肽/透明质酸纳米胶束, 可延长血液循环时间并促进在肿瘤细胞内的摄取, 采用该载体共装载7-乙基-10-羟基喜树碱(SN38)和近红外荧光探针吲哚菁绿, 并用于对小鼠黑素瘤的诊断治疗。结果显示, 经化疗/光动力联合治疗的荷瘤小鼠, 有50%的小鼠肿瘤完全消失。Zhang等[184]采用DNA修饰喜树碱以增加药物的水溶性, 得到的前体药物可自组装形成四面体结构。相对于游离药物, 该纳米喜树碱对裸鼠移植结肠肿瘤具有显著增强的药效作用。申有青团队研究了不同大小的纳米药物在动物体内的动力学, 他们合成了粒径可调控的7-乙基-10-羟基喜树碱聚合物前体药物, 发现随纳米药物的粒径增大, 其血液循环时间及在肿瘤中的摄取都增加, 较理想的粒径范围为100~160 nm。然而, 更高的肿瘤摄取并不意味着抑瘤效果的提高, 原因是相对于较小的纳米粒子(30 nm), 较大的纳米粒子(100 nm)对肿瘤的穿透能力减弱[185], 这与Cabral等[186]的研究结果一致。表明为提高对肿瘤的治疗效果, 纳米药物的研发需要在肿瘤的蓄积能力与对肿瘤的穿透能力之间寻求平衡。
针对大尺寸纳米药物在致密肿瘤内依靠自身扩散被动渗透难的瓶颈问题, 申有青等和加州大学洛杉矶分校顾臻团队合作, 利用肿瘤血管内皮细胞上及血管附近肿瘤细胞高表达γ-谷氨酰转肽酶(GGT)的特点, 设计合成了GGT响应的聚合物PBEAGA及其与化疗药物喜树碱(CPT)的偶联物PBEAGA-CPT, 其可自组装成纳米颗粒[187]。该纳米喜树碱到达肿瘤毛细血管后, 内皮细胞表面的GGT使纳米粒表面聚合物上的γ-谷氨酰基水解而产生胺基, 使纳米粒带正电荷, 触发血管内皮细胞快速转胞吞渗入肿瘤, 进而借助转胞吞作用在肿瘤组织内跨细胞传递。尾静脉注射10 min后, 纳米药物就已经外渗出血管并遍布整个肿瘤区域, 1 h内肿瘤组织内药物浓度和血管内基本相当。该纳米粒尾静脉注射不仅能完全治愈起始体积为100 mm3的小肿瘤, 也能使已处于指数增长、难治的大肿瘤(500 mm3)迅速缩小, 停药未见明显反弹, 抑瘤率高达98%。这种化被动渗透为主动渗透的策略促进纳米药物在肿瘤组织内的蓄积, 为下一阶段纳米药物的设计开辟了新的思路。
针对晚期结直肠癌, 盐酸伊立替康是临床广泛使用的广谱细胞毒性药物。但是, 其存在致死性腹泻脱水、腹部痉挛性疼痛、发热等不良反应。梁兴杰课题组利用相容性好的生物材料实现了盐酸伊立替康纳米化, 于2019年获准开展临床试验。这是目前国内获得批准进入临床的第一个名称中含有“纳米”字样的治疗性新药。2020年4月, 国家纳米中心与广东惟楚医疗科技有限公司签署合作协议, 接续抗肿瘤2.2类新药注射用盐酸伊立替康(纳米)胶束临床试验研究, 该成果转让金额超过亿元。
4.1.3 以小檗碱等纳米药物为代表的中药活性成分新剂型生物碱是含氮化合物, 多具有复杂环状结构, 为中药与天然植物的重要有效成分之一。小檗碱(berberine)是广谱抗菌药物, 临床上盐酸小檗碱用于治疗胃肠道感染。小檗碱广泛存在于黄连(Coptis chinensis Franch.)、黄柏(Phellodendron chinense Schneid.)等中药中。然而, 其注射剂可引起心脏抑制及阿斯综合症等, 严重时可导致死亡, 我国已淘汰盐酸小檗碱注射剂。纳米技术的发展为小檗碱的减毒增效提供了有效途径。雷海民等发现小檗碱与黄芩苷在特定条件下可形成纳米粒子, 与小檗碱相比, 该纳米复合物具有显著增强的抗菌及清除生物膜的能力。该研究为中药复方相对于单方的协同起效作用机制的探讨提供了一种可能解释[188]。
雷公藤甲素(triptolide)是环氧二萜内酯化合物, 为卫矛科植物雷公藤(Tripterygium wilfordii Hook. f.)的主要活性成分之一, 具有抗炎、免疫抑制、抗类风湿、抗肿瘤等药理作用。临床上有雷公藤片、雷公藤多苷片等。因其水难溶性而应用受到限制。Kong等[189]将雷公藤甲素载入pH超敏感胶束并实现肿瘤细胞靶向, 通过阻断肿瘤细胞溶酶体的酸化作用和快速释药实现对小鼠胰腺肿瘤的有效治疗。Feng等[158]针对胰腺导管癌成纤维结缔组织增生的特点, 设计了可靶向肿瘤相关成纤维组织的纳米粒子并共装载α-倒捻子素和雷公藤甲素, 该纳米药物可显著增强药物的抗肿瘤药效并能明显减少肿瘤细胞外基质的生长。
黄酮类化合物也是广泛存在于中药与天然植物中的活性物质。槲皮素(quercetin)广泛存在于许多植物的茎皮、花、叶、芽、种子、果实中, 多以苷的形式存在, 如芦丁、槲皮苷、金丝桃苷等。槲皮素具有抗炎、降血压、抗病毒、抗肿瘤等药理活性。美国北卡罗来纳大学黄立夫等制备了粒径为35 nm的槲皮素纳米粒, 可显著提高槲皮素的生物利用度及代谢稳定性, 该纳米槲皮素可通过显著下调Wnt16的表达, 改善胰腺癌的肿瘤微环境, 通过抑制肿瘤周围组织的纤维化从而提高纳米顺铂用于富含成纤维组织的膀胱癌模型的协同治疗作用[190]。
天然多酚类化合物是一类重要的具药理活性化学物质, 广泛存在于中药与天然植物之中。姜黄素(curcumin)是姜科、天南星科等植物根茎中的一种多酚化合物, 作为天然色素广泛应用于食品工业、中药及印度药中。姜黄素具有抗氧化、抗老年痴呆、抗肿瘤等活性, 但因其溶解度不高而导致其生物利用度较低, 且稳定性差、代谢快, 影响了其在制药领域的应用。为提高姜黄素的口服生物利用度, Chuang等[191]巧妙采用二乙基三胺戊乙酸二酸酐、碳酸钠、十二烷基硫酸钠制备了一种自发泡体系, 其可与姜黄素在肠道环境下自发形成纳米乳, 该纳米乳可被动靶向至肠道M细胞, 并通过肠道-淋巴系统被吞噬和转运至胰腺组织。该纳米乳可使急性胰腺炎大鼠模型胰腺中的药物浓度比游离姜黄素组高12倍。蒋晨团队设计了修饰有可靶向晚期糖基化终末产物受体多肽的聚乙二醇-聚赖氨酸两亲胶束并装载姜黄素, 制备的纳米药物可通过仿β-淀粉样蛋白转运途径在阿尔茨海默症小鼠模型病变组织中蓄积。该聚合物可捕捉活性氧自由基, 携带的药物可抑制β-淀粉样蛋白的表达, 通过该纳米药物的协同作用调控小神经胶质细胞, 从而缓解β-淀粉样斑块造成的负担, 提高阿尔茨海默症小鼠模型的认知能力[192]。唇形科植物迷迭香(Rosmarinus officinalis Linn)是一种药食两用植物, 在西方常用作食用调料。迷迭香酸(rosmarinic acid)是迷迭香中一种水溶性天然多酚类抗氧化剂, 也广泛存在于夏枯草(Prunella vulgaris L.)、紫苏子(Perillae fructus)等中药中, 具有抗炎、抗病毒、抗肿瘤等活性。Chung等[193]采用聚乙二醇(PEG)修饰迷迭香酸, 得到直径约60 nm的纳米粒子, 该纳米药物可通过减少结肠炎小鼠模型的氧化应激而对其炎症进行治疗。
4.2 以大麻素类药物为代表的天然药物制剂目前, 传统剂型仍在临床使用药物剂型中占据主流地位。除口服制剂外, 黏膜给药制剂等局部给药制剂由于其应用方便、患者顺应性好的优点, 因而也得到了各制药公司的重视。
大麻(C. Sativa L.)又名线麻、寒麻、云麻、火麻等, 是桑科(Moraceae)大麻属(Cannabis L.)一年生草本植物, 为我国传统经济作物, 广泛应用于医药、食品、保健品、化妆品等领域。大麻素是一类含有21或22个碳的羧基化萜酚类化合物, 具有广泛的药理活性, 包括抗癫痫、治疗多发性硬化、抗炎、抗抑郁、抗肿瘤等, 在临床上应用于治疗癫痫、多发性硬化症等。英国吉瓦制药(GW Pharma)开发的Setivex® (Nabiximols)是一种含有四氢大麻酚和大麻二酚的口腔黏膜喷雾剂, 于2010年在英国上市, 用于多发性硬化患者减轻神经性疼痛、痉挛、膀胱过度活动症和其他症状。该公司基于大麻二酚的液体口服制剂Epidiolex®, 2018年6月获美国FDA批准, 用于治疗2岁及以上患者的Dravet综合征和Lennox-Gasraut综合征相关的罕见癫痫发作治疗。Riva等[194]采用Nabiximols针对60名患有运动神经元病的患者开展了II期临床研究, 他们发现, 与安慰剂组相比, Nabiximols组可有效缓解患者的痉挛症状, 并且该药物显示出较好的安全性及患者顺应性。Mao等[195]采用Epidiolex®治疗患有Lennox-Gastaut综合征的患者, 在该III期临床试验中, 服用大麻二酚患者的每月癫痫发作频率降低了43.9%, 而安慰剂组仅降低了21.8%。同时, 该制剂的不良反应多数较轻微。Thiele等[167]另外开展的III期临床试验也得到相似的临床结论。以上研究充分说明了大麻素类药物在临床上的重要潜力。另外, 黏膜给药剂型和液体口服剂型尤其适用于儿童及老年患者。
4.3 以Trodelvy ™为代表的抗体偶联药物(antibody-drug conjugates, ADC)制剂加快推向临床抗体偶联药物是将单克隆抗体的高特异性、体内长循环性和小分子细胞毒药物的高活性相结合, 以提高抗肿瘤药物的靶向性, 减少不良反应[196]。与传统完全或部分人源化抗体或抗体片段相比, ADC因为能在肿瘤组织内释放高活性的细胞毒药物从而理论上疗效更高。和融合蛋白相比, 它具有更高的耐受性和/或较低的副作用。ADC药物对靶点的准确识别性及非癌细胞不受影响性, 极大地提高了药效并减少了不良反应, 因而备受关注。第一个被美国FDA批准的ADC药物是辉瑞的Mylotarg®, 用于治疗急性单核细胞白血病, 其因不能延长患者的生存期和更高的毒性而被辉瑞终止上市[197]。罗氏的注射用恩美曲妥珠单抗[Trastuzumab emtansine, 商品名赫赛莱(Kadcyla®)]是国内首款获批上市的ADC药物, 用于HER2阳性乳腺癌患者的辅助治疗。美登素(maytansine)是卫茅科美登木属及其亲缘植物中的强效抗肿瘤生物碱, 恩美曲妥珠单抗中的细胞毒药物为美登素衍生物。Trodelvy™ (Sacituzumab govitecan)是一种新型ADC药物, 由靶向Trop-2抗原的人源化IgG1抗体与化疗药物伊立替康(拓扑异构酶I抑制剂, 为水溶性喜树碱衍生物)的代谢活性产物SN-38偶联而成。Trop-2是一种在90%以上的转移性三阴性乳腺癌(TNBC)患者中表达的细胞表面糖蛋白。Sacituzumab govitecan可将药物以Trop-2为靶点进行针对性治疗。2020年4月22日, 美国FDA加速批准Trodelvy™用于治疗既往已接受至少2种疗法的TNBC患者, 这是首款获得FDA批准治疗转移性三阴性乳腺癌患者的靶向Trop-2的抗体偶联药物。Bardia等[198]针对69例TNBC患者的治疗中, 发现该单抗偶联药物的响应率达30%。开发ADC药物对单克隆抗体的要求是无免疫原性、高效和脱靶率低; 而对细胞毒药物的要求为:半抑制浓度(IC50)在亚纳摩尔水平、具有适宜的水溶性、对多药耐药蛋白1 (MDR1)不易感等[197, 199]。目前, 全世界有超过100种ADC药物处于不同临床研究阶段[200]。天然药物的多样性可为ADC药物的开发提供更多选择。
5 前沿热点与重要进展的展望和启示由于化学合成药物的研发时间及研发成本越来越高, 广大药物开发人员越来越注意挖掘药用植物中新型高效的天然药物及其衍生物用于开发新药。需要指出的是, 各大制药公司的研发管线有相当大一部分重点仍是抗肿瘤药物, 如全球TOP10制药公司的研发管线中抗癌药物占据30%以上, 超过455家的小型制药公司的研发管线中90%以上是抗肿瘤药物。另外, 上市5年内的抗肿瘤新药在发达国家占据越来越高的市场份额, 而对于新兴市场国家, 上市15年以上的制剂及仿制药仍是主力军。中国抗肿瘤药物市场2018年超过1 400亿元。随着中国经济的进一步发展及产业结构升级的不断推进, 开发原创性抗肿瘤新药是摆在国内制药公司及药物研究人员面前的重要方向。中药与天然药物是一个巨大的宝库, 必将为新型药物的开发提供更多的资源和启示, 大麻素类有关药物的上市即是很好的实例。
天然产物是新药设计与研发的重要源泉。随着化学和生物学研究技术的不断提高, 拥有新骨架结构的新天然产物层出不穷, 这为新药开发提供了更多的化学结构信息, 也形成了更加庞大的天然先导化合物库。随着天然产物合成和衍生化等化学工作的深入开展, 借助于计算机辅助分子设计策略能够进一步有效地推动药物先导化合物的发现。另外, 将基因组、蛋白组与次级代谢物组等组学研究相结合的策略, 在系统生物信息学分析的基础上找出同一基因簇家族的天然产物及其与生物合成基因(蛋白)的相关性, 同样能够为新活性天然产物的开发提供了巨大的研究潜力。因此, 应充分发挥我国民族中药的优势, 深入挖掘具有特色的天然新物种或新资源, 为创新药物的研究提供更有价值的先导化合物, 以推动我国自主知识产权的新天然药物开发。
由于中药和天然药市场需求量不断增加, 野生药用动植物资源数量急剧减少, 因此生药资源供需矛盾越来越大, 生物技术是解决生药资源紧张的有效手段。在生药资源研究领域, 综合利用基因组学、转录组学、蛋白质组学、代谢组学和表型组学以及合成生物学等前沿技术, 进行多组学联合分析, 解析复杂天然产物的生物合成途径和关键酶学机制, 挖掘关键基因和紧密连锁的分子标记, 并应用于生药资源种质创新、精准鉴定、仿生栽培以及天然产物合成生物学研究等领域, 实现中药资源的科学化、标准化、可持续性发展。
药理毒理学研究从天然产物中挖掘和创制防治重大疾病的药物, 建立关键技术平台, 形成物质基础、药效物质活性筛选、成药性评价、安全性评价等技术体系, 丰富和发展了医药理论, 促进了医药产业的进步。随着医药临床应用的快速增长, 药理毒理学研究受到了更广泛的关注和重视。围绕国际新药研发趋势和社会需求, 重视传统医药临床用药经验, 以及来自于真实世界或随机对照临床试验的数据, 结合生物信息学、谱学、药代动力学、系统生物学、系统毒理学等研究方法和技术, 阐明中药与天然药药效物质基础、体内代谢过程、作用靶点及机制、潜在毒性和产生机制等关键问题, 促进防治重大疾病的新药创制研发, 助力精准医疗和医药现代化的发展。
由于纳米医学的飞速发展, 纳米技术不断为新型药物制剂赋能, 使其具有水溶性好、长效、靶向、低毒等优点, 这些优点尤其适用于中药与天然药物中的有效成分。利用纳米技术开发新型或改造原有的药物制剂已成为制药公司投入巨资研发的重要方向。目前, 超过100种纳米药物处于不同临床研究阶段, 有十余种纳米药物已经上市。然而, 尽管纳米药物已在动物和体外研究层面取得了很大的成功, 但从在实验室被证明有效的纳米药物到走向临床应用仍有相当长的路要走。其原因部分在于在动物模型层面进行的药效学评价往往不能真实反映人体的病理生理作用机制。另一方面, 对于纳米药物的安全性和在临床上的有效性也需要进行更为深入的机制研究和药效评价。借助于抗体药物的不断发展, 抗体偶联药物是值得关注的一大领域。目前, 全球已有6个ADC药物获批, 其市场已超过100亿美元。国内也有数十个不同的ADC药物处于不同临床研究阶段。但目前ADC药物中的细胞毒药物选择范围仍较有限, 而中药与天然药物中的活性成分可为ADC类药物的研发提供更多选择。
致谢: 感谢叶敏、廖永红、杨凌、邹忠梅、林娜、王向涛等教授为本文撰写提供相关文献信息资料和帮助。
作者贡献:陈士林是本综述的构思者、负责人及主要撰写人, 指导论文写作与修改, 对整体结构和质量进行把控; 孙奕、万会花、张晗、赵庆贺分别参与“药物化学研究”、“药物资源研究”、“药理毒理学研究”和“药物制剂研究”的资料搜集和写作。
利益冲突:无任何经济利益或版权冲突。
| [1] |
Wang J, Xu C, Liao FL, et al. A temporizing solution to "Artemisinin Resistance"[J]. New Engl J Med, 2019, 380: 2087-2089. |
| [2] |
Wang J, Xu C, Liao FL, et al. Suboptimal dosing triggers artemisinin partner drug resistance[J]. Lancet Infect Dis, 2019, 19: 1167-1168. |
| [3] |
Wang J, Xu C, Lun Z, et al. Unpacking 'artemisinin resistance'[J]. Trends Pharmacol Sci, 2017, 38: 506-511. |
| [4] |
Kong LY, Tan R. Artemisinin, a miracle of traditional Chinese medicine[J]. Nat Prod Rep, 2015, 32: 1617-1621. |
| [5] |
Tiwari MK, Chaudhary S. Artemisinin-derived antimalarial endoperoxides from bench-side to bed-side:chronological advancements and future challenges[J]. Med Res Rev, 2020, 40: 1220-1275. |
| [6] |
Matsuda Y, Abe I. Biosynthesis of fungal meroterpenoids[J]. Nat Prod Rep, 2016, 33: 26-53. |
| [7] |
Peng X, Qiu M. Meroterpenoids from Ganoderma species:a review of last five years[J]. Nat Prod Bioprospect, 2018, 8: 137-149. |
| [8] |
Zhao Z, Wu L, Xie J, et al. Rhodomyrtus tomentosa (Aiton.):a review of phytochemistry, pharmacology and industrial applications research progress[J]. Food Chem, 2020, 309: 125715. |
| [9] |
Qi C, Bao J, Wang J, et al. Asperterpenes A and B, two unprecedented meroterpenoids from Aspergillus terreus with BACE1 inhibitory activities[J]. Chem Sci, 2016, 7: 6563-6572. |
| [10] |
Qin X, Rauwolf T, Li P, et al. Isolation and synthesis of novel meroterpenoids from Rhodomyrtus tomentosa:investigation of a reactive enetrione intermediate[J]. Angew Chem Int Ed, 2019, 58: 4291-4296. |
| [11] |
Qin F, Zhang H, Di Q, et al. Ganoderma cochlear metabolites as probes to identify a COX-2 active site and as in vitro and in vivo anti-inflammatory agents[J]. Org Lett, 2020, 22: 2574-2578. |
| [12] |
Zhou FJ, Nian Y, Yan YM, et al. Two new classes of T-type calcium channel inhibitors with new chemical scaffolds from Ganoderma cochlear[J]. Org Lett, 2015, 17: 3082-3085. |
| [13] |
Fang X, Di Y, Zhang Y, et al. Unprecedented quassinoids with promising biological activity from Harrisonia perforata[J]. Angew Chem Int Ed, 2015, 54: 5592-5595. |
| [14] |
Yu J, Liu Q, Sheng L, et al. Cipacinoids A-D, four limonoids with spirocyclic skeletons from Cipadessa cinerascens[J]. Org Lett, 2016, 18: 444-447. |
| [15] |
Wang W, Liu X, Zhang M, et al. Taxodisones A and B:bioactive C30-terpenes with new skeletons from Taxodium distichum and their biosynthetic origin[J]. Chem Commun, 2020, 56: 3329-3332. |
| [16] |
Niu CS, Li Y, Liu YB, et al. Pierisketolide A and pierisketones B and C, three diterpenes with an unusual carbon skeleton from the roots of Pieris formosa[J]. Org Lett, 2017, 19: 906-909. |
| [17] |
Fan Y, Shi S, Deng G, et al. Crokonoids A-C, a highly rearranged and dual-bridged spiro diterpenoid and two other diterpenoids from Croton kongensis[J]. Org Lett, 2020, 22: 929-933. |
| [18] |
Zhang W, Zhao J, Sheng L, et al. Mangelonoids A and B, two pairs of macrocyclic diterpenoid enantiomers from Croton mangelong[J]. Org Lett, 2018, 20: 4040-4043. |
| [19] |
Xue GM, Han C, Chen C, et al. Artemisians A-D, diseco-guaianolide involved heterodimeric[4+2] adducts from Artemisia argyi[J]. Org Lett, 2017, 19: 5410-5413. |
| [20] |
Wang TT, Wei YJ, Ge HM, et al. Acaulide, an osteogenic macrodiolide from Acaulium sp. H-JQSF, an isopod-associated fungus[J]. Org Lett, 2018, 20: 1007-1010. |
| [21] |
Wu C, Der Heul HUV, Melnik AV, et al. Lugdunomycin, an angucycline-derived molecule with unprecedented chemical architecture[J]. Angew Chem Int Ed, 2019, 58: 2809-2814. |
| [22] |
Cheol KM, Henrique M, Hwa JK, et al. Integration of genomic data with NMR analysis enables assignment of the full stereostructure of neaumycin B, a potent inhibitor of glioblastoma from a marine-derived Micromonospora[J]. J Am Chem Soc, 2018, 140: 10775-10784. |
| [23] |
Song L, Jenner M, Masschelein J, et al. Discovery and biosynthesis of gladiolin:a Burkholderia gladioli antibiotic with promising activity against Mycobacterium tuberculosis[J]. J Am Chem Soc, 2017, 139: 7974-7981. |
| [24] |
Hoffmann H, Kogler H, Heyse W, et al. Discovery, structure elucidation, and biological characterization of nannocystin A, a macrocyclic myxobacterial metabolite with potent antiproliferative properties[J]. Angew Chem Int Ed, 2015, 54: 10145-10148. |
| [25] |
Moss NA, Seiler GS, Leao T, et al. Nature's combinatorial biosynthesis produces vatiamides A-F[J]. Angew Chem Int Ed, 2019, 58: 9027-9031. |
| [26] |
Wyche TP, Ruzzini AC, Schwab L, et al. Tryptorubin A:a polycyclic peptide from a fungus-derived Streptomycete[J]. J Am Chem Soc, 2017, 139: 12899-12902. |
| [27] |
Gao X, Fan Y, Liu Q, et al. Suadimins A-C, unprecedented dimeric quinoline alkaloids with antimycobacterial activity from Melodinus suaveolens[J]. Org Lett, 2019, 21: 7065-7068. |
| [28] |
Zhang H, Shyaula S, Li J, et al. Himalensines A and B, alkaloids from Daphniphyllum himalense[J]. Org Lett, 2016, 18: 1202-1205. |
| [29] |
Yu Z, Xiao D, Shun S, et al. Melocochines A and B, two alkaloids from the fruits of Melodinus cochinchinensis[J]. Org Lett, 2019, 21: 9272-9275. |
| [30] |
Zhang ZJ, Wang C, Wu XD, et al. Phlegmadine A:a lycopodium alkaloid with a unique cyclobutane ring from Phlegmariurus phlegmaria[J]. J Org Chem, 2019, 84: 11301-11305. |
| [31] |
Wu YZ, Shao S, Guo QL, et al. Aconicatisulfonines A and B, analgesic zwitterionic C20-diterpenoid alkaloids with a rearranged atisane skeleton from aconitum Aconitum carmichaelii[J]. Org Lett, 2019, 21: 6850-6854. |
| [32] |
Guo Q, Xia H, Shi G, et al. Aconicarmisulfonine A, a sulfonated C-20-diterpenoid alkaloid from the lateral roots of Aconitum carmichaelii[J]. Org Lett, 2018, 20: 816-819. |
| [33] |
Gao XH, Xu YS, Fan YY, et al. Cascarinoids A-C, a class of diterpenoid alkaloids with unpredicted conformations from Croton cascarilloides[J]. Org Lett, 2018, 20: 228-231. |
| [34] |
Zhu H, Chen C, Tong Q, et al. Asperflavipine A:a cytochalasan a heterotetramer uniquely defined by a highly complex tetradecacyclic ring system from Aspergillus flavipes QCS12[J]. Angew Chem Int Ed, 2017, 56: 5242-5246. |
| [35] |
Zhu H, Chen C, Xue Y, et al. Asperchalasine A, a cytochalasan dimer with an unprecedented decacyclic ring system, from Aspergillus flavipes[J]. Angew Chem Int Ed, 2015, 54: 13374-13378. |
| [36] |
Wang W, Lei X, Yang Y, et al. Xylarichalasin A, a halogenated hexacyclic cytochalasan from the fungus Xylaria cf. curta[J]. Org Lett, 2019, 21: 6957-6960. |
| [37] |
Wang W, Li ZL, Feng T, et al. Curtachalasins A and B, two cytochalasans with a tetracyclic skeleton from the endophytic fungus Xylaria curta E10[J]. Org Lett, 2018, 20: 7758-7761. |
| [38] |
Wang W, Lei X, Ai H, et al. Cytochalasans from the endophytic fungus Xylaria cf. curta with resistance reversal activity against fluconazole-resistant Candida albicans[J]. Org Lett, 2019, 21: 1108-1111. |
| [39] |
Su FY, Zhao Z, Ma SG, et al. Cnidimonins A-C, three types of hybrid dimer from Cnidium monnieri:structural elucidation and semisynthesis[J]. Org Lett, 2017, 19: 4920-4923. |
| [40] |
Tang Z, Liu Y, Ma S, et al. Antiviral spirotriscoumarins A and B:two pairs of oligomeric coumarin enantiomers with a spirodienone-sesquiterpene skeleton from Toddalia asiatica[J]. Org Lett, 2016, 18: 5146-5149. |
| [41] |
Vu V, Chen X, Kong L, et al. Melipatulinones A-C, three lignan-phloroglucinol hybrids from Melicope patulinervia[J]. Org Lett, 2020, 22: 1380-1384. |
| [42] |
Wolfender J, Litaudon M, Touboul D, et al. Innovative omics-based approaches for prioritisation and targeted isolation of natural products-new strategies for drug discovery[J]. Nat Prod Rep, 2019, 36: 855-868. |
| [43] |
Wolfender J, Nuzillard J, Hooft JJJ, et al. Accelerating metabolite identification in natural product research:toward an ideal combination of LC-HRMS/MS and NMR profiling, in silico databases and chemometrics[J]. Anal Chem, 2019, 91: 704-742. |
| [44] |
Sindelar M, Patti GJ. Chemical discovery in the era of metabolomics[J]. J Am Chem Soc, 2020, 142: 9097-9105. |
| [45] |
Wang M, Carver JJ, Phelan VV, et al. Sharing and community curation of mass spectrometry data with Global Natural Products Social Molecular Networking[J]. Nat Biotechnol, 2016, 34: 828-837. |
| [46] |
Floros DJ, Jensen PR, Dorrestein PC, et al. A metabolomics guided exploration of marine natural product chemical space[J]. Metabolomics, 2016, 12: 145-148. |
| [47] |
Allard P, Peresse T, Bisson J, et al. Integration of molecular networking and in-silico MS/MS fragmentation for natural products dereplication[J]. Anal Chem, 2016, 88: 3317-3323. |
| [48] |
Crusemann M, Oneill EC, Larson CB, et al. Prioritizing natural product diversity in a collection of 146 bacterial strains based on growth and extraction protocols[J]. J Nat Prod, 2017, 80: 588-597. |
| [49] |
Reher R, Kim HW, Zhang C, et al. A convolutional neural network-based approach for the rapid annotation of molecularly diverse natural products[J]. J Am Chem Soc, 2020, 142: 4114-4120. |
| [50] |
Hautbergue T, Jamin EL, Debrauwer L, et al. From genomics to metabolomics, moving toward an integrated strategy for the discovery of fungal secondary metabolites[J]. Nat Prod Rep, 2018, 35: 147-173. |
| [51] |
Yan Y, Liu Q, Zang X, et al. Resistance-gene-directed discovery of a natural-product herbicide with a new mode of action[J]. Nature, 2018, 559: 415-418. |
| [52] |
Chevrette MG, Carlson CM, Ortega HE, et al. The antimicrobial potential of Streptomyces from insect microbiomes[J]. Nat Commun, 2019, 10: 1-11. |
| [53] |
Ismail HM, Barton V, Phanchana M, et al. Artemisinin activity-based probes identify multiple molecular targets within the asexual stage of the malaria parasites Plasmodium falciparum 3D7[J]. Proc Natl Acad Sci U S A, 2016, 113: 2080-2085. |
| [54] |
Li J, Casteels T, Frogne T, et al. Artemisinins target GABAA receptor signaling and impair alpha cell identity[J]. Cell, 2017, 168: 86-100. |
| [55] |
Yi C, Yu J, Kim H, et al. Identification of actin as a direct proteomic target of berberine, using an affinity-based chemical probe and elucidation of its modulatory role in actin assembly[J]. Chem Commun, 2017, 53: 7045-7047. |
| [56] |
Xu X, Li W, Li T, et al. Direct infusion-three-dimensional-mass spectrometry enables rapid chemome comparison among herbal medicines[J]. Anal Chem, 2020, 92: 7646-7656. |
| [57] |
Ding X, Cao Y, Yuan Y, et al. Development of APTES-decorated HepG2 cancer stem cell membrane chromatography for screening active components from Salvia miltiorrhiza[J]. Anal Chem, 2016, 88: 12081-12089. |
| [58] |
Chen L, Lv D, Chen X, et al. Biosensor-based active ingredients recognition system for screening STAT3 ligands from medical herbs[J]. Anal Chem, 2018, 90: 8936-8945. |
| [59] |
Song W, Qiao X, Chen K, et al. Biosynthesis-based quantitative analysis of 151 secondary metabolites of licorice to differentiate medicinal Glycyrrhiza species and their hybrids[J]. Anal Chem, 2017, 89: 3146-3153. |
| [60] |
Qiu S, Yang W, Shi X, et al. A green protocol for efficient discovery of novel natural compounds:characterization of new ginsenosides from the stems and leaves of Panax ginseng as a case study[J]. Anal Chim Acta, 2015, 893: 65-76. |
| [61] |
Shi X, Yang W, Qiu S, et al. An in-source multiple collision-neutral loss filtering based nontargeted metabolomics approach for the comprehensive analysis of malonyl-ginsenosides from Panax ginseng, P. quinquefolius, and P. notoginseng[J]. Anal Chim Acta, 2017, 952: 59-70. |
| [62] |
Qiao X, Lin X, Ji S, et al. Global profiling and novel structure discovery using multiple neutral loss/precursor ion scanning combined with substructure recognition and statistical analysis (MNPSS):characterization of terpene-conjugatred curcuminoids in Curcuma longa as a case study[J]. Anal Chem, 2016, 88: 703-710. |
| [63] |
Wu C, Liu Y, Yang Y, et al. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods[J]. Acta Pharm Sin B, 2020, 10: 766-788. |
| [64] |
Chen S, Song J, Sun C, et al. Herbal genomics:examining the biology of traditional medicines[J]. Science, 2015, 347: S27-S29. |
| [65] |
Guo L, Winzer T, Yang X, et al. The opium poppy genome and morphinan production[J]. Science, 2018, 362: 343-347. |
| [66] |
Li Q, Ramasamy S, Singh P, et al. Gene clustering and copy number variation in alkaloid metabolic pathways of opium poppy[J]. Nat Commun, 2020, 11: 1-13. |
| [67] |
Xu J, Chu Y, Liao B, et al. Panax ginseng genome examination for ginsenoside biosynthesis[J]. Gigascience, 2017, 6: 1-15. |
| [68] |
Jayakodi M, Choi B, Lee S, et al. Ginseng Genome Database:an open-access platform for genomics of Panax ginseng[J]. BMC Plant Biol, 2018, 18: 62. |
| [69] |
Chen W, Kui L, Zhang G, et al. Whole-genome sequencing and analysis of the Chinese herbal plant Panax notoginseng[J]. Mol Plant, 2017, 10: 899-902. |
| [70] |
Zhang D, Li W, Xia E, et al. The medicinal herb Panax notoginseng genome provides insights into ginsenoside biosynthesis and genome evolution[J]. Mol Plant, 2017, 10: 903-907. |
| [71] |
Kellner F, Kim J, Clavijo BJ, et al. Genome-guided investigation of plant natural product biosynthesis[J]. Plant J, 2015, 82: 680-692. |
| [72] |
Su P, Guan H, Zhao Y, et al. Identification and functional characterization of diterpene synthases for triptolide biosynthesis from Tripterygium wilfordii[J]. Plant J, 2018, 93: 50-65. |
| [73] |
Liu Y, Zhou J, Hu T, et al. Identification and functional characterization of squalene epoxidases and oxidosqualene cyclases from Tripterygium wilfordii[J]. Plant Cell Rep, 2019, 39: 409-418. DOI:10.1007/s00299-019-02499-7?utm_source=other |
| [74] |
Tu L, Su P, Zhang Z, et al. Genome of Tripterygium wilfordii and identification of cytochrome P450 involved in triptolide biosynthesis[J]. Nat Commun, 2020, 11: 1-12. |
| [75] |
Yuan Y, Jin X, Liu J, et al. The Gastrodia elata genome provides insights into plant adaptation to heterotrophy[J]. Nat Commun, 2018, 9: 1615. |
| [76] |
Zhang G, Tian Y, Zhang J, et al. Hybrid de novo genome assembly of the Chinese herbal plant danshen (Salvia miltiorrhiza Bunge)[J]. Gigascience, 2015, 4: 62. |
| [77] |
Xu H, Song J, Luo H, et al. Analysis of the genome sequence of the medicinal plant Salvia miltiorrhiza[J]. Mol Plant, 2016, 9: 949-952. |
| [78] |
Song C, Liu Y, Song A, et al. The Chrysanthemum nankingense genome provides insights into the evolution and diversification of chrysanthemum flowers and medicinal traits[J]. Mol Plant, 2018, 11: 1482-1491. |
| [79] |
Liu X, Liu Y, Huang P, et al. The genome of medicinal plant Macleaya cordata provides new insights into benzylisoquinoline alkaloids metabolism[J]. Mol Plant, 2017, 10: 975-989. |
| [80] |
Mochida K, Sakurai T, Seki H, et al. Draft genome assembly and annotation of Glycyrrhiza uralensis, a medicinal legume[J]. Plant J, 2017, 89: 181-194. |
| [81] |
Zhao Q, Yang J, Cui M, et al. The reference genome sequence of scutellaria baicalensis provides insights into the evolution of wogonin biosynthesis[J]. Mol Plant, 2019, 12: 935-950. |
| [82] |
Shen Q, Zhang L, Liao Z, et al. The genome of Artemisia annua provides insight into the evolution of Asteraceae family and artemisinin biosynthesis[J]. Mol Plant, 2018, 11: 776-788. |
| [83] |
Sun W, Leng L, Yin Q, et al. The genome of the medicinal plant Andrographis paniculata provides insight into the biosynthesis of the bioactive diterpenoid neoandrographolide[J]. Plant J, 2019, 97: 841-857. |
| [84] |
Zhang J, Tian Y, Yan L, et al. Genome of plant maca (Lepidium meyenii) illuminates genomic basis for high-altitude adaptation in the central Andes[J]. Mol Plant, 2016, 9: 1066-1077. |
| [85] |
Vining KJ, Johnson SR, Ahkami A, et al. Draft genome sequence of Mentha longifolia and development of resources for mint cultivar improvement[J]. Mol Plant, 2017, 10: 323-339. |
| [86] |
Wan T, Liu Z, Li L, et al. A genome for gnetophytes and early evolution of seed plants[J]. Nat Plants, 2018, 4: 82-89. |
| [87] |
Raymond O, Gouzy J, Just J, et al. The Rosa genome provides new insights into the domestication of modern roses[J]. Nat Genet, 2018, 50: 772-777. |
| [88] |
Hibrand Saint-Oyant L, Ruttink T, Hamama L, et al. A high-quality genome sequence of Rosa chinensis to elucidate ornamental traits[J]. Nat Plants, 2018, 4: 473-484. |
| [89] |
Xu Z, Xin T, Bartels D, et al. Genome analysis of the ancient tracheophyte Selaginella tamariscina reveals evolutionary features relevant to the acquisition of desiccation tolerance[J]. Mol Plant, 2018, 11: 983-994. |
| [90] |
Zeng L, Tu X, Dai H, et al. Whole genomes and transcriptomes reveal adaptation and domestication of pistachio[J]. Genome Biol, 2019, 20: 79. DOI:10.1186/s13059-019-1686-3 |
| [91] |
Hu L, Xu Z, Wang M, et al. The chromosome-scale reference genome of black pepper provides insight into piperine biosynthesis[J]. Nat Commun, 2019, 10: 4702. |
| [92] |
Sánchez-Pérez R, Pavan S, Mazzeo R, et al. Mutation of a bHLH transcription factor allowed almond domestication[J]. Science, 2019, 364: 1095-1098. |
| [93] |
Pu X, Li Z, Tian Y, et al. The honeysuckle genome provides insight into the molecular mechanism of carotenoid metabolism underlying dynamic flower coloration[J]. New Phytol, 2020, 227: 930-943. |
| [94] |
Albert VA, Renner T. Aquatic angiosperm ambiguities answered[J]. Nat Plants, 2020, 6: 181-183. |
| [95] |
Zhang L, Chen F, Zhang X, et al. The water lily genome and the early evolution of flowering plants[J]. Nature, 2020, 577: 79-84. |
| [96] |
Xu Z, Pu X, Gao R, et al. Tandem gene duplications drive divergent evolution of caffeine and crocin biosynthetic pathways in plants[J]. BMC Biol, 2020, 18: 63. |
| [97] |
Luo X, Reiter MA, Espaux LD, et al. Complete biosynthesis of cannabinoids and their unnatural analogues in yeast[J]. Nature, 2019, 567: 123-126. |
| [98] |
Liu X, Cheng J, Zhang G, et al. Engineering yeast for the production of breviscapine by genomic analysis and synthetic biology approaches[J]. Nat Commun, 2018, 9: 1-10. |
| [99] |
Wei W, Wang P, Wei Y, et al. Characterization of Panax ginseng UDP-glycosyltransferases catalyzing protopanaxatriol and biosyntheses of bioactive ginsenosides F1 and Rh1 in metabolically engineered yeasts[J]. Mol Plant, 2015, 8: 1412-1424. |
| [100] |
Wang P, Wei Y, Fan Y, et al. Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts[J]. Metab Eng, 2015, 29: 97-105. |
| [101] |
Zhuang Y, Yang G, Chen X, et al. Biosynthesis of plant-derived ginsenoside Rh2 in yeast via repurposing a key promiscuous microbial enzyme[J]. Metab Eng, 2017, 42: 25-32. |
| [102] |
Wang P, Wei W, Ye W, et al. Synthesizing ginsenoside Rh2 in Saccharomyces cerevisiae cell factory at high-efficiency[J]. Cell Discov, 2019, 5: 5. |
| [103] |
Wang D, Wang J, Shi Y, et al. Elucidation of the complete biosynthetic pathway of the main triterpene glycosylation products of Panax notoginseng using a synthetic biology platform[J]. Metab Eng, 2020, 61: 131-140. |
| [104] |
Li J, Mutanda I, Wang K, et al. Chloroplastic metabolic engineering coupled with isoprenoid pool enhancement for committed taxanes biosynthesis in Nicotiana benthamiana[J]. Nat Commun, 2019, 10: 4850. |
| [105] |
Royer J, Shanklin J, Balch-Kenney N, et al. Rhodoxanthin synthase from honeysuckle; a membrane diiron enzyme catalyzes the multistep conversion of β-carotene to rhodoxanthin[J]. Sci Adv, 2020, 6: eaay9226. |
| [106] |
Oyarce P, De Meester B, Fonseca F, et al. Introducing curcumin biosynthesis in Arabidopsis enhances lignocellulosic biomass processing[J]. Nat Plants, 2019, 5: 225-237. |
| [107] |
Zhang Y, Li Y, Wang Y, et al. Identification and characterization of N9-methyltransferase involved in converting caffeine into non-stimulatory theacrine in tea[J]. Nat Commun, 2020, 11: 1473. |
| [108] |
Wang Z, Wang S, Xu Z, et al. Highly promiscuous flavonoid 3-O-glycosyltransferase from Scutellaria baicalensis[J]. Org Lett, 2019, 21: 2241-2245. |
| [109] |
He J, Zhao P, Hu Z, et al. Molecular characterization and structural basis of a promiscuous C-glycosyltransferase from Trollius chinensis[J]. Angew Chem Int Ed, 2019, 58: 11513-11520. |
| [110] |
He J, Chen K, Hu Z, et al. UGT73F17, a new glycosyltransferase from Glycyrrhiza uralensis, catalyzes the regiospecific glycosylation of pentacyclic triterpenoids[J]. Chem Commun, 2018, 54: 8594-8597. |
| [111] |
Zhang M, Li F, Li K, et al. Functional characterization and structural basis of an efficient di-C-glycosyltransferase from Glycyrrhiza glabra[J]. J Am Chem Soc, 2020, 142: 3506-3512. |
| [112] |
Gao L, Su C, Du X, et al. FAD-dependent enzyme-catalysed intermolecular[J]. Nat Chem, 2020, 12: 620-628. |
| [113] |
Chen R, Gao B, Liu X, et al. Molecular insights into the enzyme promiscuity of an aromatic prenyltransferase[J]. Nat Chem Biol, 2017, 13: 226-234. |
| [114] |
Zhang B, Wang KB, Wang W, et al. Enzyme-catalysed[J]. Nature, 2019, 568: 122-126. |
| [115] |
Chen D, Chen R, Wang R, et al. Probing the catalytic promiscuity of a regio-and stereospecific C-glycosyltransferase from Mangifera indica[J]. Angew Chem Int Ed, 2015, 54: 12678-12682. |
| [116] |
Zhou J, Yang L, Wang C, et al. Enhanced performance of the methylerythritol phosphate pathway by manipulation of redox reactions relevant to IspC, IspG, and IspH[J]. J Biotechnol, 2017, 248: 1-8. |
| [117] |
Sun L, Liu G, Li Y, et al. Metabolic engineering of Saccharomyces cerevisiae for efficient production of endocrocin and emodin[J]. Metab Eng, 2019, 54: 212-221. |
| [118] |
Zhu M, Wang C, Sun W, et al. Boosting 11-oxo-β-amyrin and glycyrrhetinic acid synthesis in Saccharomyces cerevisiae via pairing novel oxidation and reduction system from legume plants[J]. Metab Eng, 2018, 45: 43-50. |
| [119] |
Li Q, Fan F, Gao X, et al. Balanced activation of IspG and IspH to eliminate MEP intermediate accumulation and improve isoprenoids production in Escherichia coli[J]. Metab Eng, 2017, 44: 13-21. |
| [120] |
Qu Y, Easson ML, Froese J, et al. Completion of the seven-step pathway from tabersonine to the anticancer drug precursor vindoline and its assembly in yeast[J]. Proc Natl Acad Sci U S A, 2015, 112: 6224-6229. |
| [121] |
Brown S, Clastre M, Courdavault V, et al. De novo production of the plant-derived alkaloid strictosidine in yeast[J]. Proc Natl Acad Sci U S A, 2015, 112: 3205-3210. |
| [122] |
Bai YF, Yin H, Bi HP, et al. De novo biosynthesis of gastrodin in Escherichia coli[J]. Metab Eng, 2016, 35: 138-147. |
| [123] |
Li J, Tian C, Xia Y, et al. Production of plant-specific flavones baicalein and scutellarein in an engineered E. coli from available phenylalanine and tyrosine[J]. Metab Eng, 2019, 52: 124-133. |
| [124] |
Whitaker WB, Jones JA, Bennett RK, et al. Engineering the biological conversion of methanol to specialty chemicals in Escherichia coli[J]. Metab Eng, 2017, 39: 49-59. |
| [125] |
Laverty KU, Stout JM, Sullivan MJ, et al. A physical and genetic map of Cannabis sativa identifies extensive rearrangements at the THC/CBD acid synthase loci[J]. Genome Res, 2019, 29: 146-156. |
| [126] |
Ma Y, Xu D, Li L, et al. Jasmonate promotes artemisinin biosynthesis by activating the TCP14-ORA complex in Artemisia annua[J]. Sci Adv, 2018, 4: s9357. |
| [127] |
Shi R, Hu Z, Lu H, et al. Hierarchical nanostructuring array enhances mid-hybridization for accurate herbal identification via ITS2 DNA barcode[J]. Anal Chem, 2020, 92: 2136-2144. |
| [128] |
Feng L, Ruhsam M, Wang Y, et al. Using demographic model selection to untangle allopatric divergence and diversification mechanisms in the Rheum palmatum complex in the Eastern Asiatic Region[J]. Mol Ecol, 2020, 29: 1791-1805. |
| [129] |
Zheng J, Wu M, Wang H, et al. Network pharmacology to unveil the biological basis of health-strengthening herbal medicine in cancer treatment[J]. Cancers, 2018, 10: 461. |
| [130] |
Guo Y, Bao C, Ma D, et al. Network-based combinatorial CRISPR-Cas9 screens identify synergistic modules in human cells[J]. ACS Synth Biol, 2019, 8: 482-490. |
| [131] |
Dai Z, Ge G, Feng L, et al. A highly selective ratiometric two-photon fluorescent probe for human cytochrome P4501A[J]. J Am Chem Soc, 2015, 137: 14488-14495. |
| [132] |
Dai Z, Feng L, Jin Q, et al. A practical strategy to design and develop an isoform-specific fluorescent probe for a target enzyme:CYP1A1 as a case study[J]. Chem Sci, 2017, 8: 2795-2803. |
| [133] |
Lv X, Ge G, Feng L, et al. An optimized ratiometric fluorescent probe for sensing human UDP-glucuronosyltransferase 1A1 and its biological applications[J]. Biosens Bioelectron, 2015, 72: 261-267. |
| [134] |
Lv X, Feng L, Ai C, et al. A practical and high-affinity fluorescent probe for uridine diphosphate glucuronosyltransferase ∣A∣:a good surrogate for bilirubin[J]. J Med Chem, 2017, 60: 9664-9675. |
| [135] |
Zou L, Wang P, Qian X, et al. A highly specific ratiometric two-photon fluorescent probe to detect dipeptidyl peptidase IV in plasma and living systems[J]. Biosens Bioelectron, 2017, 90: 283-289. |
| [136] |
Jin Q, Feng L, Wang D, et al. A highly selective near-infrared fluorescent probe for carboxylesterase 2 and its bioimaging applications in living cells and animals[J]. Biosens Bioelectron, 2016, 83: 193-199. |
| [137] |
Jin Q, Feng L, Wang D, et al. A two-photon ratiometric fluorescent probe for imaging carboxylesterase 2 in living cells and tissues[J]. ACS Appl Mater Inter, 2015, 7: 28474-28481. |
| [138] |
Wang D, Jin Q, Zou L, et al. A bioluminescent sensor for highly selective and sensitive detection of human carboxylesterase 1 in complex biological samples[J]. Chem Commun, 2016, 52: 3183-3186. |
| [139] |
Tian Z, Ding L, Li K, et al. Rational design of a long-wavelength fluorescent probe for highly selective sensing of carboxylesterase 1 in living systems[J]. Anal Chem, 2019, 91: 5638-5645. |
| [140] |
Wu J, Cao Y, Feng L, et al. A naturally occurring isoform-specific probe for highly selective and sensitive detection of human cytochrome P4503A5[J]. J Med Chem, 2017, 60: 3804-3813. |
| [141] |
Ding L, Tian Z, Hou J, et al. Sensing carboxylesterase 1 in living systems by a practical and isoform-specific fluorescent probe[J]. Chin Chem Lett, 2019, 30: 558-562. |
| [142] |
Wang X, Lv X, Li S, et al. Identification and characterization of naturally occurring inhibitors against UDP-glucuronosyltransferase 1A1 in Fructus Psoraleae (Bu-gu-zhi)[J]. Toxicol Appl Pharm, 2015, 289: 70-78. |
| [143] |
Liu Y, Li S, Hou J, et al. Identification and characterization of naturally occurring inhibitors against human carboxylesterase 2 in white mulberry root-bark[J]. Fitoterapia, 2016, 115: 57-63. |
| [144] |
Liu J, Cai Q, Wang W, et al. Ginsenoside Rh2 pretreatment and withdrawal reactivated the pentose phosphate pathway to ameliorate intracellular redox disturbance and promoted intratumoral penetration of adriamycin[J]. Redox Biol, 2020, 32: 101452. |
| [145] |
Zhou F, Hao G, Zhang J, et al. Protective effect of 23-hydroxy-betulinic acid on doxorubicin-induced cardiotoxicity:a correlation with the inhibition of carbonyl reductase-mediated metabolism[J]. Brit J Pharmacol, 2015, 172: 5690-5703. |
| [146] |
Wang X, Ren J, Zhang A, et al. Novel applications of mass spectrometry-based metabolomics in herbal medicines and its active ingredients:current evidence[J]. Mass Spectrom Rev, 2019, 38: 380-402. |
| [147] |
Xu D, Lv Y, Wang J, et al. Deciphering the mechanism of Huang-Lian-Jie-Du-Decoction on the treatment of sepsis by formula decomposition and metabolomics:enhancement of cholinergic pathways and inhibition of HMGB-1/TLR4/NF-κB signaling[J]. Pharmacol Res, 2017, 121: 94-113. |
| [148] |
Yang M, Zhou Z, Guo D. A strategy for fast screening and identification of sulfur derivatives in medicinal Pueraria species based on the fine isotopic pattern filtering method using ultra-high-resolution mass spectrometry[J]. Anal Chim Acta, 2015, 894: 44-53. |
| [149] |
Li C, Rao T, Chen X, et al. HLA-B*35:01 allele is a potential biomarker for predicting polygonum multiflorum-induced liver injury in humans[J]. Hepatology, 2019, 70: 346-357. |
| [150] |
Lu Z, Luo Q, Zhao L, et al. The mutational features of aristolochic acid-induced mouse and human liver cancers[J]. Hepatology, 2020, 71: 929-942. |
| [151] |
Zhang Y, ShiYang X, Zhang Y, et al. Exposure to aristolochic acid I compromises the maturational competency of porcine oocytes via oxidative stress-induced DNA damage[J]. Aging, 2019, 11: 2241-2252. |
| [152] |
Abba M, Patil N, Leupold JH, et al. Prevention of carcinogenesis and metastasis by artemisinin-type drugs[J]. Cancer Lett, 2018, 429: 11-18. |
| [153] |
Wong YK, Xu C, Kalesh KA, et al. Artemisinin as an anticancer drug:recent advances in target profiling and mechanisms of action[J]. Med Res Rev, 2017, 37: 1492-1517. |
| [154] |
Li X, Zhou Y, Liu Y, et al. Preclinical efficacy and safety assessment of artemisinin-chemotherapeutic agent conjugates for ovarian cancer[J]. Ebiomedicine, 2016, 14: 44-54. |
| [155] |
Li Z, Shi X, Liu J, et al. Artesunate prevents type 1 diabetes in NOD mice mainly by inducing protective IL-4-producing T cells and regulatory T cells[J]. FASEB J, 2019, 33: 8241-8248. |
| [156] |
Wang X, Sun G, Feng T, et al. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer's disease progression[J]. Cell Res, 2019, 29: 787-803. |
| [157] |
Liao L, Song X, Wang L, et al. Highly selective inhibition of IMPDH2 provides the basis of antineuroinflammation therapy[J]. Proc Natl Acad Sci U S A, 2017, 114: 201706778. |
| [158] |
Feng J, Xu M, Wang J, et al. Sequential delivery of nanoformulated α-mangostin and triptolide overcomes permeation obstacles and improves therapeutic effects in pancreatic cancer[J]. Biomaterials, 2020, 241: 119907. |
| [159] |
Yu D, Liu Y, Zhou Y, et al. Triptolide suppresses IDH1-mutated malignancy via Nrf2-driven glutathione metabolism[J]. Proc Natl Acad Sci U S A, 2020, 117: 9964-9972. |
| [160] |
Zhang Y, Shen Y, Liao M, et al. Galactosylated chitosan triptolide nanoparticles for overcoming hepatocellular carcinoma:enhanced therapeutic efficacy, low toxicity, and validated network regulatory mechanisms[J]. Nanomedicine, 2019, 15: 86-97. |
| [161] |
Chen J, Qiao Y, Tang B, et al. Modulation of salmonella tumor-colonization and intratumoral anti-angiogenesis by triptolide and its mechanism[J]. Theranostics, 2017, 7: 2250-2260. |
| [162] |
Huang Y, Zhang Q, Zhang J, et al. Triptolide up-regulates metabotropic glutamate receptor 5 to inhibit microglia activation in the lipopolysaccharide-induced model of Parkinson's disease[J]. Brain Behav Immun, 2018, 71: 93-107. |
| [163] |
Hu X, Dong Y, Jin X, et al. The novel and potent anti-depressive action of triptolide and its influences on hippocampal neuroinflammation in a rat model of depression comorbidity of chronic pain[J]. Brain Behav Immun, 2017, 64: 180-194. |
| [164] |
Hu M, Luo Q, Alitongbieke G, et al. Celastrol-induced Nur77 interaction with TRAF2 alleviates inflammation by promoting mitochondrial ubiquitination and autophagy[J]. Mol Cell, 2017, 66: 141-153. |
| [165] |
Chen Y, Gao Q, Zou T, et al. Berberine versus placebo for the prevention of recurrence of colorectal adenoma:a multicentre, double-blinded, randomised controlled study[J]. Lancet Gastroenterol Hepatol, 2020, 5: 267-275. |
| [166] |
Guo H, Feng C, Zhang W, et al. Liver-target nanotechnology facilitates berberine to ameliorate cardio-metabolic diseases[J]. Nat Commun, 2019, 10: 1981. |
| [167] |
Thiele EA, Marsh ED, French JA, et al. Cannabidiol in patients with seizures associated with Lennox-Gastaut syndrome (GWPCARE4):a randomised, double-blind, placebo-controlled phase 3 trial[J]. Lancet, 2018, 391: 1085-1096. |
| [168] |
Guo Q, Li W, Wang C, et al. Biomolecular network-based synergistic drug combination discovery:a combination of paeoniflorin and liquiritin alleviates neuropathic pain by inhibiting neuroinflammation via suppressing the chemokine signaling pathway[J]. Signal Transduct Target Ther, 2020, 5: 73. |
| [169] |
Zhang C, Liu Z, Zheng Y, et al. Glycyrrhetinic acid functionalized graphene oxide for mitochondria targeting and cancer treatment in vivo[J]. Small, 2018, 14: 1703306. |
| [170] |
Sarikaya M, Tamerler C, Jen AKY, et al. Molecular biomimetics:nanotechnology through biology[J]. Nat Mater, 2003, 2: 577-585. |
| [171] |
Hu C, Fang R, Wang K, et al. Nanoparticle biointerfacing by platelet membrane cloaking[J]. Nature, 2015, 526: 118-121. |
| [172] |
Sun H, Su J, Meng Q, et al. Cancer-cell-biomimetic nanoparticles for targeted therapy of homotypic tumors[J]. Adv Mater, 2016, 28: 9581-9588. |
| [173] |
Xue J, Zhao Z, Zhang L, et al. Neutrophil-mediated anticancer drug delivery for suppression of postoperative malignant glioma recurrence[J]. Nat Nanotechnol, 2017, 12: 692-700. |
| [174] |
Guo S, Vieweger M, Zhang K, et al. Ultra-thermostable RNA nanoparticles for solubilizing and high-yield loading of paclitaxel for breast cancer therapy[J]. Nat Commun, 2020, 11: 972. |
| [175] |
Shitara K, Takashima A, Fujitani K, et al. Nab-paclitaxel versus solvent-based paclitaxel in patients with previously treated advanced gastric cancer (ABSOLUTE):an open-label, randomised, non-inferiority, phase 3 trial[J]. Lancet Gastroenterol Hepatol, 2017, 2: 277-287. |
| [176] |
Untch M, Jackisch C, Schneeweiss A, et al. NAB-paclitaxel improves disease-free survival in early breast cancer:GBG 69-GeparSepto[J]. J Clin Oncol, 2019, 37: 2226-2234. |
| [177] |
Sindhwani S, Syed AM, Ngai J, et al. The entry of nanoparticles into solid tumours[J]. Nat Mater, 2020, 19: 566-575. |
| [178] |
Clark AJ, Wiley DT, Zuckerman JE, et al. CRLX101 nanoparticles localize in human tumors and not in adjacent, nonneoplastic tissue after intravenous dosing[J]. Proc Natl Acad Sci U S A, 2016, 113: 3850-3854. |
| [179] |
Zheng D, Dong X, Pan P, et al. Phage-guided modulation of the gut microbiota of mouse models of colorectal cancer augments their responses to chemotherapy[J]. Nat Biomed Eng, 2019, 3: 717-728. |
| [180] |
Liang X, Gao C, Cui L, et al. Self-assembly of an amphiphilic janus camptothecin-floxuridine conjugate into liposome-like nanocapsules for more efficacious combination chemotherapy in cancer[J]. Adv Mater, 2017, 29: 1703135. |
| [181] |
Wang S, Wang Z, Yu G, et al. Tumor-specific drug release and reactive oxygen species generation for cancer chemo/chemodynamic combination therapy[J]. Adv Sci, 2019, 6: 1801986. |
| [182] |
Piao X, Yin H, Guo S, et al. RNA nanotechnology to solubilize hydrophobic antitumor drug for targeted delivery[J]. Adv Sci, 2019, 6: 1900951. |
| [183] |
Cong Z, Zhang L, Ma S, et al. Size-transformable hyaluronan stacked self-assembling peptide nanoparticles for improved transcellular tumor penetration and photo-chemo combination therapy[J]. ACS Nano, 2020, 14: 1958-1970. |
| [184] |
Zhang J, Guo Y, Ding F, et al. A camptothecin-grafted DNA tetrahedron as a precise nanomedicine to inhibit tumor growth[J]. Angew Chem Int Ed, 2019, 58: 13794-13798. |
| [185] |
Wang J, Mao W, Lock LL, et al. The role of micelle size in tumor accumulation, penetration, and treatment[J]. ACS Nano, 2015, 9: 7195-7206. |
| [186] |
Cabral H, Matsumoto Y, Mizuno K, et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size[J]. Nat Nanotechnol, 2011, 6: 815-823. |
| [187] |
Zhou Q, Shao S, Wang J, et al. Enzyme-activatable polymer-drug conjugate augments tumour penetration and treatment efficacy[J]. Nat Nanotechnol, 2019, 14: 799-809. |
| [188] |
Li T, Wang P, Guo W, et al. Natural berberine-based chinese herb medicine assembled nanostructures with modified antibacterial application[J]. ACS Nano, 2019, 13: 6770-6781. |
| [189] |
Kong C, Li Y, Liu Z, et al. Targeting the oncogene KRAS mutant pancreatic cancer by synergistic blocking of lysosomal acidification and rapid drug release[J]. ACS Nano, 2019, 13: 4049-4063. |
| [190] |
Hu K, Miao L, Goodwin TJ, et al. Quercetin remodels the tumor microenvironment to improve the permeation, retention, and antitumor effects of nanoparticles[J]. ACS Nano, 2017, 11: 4916-4925. |
| [191] |
Chuang EY, Lin K, Huang TY, et al. An intestinal "transformers" -like nanocarrier system for enhancing the oral bioavailability of poorly water-soluble drugs[J]. ACS Nano, 2018, 12: 6389-6397. |
| [192] |
Lu Y, Guo Z, Zhang Y, et al. Microenvironment remodeling micelles for alzheimer's disease therapy by early modulation of activated microglia[J]. Adv Sci, 2018, 6: 1801586. |
| [193] |
Chung CH, Jung W, Keum H, et al. Nanoparticles derived from the natural antioxidant rosmarinic acid ameliorate acute inflammatory bowel disease[J]. ACS Nano, 2020, 14: 6887-6896. |
| [194] |
Riva N, Mora G, Sorarù G, et al. Safety and efficacy of nabiximols on spasticity symptoms in patients with motor neuron disease (CANALS):a multicentre, double-blind, randomised, placebo-controlled, phase 2 trial[J]. Lancet Neurol, 2019, 18: 155-164. |
| [195] |
Mao X, Li W, Chen W, et al. Exploring and characterizing a novel combination of paeoniflorin and talatizidine for the treatment of rheumatoid arthritis[J]. Pharmacol Res, 2020, 153: 104658. |
| [196] |
Bargh JD, Isidrollobet A, Parker JS, et al. Cleavable linkers in antibody-drug conjugates[J]. Chem Soc Rev, 2019, 48: 4361-4374. |
| [197] |
Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of antibody-drug conjugates[J]. Nat Rev Drug Discov, 2017, 16: 315-337. |
| [198] |
Bardia A, Mayer IA, Diamond JR, et al. Efficacy and safety of anti-trop-2 antibody drug conjugate sacituzumab govitecan (IMMU-132) in heavily pretreated patients with metastatic triple-negative breast cancer[J]. J Clin Oncol, 2017, 35: 2141-2148. |
| [199] |
Thomas A, Teicher BA, Hassan R. Antibody-drug conjugates for cancer therapy[J]. Lancet Oncol, 2016, 17: e254-e262. |
| [200] |
Chau CH, Steeg PS, Figg WD. Antibody-drug conjugates for cancer[J]. Lancet, 2019, 394: 793-804. |
 2020, Vol. 55
2020, Vol. 55


