2. 沃特世科技有限公司, 上海 201206
2. Waters Corporation, Shanghai 201206, China
聚氧乙烯35蓖麻油(polyoxyethylene 35 castor oil, CrEL)是一种非离子型表面活性剂, 常作为口服、眼部和注射制剂的乳化剂或增溶剂, 尤其在注射剂和大输液中, 单位剂量中的最大用量可达到50%以上, 属于高风险性药用辅料[1]。根据《中国药典》2015年版四部[2], CrEL系聚氧乙烯甘油三蓖麻酸酯(polyoxyethylene glycerol tri-ricinoleate, PGTri-蓖麻油酸酯), 起始物料为甘油、环氧乙烷和蓖麻油[3], 合成工艺见图 1。事实上因原料蓖麻油脂肪酸组成多样[4]、环氧乙烷聚合度的差异和酯化程度的不同, CrEL实际是复杂的混合物, 其组成复杂, 存在结构相似和异构体, 致使分离分析困难, 缺乏快速有效的测定手段。
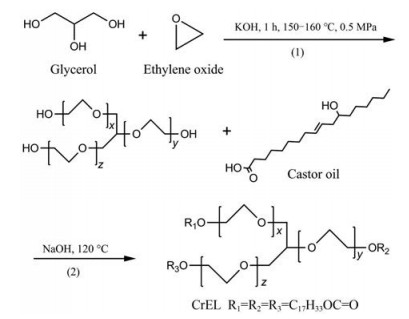
|
Figure 1 Manufacturing process of polyoxyethylene 35 castor oil (CrEL) |
有人用高效液相色谱法测定血液中CrEL和CrEL中聚乙二醇(PEG)、蓖麻油酸的含量[5-8]; 还有研究者通过反相制备型液相色谱分离CrEL得到17个混合馏分, 用于探究各馏分与逆转多药耐药、氨基酸转运和细胞毒性的相关性[9]; 也有用胶束电动毛细管色谱-间接紫外检测器法对其进行分离, 再通过延时萃取基质辅助激光解吸电离串联飞行时间质谱法(DE-MALDI-TOF-MS)进行定性分析[10]。人们在上述研究中获取许多对CrEL的认知, 然而还是因各种方法自身的局限, 如前处理复杂、成本高、耗时长等, 无法对CrEL成分进行快速分离和准确分析。
超高效合相色谱(ultraperformance convergence chromatography, UPCC)是建立在成熟的超高效液相色谱(UPLC)之上, 以绿色经济的超临界流体CO2作为主要流动相的超临界流体色谱(SFC), 它兼具气相色谱和超高效液相色谱的特点, 与四级杆飞行时间质谱(Q-TOF-MS)等高分辨质谱串联后, 大大提高检测灵敏度, 同时扩大了分析研究的范围。与常规反相超高效液相法相比, UPCC法具有选择性更高、柱效更优、洗脱程序更佳且分析速度更快的优点, 更适用于疏水性较强的物质[11, 12], 还可与Progenesis QI分析软件联用, 通过正交偏最小二乘判别法(OPLS-DA)快速评价不同来源产品的质量[13]。因此, 本实验建立UPCC-Q-TOF-MS法分析CrEL成分。
CrEL在临床应用中出现了较多不良反应, 如细胞毒性、急性超敏反应、神经毒性、溶血等[8, 14-17], 这些毒性的产生与哪些成分相关的深层次研究相对较少。而注射用CrEL引起的过敏反应现已证实属于由补体激活所引起的急性超敏反应[18], 且与自身成分有关, 主要是乙氧基化和酯化的不饱和脂肪酸或羟化脂肪酸[19]。为了初步探究CrEL产品的安全性, 本研究选用L-02细胞为模型考察其体外细胞毒性; 采用RBL-2H3细胞作为肥大细胞模型细胞, β-氨基己糖苷酶作为组胺的体外评价指标, 以评价产品的细胞致敏性, 该方法成熟、简便经济、应用广泛且结果稳定性好[20, 21]。
材料与方法仪器与材料 Acquity超高效合相色谱仪和Vion IMS四级杆飞行时间质谱(美国沃特世科技有限公司); Forma371型CO2培养箱和Multifuge X3R离心机(美国赛默飞世尔科技公司); IX53倒置荧光显微镜(日本奥林巴斯); SpectraMax iD3多功能酶标仪(美国MD公司); Progenesis QI软件; SoftMax Pro软件; Origin Pro软件; CrEL (A、B、C、D、E、F、G、H 8个厂家, 共22批次, 平均相对分子质量为2 472);色谱纯甲醇、乙腈和甲酸铵(德国Merck公司); 二氧化碳(> 99.99%, 北京市北氧特种气体研究所有限公司); L-02细胞(中国医学科学院肿瘤细胞库); RBL-2H3细胞(北纳创联生物科技有限公司); 1640培养基、MEM (minimum essential medium)培养基、胎牛血清、双抗和0.25%胰蛋白酶-EDTA (美国Gibco公司); PBS (美国HyClone公司); MTS染色液(美国Progema公司); 改良Tyrode液(北京雷根生物技术有限公司, 批号: 0704A18); Compound48/80 (批号: 017M4089V)和对硝基苯基-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷(美国Sigma公司); TritonX-100 (美国Amresco公司); 柠檬酸钠、柠檬酸、碳酸氢钠、碳酸钠均购于国药集团化学试剂有限公司; 生理盐水注射液(石家庄四药有限公司); 细胞培养用96孔板(美国Corning公司)。
UPCC-Q-TOF-MS法确证CrEL成分结构
CrEL供试品溶液的配制 取CrEL样品适量, 精密称定, 用甲醇溶解, 制得浓度为0.5 mg·mL-1的供试品溶液。
色谱条件 色谱柱: Acquity UPCC Torus Diol (3.0 mm×100 mm, 1.7 μm, 130 A); 流动相: A: CO2, B:甲醇-乙腈(50:50), 梯度洗脱程序: 0~0.2 min, 94% A; 0.2~18 min, 94% A~75% A; 18~22 min, 75% A~55% A; 22~22.5 min, 55% A~94% A; 22.5~25 min, 94% A; 流速: 1.0 mL·min-1; 离子化试剂:甲醇+ 2.5 mmol·L-1甲酸铵; 离子化试剂流速: 0.2 mL·min-1, 柱温: 50 ℃; 背压: 2 000 psi (1 psi≈6.9 kPa)。
质谱条件 离子化方式: ESI; 离子极性: ES+; 毛细管电压: 1.5 kV; 离子源温度: 120 ℃; 采样锥电压: 40 V; 雾化气温度: 500 ℃; 雾化气流速: 900 L·h-1; 采集模式: MSE。
Progenesis QI数据处理 UPCC-Q-TOF-MSE采集样品中各成分的分子离子和碎片离子信息, 采用Progenesis QI软件进行结构确证, 导入质谱数据后, 选择参比样品(A1), 进行保留时间校准; 创建“汇总运行”, 涵盖所有样品中的化合物离子; 选择分析峰和加合离子(NH4+、Na+、H+)与电荷(1~3价)去卷积, 确定中性母离子; 最后使用MetaScope检索工具, 对CrEL成分进行鉴定。
L-02细胞毒性实验
样品储备液配制 分别称取CrEL样品适量, 用生理盐水注射液溶解, 制得浓度为10 000 μmol·L-1样品储备液。
细胞培养 L-02细胞培养于含10%胎牛血清的1640培养基, 将L-02细胞置于37 ℃、5% CO2、饱和湿度的CO2培养箱中无菌培养。细胞呈单层贴壁生长, 每2~3天传代一次, 传代时用0.25%胰蛋白酶-EDTA室温下消化2~3 min。
MTS实验 采用MTS法检测不同浓度的CrEL样品对L-02细胞的细胞毒性。取浓度为每毫升1×105个的L-02细胞悬液接种于96孔板, 每孔100 μL。24 h贴壁后, 弃去孔液, 加入不同浓度的样品溶液(由1640培养基稀释样品储备液制得), 每孔100 μL, 设置6个复孔。培养24 h后, 加MTS溶液20 μL, 继续培养3 h。选择490 nm作为检测波长, 650 nm作为参比波长, 测定各孔吸光度(A)值。用SoftMax Pro软件处理结果, 以浓度为横坐标, 吸光度为纵坐标绘制细胞抑制率曲线, 得到半最大效应浓度(EC50)。EC50值越大, 说明样品的体外细胞毒性越小。
RBL-2H3细胞致敏性实验
阳性对照溶液配制 称取Compound48/80适量, 用改良Tyrode液(137 mmol·L-1氯化钠, 2.7 mmol·L-1氯化钾, 5.6 mmol·L-1葡萄糖, 1.8 mmol·L-1氯化钙, 1 mmol·L-1氯化镁, 20 mmol·L-1 4-羟乙基哌嗪乙磺酸, 1 mg·mL-1牛血清白蛋白, pH 7.4)溶解, 制得浓度为2 mg·mL-1阳性对照溶液。
样品溶液配制 分别称取CrEL样品适量, 用改良Tyrode液溶解, 制得浓度为100 mg·mL-1、125 mg·mL-1和150 mg·mL-1样品溶液。
细胞培养 RBL-2H3细胞培养于含15%胎牛血清的MEM培养基, 将RBL-2H3细胞置于37 ℃、5% CO2、饱和湿度的CO2培养箱中无菌培养。细胞呈单层贴壁生长, 每2~3天传代一次, 传代时用0.25%胰蛋白酶-EDTA室温下消化2~3 min。
实验方法 取浓度为每毫升2×105个的RBL-2H3细胞悬液接种于96孔板, 每孔200 μL, 24 h贴壁后, 弃去孔液, 用改良Tyrode液洗2遍, 加入各种受试液: ①阴性对照组加入改良Tyrode液; ②阳性对照组加入阳性对照溶液; ③裂解组加改良Tyrode液; ④试验组加入各组样品溶液, 每孔200 μL, 设置3个复孔; 孵育1 h后, 置于冰上10 min终止反应。裂解组相应的复孔中加入40 μL 1.2% TritonX-100, 冰上裂解10 min, 获得细胞裂解液; 4 ℃、1 500 r·min-1离心5 min。分别取细胞上清50 μL或细胞裂解液60 μL, 转移至新96孔板, 在各组细胞上清液及阴性对照中加入1.2% TritonX-100溶液10 μL补齐体积至60 μL。各孔加入底物(5 mmol·L-1对硝基苯基-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷+ 0.1 mol·L-1柠檬酸钠缓冲液, pH 4.5) 60 μL; 孵育1 h后, 每孔加入终止液(100 mmol·L-1 Na2CO3、100 mmol·L-1 NaHCO3缓冲液, pH 10.7) 150 μL终止反应, 于405 nm处测定吸光度(A)值, 计算β-氨基己糖苷酶释放率(%), 见式(1)。释放率越高, 说明样品的组胺释放越大, 细胞致敏性越大。
| $ \beta \text { - 氨基己糖苷酶释放率 }(\%)=\frac{A_{\text {样品 }}-A_{\text {空白 }}}{A_{\text {裂解 }}-A_{\text {空白 }}} \times 100 \% $ | (1) |
Person相关性分析 采用Origin Pro软件分析CrEL中13类成分含量与其细胞毒性和组胺释放的Person相关性, *P < 0.05表示相关性良好。
结果 1 UPCC-Q-TOF-MS法测定CrEL各成分及建立主成分分析(PCA)模型本文中CrEL各成分形成了3种分子离子[M+NH4]+、[M+Na]+和[M+H]+, 以一价、二价和三价的[M+NH4]+的分子离子及对应的碎片离子数据为主, [M+Na]+和[M+H]+的分子离子及对应的碎片离子数据为辅, 利用Progenesis QI软件将其还原为中性质量, 排除共流出成分干扰。由于不同系列成分在各自保留时间范围且有规律, 质量误差小于百万分之五, 因此以保留时间和m/z作为定性评判标准, 根据原料和合成工艺整理所有系列成分的元素组成, 形成数据库, 通过元素组成与目标成分匹配进行结构确证。
1.1 CrEL成分表征UPCC-Q-TOF-MS分离CrEL峰强度(base peak intensity, BPI)色谱图见图 2, 分析结果表明CrEL含13类成分共255个化合物, 分别为PEG、乙氧基化甘油(PG)、聚氧乙烯甘油单蓖麻油酸酯(PGM-蓖麻油酸酯)、聚氧乙烯甘油二蓖麻油酸酯(PGD-蓖麻油酸酯)、PGTri-蓖麻油酸酯、聚氧乙烯甘油单亚油酸酯(PGM-亚油酸酯)、聚氧乙烯甘油单棕榈酸酯(PGM-棕榈酸酯)、聚氧乙烯蓖麻油酸酯(PM-蓖麻油酸酯)、聚氧乙烯花生酸酯(PM-花生酸酯)、聚氧乙烯油酸酯(PM-油酸酯)、聚氧乙烯亚油酸酯(PM-亚油酸酯)、聚氧乙烯二蓖麻油酸酯(PD-蓖麻油酸酯)和聚氧乙烯二软脂油酸酯(PD-软脂油酸酯) (表 1), 化学结构式见图 3, 其中定义成分PGTri-蓖麻油酸酯的典型质谱图见图 4。
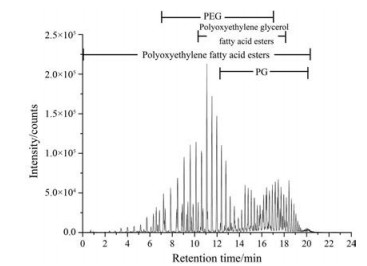
|
Figure 2 Base peak intensity chromatogram of CrEL |
| Table 1 Information of 13 kinds of components in CrEL |
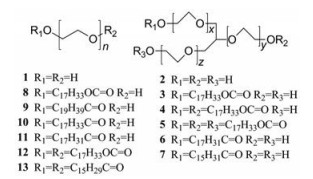
|
Figure 3 Chemical structures of 13 kinds of components in CrEL (n = x+y+z) |

|
Figure 4 MS spectra of PGTri-ricinoleate (n = 27, m/z = 1 078.812 7) |
根据每类成分的响应, 采用归一化法计算样品中13类成分的百分含量。结果显示, 所有样品中定义成分PGTri-蓖麻油酸酯的含量极低, 仅占0.36%~2.80%, 而PEG、PG、PGM-蓖麻油酸酯的含量相对较高, 都大于15%。按照化学结构式, 13类成分可被统分为4大类: PEG、PG、聚氧乙烯甘油脂肪酸酯和聚氧乙烯脂肪酸酯, 图 5可见A、B、C和D厂家样品的批间一致性较好, E厂家E4样品与其他5批样品有较大差异, A、E4和G厂家样品与其他厂家样品有明显差异: PEG和聚氧乙烯脂肪酸酯含量明显高于其他样品, 而PG和聚氧乙烯甘油脂肪酸酯含量明显低于其他样品。
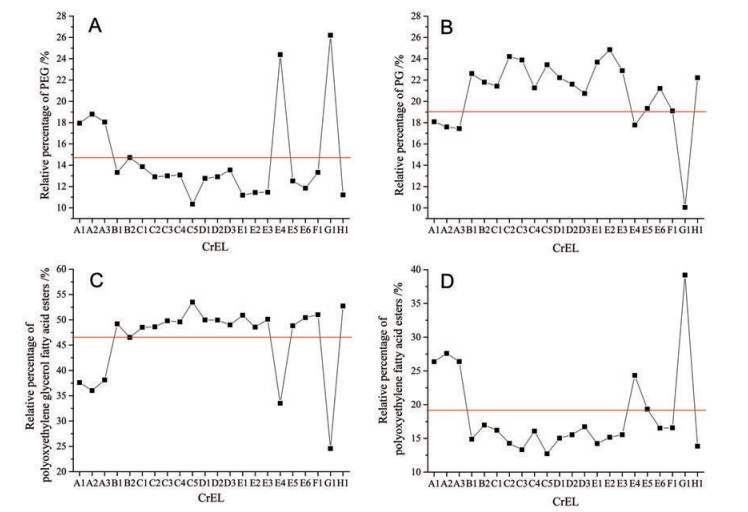
|
Figure 5 Relative percentage of components in CrEL samples. A: PEG; B: PG; C: Polyoxyethylene glycerol fatty acid esters; D: Polyoxyethylene fatty acid esters; A1-H1: CrEL samples |
基于UPCC-Q-TOF-MS给出的各企业不同批次所含组分的种类和含量, 采用Progenesis QI软件对所有样品建立PCA模型, 结果显示8个厂家的样品被分为5类, 分别为A、G、B/C/D/F/H、E (除E4)和E4。其中, D样品为纯化级样品, E样品为注射级样品。如果能够进一步扩大样本量, 获取的分类意义会更加突出, 有望对未知样品的质量属性进行快速评估, 并可对样品进行分级, 如注射级和非注射级。
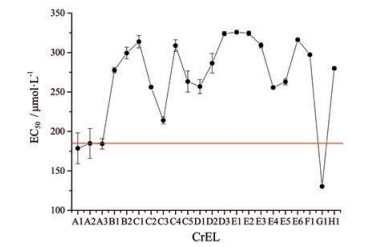
2 L-02细胞毒性EC50值图 6显示, 所有样品均有体外细胞毒性, 其中A和G厂家样品的体外细胞毒性明显高于其他厂家样品。
|
Figure 6 EC50 of CrEL samples by L-02 cell (n = 6, x ± s). A1-H1: CrEL samples |
选取低、中、高浓度(100、125和150 mg·mL-1)刺激RBL-2H3细胞, 测定并计算β-氨基己糖苷酶释放率(%)。结果显示, 3个浓度下所有样品均引起β-氨基己糖苷酶释放, 其中A和G厂家样品的释放率明显高于其他厂家样品(图 7)。

|
Figure 7 Release rate of β-hexosaminidase of CrEL samples by RBL-2H3 cell (n = 3, x ± s). A1-H1: CrEL samples |
Pearson相关性结果显示, CrEL的细胞毒性和组胺释放与PGTri-蓖麻油酸酯含量负相关(约-0.8*), 与聚氧乙烯脂肪酸酯含量正相关(约0.9*), 说明PGTri-蓖麻油酸酯含量越高, 聚乙二醇脂肪酸酯含量越低, CrEL的细胞毒性和组胺释放越小, 与文献[19]报道一致。其中, PM-蓖麻油酸酯(约0.8*)、PM-油酸酯(约0.8*)和PM-亚油酸酯(约0.9*)含量与CrEL的细胞毒性和组胺释放有关, 该结论仍需进一步的实验研究。
讨论CrEL的组成与其生产原料蓖麻油纯度有关, 因此, 脂肪酸组成检查是原料源头控制的重要指标; 作为高风险制剂(注射用、眼用)中使用的CrEL需要对其进行质量风险评估, 而现行的中国药典标准中并未设置此检查项, 建议增加该项对主要脂肪酸含量进行控制, 提高生产原料蓖麻油的纯度, 控制定义成分PGTri-蓖麻油酸酯和聚乙二醇脂肪酸酯的含量, 以减少产品带来的不良反应, 提高含CrEL制剂的临床用药安全性。
作者贡献:孙会敏、王珏、李婷构思和设计实验; 李婷、袁铭进行实验并收集数据; 王珏、李婷完成初稿; 孙会敏、王珏修改文章; 所有作者都对文章内容负有主要责任。
利益冲突:无任何利益冲突。
| [1] |
FDA. Inactive Ingredient Database[EB/OL]. US: FDA, 2020[2020-04-01]. https://www.accessdata.fda.gov/scripts/cder/iig/index.cfm?event=BasicSearch.page.
|
| [2] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 4. Beijing: China Medical Science Press, 2015: 629-630.
|
| [3] |
Wu ML, Fu X, Pan JJ, et al. Preparation of high purity glycerol polyoxyethylene ricinoleate: CN, 201610597608.6[P]. 2017-05-10.
|
| [4] |
Fan P. Separation and Purification of Biological Macromolecules from Castor Beans and Preparation of its Derivatives (蓖麻籽中生物大分子的分离纯化及其衍生物的制备)[D]. Wuhan: Huazhong University of Science and Technology, 2008.
|
| [5] |
Vijaya Bhaskar V, Middha A. Liquid chromatography/tandem mass spectrometry method for quantitation of Cremophor EL and its applications[J]. Int J Anal Chem, 2013, 2013: 1-11. |
| [6] |
Ghassempour A, Nabid MR, Talebi M, et al. Comparison of pyrolysis mass spectrometry with high performance liquid chromatography for the analysis of Cremophor EL in drugs and serum[J]. Talanta, 2003, 59: 435-441. DOI:10.1016/S0039-9140(02)00466-6 |
| [7] |
Sha M, Li HL, Zhou DM. Determination of polyethylene glycol in polyoxy (35) castor oil by HPLC[J]. Chem Ind Times (化工时刊), 2019, 33: 18-20. |
| [8] |
Gelderblom H, Verweij J, Nooter K, et al. Cremophor EL:the drawbacks and advantages of vehicle selection for drug formulation[J]. Eur J Cancer, 2001, 37: 1590-1598. DOI:10.1016/S0959-8049(01)00171-X |
| [9] |
Kessel D, Woodburn K, Decker D, et al. Fractionation of Cremophor EL delineates components responsible for plasma lipoprotein alterations and multidrug resistance reversal[J]. Oncol Res, 1995, 7: 207-212. |
| [10] |
Meyer TH, Waidelich D, Frahm AW. Polyoxyethylene-delta(9, 11)-didehydrostearate and glycerol-polyoxyethylene-delta (9, 11)-didehydrostearate:two new components of the non-ionic emulsifier Cremophor EL[J]. J Pharm Biomed Anal, 2002, 30: 263-271. DOI:10.1016/S0731-7085(02)00333-3 |
| [11] |
Quanson JL, Stander MA, Pretorius E, et al. High-throughput analysis of 19 endogenous androgenic steroids by ultra-performance convergence chromatography tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1031: 131-138. DOI:10.1016/j.jchromb.2016.07.024 |
| [12] |
Simeone JL, Rainville PD. Reducing phospholipids-based matrix interferences in bioanalytical studies using UPC2/MS/MS[EB/OL]. US: Waters Corporation, 2013[2020-04-01]. https://www.waters.com/webassets/cms/library/docs/720004707en.pdf.
|
| [13] |
Hou JJ, Cao CM, Xu YW, et al. Exploring lipid markers of the quality of coix seeds with different geographical origins using supercritical fluid chromatography mass spectrometry and chemometrics[J]. Phytomedicine, 2018, 45: 1-7. DOI:10.1016/j.phymed.2018.03.010 |
| [14] |
Yamaguchi JY, Nishimura Y, Kanada A, et al. Cremophor EL, a non-ionic surfactant, promotes Ca2+-dependent process of cell death in rat thymocytes[J]. Toxicology, 2005, 211: 179-186. DOI:10.1016/j.tox.2004.10.019 |
| [15] |
Kiss L, Walter FR, Bocsik A, et al. Kinetic analysis of the toxicity of pharmaceutical excipients Cremophor EL and RH40 on endothelial and epithelial cells[J]. J Pharm Sci, 2013, 102: 1173-1181. DOI:10.1002/jps.23458 |
| [16] |
Gao P, Tu JS. Use and safety of polyoxyethylene castor oil[J]. Pharm Clin Res (药学与临床研究), 2010, 18: 59-63. |
| [17] |
Zhang Y, Zhao H, Wang X, et al. Effects of Cremophor EL/ethanol/oleinic acid/water microemulsion on human blood components and coagulation function[J]. Colloids Surf B Biointerfaces, 2019, 180: 254-262. DOI:10.1016/j.colsurfb.2019.04.058 |
| [18] |
Weiszhár Z, Czúcz J, Révész C, et al. Complement activation by polyethoxylated pharmaceutical surfactants:Cremophor-EL, Tween-80 and Tween-20[J]. Eur J Pharm Sci, 2012, 45: 492-498. DOI:10.1016/j.ejps.2011.09.016 |
| [19] |
Lorenz W, Schmal A, Schult H, et al. Histamine release and hypotensive reactions in dogs by solubilizing agents and fatty acids:analysis of various components in cremophor El and development of a compound with reduced toxicity[J]. Agents Actions, 1982, 12: 64-80. DOI:10.1007/BF01965109 |
| [20] |
Zhao Y, Li Q, Zhang XY. Study progress of type I anaphylaxis reaction and anaphylactoid reaction on the basis of RBL-2H3 cell models[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2010, 15: 1310-1315. |
| [21] |
Guan CW, Jin J, Li J, et al. Study of degranulation induced by injective excipients in a rat mast (RBL-2H3) cell line[J]. J Toxicol (毒理学杂志), 2012, 26: 98-101. |
 2020, Vol. 55
2020, Vol. 55


