2. 沈阳药科大学基于靶点的药物设计与研究教育部重点实验室, 辽宁 沈阳 110016
2. Key Laboratory of Structure-Based Drugs Design and Discovery(Shenyang Pharmaceutical University), Ministry of Education, Shenyang 110016, China
蛋白质的磷酸化以及磷酸化后级联反应调控细胞内多种癌症相关的信号转导通路[1]。Pin1 (protein interaction with never in mitosis A1)是一种肽脯氨酰顺反异构酶, 能够特异性地识别并催化磷酸化的丝/苏-脯氨酸序列发生构象改变, 进而影响底物蛋白的稳定性和生理功能[2, 3]。Pin1蛋白是由人类19p13基因编码的核蛋白, 包含163个氨基酸残基, 组成两个高度保守的结构功能区: N端的色氨酸-色氨酸中心WW域, 主要负责识别特异性的底物肽段; C端的肽脯氨酰异构酶PPIase域, 是功能性催化活性中心[3]。Pin1在肿瘤细胞凋亡、细胞周期进程、细胞增殖和存活等许多生物学过程中都发挥着重要作用, 通过破坏癌基因和肿瘤抑制因子之间的平衡促进癌症的发生、发展和转移[4]。Pin1蛋白在前列腺癌、乳腺癌、肺癌等多种肿瘤组织中过度表达, 并且其表达量与癌症的恶性程度和患者不良预后相关, 是潜在的癌症治疗药物的作用靶标[5]。
国内外医药研发机构报道了不同结构类型的Pin1抑制剂(图 1), 但是截止到目前为止还没有推进临床研究的品种[4]。胡桃醌(juglone, 1)是通过高通量筛选发现的第一个次生代谢物Pin1抑制剂, 也是目前最常用的阳性对照药。作为一种天然萘醌类化合物, 其结构中的α, β-不饱和酮能够与PPIase域Cys113上的巯基发生Michael加成而发挥不可逆抑制活性[6]。表没食子儿茶素没食子酸酯(EGCG, 2)是绿茶中提取的一种天然活性成分, 具有茶多酚结构。共结晶结构显示, EGCG既可以与PPIase域结合降低Pin1的催化活性, 也可以作用于WW域阻碍Pin1对底物蛋白中pThr-Pro序列的识别[7]。全反式维甲酸(ATRA, 3)是基于作用机制的高通量筛选策略发现的Pin1小分子抑制剂, 能够与Pin1蛋白结合抑制其催化活性, 降低细胞内cyclin D1的表达, 并诱导Pin1蛋白的降解[8]。Pfizer制药和Vernalis公司采用基于PPIase活性口袋的结构特点进行片段生长, 并由此获得大量不同结构类型的高活性Pin1抑制剂, 然而大多数化合物并未表现出抗肿瘤细胞增殖活性。尽管随后采取多种策略来提高化合物在细胞水平的活性, 但都收效甚微[9, 10]。中国医学科学院药物研究所采用基于受体结构的合理药物设计思想发现了多个类型的Pin1抑制剂, 包括喹唑啉类、二苯甲酮类、噻唑烷类和嘧啶类衍生物等[11, 12]。近年来计算机辅助的虚拟筛选同样被广泛用于Pin1抑制剂的开发[13, 14]。KPT-6566 (4)和(S)-2 (5)是文献报道的两种新型不可逆Pin1抑制剂, 它们具有极强的Pin1抑制活性, 并明显下调cyclin D1的表达, KPT-6566还可以降低乳腺癌小鼠模型的肺转移[15, 16]。总体来说, 天然产物的生物活性显著但往往具有多种作用机制, 而多数Pin1小分子抑制剂在细胞水平活性较差[17]。
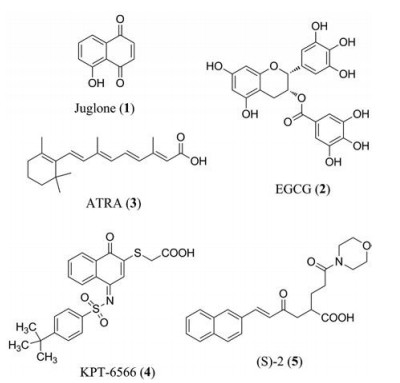
|
Figure 1 Chemical structures of reported Pin1 inhibitors |
Pin1蛋白C端PPIase域的催化活性中心包含两个疏水性区域和一个由碱性氨基酸组成的磷酸盐结合口袋。课题组前期研究发现苯并咪唑骨架能够精确地嵌合在Pin1蛋白脯氨酰结合口袋中[18]。为继续探索新型Pin1小分子抑制剂, 本研究将3-(1H-苯并咪唑-2-基)丙酸(14a)中C2位的丙酸片段替换为硫代乙酸, 以期其结构中的硫原子与催化域Cys113的巯基在空间上靠近, 保留末端的羧基使其恰好能够伸入磷酸盐结合口袋; 在N1位引入柔性脂溶性芳香片段以增强与疏水性浅表的相互作用; 在C5、C6位引入不同取代基以考察其对化合物活性的影响。基于以上思想设计合成一系列2-(1H-苯并咪唑-2-基硫)乙酸类衍生物(图 2), 并对其生物活性进行评价。
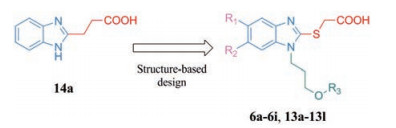
|
Figure 2 Design strategy of novel Pin1 inhibitors |
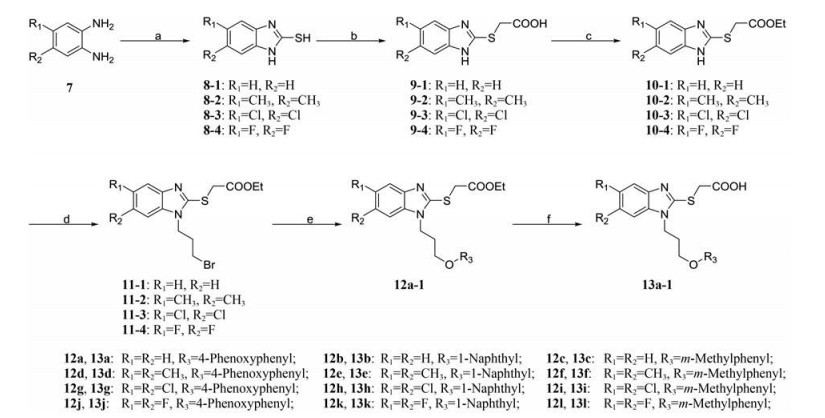
目标化合物6a~6i的制备方法如合成路线1所示。以不同取代的2-硝基苯胺为起始原料, 与1, 3-二溴丙烷在回流条件下反应得到中间体2-1/2/3, 再与不同取代的苯酚或萘酚反应得到中间体3a~3i, 经硝基还原制得中间体4a~4i。在碱性条件下, 4a~4i与二硫化碳环合得到中间体5a~5i, 然后与氯乙酸在乙醇溶液中发生亲核取代反应得到目标化合物6a~6i。

|
Scheme 1 Synthesis of 6a-6i. Reagents and conditions: (a) 1, 3-Dibromopropane, K2CO3, MeCN, 82 ℃, 4 h; (b) Substituted phenol or naphthol, K2CO3, acetone, 56 ℃, 4 h; (c) NH4Cl, Zn, EtOH/H2O, 95 ℃, 2 h; (d) CS2, KOH, EtOH/H2O, 50 ℃, 2 h; (e) Chloroacetic acid, NaOH, EtOH, 78 ℃, 6 h |
目标化合物13a~13l的制备方法如合成路线2所示。以不同取代的邻苯二胺为原料, 与二硫化碳环合得到中间体8-1/2/3/4, 再与氯乙酸反应得到中间体9-1/2/3/4。在浓硫酸条件下通过乙酯化保护羧基, 然后与1, 3-二溴丙烷反应得到中间体11-1/2/3/4, 再与不同取代的苯酚或萘酚反应得到中间体12a~12l。最后, 在碱性条件下脱保护基得到目标化合物13a~13l。
目标化合物的结构经1H NMR、13C NMR、ESI-MS和IR进行确证, 详细谱图数据见本文实验部分。
2 生物活性评价以胡桃醌为阳性对照药, 采用胰凝乳蛋白酶偶联法测定目标化合物对Pin1的抑制作用, 并采用MTT法考察6a~6i和13a~13l对Pin1高表达的人前列腺癌PC-3细胞的生长抑制活性。活性结果如表 1所示。
| Table 1 Structures and inhibitory activities of synthesized compounds towards Pin1 and PC-3 cell |
酶活性数据表明, 20个化合物的Pin1抑制作用明显优于阳性对照药胡桃醌(IC50 = 10.47 μmol·L-1)和先导化合物14a (23% @ 10 μmol·L-1), 其中活性最强的化合物6g、6h和13i的半数有效抑制浓度达到亚微摩尔水平。化合物13a (IC50 = 3.85 μmol·L-1)、13b (IC50 = 3.10 μmol·L-1)和13c (IC50 = 4.20 μmol·L-1)对Pin1的抑制作用相当, 说明在苯并咪唑N1位引入疏水性片段有利于活性提升, 且可以容忍芳香环结构的适当变化, 但随着C5、C6位取代基的不同其对活性的影响也会发生改变; 在苯并咪唑C5位取代的化合物6a~6i中, 引入氟原子的化合物6g (IC50 = 0.34 μmol·L-1)、6h (IC50 = 0.33 μmol·L-1)和6i (IC50 = 2.27 μmol·L-1)活性最佳, 而引入甲基或者氯原子的化合物6a~6c、6d~6f则活性相对较弱, 说明该位置取代基的微小变化可以显著影响化合物的活性; 在苯并咪唑C5、C6位同时取代的化合物13d~13l中, 化合物13g (IC50 = 2.28 μmol·L-1)、13h (IC50 = 1.08 μmol·L-1)和13i (IC50 = 0.47 μmol·L-1)的Pin1抑制活性分别是化合物13a~13c的1.5~6.6倍, 说明该位置同时引入氯原子能够不同程度地改善化合物的活性, 但由化合物13d~13f、13j~13l可以看出将氯原子双取代替换为甲基或者氟原子双取代则导致活性有所下降; 对比6a~6i和13d~13l的活性数据发现, C5位取代化合物的活性整体上优于C5、C6位同时取代的化合物。
|
Scheme 2 Synthesis of 13a-13l. Reagents and conditions: (a) CS2, KOH, EtOH/H2O, 50 ℃, 6 h; (b) Chloroacetic acid, NaOH, EtOH, 78 ℃, 5 h; (c) EtOH, H2SO4, 78 ℃, 5 h; (d) 1, 3-Dibromopropane, K2CO3, MeCN, 82 ℃, 4 h; (e) Substituted phenol or naphthol, K2CO3, acetone, 56 ℃, 4 h; (f) NaOH/H2O, 50 ℃, 3 h |
MTT实验结果显示, 目标化合物和许多文献中报道的Pin1小分子抑制剂面临同样的问题, 在细胞水平没有表现出令人满意的抗增殖活性。其中, 化合物6b、6e、6f、13e和13g具有中等强度的PC-3细胞生长抑制活性。综上所述, 虽然目标化合物的Pin1酶抑制活性明显优于阳性对照药, 但其体外抗增殖活性却相对较弱, 分析原因一方面可能是胡桃醌除了抑制Pin1酶之外还具有其他的作用机制, 另一方面该类化合物结构中的羧基可能会导致分子极性过大而难以进入细胞内。
3 分子对接将Pin1酶抑制活性较强的化合物6g进行分子模拟对接, 结果显示该化合物与Pin1蛋白(PDB: 3KAI)的配体分子具有相似的结合方式(图 3和表 2)。苯并咪唑骨架充分占据脯氨酰结合口袋:苯环部分与Phe134和Met130分别形成Pi–Pi T-shaped和Pi-Sulfur相互作用; C5位的氟原子与His157形成卤键; 咪唑环3位的氮原子作为氢键受体与Ser154形成一个关键性的氢键。C2位的硫代乙酸片段恰好位于碱性氨基酸富集区域, 其羧基不仅与介导磷酸结合的Lys63和Arg69形成盐桥作用, 还能够与Ser114形成氢键作用, 而C2位的硫原子和本课题组预期的一样在空间上靠近Cys113的巯基。此外, 化合物6g的N1位芳香环侧链与PPIase域开阔的浅表区形成疏水性相互作用, 增强了分子与受体蛋白的结合能力。
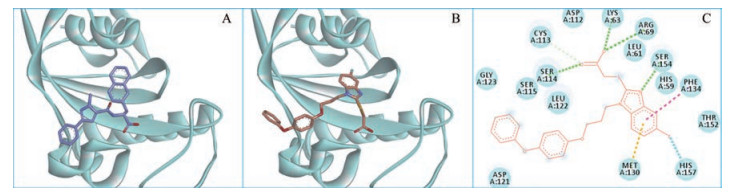
|
Figure 3 Co-crystal structure of 3KAI (A) and predicated binding mode of 6g (B, C) in PPIase domain of Pin1 |
| Table 2 Detailed docking data of representative compound 6g with Pin1 PPIase domain |
本文基于Pin1蛋白PPIase域催化口袋的结构特征, 以苯并咪唑为母核进行片段生长, 设计并合成一系列2-(1H-苯并咪唑-2-基硫)乙酸类衍生物, 均为未见文献报道的新化合物。生物活性评价结果显示大多数目标化合物具有较强的Pin1酶抑制活性, 部分化合物表现出一定的体外抗前列腺癌PC-3细胞增殖作用。化合物6g、6h和13i的Pin1抑制作用最强, 其IC50值分别为0.34、0.33和0.47 μmol·L-1, 是阳性对照药胡桃醌的22~31倍。构效关系分析和分子对接结果显示苯并咪唑N1位的疏水性侧链以及C2位的硫代乙酸片段为活性必需, 在C5、C6位引入合适的取代基有利于Pin1酶抑制活性提升。缺乏细胞水平活性仍然是当前开发Pin1小分子抑制剂所面临的难题, 本文发现一类具有新型结构骨架的强效小分子化合物, 值得进一步研究以提高其肿瘤细胞生长抑制活性。
实验部分熔点用X-4数字显微熔点仪测定, 温度未经校正。质谱用美国Waters公司ACQUITY Ultra Performance LCTM超高效液相色谱仪, 美国Waters公司Waters Quattro micro API三重四极杆串联质谱仪测定。1H NMR和13C NMR以二甲基亚砜(DMSO)-d6为溶剂, 四甲基硅烷(TMS)为内标, 用Bruker AVANCEⅢ (600 MHz和150 MHz)型核磁共振波谱仪测定。薄层色谱(TLC)采用青岛海洋化工生产的GF254硅胶板。所用试剂为市售分析纯或化学纯, 必要时根据需要进行纯化。
1 化合物的合成 1.1 目标化合物6a~6i的合成通法将不同取代的2-硝基苯胺(10 mmol)溶于40 mL干燥乙腈中, 加入碳酸钾(2.07 g, 15 mmol)。室温搅拌30 min, 缓慢滴加1, 3-二溴丙烷(3.5 mL, 30 mmol), 升温至82 ℃继续反应4 h, TLC监测。反应完成后减压浓缩, 加入适量水用乙酸乙酯萃取3次(20 mL×3), 合并有机层, 饱和NaCl溶液洗1次, 无水硫酸钠干燥。减压浓缩后柱色谱纯化得中间体2-1/2/3, 淡黄色固体, 收率60%~72%。
将不同取代的苯酚或萘酚(1.2 mmol)溶于25 mL干燥丙酮中, 加入碳酸钾(276 mg, 2 mmol)。室温搅拌30 min, 加入2-1/2/3 (1 mmol), 升温至56 ℃继续反应4 h, TLC监测。反应结束后减压浓缩, 加入适量水用乙酸乙酯萃取3次(15 mL×3), 合并有机层, 饱和NaCl溶液洗1次, 无水硫酸钠干燥。减压浓缩后柱色谱纯化得中间体3a~3i, 白色固体, 收率70%~83%。
将氯化铵(106 mg, 2 mmol)和锌粉(650 mg, 10 mmol)加入20 mL乙醇-水(2:1)混合溶剂中, 剧烈搅拌加热至95 ℃。加入3a~3i继续反应2 h, TLC监测。反应完成后, 用饱和碳酸氢钠调节pH至7~8, 二氯甲烷萃取3次(50 mL×3), 合并有机层, 饱和NaCl溶液洗1次, 无水硫酸钠干燥。减压浓缩得中间体4a~4i, 淡黄色固体, 无需纯化进行下一步反应。
将4a~4i (20 mmol)加入20 mL 95%乙醇溶液中, 室温搅拌下加入氢氧化钾(1.12 g, 20 mmol)和二硫化碳(12 mL, 200 mmol), 升温至50 ℃继续反应6 h, TLC监测。反应完成后冷却至室温, 缓慢倒入100 mL冰水中, 调节pH至7, 析出大量固体, 抽滤、水洗、干燥后得中间体5a~5i, 白色固体, 收率81%~90%。
将5a~5i (10 mmol)溶于20 mL乙醇中, 加入氢氧化钠(720 mg, 18 mmol), 回流反应1 h。冷却至室温后加入氯乙酸(950 mg, 10 mmol), 升温至78 ℃继续反应5 h, TLC监测。反应完成后冷却至室温, 缓慢倒入100 mL冰水中, 用2 mol·L-1盐酸调节pH至3~4, 析出大量固体, 抽滤干燥得目标化合物6a~6i。
2 -((5-甲基-1-(3-(4-苯氧基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(6a) 白色固体, 收率95%。mp: 68~70 ℃; IR (KBr) υ/cm-1: 3 427, 2 924, 1 609, 1 503, 872, 758; 1H NMR (DMSO-d6) δ 12.90 (s, 1H, -COOH), 7.34 (t, J = 7.8 Hz, 2H), 7.31 (d, J = 8.5 Hz, 2H), 7.06 (t, J = 7.3 Hz, 1H), 6.97 (d, J = 8.9 Hz, 2H), 6.94 (d, J = 3.4 Hz, 2H), 6.92 (d, J = 4.8 Hz, 2H), 6.90 (s, 1H), 4.29 (t, J = 6.8 Hz, 2H, CH2), 4.04 (s, 2H, CH2), 3.95 (t, J = 5.8 Hz, 2H, CH2), 2.36 (s, 3H, CH3), 2.20~2.12 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.8, 158.4, 155.0, 151.8, 149.8, 143.6, 134.6, 130.7, 130.2, 123.0, 122.9, 121.0, 117.8, 117.7, 116.2, 109.2, 65.2, 40.8, 37.0, 29.0, 21.5; ESI-MS m/z: 448.9 [M+H]+, 446.6 [M-H]-。
2 -((5-甲基-1-(3-(萘酚-1-基氧)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(6b) 白色固体, 收率93%。mp: 137~138 ℃; IR (KBr) υ/cm-1: 3 426, 2 984, 2 925, 2 854, 1 723, 1 598, 1 504, 789, 769; 1H NMR (DMSO-d6) δ 12.99 (s, 1H, -COOH), 8.20 (d, J = 7.7 Hz, 1H), 7.87 (d, J = 7.5 Hz, 1H), 7.57~7.48 (m, 2H), 7.47 (d, J = 8.0 Hz, 1H), 7.38 (t, J = 8.4 Hz, 2H), 7.33 (s, 1H), 6.90 (dd, J = 10.8, 7.7 Hz, 2H), 4.43 (t, J = 7.5, 2H, CH2), 4.20~4.11 (m, 4H, CH2), 2.36 (s, 3H, CH3), 2.34~2.28 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 170.0, 154.2, 150.7, 143.5, 134.7, 134.4, 131.0, 127.8, 126.8, 126.6, 125.7, 125.3, 123.3, 121.9, 120.4, 118.0, 109.3, 105.4, 65.1, 41.2, 34.6, 29.2, 21.5; ESI-MS m/z: 406.8 [M+H]+, 404.7 [M-H]-。
2 -((5-甲基-1-(3-(3-甲基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(6c) 白色固体, 收率93%。mp: 149~151 ℃; IR (KBr) υ/cm-1: 3 427, 2 921, 1 705, 1 601, 1 491, 897, 787, 689; 1H NMR (DMSO-d6) δ 12.87 (s, 1H, -COOH), 7.34 (d, J = 8.3 Hz, 1H), 7.32 (s, 1H), 7.14 (t, J = 7.7 Hz, 1H), 6.95 (d, J = 8.2 Hz, 1H), 6.74 (d, J = 7.5 Hz, 1H), 6.72~6.67 (m, 2H), 4.29 (t, J = 6.9 Hz, 2H, CH2), 4.13 (s, 2H, CH2), 3.94 (t, J = 5.9 Hz, 2H, CH2), 2.37 (s, 3H, CH3), 2.25 (s, 3H, CH3), 2.19~2.12 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 170.0, 158.6, 150.9, 143.5, 139.3, 134.7, 130.9, 129.6, 123.2, 121.8, 117.9, 115.6, 111.8, 109.4, 64.5, 40.9, 35.0, 29.0, 21.5; ESI-MS m/z: 368.6 [M-H]-。
2 -((5-氯-1-(3-(4-苯氧基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(6d) 白色固体, 收率96%。mp: 96~98 ℃; IR (KBr) υ/cm-1: 3 430, 2 984, 2 925, 2 853, 1 609, 1 504, 843; 1H NMR (DMSO-d6) δ 12.95 (s, 1H, -COOH), 7.56 (s, 1H), 7.48 (d, J = 8.5 Hz, 1H), 7.34 (t, J = 7.7 Hz, 2H), 7.12 (d, J = 8.4 Hz, 1H), 7.06 (t, J = 7.3 Hz, 1H), 6.96 (d, J = 8.8 Hz, 2H), 6.94~6.87 (m, 4H), 4.33 (t, J = 6.7 Hz, 2H, CH2), 4.03 (s, 2H, CH2), 3.95 (t, J = 5.6 Hz, 2H, CH2), 2.25~2.11 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.6, 158.4, 155.0, 154.4, 149.8, 144.2, 135.4, 130.2, 126.2, 122.9, 121.6, 121.0, 117.7, 117.3, 116.1, 110.9, 65.2, 41.1, 37.3, 28.8; ESI-MS m/z: 468.8 [M+H]+, 466.6 [M-H]-。
2 -((5-氯-1-(3-(萘酚-1-基氧)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(6e) 白色固体, 收率90%。mp: 176~178 ℃; IR (KBr) υ/cm-1: 3 430, 3 062, 2 925, 1 724, 1 597, 1 506, 771; 1H NMR (DMSO-d6) δ 13.05 (s, 1H, -COOH), 8.12 (d, J = 8.2 Hz, 1H), 7.86 (d, J = 8.0 Hz, 1H), 7.59 (s, 1H), 7.56~7.51 (m, 2H), 7.50~7.45 (m, 2H), 7.38 (t, J = 7.9 Hz, 1H), 7.12 (d, J = 8.5 Hz, 1H), 6.89 (d, J = 7.5 Hz, 1H), 4.47 (t, J = 6.8 Hz, 2H, CH2), 4.18 (s, 4H, CH2), 2.41~2.28 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.8, 154.1, 153.2, 144.1, 135.5, 134.4, 127.8, 126.8, 126.5, 125.6, 125.2, 121.9, 120.4, 117.5, 111.1, 105.4, 65.2, 41.5, 34.8, 29.0; ESI-MS m/z: 424.7 [M-H]-。
2 -((5-氯-1-(3-(3-甲基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(6f) 白色固体, 收率92%。mp: 155~157 ℃; IR (KBr) υ/cm-1: 3 431, 3 037, 2 923, 2 868, 1 724, 1 601, 1 491, 900, 778, 689; 1H NMR (DMSO-d6) δ 12.02 (s, 1H, -COOH), 7.58 (d, J = 1.7 Hz, 1H), 7.50 (d, J = 8.6 Hz, 1H), 7.15 (dd, J = 8.6, 1.7 Hz, 1H), 7.12 (d, J = 8.0 Hz, 1H), 6.73 (d, J = 7.5 Hz, 1H), 6.68 (d, J = 7.5 Hz, 2H), 4.33 (t, J = 6.9 Hz, 2H, CH2), 4.15 (s, 2H, CH2), 3.95 (t, J = 5.9 Hz, 2H, CH2), 2.25 (s, 3H, CH3), 2.20~2.13 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.8, 158.6, 153.4, 144.0, 139.3, 135.4, 129.5, 126.4, 121.9, 121.8, 117.5, 115.6, 111.8, 111.1, 64.6, 41.2, 35.1, 28.8, 21.5; ESI-MS m/z: 388.5 [M-H]-。
2 -((5-氟-1-(3-(4-苯氧基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(6g) 白色固体, 收率94%。mp: 122~124 ℃; IR (KBr) υ/cm-1: 3 429, 2 925, 1 713, 1 605, 1 505, 840; 1H NMR (DMSO-d6) δ 13.07 (s, 1H, -COOH), 7.49 (dd, J = 8.8, 4.7 Hz, 1H), 7.35 (m, 1H), 7.33 (d, J = 7.9 Hz, 2H), 7.06 (t, J = 7.4 Hz, 1H), 7.00 (dd, J = 9.2, 2.1 Hz, 1H), 6.96 (d, J = 9.0 Hz, 2H), 6.94~6.89 (m, 4H), 4.34 (t, J = 6.8 Hz, 2H, CH2), 4.14 (s, 2H, CH2), 3.96 (t, J = 5.8 Hz, 2H, CH2), 2.24~2.13 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.8, 159.6, 158.4, 158.0, 155.0, 153.3, 149.9, 143.5, 133.3, 130.2, 122.9, 121.0, 117.7, 116.1, 110.5, 110.4, 109.7, 109.5, 104.0, 103.8, 65.2, 41.2, 35.2, 28.8; ESI-MS m/z: 452.9 [M+H]+, 450.7 [M-H]-。
2 -((5-氟-1-(3-(萘酚-1-基氧)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(6h) 白色固体, 收率97%。mp: 87~89 ℃; IR (KBr) υ/cm-1: 3 426, 3 053, 2 925, 1 722, 1 595, 1 508, 792, 772; 1H NMR (DMSO-d6) δ 12.90 (s, 1H, -COOH), 8.15 (d, J = 8.0 Hz, 1H), 7.86 (d, J = 7.8 Hz, 1H), 7.55~7.47 (m, 3H), 7.46 (d, J = 8.2 Hz, 1H), 7.38 (t, J = 7.9 Hz, 1H), 7.36~7.32 (m, 1H), 6.94 (t, J = 9.2 Hz, 1H), 6.89 (d, J = 7.6 Hz, 1H), 4.45 (t, J = 6.8 Hz, 2H, CH2), 4.18 (t, J = 5.4 Hz, 2H, CH2), 4.12 (s, 2H, CH2), 2.38~2.27 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.9, 159.5, 158.0, 154.1, 143.7, 134.4, 133.3, 127.8, 126.8, 126.5, 125.7, 125.2, 121.9, 120.4, 110.3, 109.4, 105.4, 104.0, 65.2, 41.4, 36.1, 29.1; ESI-MS m/z: 408.6 [M-H]-。
2 -((5-氟-1-(3-(3-甲基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(6i) 白色固体, 收率90%。mp: 121~123 ℃; IR (KBr) υ/cm-1: 3 431, 2 922, 1 726, 1 601, 1 487, 898, 779, 688; 1H NMR (DMSO-d6) δ 13.05 (s, 1H, -COOH), 7.49 (dd, J = 8.6, 4.3 Hz, 1H), 7.35 (d, J = 9.1 Hz, 1H), 7.13 (t, J = 7.7 Hz, 1H), 7.00 (t, J = 8.6 Hz, 1H), 6.73 (d, J = 7.3 Hz, 1H), 6.70 (s, 1H), 6.68 (d, J = 8.1 Hz, 1H), 4.33 (t, J = 6.7 Hz, 2H, CH2), 4.16 (s, 2H, CH2), 3.95 (t, J = 5.7 Hz, 2H, CH2), 2.25 (s, 3H, CH3), 2.20~2.14 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.8, 158.6, 158.0, 153.1, 143.6, 139.3, 133.3, 129.6, 121.8, 115.6, 111.8, 110.5, 109.6, 104.0, 64.5, 41.2, 34.8, 28.9, 21.5; ESI-MS m/z: 374.8 [M+H]+, 372.5 [M-H]-。
1.2 目标化合物13a~13l的合成通法以不同取代的1, 2-苯二胺和二硫化碳为原料, 按照5a~5i的合成方法, 得到中间体8-1/2/3/4。以8-1/2/3/4和氯乙酸为原料, 按照目标化合物6a~6i的合成方法, 得到中间体9-1/2/3/4。将9-1/2/3/4 (10 mmol)溶于80 mL乙醇中, 逐滴加入8 mL浓硫酸, 升温至78 ℃回流反应5 h, TLC监测。反应完成后冷却至室温, 减压浓缩除去部分乙醇后缓慢倒入200 mL冰水中, 用2 mol·L-1氢氧化钠调节pH至7, 析出大量固体, 抽滤、水洗、干燥后得中间体10-1/2/3/4, 白色固体, 收率86%~95%。
以10-1/2/3/4和1, 3-二溴丙烷为原料, 按照2-1/2/3的合成方法, 得到中间体11-1/2/3/4。以11-1/2/3/4和不同取代的苯酚或萘酚为原料, 按照3a~3i的合成方法, 得到中间体12a~12l。将12a~12l (0.3 mmol)加入15 mL 2 mol·L-1氢氧化钠溶液中, 升温至50 ℃继续反应3 h, TLC监测。反应完成后冷却至室温, 冰浴下用2 mol·L-1盐酸调节pH至3~4, 析出大量固体, 抽滤、水洗、干燥后得目标化合物13a~13l。
2 -((1-(3-(4-苯氧基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13a) 白色固体, 收率93%。mp: 76~78 ℃; IR (KBr) υ/cm-1: 3 430, 2 924, 1 721, 1 607, 1 504, 844, 743; 1H NMR (DMSO-d6) δ 13.08 (s, 1H, -COOH), 7.52~7.50 (m, 1H), 7.48~7.46 (m, 1H), 7.33 (t, J = 8.4 Hz, 2H), 7.14~7.11 (m, 2H), 7.05 (t, J = 7.2 Hz, 1H), 6.95 (d, J = 8.9 Hz, 2H), 6.92 (d, J = 8.9 Hz, 2H), 6.89 (d, J = 7.8 Hz, 2H), 4.33 (t, J = 7.1 Hz, 2H, CH2), 4.14 (s, 2H, CH2), 3.95 (t, J = 5.9 Hz, 2H, CH2), 2.20~2.16 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.9, 158.4, 155.0, 151.3, 149.9, 143.2, 136.6, 130.3, 122.9, 122.0, 121.9, 121.0, 118.0, 117.7, 116.1, 109.8, 65.2, 40.9, 34.9, 28.9; ESI-MS m/z: 432.7 [M-H]-。
2 -((1-(3-(萘酚-1-基氧)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13b) 白色固体, 收率93%。mp: 73~75 ℃; IR (KBr) υ/cm-1: 3 428, 3 052, 2 924, 1 723, 1 609, 1 507, 776, 744, 690; 1H NMR (DMSO-d6) δ 12.97 (s, 1H, -COOH), 8.20 (d, J = 8.0 Hz, 1H), 7.87 (d, J = 7.8 Hz, 1H), 7.58~7.48 (m, 4H), 7.47 (d, J = 8.2 Hz, 1H), 7.38 (t, J = 7.9 Hz, 1H), 7.14 (t, J = 7.3 Hz, 1H), 7.09 (t, J = 7.2 Hz, 1H), 6.89 (d, J = 7.6 Hz, 1H), 4.47 (t, J = 6.9 Hz, 2H, CH2), 4.18 (t, J = 5.7 Hz, 2H, CH2), 4.18 (s, 2H, CH2), 2.42~2.28 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.9, 154.2, 151.1, 143.2, 136.6, 134.4, 127.8, 126.8, 126.6, 125.7, 125.3, 122.0, 121.9, 120.4, 118.1, 109.8, 105.4, 65.1, 41.2, 34.7, 29.2; ESI-MS m/z: 390.7 [M-H]-。
2 -((1- (3-(3-甲基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13c) 白色固体, 收率, 91%。mp: 101~103 ℃; IR (KBr) υ/cm-1: 3 401, 2 926, 2 853, 1 630, 1 491, 743; 1H NMR (DMSO-d6) δ 13.17 (s, 1H, -COOH), 7.55~7.50 (m, 1H), 7.50~7.45 (m, 1H), 7.14 (t, J = 7.1 Hz, 3H), 6.75~6.71 (m, 2H), 6.69 (d, J = 7.9 Hz, 1H), 4.33 (t, J = 6.8 Hz, 2H, CH2), 4.15 (s, 2H, CH2), 3.95 (t, J = 5.8 Hz, 2H, CH2), 2.25 (s, 3H, CH3), 2.22~2.12 (m, 2H, CH2); 13C NMR (DMSO-d6) δ 169.9, 158.6, 151.4, 143.2, 139.3, 136.5, 129.6, 122.0, 121.9, 121.8, 118.0, 115.6, 111.8, 109.8, 64.6, 40.9, 29.0, 21.5; ESI-MS m/z: 356.8 [M+H]+, 354.5 [M-H]-。
2 -((5, 6-二甲基-1-(3-(4-苯氧基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13d) 白色固体, 收率89%。mp: 51~53 ℃; IR (KBr) υ/cm-1: 3 438, 3 026, 2 932, 1 737, 1 591, 1504, 843; 1H NMR (DMSO-d6) δ 7.34 (t, J = 7.1 Hz, 2H), 7.28 (s, 1H), 7.18 (s, 1H), 7.07 (t, J = 6.8 Hz, 1H), 6.97 (d, J = 8.2 Hz, 2H), 6.95 (d, J = 8.0 Hz, 2H), 6.91 (d, J = 7.5 Hz, 2H), 4.34~4.24 (m, 2H, CH2), 4.19 (s, 2H, CH2), 3.91 (t, J = 6.2, 2H, CH2), 2.25 (s, 3H, CH3), 2.19 (s, 3H, CH3), 2.18 (s, 2H, CH2); ESI-MS m/z: 461.4 [M-H]-。
2 -((5, 6-二甲基-1-(3-(萘酚-1-基氧)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13e) 白色固体, 收率88%。mp: 88~90 ℃; IR (KBr) υ/cm-1: 3 436, 3 058, 2 984, 2 926, 1 722, 1 581, 1 507, 791, 772; 1H NMR (DMSO-d6) δ 13.23 (s, 1H, -COOH), 8.20 (d, J = 8.0 Hz, 1H), 7.88 (d, J = 7.6 Hz, 1H), 7.59~7.49 (m, 2H), 7.47 (d, J = 8.2 Hz, 1H), 7.37 (t, J = 7.9 Hz, 1H), 7.33 (s, 1H), 7.29 (s, 1H), 6.85 (d, J = 7.6 Hz, 1H), 4.51 (t, J = 6.5 Hz, 2H, CH2), 4.25 (s, 2H, CH2), 4.13 (t, J = 5.5 Hz, 2H, CH2), 2.41~2.33 (m, 2H, CH2), 2.23 (s, 3H, CH3), 1.98 (s, 3H, CH3); ESI-MS m/z: 418.9 [M-H]-。
2 -((5, 6-二甲基-1-(3-(3-甲基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13f) 白色固体, 收率90%。mp: 67~69 ℃; IR (KBr) υ/cm-1: 3 428, 3 028, 2 965, 2 923, 1 722, 1 606, 1 474, 897, 768, 690; 1H NMR (DMSO-d6) δ 7.27 (s, 1H), 7.16 (s, 1H), 7.14 (d, J = 7.7 Hz, 1H), 6.74 (d, J = 7.8 Hz, 2H), 6.70 (d, J = 8.3 Hz, 1H), 4.26 (t, J = 6.5 Hz, 2H, CH2), 4.06 (s, 2H, CH2), 3.91 (t, J = 5.6 Hz, 2H, CH2), 2.26 (s, 3H, CH3), 2.24 (s, 3H, CH3), 2.17 (s, 3H, CH3), 2.15~2.12 (m, 2H, CH2); ESI-MS m/z: 385.4 [M+H]+, 383.3 [M-H]-。
2 -((5, 6-二氯-1-(3-(4-苯氧基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13g) 白色固体, 收率93%。mp: 51~53 ℃; IR (KBr) υ/cm-1: 3 437, 2 986, 2 926, 1 729, 1 603, 1 505, 840; 1H NMR (DMSO-d6) δ 7.80~7.73 (m, 2H), 7.35~7.31 (m, 2H), 7.07~7.03 (m, 1H), 6.96 (d, J = 8.8 Hz, 2H), 6.93~6.85 (m, 4H), 4.32 (t, J = 6.8 Hz, 2H, CH2), 3.97 (s, 2H, CH2), 3.93 (t, J = 5.6 Hz, 2H, CH2), 2.19~2.15 (m, 2H, CH2); ESI-MS m/z: 501.4 [M-H]-。
2 -((5, 6-二氯-1-(3-(萘酚-1-基氧)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13h) 白色固体, 收率89%。mp: 219~221 ℃; IR (KBr) υ/cm-1: 3 436, 2 985, 1 735, 1 602, 1 508, 790, 770; 1H NMR (DMSO-d6) δ 8.14 (d, J = 8.0 Hz, 1H), 7.85 (d, J = 7.8 Hz, 1H), 7.75 (s, 1H), 7.72 (s, 1H), 7.55~7.47 (m, 2H), 7.45 (d, J = 8.1 Hz, 1H), 7.37 (t, J = 7.9 Hz, 1H), 6.87 (d, J = 7.6 Hz, 1H), 4.43 (t, J = 6.8 Hz, 2H, CH2), 4.15 (t, J = 5.4 Hz, 2H, CH2), 3.94 (s, 2H, CH2), 2.35~2.30 (m, 2H, CH2); ESI-MS m/z: 459.3 [M-H]-。
2 -((5, 6-二氯-1-(3-(3-甲基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13i) 白色固体, 收率92%。mp: 77~79 ℃; IR (KBr) υ/cm-1: 3 438, 2 987, 2 952, 2 877, 1 604, 1 489, 867, 775, 689; 1H NMR (DMSO-d6) δ 7.76 (s, 1H), 7.74 (s, 1H), 7.13 (t, J = 8.2 Hz, 1H), 6.73 (d, J = 7.4 Hz, 1H), 6.66 (d, J = 5.9 Hz, 2H), 4.30 (t, J = 6.8 Hz, 2H, CH2), 3.96 (s, 2H, CH2), 3.94 (t, J = 5.8 Hz, 2H, CH2), 2.25 (s, 3H, CH3), 2.18~2.11 (m, 2H, CH2); ESI-MS m/z: 423.2 [M-H]-。
2 -((5, 6-二氟-1-(3-(4-苯氧基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13j) 白色固体, 收率90%。mp: 156~158 ℃; IR (KBr) υ/cm-1: 3 440, 2 987, 2 953, 1 710, 1 600, 1 505, 843; 1H NMR (DMSO-d6) δ 7.63~7.55 (m, 2H), 7.33 (t, J = 8.0 Hz, 2H), 7.06 (t, J = 7.4 Hz, 1H), 6.96 (d, J = 9.0 Hz, 2H), 6.90 (s, 2H), 6.89 (s, 2H), 4.31 (t, J = 6.8 Hz, 2H, CH2), 4.04 (s, 2H, CH2), 3.94 (t, J = 5.8 Hz, 2H, CH2), 2.21~2.14 (m, 2H, CH2); ESI-MS m/z: 471.4 [M+H]+, 469.0 [M-H]-。
2 -((5, 6-二氟-1-(3-(萘酚-1-基氧)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13k) 白色固体, 收率88%。mp: 113~114 ℃; IR (KBr) υ/cm-1: 3 435, 3 055, 2 931, 1 722, 1 597, 1 507, 787, 766; 1H NMR (DMSO-d6) δ 13.17 (s, 1H, -COOH), 8.11 (d, J = 8.2 Hz, 1H), 7.86 (d, J = 8.0 Hz, 1H), 7.68 (dd, J = 10.5, 7.3 Hz, 1H), 7.58 (dd, J = 10.9, 7.4 Hz, 1H), 7.52 (t, J = 7.1 Hz, 1H), 7.50~7.44 (m, 2H), 7.38 (t, J = 7.9 Hz, 1H), 6.89 (d, J = 7.6 Hz, 1H), 4.44 (t, J = 6.9 Hz, 2H, CH2), 4.18 (t, J = 5.6 Hz, 2H, CH2), 4.13 (s, 2H, CH2), 2.37~2.30 (m, 2H, CH2); ESI-MS m/z: 427.0 [M-H]-。
2 -((5, 6-二氟-1-(3-(3-甲基苯氧基)丙基)-1H-苯并咪唑-2-基)硫代)乙酸(13l) 白色固体, 收率89%。mp: 72~74 ℃; IR (KBr) υ/cm-1: 3 427, 2 984, 1 603, 1 483, 879, 771, 689; 1H NMR (DMSO-d6) δ 7.61~7.53 (m, 2H), 7.13 (t, J = 7.7 Hz, 1H), 6.73 (d, J = 7.4 Hz, 1H), 6.67 (d, J = 10.0 Hz, 2H), 4.28 (t, J = 6.8 Hz, 2H, CH2), 3.97 (s, 2H, CH2), 3.94 (t, J = 5.8 Hz, 2H, CH2), 2.25 (s, 3H, CH3), 2.18~2.11 (m, 2H, CH2); ESI-MS m/z: 391.1 [M-H]-。
2 生物活性 2.1 Pin1酶抑制活性将底物肽段Suc-Ala-Glu-cis-Pro-Phe-4-nitroanilide (Bachem)溶于LiCl/TFE (0.47 mol·L-1)。紫外-可见分光光度计预冷至10 ℃以下, 放入茶色比色皿后调零, 加入860 μL缓冲Buffer溶液(35 mmol·L-1 HEPES, pH 7.8)和20 μL重组人源Pin1活性蛋白(Abcam 51230), 用移液枪吹打混匀, 加入10 μL不同浓度的待测化合物孵育21 min。加入150 μL胰凝乳蛋白酶(60 mg·mL-1), 快速混匀。最后加入40 μL底物启动反应, 在390 nm处连续测定吸光度90 s。
2.2 细胞生长抑制活性人前列腺癌PC-3细胞以每毫升2.5×104个细胞密度加入96孔测试板中, 每孔100 μL, 放入含5% CO2的培养箱中37 ℃孵育24 h使其贴壁生长。药物用乙醇和培养液稀释成一定浓度后每孔加入100 μL, 继续孵育96 h。避光下每孔加入50 μL MTT溶液(2 mg·mL-1), 再次孵育4 h后弃去上层培养液, 每孔加入200 μL DMSO后摇床震荡10 min使蓝紫色结晶溶解。用酶标仪测定570 nm波长下的吸光度。
3 分子对接使用Sybyl-X 2.0对6g进行能量优化, 选择Tripos力场, 电荷类型为Gasteiger-Huckel, 最大迭代次数为1 000, 终止标准Gradient为0.005, 其余为默认参数。Pin1蛋白(PDB: 3KAI)的准备:提取配体分子; 删除所有水分子和多余的小分子配体; 修补侧链; 加全氢; 加电荷。选择Surflex-Dock (SFXC)模块, 基于配体分子定义活性口袋, 设置默认运行参数, 执行CScore Calculations, 运算结束后根据软件评分选择合理的结合构象。
作者贡献:第一作者李坤负责化合物的设计、合成及活性测试, 作者牛群负责分子模拟对接和化合物结构确证, 作者徐祺皓和韩宇参与化合物的合成及活性测试, 作者刘丹和通讯作者赵临襄负责实验设计及整体把关, 指导稿件的撰写和修改等工作。
利益冲突:本文作者声明无任何利益冲突。
| [1] |
Min SH, Zhou XZ, Lu KP. The role of Pin1 in the development and treatment of cancer[J]. Arch Pharm Res, 2016, 39: 1609-1620. DOI:10.1007/s12272-016-0821-x |
| [2] |
Lu KP, Hanes SD, Hunter T. A human peptidyl-prolyl isomerase essential for regulation of mitosis[J]. Nature, 1996, 380: 544-547. DOI:10.1038/380544a0 |
| [3] |
Lu KP, Zhou XZ. The prolyl isomerase PIN1:a pivotal new twist in phosphorylation signalling and disease[J]. Nat Rev Mol Cell Biol, 2007, 8: 904-916. |
| [4] |
Yu JH, Im CY, Min SH. Function of PIN1 in cancer development and its inhibitors as cancer therapeutics[J]. Front Cell Dev Biol, 2020, 8: 120. DOI:10.3389/fcell.2020.00120 |
| [5] |
Suizu F, Ryo A, Wulf G, et al. Pin1 regulates centrosome duplication, and its overexpression induces centrosome amplification, chromosome instability, and oncogenesis[J]. Mol Cell Biol, 2006, 26: 1463-1479. DOI:10.1128/MCB.26.4.1463-1479.2006 |
| [6] |
Chao SH, Greenleaf AL, Price DH. Juglone, an inhibitor of the peptidyl-proyl isomerase Pin1, also directly blocks transcription[J]. Nucleic Acids Res, 2001, 29: 767-773. DOI:10.1093/nar/29.3.767 |
| [7] |
Urusova DV, Shim JH, Kim DJ, et al. Epigallocatechin-gallate suppresses tumorigenesis by directly targeting Pin1[J]. Cancer Prev Res (Phila), 2011, 4: 1366-1377. DOI:10.1158/1940-6207.CAPR-11-0301 |
| [8] |
Wei S, Kozono S, Kats L, et al. Active Pin1 is a key target of all-trans retinoic acid in acute promyelocytic leukemia and breast cancer[J]. Nat Med, 2015, 21: 457-466. DOI:10.1038/nm.3839 |
| [9] |
Guo C, Hou X, Dong L, et al. Structure-based design of novel human Pin1 inhibitors (III):optimizing affinity beyond the phosphate recognition pocket[J]. Bioorg Med Chem Lett, 2014, 24: 4187-4191. DOI:10.1016/j.bmcl.2014.07.044 |
| [10] |
Potter A, Oldfield V, Nunns C, et al. Discovery of cell-active phenyl-imidazole Pin1 inhibitors by structure-guided fragment evolution[J]. Bioorg Med Chem Lett, 2010, 20: 6483-6488. DOI:10.1016/j.bmcl.2010.09.063 |
| [11] |
Xi Y, Jin J, Sun Y, et al. Design, synthesis and biological evaluation of novel diaryl ethers bearing a pyrimidine motif as human Pin1 inhibitors[J]. Acta Pharm Sin (药学学报), 2013, 48: 1266-1272. |
| [12] |
Cui G, Jin J, Chen H, et al. Synthesis and biological evaluation of pyrimidine derivatives as novel human Pin1 inhibitors[J]. Bioorg Med Chem, 2018, 26: 2186-2197. DOI:10.1016/j.bmc.2018.03.024 |
| [13] |
Russo Spena C, De Stefano L, Poli G, et al. Virtual screening identifies a PIN1 inhibitor with possible antiovarian cancer effects[J]. J Cell Physiol, 2019, 234: 15708-15716. DOI:10.1002/jcp.28224 |
| [14] |
Wu KJ, Zhong HJ, Yang G, et al. Small molecule Pin1 inhibitor blocking NF-κB signaling in prostate cancer cells[J]. Chem Asian J, 2018, 13: 275-279. DOI:10.1002/asia.201701216 |
| [15] |
Ieda N, Itoh K, Inoue Y, et al. An irreversible inhibitor of peptidyl-prolyl cis/trans isomerase Pin1 and evaluation of cytotoxicity[J]. Bioorg Med Chem Lett, 2019, 29: 353-356. DOI:10.1016/j.bmcl.2018.12.044 |
| [16] |
Campaner E, Rustighi A, Zannini A, et al. A covalent PIN1 inhibitor selectively targets cancer cells by a dual mechanism of action[J]. Nat Commun, 2017, 8: 15772. DOI:10.1038/ncomms15772 |
| [17] |
Li J, Li Y, Luo J, et al. Highlights of natural products research from China in 2018[J]. Acta Pharm Sin (药学学报), 2019, 54: 1333-1347. |
| [18] |
Li K, Ma T, Cai J, et al. Conjugates of 18beta-glycyrrhetinic acid derivatives with 3-(1H-benzo[d]imidazol-2-yl)propanoic acid as Pin1 inhibitors displaying anti-prostate cancer ability[J]. Bioorg Med Chem, 2017, 25: 5441-5451.
|
 2020, Vol. 55
2020, Vol. 55



