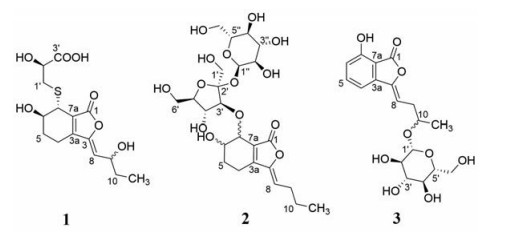
川芎(Ligusticum chuanxiong Hort.)为伞形科(Apiaceae)藁本属多年生草本栽培植物, 主产于我国四川、云南、贵州等地[1]。川芎的干燥根茎作为传统中药, 始载于《神农本草经》, 其性温, 味辛, 归肝经、胆经、心包经, 有活血行气、祛风止痛的功效, 主治血瘀气滞所致月经不调, 痛经经闭, 肝郁气滞而致血行不畅的胸胁疼痛、头痛、风寒湿痹、跌打肿痛等疾病[2]。目前临床主要将其用于治疗心脑血管、呼吸、泌尿系统及妇科方面的疾病[3]。化学成分研究显示, 川芎含有苯酞类、有机酸、生物碱、多糖等多种化学成分, 其中苯酞类化合物是其主要化学成分[4]。现代药理研究证明川芎具有抗脑缺血、抗心肌缺血、保护血管内皮细胞、平喘、镇静、阵痛等作用, 其中苯酞类是主要活性物质[5-7]。前期本课题组从川芎80%乙醇提取物的正丁醇部位分离得到一系列苯酞类新化合物[8-10], 为发现更多结构新颖的苯酞类化合物, 进一步为川芎的开发利用提供科学依据。本实验采用Sephadex LH-20柱色谱和高效液相制备色谱等多种色谱学方法, 从川芎正丁醇部位分离得到3个苯酞类新化合物(图 1), 并通过MS、NMR和CD等波谱技术鉴定结构, 分别为(3Z, 3aE)-(6R, 7R, 2'S)-6-hydroxy-7-(2-carboxyl-2-hydroxyethylthio)-3-(2-hydroxybutylidene)-4, 5, 6, 7-tetrahydro-phthalide (1)、(3Z, 3aZ)-3-butylidene-6, 7-dihydroxy-4, 5, 6, 7-tetrahydro-phthalide 7-O-α-D-glucopyranosyl-(1→2)-β-D-fructo-furanoside (2)和3-(3-β-D-glucopyranosyloxy-butylidene)-7-hydroxy-phthalide (3)。
|
Figure 1 The chemical structures of compounds 1-3 |
化合物1 白色无定形粉末, UV λmax (MeOH) (log ε): 201 (4.08)、273 (4.03) nm; [α]D20-12.3 (c 0.10 MeOH); HR-ESI-MS m/z 367.083 0 [M+Na]+ (Calcd. 367.082 2), 提示化合物1的分子式为C15H20O7S, 不饱和度为6; IR光谱在3 356、2 932、1 757、1 678、1 636、1 411、1 239和1 090 cm-1处有吸收峰, 说明化合物存在羟基、γ-内酯和二烯结构片段。
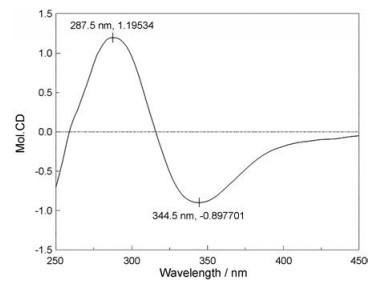
1的1H NMR谱(表 1)提示存在1个烯质子信号δH 5.35 (1H, d, J = 9.0 Hz, H-8); 4个亚甲基信号δH 2.43 (2H, m, H-4)、1.82 (2H, m, H-5)、1.45 (1H, m, H-10a)、1.55 (1H, m, H-10b)、2.85 (1H, dd, J = 7.0, 13.5 Hz, H-1'a)和3.04 (1H, dd, J = 4.0, 13.5 Hz, H-1'b); 1个甲基信号δH 0.84 (3H, t, J = 7.5 Hz, H-11); 3个连氧次甲基信号δH 4.11 (1H, m, H-6)、4.41 (1H, m, H-9)和4.03 (1H, dd, J = 4.0, 7.0 Hz, H-2')。13C NMR谱(表 2)共显示有15个碳信号, 包括两个羰基信号δC 167.8 (C-1)和174.0 (C-3'), 3个连氧次甲基δC 67.4 (C-6)、66.3 (C-9)和70.7 (C-2')。仔细分析1的质谱和核磁数据发现其与本研究组前期分离得到的化合物thiosenkyunolide C波谱数据非常接近[8], 区别在于9位的亚甲基在1中被羟基化, HMBC谱和1H-1H COSY谱均证实了上述推断(图 2)。ROESY实验中, H-8和H-4相关提示3位双键为Z构型。侧链上C-2'位的绝对构型通过加入钼试剂[Mo2(AcO)4]测定CD谱的方法来确定[11], CD图谱在345 nm处显示了负Cotton效应(图 3), 因此C-2'位的绝对构型为S。
| Table 1 1H NMR data of compounds 1-3 at 500 MHz in DMSO-d6 (J in Hz) |
| Table 2 13C NMR data of compounds 1-3 at 125 MHz in DMSO-d6 |

|
Figure 2 Key HMBC 1H-1H COSY and ROESY correlations of 1 |
|
Figure 3 CD spectrum of 1 with [Mo2(AcO)4] |
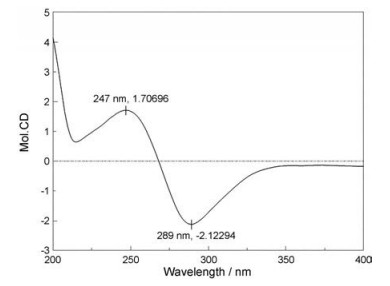
通过系统的构象分析结合1H NMR谱和ROESY谱数据, 可以确定H-6和H-7的相对立体构型与thiosenkyunolide C相同, 也为反式。而且1和thiosenkyunolide C的实验ECD图谱Cotton效应趋势一致(图 4), 可以推断1的6, 7位具有与thiosenkyunolide C相同的绝对构型。因此确定该化合物的结构为(3Z, 3aE)-(6R, 7R, 2'S)-6-hydroxy-7-(2-carboxyl-2-hydroxyethylthio)-3-(2-hydroxybutylidene)-4, 5, 6, 7-tetrahydro-phthalide。
|
Figure 4 CD spectrum of 1 |
化合物2 白色无定形粉末, UV λmax (MeOH) (log ε): 200 (3.76)、273 (3.85) nm; [α]D2015.7 (c 0.10 MeOH); HR-ESI-MS m/z 571.199 6 [M+Na]+ (Calcd. 571.199 7), 提示2的分子式为C24H36O14, 不饱和度为7; IR光谱在3 380、2 932、2 877、1 751、1 640、1 418、1 049 cm-1处有吸收峰。
在2的1H NMR谱(表 1)低场区观察到1个双键质子信号δH 5.50 (1H, t, J = 7.5 Hz, H-8), 高场区存在1个甲基氢信号δH 0.91 (3H, t, J = 7.5 Hz, H-11), 4个亚甲基氢信号δH 2.44 (2H, m, H-4)、1.80 (2H, m, H-5)、2.27 (2H, q, J = 7.5 Hz, H-9)和1.46 (2H, m, H-10), 两个连氧次甲基氢信号δH 4.16 (1H, m, H-6)和4.09 (1H, d, J = 9.5 Hz, H-7);其13C NMR谱(表 2)显示1个酯羰基碳信号δC 168.6 (C-1), 4个双键碳信号δC 148.0 (C-3)、154.4 (C-3a)、123.5 (C-7a)和113.0 (C-8), 1个甲基碳信号δC 13.7 (C-11), 4个亚甲基碳信号δC 16.4 (C-4)、23.0 (C-5)、27.6 (C-9)和21.7 (C-10), 两个连氧次甲基碳信号δC 65.4 (C-6)和71.1 (C-7), 以上数据说明2的母核骨架与1相同。与此同时2的1H NMR谱还显示存在一组蔗糖氢信号δH 3.47 (1H, overlap, H-1'a)、3.56 (3H, overlap, H-1'b/6')、4.11 (1H, d, J = 6.0 Hz, H-3')、3.85 (1H, m, H-4')、3.59 (1H, overlap, H-5')、5.15 (1H, d, J = 4.0 Hz, H-1")、3.10 (1H, overlap, H-2")、3.25 (1H, m, H-3")、3.11 (1H, overlap, H-4")和3.47 (3H, overlap, H-5"/6")。
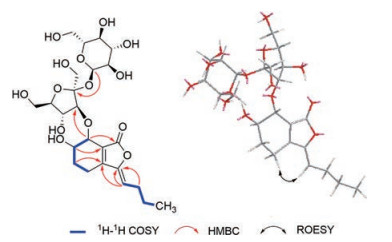
2的HMBC谱中显示H-8与C-3/C-3a相关, H-7与C-7a/C-3a/C-1相关, H-6和C-7a相关, H-5和C-3a相关, H-4与C-3a/C-7a相关, 结合1H-1H COSY谱中H-8/H-9/H-10/H-11相关, H-4/H-5/H-6/H-7相关证实了丁基四氢苯酞结构母核的存在(图 5)。HMBC谱中, 葡萄糖端基质子(δH 5.15)和C-2'的相关证实了蔗糖的存在, 而H-7和C-3'相关, 说明蔗糖的C-3'位和C-7位通过糖苷键相连。根据H-6和H-7的化学位移和耦合常数可以确定其相对构型为6, 7-trans[8, 10, 12], 葡萄糖端基氢的偶合常数(4.0 Hz)和单糖衍生化样品的气相色谱分析确定为α-D-葡萄糖。ROESY谱中, H-8和H-4相关提示3位双键为Z构型。通过以上分析, 可以确定化合物2的结构为(3Z, 3aZ)-3-butylidene-6, 7-dihydroxy-4, 5, 6, 7-tetrahydro-phthalide 7-O-α-D-glucopyranosyl-(1→2)-β-D-fructo-furanoside。
|
Figure 5 Key HMBC1H-1H COSY and ROESY correlations of 2 |
化合物3 白色无定形粉末, UV λmax (MeOH) (log ε): 225 (4.24)、265 (4.02) nm; [α]D20-20.9 (c 0.10 MeOH); HR-ESI-MS m/z 405.115 8 [M+Na]+ (Calcd. 405.115 6), 提示3的分子式为C18H22O9, 不饱和度为8; IR光谱在3 410、2 928、2 671、1 759、1 689、1 607、1 015 cm-1有吸收峰。
3的1H NMR谱(表 1)的低场区可以观察到3个苯环上的相邻氢信号δH 7.25 (1H, d, J = 8.0 Hz, H-4)、7.55 (1H, t, J = 8.0 Hz, H-5)和6.90 (1H, d, J = 8.0 Hz, H-6), 1个双键上的氢信号δH 5.98 (1H, t, J = 7.5 Hz, H-8), 提示该化合物可能含有1个1, 2, 3-三取代的苯环和1个双键结构片段。在高场区还显示了1个甲基氢信号δH 1.18 (3H, d, J = 6.5 Hz, H-11), 1个亚甲基氢信号δH 2.53 (2H, dd, J = 7.5, 13.5 Hz, H-9), 1个连氧次甲基氢信号δH 3.91 (1H, m, H-10), 以及1组葡萄糖氢信号δH 4.25 (1H, d, J = 8.0 Hz, H-1')、2.95 (1H, t, J = 8.0 Hz, H-2')、3.12 (1H, m, H-3')、3.04 (1H, q, J = 9.0 Hz, H-4')、3.08 (1H, m, H-5')、3.42 (1H, dd, J = 5.5, 11.5 Hz, H-6'a)和3.65 (1H, dd, J = 2.0, 11.5 Hz, H-6'b)。13C NMR谱(表 2)共显示18个碳信号, 包括1个酯羰基碳信号δC 164.5 (C-1), 6个苯环碳信号δC 141.0 (C-3a)、110.3 (C-4)、136.6 (C-5)、116.5 (C-6)、157.1 (C-7)和109.4 (C-7a), 两个双键碳信号δC 145.6 (C-3)和104.5 (C-8), 1个甲基碳信号δC 21.4 (C-11), 1个亚甲基碳信号δC 32.0 (C-9), 1个连氧次甲基碳信号δC 73.8 (C-10), 以及1组葡萄糖碳信号δC 102.2 (C-1')、73.6 (C-2')、76.8 (C-3')、70.1 (C-4')、76.7 (C-5')和61.1 (C-6')。
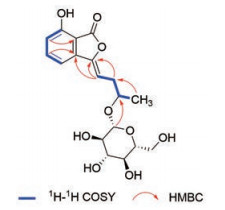
3的碳氢谱核磁数据显示, 3与ligusticumolide F母核结构相似[9], 为丁基苯酞类化合物, 该结论可通过HMBC谱中H-6与C-4/C-7a相关, H-5与C-7/C-3a相关, H-4与C-6/C-7a/C-3相关, H-8与C-3/C-3a相关进行证实(图 6)。此外, H-1' (δH 4.25)和C-10相关, 说明葡萄糖连接在C-10位。根据葡萄糖端基氢的偶合常数(8.0 Hz)和单糖衍生化样品的气相色谱分析确认为β-D-葡萄糖。通过以上分析, 可以确定化合物3的结构为3-(3-β-D-glucopyranosyloxy-butylidene)-7-hydroxy-phthalide。
|
Figure 6 Key HMBC correlations of 3 |
最后, 由于所得化合物的量太少, 在检测完1~3的各种波谱数据、确定平面结构和1的部分立体构型后, 无法满足后续的绝对构型的确定。下一步将继续对川芎中化学成分进行深入研究, 为川芎的开发利用提供理论和实验依据。
实验部分JASCO P-2000型旋光仪, JASCO V-650型紫外分光光度计, JASCO J-712型圆二色谱仪(美国JASCO公司); Nicolet 5700型红外光谱仪(美国Thermo公司); Bruker AVANCE III 500型核磁共振仪(美国Bruker-Biospin公司); Agilent 1100 LC/MSD TOF型高分辨质谱仪(美国Agilent公司); Agilent 1260型高效液相色谱仪(美国安捷伦科技有限公司); Shimadzu LC-6AD型半制备液相色谱仪(日本岛津公司); YMC ODS-A C18制备柱(250 mm×10 mm, 5 µm, 日本YMC公司); Sephadex LH-20葡聚糖凝胶色谱填料(瑞典Pharmacia Fine Chemicals公司); 硅胶色谱填料(青岛海洋化工厂)。
1 提取与分离川芎的干燥根茎共100 kg, 粉碎后经80%乙醇回流提取(3×2 h), 得浸膏(约23.1 kg)。浸膏经水分散后, 依次用乙酸乙酯和正丁醇萃取。所得正丁醇部位(1.3 kg)加水分散, 水溶解部分上大孔吸附树脂, 依次用0%~95%乙醇梯度洗脱。取正丁醇部位大孔吸附树脂15%乙醇洗脱部分进行中压ODS柱色谱分离, 用水和甲醇梯度洗脱, 得到Fr1~Fr 84共计84个洗脱部分。Fr 19 (60 mg)上样Sephadex LH-20柱色谱, 随后使用pre-HPLC (C18, 5 μm, 250 mm×20 mm, YMC; 5.0 mL·min-1; 254 nm; 25% MeOH/H2O)纯化得到化合物1 (3.1 mg, tR = 26.0 min, 纯度: 93%)。Fr 32 (55 mg)经pre-HPLC (C18, 5 μm, 250 mm×10 mm, YMC; 3.0 mL·min-1; 254 nm; 18% MeOH/H2O)分离, 得到化合物2 (3 mg, tR = 23.7 min, 纯度: 97%)。Fr 42 (55 mg)经Sephadex LH-20分离, 随后使用pre-HPLC (C18, 5 μm, 250 mm×10 mm, YMC; 3.0 mL·min-1; 254 nm; 12% ACN/H2O)柱色谱分离, 得到化合物3 (2.8 mg, tR = 21.0 min, 纯度: 95%)。
2 化合物2和3糖取代基绝对构型的确定分别取化合物2和3各1.5 mg, 溶于3 mL三氟乙酸溶液(1 mol·L-1)中, 60 ℃水浴加热4 h, 真空减压回收溶剂, 残渣冷冻干燥。将冻干样品溶于1 mL吡啶溶液中, 加入L-半胱氨酸甲酯盐酸盐3 mg, 60 ℃水浴加热1 h。反应液经减压回收溶剂后, 加入三甲基硅烷咪唑0.5 mL, 60 ℃水浴加热1 h。然后加入水2 mL至反应液中, 用正己烷萃取3次(每次2 mL)。有机相浓缩至0.2 mL, 过滤后进气相色谱分析。通过与标准品的保留时间比较(D-葡萄糖的保留时间为29.61 min)[13], 确定2和3中葡萄糖的绝对构型。
3 结构鉴定化合物1 白色无定形粉末, UV λmax (MeOH) (log ε): 201 (4.08)、273 (4.03) nm; [α]D20-12.3 (c 0.10 MeOH); HR-ESI-MS m/z 367.083 0 [M+Na]+ (Calcd. 367.082 2); IR: 3 356、2 967、2 932、1 757、1 678、1 636、1 519、1 411、1 307、1 239、1 188、1 090、1 045、972 cm-1; ECD (MeOH)/nm: 247 (∆ε 1.71)、289 (∆ε -2.12); 1H NMR (500 MHz, DMSO-d6)数据参见表 1, 13C NMR (125 MHz, DMSO-d6)数据参见表 2。
化合物2 白色无定形粉末, UV λmax (MeOH) (log ε): 200 (3.76)、273 (3.85) nm; [α]D2015.7 (c 0.10 MeOH); HR-ESI-MS m/z 571.199 6 [M+Na]+ (Calcd. 571.199 7); IR: 3 380、2 962、2 932、2 877、1 751、1 679、1 640、1 418、1 331、1 256、1 049、996、930 cm-1; 1H NMR (500 MHz, DMSO-d6)数据参见表 1, 13C NMR (125 MHz, DMSO-d6)数据参见表 2。
化合物3 白色无定形粉末, UV λmax (MeOH) (log ε): 198 (4.04)、225 (4.24)、265 (4.02)、230 (3.79)、239 (3.80) nm; [α]D20-20.9 (c 0.10 MeOH); HR-ESI-MS m/z 405.115 8 [M+Na]+ (Calcd. 405.115 6); IR: 3 410、2 975、2 928、2 671、1 759、1 689、1 607、1 472、1 377、1 288、1 199、1 162、1 076、1 015、897 cm-1; 1H NMR (500 MHz, DMSO-d6)数据参见表 1, 13C NMR (125 MHz, DMSO-d6)数据参见表 2。
作者贡献:本文中苑祥和韩冰主要负责分离纯化工作, 苑祥负责解析, 冯子明和姜建双负责指导分离工作, 杨桠楠和张培成负责指导结构解析工作, 张培成全程指导实验设计、结构解析和论文撰写。
利益冲突:文中没有任何利益冲突。
| [1] |
Han W. Advances in chemical constituents and pharmacological effects of Ligusticum chuanxiong[J]. Mod Chin Med (中国现代中药), 2017, 19: 1341-1349. |
| [2] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 1. Beijing: China Medical Science Press, 2015: 40.
|
| [3] |
Liu ZK, Ng CF, Shiu HT, et al. A traditional Chinese formula composed of Chuanxiong Rhizoma and Gastrodiae Rhizoma (Da Chuanxiong Formula) suppresses inflammatory response in LPS-induced RAW 264.7 cells through inhibition of NF-κB pathway[J]. J Ethnopharmacol, 2017, 196: 20-28. DOI:10.1016/j.jep.2016.12.014 |
| [4] |
Zhang X, Han B, Feng ZM, et al. Novel phenylpropanoid-amino acid adducts from Ligusticum chuanxiong[J]. Org Chem Front, 2018, 5: 1423-1430. DOI:10.1039/C8QO00012C |
| [5] |
Hu P, Zheng Q, Yang M, et al. Pharmacokinetic comparative study of gastrodin after oral administration of gastrodiaelata Bl. extract and its compatibility with the different indigents of Ligusticum chuanxiong Hort. to rats[J]. J Ethnopharmacol, 2016, 191: 82-86. DOI:10.1016/j.jep.2016.06.007 |
| [6] |
Li J, Yu J, Ma H, et al. Intranasal pretreatment with Z-ligustilide, the main volatile component of Rhizoma Chuanxiong, confers prophylaxis against cerebral ischemia via Nrf2 and HSP70 signaling pathways[J]. J Agric Food Chem, 2017, 65: 1533-1542. DOI:10.1021/acs.jafc.6b04979 |
| [7] |
Xie Y, Liu H, Lin L, et al. Application of natural deep eutectic solvents to extract ferulic acid from Ligusticum chuanxiong Hort with microwave assistance[J]. RSC Adv, 2019, 9: 22677-22684. DOI:10.1039/C9RA02665G |
| [8] |
Zhang X, Han B, Feng ZM, et al. Bioactive thionic compounds and aromatic glycosides from Ligusticum chuanxiong[J]. Acta Pharm Sin B, 2018, 8: 818-824. DOI:10.1016/j.apsb.2018.04.002 |
| [9] |
Zhang X, Feng ZM, Yang YN, et al. Bioactive butylphthalide derivatives from Ligusticum chuanxiong[J]. Bioorg Chem, 2019, 84: 505-510. DOI:10.1016/j.bioorg.2018.12.032 |
| [10] |
Zhang X, Han B, Feng ZM, et al. Phthalide derivatives from Ligusticum chuanxiong[J]. RSC Adv, 2017, 7: 37478-37486. DOI:10.1039/C7RA06813A |
| [11] |
Snatzke G, Wagner U, Wolff HP. Circulardichroism-LXXV:cottonogenic derivatives of chiral bidentate ligands with the complex[Mo2(O2CCH3)4][J]. Tetrahedron, 1981, 37: 349-361. DOI:10.1016/S0040-4020(01)92021-6 |
| [12] |
Takashi N, Takao K, Kazuaki N, et al. Two phthalides from Ligusticum chuanxiong[J]. Phytochemistry, 1992, 31: 639-642. DOI:10.1016/0031-9422(92)90051-Q |
| [13] |
Yuan X, Han B, Feng ZM, et al. Chemical constituents of Ligusticum chuanxiong and their anti-inflammation and hepatoprotective activities[J]. Bioorg Chem, 2020, 101: 104016. DOI:10.1016/j.bioorg.2020.104016 |
 2020, Vol. 55
2020, Vol. 55


