2. 内蒙古医科大学新药安全评价中心, 内蒙古自治区 呼和浩特 010110;
3. 内蒙古自治区新药筛选工程研究中心, 内蒙古自治区 呼和浩特 010110;
4. 内蒙古医科大学附属医院, 内蒙古自治区 呼和浩特 010110
2. The Center for New Drug Safety Evaluation and Research, Inner Mongolia Medical University, Hohhot 010110, China;
3. Inner Mongolia New Drug Screening Engineering Research Center, Hohhot 010110, China;
4. Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010110, China
近年来, 随着对肿瘤形成机制的不断探索, 人们发现肿瘤的发生、发展和转移与肿瘤微环境有着十分密切的关系, 其中缺氧是推动肿瘤进展的重要微环境因素之一[1]。在肿瘤的发展过程中会造成细胞缺氧, 同时可以激活缺氧诱导因子-1α (hypoxia inducible factor-1α, HIF-1α), 其过表达与肿瘤的转移密切相关, 最终导致患者死亡率升高[2]。苯并芘(benzo[α]pyrene, BaP)是一种普遍存在的环境污染物与致癌物, 有致毒性、致癌性以及致畸性[3], 它是芳香烃受体(aryl hydrocarbon receptor, AhR)的配体, 同时也是多环芳烃(polycyclic aromatic hydrocarbons, PAH)类化合物的主要代表[4, 5]。在无配体存在时, AhR、热休克蛋白90 (heat shock protein 90, HSP90)、乙型肝炎病毒X-相关蛋白2 (the hepatitis B virus X-associated protein 2, XAP2)和p23蛋白以复合物形式存在于细胞浆中, 当BaP和AhR结合后, 将与芳香烃受体核转位因子(aryl hydrocarbon receptor nuclear translocator, ARNT)结合并进入细胞核, HSP90等被释放到细胞浆中[6]。HSP90作为热休克蛋白家族中的一员, 在分子伴侣自噬(chaperone-mediated autophagy, CMA)过程中发挥着重要作用。CMA是细胞自噬的特殊形式, 也是哺乳动物特有的自噬途径[7, 8]。热休克同源蛋白70 (heat shock cognate protein 70, HSC70)和HSP90作为分子伴侣参与CMA过程[9-11]。CMA的发生需要胞质内HSC70与底物分子的特异氨基酸序列(KFERQ)识别结合[12], 形成的复合物能被溶酶体相关蛋白2A (lysosomal associated protein 2A, LAMP-2A)所识别, 在溶酶体腔内HSC70的介导下使底物去折叠并转位至溶酶体进行降解[13]。此外, HSP90作为分子伴侣维持客户蛋白的稳定性, 对关键癌蛋白具有调节作用进而促进癌症发展[14], 其具有多种亚型如HSP90α和HSP90β等, 其中HSP90α是构成性表达并主要分布于细胞质。HIF-1α是HSP90的客户蛋白, 其与HSP90α的相互作用可调节与其二聚化伴侣ARNT的相互作用[15]。CMA的发生还与DNA的损伤有关, 基因组的不稳定性、DNA损伤以及氧化应激都是CMA的异常表现[16, 17]。BaP对细胞氧化损伤的积累可间接造成DNA双链断裂(double strand break, DSB)[18], DSB是DNA损伤中最严重的一种形式, 其显著形态学标志是γ-H2AX焦点形成[19]。在常氧和缺氧环境下探讨BaP引起自噬的分子机制, 对BaP致癌机制的探讨及HSP90在BaP致癌和BaP引起的自噬中的作用具有重要意义, 也可为HSP90抑制剂应用于抗肿瘤提供一定的理论依据。
材料与方法细胞株及主要试剂 人肺腺癌细胞株A549 (中国医学科学院基础医学研究所), 在37 ℃、5% CO2条件下培养于含10%胎牛血清的RPMI 1640培养基(美国Gibco公司); BaP和CoCl2 (美国Sigma公司); Total RNA Kit (北京天根生化科技有限责任公司); Revert Aid First Strand cDNA Synthesis Kit (美国Thermo Scientific公司); QuantiFast SYBR Green Kit (日本TOYOBO公司); TRIzol提取试剂盒(日本TaKaRa公司); PCR引物和pSGU6/GFP/Neo表达载体(中国上海生工生物工程有限公司); HSP90抑制剂GA (geldanamycin)、蛋白浓度测定试剂盒、羊血清封闭液和DAPI (4', 6-diamidino-2-phenylindole)核染料(中国碧云天公司); 甘氨酸和Tris base (法国ANGUS化学公司); HSP90、LAMP-2A、HSC70、HIF-1α、γ-H2AX和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体(英国Abcam公司); 荧光二抗(美国LICOR公司); Lipofectamine 3000脂质体转染试剂盒(美国Thermo公司); 低熔点琼脂糖和正常熔点琼脂糖(美国Solarbio公司); 单面磨砂载玻片和细胞爬片(中国晶安生物公司)。
细胞活力检测实验 取对数生长期的A549细胞制成每毫升5×104个细胞悬液, 按每孔100 μL接种于96孔培养板, 于37 ℃、5% CO2培养箱培养约24 h, 加入含有BaP的培养液。按BaP终浓度分为0.01、0.1、1、10和100 μmol·L-1剂量组及空白对照组(细胞+培养基)、溶剂对照组(只有培养基)和细胞对照组(细胞+培养基+DMSO, 预实验显示0.1%的DMSO对细胞生长无影响), 共8组, 每个浓度设5个复孔, 分别于24、48和72 h后, 每孔加入20 μL MTT溶液, 于37 ℃、5% CO2培养箱温育4 h, 小心弃去原液, 每孔加入150 μL DMSO, 振荡10 min, 使结晶物充分溶解, 于490 nm测定吸光度值(A490), 取3次实验平均值, 计算细胞存活率。
细胞缺氧模型处理 CoCl2是一种化学乏氧剂, 当Co2+处于高浓度环境下可以与氧结合, 使细胞感觉缺氧, 并诱导细胞中HIF-1及其调控基因的表达而增强细胞的抗缺氧能力[20], 因此CoCl2是较好的化学缺氧诱导剂[21]。本实验选取CoCl2作用于A549细胞, 模拟体外细胞化学性缺氧条件。将A549细胞以每毫升1.2×105个的细胞悬液接种于6孔板, 于37 ℃、5% CO2培养箱培养至细胞贴壁。采用CoCl2构建细胞缺氧环境, 以未加CoCl2的细胞为对照组, 分别给予CoCl2 (200、300和400 μmol·L-1)培养24 h, 以及CoCl2 (300 μmol·L-1)作用于细胞0、12、24和48 h, 从而确定CoCl2最佳浓度以及作用时间。具体为: ①将细胞接种于6孔板, CoCl2 (300 μmol·L-1)作用24 h构建细胞缺氧环境, 设置常氧组和缺氧组。将细胞接种至6孔板并构建缺氧环境24 h后, 每孔加入不同浓度BaP (0.1、1和10 μmol·L-1)培养24 h; ②将细胞接种于6孔板, CoCl2 (300 μmol·L-1)作用于细胞24 h以构建细胞缺氧环境, 加入GA (1.2 μmol·L-1), 继续以0、6、12和24 h培养细胞, 从而确定GA最佳作用时间。
构建沉默HSP90α的A549细胞[22] 通过查阅PubMed网站及采用Primer5.0软件设计得到shRNA靶序列, HSP90α正义链序列为5'-CACCGTGACTGGGA AGATCACTTGTTCAAGAGACAAGTGATCTTCCCA GTCACTTTTTTG-3', 反义链序列为5'-CGAAGCTTC AAAAAAGTGACTGGGAAGATCACTTGTCTCTTGA ACAAGTGATCTTCCCAGTCAC-3'。通过细胞转染将适量对数期的人A549细胞接种于6孔板中, 次日当细胞密度达到40%~60%后, 使用Lipofectamine 3000试剂进行shRNA瞬时转染, 转染6 h后换液, 继续培养用于后续实验, qPCR法检测转染效率。将细胞分为不转染control组以及转染shRNA组。
碱性彗星实验 A549细胞以每毫升1.2×105个的细胞悬液接种至6孔板, 于37 ℃、5% CO2培养箱培养至细胞贴壁, 加入不同浓度BaP (0.1、1和10 μmol·L-1)培养24 h。将细胞收集并用PBS混匀, 取1/3细胞调整浓度为每毫升10个, 用低熔点琼脂糖将细胞混匀溶解并制备悬液。75%无水乙醇清洗载玻片, 用PBS配制1.5%正常熔点琼脂糖, 将载玻片水平放入其中, 待凝固; 配制0.5%低熔点琼脂糖, 冷却至37 ℃备用; 将细胞悬液10 μL (约5 000个)与120 μL 0.5%低熔点琼脂糖混匀, 滴加至1.5%正常熔点琼脂糖的载玻片并盖上盖玻片后, 4 ℃放置10 min; 去除盖玻片, 将载玻片置于细胞裂解液中, 4 ℃避光裂解至少1 h; 用无菌水清洗载玻片并置于水平电泳槽, 加入1×电泳缓冲液, 4 ℃避光解旋30 min; 于25 V、300 mA电泳30 min; 取出载玻片用中和缓冲液中和2次, 每次10 min; 无菌水清洗载玻片并晾干; 滴加溴化乙锭(EtBr, EB), 采用奥林巴斯CKX53显微镜自带图像分析系统对数据图片进行处理并测量彗尾长度并拍照。
免疫荧光检测γ-H2AX焦点实验 A549细胞以每毫升1.2×105个的细胞悬液接种至6孔板中的专用小孔细胞爬片上, 于37 ℃、5% CO2培养箱培养至细胞贴壁, 每孔加入不同浓度BaP (0.1、1和10 μmol·L-1)培养24 h。将细胞爬片取出并用4%多聚甲醛室温固定15 min, 冰PBS清洗3次(每次5 min)。用PBST (含0.2 Triton X-100)破膜爬片10 min并清洗3次(每次5 min)。使用羊血清封闭液室温封闭30 min, 加入γ-H2AX抗体并于4 ℃冰箱孵育过夜后, PBST清洗3次(每次5 min), 加入二抗(Alexa Fluor 488)并于室温避光孵育1 h, PBST避光清洗3次(每次5 min)。用DAPI (DNA染色)孵育爬片7 min, PBST清洗3次(每次5 min), 滴加90%甘油并用盖玻片封片后上机拍照。
实时荧光定量PCR (quantitative real-time PCR, qPCR)实验 根据TRIzol试剂说明书提取细胞总RNA, 取1 μg总RNA进行逆转录, 产物作为后续qPCR实验模板。取适量cDNA模板进行qPCR, 反应条件为: 95 ℃预变性30 s; 95 ℃变性5 s, 55 ℃退火30 s, 72 ℃延伸30 s, 40个循环, 以2-△△Ct法计算目的基因转录的mRNA水平。各基因引物序列见表 1。
| Table 1 Primer sequences. GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; HSP90: Heat shock protein 90; LAMP-2A: Lysosomal associated protein 2A; HIF-1α: Hypoxia inducible factor-1α; HSC70: Heat shock cognate protein 70 |
Western blot法检测蛋白水平 使用全蛋白提取试剂盒提取细胞总蛋白, 用BCA (bicinchonininc acid)法测定蛋白质浓度。取约20 μg蛋白样品进行SDS-PAGE (polyacrylamide gel electrophoresis)电泳并转移至PVDF (polyvinylidene fluoride)膜, 加入5%牛血清白蛋白(bovine serum albumin, BSA)于室温封闭1.5 h, 依次加入一抗, 于4 ℃孵育过夜, TBST (Tris-buffered saline and Tween-20)洗膜3次, 每次5 min, 荧光二抗室温避光孵育1 h, TBST洗膜3次, 每次5 min, Odyssey红外荧光扫描系统进行扫膜。结果用Image J软件进行分析, 以目标蛋白与内参GAPDH条带的灰度比值作为目标蛋白的相对表达水平。
统计学方法 采用SPSS21.0和GraphPad Prism软件进行t检验和单因素方差分析, 数据均以x ± s表示, P < 0.05为差异具有统计学意义。
结果 1 构建细胞缺氧环境检测不同浓度和不同时间的CoCl2作用于A549细胞后的HIF-1α的mRNA表达水平, 结果表明, 与对照组相比, CoCl2 (200、300和400 μmol·L-1)可使HIF-1α的mRNA表达水平升高, 且差异具有统计学意义(P < 0.001), 其中300 μmol·L-1浓度的作用最明显(图 1A)。与对照组相比, CoCl2 (300 μmol·L-1)在12、24和48 h时均可使HIF-1α的mRNA表达水平升高, 且差异具有统计学意义(P < 0.001), 其中作用24 h时, HIF-1α的mRNA表达量最高(图 1B)。
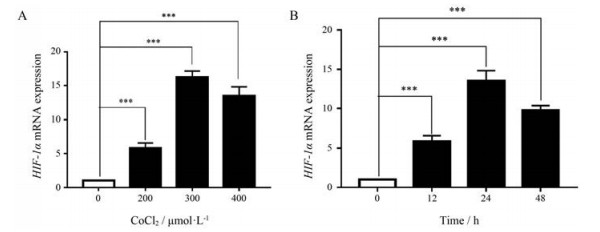
|
Figure 1 The mRNA expression level of HIF-1α in A549 cells after CoCl2 at different concentrations and at different times. A: The HIF-1α mRNA expression in A549 cells treated with 200, 300, and 400 μmol·L-1 CoCl2 after 24 h of continuous exposure to hypoxia compared with the solvent control group; B: The HIF-1α mRNA expression after CoCl2 was acted at a concentration of 300 μmol·L-1 for 0, 12, 24, and 48 h. n = 3, x ± s. ***P < 0.001 |
在缺氧环境下, 通过qPCR和Western blot法检测HIF-1α、HSP90、HSC70和LAMP-2A的mRNA和蛋白表达情况。结果显示, 与常氧组比较, 缺氧组细胞中HIF-1α、HSP90、HSC70和LAMP-2A的mRNA和蛋白表达量明显增加, 差异具有统计学意义(P < 0.001, P < 0.05), 表明缺氧能促进CMA的发生(图 2)。
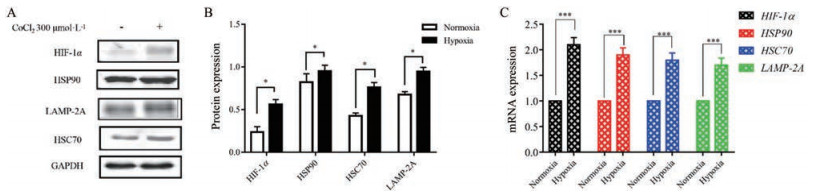
|
Figure 2 The mRNA and protein expression of HIF-1α, HSP90, HSC70, and LAMP-2A under hypoxic environment. A: The representative Western blot results of HIF-1α, HSP90, HSC70, LAMP-2A, and GAPDH under hypoxia and normoxia; B: The statistical results of A; C: The mRNA expression of HIF-1α, HSP90, HSC70, and LAMP-2A under hypoxia and normoxia. n = 3, x ± s. *P < 0.05, ***P < 0.001 |
本研究是在BaP对细胞不造成毒性作用的剂量下, 观察其对CMA的影响, 通过MTT法发现BaP在0~10 μmol·L-1浓度范围内, 作用时间24和48 h对A549细胞的增殖影响不显著。因而, 本研究选定BaP浓度为0、0.1、1和10 μmol·L-1, 作用24 h进行后续实验(图 3)。
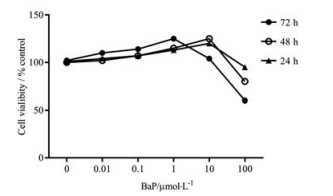
|
Figure 3 Different concentrations of BaP in hypoxia environment could affect the proliferation of A549 cells within the concentration range of 0-10 μmol·L-1 in 24, 48, and 72 h. Bap: Benzo[α]pyrene |
应用A549细胞构建缺氧环境, 观察不同浓度BaP作用24 h对HIF-1α、HSP90、HSC70和LAMP-2A的mRNA和蛋白表达情况。结果显示, BaP浓度为1 μmol·L-1时, HIF-1α、HSP90、HSC70和LAMP-2A的mRNA和蛋白表达量降低, 差异具有统计学意义(P < 0.05), 表明在缺氧环境下, BaP可以抑制CMA (图 4)。
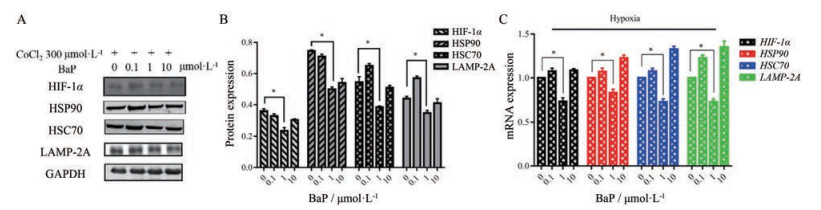
|
Figure 4 Different concentrations of BaP were given to A549 cells under hypoxia to influent the expression of HIF-1α, HSP90, HSC70, and LAMP-2A. A: The representative Western blot results of HIF-1α, HSP90, HSC70, LAMP-2A, and GAPDH under different concentrations of BaP under hypoxia environment; B: The statistical results of A; C: The mRNA expression of HIF-1α, HSP90, HSC70, and LAMP-2A under different concentrations of BaP in a hypoxia environment. n = 3, x ± s. *P < 0.05 |
给予A549细胞的GA浓度为1.2 μmol·L-1, 作用时间为6、12和24 h, 结果表明, HSP90的mRNA表达量在12 h时较低, 差异具有统计学意义(P < 0.001), 因此本实验选取12 h时间点用于后续实验研究。
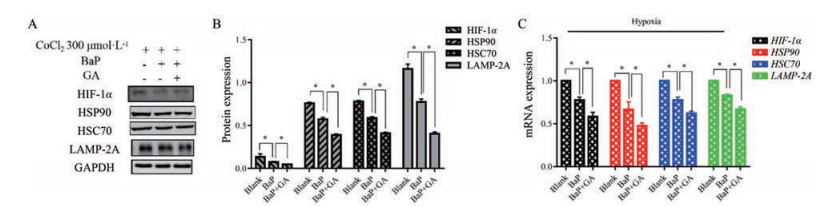
应用A549细胞构建缺氧环境后, BaP组与空白组相比, HIF-1α、HSP90、HSC70和LAMP-2A的mRNA和蛋白表达量降低, 差异具有统计学意义(P < 0.05); BaP + GA组与BaP组相比, HIF-1α、HSP90、HSC70和LAMP-2A的mRNA和蛋白表达量降低, 差异具有统计学意义(P < 0.05)。上述结果表明, BaP抑制CMA与HSP90有关, HSP90抑制剂增加了BaP抑制CMA的作用(图 5)。
|
Figure 5 Under hypoxic environment, BaP and GA were added to A549 cells to detect the expression of HIF-1α, HSP90, HSC70, and LAMP-2A. A: The representative Western blot results of HIF-1α, HSP90, HSC70, LAMP-2A, and GAPDH in A549 cells administered with BaP and GA under hypoxia environment; B: The statistical results of A; C: The mRNA expression of HIF-1α, HSP90, HSC70, and LAMP-2A in A549 cells given BaP and GA under hypoxia. n = 3, x ± s. *P < 0.05. GA: Geldanamycin |
通过基因测序检测重组质粒, 结果表明插入的片段DNA序列与设计的干扰基因编码序列完全一致, 确证构建的重组质粒正确。应用qPCR法检测转染重组质粒24和48 h后的A549细胞中的HSP90α mRNA表达, 设定control组HSP90α mRNA表达量为1。转染24和48 h后, shRNA组与control组比较, 表达量降低, 差异均具有统计学意义(P < 0.05), 因此选取HSP90α重组质粒转染24 h进行后续实验(图 6)。

|
Figure 6 HSP90α mRNA expression in A549 cells after 24 and 48 h transient transfection of plasmid. n = 3, x ± s. *P < 0.05 |
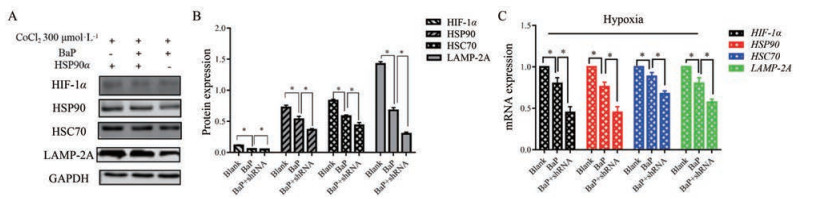
构建沉默HSP90α的A549细胞, BaP组与空白组相比, HIF-1α、HSP90、HSC70和LAMP-2A的mRNA和蛋白表达量降低, 差异具有统计学意义(P < 0.05); shRNA + BaP组与BaP组相比, HIF-1α、HSP90、HSC70和LAMP-2A的mRNA和蛋白表达量降低, 差异具有统计学意义(P < 0.05), 结果表明, BaP抑制CMA与HSP90有关, 沉默HSP90α增加了BaP抑制CMA的作用(图 7)。
|
Figure 7 The expression of HIF-1α, HSP90, HSC70, and LAMP-2A after giving different concentrations of BaP to HSP90-silenced A549 cells under hypoxia. A: The representative Western blot results of HIF-1α, HSP90, HSC70, LAMP-2A, and GAPDH after adding different concentrations of BaP to HSP90α-silenced A549 cells under hypoxia; B: The statistical results of A; C: The mRNA expression of HIF-1α, HSP90, HSC70, and LAMP-2A in HSP90-silenced A549 cells in hypoxic environment after adding different concentrations of BaP. n = 3, x ± s. *P < 0.05 |
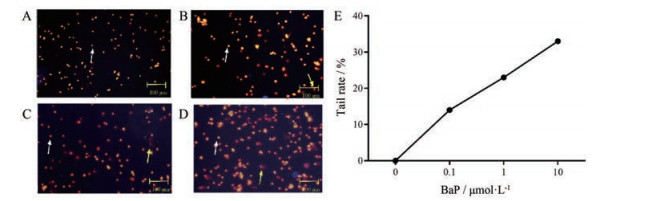
碱性彗星实验结果显示:在常氧环境下, 不给予BaP的对照组无拖尾细胞, 其拖尾率为0%;当分别给予0.1、1和10 μmol·L-1的BaP时, 其拖尾率分别为13.02%、22.34%和31.03%。统计结果表明, 随着BaP浓度增加, 其拖尾率随之增加(图 8)。
|
Figure 8 In the normoxic environment, the tailing phenomenon produced when A549 cells were given different concentrations of BaP. A: The tailing situation without BaP; B-D: The tailing situation when BaP concentration is 0.1, 1, or 10 μmol·L-1 in normoxic environment, respectively. White arrow represents tailless cells, and the yellow arrow represents the cells that produce tails. Scale bar, 100 μm; E: The tailing rate of A549 cells was shown at different concentrations of BaP under normoxia |
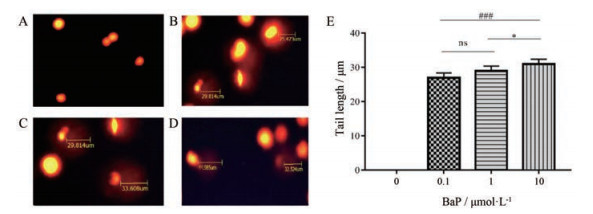
在荧光显微镜下每个浓度选取30个拖尾细胞, 分析结果显示:对照组A549细胞在不给予BaP时, 视野内看不到拖尾细胞, 平均拖尾长度为0 μm; 分别给予0.1、1和10 μmol·L-1的BaP时, 拖尾细胞的平均拖尾长度分别为26.36、29.09和31.74 μm, 即随着BaP浓度增加, 平均拖尾长度明显增加。将彗尾长度进行统计学分析, 结果显示: BaP (0.1 μmol·L-1)组与BaP (1 μmol·L-1)组比较无统计学差异(P > 0.05); BaP (1 μmol·L-1)组与BaP (10 μmol·L-1)组比较, 具有统计学差异(P < 0.05); BaP (0.1 μmol·L-1)组与BaP (10 μmol·L-1)组比较, 具有统计学差异(P < 0.001)。结果表明, 随着BaP浓度增加, 拖尾率和平均拖尾长度明显增加, 说明其对细胞中DNA单链断裂程度明显增加(图 9)。
|
Figure 9 Under normoxic environment, different concentrations of BaP act on A549 cells, and the comet length of the tailing cells. A: The comet length of the tailing cells without BaP; B–D: The comet length of tailing cells with BaP at 0.1, 1 or 10 μmol·L-1; E: The summary results of comet tail length of tailing cells at different concentrations of BaP. n = 3, x ± s. ns: No significance; *P < 0.05 vs BaP (1 μmol·L-1) group; ###P < 0.001 vs BaP (0.1 μmol·L-1) group |
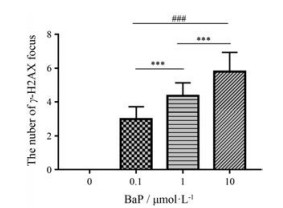
在荧光显微镜下每张片子选取40个细胞观察, 结果发现:常氧环境下, 不给予BaP时, 没有观察到细胞核中有γ-H2AX焦点出现, 记为0焦点/细胞; 分别给予0.1、1和10 μmol·L-1 BaP时, 细胞核中γ-H2AX焦点平均值分别为3.02、6.38和8.21焦点/细胞。将每个浓度的γ-H2AX焦点数进行统计分析, 结果显示, BaP (0.1 μmol·L-1)组与BaP (1 μmol·L-1)组比较, BaP (1 μmol·L-1)组与BaP (10 μmol·L-1)组比较, 以及BaP (0.1 μmol·L-1)组与BaP (10 μmol·L-1)组比较, 差异均具有统计学意义(P < 0.001)。上述结果表明, 随着BaP浓度的增加, γ-H2AX焦点数及其平均值增加, 说明BaP对细胞内DNA双链断裂程度明显增加(图 10)。
|
Figure 10 Under normoxic conditions, the number of γ-H2AX focal points in the nucleus of A549 cells were statistically analyzed when BaP of different concentrations was applied. Different concentrations of BaP act on A549 cells and the number of focus points of γ-H2AX at each concentration. n = 3, x ± s. ***P < 0.001 vs BaP (1 μmol·L-1) group; ###P < 0.001 vs BaP (0.1 μmol·L-1) group |
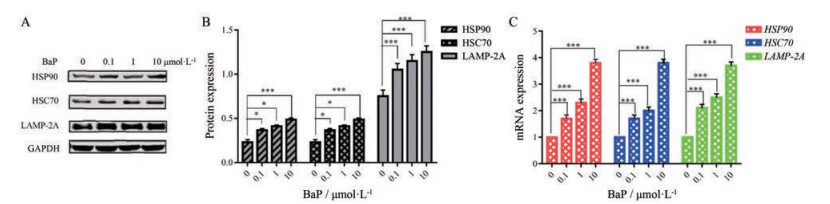
常氧环境下, 给予不同浓度的BaP作用于A549细胞24 h, 观察HSP90、HSC70和LAMP-2A的mRNA和蛋白表达情况。与空白组比较, 随着BaP浓度的增加, HSP90、HSC70和LAMP-2A的mRNA和蛋白表达量均增加, 差异均具有统计学意义(P < 0.001或P < 0.05)。结果表明, 在常氧环境下, BaP能促进HSP90、HSC70和LAMP-2A的mRNA和蛋白的表达水平(图 11)。
|
Figure 11 Under normoxic conditions, the mRNA and protein expression levels of HSP90, HSC70, and LAMP-2A in A549 cells with different concentrations of BaP were detected. A: Western blot results of HSP90, HSC70, LAMP-2A, and GAPDH in A549 cells under normoxia after administering different concentrations of BaP; B: The statistical results of A; C: The mRNA expression of HSP90, HSC70, and LAMP-2A after administration of different concentrations of BaP to A549 cells under normoxia. n = 3, x ± s. *P < 0.05, ***P < 0.001 |
BaP是环境中一种主要污染物, 接触BaP会对健康造成各种不良影响, 包括癌症、免疫抑制和致畸等[23]。自噬是一把双刃剑, 一方面, 自噬可清除肿瘤细胞内折叠不当的蛋白质和功能失调的细胞器, 最终防止基因组损伤, 阻止癌症的进展; 另一方面, 在癌症晚期, 肿瘤细胞可以利用自噬在营养缺乏或缺氧的情况下生存[24]。CMA是一种重要的降解机制, 将细胞内成分传递到溶酶体中, 有助于维持细胞内稳态。CMA的机制是通过溶酶体对含有KFERQ序列的细胞蛋白质进行选择性降解。在低氧、长时间饥饿和DNA损伤等不利条件下, HSC70结合不同辅助伴侣, 如形成HSC70/HSP90复合物, 定向到LAMP-2A, 最后进入溶酶体内[25]。缺氧是CMA的反应源之一, HIF-1可以激活CMA, 这是一种参与维持细胞内稳态的分解途径[26]。此外, 自噬途径既参与细胞内稳态, 又参与神经变性、心血管疾病和癌症等病理进程, 其在DNA损伤反应中的作用得到了广泛研究[27, 28], 但DNA损伤触发自噬的确切机制以及自噬在DNA损伤反应中的作用尚不清楚[29]。
研究发现, 低氧暴露会导致CMA相关基因上调[30], 与本研究结果一致。此外, HIF-1α与HSP90在人体多种肿瘤中高表达, 在非小细胞肺癌中, HIF-1α与HSP90的表达呈正相关[31]。HIF-1α是细胞缺氧反应的中介因子, 它与AhR有共同的二聚伴侣ARNT, 并可能发生相互串扰。在低氧条件下, AhR通路的激活会导致缺氧通路的激活减少, 而缺氧则会导致AhR激动剂对AhR通路的激活减少。缺氧和AhR通路也共享转录所需的协同激活因子。这些因素可能导致缺氧途径的活性降低[32]。在串扰假设下, BaP降低了HIF-1活性的诱导, 但在常氧条件下也降低了HIF-1活性。相反, Yu等[33]报道BaP和缺氧具有协同作用。据报道, BaP代谢物可以增加HIF-1α蛋白的降解[34]。本研究发现, BaP抑制HIF-1α与HSP90等CMA相关基因的表达, 可能与发生上述相互串扰有关。
HSP90是一组高度保守的分子伴侣, HSP90通过多分子伴侣复合物对作用蛋白的构象起到稳定作用, 抑制或防止其由泛素化途径降解, 影响许多癌基因通路, 在肿瘤细胞的生长和存活中起着非常重要的调节作用[35]。有文献报道, HSP90抑制剂可以增强BaP对CMA的抑制作用, 说明BaP抑制CMA与HSP90相关。当抑制HSP90时, CMA相关基因很大程度上被抑制[36]。在哺乳动物中, HSP90有两种主要的细胞质亚型, 一种是应激诱导的HSP90α, 另一种是组成型HSP90β[37]。Li等[38, 39]研究发现低氧(1% O2)状态下, HIF-1α能够诱导HSP90α的分泌, 分泌的HSP90α反过来促进细胞的迁移, 上述结果支持了本研究的结果。此外, 自噬和DNA损伤是细胞和生物稳态所必需的生物过程, DNA损伤可以激活自噬, 但其在DNA损伤反应中的作用尚不清楚[40]。本研究发现在常氧环境下, BaP能够引起DNA损伤进而诱导CMA, HSP90在这个过程中起着重要的调控作用。
综上所述, 本研究发现BaP在缺氧环境中通过HSP90影响CMA相关因子表达, 且BaP在常氧环境中与CMA的发生和DNA损伤相关。本文为研究不同氧环境下, BaP对CMA的影响提供了科学依据, 对BaP致癌机制的探讨及HSP90在BaP致癌和BaP引起的自噬中的作用具有重要意义, 可为寻找HSP90抑制剂防治癌症提供一定的理论依据。
作者贡献:常福厚进行了课题的设计; 杨帆、林楠和张莎莎负责细胞活力检测、细胞培养、碱性彗星实验以及免疫荧光检测γ-H2AX焦点实验等实验验证; 张梦迪、胡玉霞和吕晓丽负责论文的指导; 李君和肖志彬负责实验数据的分析和统计; 杨帆、奥敦托娅和白图雅负责文献查阅和文章内容的撰写。所有作者均已批准该稿件的最终版本。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Semenza GL. Oxygen sensing, hypoxia-inducible factors, and disease pathophysiology[J]. Annu Rev Pathol, 2014, 9: 47-71. DOI:10.1146/annurev-pathol-012513-104720 |
| [2] |
Feng J, Zhang Y, She X, et al. Hypermethylated gene ANKDD1A is a candidate tumor suppressor that interacts with FIH1 and decreases HIF1α stability to inhibit cell autophagy in the glioblastoma multiforme hypoxia microenvironment[J]. Oncogene, 2019, 38: 103-119. DOI:10.1038/s41388-018-0423-9 |
| [3] |
Alharthy KM, Albaqami FF, Thornton C, et al. Mechanistic evaluation of benzo[α]pyrene's developmental toxicities mediated by reduced cyp19a1b activity[J]. Toxicol Sci, 2017, 155: 135-147. DOI:10.1093/toxsci/kfw182 |
| [4] |
Zhao G, Wang Z, Huang Y, et al. Effects of benzoapyrene on migration and invasion of lung cancer cells functioning by TNF-α[J]. J Cell Biochem, 2018, 119: 6492-6500. DOI:10.1002/jcb.26683 |
| [5] |
Krais AM, Speksnijder EN, Melis JPM, et al. The impact of p53 on DNA damage and metabolic activation of the environmental carcinogen benzo[α]pyrene:effects in Trp53(+/+), Trp53(+/-) and Trp53(-/-) mice[J]. Arch Toxicol, 2016, 90: 839-851. DOI:10.1007/s00204-015-1531-8 |
| [6] |
Tsay JJ, Tchou-Wong KM, Greenberg AK, et al. Aryl hydrocarbon receptor and lung cancer[J]. Anticancer Res, 2013, 33: 1247-1256. |
| [7] |
Wang JY, Wu T, Ma W, et al. Expression and clinical significance of autophagic protein LC3B and EMT markers in gastric cancer[J]. Cancer Manag Res, 2018, 10: 1479-1486. DOI:10.2147/CMAR.S164842 |
| [8] |
Bednarczyk M, Zmarzły N, Grabarek B, et al. Genes involved in the regulation of different types of autophagy and their participation in cancer pathogenesis[J]. Oncotarget, 2018, 9: 34413-34428. DOI:10.18632/oncotarget.26126 |
| [9] |
Wang B, Chen Z, Yu F, et al. HSP90 regulates autophagy and plays a role in cancer therapy[J]. Tumour Biol, 2016, 37: 1-6. |
| [10] |
Kon M, Cuervo AM. Chaperone-mediated autophagy in health and disease[J]. FEBS Lett, 2010, 584: 1399-1404. DOI:10.1016/j.febslet.2009.12.025 |
| [11] |
Massey AC, Zhang C, Cuervo AM. Chaperone-mediated autophagy in aging and disease[J]. Curr Top Dev Biol, 2006, 73: 205-235. DOI:10.1016/S0070-2153(05)73007-6 |
| [12] |
Juste YR, Cuervo AM. Analysis of chaperone-mediated autophagy[J]. Methods Mol Biol, 2019, 1880: 703-727. |
| [13] |
Pajares M, Rojo AI, Arias E, et al. Transcription factor NFE2L2/NRF2 modulates chaperone-mediated autophagy through the regulation of LAMP-2A[J]. Autophagy, 2018, 14: 1310-1322. DOI:10.1080/15548627.2018.1474992 |
| [14] |
Yuno A, Lee MJ, Lee S, et al. Clinical evaluation and biomarker profiling of HSP90 inhibitors[J]. Methods Mol Biol, 2018, 1709: 423-441. |
| [15] |
Prince TL, Kijima T, Tatokoro M, et al. Client proteins and small molecule inhibitors display distinct binding preferences for constitutive and stress-induced HSP90 isoforms and their conformationally restricted mutants[J]. PLoS One, 2015, 10. |
| [16] |
Smit E, Souza T, Jennen DGJ, et al. Identification of essential transcription factors for adequate DNA damage response after benzo[α]pyrene and aflatoxin B1 exposure by combining transcriptomics with functional genomics[J]. Toxicology, 2017, 390: 74-82. DOI:10.1016/j.tox.2017.09.002 |
| [17] |
Lorente J, Velandia C, Leal JA, et al. The interplay between autophagy and tumorigenesis:exploiting autophagy as a means of anticancer therapy[J]. Biol Rev Camb Philos Soc, 2018, 93: 152-165. DOI:10.1111/brv.12337 |
| [18] |
Tung EW, Philbrook NA, Belanger CL, et al. Benzo[α]pyrene increases DNA double strand break repair in vitro and in vivo:a possible mechanism for benzo[α]pyrene-induced toxicity[J]. Mutat Res Genet Toxicol Environ Mutagen, 2014, 760: 64-69. DOI:10.1016/j.mrgentox.2013.12.003 |
| [19] |
Uprecht N, Hungerbühler MN, Böhm IB, et al. Improved identification of DNA double strand breaks:γ-H2AX-epitope visualization by confocal microscopy and 3D reconstructed images[J]. Radiat Environ Biophys, 2019, 58: 295-302. DOI:10.1007/s00411-019-00778-1 |
| [20] |
Lan A, Liao X, Mo L, et al. Hydrogen sulfide protects against chemical hypoxia-induced injury by inhibiting ROS-activated ERK1/2 and p38 MAPK signaling pathways in PC12 cells[J]. PLos One, 2011, 6: e25921. DOI:10.1371/journal.pone.0025921 |
| [21] |
Karovic O, Tonazzini I, Rebola N, et al. Toxic effects of cobalt in primary culture of mouse astrocytes similarities with hypoxia and role of HIF-1α[J]. Biochem Pharmacol, 2007, 73: 694-708. DOI:10.1016/j.bcp.2006.11.008 |
| [22] |
Zhang SS, Zhou SH, Zhang MD, et al. Mechanism of BaP on the proliferation, migration and invasion of human lung cancer A549 cells[J]. Chin J Cancer Prev Treat (中华肿瘤防治杂志), 2020, 27: 1119-1124. |
| [23] |
Kim KS, Kim NY, Son JY, et al. Curcumin ameliorates benzo[α]pyrene-induced DNA damages in stomach tissues of Sprague-Dawley rats[J]. Int J Mol Sci, 2019, 20: 5533. DOI:10.3390/ijms20225533 |
| [24] |
Jing X, Yang F, Shao C, et al. Role of hypoxia in cancer therapy by regulating the tumor microenvironment[J]. Mol Cancer, 2019, 18: 157. DOI:10.1186/s12943-019-1089-9 |
| [25] |
Robert G, Jacquel A, Auberger P. Chaperone-mediated autophagy and its emerging role in hematological malignancies[J]. Cells, 2019, 8: 1260. DOI:10.3390/cells8101260 |
| [26] |
Mimouna S, Bazin M, Mograbi B, et al. HIF1A regulates xenophagic degradation of adherent and invasive Escherichia coli (AIEC)[J]. Autophagy, 2014, 10: 2333-2345. DOI:10.4161/15548627.2014.984275 |
| [27] |
Galati S, Boni C, Gerra MC, et al. Autophagy:a player in response to oxidative stress and DNA damage[J]. Oxid Med Cell Longev, 2019, 2019: 5692958. |
| [28] |
Saha T. LAMP-2A overexpression in breast tumors promotes cancer cell survival via chaperone-mediated autophagy[J]. Autophagy, 2012, 8: 1643-1656. DOI:10.4161/auto.21654 |
| [29] |
Rodriguez-Rocha H, Garcia-Garcia A, Panayiotidis MI, et al. DNA damage and autophagy[J]. Mutat Res, 2011, 711: 158-166. DOI:10.1016/j.mrfmmm.2011.03.007 |
| [30] |
Hubbi ME, Hu H, Kshitiz, et al. Chaperone-mediated autophagy targets hypoxia-inducible factor-1α (HIF-1α) for lysosomal degradation[J]. J Biol Chem, 2013, 288: 10703-10714. DOI:10.1074/jbc.M112.414771 |
| [31] |
Hyun SY, Le HT, Nguyen CT, et al. Development of a novel HSP90 inhibitor NCT-50 as a potential anticancer agent for the treatment of non-small cell lung cancer[J]. Sci Rep, 2018, 8: 13924. DOI:10.1038/s41598-018-32196-6 |
| [32] |
Vorrink SU, Domann FE. Regulatory crosstalk and interference between the xenobiotic and hypoxia sensing pathways at the AhR-ARNT-HIF1α signaling node[J]. Chem Biol Interact, 2014, 218: 82-88. DOI:10.1016/j.cbi.2014.05.001 |
| [33] |
Yu RM, Ng PK, Tan T, et al. Enhancement of hypoxia-induced gene expression in fish liver by the aryl hydrocarbon receptor (AhR) ligand, benzo[α]pyrene (BaP)[J]. Aquat Toxicol, 2008, 90: 235-242. DOI:10.1016/j.aquatox.2008.09.004 |
| [34] |
Li ZD, Liu LZ, Shi X, et al. Benzo[α]pyrene-3, 6-dione inhibited VEGF expression through inducing HIF-1alpha degradation[J]. Biochem Biophys Res Commun, 2007, 357: 517-523. DOI:10.1016/j.bbrc.2007.03.178 |
| [35] |
Hoter A, Rizk S, Naim HY. The multiple roles and therapeutic potential of molecular chaperones in prostate cancer[J]. Cancers (Basel), 2019, 11: 1194. DOI:10.3390/cancers11081194 |
| [36] |
Gong Z, Tasset I, Diaz A, et al. Humanin is an endogenous activator of chaperone-mediated autophagy[J]. J Cell Biol, 2018, 217: 635-647. DOI:10.1083/jcb.201606095 |
| [37] |
Sreedhar AS, Kalmár E, Csermely P, et al. HSP90 isoforms:functions, expression and clinical importance[J]. FEBS Lett, 2004, 562: 11-15. DOI:10.1016/S0014-5793(04)00229-7 |
| [38] |
Li W, Li Y, Guan S, et al. Extracellular heat shock protein-90α:linking hypoxia to skin cell motility and wound healing[J]. EMBO J, 2007, 26: 1221-1233. DOI:10.1038/sj.emboj.7601579 |
| [39] |
Simon MC, Keith B. The role of oxygen availability in embryonic development and stem cell function[J]. Nat Rev Mol Cell Biol, 2008, 9: 285-296. DOI:10.1038/nrm2354 |
| [40] |
Eliopoulos AG, Havaki S, Gorgoulis VG. DNA damage response and autophagy:a meaningful partnership[J]. Front Genet, 2016, 7: 204. |
 2020, Vol. 55
2020, Vol. 55


