2. 中国中医科学院广安门医院, 北京 100053
2. Guang'anmen Hospital of the China Academy of Traditional Chinese Medicine, Beijing 100053, China
溃疡性结肠炎(ulcerative colitis, UC)是一种影响结肠的慢性特发性炎症性疾病, 其发病率在全球范围内逐渐增高。我国和发达国家相比, UC发病率较低, 但近20年来因其就诊人数呈快速上升趋势[1], 故而越来越受大众的重视。UC发病原因复杂, 发病机制尚不明确, 目前认为是免疫功能异常、感染、遗传及环境等因素相互影响的结果, 因此西医以诱导并维持临床缓解以及内镜下缓解为治疗目标, 正在积极研发具有新靶点的药物[2]。中医将其归于“肠澼”、“久痢”、“泄泻”、“痢疾”等范畴, 病因涉及感受外邪、情志内伤、劳倦过度、饮食不节(洁)等。其发病机制是湿热邪滞肠道、脾气亏虚、肠络受损而致里急后重、下痢赤白黏液, 其发病特点是寒热错杂、本虚标实。《诸病源候论·赤白痢候》谓: “然其痢而赤白者, 是热乘于血, 血渗肠内则赤也; 冷气入肠, 搏于肠间, 津液凝滞则白也; 冷热相交, 故赤白相杂。”
李氏溃结方(Lishi-Kuijie decoction, KJF)是广安门医院李华山教授的经验方, 李华山教授结合自身数十年临床经验, 认为UC的辨证分型以脾气虚弱, 兼夹湿热为主。该方由黄芩(HQ)、葛根(GG)、黄连(HL)、党参(DS)、茯苓(FL)、炒白术(BZ)、白扁豆(BBD)、陈皮(CP)、莲子心(LZX)、山药(SY)、桔梗(JG)、砂仁(SR)、甘草(GC)组成, 方中党参、白术、茯苓、甘草补气健脾; 莲子心清心安神; 山药、白扁豆补脾渗湿; 砂仁醒脾; 陈皮健脾和胃, 行气宽中; 葛根升清陌, 止泻利; 黄芩、黄连清里热; 桔梗升清, 宣肺利气, 用以载药上行。该方在临床获得了较好的疗效, 症状缓解明显, 复发率降低。
中药复方具有多成分、多靶点、多途径协同作用的特点, 故而复方的药效物质基础和作用机制尚不明确, 缺乏科学的药效评价体系。网络药理学作为药物研究的新模式, 基于“疾病-基因-靶点-药物”相互作用网络, 系统综合地观察药物对疾病网络的干预与影响, 与中医药整体观、辨证论治的观念不谋而合[3]。基于此, 本研究应用网络药理学的方法, 分析李氏溃结方的药效物质基础和可能的分子机制, 探究该方的多成分、多靶点和多途径的作用机制, 为进一步研究提供思路。
材料与方法李氏溃结方活性成分和相关靶点筛选 分别以“李氏溃结方”所包含药物为检索词, 通过TCMSP (https://lsp.nwu.edu.cn/tcmsp.php)检索其化学成分, 按照口服吸收率(OB≥30%)及类药性(DL≥0.18)作为活性成分筛选条件[4], 并增加Pubmed数据库中未纳入筛选标准、但研究报道有生物活性和药理作用的化合物。其中Pubmed数据库中获得的活性成分通过Drugbank数据库收集靶点。
UC相关靶点预测 以“ulcerative colitis”为检索词, 检索GeneCards数据库(https://www.GeneCards.org/)、DisGeNet数据库(https://www.disgenet.org/)、OMIM数据库(https://www.omim.org), 获取UC相关靶点。应用GeneCards数据库[5]筛选得分大于5的基因; 应用DisGeNet数据库查询来源为CTD-human数据库中的得分大于0.05的基因; 应用OMIM数据库收集UC相关基因, 并通过Uniprot数据库进行标准化。将上述收集到的靶点与李氏溃结方靶点取交集, 即为药物影响疾病的潜在靶点。
药物-成分-疾病-靶点作用网络图 将获得的交集靶点以及药物化合物导入Cytoscape 3.7.2软件[6], 绘制李氏溃结方与UC “药物-成分-疾病-靶点作用网络图”。并使用CytoNCA对网络进行拓扑学性质分析, 分析节点最大中心性(MCC)、连接度(degree)和介数中心性(betweenness)等参数, 并依据degree降序排列。
PPI网络构建 将获得的交集靶点, 通过String 11.0数据库(https://www.string-db.org), 设定物种为“human species”, 选定得分(score)大于0.7绘制蛋白互作图(protein-protein interaction, PPI)。并对所获得的PPI网络, 按相互作用频次分别计数, 绘制“PPI网络蛋白频次条形图”。
Hub网络获取 将由String数据库中获得的网络导入Cytoscape 3.7.2, 使用Compound Spring Embedder (CoSE)创建网络图[7], 设置degree越高的节点越大。并使用cytoHubba插件计算网络中的各节点的MCC值, 选择MCC值最大的前20个节点建立Hub基因网络。
分子对接验证 应用分子对接模拟软件AutoDock对degree≥19的关键药效分子与筛选的12个核心靶点及与UC相关的靶点γ干扰素(interferon-γ, IFN-γ)和转化生长因子β (transforming growth factor-β, TGF-β)进行受体-配体对接模拟计算, 对接运算采用拉马克遗传算法, 对接过程选用半柔性对接, 运行次数为50次, 最大能量评价为2 500 000, 以靶点蛋白相应的配体作为阳性对照。完成全部的对接模拟之后, 根据关键药效分子和核心靶点最低结合能值绘制热图。
GO富集分析与KEGG通路分析 将交集得到的108个靶点, 利用Bioconductor中的R包clusterprofile version 3.12.0, 设定P值小于0.05, 进行GO (gene ontology)富集分析及KEGG富集分析[8], 并应用R语言绘制KEGG富集气泡图, 显示富集最多的前20条通路, 并使用pathview图形化显示KEGG富集结果。
结果 1 李氏溃结方药物-成分-疾病-靶点网络的构建根据OB和DL的界定值, 剔除重复和不符合要求的化合物, 并结合其他文献检索结果, 最终得出149个活性成分, 其中白扁豆、茯苓各1个, 葛根、砂仁各2个, 白术、桔梗各3个化学成分, 陈皮4个, 山药8个, 党参、黄连、莲子心各9个, 黄芩28个, 甘草94个。利用149个化合物与靶点的关系构建药物-成分-疾病-靶点作用网络图(图 1), 并对获得的网络进行拓扑学计算, 结果见表 1。
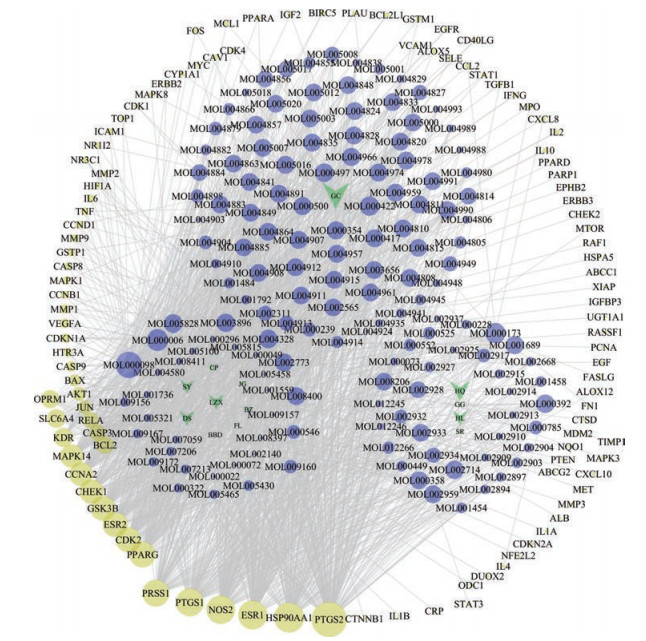
|
Figure 1 Lishi-Kuijie decoction (KJF) drug-compound-disease-target network diagram. The yellow nodes represent intersection targets, the blue nodes represent compounds, the green nodes represent drug |
| Table 1 Drug-compound-disease-target network topology analysis. *The proportion of any two nodes can form the shortest path |
在药物-成分-疾病-靶点相互作用网络中, 共包括270个靶点和1 477条边, 每条边表示化合物和靶点之间的关系。表 2根据化合物degree值降序排列, 从表中可发现槲皮素(MOL000098)具有最高的degree值, 为76;其次是木犀草素(MOL000006)为40;再次是汉黄芩素(MOL000173)为29;山奈酚(MOL000422)为24;川陈皮素(MOL005828)、甘草查尔酮a (MOL000497)各为19。这些degree值较高的关键有效分子可能在李氏溃结方中起着重要的药理作用, 表明这些化合物在李氏溃结方中治疗UC的可能性较大。
| Table 2 Network characteristics of key compound-target network nodes. OB: Oral bioavailability; DL: Drug-likeness; GC: Gancao; HL: Huanglian; LZX: Lianzixin; DS: Dangshen; JG: Jiegeng; HQ: Huangqin; CP: Chenpi; BBD: Baibiandou |
通过GeneCards数据库筛选共得到786个基因; 通过DisGeNet数据库筛选共得到59个基因; 通过OMIM数据库收集UC相关基因1个。将疾病与药物基因取交集后共得到108个交集基因。将108个交集基因导入String 11.0数据库, 共得到节点(number of nodes) 107个, 边(number of edges) 1 108条。在PPI网络中李氏溃结方化合物靶点和UC的靶点交集前30位分别为丝氨酸/苏氨酸蛋白激酶(serine-threonine protein kinase, AKT1)、信号转导与转录激活因子3 (signal transducer and activator of transcription 3, STAT3)和白介素6 (interleukin 6, IL6)等(图 2A)。从这些靶点也可以大致观察出李氏溃结方治疗UC的治疗靶点。图 2A为按照相互作用频次绘制的网络蛋白频次条形图。计算网络中107个节点的MCC值, 并据此筛选Hub基因, 图 2B为前20位Hub基因网络。前12位分别为STAT3、IL6及肿瘤坏死因子(tumor necrosis factor, TNF)等(图 2B)。其中STAT3和IL6在该网络中MCC值最大, 为4 106 935 488。
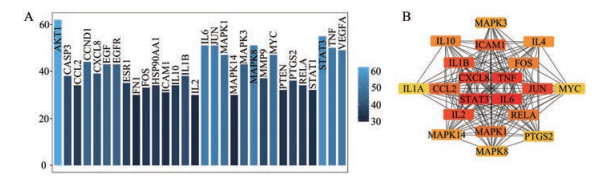
|
Figure 2 Protein-protein interaction (PPI) network of KJF compound targets against ulcerative colitis (UC). A: Top 30 frequency of PPI network of intersection targets; B: Hub gene of PPI |
绘制最低结合能热图, 如图 3所示。其中横坐标为靶蛋白, 纵坐标为李氏溃结方的活性成分及其原有配体, 颜色的深浅代表最低结合能大小。由图可见, 所有分子与靶蛋白的最低结合能均为负数, 结合能越小说明分子与靶点蛋白结合越好。本研究发现分子与靶蛋白的结合能数值大致分布在-1~-7.5 kcal·mol-1, 作为阳性对照的靶点蛋白各自相应配体的结合能数值大致分布在-1.7~-5 kcal·mol-1。由图可知, TNF-α、IL2、MAPK1及RELA对接结果较好, 说明李氏溃结方中化合物与上述靶点蛋白结合较好。表 3列出了靶点蛋白的基本信息。
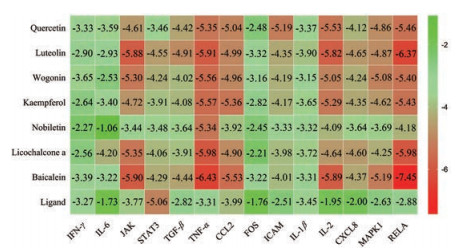
|
Figure 3 Heat map for binding energy of key targets with active ingredients of KJF. The abscissa represents the target protein, the ordinate represents the active ingredient of the KJF and the shade of the color represents the minimum binding energy |
| Table 3 Information on 14 proteins involved in molecular docking |
利用R包clusterprofile共富集出2 371个GO条目, 对前5个分子功能(molecular function, MF)和细胞组成(cellular component, CC)及前15个生物学进程(biological process, BP)进行可视化展示, 如图 4所示。蓝色代表MF, 绿色代表CC, 粉色代表BP。Y轴代表GO条目, X轴代表目标基因集中属于GO的基因数量。在MF中, 细胞因子受体结合、细胞因子活性、激酶调节活性、磷酸酶结合及核受体活性富集排名靠前; 在CC中, 囊泡、膜区、膜微区、膜筏及血管内皮细胞增殖富集排名靠前; 在BP中, 对细菌来源分子的反应、炎症反应的调节、白细胞-细胞黏附的调节富集排名靠前。
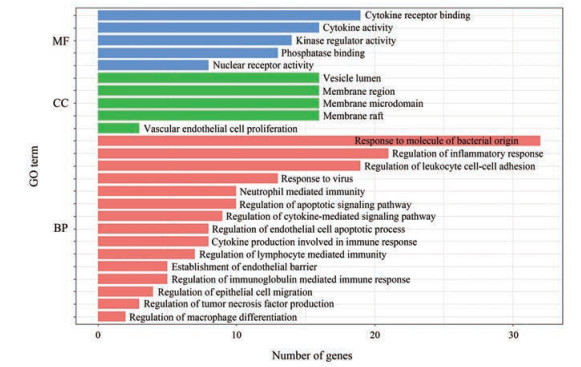
|
Figure 4 GO enrichment of predicted targets of KJF against UC. MF: Molecular function; CC: Cellular component; BP: Biological process |
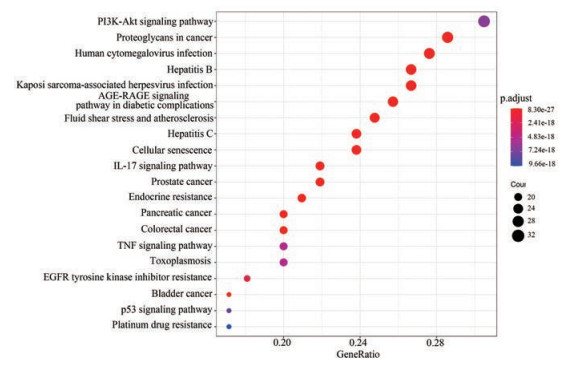
KEGG通路富集共获得155条富集通路, 其中前20条如图 5所示。Y轴代表通路名称, X轴代表KJF靶向基因占背景基因比率, 气泡面积大小代表目标基因集中在KEGG的基因数量, 气泡颜色代表富集显著性。其中与UC有关的包括PI3K-AKT信号通路、肿瘤坏死因子信号通路、NF-kappa B信号通路、JAK-STAT信号通路、NOD样受体信号通路、Toll样受体信号通路、IL-17信号通路及MAPK信号通路等。表明李氏溃结方有效成分可能作用于这些信号通路来达到治疗的目的。经过筛选, 本研究发现李氏溃结方能够靶向炎性肠疾病通路(图 6, KEGG ID: hsa05321, 通过R包Pathview下载, P < 0.000 1)中的大部分靶点(图 6红色部分)。由此推测, 李氏溃结方通过影响与炎症性肠病相关通路, 从而影响UC的发生发展。
|
Figure 5 KEGG pathway enrichment of predicted targets of KJF against UC |

|
Figure 6 Inflammatory bowel disease pathway (KEGG ID: hsa05321) downloaded from R package of Pathview. The red parts represent the protein targeted by compounds |
李氏溃结方具有补益脾气、清热止痢的作用, 在临床上取得了较好的疗效, 但具体作用机制尚不明确。本研究通过网络药理学探究该方治疗UC的潜在作用机制。基于表 2发现, 槲皮素(MOL000098)、木犀草素(MOL000006)、汉黄芩素(MOL000173)、山奈酚(MOL000422)、川陈皮素(MOL005828)、甘草查尔酮a (MOL000497)的degree值远高于其他成分, 表明这些药物成分可能是李氏溃结方治疗UC的主要成分。究其原因, 它们均属于黄酮类化合物。黄酮类化合物在中草药中分布广泛, 并具有抗菌、抗炎及抗氧化功能[9]。有研究表明[10], 山奈酚及槲皮素能够快速清除1, 1-二苯基-2-三硝基苯肼(DPPH)和2, 2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基, 从而有效抑制IL6、IL1β、TNF-α的分泌; Chuanput等[11]研究表明, 随着木犀草素浓度的增加, IL6、IL8、IL1β、TNF-α基因表达降低; 研究[12]发现川陈皮素对iNOS和COX-2抑制作用较明显, 延缓炎症发展, 最终均能起到抗炎作用。
基于PPI及Hub基因网络, 筛选出STAT3、IL6、TNF、CXCL8、IL2、IL1β、ICAM1、CCL2、MAPK1、RELA、JUN及FOS这12个较为关键的靶点, 意味着李氏溃结方可能通过以上靶点治疗UC。分子对接的结果显示, 李氏溃结方中的活性化合物与TNF-α、IL2、MAPK1及RELA结合较好。
肠黏膜免疫异常被认为在UC发病中扮演着重要的角色, 目前认为自身抗体、细胞因子、Toll样受体、黏附分子及细胞凋亡等免疫因素导致UC的发病[13], 此次研究BP结果显示, 李氏溃结方主要作用于白细胞-细胞黏附的调节、凋亡信号通路的调控、中性粒细胞介导免疫等方面。TNF是一种在一定条件下可刺激细胞增殖和诱导细胞分化的细胞因子, IL是细胞因子中最主要的一组淋巴因子, IL6对中性粒细胞和巨噬细胞产生趋化作用, 从而上调免疫反应; IL1β作为IL1的一种促炎因子, 它能增加由巨噬细胞所产生的细胞因子, 使得中性粒细胞向炎症部位聚集, 进入肠道病变部位, 从而引起一系列的肠道病变, 最终造成UC的发病。IL6和IL1β产生协同作用, 血清浓度与炎症分级呈正相关[14]。IL2能刺激单核细胞促进其杀伤作用, 以及增强细胞免疫反应。通过研究发现, 李氏溃结方能够通过其中药成分中的槲皮素、木犀草素、汉黄芩素及山奈酚靶向TNF、IL6、IL2、IL1β, 而这些化合物主要存在于甘草、黄连、黄芩、莲子心、党参及桔梗中, 并且TNF、IL2、IL6及IL1β在炎症性肠病信号通路上都是重要靶点(图 6)。说明李氏溃结方组方合理, 通过上述药物作用于这些靶点及炎症性肠病通路。但是各药物作用于靶点具体是上调或是下调表达作用, 还需要进一步研究。
STAT3是STAT蛋白家族的一员, 通过磷酸化反应被多种细胞因子和生长因子激活(包括干扰素家族、表皮生长因子、IL5、IL6、肝细胞生长因子、LIF白介素6家族细胞因子和骨形态发生蛋白2)。STAT3在细胞刺激下介导对白介素、KITLG/SCF、LEP和其他生长因子反应的信号转导和转录激活剂[15], 在细胞生长和凋亡中起着重要作用。作为炎症反应的调节因子, STAT3二聚体通过LOXL3去乙酰化和氧化赖氨酸残基的作用而被破坏, 并抑制其转录活性, 从而调节初始CD4+ T细胞向辅助性T细胞(Th17)或调节性T细胞(Treg)方向分化, 从而调节炎症反应[16]。通过研究发现, 李氏溃结方中的查尔酮a能够靶向STAT3, 在调节STAT3功能上发挥作用, 从而影响UC的发生发展(图 6)。
MAPK1亦称为ERK2, 是丝裂原活化蛋白激酶(motigen-activated protein kinase, MAPK)家族中的重要一员, 参与了细胞增殖、分化、迁移、衰老和凋亡的过程, 它与免疫系统、消化道系统、心血管系统及肿瘤等多种疾病密切相关[17]。有研究[18]显示, MAPK1在UC模型大鼠的肠黏膜中表达较高, 说明其有可能为启动肠黏膜自我修复的重要靶点。通过研究发现, 李氏溃结方中木犀草素能够靶向MAPK1, 其主要来自于党参、桔梗和莲子心, 这意味着这3味中药可能在肠黏膜自我修复中起到重要作用。
RELA是真核转录因子蛋白家族NF-κB的一个亚单位, 在免疫应答和炎症反应中扮演重要角色。有研究表明, RELA的磷酸化一方面可以促进炎症反应[19], 另一方面它可能抑制了NF-κB调控的炎症反应[20]。这意味着RELA在炎症反应过程中发挥的作用不仅重要且复杂。通过研究发现, 李氏溃结方中7个关键药效分子可与RELA结合的最低结合能数值为-7.45 kcal·mol-1, 并且最低结合能均小于-1.2 kcal·mol-1, 提示李氏溃结方与RELA活性位点结合较强[21], 因此推测李氏溃结方通过作用于RELA, 从而调控RELA的磷酸化, 影响启动子与转录因子的结合, 最终影响炎症过程。
综上所述, 本文应用网络药理学的方法对李氏溃结方治疗UC的分子机制进行探讨, 揭示了中药方剂系统性、整体性的特点, 并为下一步的机制考察提供了依据, 使后续的研究更有针对性。
作者贡献:李华山教授资助并指导本研究, 田瑞设计并进行研究, 田瑞和李宇飞完成了数据的分析, 李莹倩和郑继雯参与了大部分的数据收集, 最终由田瑞完成文章的撰写。
利益冲突:作者声明没有利益冲突。
| [1] |
Wang Y, Ouyang Q. Ulcerative colitis in China:retrospective analysis of 3100 hospitalized patients[J]. J Gastroenterol Hepatol, 2007, 22: 1450-1455. |
| [2] |
Ungaro R, Mehandru S, Allen PB, et al. Ulcerative colitis[J]. Lancet, 2017, 389: 1756-1770. |
| [3] |
Zhang YQ, Li S. Network pharmacology and the development of modern research of traditional Chinese medicine[J]. Chin J Pharmacol Toxicol, 2015, 29: 883-888. |
| [4] |
Ru J, Li P, Wang J, et al. TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6: 13. |
| [5] |
Stelzer G, Rosen N, Plaschkes I, et al. The GeneCards suite:from gene data mining to disease genome sequence analyses[J]. Curr Protoc Bioinformatics, 2016, 54: 1-30. |
| [6] |
Otasek D, Morris JH, Boucas J, et al. Cytoscape automation:empowering workflow-based network analysis[J]. Genome Biol, 2019, 20: 185. |
| [7] |
Dogrusoz U, Giral E, Cetintas A, et al. A layout algorithm for undirected compound graphs[J]. Information Ences, 2009, 179: 980-994. |
| [8] |
Yu G, Wang LG, Han Y, et al. ClusterProfiler:an R package for comparing biological themes among gene clusters[J]. OMICS, 2012, 16: 284-287. |
| [9] |
Wang TY, Li Q, Bi KS. Bioactive flavonoids in medicinal plants:structure, activity and biological fate[J]. Asian J Pharm Sci, 2018, 13: 12-23. |
| [10] |
Lee KJ, Oh YC, Cho WK, et al. Antioxidant and anti-inflammatory activity determination of one hundred kinds of pure chemical compounds using offine and online screening HPLC assay[J]. Evid Based Complement Alternat Med, 2015, 2015: 1-13. |
| [11] |
Chanput W, Krueyos N, Ritthiruangdej P. Anti-oxidative assays as markers for anti-inflammatory activity of flavonoids[J]. Int Immunopharmacol, 2016, 40: 170-175. |
| [12] |
Chen XM, Tait AR, Kitts DD. Flavonoid composition of orange peel and its association with antioxidant and anti-inflammatory activities[J]. Food Chem, 2017, 218: 15-21. |
| [13] |
Han Y, Ma TM, Lu ML, et al. Role of moxibustion in inflammatory responses during treatment of rat ulcerative colitis[J]. World J Gastroenterol, 2014, 20: 11297-11304. |
| [14] |
Faghfoori Z, Navai L, Shakerhosseini R, et al. Effects of an oral supplementation of germinated barley foodstuff on serum tumour necrosis factor, interleukin-6 and -8 in patients with ulcerative colitis[J]. Ann Clin Biochem, 2011, 48: 233-237. |
| [15] |
Shen S, Niso-Santano M, Adjemian S, et al. Cytoplasmic STAT3 represses autophagy by inhibiting PKR activity[J]. Mol Cell, 2012, 48: 667-680. |
| [16] |
Ma L, Huang C, Wang XJ, et al. Lysyl oxidase 3 is a dual-specificity enzyme involved in STAT3 deacetylation and deacetylimination modulation[J]. Mol Cell, 2017, 65: 296-309. |
| [17] |
Sun Y, Liu WZ, Liu T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35: 600-604. |
| [18] |
Zhu XD, Duan YQ, Wang Y, et al. Influence of Tongxie Yao Fang on ERK1 and ERK2 gene expressions of colonic mucosa in rats with ulcerative colitis[J]. J Nanjing Univ TCM (南京中医药大学学报), 2013, 29: 347-350. |
| [19] |
Chen LY, Pan WW, Chen M, et al. Synergistic induction of inflammation by bacterial products lipopolysaccharide and fMLP:an important microbial pathogenic mechanism[J]. J Immunol, 2009, 182: 2518-2524. |
| [20] |
Reber L, Vermeulen L, Haegeman G, et al. Ser276 phosphorylation of NF-κB p65 by MSK1 controls SCF expression in inflammation[J]. PLoS One, 2009, 4: e4393. |
| [21] |
Song HX, Ma XR, Wang DF, et al. Potential mechanism of Huangqin decoction for the treatment of ulcerative colitis based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2020, 55: 247-255. |
 2020, Vol. 55
2020, Vol. 55


