人类巨细胞病毒(human cytomegalovirus, HCMV)属于疱疹病毒β亚家族, 全长约230 kb, 是一种常见且重要的病原体, 在人群中感染率较高。HCMV具有与其他疱疹病毒类似的持续性感染和潜伏-活化的特性。在免疫功能健全的个体中, HCMV的感染通常表现为隐性[1]。然而, 在免疫功能低下或免疫缺陷的个体中(例如移植受者), 易出现HCMV再激活感染[2], 最常表现为间质性肺炎等[3], 损伤患者呼吸系统, 最终导致死亡。
HCMV感染后, 此类患者需长期进行抗病毒防治, 使得病毒耐药也日趋严重, 目前临床常用的抗HCMV药物是更昔洛韦(ganciclovir, GCV)、膦甲酸(fosarnet, FOS)和西多福韦(cidofovir, CDV), 三者作用模式类似, 能够靶向病毒DNA聚合酶, 在多个环节抑制病毒DNA的复制[4]。但随着临床的广泛应用, 骨髓抑制、肾脏损害[5]等不良反应和耐药[6]病毒株开始出现, 并出现三者的交叉耐药, 因此迫切需要开发不同作用机制的新一代药物来治疗HCMV感染。
青蒿琥酯(artesunate, ART)是一种衍生自天然产物青蒿素的半合成化合物, 通常用于治疗严重疟疾。ART和其衍生物在体外和体内均表现出多种抗病毒活性[7]。Zeng等[8]研究发现ART对HCMV标准株及耐药株均有明显抗病毒效应。此外, 青蒿琥酯还具有调节免疫的功能, 可通过影响细胞因子, 对百草枯所致的肺损伤大鼠的肺组织显示出保护作用[9]。目前对于ART在抗CMV病毒感染方面的研究主要局限在体外及少数病例研究, 对于其体内感染作用及肺组织损伤机制研究的相关报道较少。
巨细胞病毒物种基本上存在于所有哺乳动物宿主物种中, 而不同种属的宿主之间具有不同的巨细胞病毒种类[10], 这导致巨细胞病毒之间存在严格的种属特异性[11]。小鼠巨细胞病毒(murine cytomegalovirus, MCMV)感染小鼠模型是目前对于HCMV感染研究最多的动物模型, 这主要是由于MCMV感染小鼠后所引起的临床表现及相应的致病机制与HCMV感染后具有相似的特征。本实验室成功建立了MCMV-GFP (green fluorescent protein)感染小鼠肺炎模型。本研究主要探索青蒿琥酯对MCMV感染小鼠病毒性肺炎的作用, 并进一步研究了其作用机制及主要参与的信号通路, 为青蒿琥酯在临床的应用提供了理论基础。
材料与方法实验动物 5~6周龄SPF (specific pathogen free)级BALB/c nude小鼠125只, 雌性(广州晴乐有限公司)。生产许可证号SCXK (京) 2019-0010, 使用许可证号SYXK (粤) 2016-0168。小鼠饲养于独立送风隔离笼具系统内。
试剂 小鼠3T3细胞(美国ATCC细胞库); MCMV-GFP病毒株由武汉病毒所(罗敏华教授课题组)提供; 青蒿琥酯(广州鼎国有限公司, 浓度≥99%); 小鼠白细胞介素6 (interleukin 6, IL-6)、IL-10和肿瘤坏死因子α (tumor necrosis factor α, TNF-α)的ELISA (enzyme-linked immunosorbent assay)试剂盒(欣博盛生物制品有限公司); 红细胞裂解液(英潍捷基有限公司); 两步法反转录试剂盒(TaKaRa公司); NF-κB (nuclear factor-κB) p65、phospho-NF-κB p65和GAPDH (glyceraldehyde-3-phosphate dehydrogenase)抗体(CST公司); 辣根酶标记二抗(中杉金桥公司); 引物(广州擎科技术有限公司合成)。
仪器 Dmi8荧光倒置显微镜(德国Leica公司); LightCycler480Ⅱ荧光定量PCR仪(瑞士Roche公司); 酶标仪(德国Berthold公司); 凝胶电泳仪(美国Bio-Rad公司); Amersham Imager 600量化成像分析流式细胞仪(美国GE公司); LSM880超高分辨率激光共聚焦显微镜(德国ZEISS公司)。
药物配制 称取60 mg青蒿琥酯, 用适量5%碳酸氢钠将青蒿琥酯溶解, 配置成0.02 mol·L-1浓度的贮备液, 每只小鼠腹腔注射0.2 mL, 按照体重加入蒸馏水稀释到所需终浓度(60、120和240 mg·kg-1)。将配好的药物溶液置37 ℃水浴锅备用。
MCMV感染小鼠肺炎模型制备及药效研究 将小鼠分为5组, 分别为空白对照组、MCMV感染组和青蒿琥酯(60、120和240 mg·kg-1)剂量组, 每组15只, 将各组小鼠用乙醚轻度麻醉, 空白对照组以0.06 mL生理盐水滴鼻, 其余各组以0.06 mL生理盐水溶解的MCMV病毒液滴鼻。于感染当天开始腹腔注射给药, 每只腹腔注射0.2 mL, 隔天1次, 正常对照组、MCMV感染组在同等条件下注射等量生理盐水。各组分别在感染后第3、7和21天摘眼球放血致死, 采集全肺, 取左肺大叶组织做肺组织石蜡切片, 右肺保存于-80 ℃冰箱里用于后续实验。
小鼠体重变化图及生存曲线绘制 将小鼠随机分为5组, 分别为空白对照组、MCMV感染组和青蒿琥酯60、120和240 mg·kg-1剂量组, 每组10只。按上述方法造模后, 隔天记录小鼠体重和存活等状况, 通过GraphPad Prism 7.0软件绘制生存曲线。
肺组织病理切片 取感染第21天的各组小鼠的左肺大叶组织, 于前、中、后切面各取2张进行HE染色, 于倒置荧光显微镜下观察肺部炎症情况。
免疫荧光检测肺组织病毒载量 取感染第3天的各组小鼠的左肺大叶组织石蜡切片, 避光操作, 0.3% Triton X-100通透5 min, 5% BSA (bovine serum albumin)室温封闭1 h, 再加入GFP一抗(按1:50比例稀释), 4 ℃孵育过夜, PBS (phosphate buffered saline)洗3次, 每次10 min, 加入荧光二抗(按1:1 000比例稀释), 室温避光孵育1 h, PBS洗3次, DAPI (4', 6-diamidino-2-phenylindole)染色5 min, PBS洗3次, 滴加抗荧光淬灭剂, 于共聚焦显微镜下观察GFP荧光来检测病毒在肺部的表达情况。
荧光定量PCR检测肺部主要即刻早期基因1 (major immediate early 1, Mie1)的表达 各组取同等重量的右肺组织匀浆, 用Trizol法提取肺组织总RNA, 利用逆转录试剂盒将RNA逆转为cDNA, 进行荧光定量PCR, 以Gapdh作为内参基因, 检测Mie1的表达。Mie1引物:上游5'-TGAGGTGACCCGCATCCCAGTG-3', 下游5'-CGAGGAGCAGTGCCAGAAGAAGC-3'; Gapdh引物:上游5'-TGCACCACCAACTGCTTAGC-3', 下游5'-GGCATGGACTGTGGT-CATGAG-3'。
ELISA法检测炎症因子 收集各组小鼠肺组织匀浆上清, 于4 ℃、3 000 r·min-1离心10 min, 收集上清, 于-80 ℃保存。按ELISA试剂盒说明书检测炎症因子IL-10、TNF-α和IL-6的含量。
Western blot法检测肺组织炎症信号通路NF-κB p65 取各组小鼠同等重量的右肺组织匀浆, 按照20 mL·g-1加入含1 mg·L-1 PMSF (phenylmethanesulfonyl fluoride)的RIPA (radio immunoprecipitation assay)裂解液, 经过组织破碎仪破碎60 s后, 4 ℃、12 000 r·min-1离心10 min。取上清于1.5 mL离心管中, 通过BCA (bicinchoninic acid)法进行蛋白定量, 加入5×SDS上样缓冲液, 100 ℃煮沸10 min进行蛋白变性, 按照每孔30 μg进行蛋白上样。
统计学处理 数据采用GraphPad Prism 7软件进行统计分析, 多组间比较采用单因素方差分析, 实验数据以x±s表示。
结果 1 青蒿琥酯对MCMV感染小鼠体重及生存期的影响由体重变化图及生存曲线图可以看出(图 1), MCMV感染16天后, 模型组小鼠体重呈现下降趋势, 在第25天开始出现死亡, 大部分小鼠在第27天左右死亡。青蒿琥酯给药后, 小鼠体重下降减缓, 死亡数较MCMV感染组降低, 存活天数增加, 生存期延长。在感染后第40天时, 根据生存曲线图可以看出, 青蒿琥酯(120 mg·kg-1)剂量组的死亡保护作用优于青蒿琥酯(60和240 mg·kg-1)剂量组。
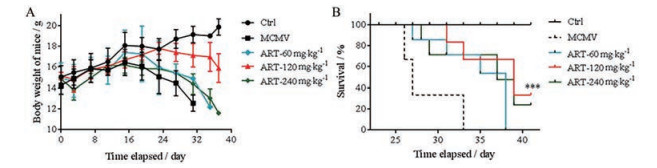
|
Figure 1 Effects of artesunate (ART) on weight and mortality of murine cytomegalovirus (MCMV) infected mice. A: Body weight change was monitored following infection for 40 days. Median with interquartile range of 10 mice per experimental group; B: Survival time of mice was recorded over 40 days. n = 10, x±s. ***P < 0.001 vs MCMV group. Ctrl: Control |
在感染后第21天, 进行小鼠肺部组织HE染色, 于光镜下观察发现, 空白对照组小鼠肺组织结构完整, 肺泡壁厚度正常, 肺泡腔内无炎性细胞浸润。而MCMV感染组小鼠肺组织出现典型间质性肺炎特征, 肺泡壁增宽, 血管充血, 有炎症细胞浸润, 肺泡腔结构破坏。青蒿琥酯治疗组与MCMV感染模型组小鼠相比, 肺组织病变有所改善, 肺泡腔水肿及炎症减轻。青蒿琥酯(120 mg·kg-1)剂量组对肺部炎症的改善效果优于青蒿琥酯(60和240 mg·kg-1)剂量组(图 2)。

|
Figure 2 Hematoxylin-eosin (HE)-stained sections of MCMV infected-mice lungs at 21 days post-infection compared to the phosphate buffered saline (PBS)-infected mice lungs. A: Control group; B: MCMV group; C: ART group (60 mg·kg-1); D: ART group (120 mg·kg-1); E: ART group (240 mg·kg-1). Scale bar: 200 μm |
正常小鼠未被感染时肺组织内无病毒载量表达; MCMV-GFP滴鼻法感染小鼠后, 病毒在小鼠肺部组织细胞内复制并表达GFP荧光。对肺组织切片进行特异性GFP荧光染色, 结果表明, 与空白组相比, MCMV肺炎模型组GFP表达量明显上升; 给予青蒿琥酯治疗, 青蒿琥酯(120和240 mg·kg-1)剂量组在感染后各时间点病毒载量均显著低于同时间点MCMV模型组, 肺部GFP荧光明显减少。与MCMV肺炎模型组相比, 青蒿琥酯(120和240 mg·kg-1)剂量组的MCMV Mie1 mRNA的表达量明显降低, 差异有统计学意义。以上实验结果均提示青蒿琥酯可以抑制感染小鼠肺部MCMV的复制(图 3)。

|
Figure 3 Effects of ART on MCMV replication in lung tissues. Mice were infected with MCMV-GFP. After treatment for 3 days with artesunate, lung sections were stained for MCMV-expressed GFP (green in the merge images). Nuclei were stained with DAPI (blue). Scale bar: 50 μm. A: Control group; B: MCMV group; C: ART group (60 mg·kg-1); D: ART group (120 mg·kg-1); E: ART group (240 mg·kg-1); F: Immune fluorescence identification of mice lungs was analyzed; G: The expression of Mie1 mRNA in lung tissues of MCMV-infected mice. n = 5, x±s. ##P < 0.01, ####P < 0.000 1 vs control; *P < 0.05, **P < 0.01, ***P < 0.001 vs MCMV group. GFP: Green fluorescent protein; DAPI: 4', 6-Diamidino-2-phenylindole; Mie1: Major immediate early 1 |
MCMV感染小鼠肺组织后, 肺部多种炎症细胞在肺组织聚集, 释放多种炎症因子如IL-6和TNF-α等炎性介质(图 4)。在感染后第3天, 与空白对照组相比, MCMV肺炎模型组肺上清中促炎因子IL-6和TNF-α显著升高, IL-10分泌明显降低; 与MCMV肺炎模型组相比, 青蒿琥酯(120和240 mg·kg-1)组IL-10分泌明显升高, 对肺组织具有保护作用, 120 mg·kg-1剂量组的IL-6和TNF-α水平明显低于同时间MCMV组, 且感染后各时间点120 mg·kg-1剂量组的表达量均低于120和240 mg·kg-1剂量组, 表明120 mg·kg-1剂量对炎症因子具有更强的抑制作用。在感染后第7天, 各组IL-6和TNF-α水平无显著性差异。
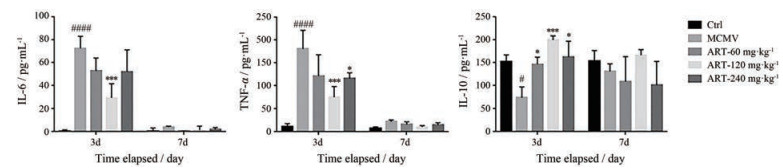
|
Figure 4 Effects of ART on inflammatory factors in lung tissues. The expression levels of interleukin 10 (IL-10), tumor necrosis factor α (TNF-α), and IL-6 in lung supernatants were measured by enzyme-linked immunosorbent assay (ELISA). n = 5, x±s. #P < 0.05, ####P < 0.000 1 vs control; *P < 0.05, ***P < 0.001 vs MCMV group |
由图 4可知, 青蒿琥酯可以调控IL-6和TNF-α炎症因子, 这些炎症因子可以激活NF-κB信号通路, 造成肺损伤。由于青蒿琥酯(60、120和240 mg·kg-1)剂量组在感染后第7天对炎症因子的影响不显著, 本实验只选用感染第3天肺组织进行检测。通过Western blot方法检测炎症信号通路NF-κB蛋白的表达, 结果发现, 与空白对照组相比, MCMV模型组肺组织中p-NF-κB蛋白表达明显升高; 青蒿琥酯处理后, 青蒿琥酯(120和240 mg·kg-1)剂量组p-NF-κB蛋白表达降低。青蒿琥酯可能通过抑制NF-κB信号通路的激活, 减轻MCMV感染性肺炎(图 5)。

|
Figure 5 Expression of nuclear factor-kappa B (NF-κB) and phospho-NF-κB (p-NF-κB) in MCMV-infected mice lungs after ART treatment (60, 120, and 240 mg·kg-1) were detected. Representative Western blot images of NF-κB and p-NF-κB were presented and analyzed. n = 5, x ± s.*P < 0.05, **P < 0.01 vs MCMV group. GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
HCMV作为一种双链DNA病毒, 在免疫功能正常患者中无明显临床症状。在免疫缺陷的宿主中, HCMV具有较高的致病力, 最终造成多种器官疾病[12]。青蒿素类药物, 尤其是青蒿琥酯对双链DNA疱疹病毒具有强抑制作用。研究表明HCMV可以诱导宿主中NF-κB和Sp1 (specificity protein-1)转录因子的DNA结合[13]。此外, 青蒿琥酯在肺部疾病的研究中呈现多种药理效应, 其可通过影响细胞因子水平影响肺部炎症进程, 对肺组织显示出保护作用[9]。青蒿琥酯的这些抗炎作用可能是通过抑制NF-κB活性从而抑制辅助性T (T helper, Th)-1和Th-17细胞因子, 与干扰素-γ和TNF-α表达水平密切相关。NF-κB是免疫和炎症反应的关键调节剂, IL-6、IL-10和TNF-α等相关炎症因子在炎症中发挥重要作用, 细胞因子的转录表达可以由激活的NF-κB调控[14, 15]。
本研究通过小鼠鼻腔滴入MCMV构建小鼠肺炎模型, 腹腔注射青蒿琥酯给药, 病理学结果显示, MCMV感染的小鼠肺部出现间质性肺炎特征, 小鼠肺部病毒基因及MCMV-GFP蛋白表达均明显增加, 说明成功建立小鼠MCMV感染肺炎模型。在MCMV感染3天后发现, 使用不同浓度青蒿琥酯给药组处理后, 相关促炎因子IL-6和TNF-α降低, 抗炎因子IL-10升高; 相比青蒿琥酯(60和240 mg·kg-1)剂量组, 青蒿琥酯(120 mg·kg-1)剂量组效果最为明显, 肺泡充血明显减轻, 肺泡结构较完整。此外, 青蒿琥酯对NF-κB信号通路的激活具有抑制作用, 青蒿琥酯(120 mg·kg-1)剂量组明显降低NF-κB的磷酸化。研究表明, 青蒿琥酯给药后小鼠肺部炎症均有改善, 生存期得到延长, 最终达到明显的抗病毒性肺炎的作用。
有研究证明, 在炎症早期, 巨噬细胞会极化为M1巨噬细胞, 可以释放多种趋化因子和炎性细胞因子, 而在炎症晚期巨噬细胞极化为M2巨噬细胞, 通过分泌高浓度抗炎因子IL-10来缓解炎症反应, 加速组织修复[16]。青蒿琥酯调节炎症因子TNF-α、IL-6和IL-10的表达, 其调节机制与NF-κB信号通路有关, 这可能是通过减轻炎性细胞在肺内的聚集来发挥一定的抗炎作用。通过调节相关炎症信号通路及其伴随的炎症反应, 使机体的免疫功能得以恢复, 后续工作将对青蒿琥酯抗炎的免疫调节机制进行深入研究。
作者贡献:王萍负责实验设计、实验研究、采集与统计分析数据和文章撰写; 陈盛、黄小桃、肖小梅和湛青平负责实验研究和采集数据; 秦爱萍负责实验设计和指导, 对文章的知识性内容进行审阅; 余细勇负责指导和对文章的知识性内容进行审阅并提供研究经费。
利益冲突:所有作者均声明没有利益冲突。
| [1] |
Lumbreras C, Manuel O, Len O, et al. Cytomegalovirus infection in solid organ transplant recipients[J]. Clin Microbiol Infect, 2014, 20: 19-26. |
| [2] |
Naing ZW, Scott GM, Shand A, et al. Congenital cytomegalovirus infection in pregnancy:a review of prevalence, clinical features, diagnosis and prevention[J]. Aust N Z J Obstet Gynaecol, 2016, 56: 9-18. DOI:10.1111/ajo.12408 |
| [3] |
Ebisutani C, Kawamura A, Shibata N, et al. Gastric ulcer associated with cytomegalovirus in an immunocompetent patient:method for diagnosis[J]. Case Rep Gastroenterol, 2012, 6: 365-368. DOI:10.1159/000339714 |
| [4] |
LI J, Liu XY, Zhan P. Advances in human cytomegalovirus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 585-596. |
| [5] |
Mareri A, Lasorella S, Iapadre G, et al. Anti-viral therapy for congenital cytomegalovirus infection:pharmacokinetics, efficacy and side effects[J]. J Matern Fetal Neonatal Med, 2016, 29: 1657-1664. DOI:10.3109/14767058.2015.1058774 |
| [6] |
Hakki M, Chou S. The biology of cytomegalovirus drug resistance[J]. Curr Opin Infect Dis, 2011, 24: 605-611. DOI:10.1097/QCO.0b013e32834cfb58 |
| [7] |
Flobinus A, Taudon N, Desbordes M, et al. Stability and antiviral activity against human cytomegalovirus of artemisinin derivatives[J]. J Antimicrob Chemother, 2014, 69: 34-40. DOI:10.1093/jac/dkt346 |
| [8] |
Zeng AH, Ouyang Y, Guo MM, et al. Antiviral activity research of artesunate against human eytomegalovirus by fractionation dosage method in vitro[J]. Chin J Appl Clin Pediatr (中华实用儿科临床杂志), 2014, 29: 1703-1707. |
| [9] |
Luo Q, Lin J. Research progress of artesunate in lung diseases[J]. Chin J Respir Crit Care Med (中国呼吸与危重监护杂志), 2015, 14: 611-614. |
| [10] |
Redwood AJ, Shellam GR, Smith LM. Molecular evolution of murine cytomegalovirus genomes[M]//Reddehase MJ. Cytomegaloviruses: From Molecular Pathogenesis to Intervention (Vol.1). Norfolk: Caister Academic Press, 2013: 23-37.
|
| [11] |
Ostermann E, Pawletko K, Indenbirken D, et al. Stepwise adaptation of murine cytomegalovirus to cells of a foreign host for identification of host range determinants[J]. Med Microbiol Immunol, 2015, 204: 461-469. DOI:10.1007/s00430-015-0400-7 |
| [12] |
Boppana SB, Britt WJ. Synopsis of clinical aspects of human cytomegalovirus disease[M]//Reddehase MJ. Cytomegaloviruses: From Molecular Pathogenesis to Intervention (Vol.2). Norfolk: Caister Academic Press, 2013: 1-25.
|
| [13] |
Schreiber A, Härter G, Schubert A, et al. Antiviral treatment of cytomegalovirus infection and resistant strains[J]. Expert Opin Pharmacother, 2009, 10: 191-209. DOI:10.1517/14656560802678138 |
| [14] |
Suzuki A, Hanada T, Mitsuyama K, et al. CIS3/SOCS3/SSI3 plays a negative regulatory role in STAT3 activation and intestinal inflammation[J]. J Exp Med, 2001, 193: 471-481. DOI:10.1084/jem.193.4.471 |
| [15] |
Kim SJ, Kim HM. Dynamic lipopolysaccharide transfer cascade to TLR4/MD2 complex via LBP and CD14[J]. BMB Rep, 2017, 50: 55-57. DOI:10.5483/BMBRep.2017.50.2.011 |
| [16] |
Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation[J]. Nat Rev Immunol, 2008, 8: 958-969. DOI:10.1038/nri2448 |
 2020, Vol. 55
2020, Vol. 55


