2. 河北鑫民和质检技术服务有限公司, 河北 安国 071200
2. XinMinHe Testing(HeBei) Co. Ltd., Anguo 071200, China
动脉粥样硬化(atherosclerosis, AS)以血管内膜下纤维斑块或粥瘤为其典型特征, 主要累及大、中动脉, 受累动脉内膜先后发生脂质聚集、纤维增生及钙质沉淀, 导致血管壁增厚和硬化的一个渐进性过程[1]。AS作为冠心病发病的独立危险因素, 一直以来受到广泛关注[2]。临床上常采取他汀类等降血脂药物治疗AS, 但临床数据显示, 他汀类药物具有较强的肌毒性, 且与其他药物联用时横纹肌溶解的发生率大幅提升[3]。因此, 研究开发新型治疗动脉粥样硬化药物具有重要意义。
黄精Polygonati rhizoma.为百合科植物滇黄精Polygonatum kingianum Coll. Et Hemsl.、黄精Polygonatum sibiricum Red.或多花黄精Polygonatum cyrtonema Hua的干燥根茎。黄精最早见于晋代陶弘景的《名医别录》, 黄精性甘、平, 质滋润, 归肾、脾、肺经, 用于治疗阴虚燥咳、唠嗽久咳、脾胃虚弱、肾精亏虚、腰膝酸软等证。现代药理研究表明, 黄精具有增强免疫功能、降低血脂、保护心肌细胞、调节血糖及抗肿瘤等作用[4]。近年研究指出, 黄精通过降低血清中氧化应激标记物及炎性因子的水平发挥治疗AS的作用, 通过调节血栓素及组织纤溶酶原的水平抑制血小板活动进而改善AS病程[5]。此外, 李友元等[6]研究发现, 黄精化学成分可通过调节血脂代谢, 保护动脉血管发挥抗AS的药效。以上研究结果表明黄精治疗AS的疗效确切, 但目前研究多从单一成分或单一通路阐释黄精治疗AS的作用机制, 并且主要停留在动物层面, 无法以整体性及系统性的角度阐释黄精治疗AS的作用模式。因此本研究旨在运用网络药理学技术, 构建“成分-靶点-通路-疾病”多维网络, 阐释黄精抗AS的生物学机制, 为黄精临床试验研究及产品开发提供科学依据[7]。本研究的思路流程图见图 1。
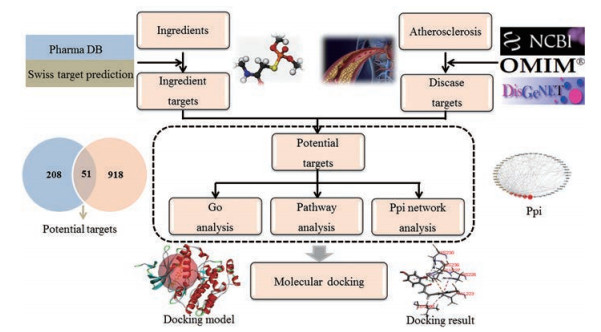
|
Figure 1 Flow chart of research |
黄精化学成分的获取 本研究利用中药化学成分数据库(Traditional Chinese Medicine Database, TCMD 2009)和中药系统药理学数据库TCMSP (http://lsp.nwu.edu.cn/tcmsp.php), 以黄精为关键词检索获得黄精全部成分, 去重并校正, 以口服利用度(oral bioavailability, OB)≥30%且类药性指数(drug like index, DL)≥0.18作为筛选条件, 获取黄精的活性成分用于后续研究[8]; 并通过文献检索获取黄精活性成分, 补充上述数据库检索结果。
黄精化学成分反向找靶研究 利用Discovery Studio 4.0 (DS 4.0)对黄精成分进行预处理。通过Minimize ligands模块在CHARMm力场下采用最陡下降法和共轭梯度法相结合的能量优化算法, 对成分进行能量最小化分析。随后对分子进行多构象的生成, 选择BEST模式, 从而生成黄精成分三维结构数据库, 基于PharmaDB数据库(共2 676个靶点, 5 780个晶体结构的基于受体结构的药效团模型)进行黄精活性成分的反向找靶研究, 搜索方式选择柔性搜索, 以匹配打分值(已归一化, 即完全匹配打分值最高为1) 0.9为截断值, 获得其作用靶点。同时基于Swiss TargetPrediction数据库预测黄精潜在作用靶点, 设置Probability≥0.9, 获得预测结果。将PharmaDB数据库及Swiss TargetPrediction数据库靶点预测结果取并集, 最终获得黄精潜在作用靶点集。
黄精抗AS潜在作用靶点研究 在人类基因和基因表型数据库OMIM (http://www.omim.org/)、疾病相关的基因与突变位点数据库DisGeNET (http://disgenet.org/)及NCBI基因数据库(https://ncbi.org/)中以“atherosclerosis”为关键词进行检索, 获得AS相关的疾病靶点。将黄精潜在作用靶点与AS疾病靶点取交集, 最终获得黄精抗AS的潜在作用靶点。
药物-疾病靶点网络构建 将黄精治疗AS的潜在作用靶点导入STRING (http://string-db.org)平台中获得靶点之间的相互作用关系, 物种选择“homo sapiens”, 构建蛋白-蛋白相互作用(PPI)网络模型。将建立的蛋白相互作用关系导入Cytoscape 3.6.1中进行可视化分析并进行筛选, 去除孤立点、重复边和自环边, 取最大连通子图, 最终获得黄精抗AS的蛋白互作网络。
关键靶点、基因功能富集分析与通路分析 利用cytoHubba插件, 计算黄精抗AS蛋白互作网络中各节点的度值(degree), 度值的大小表示对应节点在网络中的关键度[9], 选取度值较高的靶点作为黄精抗AS的关键靶点。Clue GO[10]是一种基因富集工具, 常用于网络药理学的研究中。本文采用Clue GO中的biological process、molecular function、cellular component, 从生物过程、分子功能以及细胞构成3个方面对黄精抗AS的潜在作用靶点进行GO富集分析, 使用Clue GO中KEGG对黄精抗AS中潜在作用靶点进行通路分析[11]。在Clue GO的基因列表面板中输入靶点的基因ID, 同时为所提交的靶点列表选择对应的物种“homo sapiens”, 选择“P≤0.05”表示差异具有统计学意义[12], 获得GO功能富集分析与通路分析结果。
关键靶点分子对接验证 利用Discovery Studio 4.0软件构建关键靶点的分子对接模型, 进而与黄精成分及抗AS阳性药分子进行分子对接, 分析对接结果从而验证网络分析结果的可靠性。首先在Protein Database (https://www.rcsb.org/)数据库下载黄精治疗AS的关键靶点的蛋白晶体结构, 选择解析度小于3Å并具有配体的蛋白复合物, 以保证对接的精度[13]。采用DS 4.0中Clean Protein工具对PDB中下载的蛋白进行预处理, 根据PDB晶体的原配体的空间位置定义活性口袋, 将Conformation Method参数设置为“BEST”, Docking Preferences参数设置为“High Quality”, 其余参数为默认。将原配体抽出后重新对接到蛋白的活性口袋中, 根据对接后的配体分子与原配体分子的均方根偏差(root-mean-square deviation, RMSD)大小判断对接程序参数设置的合理性以及对该晶体复合物的实用性, 一般认为当RMSD≤2 Å时说明分子对接模型能够较好地重现原配体与蛋白的结合模式, 对接结果有较高的可靠性。随后, 将黄精潜在活性成分及抗AS阳性药分子导入DS 4.0中进行分子对接, 计算对接打分值(-CDOCKER ENERGY)。当-CDOCKER ENERGY值高于原配体时, 可认为成分与靶标具有较高的结合活性, 以此作为标准对分子对接结果进行评价, 并与阳性药分子对比分析对接结果。
结果 1 黄精化学成分及反向找靶研究本研究基于TCMD和TCMSP数据库收集整理获得黄精有效成分, 并以口服利用度及类药性指数筛选得到45个成分, 其中苯丙素类4个、黄酮类14个、糖类4个、有机酸类4个、甾体类3个、皂苷类14个、其他类成分2个。通过文献检索获得黄精活性成分为:黄精多糖、薯蓣皂苷、甘草素、丁香脂素和鹅掌楸碱。将上述成分与数据库检索结果比对, 结果发现上述成分已包含于数据库检索获得的45个成分中。分别以匹配值0.9及Probability值0.9截取PharmaDB和Swiss TargetPrediction数据库的黄精作用靶点预测结果, 分别获得193和63个人源靶点, 将两个数据库获得的人源靶点进行汇总并去除重复靶点, 最终获得与黄精化学成分相关的208个人源靶点。将同一成分的靶点匹配值进行加和, 加和值排在前10的黄精化学成分信息见表 1。
| Table 1 Part of Polygonati rhizoma chemical constituents |
通过反向找靶研究, 获得打分值大于0.9的黄精潜在作用靶点208个。在OMIM、DisGeNET和NCBI基因数据库中, 以“atherosclerosis”为关键词进行检索, 分别获得202、52和847个人源靶点, 将3个数据库获得人源靶点汇总后并去除重复靶点, 最终获得与AS相关的918个人源靶点。将黄精成分作用的208个潜在作用靶点映射到918个AS疾病靶点集中, 最终获得黄精抗AS的潜在作用靶点为51个, 见图 2。靶点详细信息, 见表 2。

|
Figure 2 Venn diagram of targets of Polygonati rhizoma and atherosclerosis |
| Table 2 Potential targets of Polygonati rhizoma for the treatment of atherosclerosis |
基于STRING平台获取黄精抗AS潜在作用靶点间的蛋白互作信息, 并在Cytoscape中进行可视化, 得到黄精抗AS蛋白互作网络如图 3所示。该网络包含47个节点, 171条边, 其中节点代表黄精抗AS的潜在作用靶点, 节点越大表明其度值越高, 边为潜在作用靶点间的相互作用关系。
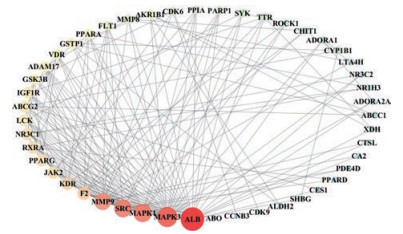
|
Figure 3 Protein-protein interaction network of Polygonati rhizoma for the treatment of atherosclerosis. The larger the node, the higher the centrality of the node degree |
利用度中心性筛选蛋白互作网络中的关键靶点, 靶点的度中心性越大, 说明该靶点在网络中越重要。PPI图中根据度值将节点分为不同的大小, 其中节点越大, 度中心性越高, 靶点在网络中也就越关键。经计算, 排名前5位的关键靶点分别为血清白蛋白(serum albumin, ALB)、丝裂原活化蛋白激酶3 (mitogen-activated protein kinase 3, MAPK3)、丝裂原活化蛋白激酶1 (mitogen-activated protein kinase 1, MAPK1)、原癌基因酪氨酸蛋白激酶Src (proto-oncogene tyrosine-protein kinase Src, SRC)、基质金属蛋白酶-9 (matrix metalloproteinase-9, MMP9)。根据显著性程度, GO功能富集分析与KEGG通路分析均以P≤0.05表示具有统计学意义[14]。GO富集分析共获得131条GO条目, 结果显示, 黄精治疗动脉粥样硬化交集蛋白主要通过调节类固醇激素受体的活性、细胞对类固醇激素刺激的反应、磷脂酰肌醇-3激酶信号通路等生物过程发挥作用; 在细胞构成方面主要与三级颗粒内腔有关; 在分子功能方面主要涉及了类固醇结合、脂肪酸结合以及雌激素受体结合等。分别从生物学过程、细胞构成、分子学功能3个层面选取P值排名前10的功能信息, 结果见表 3。KEGG通路注释分析结果显示, 潜在靶点涉及37条相关信息通路, 经调研发现其中与动脉粥样硬化密切相关的信号通路有5条, 包括过氧化物酶体增殖激活受体信号通路(peroxisome proliferation activated receptor signaling pathway, PPAR signaling pathway)、血管内皮生长因子信号通路(vascular endothelial growth factor signaling pathway, VEGF signaling pathway)、血小板激活信号通路(platelet activation signaling pathway)、黏着连接信号通路(adhesive connection signaling pathway)、低氧诱导因子信号通路(hypoxia inducible factor signaling pathway, HIF-1 signaling pathway)。P值较小的前10条相关通路信息见表 4。
| Table 3 Analysis of GO enrichment Polygonati rhizoma in the treatment of atherosclerosis |
| Table 4 Analysis on the KEGG pathway of Polygonati rhizoma in the treatment of atherosclerosis |
分子对接即把配体分子放在受体活性位点的位置, 按照几何互补和能量互补的原则来实时评价配体和受体的相互作用, 寻找最佳结合模式。为验证本研究网络分析结果的准确性, 针对网络分析获得黄精治疗AS的5个关键靶点MAPK3、MAPK1、MMP9、ALB、SRC分别建立分子对接模型, 将原配体从活性口袋中抽离并重新对接, 计算对接后的RMSD及-CDOCKER ENERGY值。结果显示, MAPK3、MAPK1、MMP9、ALB、SRC分子对接模型RMSD值分别为0.781 3、0.563 9、0.343 2、1.113 9、1.301 8, 均小于2Å, 认为能够较好地重现原配体与蛋白的结合模式, 对接结果具有较高可靠性。5个靶点分子对接模型见图 4, 信息如表 5所示。将上述5个模型与黄精45个潜在活性成分及3个治疗AS的阳性药成分卡托普利、辛伐他汀、华法林进行对接, 对接结果如表 6所示, 与原配体的对接结果见图 5。结果显示, 在黄精的45个潜在活性成分中有73%与靶点MAPK3对接成功, 其中24%的成分-CDOCKER ENERGY值高于原配体, 具有较高的结合活性; 73%的成分与靶点MAPK1对接成功, 其中60%的成分-CDOCKER ENERGY值高于原配体, 具有较高的结合活性; 69%的成分与靶点MMP9对接成功, 但-CDOCKER ENERGY值均低于原配体; 76%的成分与靶点ALB对接成功, 其中49%的成分-CDOCKER ENERGY值高于原配体, 具有较高的结合活性; 96%的成分与靶点SRC对接成功, 其中42%的成分-CDOCKER ENERGY值高于原配体, 具有较高的结合活性。各靶点与阳性药分子对接结果显示, 黄精中部分潜在活性成分与靶点-CDOCKER ENERGY值高于阳性药。结合上述结果, 黄精成分与潜在关键靶点具有较好的结合活性, 提示黄精可能通过作用于潜在关键靶点产生抗AS的作用。
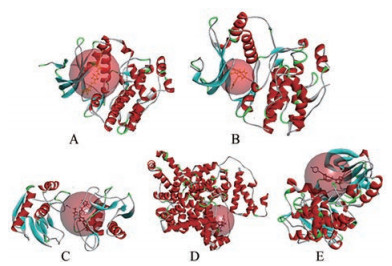
|
Figure 4 Molecular docking models of MAPK3 (A), MAPK1 (B), MMP9 (C), ALB (D) and SRC (E). MAPK3: Mitogen-activated protein kinase 3; MAPK1: Mitogen-activated protein kinase 1; MMP9: Matrix metalloproteinase-9; ALB: Serum albumin; SRC: Proto-oncogene tyrosine-protein kinase Src |
| Table 5 The related information of molecular docking models. PDB: Protein data bank; RMSD: Root-mean-square deviation |
| Table 6 Molecular docking results of MAPK3, MAPK1, MMP9, ALB and SRC with active components of Polygonati rhizoma |
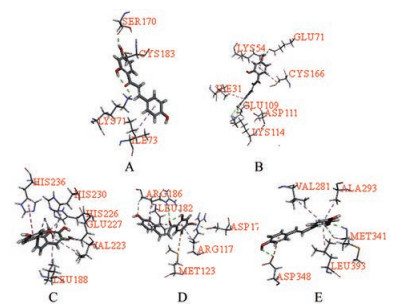
|
Figure 5 Molecular docking results of MAPK3 (A), MAPK1 (B), MMP9 (C), ALB (D) and SRC (E) with original ligands |
综合分析关键靶点、KEGG、GO富集结果, 黄精可能通过作用于MAPK1、MAPK3、ALB、SRC、MMP9以及PPARγ等关键靶点, 调控VEGF通路、血小板激活通路、ERK1/2-NF-κB通路、黏着连接通路以及PPAR通路, 产生调节脂质代谢、调节凝血、保护血管及促进血管新生、抑制AS斑块形成的药理作用从而发挥治疗AS的作用。黄精治疗AS的潜在作用靶点、通路及发挥药理作用如图 6所示。
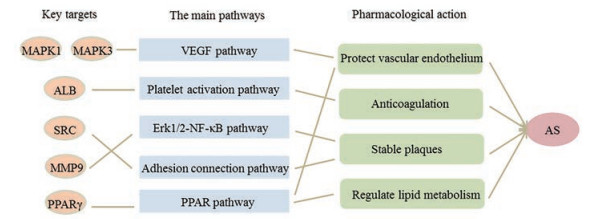
|
Figure 6 Schematic diagram of target-pathway-pharmacological effects of Polygonati rhizoma for the treatment of atherosclerosis |
ALB靶点蛋白是血液系统的重要组成部分, 参与血小板激活信号通路, 在维持血液胶体渗透压、抑制血小板功能和抗凝血以及影响动脉血管的渗透性等方面发挥着重要的生理功能[15]。预测黄精活性成分通过调节ALB抑制血小板激活信号通路发挥凝血作用, 从而间接参与AS的治疗过程。董娉婷[16]通过分析98例进行血液透析AS患者的血液指标, 发现血液中ALB水平与AS形成发展高度相关。郭焕等[17]研究发现血液钙结合蛋白S100A12与血液透析患者的动脉粥样硬化有密切联系, 而血液中的ALB蛋白是影响S100A12浓度的重要因素之一。这为ALB是抗AS关键靶点的预测结果提供佐证。
关键靶点SRC在纤维整合素诱导的信号链中起作用, 作为一衔接蛋白将特异蛋白定位于黏附结构上, 从而参与黏着连接信号通路[18], 而黏着连接信号通路在AS斑块形成及稳定过程中起到关键作用[19]。此外, 关键靶点MMP9是一类依赖锌的内肽酶, 参与ERK1/2-NF-κB信号通路, 活化后能够降解除多糖以外的所有细胞外基质, 使AS斑块的稳定性降低甚至导致斑块破裂, 同时MMP9能够增大血管内径、内膜面积以及细胞核密度, 为斑块的生长提供空间[20]。因此, 黄精可能通过作用于以上靶点和通路, 产生稳定动脉斑块的药理作用, 从而发挥抗AS的疗效。孙劼等[21]研究表明, 在AS疾病大鼠模型中, 斑块中MMP9的含量随斑块的进展逐渐增加。何宏涛等[22]收集了360例AS患者的颈动脉彩色多普勒超声结果, 观察AS斑块稳定性状况, 同时采用酶联免疫法检测患者血清MMP9水平, 研究发现MMP9在AS形成及斑块的稳定性改变中发挥重要作用。石惠等[23]研究发现甘草素能显著下调MMP9的表达水平且呈剂量效应关系, 当甘草素剂量为100 μmol·L-1时, 与对照组相比, MMP9蛋白表达均降低将近50% (P < 0.01);而甘草素是黄精主要活性成分之一, 这为MMP9是黄精抗AS关键靶点的预测结果提供佐证。
丝裂原活化蛋白激酶MAPK1和MAPK3均为VEGF信号通路中的关键靶点, 该通路参与血管内皮细胞的分裂、迁徙, 对血管生成具有重要促进作用[24]; 此外, PPAR信号通路也参与保护动脉血管内皮[25]。因此, 黄精活性成分可能通过调节上述两条信号通路, 产生保护动脉血管内皮、促进血管新生的药理作用从而发挥治疗AS的药效。伏有为[26]在探究黄精速溶粉对肝病小鼠的保护机制过程中发现, 黄精速溶粉及黄精多糖均能显著上调小鼠肝脏中MAPK1、MAPK3靶点蛋白的表达。以上结果在一定程度上, 对黄精通过作用于MAPK1、MAPK3发挥抗AS作用的预测结果提供佐证。
PPARγ是脂肪细胞分化过程和脂肪生成过程关键的转录因子, 参与脂肪的形成, 包括前体脂肪细胞的募集、分化及甘油三脂的合成等过程[27], 从而出现脂肪堆积。
本研究KEGG分析结果显示, 黄精活性成分与PPAR信号通路密切相关, 由此推测黄精可能通过调节PPAR信号通路参与脂质代谢过程发挥治疗AS作用。孔瑕等[28]以高脂大鼠为模型, 探讨了黄精多糖通过调节PPAR信号通路的降脂作用, 结果显示, 高脂条件下PPARγ的表达上调, 而黄精多糖作用后其表达量显著下调, 说明黄精多糖通过调节PPAR通路起到降脂作用, 参与AS治疗。以上结果与本研究预测黄精通过调节PPAR信号通路参与脂质代谢过程发挥治疗AS作用的结论相一致。
AS严重影响人类的身体健康和生活质量, 虽然他汀类药物已广泛应用, 但心脑血管疾病的发生率仍在持续上升。因此, 有必要研究开发新型抗AS药物[6]。
近年来, 较多研究在动物层面揭示了黄精具有抗AS疗效, 发现其主要通过保护血管组织、抑制血小板活动及调节脂质代谢发挥作用, 但研究多从单一成分或单一通路进行研究。而中药具有多成分, 作用于多靶点, 调控多条通路发挥药效的特点, 从单一方面的研究难以阐明黄精抗AS的整体性与系统性, 并且难以阐释黄精抗AS的药效物质基础及作用机制。因此, 本研究运用网络药理学技术, 在整体层面阐释黄精活性成分、靶点、通路及AS疾病之间的关系, 发现黄精可能通过调节脂质代谢、调节凝血、保护血管及抑制AS斑块发挥治疗AS作用, 目前已有研究也印证了本研究的预测结果。本研究揭示了黄精抗AS的活性成分及其作用机制, 但活性成分只有在体内达到一定浓度才能成为药效物质, 因此有待进一步研究以揭示其药效物质基础, 为抗AS药物研发提供指导。
作者贡献:高凤凤负责撰写文章, 绘制插图; 裴艳玲、任越、陈紫军、卢建秋、张燕玲负责修改文章。
利益冲突:本文章不存在利益冲突。
| [1] |
Mao JM, Wang G. Atherosclerosis and inflammation[J]. Chin Circ J (中国循环杂志), 2006, 21: 405-406. |
| [2] |
Wei AZ, Yang JF. Discussion on the research progress of atherosclerosis[J]. J Clin Med (临床医药文献杂志), 2014, 14: 1866-1867. |
| [3] |
Li P, Wang CY. Analysis of the interaction between statins and common cardiovascular drugs[J]. Chin Pharm (中国药业), 2019, 28: 82-84. |
| [4] |
Zhao WL, Zhao Y, Teng Y. Progress in pharmacological studies of huangjing[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 240-246. |
| [5] |
Fukuba N, Ishihara S, Sonoyama H, et al. Antiatherosclerotic potential of Rhizoma Polygonati polysaccharide in hyperlipidemia-induced atherosclerotic hamsters[J]. Drug Res (Stuttg), 2015, 65: 479-483. |
| [6] |
Li YY, Deng HB, Xiang DX, et al. The antiatherogenic and antilipidemic effects of xanthomonas polysaccharide[J]. Chin J Arterioscler (中国动脉硬化杂志), 2005, 4: 429-431. |
| [7] |
Shi Y, Yao YJ. An analysis of the mechanism of kaixin powder in the treatment of alzheimer's disease based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2018, 53: 76-84. |
| [8] |
Ren JZ, Zhang Z, Li B. To explore the antitumor mechanism of paitouweng decoction based on network pharmacology[J]. World Clin Drugs (世界临床药物), 2019, 40: 27-34. |
| [9] |
Shi S, Hu YH, Wu HQ, et al. Discussion on network pharmacology of action mechanism of salvia miltiorrhiza panax notoginseng[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2018, 24: 192-197. |
| [10] |
Gabriela B, Bernhard M, Hubert H, et al. ClueGO:a Cytoscape plug-in to decipher functionally grouped gene ontology and pathway annotation networks[J]. Bioinformatics, 2009, 25: 1091-1093. DOI:10.1093/bioinformatics/btp101 |
| [11] |
Zhao S, Wu DX, Chen X, et al. Mechanism of action of herba siegesbeckiae in treating ischemic stroke based on network pharmacology[J]. Chin J Chin Mater Med (中国中药杂志), 2019, 44: 2727-2735. |
| [12] |
Huang XF, Gao YJ, Liao G, et al. To explore the mechanism of treating asthma with shenma antiasthmatic fluid based on network pharmacology[J]. Chin J Chin Mater Med (中国中药杂志), 2019, 25: 187-195. |
| [13] |
Zheng YF, Jia H, Zhang BY, et al. Pharmacology of antiapoplexy prescription based on compound-target interaction prediction model[J]. Acta Pharm Sin (药学学报), 2020, 55: 256-264. |
| [14] |
Ouyang XQ, Rao L, Lei M, et al. To explore the mechanism of Jiawei Erzhi wan in the treatment of atherosclerosis based on network pharmacology[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2020, 26: 175-182. |
| [15] |
Zhang YX, Zhang Y. Function and application of serum albumin[J]. Nat Sci J Hainan Univ (海南大学学报), 2007, 23: 833. |
| [16] |
Dong PT. The relationship between malnutrition and atherosclerosis in hemodialysis patients[J]. Int J Urol (国际泌尿系统杂志), 2017, 37: 28-31. |
| [17] |
Guo H, Lu B. Study on the influencing factors of blood calcium binding protein S100A12 in hemodialysis patients and its relationship with arteriosclerosis[J]. Lab Med (检验医学), 2014, 29: 930-934. |
| [18] |
Qiu Y, Rui YC. Research progress of Src family kinases[J]. Drug Appl Monit China (中国药物应用与监测), 2004, 2: 37-40. |
| [19] |
Wang XK, Sun F, Ma SJ, et al. Atherosclerosis and inflammation[J]. Gansu Sci Technol (甘肃科技), 2019, 35: 129-131, 100. |
| [20] |
Wågsater D, Zhu C, Björkegren J, et al. MMP-2 and MMP-9 are prominent matrix metalloproteinases during atherosclerosis development in the Ldlr-/- Apob100/100 mouse[J]. Int J Mol Med, 2011, 28: 247-253. |
| [21] |
Sun J, Dong JT, Deng ZH, et al. Effects of amlodipine on the stability of atherosclerotic plaque and the expression of MMP-9 and its inhibitor in rats[J]. Hainan Med J (海南医学), 2016, 27: 867-869. |
| [22] |
He HT, Yang XP, Zhang ZM. Study on the relationship between MMP-9, TIMP-1 and VEGF and the stability of carotid atherosclerotic plaque[J]. Hebei Pharm (河北医药), 2016, 38: 555-557. |
| [23] |
Shi H, Wu YC, Cai YQ. Effect of glycyrrhizin on invasion and metastasis of B16F10 melanoma cells and its mechanism[J]. Chin J Nutr (营养学报), 2014, 36: 486-490. |
| [24] |
Wang YD, Hu Y, Sun CY. The role of Akt and erk1/2 activation in promoting angiogenesis of BDNF[J]. Chin J Pathophysiol (中国病理生理杂志), 2007, 23: 833. |
| [25] |
Hu ZP. Effects of Telmisartan on Vascular Endothelial Function in Hypertension and Atherosclerosis and Its Mechanism (替米沙坦对高血压和动脉粥样硬化血管内皮功能的影响及其机制)[D]. Anhui: Anhui Medical University, 2011.
|
| [26] |
Fu YW. Nrf 2/ARE Pathway to Explore the Protective Effect of Huangjing Instant Powder on Mice with Alcoholic Liver Disease and Its Possible Mechanism (基于Nrf2/ARE通路探究黄精速溶粉对酒精性肝病小鼠的保护作用及可能机制)[D]. Anhui: Anhui Medical University, 2019.
|
| [27] |
Eurlings PM, Vanderkallen CJ, Veemeulen VM, et al. Variants in the PPARgama gene affect fatty acid and glycerol metabolism in familial combined hyperlipidemia[J]. Mol Genet Metab, 2003, 80: 296. DOI:10.1016/S1096-7192(03)00138-0 |
| [28] |
Kong X, Liu JJ, Li H, et al. Effect of xanthan polysaccharide on mRNA and protein expression of lipid metabolism-related genes in hyperlipidemia mice[J]. Chin J Chin Mater Med (中国中药杂志), 2018, 43: 3740-3747. DOI:10.19540/j.cnki.cjcmm.20180502.001 |
 2020, Vol. 55
2020, Vol. 55


