2. 中国医学科学院、北京协和医学院医药生物技术研究所, 北京 100050
2. Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
急性淋巴细胞白血病(ALL)的特点是淋巴细胞的异常增殖和分化, 导致正常的免疫反应失调和造血功能障碍。费城染色体(Ph)阳性ALL是最常见的遗传异常相关ALL, 且已被证实在儿童和成人中均具有最坏的临床预后[1, 2]。Ph阳性ALL存在广泛的基因突变, 最明显的特征是存在Ph染色体[3]。Ph染色体是由9号染色体与22号染色体发生长臂易位, ABL基因转座到22号染色体上, 形成新的融合基因断裂点簇基区-Abelson酪氨酸激酶(BCR-ABL)。BCR-ABL编码一种异常的酪氨酸激酶(TK)蛋白, 该异常酪氨酸激酶改变了调节细胞增殖、存活和自我更新的相关信号通路, 促进含有费城染色体(Ph)细胞的肿瘤转化[4]。虽然Ph+ ALL在任何年龄阶段均可发病, 但其发病率会随着年龄的增长逐渐升高[5]。约20%~25%的成年ALL患者携带BCR-ABL融合基因, 这些患者在常规化疗后的预后非常差。造血干细胞移植(SCT)被认为是能够使Ph+ ALL患者完全缓解的金标准疗法[6]。随着BCR-ABL酪氨酸激酶抑制剂(TKI)甲磺酸伊马替尼被批准作为一线治疗药物后, Ph+ ALL患者的预后明显改善。尽管取得以上进展, Ph+ ALL患者经SCT或TKI治疗后仍经常复发[7]。研究表明, 伊马替尼诱导溶酶体膜渗透性增加, 进而激活组织蛋白酶B (cathepsin B), 并将其重新分配到白血病细胞的细胞质中, 最终直接促进BCR-ABL降解[8]。因此, 在一线治疗的基础上, 探索调控BCR-ABL降解的具体机制, 可能为Ph+ ALL疗法带来新的治疗选择。
假性激酶tribbles蛋白家族成员TRIB1、TRIB2和TRIB3参与多种炎症疾病和肿瘤进程, 作为应激感受器的角色发挥重要作用[9]。在急性髓系白血病(AML)中, TRIB1和TRIB2作为重要的调控因子参与疾病的发生发展[10, 11]。研究表明, TRIB1与丝裂原活化蛋白激酶1 (MEK1)相互作用, 促进MEK1的磷酸化并诱导转录因子CCAAT/增强子结合蛋白(C/EBP)降解, 促进AML的发生发展。TRIB2被鉴定为致癌基因家族成员之一, 在小鼠中通过诱导C/EBPA失活而导致AML的发生[12]。TRIB3是假性激酶家族成员, 也被称为关键的“应激调节开关”, 通过与细胞内信号和功能蛋白的相互作用, 将稳态、代谢性疾病和癌症联系起来[13-16]。本课题组前期研究表明, TRIB3在AML样本中表达上调, 并且TRIB3蛋白表达水平与急性早幼粒白血病(APL)疾病进展及药物耐受呈正相关, TRIB3通过维持早幼粒细胞白血病-维甲酸受体融合蛋白(PML-RARA)的蛋白稳定性从而维持APL起始细胞的自我更新能力, 参与APL发生和疾病进展[17-19]。多项研究表明, TRIB3可作为潜在的肿瘤治疗靶点, 在肿瘤细胞中降低TRIB3的表达可显著抑制肿瘤的发生发展[20, 21]。然而, TRIB3在Ph+ ALL疾病过程中的作用及机制尚未阐明。
近几年, 蛋白质质量控制已成为肿瘤领域的研究热点之一。蛋白质质量控制失调, 例如泛素蛋白酶体降解系统(UPS)和自噬(autophagy)的功能障碍, 导致促肿瘤蛋白的大量聚集并促进肿瘤发生发展[22]。组织蛋白酶Z (cathepsin Z, CTSZ)是一种溶酶体半胱氨酸蛋白酶, cDNA全长为1.4 kb, 编码306个氨基酸。CTSZ具有类木瓜蛋白酶样半胱氨酸蛋白酶的所有特征, 包括“催化三联体”的高度保守残基。CTSZ与已报道的哺乳动物木瓜蛋白酶样半胱氨酸肽酶的同源性仅为26.35%, 并且有一个异常短的前肽, 这表明它是该家族中一个新的亚家族成员[23]。在正常细胞中, CTSZ主要负责细胞内蛋白质的降解和转运。有研究表明, CTSZ在实体瘤中表达上调, 高表达的CTSZ能促进肿瘤的发生发展[24], 但是, CTSZ在白血病中的功能尚不明确。因此, 本研究旨在探究TRIB3与CTSZ在原发性Ph+ ALL白血病中的作用, 探讨TRIB3通过与CTSZ的相互作用调控BCR-ABL表达和活性的分子机制, 并寻找BCR-ABL相关白血病潜在的分子靶向治疗策略。
材料与方法患者样本 原代患者样本从中国医学科学院血液研究所和血液病医院获得。根据赫尔辛基宣言, 所有参与者均获得知情同意, 并且获得了血液学研究所和血液病医院伦理审查委员会的批准。
原代白血病细胞的分离 使用Percoll通过梯度离心法分离白血病患者骨髓样本中的单个核细胞(PBMC)。具体操作为: ①将10×PBS与Percoll按照1:9比例混合, 配制成密度为1.129 4 g·mL-1的Percoll悬液, 上述配制的悬液是100% Percoll (淋巴细胞分离液)。②将100% Percoll悬液用1×PBS稀释, 而获得适宜密度进行细胞分离, 因为稀释度与密度线性相关, 70%、60%、50%、40%、30%和20% Percoll的密度分别为1.090、1.077、1.067、1.056、1.043和1.031 g·mL-1。③通过从高到低稀释度的叠加, 形成每个比重相对应的浓度梯度, 从而可以区分不同梯度的PBMC细胞。
质粒构建和重组蛋白 用标准分子克隆法在pcDNA3.1-HA载体上构建HA标记的TRIB3。Myc或His标签的BCR-ABL是在pcDNA3.1-Myc-His (-B)载体上通过标准分子克隆方法构建。
细胞系 BV173 (人Ph+ ALL细胞系)和HEK 293T (人胚肾细胞系)均购自中国科学院上海细胞生物学研究所, 使用前均通过STR图谱鉴定, 并进行支原体和细胞活力检测。BV173细胞的培养条件为: 10%热灭活胎牛血清(FBS, Gibco公司)的RPMI-1640培养基(Gibco公司)中, 并置于37 ℃、5% CO2及饱和湿度的培养箱中。
转染与细胞分选 为构建稳定敲低TRIB3的BV173细胞系, 使用转染试剂(Lipofectamine®2000)根据说明书的转染方法, 将control-shRNA和TRIB3-shRNA1/2质粒分别转染到BV173细胞中。转染24 h后, 使用含有200 μg·mL-1潮霉素(Calbiochem公司)的培养基筛选转染TRIB3-shRNA的BV173细胞系, 培养7天后, 挑取单细胞克隆, 传代2~3次, 经Western blot验证TRIB3敲低后, 用于后续实验。
细胞生长与凋亡分析 将细胞消化、离心后计数, 然后将其均匀接种到96孔板中, 2 000个细胞/孔, 做3个平行孔。通过Celigo Imaging Cytometer测量细胞数量, 测量时间3~5天, 根据不同天数的细胞数, 绘制细胞增长的时间曲线, 生长曲线测定重复3次。并使用Vi-Cell XR细胞活力分析仪(Beckman Coulter)进行定量。对给予伊马替尼或阴性对照的BV173细胞进行细胞凋亡测定。收集细胞, 用PBS洗涤2次, Annexin V-FITC/PI染色(BD-Biosciences), 流式细胞术检测(BD-Biosciences公司)。
蛋白免疫印迹 采用Western blot法检测患者白血病细胞中TRIB3、CTSZ、BCR-ABL等蛋白水平。将含TRIB3、CTSZ、BCR-ABL等蛋白的PVDF膜与一抗(1:1 000)孵育, 再与辣根过氧化物酶结合二抗(1:2 000)孵育。根据制造商的说明(Pierce公司), 使用增强化学发光检测目标蛋白质。使用Quantity One软件(Bio-Rad Laboratories公司), 以GAPDH为内参, 对图像中的阳性条带进行半定量。
免疫沉淀反应 将细胞收集到10 mL离心管中, 在4 ℃条件下, 3 000 r·min-1离心5 min, 去上清, 往细胞沉淀中加入适量CO-IP细胞裂解液, 转移至1.5 mL离心管中, 轻轻弹匀细胞悬液, 放置在冰上裂解30 min; 在4 ℃条件下, 12 000 r·min-1离心30 min, 之后吸取蛋白上清; 将蛋白上清液分为两部分, 取50 μL上清于新的1.5 mL离心管, 加入Loading Buffer在98 ℃金属浴变性10 min; 在剩下的蛋白上清中加入适量抗体和琼脂糖, 在4 ℃下孵育过夜; 用3 000 r·min-1速度离心5 min, 去掉上清, 加入CO-IP洗液清洗沉淀, 重复5遍; 加入2×上样缓冲液30 μL, 98 ℃金属浴变性10 min。
细胞周期检测 取对数生长期细胞分别接种于12孔板, 24 h之后, 收集细胞, 1 000 r·min-1离心5 min, 弃上清, 用预冷的PBS洗2次, 加入75%的乙醇在4℃固定4 h以上。取已固定的细胞1 000 r·min-1离心5 min, 弃上清, 将细胞用PBS洗涤2次并重悬于100 μL染色缓冲液中。然后在PI染色缓冲液(PI: 50 μg·mL-1; RNase: 100 μg·mL-1)中避光温育15 min。流式细胞仪对样品进行测试。通过CellQuest软件(Becton Dickinson公司)分析流式细胞术的数据。
动物实验 NOD-SCID小鼠(4~6周龄, 雄性)购自南京模式动物中心[中国南京, 动物许可证编号: SCXK (苏) 2018-0008)]。该小鼠在中国医学科学院药物研究所SPF条件的动物设施中饲养。在动物研究中, 实验小鼠在分组前被标记出来, 然后由一个独立的研究人员随机分成几组。样本量是根据以往使用相同细胞株和处理的经验预先确定的。所有动物实验均经中国医学科学院动物实验伦理委员会批准, 并按照中国医学科学院动物保护与利用委员会的指导方针进行。
小动物活体成像 在小鼠急性白血病细胞侵袭模型中, 应用荧光素酶标记细胞, 用活体动物成像仪监测白血病细胞对小鼠各脏器的受累程度。具体操作步骤:小鼠成像实验前, 对每只小鼠腹腔注射125 mg·kg-1荧光素, 并将小鼠放入气体麻醉装置。等小鼠麻醉后, 将小鼠放入小动物活体成像仪, 并进行动物成像实验。
统计学分析 实验结果以mean ± SEM表示, 采用t检验各组间差异。*P < 0.05, 与对照组相比有显著差异, **P < 0.01, ***P < 0.001与对照组相比有极显著差异。实验平行操作, 重复3次。
结果 1 TRIB3与BCR-ABL表达在Ph+ ALL样本中呈正相关为了分析TRIB3在Ph+ ALL疾病中的作用, 本研究首先使用蛋白印迹法检测Ph+ ALL患者骨髓样本中的TRIB3蛋白表达水平。研究结果表明, Ph+ ALL患者样本来源的细胞中TRIB3蛋白表达水平明显高于正常人骨髓来源细胞(图 1A和B)。融合蛋白BCR-ABL酪氨酸激酶是目前Ph+ ALL最重要的致癌蛋白以及治疗靶点, 本研究进一步检测Ph+ ALL细胞中TRIB3和BCR-ABL的蛋白表达水平, 并分析这两种蛋白在Ph+ ALL患者样本中的相关性。结果显示, Ph+ ALL细胞中表达上调的TRIB3和BCR-ABL的蛋白表达水平趋势类似(图 1C)。通过分析23例Ph+ ALL患者样本中TRIB3和BCR-ABL表达的相关性, 发现TRIB3与BCR-ABL的蛋白表达水平呈明显正相关(图 1D)。以上结果表明, 与正常人相比, Ph+ ALL患者样本中TRIB3表达水平明显增加, 并且其表达水平与BCR-ABL蛋白水平呈正相关, 提示TRIB3可能在BCR-ABL特异性表达的Ph+ ALL疾病中发挥特异性作用。
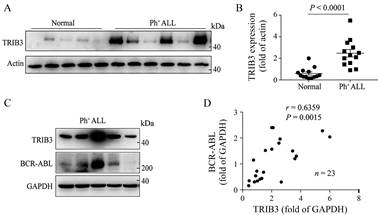
|
Figure 1 Tribbles homologue 3 (TRIB3) expression is positively associated with BCR-ABL in Ph+ ALL cells. A, C: TRIB3 expression was detected by Western blot (WB) in the bone marrow of Ph+ ALL or healthy donors. The data are the means ± SEM of 3 assays; B: Statistical significance of TRIB3 expression was determined by student's t-test in the indicated groups; D: Correlation between TRIB3 and BCR-ABL expressions in leukemia cells derived from Ph+ ALL patients (n = 23). Ph: Philadelphia chromosome; BCR-ABL: Breakpoint cluster region-Abelson tyrosine kinase; ALL: Acute lymphoblastic leukemia |
为了进一步研究TRIB3在Ph+ ALL中的作用, 本研究首先构建了稳定敲低TRIB3的BV173细胞系, 研究TRIB3对Ph+ ALL细胞增殖和凋亡的影响。实验结果显示, 敲低TRIB3的Ph+ ALL细胞增殖能力明显减弱(图 2A), 其细胞凋亡比例却明显增加(图 2B), 以上结果表明, TRIB3可能通过维持Ph+ ALL细胞的增殖活性及抵抗细胞发生凋亡的能力来参与Ph+ ALL疾病进程。为进一步探究TRIB3在Ph+ ALL疾病进程中的作用, 本研究通过尾静脉注射的方法将稳定表达control-shRNA和TRIB3-shRNA的BV173细胞分别移植到免疫缺陷小鼠体内。使用小动物活体成像仪器观察肿瘤细胞植入5周后小鼠体内白血病细胞的分布情况和小鼠各种器官的受累程度。实验结果显示, 移植BV173细胞的小鼠多种器官被白血病细胞浸润, 并且小鼠多脏器的受累程度比较严重。然而, 接种敲低TRIB3的BV173细胞(TRIB3-shRNA)的小鼠脏器的受累程度明显下降(图 2C), 该组荷瘤小鼠的生存周期显著延长(图 2D)。以上研究表明, 敲低TRIB3抑制Ph+ ALL荷瘤小鼠的疾病进展。
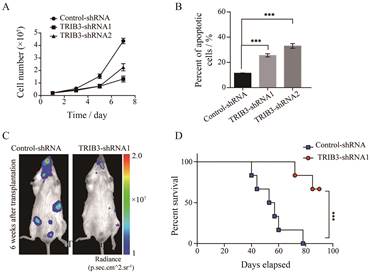
|
Figure 2 Silencing TRIB3 induces proliferation inhibition and apoptosis in Ph+ ALL cells. A: Growth curves of BV173 control-shRNA and TRIB3-shRNA1/2 cells. At different time, BV173 control-shRNA and TRIB3-shRNA1/2 cells were counted using a cell counter. n= 5, mean ± SEM; B: Apoptosis assay of BV173 control-shRNA and TRIB3-shRNA1/2 cells. n= 3, mean ± SEM; C: The progression of BV173 control-shRNA and TRIB3-shRNA1 cells in vivo was evaluated with IVIS Spectrum imaging. NOD-SCID mice were injected i.v. with 1×106 luciferase-labeled BV173 cells with or without TRIB3 depletion. Data are representative images of mice at the indicated time; D: Survival rate was analyzed by Kaplan-Meier at the end of 90 days. Statistical significance between two groups was determined by t-test; ***P < 0.001 |
由于在Ph+ ALL患者样本中TRIB3与BCR-ABL表达水平呈正相关, 本研究首先检测敲低Ph+ ALL细胞中TRIB3的表达对BCR-ABL活性的影响, 发现敲低Ph+ ALL细胞中TRIB3的表达能够明显抑制BCR-ABL激酶的活性, 表现为BCR-ABL信号通路中BCR-ABL、细胞信号转导和转录活化蛋白5 (STAT5)和CRK样蛋白(CRKL)蛋白的磷酸化水平下降(图 3A)。BCR-ABL蛋白降解依赖于泛素连接酶介导的泛素化, 过表达TRIB3能够明显降低BCR-ABL的泛素化水平(图 3B), 延长BCR-ABL蛋白的降解半衰期(图 3C)。以上研究结果表明, TRIB3主要通过抑制BCR-ABL的泛素化和降解, 从而维持BCR-ABL的活性。
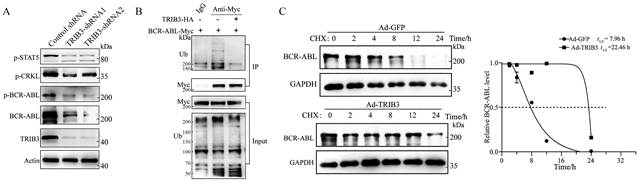
|
Figure 3 TRIB3 represses ubiquitylation and degradation of BCR-ABL. A: Silencing TRIB3 decreases the activity of the BCR-ABL pathway. The expression levels of p-BCR-ABL, p-STAT5, and p-CRKL were detected by WB in BV173 control-shRNA and TRIB3-shRNA1/2 cells. The data are representative immunoblots of 3 assays; B: The effect of TRIB3 on BCR-ABL ubiquitylation in vivo. HEK293 cells were transfected with TRIB3 and BCR-ABL expressing plasmids and extracts of transfected cells were IP with anti-Myc Ab. BCR-ABL ubiquitination was detected by immunoblotting; C: HEK293T cells were transfected with BCR-ABL plasmid. Then these cells were infected with TRIB3- or GFP-adenovirus and incubated with cycloheximide (CHX) for different time |
由于TRIB3能够抑制BCR-ABL降解维持其稳定性, 本研究进一步探讨TRIB3调控BCR-ABL蛋白降解的具体机制。既往研究表明, TRIB3通过蛋白质-蛋白质相互作用发挥多种生物学作用[25], 通过酵母双杂交实验筛选与TRIB3存在相互作用的蛋白质, 结果显示, 组织蛋白酶Z (CTSZ)可能与TRIB3存在潜在相互作用。免疫共沉淀方法验证BV173白血病细胞中CTSZ与TRIB3存在结合(图 4A), 并且两者在BV173细胞中存在明显共定位(图 4B)。此外, 使用免疫共沉淀方法检测BV173细胞裂解液, 结果发现组织蛋白酶CTSZ与BCR-ABL存在明显的相互作用(图 4C), 而在BV173细胞中过表达TRIB3则妨碍BCR-ABL与CTSZ的相互作用(图 4D), 这一结果提示, TRIB3可能参与组织蛋白酶CTSZ介导的BCR-ABL蛋白降解调控。使用稳定敲低TRIB3的BV173细胞, 结果发现, 敲低TRIB3促进BCR-ABL降解, 降低BCR-ABL蛋白稳定性, 在此基础上进一步敲低CTSZ, 则可反转敲低TRIB3促进BCR-ABL蛋白降解的作用(图 4E)。以上研究结果表明, TRIB3通过与CTSZ相互作用抑制BCR-ABL蛋白降解, 增强其蛋白稳定性和活性, 促进B-ALL的疾病进展。
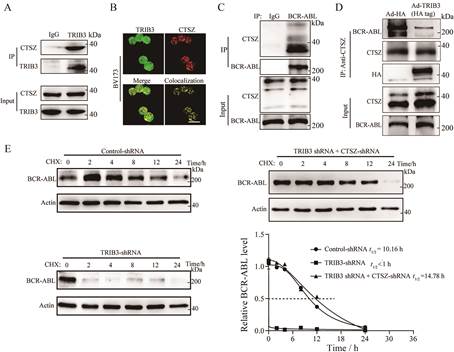
|
Figure 4 TRIB3 interacts with cysteine proteinase cathepsin Z (CTSZ) to interfere with BCR-ABL degradation. A: The interaction of TRIB3 and CTSZ was evaluated by Co-IP assay. Extracts of BV173 cells were CO-IP with normal IgG or anti-TRIB3 antibody and blotted with anti-CTSZ Ab; B: Immunofluorescence (IF) was performed to detect the co-localization of TRIB3 and CTSZ in BV173 cells. Representative images were shown. Scale bar, 2 μm; C: The interaction of CTSZ and BCR-ABL was evaluated by Co-IP assay. Extracts of BV173 cells were IP with normal (IgG) or anti-BCR-ABL and blotted with anti-CTSZ antibody; D: The effect of TRIB3 on the interaction of BCR-ABL/CTSZ; E: The effects of CTSZ on the degradation of BCR-ABL in TRIB3 depleted cells. BV173 cells with TRIB3 or/and CTSZ depletion were treated with CHX (10 μg·mL-1) for the indicated time. The indicated proteins were detected by immunoblotting to detect the stability of BCR-ABL |
急性淋巴细胞白血病患者治疗失败率、复发率和中枢神经系统的侵袭率均远高于其他类型的白血病患者[2]。大约20%~25%的成年急性淋巴细胞白血病患者携带BCR-ABL融合基因, 该类型患者在常规化疗后的预后较差[26]。虽然造血干细胞移植是费城染色体阳性急性淋巴细胞白血病(Ph+ All)患者的核心治疗选择, 但伊马替尼为(Ph+ ALL)患者的治疗提供了新的选择[2]。伊马替尼治疗不仅使Ph+ ALL患者有更好的机会接受造血干细胞移植, 而且可以改善造血干细胞移植后患者的预后[27]。然而, Ph+ ALL患者造血干细胞移植后仍然存在复发, 并且存在无复发死亡的病例。此外, Ph+ ALL患者血干细胞移植后其治疗成功率并不高, 只有20%患者能长期生存[26]。因此, 需要探索和研发针对Ph+ ALL患者新的治疗策略。
假激酶TRIB3促进实体瘤发生和转移的重要作用已被证实[28, 29], 此外, 越来越多的研究也表明TRIB3能够促进白血病的发生发展。本课题组前期研究表明, TRIB3通过稳定癌蛋白PML-RARα和抑制p53介导衰老, 从而促进急性早幼粒白血病的发病及疾病进程[20]; TRIB3与转录因子TWIST1相互作用介导急性早幼粒白血病的耐药性[27, 30]。本研究发现, TRIB3在Ph+ ALL患者样本中高表达, 并且与BCR-ABL的表达呈正相关。抑制TRIB3基因或者蛋白表达能够抑制Ph+ ALL细胞的增殖和侵袭能力, 这提示TRIB3可以作为Ph+ ALL治疗的潜在靶点。
BCR-ABL调节细胞内多种蛋白酪氨酸磷酸化水平, 抑制微丝机动蛋白的功能, 扰乱细胞内正常信号通路并抑制细胞凋亡。多篇文献已报道调控BCR-ABL表达或活性的具体机制[31, 32], 其中溶酶体蛋白酶B (CTSB)被报道参与三氧化二砷介导的BCR-ABL蛋白降解[33]。CTSZ作为肿瘤促进因素在内质网应激依赖性凋亡途径中发挥重要作用[24], 其是否参与原癌蛋白降解调控的作用和机制并不清楚。本研究报道BCR-ABL作为CTSZ的潜在降解低物, TRIB3与CTSZ相互作用妨碍CTSZ介导BCR-ABL降解, 维持BCR-ABL的活性, 进而促进Ph+ ALL疾病进程。该研究可能为Ph+ ALL的治疗提供潜在的理论基础和治疗策略。
作者贡献: 再吾力·叶尔江、王凤和杨兆娜负责细胞和动物实验等; 李珂负责实验设计和论文的撰写; 胡卓伟负责论文的指导及审阅。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Abou Dalle I, Kantarjian HM, Short NJ, et al. Philadelphia chromosome-positive acute lymphoblastic leukemia at first relapse in the era of tyrosine kinase inhibitors[J]. Am J Hematol, 2019, 94: 1388-1395. DOI:10.1002/ajh.25648 |
| [2] |
Tasian SK, Loh ML, Hunger SP. Philadelphia chromosome-like acute lymphoblastic leukemia[J]. Blood, 2017, 130: 2064-2072. DOI:10.1182/blood-2017-06-743252 |
| [3] |
Pui CH, Roberts KG, Yang JJ, et al. Philadelphia chromosome-like acute lymphoblastic leukemia[J]. Clin Lymphoma Myeloma Leuk, 2017, 17: 464-470. DOI:10.1016/j.clml.2017.03.299 |
| [4] |
Soverini S, Bassan R, Lion T. Treatment and monitoring of Philadelphia chromosome-positive leukemia patients:recent advances and remaining challenges[J]. J Hematol Oncol, 2019, 12: 39. DOI:10.1186/s13045-019-0729-2 |
| [5] |
Slayton WB, Schultz KR, Kairalla JA, et al. Dasatinib plus intensive chemotherapy in children, adolescents, and young adults with Philadelphia chromosome-positive acute lymphoblastic leukemia:results of children's oncology group trial AALL0622[J]. J Clin Oncol, 2018, 36: 2306. DOI:10.1200/JCO.2017.76.7228 |
| [6] |
Man LM, Morris AL, Keng M. New therapeutic strategies in acute lymphocytic leukemia[J]. Curr Hematol Malig Rep, 2017, 12: 197-206. DOI:10.1007/s11899-017-0380-3 |
| [7] |
Liew E, Ghosh S, Saini L. Use of tyrosine kinase inhibitors post-allogeneic stem cell transplant in patients with Philadelphia or BCR-ABL positive acute lymphoblastic leukemia:a systematic review and meta-analysis[J]. Blood, 2016, 128: 2778. DOI:10.1182/blood.V128.22.2778.2778 |
| [8] |
Citalan-Madrid AF, Cabral-Pacheco GA, Martinez-de-Villarreal LE, et al. Proteomic tools and new insights for the study of B-cell precursor acute lymphoblastic leukemia[J]. Hematology, 2019, 24: 637-650. DOI:10.1080/16078454.2019.1664127 |
| [9] |
Eyers PA, Keeshan K, Kannan N. Tribbles in the 21st century:the evolving roles of tribbles pseudokinases in biology and disease[J]. Trends Cell Biol, 2017, 27: 284-298. DOI:10.1016/j.tcb.2016.11.002 |
| [10] |
Richmond L, Keeshan K. Pseudokinases:a tribble-edged sword[J]. FEBS J, 2019. DOI:10.1111/febs.15096 |
| [11] |
Sakai S, Miyajima C, Uchida C, et al. Tribbles-related protein family members as regulators or substrates of the ubiquitin-proteasome system in cancer development[J]. Curr Cancer Drug Targets, 2016, 16: 147-156. DOI:10.2174/1568009616666151112122645 |
| [12] |
Guan H, Shuaib A, Leon DD, et al. Competition between members of the tribbles pseudokinase protein family shapes their interactions with mitogen activated protein kinase pathways[J]. Sci Rep, 2016, 6: 32667. DOI:10.1038/srep32667 |
| [13] |
Hong B, Zhou J, Ma K, et al. TRIB3 promotes the proliferation and invasion of renal cell carcinoma cells via activating MAPK signaling pathway[J]. Int J Biol Sci, 2019, 15: 587. DOI:10.7150/ijbs.29737 |
| [14] |
Fischer Z, Das R, Shipman A, et al. A Drosophila model of insulin resistance associated with the human TRIB3 Q/R polymorphism[J]. Dis Model Mech, 2017, 10: 1453-1464. DOI:10.1242/dmm.030619 |
| [15] |
Ord T, Ord T. Mammalian pseudokinase TRIB3 in normal physiology and disease:charting the progress in old and new avenues[J]. Curr Protoc Protein Sci, 2017, 18: 819-842. |
| [16] |
Mondal D, Mathur A, Chandra PK. Tripping on TRIB3 at the junction of health, metabolic dysfunction and cancer[J]. Biochimie, 2016, 124: 34-52. DOI:10.1016/j.biochi.2016.02.005 |
| [17] |
Li K, Wang F, Cao WB, et al. TRIB3 promotes APL progression through stabilization of the oncoprotein PML-RARα and inhibition of p53-mediated senescence[J]. Cancer Cell, 2017, 31: 697-710.e7. DOI:10.1016/j.ccell.2017.04.006 |
| [18] |
Li K, Wang F, Hu ZW. Targeting TRIB3 and PML-RARα interaction against APL[J]. Oncotarget, 2017, 8: 52012. DOI:10.18632/oncotarget.19442 |
| [19] |
Li K, Wang F, Hu ZW. Targeting pseudokinase TRIB3 brings about a new therapeutic option for acute promyelocytic leukemia[J]. Mol Cell Biol, 2017, 4: e1337547. |
| [20] |
Hua F, Shang S, Yang Y, et al. TRIB3 interacts with β-catenin and TCF4 to increase stem cell features of colorectal cancer stem cells and tumorigenesis[J]. Gastroenterology, 2019, 156: 708-721. DOI:10.1053/j.gastro.2018.10.031 |
| [21] |
Yu JM, Sun W, Wang ZH, et al. TRIB3 supports breast cancer stemness by suppressing FOXO1 degradation and enhancing SOX2 transcription[J]. Nat Commun, 2019, 10: 5720. DOI:10.1038/s41467-019-13700-6 |
| [22] |
Driscoll JJ, Minter A, Driscoll DA, et al. The ubiquitin proteasome protein degradation pathway as a therapeutic strategy in the treatment of solid tumor malignancies[J]. Anticancer Agents Med Chem, 2011, 11: 242-246. DOI:10.2174/187152011795255948 |
| [23] |
Akkari L, Gocheva V, Quick ML, et al. Combined deletion of cathepsin protease family members reveals compensatory mechanisms in cancer[J]. Genes Dev, 2016, 30: 220-232. DOI:10.1101/gad.270439.115 |
| [24] |
Dera AA, Ranganath L, Barraclough R, et al. Cathepsin Z as a novel potential biomarker for osteoporosis[J]. Sci Rep, 2019. DOI:10.1038/s41598-019-46068-0 |
| [25] |
Wang HQ, Li YH. Progress in the study of the function of tribbles homologous protein 3[J]. Acta Pharm Sin (药学学报), 2018, 53: 1986-1994. |
| [26] |
Comoli P, Basso S, Riva G, et al. BCR-ABL-specific T-cell therapy in Ph+ ALL patients on tyrosine-kinase inhibitors[J]. Blood, 2017, 129: 582-586. DOI:10.1182/blood-2016-07-731091 |
| [27] |
Chen H, Liu K, Xu L, et al. Haploidentical hematopoietic stem cell transplantation for pediatric Philadelphia chromosome-positive acute lymphoblastic leukemia in the imatinib era[J]. Leukemia, 2017, 59: 136-141. DOI:10.1016/j.leukres.2017.05.021 |
| [28] |
Hua F, Mu R, Liu J, et al. TRB3 interacts with SMAD3 promoting tumor cell migration and invasion[J]. J Cell Sci, 2011, 124: 3235-3246. DOI:10.1242/jcs.082875 |
| [29] |
Hua F, Li K, Yu JJ, et al. TRB3 links insulin/IGF to tumour promotion by interacting with p62 and impeding autophagic/proteasomal degradations[J]. Nat Commun, 2015, 6: 7951. DOI:10.1038/ncomms8951 |
| [30] |
Peeke SZ, Gritsman K. Twist of fate for acute promyelocytic leukemia:TRIB3-TWIST1 interaction promotes resistance[J]. Clin Cancer Res, 2019, 25: 6018-6020. DOI:10.1158/1078-0432.CCR-19-2140 |
| [31] |
Kang KW, Jung JH, Hur W, et al. The potential of exosomes derived from chronic myelogenous leukaemia cells as a biomarker[J]. Anticancer Res, 2018, 38: 3935-3942. DOI:10.21873/anticanres.12679 |
| [32] |
Badger J, Grover P, Shi H, et al. c-Abl tyrosine kinase adopts multiple active conformational states in solution[J]. Biochemistry, 2016, 55: 3251-3260. DOI:10.1021/acs.biochem.6b00202 |
| [33] |
Goussetis DJ, Gounaris E, Wu EJ, et al. Autophagic degradation of the BCR-ABL oncoprotein and generation of antileukemic responses by arsenic trioxide[J]. Blood, 2012, 120: 3555-3562. |
 2020, Vol. 55
2020, Vol. 55


