逐层自组装(layer-by-layer self-assembly, LbL)技术是利用逐层交替沉积的原理, 通过模板表面的化学基团与成膜物质之间的作用力, 在模板表面自发形成具有完整结构和功能的薄膜的一种技术(图 1)[1]。根据现有文献[2], 此概念最早是由Iler在1966年提出的, 通过将表面带有电荷的基片交替吸附带有相反电荷的胶体溶液, 从而制备出一种多层结构。1991年Decher等[3]在宏观表面上利用静电作用交替吸附带相反电荷的聚电解质溶液从而制备出超薄膜, 提出了静电交替沉积技术。由此, LbL引起了研究者的广泛关注, 进入了快速发展期。

|
Figure 1 Simplified molecular picture of the first two adsorption steps, depicting film deposition starting with a positively charged substrate. (Adapted from Ref. 1 with permission. Copyright © 1997 the American Association for the Advancement of Science) |
与其他传统的表面修饰技术相比, LbL最大的优势是其可控性, 通过控制吸附分子层的数量, 可以调控多层膜的物理性质, 如机械性质[4, 5], 壳层厚度可以调整到纳米级的精度; 并且所组装的多层膜的结构和化学性质可以通过改变聚电解质或者其他带电物质种类来调控。其次LbL所使用的模板或核心材料具有灵活性, 可以使用不同粒径的无机或有机颗粒、药物晶体, 甚至可以使用DNA、多肽、蛋白质聚集体和生物细胞作为模板[6-10]。LbL技术的广泛适用性和操作简便性使得该技术拥有深厚的发展潜力, 相信随着相关研究的逐步深入, 该技术在药物递送中会得到更为广泛的应用。
1 LbL成膜材料绝大部分物质都可以用作自组装技术的成膜材料, 材料的可选择范围广, 为LbL得到广泛应用提供了可能性, 同时也为作为药物载体提供了更多的选择性。除了广泛使用的聚电解质外, 碳纳米管、纳米粒和生物大分子均可作为成膜材料。材料的不同物理化学性质也决定了自组装膜的物化性质和结构特点, 因此, 应从研究目的出发来选择合适的成膜材料。
1.1 聚电解质用于LbL成膜的材料最常用的为聚电解质。带有负电荷的聚阴离子电解质可以与带有正电荷的聚阳离子电解质通过静电吸附作用在模板表面自组装成膜。聚电解质的物理化学性质如分子量等会影响自组装膜的结构性质。聚阳离子电解质分子量的增加会使得自组装膜具有较高粗糙度; 分子量小于65 kDa的聚阴离子电解质稳定性更好, 分子量越大, 聚集性越强。此外, 聚电解质电荷密度的增加, 使得电解质之间的静电作用力变大, 因此多层薄膜的厚度也随之增大[11]。
1.1.1 人工合成聚电解质常用的人工合成聚阴离子电解质有聚苯乙烯磺酸钠[sodium poly (styrenesulfonate), PSS]、聚丙烯酸[poly (acrylic acid), PAA]、聚甲基丙烯酸[poly (methacrylic acid), PMA]等; 常用的聚阳离子电解质有聚烯丙基胺盐酸盐[poly (allylamine) hydrochloride, PAH]、聚乙烯亚胺[poly (ethylenimine), PEI]等。Yashchenok等[12]以碳酸钙为模板, 采用PSS/PAH电解质组合在模板上进行膜的自组装。She等[13]以氢氧化钙为模板, 以PAH和戊二醛(glutaraldehyde, GA)为聚电解质组合进行成膜, 自组装结束后去除氢氧化钙模板, 制备出了类红细胞形状的微胶囊, 该微胶囊具有红细胞类似的良好的屈曲性和变形性。
1.1.2 天然聚电解质由人工合成聚电解质自组装成的LbL微胶囊被用于药物递送, 但研究发现这些合成聚电解质由于其细胞毒性和非生物降解性而限制了其向临床的转化。近年来, 包括肽和蛋白质在内的天然高分子[14, 15]或生物聚合物[16]如壳聚糖和硫酸葡聚糖被用于LbL自组装, 以提高自组装膜的生物相容性。常用的天然聚合物电解质[16]有硫酸葡聚糖、透明质酸、壳聚糖、聚赖氨酸、鱼精蛋白、牛血清白蛋白(bovine serum albumin, BSA)和人血清白蛋白等。
1.2 其他成膜材料除了常用的聚电解质分子外, 其他一些带电材料也被用于成膜, 包括带电纳米粒、染料、胶束、嵌段共聚物、树状聚合物、核酸和病毒等。Peng等[17]利用可再生的阳离子胶束(由两亲性的含二硫化物的聚氨基胺形成)和DNA进行LbL成膜, 所制备的薄膜可用于基因定位传递。在其他领域研究中, 一些有机染料也是成膜材料, 如钌(Ⅱ)酞菁。Zhao等[18]利用功能化多壁碳纳米管与(酞菁)钌(Ⅱ)配合键合自组装新薄膜, 进行光电性能的研究。Liu等[19]在纳米脂质体表面制备了海藻酸钠和壳聚糖包覆的聚电解质传递体系。
2 制备方式 2.1 自组装作用力类型 2.1.1 静电作用力静电作用力是一种常用的LbL成膜驱动力。利用带相反电荷的两种成膜物质, 在带电模板上交替吸附沉积, 循环多次成膜。一般以聚电解质为自组装膜材料进行自组装成膜, 其驱动力为静电作用力。如阳离子化酪蛋白与带负电荷的海藻酸钠通过静电作用力制备出聚合物薄膜[20], 类似地, 聚电解质组合聚赖氨酸/透明质酸[21]、聚脲胺/PSS[22]等, 均通过静电吸附进行多层聚电解质膜的制备。静电驱动的自组装过程可以在分子水平上对自组装膜的厚度及结构进行调控。此外, 静电作用作为一种非特异性的作用力, 也可以对膜成分进行调控, 一些功能化的分子可以组装到薄膜中, 使自组装膜更具功能化。然而采用静电作用力作为自组装的驱动力, 要求自组装物质必须带有电荷, 因而, 对自组装材料的选择产生了限制性。
2.1.2 氢键作用力利用成膜材料之间形成氢键同样可以作为LbL成膜的驱动力[23]。与静电驱动的自组装成膜不同的是, 聚合物分子量、离子强度、pH值和温度对氢键薄膜生长和自组装后响应有很大的影响, 所制备的多层膜结构不稳定[24]。因此, 在利用氢键自组装成膜时应考虑上述因素的影响。Zhang等[25]将3种纤维素醚羟乙基纤维素、羟丙基纤维素和甲基纤维素与PAA通过氢键作用组装成薄膜, 所制成的薄膜具有良好的pH值响应性能和良好的水吸附性能, 可以用于各种应用领域, 特别是生物医学领域。采用氢键进行自组装的优势在于一些高分子材料具有疏水性, 难溶于水, 此时可以利用氢键作为驱动力, 在有机溶剂中进行自组装, 将以水为介质拓展到以有机溶剂为介质进行自组装, 扩大了LbL技术的应用范围。
2.1.3 共价键近年来基于以共价键结合为驱动力的LbL逐渐发展起来。该技术是通过成膜材料之间基团进行反应形成共价键的方式触发膜的自组装过程。Hu等[26]在氨基化基底上对硝基苯氧基羰基端超支化聚醚(HBPO-NO2)与PEI在氨基交替进行共价反应制备出了多层膜, 多层膜上有大量剩余反应基团, 也为后续的功能化和制备高性能聚合物提供了可能。相比于传统的基于弱相互作用如静电和氢键等自组装技术, 共价键的键能远远高于静电作用力和氢键键能, 基于共价结合的组装策略能够通过聚合物交联作用提供膜更高的稳定性, 因此不容易在强酸强碱或高离子强度的环境中解离。
2.1.4 电荷转移作用两种成膜材料中一种为电子给体聚合物, 另一种为电子受体聚合物, 两种物质通过电荷转移来进行LbL成膜。该作用方式驱动自组装成膜的示意图见图 2。Shimazaki等[27]以聚[甲基苯烯-2-(3, 5-二硝基苯甲酸)乙烯酯]为电子供体, 聚[甲基丙烯-2-(9-咔唑)-乙基酯]为电子受体, 两种聚合物之间通过电子转移作用形成多层膜。电荷转移的作用力比以上几种作用力强度低, 是一种弱相互作用力, 以此为驱动力所制备的自组装膜的结构稳定性低, 环境因素如介质极性等会对其产生影响。
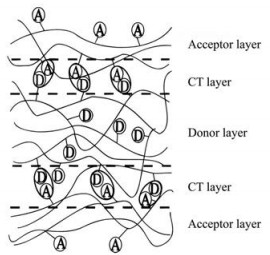
|
Figure 2 Side-view illustration of the deposited film. For simplicity a carbazolyl group and a 3, 5-dinitrobenzoyl group are represented as D and A, respectively. Pairs of D and A forming charge-transfer (CT) complexes are circled. (Adapted from Ref. 27 with permission. Copyright © 1997 American Chemical Society) |
主-客体化学的基本思想是:具有显著“识别能力”的某些冠醚可以作为“主体”, 有选择性地与作为“客体”的底物发生配合[28]。该概念最初是由Donald James Cram提出的。Crespo-Biel等[29]基于客体功能化的树枝状大分子与改性金纳米粒之间的多价超分子相互作用, 逐步构建了一种新型的自组装有机/无机多层结构, 实现了超分子的逐层组装。Suzuki等[30]在环糊精-二茂铁主-客体相互作用的基础上, 发现环糊精二聚体可以有效地制备带正电荷的二茂铁附加聚烯烃的逐层结构。
2.1.6 其他作用除了以上所介绍的作用力外, 还有其他类型的作用力应用于LbL成膜中, 例如酸碱对[31]、金属离子配位[32]和糖-凝集素相互作用[33]等。
2.2 载药方式药物包载在自组装膜中主要分为前载药和后载药两种方式。后载药方式通过改变自组装膜的渗透性, 将药物装载到自组装膜组成的微囊内部。一般通过改变温度、光强、pH值、离子强度和磁场强度等来调控自组装膜的渗透性, 所需改变的环境条件是由自组装膜的材料类型决定, 取决于该材料是温敏材料、光敏材料或磁敏材料等。对于药物载体来说, 这种渗透必须是可逆的, 不能损害自组装材料的性质, 以确保该载体能在体内运输过程中保持完整性, 从而将药物释放到靶部位。一般来说, 除了温度引起的变化外, 大多数变化都是完全可逆的, 将药物包载在囊内后孔隙可以再次密封, 使LbL材料恢复到原来的状态[34]。后装药方式也存在一些缺点, 在自组装膜结束后, 需要去除模板制备成中空的微囊, 在去除模板时往往需要非常苛刻的条件, 例如酸性溶液、碱性试剂或有机溶剂, 这些试剂的使用可能会改变自组装膜的孔隙率, 甚至对自组装膜造成一定程度的损坏。此外, 试剂的残留有可能在药物包载时影响药物的活性。
前载药方式相较后载药方式来说, 更具简便性。采用前载药方式时, 无机多孔微粒如碳酸钙和介孔二氧化硅粒子是应用最为广泛的模板。该载药方式中最常用的策略为共沉淀法, 此外, 还可以通过物理吸附将药物吸附在多孔模板中再进行自组装成膜。值得注意的是, 与后载药方式一样, 在选择溶解模板的溶剂时要考虑溶剂对多层膜的影响, 以及对药物活性的影响。在选用碳酸钙为模板时, 可以用乙二胺四乙酸(EDTA)溶液对其进行溶解, 但以二氧化硅为模板时, 往往采用氢氟酸才能将其完全溶解, 氢氟酸酸性很强, 可能会对膜的完整性产生影响, 下面介绍几种常用的前载药和后载药方式。
2.2.1 共沉淀法共沉淀法是物理笼化的一种, 属于前载药方式。将药物溶解在所制备LbL成膜模板的溶液中, 在制备模板时将药物与模板共同沉淀, 即将药物包埋在固体模板中(图 3Ⅰ)。在自组装成膜结束后, 使用溶剂将模板溶解, 从而将药物留在膜所组成的微囊里。Zyzin等[35]将酶与碳酸钙粒子共沉淀, 使酶包埋在碳酸钙粒子中, 分别采用PSS/PAH、硫酸葡聚糖/聚精氨酸为成膜材料, 最后用EDTA将碳酸钙粒子溶解, 将酶包埋在聚电解质微囊内。

|
Figure 3 Schematic representation of different ways to prepare the shell loaded drugs. Ⅰ: Coprecipitation; Ⅱ: Adsorption of drugs on template; Ⅲ: The stimulus response drives drug diffusion into the shell |
扩散驱动属于后载药方式, 自组装所形成的膜可以根据周围环境介质的pH值、温度、离子强度或介电常数的变化, 来调控胶囊壁的通透性, 使其处于打开或关闭的状态, 以此将目标药物搭载在微囊中(图 3Ⅲ )。Antipov等[36]研究发现在pH值为2.0时, 荧光素晶体能够扩散到PSS/PAH多层膜上, 从释放曲线可以发现, 荧光素通过多层聚电解质膜扩散的渗透系数依赖于pH值和离子强度。然而采用扩散驱动这一方法包载药物, 大部分药物只能搭载在自组装膜壁上, 只有很少一部分能够通过膜上的孔进入囊腔内。Tiourina等[37]发现聚电解质膜与蛋白溶液孵育后, 只有10% α-胰凝乳蛋白酶被中空(PSS/PAH)4微囊捕获, 90%蛋白质被牢牢地吸附在胶囊壁上。
2.2.3 物理吸附吸附可以分为两类:一类是直接将制备好的聚电解质膜置于药物溶液中进行孵育。与扩散驱动类似, 该方法为后载药方式, 大部分药物被吸附在囊壁上, 少部分药物进入囊内; 另一类是将自组装成膜所用的模板与药物溶液共孵育, 然后进行自组装成膜, 将模板去除后, 将药物置于自组装膜囊内(图 3Ⅱ), 该方式属于前载药。
一般来说, 药物封装在膜内或微囊内是由以下一种或多种相互作用驱动: ①共价键作用; ②疏水相互作用; ③氢键或静电相互作用吸附; ④物理笼化[35]。物理相互作用和笼化, 如静电相互作用或扩散到微囊内的孔隙, 原则上比化学方法更有利。因为不需要形成共价键, 静电作用或氢键的键能远远低于共价键的键能, 所以药物的包载和释放在理论上是可逆的, 在后续药物释放时能够提高药物的释放率。
3 体内外释放对于新药研究来说, 药物的体内外释放是研究的重点之一。近年来, 随着各种新型药物递送系统的出现, 药物的释药行为研究不再局限于片剂、胶囊剂等普通剂型。随着自组装技术在药学中的不断深入研究, 以自组装膜为载药系统的释药行为也会成为研究的重点。就自组装膜而言, 其释放机制可以从以下几个方面考虑。首先, 以“自杀”方式释药, 即搭载药物的自组装膜进入体内后被降解从而释放出药物; 其次, 作为药物包载进囊内的逆过程, 可以根据自组装膜的物理化学性质, 通过环境响应来改变自组装膜的渗透性和孔隙率, 从而调控药物的释放。
3.1 自组装膜降解自组装膜降解的方式可以有水解和酶解等, 可以通过调节降解条件来实现药物的控缓释释放。Dimitrova等[38]利用透明质酸和壳聚糖进行LbL成膜, 制备出的多层聚电解质膜搭载siRNA (small interference RNA), 治疗丙型肝炎病毒, 借助细胞内的透明质酸酶来降解该多层聚电解质膜, 从而使siRNA从膜中释放出来, 达到治疗疾病的目的。然而利用体内酶对其进行降解仍有缺陷, 例如其可控性, 当其进入体内后, 对其可干预性会降低, 无法对其在体内的行为进行精准调控。除酶降解外, 利用溶剂效应也可以释放药物, 大部分制备的多层聚电解质膜不溶于水, 而可溶解在乙醇中[39]。因此, 可以用乙醇来破坏聚电解质膜, 达到药物释放的目的。
3.2 响应机制除了降解方式之外, 还可以根据自组装膜的物理化学性质, 将其设计成环境响应型药物载体, 如光敏、温敏、磁敏、pH响应和超声响应等。所使用的成膜材料类型决定载体的响应模式, 通过调整与之相适应的环境条件, 使自组装膜对条件变化做出渗透性改变的刺激性响应, 从而调控药物的释放。
3.2.1 光敏载体光敏基团的存在使得光敏载体成为可能。光敏载体[40]的响应机制为:利用光敏材料自组装成膜, 其具有光敏性质, 在光的照射作用下, 带有光敏基团的膜结构会发生形变或降解, 使得渗透性发生改变, 从而实现控制药物的释放。由于光的照射强度、种类和照射时间等可以改变, 可通过调节这些参数来调控药物的释放行为。常用的应用于LbL技术的光敏材料有含偶氮染料刚果红[41]、偶氮苯[42]、卟啉[43]、金纳米粒[44, 45]和银纳米粒[46, 47]等。Ren等[48]制备了含有二烯酰胺官能团的光敏聚电解质多层膜, 聚阳离子主链是由二(1-羟基癸基)二烯酰胺和1, 4-双(2-羟基乙基)哌嗪与2, 4-二异氰基甲苯共聚而成, PSS为聚阴离子电解质, 在可见光的照射下, 其薄膜会逐渐破损, 从而释放模型药物8‐羟基芘‐1, 3, 6‐三磺酸三钠盐, 5 h的累计释放量约为80%。在所涉及的响应类型中, 光敏应用较为广泛, 与其他响应类型相比, 光响应具有高效、无创伤性等优势。此外, 光响应载体不需要体内化学环境的改变, 减少了通过体外手段来改变内部化学环境所带来的不良反应, 其可控性更高。与具有高能量的紫外光相比, 虽然前者穿透能力强, 但对机体的损伤很大。因此, 近红外光是理想的光源, 可穿透10 cm左右厚度的组织, 且损伤小[49]。
3.2.2 温敏载体随着温敏材料的研究发展, 选用温敏型材料来控制药物释放成为一种常规方法。针对自组装技术, 可以采用具有温敏性质的聚合物作为成膜材料, 自组装成膜后通过控制温度调控药物的释放行为。该响应模式的原理是随着环境温度的改变, 使得温敏材料制备的自组装膜发生收缩或膨胀等结构变化, 从而改变其通透性; 温度的升高引起了层间的重组和部分脱水, 从而改变了渗透率和释放曲线[50]。水凝胶类物质是LbL技术中较为常用的温敏材料, 如聚N-异丙基丙烯酰胺在温度接近31 ℃时, 会发生溶胀-收缩可逆变化, 这种转变改变了凝胶的孔隙率, 可用来进行药物的包载和释放[51, 52]。Zhu等[53]采用单宁酸与温度响应型嵌段共聚物胶束[由聚(N-异丙基丙烯酰胺)和聚(N-乙烯基吡咯烷酮)组成]进行自组装成膜, 以多柔比星(doxorubicin, DOX)作为模型药物, 当温度为37 ℃时DOX的24 h释放量仅为10%, 而当温度降低到20 ℃左右则会发生的膨胀/收缩过程而导致DOX从外壳中快速释放, 30 min的释放量约20%。温敏型载体同样存在一定的自身缺陷, 温度的变化可能会对所包载药物(低温冷藏药物)的活性产生影响, 因而影响治疗效果。
3.2.3 磁敏载体磁响应载体也是研究的热点, 可以通过磁场将药物运载到靶部位, 实现药物的靶向释放。磁敏响应的控释主要基于以下原理:在膜壁上嵌入磁性纳米粒, 可以利用外部磁场引起磁性纳米粒的震动, 从而使得膜通透性改变或破坏自组装膜, 实现药物的释放。Lu等[47]以PSS和PAH为成膜材料自组装成膜搭载钴纳米粒, 使用交变电磁场引发粒子的震动从而改变自组装膜的渗透性, 达到释放药物的目的。但这种方法具有一定的局限性, 对于磁敏载体来说, 需要较长的曝光时间和较强的磁场才能使自组装膜的渗透性改变, 而处于此磁场条件下会引起局部温度的升高, 这样的温度可能会引起药物活性的下降和对身体某些组织的破坏。
3.2.4 pH响应载体对于通过静电作用或氢键作用进行组装的膜, 可以通过调节pH值控制药物的释放。其主要原理可以分为两类: ①改变pH值使得药物与膜的结合力变弱, 从而使得药物从膜上解离; ②改变pH值使得自组装膜通透性改变。一般改变溶液的pH值, 会造成弱聚电解质离子强度或电离度的改变, 从而引起成膜材料之间作用力的变化, 使得膜的渗透性发生变化, 渗透性的改变使得药物从微囊中释放出来。由pH值变化介导的药物释放可以在目标组织或细胞中实现控释的效果, 如胃的pH值为1~2、肠的pH值为8.4和肿瘤微酸性环境等, 利用pH值的差异可以将药物递送到靶部位进行释放。一般来说, 自组装膜中含有一种弱聚电解质即可设计成pH响应型载体, PAH是LbL技术中最常用的一种弱聚电解质。Dejugnat等[54]研究发现由PSS和PAH组成的多层聚电解质膜在pH值大于11.2时会引起膜的溶胀, 从而改变膜的通透性, 增加孔隙率, 便于药物的释放。Serizawa等[55]采用聚乙烯基胺和PAA来自组装成pH敏感的聚电解质膜, 以阴离子染料阿卢拉红(allura red, AR)作为模型药物考察释放行为, 研究发现在pH值为10和12时AR释放加速, 在30 min后几乎全部释放, 而在pH值为中性和微酸性时, AR的释放非常缓慢, 从而达到药物的缓释效果。当应用pH响应载体时, 应考虑病变组织环境与正常组织环境pH值的差异, 若两者差异较小, 则释药行为无显著区别, 从而不能实现靶向释放药物。pH响应载体是根据内环境的差异发挥作用的, 无法在体外对其进行干预, 可控性低。
3.2.5 超声响应超声在医学中的应用很常见, 超声波诊断是一种常规的诊断方法, 因此设计超声响应载体的安全性得到保障。该响应模式的原理是在高频率的超声处理下, 超声效应会使得自组装膜的结构受到破坏, 从而改变膜的通透性, 使得药物从囊腔中释放出来。Shchukin等[56]以PSS/PAA电解质组合进行自组装成膜制备了Fe3O4/PSS/PAA微囊, 以荧光标记的葡聚糖为模型药物, 对其进行时长1 min的超声处理后, 囊壁被完全损坏, 葡聚糖完全释放, 然而该响应机制同样存在一些缺陷, 要控制超声强度和超声时间, 使其处于机体的安全范围内, 以确保安全性。此外, 超声时会产生热量, 使局部温度升高, 与温敏型载体一样, 温度的升高会对周围组织及所包载的药物活性产生影响。
3.2.6 其他响应型载体除了上述类型之外, 还有多种响应载体, 如使用机械变形和张力也可以触发药物从LbL胶囊中释放, 因为影响了稳定性, 诱导了胶囊破裂, 也可以作为触发药物释放的刺激。此外, 氧化还原引发释放也是比较常用的策略, 细胞内环境可以作为具有还原性的环境, 在此环境下发生氧化还原反应, 使微囊得到破坏, 为胶囊释放活性药物提供机会。Yan等[57]利用PMA和聚乙烯吡咯烷酮自组装成聚电解质膜包载DOX, 借助癌细胞的还原环境发生氧化还原反应从而释放DOX, 其效果优于游离DOX。
无论哪种响应模式载体, 都存在其自身的优势和缺陷。因此, 在设计刺激响应性药物载体时, 要从膜材料性质、药物的理化性质、病变组织和正常组织的差异, 以及刺激的安全性等方面进行综合考虑, 从而设计出兼具可控性和安全性的理想药物递送载体。
4 LbL药效学和药代动力学评价100多年前, Paul提出了一种理想的药物载体, 具有如下特征:药物荷载能力、药物释放能力、长循环、靶向性和无毒[58]。LbL自组装膜作为一种药物载体也应具有这样的特性, 不仅具有缓控释能力, 还应具有靶向性, 延长体内循环时间, 从而能减少患者服药次数, 增强顺应性。
4.1 靶向性评价对于载药系统来说, 研究的目的不仅是局限于载药这一作用, 靶向性和缓控释等功能化载药系统是一种理想的目标。自组装膜作为药物载体也可实现被动靶向和主动靶向, 主要基于以下3个策略: ①利用生理环境的差异产生被动靶向。使用不同的刺激响应材料不仅可以控制被包载药物的释放, 可以对药物的分布起到关键作用, 直至达到特定的靶标。许多大分子材料如果胶[59]、海藻酸[19]和变形淀粉[60]等, 已应用于自组装膜的外层以增强对胃酸性环境的抵抗力。Elbaz等[61]利用聚精氨酸和海藻酸自组装成膜, 以姜黄素为模型药物, 通过改变pH值发现, 该递送系统在模拟胃的酸性条件时, 表现出延迟释放的行为; 在肠道的碱性条件下, 表现出突释的释药行为, 为结肠癌靶向治疗提供了良好的基础; ② LbL自组装膜表面丰富的可修饰性也为其提供了主动靶向能力。通过在膜表面修饰与病变部位高表达分子相对应的靶向基团, 从而介导该载体将药物递送到靶部位。常用的靶向受体有:整合素[62]、叶酸受体[63]、CD44受体[64]和核酸适配体靶向配体[65]等; ③自组装膜自身特异性材料被内源性受体识别。透明质酸作为膜材料制备的自组装膜具有特异性, 可以被肿瘤细胞高表达的CD44受体识别[64]。这种策略的缺陷在于有可能产生脱靶, 使其失去靶向的能力, 如胃肠道内的Toll样受体也能识别透明质酸[66]。
4.2 药代动力学评价独特的膜材料使得自组装膜药物载体在体内运输时表现出了循环时间长和生物利用度高等优势。带正电的聚电解质及其他一些带正电荷的成膜材料自组装成膜后, 膜上的正电荷会与带负电荷的细胞膜发生静电相互作用, 从而增强其在细胞膜上的保留程度, 促进细胞摄取, 进一步提高生物利用度。带正电荷的壳聚糖因其丰富的天然资源、良好的生物相容性、良好的正电荷和良好的交联性能而倍受关注, 常被用作自组装技术的成膜材料。在一些研究中发现, 乙二醇壳聚糖自组装膜可抑制P-糖蛋白介导的细胞外排, 从而增强药物在体内的循环时间和细胞积累[67]; 壳聚糖作为一种黏附层, 通过延长在肠道中的停留时间来增强相互作用, 打开紧密的上皮连接, 促进细胞旁运输[68]。此外, 可以通过调节LbL膜体系的亲水性促进内吞作用, 提高黏液层渗透率[69]。
Huang等[70]使用阿拉伯胶(gum arabic, GA)和O-羧甲基壳聚糖(O-carboxymethyl chitosan, OCMC)为成膜材料自组装成膜, 以奥美拉唑为药物模型, 将奥美拉唑包载在GA-OCMC膜中, 并与0.1 mg·mL-1京尼平交联, 研究显示, 与单纯的奥美拉唑相比, 该药物递送系统使得奥美拉唑的口服生物利用度提高了8.76倍。Ramasamy等[71]采用聚赖氨酸和聚乙二醇/聚天冬氨酸在脂质体上进行自组装成膜, 包载DOX和米托蒽醌两种药物, 研究显示, LbL膜结构显著降低了两种药物的体内清除率, 与游离DOX相比, 该载药系统使得DOX的半衰期从1 h提高到5.8 h, 显著延长了其体循环时间。
自组装膜药物载体的体内组织分布研究除了验证其靶向性能外, 也对其安全性有一定的指导作用。非特异性的组织分布可能对其他组织器官产生毒性, 从而引起不良反应, 降低其安全性。
5 LbL载体安全性评价药品的安全性不仅体现在药物活性成分本身, 一些新型递药系统的出现, 使得药物载体对机体安全性问题也应受到重视。为了减少不良反应的产生, 必须考虑LbL成膜材料的生物相容性, 应尽可能选择低毒或无毒的材料进行自组装成膜。目前已被FDA批准用于医学领域的大部分高分子或生物聚合物, 如壳聚糖、阿拉伯胶和葡聚糖等, 均可以作为自组装膜材料, 从而避免对机体产生较大毒性反应。
5.1 毒性评价载体自身的毒性评价是保证药物安全性的重要内容。Gao等[72]以PAH为聚阳离子电解质, 以己二酸乳糖乙烯酯/对苯乙烯磺酸钠共聚物[poly (vinyl lactose ester-co-sodium p-styrenesulfonate), PLESS]为聚阴离子电解质自组装成膜, 对其进行MTT活性实验, 结果表明在PLESS浓度不超过100 μg·mL-1内, 对细胞存活率基本无影响, 没有明显的细胞毒性, 具有良好的生物相容性。Men等[73]以透明质酸和聚β-氨基酯自组装形成多层聚电解质膜, 并用来包载DOX脂质体, 体内实验结果表明, 该载药模型能有效抑制肿瘤生长, 提高荷瘤小鼠的存活率和治疗效果, 与游离药物相比, LbL自组装膜包载药物能减少不良反应, 未载药的自组装膜的毒性实验显示其没有明显的细胞毒性。
5.2 血液相容性血液相容性研究是指所选用的自组装成膜材料在进入人体后, 是否会出现凝血、血细胞黏附等问题。自组装层膜的材料种类及其进入血液后的浓度会影响血液相容性。肝素具有抗凝血的作用, 因此有研究采用肝素作为成膜材料, 或在膜表面涂一层肝素来避免凝血的发生。Chou等[74]以钛为基底, 以胶原和肝素为成膜材料在其表面自组装多层膜, 研究了胶原/肝素膜的血液相容性和黏附强度, 结果显示, 在形成5层膜后, 血小板黏附明显减少, 在钛表面包覆胶原/肝素多层膜的抗凝性能优于未包覆的钛。Peng[75]研究显示, 在(PSS/PAH)5多层膜外层通过戊二醛交联后分别接枝聚乙二醇和BSA后, 一定浓度下均无溶血性, 抗凝血性能较好, 具有良好的血液相容性。
具有良好生物相容性和生物可降解性的成膜材料是提高药物载体安全性的前提。此外, 其物理特性也会对其安全性产生影响, 如载体的尺寸大小。药物载体的体内分布特征与其尺寸大小有关, 继而影响其毒性。成膜材料的机械性能也可能会引发安全性问题, 具有类红细胞样的屈曲性的材料可以用来设计微米级别的药物载体, 不但载药量大, 其变形能力使其在血液运输时能够顺利通过血管, 不发生堵塞, 这样的成膜材料具有很大的研究价值。
6 LbL用于不同类别药物递送应用LbL技术制备的微囊可以作为药物载体搭载各类药物, 在包载小分子药物、蛋白多肽类药物、基因药物及共载多种药物等方面展现出优势。此外, 表面的可修饰性增加了该载体的靶向性从而减少不良反应, 提高药物的生物利用度, 也促进了LbL在抗肿瘤药物给药载体方面的应用。
6.1 LbL用于递送小分子化学药物采用LbL技术所制备的自组装膜作为药物载体, 最常选择的模型药物为小分子治疗药物。目前已有多种小分子药物应用于自组装膜作为药物载体的研究中, 如紫杉醇[76]、DOX[71, 73]、布洛芬[77]和姜黄素[61]等。众所周知, 肿瘤药物的靶向递送仍存在诸多挑战, 如药物对肿瘤组织的穿透力有限、在肿瘤部位的浓度低和在体内不受控制的分布而带来严重的不良反应等。LbL技术可以通过调控各种成膜参数如膜架构[78]、厚度[79]、化学和机械性能[80], 以及控制载药量[81]和释放[82]来应对这些挑战。如前所述, 自组装膜表面丰富的可修饰性及不同响应类型材料的应用, 促进其在抗肿瘤方面实现靶向和缓控释递送。Han等[83]以连接宁康酸酐的PAH和半乳糖修饰的三甲基半胱氨酸壳聚糖进行自组装成膜, 并负载抗肿瘤药物DOX, 研究显示, 膜上的半乳糖可以识别肝癌细胞表达的无唾液酸糖蛋白实现靶向; 肿瘤的微酸性环境使膜上的PAH-酸酐侧链水解, 从而破坏自组装膜, 实现药物释放。
6.2 LbL用于递送蛋白多肽药物在介绍LbL的成膜部分提及蛋白多肽作为膜材料的应用, 此外, 蛋白多肽也可作为模型药物利用LbL技术实现递送。蛋白多肽类药物易降解易变性, LbL技术的出现为蛋白多肽类药物的包封提供了更多的选择性。自组装膜作为药物载体可以使蛋白多肽类药物在到达靶部位前得到充足的保护, 并且在给药方式上不局限于注射, 也为口服、黏膜等给药途径提供了可选择性。目前已有多种蛋白多肽类物质采用自组装膜进行递送研究, 如抗原[84]、生长因子[85]和酶类[37]等。以生长因子为例, 其半衰期短, 注射后非特异性分布严重, 并且难以对其释放进行控制。Facca等[86]将生长因子骨形态发生蛋白-2和转化生长因子-β包载到由聚赖氨酸和聚谷氨酸组成的多层膜中, 经皮下注射到小鼠体内, 胚胎出现成骨分化, 该多层膜保护了生长因子不被降解, 显示了基于LbL的载药系统包载蛋白多肽类药物进行递送具有较大的潜力。
6.3 LbL用于递送基因药物通过自组装技术所形成的薄膜为带电荷的基因药物的负载提供了可能。带有负电荷的DNA[87, 88]和同样带负电荷的siRNA[87, 89]可以利用静电作用交替沉积在薄膜中, 实现基因药物的负载。此外, 利用核酸自组装可以实现基因药物的递送。siRNA药物在目前基因药物中研究较为广泛, 可以利用siRNA之间的偶联自组装[90, 91]递送siRNA药物。Son等[92]以金纳米粒为基底, 将抗血管内皮生长因子的siRNA的正义链和反义链分别与金纳米粒结合, 然后通过碱基配对作用形成纳米结构, 再在其外层吸附PEI, 将其注入荷瘤小鼠中, 研究显示, 其能抑制肿瘤血管生成, 具有较好的治疗效果。核酸自组装在基因药物递送方面能显著提高递送效率, 延长体内循环时间, 增强治疗效果。
6.4 LbL共载多种药物自组装膜所形成的核壳结构为多种药物的共同负载奠定了基础, 其膜壁与中空的囊腔均可以负载药物。在肿瘤药物治疗方面, 往往采用基因药物和小分子治疗药物协同治疗, 增强治疗效果。因此, 可以采用自组装膜作为药物载体同时搭载两种药物。Yao等[93]以包载索拉菲尼的阳离子脂质体为核心, 然后在其表面采用siRNA和羧甲基壳聚糖通过静电相互作用进行自组装成膜。体内实验结果显示, 肿瘤中有较多的siRNA和索拉菲尼的积累, 具有较好的抗肿瘤效果。多种药物共载的实现能够降低给药次数, 药物之间的协同作用也可增强治疗效果。因此, LbL技术在共载递送方面具有很大的潜力。
7 总结与展望LbL技术因其简便性、灵活性和可控性受到各行各业研究人员的关注。利用自组装膜作为药物载体, 也展现出了该技术的强大优势。本文介绍了LbL技术常用的成膜材料, 以及成膜材料自组装成膜所涉及的作用力类型, 除了经典的静电作用力外, 还包括氢键、共价键、主客体和电荷转移等。成膜材料类型和作用力类型与自组装膜的物理化学性质和结构性质息息相关, 如薄膜厚度、孔隙率和稳定性等。
将药物包载在膜内的方法主要分为前载药和后载药两类, 常使用的方法为共沉淀法、静电或氢键作用力驱动的药物扩散以及物理吸附。无论哪种方式, 都应注意溶解模板所使用溶剂对自组装膜性质的影响, 这决定了药物是否能成功包载在囊内, 实现靶向和缓控释。此外, 所使用的成膜材料也决定了药物的释放机制。除通过酶降解自组装膜外, 还可以利用成膜材料的性质, 通过改变pH值、光、温度、磁和超声等环境条件调控自组装膜的渗透性, 以实现药物的缓控释。LbL技术的应用可以改变药物的生理特性, 增加半衰期, 延长体内循环时间, 避免过早的被网状内皮系统清除, 提高药物的生物利用度, 并且具有良好的生物相容性。
LbL为药物递送系统的构建提供了一种新的手段, 自组装膜作为药物载体展现出巨大潜力。从包载单一药物到共载多种药物、包载小分子药物到包载基因药物, 已有诸多研究聚焦LbL技术制备药物载体的应用, 自组装膜表面丰富的可修饰性也为其成为功能化载体奠定了基础。就目前临床转化情况来看, 大多数研究只停留在基础阶段, 几乎没有关于LbL作为载体的药物上市甚至临床试验的报道。LbL技术仍面临着可规模化生产和体内研究不足的挑战。相信随着今后相关研究的不断深入, 这些问题的解决能够使以LbL作为载体的药物更快地进入临床, 发挥其优势, 得到良好的应用。
作者贡献: 邸金威为本文的主要撰写者, 杜祎萌和刘楠为图片绘制者, 高翔和张慧负责相关文献的审核, 郑爱萍和高静为本文的通讯作者, 负责指导修改。
利益冲突: 所有作者均不存在利益冲突。
| [1] |
Decher G. Fuzzy nanoassemblies:toward layered polymeric multicomposites[J]. Science, 1997, 277: 1232-1237. DOI:10.1126/science.277.5330.1232 |
| [2] |
Iler RK. Multilayers of colloidal particles[J]. J Colloid Interf Sci, 1966, 21: 569-594. DOI:10.1016/0095-8522(66)90018-3 |
| [3] |
Decher G, Hong JD. Buildup of ultrathin multilayer films by a self-assembly process. 1. Consecutive adsorption of anionic and cationic bipolar amphiphiles on charged surfaces[J]. Makromol Chem Macromol Symp, 1991, 46: 321-327. DOI:10.1002/masy.19910460145 |
| [4] |
Fery A, Dubreuil F, Mohwald H. Mechanics of artificial microcapsules[J]. New J Phys, 2004, 6: 1-13. DOI:10.1088/1367-2630/6/1/001 |
| [5] |
Lulevich VV, Radtchenko IL, Sukhorukov GB, et al. Deformation properties of nonadhesive polyelectrolyte microcapsules studied with the atomic force microscope[J]. J Phy Chem, 2003, 107: 2735-2740. DOI:10.1021/jp026927y |
| [6] |
Jiang B, Defusco E, Li B. Polypeptide multilayer film co-delivers oppositely-charged drug molecules in sustained manners[J]. Biomacromolecules, 2010, 11: 3630-3637. DOI:10.1021/bm1010855 |
| [7] |
Ai H, Jones SA, de Villiers MM, et al. Nano-encapsulation of furosemide microcrystals for controlled drug release[J]. J Control Release, 2003, 86: 59-68. DOI:10.1016/S0168-3659(02)00322-X |
| [8] |
Trubetskoy VS, Loomis A, Hagstrom JE, et al. Layer-by-layer deposition of oppositely charged polyelectrolytes on the surface of condensed DNA particles[J]. Nucleic Acids Res, 1999, 27: 3090-3095. DOI:10.1093/nar/27.15.3090 |
| [9] |
Balabushevich NG, Tiourina OP, Volodkin DV, et al. Loading the multilayer dextran sulfate/protamine microsized capsules with peroxidase[J]. Biomacromolecules, 2003, 4: 1191-1197. DOI:10.1021/bm0340321 |
| [10] |
Swiston AJ, Cheng C, Um SH, et al. Surface functionalization of living cells with multilayer patches[J]. Nano Lett, 2008, 8: 4446-4453. DOI:10.1021/nl802404h |
| [11] |
Shende P, Patil A, Prabhakar B. Layer-by-layer technique for enhancing physicochemical properties of actives[J]. J Drug Deliver Sci Technol, 2020, 56: 101519. DOI:10.1016/j.jddst.2020.101519 |
| [12] |
Yashchenok A, Parakhonskiy B, Donatan S, et al. Polyelectrolyte multilayer microcapsules templated on spherical, elliptical and square calcium carbonate particles[J]. J Mater Chem B, 2013, 1: 1223-1228. DOI:10.1039/c2tb00416j |
| [13] |
She SP, Li QQ, Shan BW, et al. Fabrication of red-blood-cell-like polyelectrolyte microcapsules and their deformation and recovery behavior through a microcapillary[J]. Adv Mater, 2013, 25: 5814-5818. DOI:10.1002/adma.201302875 |
| [14] |
Lvov Y, Onda M, Ariga K, et al. Ultrathin films of charged polysaccharides assembled alternately with linear polyions[J]. J Biomater Sci Polym Ed, 1998, 9: 345-355. DOI:10.1080/09205063.1998.9753060 |
| [15] |
Caruso F, Furlong DN, Ariga K, et al. Characterization of polyelectrolyte? Protein multilayer films by atomic force microscopy, scanning electron microscopy, and fourier transform infrared reflection? Absorption spectroscopy[J]. Langmuir, 1998, 14: 4559-4565. DOI:10.1021/la971288h |
| [16] |
Villiers MMD, Lvov YM. Layer-by-layer self-assembled nanoshells for drug delivery[J]. Adv Drug Deliver Rev, 2011, 63: 699-700. DOI:10.1016/j.addr.2011.06.001 |
| [17] |
Peng N, Xue YN, Xia XM, et al. Bioreducible cationic micelle/DNA multilayered films for localized gene delivery[J]. J Control Release, 2011, 152: e166-e167. DOI:10.1016/j.jconrel.2011.08.066 |
| [18] |
Zhao W, Tong B, Shi J, et al. Fabrication and optoelectronic properties of novel films based on functionalized multiwalled carbon nanotubes and (phthalocyaninato) ruthenium (Ⅱ) via coordination bonded layer-by-layer self-assembly[J]. Langmuir, 2010, 26: 16084-16089. DOI:10.1021/la1022196 |
| [19] |
Liu W, Liu J, Liu W, et al. Improved physical and in vitro digestion stability of a polyelectrolyte delivery system based on layer-by-layer self-assembly alginate-chitosan-coated nanoliposomes[J]. J Agric Food Chem, 2013, 61: 4133-4144. DOI:10.1021/jf305329n |
| [20] |
Zhang YX, Ma JZ, Xu QN. Polyelectrolyte complex from cationized casein and sodium alginate for fragrance controlled release[J]. Colloids Surf B, 2019, 178: 439-444. |
| [21] |
Velk N, Uhlig K, Vikulina A, et al. Mobility of lysozyme in poly(L-lysine)/hyaluronic acid multilayer films[J]. Colloids Surf B, 2016, 147: 343-350. DOI:10.1016/j.colsurfb.2016.07.055 |
| [22] |
Shi J, Wang XJ, Xu SH, et al. Reversible thermal-tunable drug delivery across nano-membranes of hollow PUA/PSS multilayer microcapsules[J]. J Membr Sci, 2016, 499: 307-316. DOI:10.1016/j.memsci.2015.10.065 |
| [23] |
Kharlampieva E, Kozlovskaya V, Sukhishvili SA. Layer-by-layer hydrogen-bonded polymer films:from fundamentals to applications[J]. Adv Mater, 2009, 21: 3053-3065. DOI:10.1002/adma.200803653 |
| [24] |
Kharlampieva E, Sukhishvili SA. Hydrogen-bonded layer-by-layer polymer films[J]. J Macromol Sci Part C, 2006, 46: 377-395. DOI:10.1080/15583720600945386 |
| [25] |
Zhang X, Lin F, Yuan Q, et al. Hydrogen-bonded thin films of cellulose ethers and poly(acrylic acid)[J]. Carbohydr Polym, 2019, 215: 58-62. DOI:10.1016/j.carbpol.2019.03.066 |
| [26] |
Hu X, Ji J. Covalent layer-by-layer assembly of hyperbranched polyether and polyethyleneimine:multilayer films providing possibilities for surface functionalization and local drug delivery[J]. Biomacromolecules, 2011, 12: 4264-4271. DOI:10.1021/bm201137x |
| [27] |
Shimazaki Y, Mitsuishi M, Ito S, et al. Preparation of the layer-by-layer deposited ultrathin film based on the charge-transfer interaction[J]. Langmuir, 1997, 13: 1385-1387. DOI:10.1021/la9609579 |
| [28] |
Gao LZ. " Host-guest chemistry", supramolecular chemistry and "heterogeneous catalysis"[J]. Chin J Chem Edu (化学教育), 1990, 5: 12. |
| [29] |
Crespo-Biel O, Dordi B, Reinhoudt DN, et al. Supramolecular layer-by-layer assembly:alternating adsorptions of guest- and host-functionalized molecules and particles using multivalent supramolecular interactions[J]. J Am Chem Soc, 2005, 127: 7594-7600. DOI:10.1021/ja051093t |
| [30] |
Suzuki I, Egawa Y, Mizukawa Y, et al. Construction of positively-charged layered assemblies assisted by cyclodextrin complexation[J]. Chem Commun, 2002(2): 164-165. DOI:10.1039/b108771c |
| [31] |
Li D, Jiang YD, Wu ZM, et al. Fabrication of self-assembled polyaniline films by doping-induced deposition[J]. Thin Solid Films, 2000, 360: 24-27. DOI:10.1016/S0040-6090(99)00948-7 |
| [32] |
Hatzor A, van der BoomMoav T, Yochelis S, et al. A metal-ion coordinated hybrid multilayer[J]. Langmuir, 2000, 16: 4420-4423. DOI:10.1021/la0001979 |
| [33] |
Anzai JI, Kobayashi Y. Construction of multilayer thin films of enzymes by means of sugar? Lectin interactions[J]. Langmuir, 2000, 16: 2851-2856. DOI:10.1021/la9910024 |
| [34] |
Guzmán E, Mateos-Maroto A, Ruano M, et al. Layer-by-layer polyelectrolyte assemblies for encapsulation and release of active compounds[J]. Adv Colloid Interface Sci, 2017, 249: 290-307. DOI:10.1016/j.cis.2017.04.009 |
| [35] |
Zyzin MV, Ramos-Cabrer P, Carregal-Romero S. Encapsulation of enzymes in porous capsules via particle templating[J]. Methods Mol Biol, 2020, 2100: 227-241. |
| [36] |
Antipov AA, Sukhorukov GB, MoHwald H. Influence of the ionic strength on the polyelectrolyte multilayers' permeability[J]. Langmuir, 2003, 19: 2444-2448. DOI:10.1021/la026101n |
| [37] |
Tiourina OP, Antipov AA, Sukhorukov GB, et al. Entrapment of chymotrypsin into hollow polyelectrolyte microcapsules[J]. Macromol Biosci, 2001, 1: 209-214. DOI:10.1002/1616-5195(20010701)1:5<209::AID-MABI209>3.0.CO;2-Y |
| [38] |
Dimitrova M, Affolter C, Meyer F, et al. Sustained delivery of siRNAs targeting viral infection by cell-degradable multilayered polyelectrolyte films[J]. Proc Natl Acad Sci U S A, 2008, 105: 16320-16325. DOI:10.1073/pnas.0800156105 |
| [39] |
Lvov Y, Antipov AA, Mamedov A, et al. Urease encapsulation in nanoorganized microshells[J]. Nano Lett, 2001, 1: 125-128. DOI:10.1021/nl0100015 |
| [40] |
Qi JP, Lu Y, Dong XC, et al. In vivo fate study of drug nanocarriers:the applications of environment-responsive fluorescent dyes[J]. Acta Pharm Sin (药学学报), 2019, 54: 1965-1975. |
| [41] |
Tao X, Li J, Möhwald H. Self-assembly, optical behavior, and permeability of a novel capsule based on an azo dye and polyelectrolytes[J]. Chemistry, 2004, 10: 3397-3403. DOI:10.1002/chem.200400024 |
| [42] |
Bédard M, Skirtach AG, Sukhorukov GB. Optically driven encapsulation using novel polymeric hollow shells containing an azobenzene polymer[J]. Macromo Rapid Commun, 2007, 28: 1517-1521. DOI:10.1002/marc.200700257 |
| [43] |
Fan F, Wang L, Li F, et al. Stimuli-responsive layer-by-layer tellurium-containing polymer films for the combination of chemotherapy and photodynamic therapy[J]. ACS Appl Mater Interfaces, 2016, 8: 17004-17010. DOI:10.1021/acsami.6b04998 |
| [44] |
Skirtach AG, Dejugnat C, Braun D, et al. The role of metal nanoparticles in remote release of encapsulated materials[J]. Nano Lett, 2005, 5: 1371-1377. DOI:10.1021/nl050693n |
| [45] |
De Geest BG, Skirtach AG, De Beer TRM, et al. Stimuli-responsive multilayered hybrid nanoparticle/polyelectrolyte capsules[J]. Macromo Rapid Commun, 2010, 28: 88-95. |
| [46] |
Skirtach AG, Antipov AA, Shchukin DG, et al. Remote activation of capsules containing Ag nanoparticles and IR dye by laser light[J]. Langmuir, 2004, 20: 6988-6992. DOI:10.1021/la048873k |
| [47] |
Lu ZH, Prouty MD, Guo ZH, et al. Magnetic switch of permeability for polyelectrolyte microcapsules embedded with Co@Au nanoparticles[J]. Langmuir, 2005, 21: 2042-2050. DOI:10.1021/la047629q |
| [48] |
Ren H, Wu Y, Li Y, et al. Visible-light-induced disruption of diselenide-containing layer-by-layer films:toward combination of chemotherapy and photodynamic therapy[J]. Small, 2013, 9: 3981-3986. DOI:10.1002/smll.201300628 |
| [49] |
Zhang J, Zhao T, Dun JN, et al. Research progress of drug delivery system with "gatekeeper"[J]. Acta Pharm Sin (药学学报), 2019, 54: 1017-1025. |
| [50] |
Köhler K, Sukhorukov GB. Heat treatment of polyelectrolyte multilayer capsules:a versatile method for encapsulation[J]. Adv Funct Mater, 2007, 17: 2053-2061. DOI:10.1002/adfm.200600593 |
| [51] |
Quinn JF, Caruso F. Facile tailoring of film morphology and release properties using layer-by-layer assembly of thermoresponsive materials[J]. Langmuir, 2004, 20: 20-22. DOI:10.1021/la0360310 |
| [52] |
Kaneko Y, Nakamura S, Sakai K, et al. Rapid deswelling response of poly (N-isopropylacrylamide) hydrogels by the formation of water release channels using poly(ethylene oxide) graft chains[J]. Macromolecules, 1998, 31: 6099-6105. DOI:10.1021/ma971899g |
| [53] |
Zhu Z, Gao N, Wang H, et al. Temperature-triggered on-demand drug release enabled by hydrogen-bonded multilayers of block copolymer micelles[J]. J Control Release, 2013, 171: 73-80. DOI:10.1016/j.jconrel.2013.06.031 |
| [54] |
Dejugnat C, Halozan D, Sukhorukov GB. Defined picogram dose inclusion and release of macromolecules using polyelectrolyte microcapsules[J]. Macromol Rapid Commun, 2005, 26: 961-967. DOI:10.1002/marc.200500121 |
| [55] |
Serizawa T, Matsukuma D, Akashi M. Loading and release of charged dyes using ultrathin hydrogels[J]. Langmuir, 2005, 21: 7739-7742. DOI:10.1021/la0505263 |
| [56] |
Shchukin DG, Gorin DA, Mohwald H. Ultrasonically induced opening of polyelectrolyte microcontainers[J]. Langmuir, 2006, 22: 7400-7404. DOI:10.1021/la061047m |
| [57] |
Yan Y, Johnston APR, Dodds SJ, et al. Uptake and intracellular fate of disulfide-bonded polymer hydrogel capsules for doxorubicin delivery to colorectal cancer cells[J]. ACS Nano, 2010, 4: 2928-2936. DOI:10.1021/nn100173h |
| [58] |
Strebhardt K, Ullrich A. Paul Ehrlich's magic bullet concept:100 years of progress[J]. Nat Rev Cancer, 2008, 8: 473-480. DOI:10.1038/nrc2394 |
| [59] |
Comert F, Malanowski AJ, Azarikia F, et al. Coacervation and precipitation in polysaccharide-protein systems[J]. Soft Matter, 2016, 12: 4154-4161. DOI:10.1039/C6SM00044D |
| [60] |
Zhang B, Pan Y, Chen H, et al. Stabilization of starch-based microgel-lysozyme complexes using a layer-by-layer assembly technique[J]. Food Chem, 2017, 214: 213-217. DOI:10.1016/j.foodchem.2016.07.076 |
| [61] |
Elbaz NM, Owen A, Rannard S, et al. Controlled synthesis of calcium carbonate nanoparticles and stimuli-responsive multi-layered nanocapsules for oral drug delivery[J]. Int J Pharm, 2020, 574: 118866. DOI:10.1016/j.ijpharm.2019.118866 |
| [62] |
Desgrosellier JS, Cheresh DA. Integrins in cancer:biological implications and therapeutic opportunities[J]. Nat Rev Cancer, 2010, 10: 9-22. DOI:10.1038/nrc2748 |
| [63] |
Jie Z, Romero G, Rojas E, et al. Folic acid modified poly(lactide-co-glycolide) nanoparticles, layer-by-layer surface engineered for targeted delivery[J]. Macromol Chem Phys, 2010, 211: 404-411. DOI:10.1002/macp.200900514 |
| [64] |
Choi KY, Correa S, Min J, et al. Binary targeting of siRNA to hematologic cancer cells in vivo using layer-by-layer nanoparticles[J]. Adv Funct Mater, 2019, 29: 1900018. DOI:10.1002/adfm.201900018 |
| [65] |
Xie LL, Tong WJ, Yu DH, et al. Bovine serum albumin nanoparticles modified with multilayers and aptamers for pH-responsive and targeted anti-cancer drug delivery[J]. J Mater Chem, 2012, 22: 6053-6060. DOI:10.1039/c2jm16831f |
| [66] |
Kavasi RM, Berdiaki A, Spyridaki I, et al. HA metabolism in skin homeostasis and inflammatory disease[J]. Food Chem Toxicol, 2017, 101: 128-138. DOI:10.1016/j.fct.2017.01.012 |
| [67] |
Zhao M, Lee SH, Song JG, et al. Enhanced oral absorption of sorafenib via the layer-by-layer deposition of a pH-sensitive polymer and glycol chitosan on the liposome[J]. Int J Pharm, 2018, 544: 14-20. DOI:10.1016/j.ijpharm.2018.04.020 |
| [68] |
Verma A, Sharma S, Gupta PK, et al. Vitamin B12 functiona-lized layer by layer calcium phosphate nanoparticles:a mucoadhesive and pH responsive carrier for improved oral delivery of insulin[J]. Acta Biomater, 2016, 31: 288-300. DOI:10.1016/j.actbio.2015.12.017 |
| [69] |
Verma AK, Sharma S, Gupta PK, et al. Vitamin B12 grafted layer-by-layer liposomes bearing HBsAg facilitates oral immunization:effect of modulated biomechanical properties[J]. Mol Pharmaceut, 2016, 13: 2531-2542. DOI:10.1021/acs.molpharmaceut.6b00274 |
| [70] |
Huang GQ, Zhang ZK, Cheng LY, et al. Intestine-targeted delivery potency of O-carboxymethyl chitosan-coated layer-by-layer microcapsules:an in vitro and in vivo evaluation[J]. Mater Sci Eng C, 2019, 105: 110129. DOI:10.1016/j.msec.2019.110129 |
| [71] |
Ramasamy T, Haidar ZS, Tran TH, et al. Layer-by-layer assembly of liposomal nanoparticles with PEGylated polyelectrolytes enhances systemic delivery of multiple anticancer drugs[J]. Acta Biomater, 2014, 10: 5116-5127. DOI:10.1016/j.actbio.2014.08.021 |
| [72] |
Gao X, Zhang F, Chen ZC, et al. Hepatic-targeting microcapsules construction by layer-by-layer self-assembly of lactose-branched polyelectrolyte[J]. Chem J Chin Univ, 2011, 32: 957-963. |
| [73] |
Men W, Zhu P, Dong S, et al. Layer-by-layer pH-sensitive nanoparticles for drug delivery and controlled release with improved therapeutic efficacy in vivo[J]. Drug Deliv, 2020, 27: 180-190. DOI:10.1080/10717544.2019.1709922 |
| [74] |
Chou CC, Zeng HJ, Yeh CH. Blood compatibility and adhesion of collagen/heparin multilayers coated on two titanium surfaces by a layer-by-layer technique[J]. Thin Solid Films, 2013, 549: 117-122. DOI:10.1016/j.tsf.2013.09.093 |
| [75] |
Peng CY. Drug Delivery Properties and Blood Compatibility of Polyelectrolyte Microcapsules (聚电解质微胶囊的药物缓释及其血液相容性研究)[D]. Hangzhou: Zhejiang University, 2010.
|
| [76] |
Thierry B, Kujawa P, Tkaczyk C, et al. Delivery platform for hydrophobic drugs:prodrug approach combined with self-assembled multilayers[J]. J Am Chem Soc, 2005, 127: 1626-1627. DOI:10.1021/ja045077s |
| [77] |
Wang L, Liao RM, Li XZ. Layer-by-layer deposition of luminescent polymeric microgel films on magnetic Fe3O4@SiO2 nanospheres for loading and release of ibuprofen[J]. J Powder Technol, 2013, 235: 103-109. DOI:10.1016/j.powtec.2012.10.001 |
| [78] |
Hua A, Jones SA, Lvov YM. Biomedical applications of electrostatic layer-by-layer nano-assembly of polymers, enzymes, and nanoparticles[J]. Cell Biochem Biophys, 2003, 39: 23-43. DOI:10.1385/CBB:39:1:23 |
| [79] |
Francius G, Hemmerle J, Voegel JC, et al. Anomalous thickness evolution of multilayer films made from poly-L-lysine and mixtures of hyaluronic acid and polystyrene sulfonate[J]. Langmuir, 2007, 23: 2602-2607. DOI:10.1021/la062910l |
| [80] |
Wang LM, Chang H, Zhang H, et al. Dynamic stiffness of polyelectrolyte multilayer films based on disulfide bonds for in situ control of cell adhesion[J]. J Mater Chem B, 2015, 3: 7546-7553. DOI:10.1039/C5TB01151E |
| [81] |
Boudou T, Kharkar P, Jing J, et al. Polyelectrolyte multilayer nanoshells with hydrophobic nanodomains for delivery of paclitaxel[J]. J Control Release, 2012, 159: 403-412. DOI:10.1016/j.jconrel.2012.01.022 |
| [82] |
Hammond PT. Building biomedical materials layer-by-layer[J]. Mater Today, 2012, 15: 196-206. DOI:10.1016/S1369-7021(12)70090-1 |
| [83] |
Han L, Tang C, Yin CH. Dual-targeting and pH/redox-responsive multi-layered nanocomplexes for smart co-delivery of doxorubicin and siRNA[J]. Biomaterials, 2015, 60: 42-52. DOI:10.1016/j.biomaterials.2015.05.001 |
| [84] |
De Koker S, Naessens T, De Geest BG, et al. Biodegradable polyelectrolyte microcapsules:antigen delivery tools with Th17 skewing activity after pulmonary delivery[J]. J Immunol, 2010, 184: 203-211. DOI:10.4049/jimmunol.0803591 |
| [85] |
Itoh Y, Matsusaki M, Kida T, et al. Enzyme-responsive release of encapsulated proteins from biodegradable hollow capsules[J]. Biomacromolecules, 2006, 7: 2715-2718. DOI:10.1021/bm060289y |
| [86] |
Facca S, Cortez C, Mendoza-Palomares C, et al. Active multilayered capsules for in vivo bone formation[J]. Proc Natl Acad Sci U S A, 2010, 107: 3406-3411. DOI:10.1073/pnas.0908531107 |
| [87] |
Bishop CJ, Tzeng SY, Green JJ. Degradable polymer-coated gold nanoparticles for co-delivery of DNA and siRNA[J]. Acta Biomater, 2015, 11: 393-403. DOI:10.1016/j.actbio.2014.09.020 |
| [88] |
Bishop CJ, Liu AL, Lee DS, et al. Layer-by-layer inorganic/polymeric nanoparticles for kinetically controlled multigene delivery[J]. J Biomed Mater Res A, 2016, 104: 707-713. DOI:10.1002/jbm.a.35610 |
| [89] |
Deng ZJ, Morton SW, Ben-Akiva E, et al. Layer-by-layer nanoparticles for systemic codelivery of an anticancer drug and siRNA for potential triple-negative breast cancer treatment[J]. ACS Nano, 2013, 7: 9571-9584. DOI:10.1021/nn4047925 |
| [90] |
Mok H, Lee SH, Park JW, et al. Multimeric small interfering ribonucleic acid for highly efficient sequence-specific gene silencing[J]. Nat Mater, 2010, 9: 272-278. DOI:10.1038/nmat2626 |
| [91] |
Jeong H, Lee SH, Hwang Y, et al. Multivalent aptamer-RNA conjugates for simple and efficient delivery of doxorubicin/siRNA into multidrug-resistant cells[J]. Macromol Biosci, 2017. DOI:10.1002/mabi.201600343 |
| [92] |
Son S, Kim N, You DG, et al. Antitumor therapeutic application of self-assembled RNAi-AuNP nanoconstructs:combination of VEGF-RNAi and photothermal ablation[J]. Theranostics, 2017, 7: 9-22. DOI:10.7150/thno.16042 |
| [93] |
Yao Y, Su ZH, Liang YC, et al. pH-sensitive carboxymethyl chitosan-modified cationic liposomes for sorafenib and siRNA co-delivery[J]. Int J Nanomed, 2015, 10: 6185-6197. |
 2020, Vol. 55
2020, Vol. 55


