自新型冠状病毒肺炎(COVID-19)暴发以来, 到目前为止, 在全球范围内尚无治疗COVID-19的特效药物。在我国《新型冠状病毒感染的肺炎治疗方案(试行第七版)》 (以下简称诊疗方案)中推荐治疗COVID-19的化学药物包括磷酸氯喹、洛匹那韦/利托那韦、阿比朵尔等; 中药主要包括连花清瘟胶囊等[1]。
了解药物的吸收、分布、代谢、排泄和药物-药物相互作用等方面的特征, 对于临床安全用药是至关重要的。目前已有多篇文献总结了临床上用于治疗新型冠状病毒肺炎药物的临床药理学以及药效学[2-4]。本文主要回顾了目前临床上用于治疗COVID-19药物的代谢和药动学性质。由于无法获得人体组织内的药物浓度, 因此以药物血浆浓度来衡量其在体内发挥药效的水平。药物进入人体循环系统后, 大部分药物与人体血浆蛋白结合, 游离的药物发挥药效。因此应重点关注药物体外活性浓度和能在体内达到的最大血药浓度之间的关系, 以期为药物的药效评价以及新型冠状病毒肺炎患者的临床合理用药提供依据。
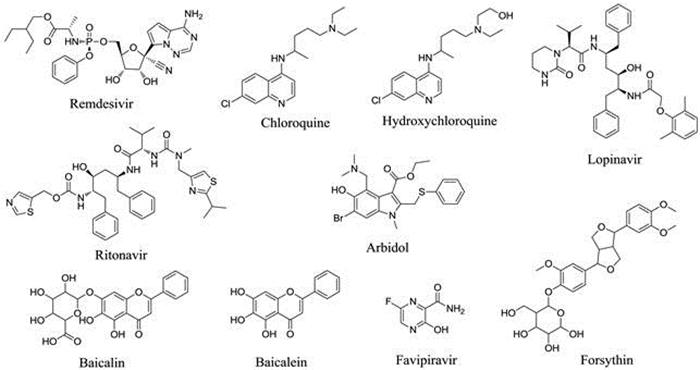
表 1总结了7个抗病毒药物推荐的用法用量和主要代谢酶。表 2[5-19]总结了9个抗病毒药物的体外活性数据包括半最大效应浓度(EC50)和能引起90%最大效应的浓度(EC90), 相应剂量下的Cmax值以及血浆蛋白结合率Cp。图 1列出了文中所提到的化合物的化学结构。
| Table 1 A list of 7 antiviral drugs, recommended dosing regimen and principal enzyme. NR: Not reported |
| Table 2 A list of 9 antiviral drugs, EC50, EC90, Cmax and dose. NR: Not reported. Cp: Binding rate of plasma protein |
|
Figure 1 Chemical structures of the 10 antiviral drugs |
瑞德西韦的第一个临床用途是用于治疗埃博拉病毒。此次疫情暴发之后, 瑞德西韦受到了人们的广泛关注。目前, 美国1名新型冠状病毒(SARS-CoV-2)感染患者接受静脉注射瑞德西韦后, 很快得到康复, 提示瑞德西韦治疗COVID-19有很大的潜力[20]。大部分RNA病毒的复制过程由RdRp催化完成。瑞德西韦是靶向丝状病毒RdRp的病毒复制抑制剂[21]。研究结果显示, 瑞德西韦对SARS-CoV-2的EC50和EC90值分别为0.77和1.76 μmol·L-1[5, 22]。目前, 已经有三项临床试验公布了瑞德西韦治疗重症新冠肺炎患者的治疗结果。美国FDA向瑞德西韦发放了紧急使用授权[23], 欧洲药品管理局也启动了对瑞德西韦用于治疗COVID-19数据的滚动审评[24]。
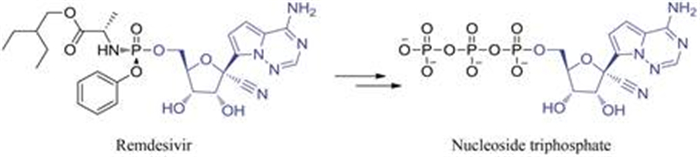
1.2 瑞德西韦的代谢性质Warren等[21]对瑞德西韦在细胞内的代谢过程进行了研究。图 2为瑞德西韦的代谢过程。瑞德西韦是腺苷类似物氨基磷酸酯的前药, 本身没有活性, 在组织和细胞中代谢后生成活性的三磷酸核苷代谢物, 从而抑制病毒RNA聚合酶, 但不抑制宿主RNA或DNA聚合酶。
|
Figure 2 Metabolism and mechanism of remdesivir |
瑞德西韦的单剂量和多剂量临床Ⅰ期试验提供了在人体中的安全性和药代动力学数据[2]。静脉输注瑞德西韦3~225 mg, 患者具有良好的耐受性, 且没有肝毒性或肾毒性。临床前药代动力学实验表明, 外周血单核细胞(PBMCs)中存在药理活性的三磷酸核苷代谢物, 其浓度水平高且持续存在。
在75 mg剂量下, 30 min内静脉输注和2 h内给予瑞德西韦后, 原形药物的AUC0-∞分别为1 839.9和1 254.7 h·ng·mL-1, 但2 h内给药的活性代谢物的AUC0-∞为176.2 h·ng·mL-1, 30 min内给药活性代谢物的AUC0-∞为394.3 h·ng·mL-1。这一数据支持在较短的时间(30 min)内完成给药更有效, 可以最大效率地提高细胞内活性代谢物的浓度。30 min和2 h内静脉输注瑞德西韦75 mg后, 血浆中瑞德西韦的半衰期分别为1.00和0.84 h, 表明瑞德西韦在体内较快地被消除[6]。活性代谢物在PBMC内半衰期超过35 h。因此, 采用第一天静脉输注给药200 mg, 然后连续每天静脉输注100 mg的给药方案, 能使瑞德西韦的血浆浓度在短时间内达到并维持在有效水平。
作为用于治疗埃博拉病毒的瑞德西韦, 目前已经完成临床Ⅰ期和Ⅱ期试验, 但其药动学数据并未完全公开。目前WHO官网上公布的药动学数据仅公布了血浆暴露量, 没有公布Cmax和血浆蛋白结合率等信息。因此无法估算瑞德西韦能否在体内达到其体外的活性浓度。
2 氯喹和羟基氯喹 2.1 药物概述氯喹是一种广泛应用于抗疟疾和自身免疫疾病的药物, 临床使用已有约70年的历史。羟氯喹在保留氯喹药效的同时, 不良反应显著降低。最近氯喹被报道为一种潜在的广谱抗病毒药物。本次疫情暴发以来, 科研工作者测试了氯喹体外抗SARS-CoV-2的活性浓度, 结果显示其EC50为1.13 μmol·L-1, EC90为6.90 μmol·L-1[5]。且最近研究发现羟氯喹作为一种毒性更小的衍生物, 在体外也可有效地抑制SARS-CoV-2感染, EC50为0.72 μmol·L-1[8, 25]。诊疗方案规定的氯喹的用法用量见表 1。
氯喹与羟氯喹同属4-氨基喹啉类抗疟药, 二者的区别在于氯喹的一个乙基被羟基取代。氯喹和羟氯喹都是弱碱, 它们是由两个具有共轭双键的芳香环, 即4-氨基喹啉核构成的。两种药物都能很好地穿过细胞膜[26]。羟氯喹的极性更强, 亲脂性更低, 透膜性较氯喹而言较低。在生理条件(pH 7.4)下, 亲脂性氯喹被动扩散进入细胞。当进入溶酶体的酸性环境中时, 氯喹质子化可在细胞内蓄积[3]。
2.2 氯喹与羟氯喹的代谢性质氯喹和羟基氯喹主要在肝脏内发生N-去烷基。猴单次灌胃给予14C标记的氯喹后, 共检测到12个标记的代谢产物。其中最重要的两种是去乙基氯喹和双去乙基氯喹, 它们都具有药理活性[9, 27]。CYP2C8和CYP3A4介导了80%氯喹和羟氯喹的代谢, 是主要的酶亚型。氯喹和羟氯喹的去乙基代谢物的半衰期比原形药物的半衰期长[28]。
2.3 氯喹与羟氯喹的药动学性质氯喹与羟氯喹在口服2~4 h之后, 几乎完全被吸收, 羟氯喹的胃肠道吸收率为70%~80%[10]。氯喹的生物利用度可达78%~89%[3], 约55%的氯喹与血浆蛋白结合[3]。羟氯喹的血浆蛋白结合率为50%[9]。氯喹与羟氯喹的血浆消除半衰期在40天左右[9]。连续给药后药物可以在体内蓄积并在较长时间内维持一定的药物浓度。由于氯喹与血小板和粒细胞高比例结合, 因此其稳态全血浓度比血浆浓度高出5~10倍[3]。人体口服氯喹后, 稳态时氯喹与去乙基氯喹之比为7.2, 羟氯喹与去乙基氯喹之比为1.75, 稳态血药浓度与原形药物相近[28]。由于用药时间较长, 其积蓄毒性应引起重视。
氯喹按每天250 mg的剂量多次给药, 在体内达到稳态后, 其Cmax值为250~650 ng·mL-1, 经换算后约为0.78~2.03 μmol·L-1[7]。在体内, 约55%的氯喹与血浆蛋白结合, 游离药物是发挥药效的主要形式。诊疗方案推荐的用药方案为体重大于50 kg者, 每次500 mg, 每日2次。因此推测氯喹能够在体内达到体外活性浓度。单次口服羟氯喹后, Cmax值为34.3 ng·mL-1, 经换算后在体内难以达到其有效浓度(表 2)。有研究[4]利用基于生理药动学的模型预测了氯喹容易在肺部蓄积且消除较慢, 因此参考抗疟方案, 首日给予一定的负荷剂量可使药物快速达到有效暴露水平。采用静脉注射的方式代替口服给药, 避免肝脏对羟氯喹的首过效应, 也能使血药浓度在短时间内快速升高。
氯喹与羟氯喹在人体各组织中的分布浓度不同。在动物组织分布研究中, 氯喹分布主要以肝脏、脾脏、肾脏为主[27], 组织浓度是血浆浓度的200~700倍[3]。
氯喹和羟氯喹在体内主要通过肾脏和肝脏排出体外。大约40%氯喹和羟氯喹未被代谢通过肾脏排泄, 8%~25%是以原形或代谢物形式通过粪便排泄[27, 29]。羟氯喹进入人体后, 50%经肝脏代谢后, 40%~50%经肾脏排泄, 16%~21%以原形从尿中排泄, 5%从皮肤排泄, 15%~24%通过粪便排出[4]。肾脏或肝脏功能障碍会减少氯喹和羟氯喹的排泄, 导致更多的药物蓄积和更高的视网膜病变风险[9]。
3 洛匹那韦/利托那韦 3.1 药物概况洛匹那韦/利托那韦是由FDA批准的口服抗艾滋病药物, 在我国已经上市, 其商品名为克力芝。洛匹那韦为人类免疫缺陷病毒蛋白酶抑制剂, 对SARS-CoV的3CL蛋白的亲和力较高。且体外实验表明洛匹那韦对SARS-CoV的EC50为1.6~12.8 μmol·L-1[30, 31]。洛匹那韦/利托那韦是我国在诊疗方案中最早被推荐的抗COVID-19的化学药物。洛匹那韦/利托那韦(4:1)为复方制剂。其用法用量见表 1。目前尚未有利托那韦/洛匹那韦对SARS-CoV-2的活性数据的报道。
3.2 洛匹那韦/利托那韦的代谢性质洛匹那韦主要由CYP3A4代谢, 而利托那韦既是CYP3A4和CYP2D6的底物, 也是CYP3A4的强抑制剂[32]。该复方就是利用利托那韦抑制洛匹那韦的代谢, 从而提高血浆中洛匹那韦的浓度以达到治疗效果。同时, 利托那韦还是OATP1B1、OATP1B3和p-PG的强抑制剂[33, 34]。因此, 与多种药物联用都可能发生药物-药物相互作用, 从而导致临床治疗失败或不良反应加重。一例艾滋病患者合并使用克拉霉素、阿托伐他汀和洛匹那韦/利托那韦后引起了横纹肌溶解[35], 需特别关注并及时处理, 必要时停药。
3.3 洛匹那韦/利托那韦的药动学性质洛匹那韦的口服生物利用度较低(大鼠内25%), 在健康受试者和HIV感染者中, 洛匹那韦的血浆蛋白结合率约为98.2%~99.2%。稳态时, 洛匹那韦的血浆蛋白结合率为98%~99%[11]。未经抗逆转录病毒治疗的患者, 在每天两次口服400/100 mg洛匹那韦/利托那韦的24周试验中, 洛匹那韦的平均血浆消除半衰期和表观清除率分别为4.1~5.8 h和6.0~7.1 L·h-1[11]。在14C标记的洛匹那韦单剂量给药8天后, 放射性剂量的10.4%和82.6%分别通过尿液和粪便排泄。剂量的2.2%和19.8%以原形药物的方式分别随尿液和粪便排出[11]。
4 法匹拉韦 4.1 药物概述法匹拉韦是富山化学有限公司开发的广谱抗病毒药物。2014年3月在日本批准上市, 用于治疗新型和复发型流感[36]。目前在美国正处于Ⅲ期临床阶段。法匹拉韦是嘌呤核酸的类似物, 法匹拉韦呋喃-5'-三磷酸的前药。这种活性代谢物可以通过抑制RNA聚合酶[37]来干扰病毒复制。法匹拉韦的大部分临床前数据来自对感染流感和埃博拉病毒患者的研究。在体外法匹拉韦对SARS-CoV-2的EC50为61.88 μmol·L-1[5]。
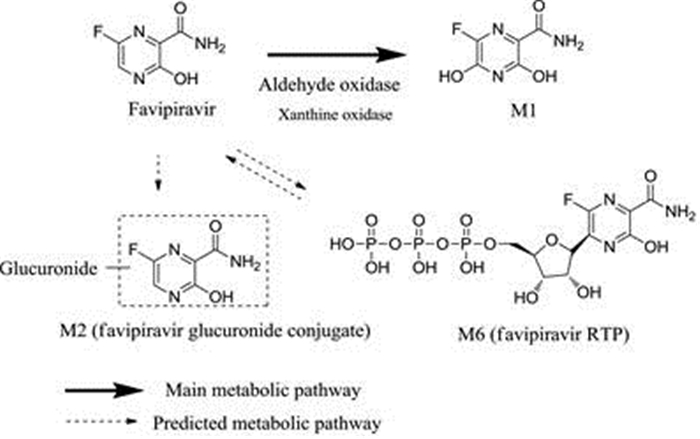
4.2 法匹拉韦的代谢性质猴子和大鼠单次给予14C标记的法匹拉韦后, 在体内鉴定了法匹拉韦可能发生的生物转化。法匹拉韦在体内的主要代谢途径为羟基化生成主要代谢物M1。M2是法匹拉韦的葡萄糖醛酸结合物。大鼠单次灌胃给予20 mg·kg-1的14C标记的法匹拉韦后, 法匹拉韦(28.33%~69.50%)和M1 (10.75%~34.44%)主要在肺部、肝脏和肾脏中被检测到。尿中M1的回收率为43.03%, M2的回收率为22.76%, 法匹拉韦的回收率为15.62%。粪中M1的回收率为42.81%。雄性大鼠单次给予20 mg·kg-1的14C标记的法匹拉韦0~24 h内, 其在尿液、粪便的累积放射性排泄率分别为放射剂量的91.14%和4.32%。猴子单次口服20 mg·kg-1的14C标记的法匹拉韦后, 法匹拉韦和M1也是其血浆中的主要成分[12]。推测的法匹拉韦在动物体内的主要代谢途径如图 3所示。
|
Figure 3 Predicted main metabolic pathway of favipiravir. RTP: Ribosyl triphosphate |
法匹拉韦在体内主要的消除途径为醛氧化酶和微量黄嘌呤氧化酶介导的肝脏代谢, 产生亲水的非活性代谢物M1, CYP450酶不参与法匹拉韦的代谢。法匹拉韦能抑制醛氧化酶。同时, 法匹拉韦浓度依赖性地抑制CYP2C8的活性, 因此应注意其与CYP2C8的底物如紫杉醇等药物联用时可能发生的药物-药物相互作用[12]。
4.3 法匹拉韦的药动学性质法匹拉韦是亲水性较好的小分子, 口服生物利用度较高(小鼠97.6%)。体外血清蛋白结合率几乎是常数(53.4%~54.4%), M1的血清蛋白结合率为28.8%~36.9% (浓度在0.5~50 μg·mL-1内)。经口服后, 该药可在0.5~1 h内迅速吸收, 生物利用度接近100%[12]。在剂量范围为30~1 600 mg的单剂量递增试验中, 法匹拉韦的Cmax为1.39~78.61μg·mL-1, M1的Cmax为0.52 ~15.28 μg·mL-1。在上述剂量下, 法匹拉韦在给药后48 h内的累积排泄率均小于0.5%, 而M1在20~800 mg时的累积尿排泄率为81.2%~94.8%, 在1 600 mg时的累积排泄率为77.3%。法匹拉韦的血浆消除半衰期为1.3~3.9 h, M1的半衰期与其相近, 为1.8~5.1 h[12]。在多次给药试验中, 大多数代谢物通过肾脏以M1的形式排出体外。随着时间的推移, 在尿液中排泄的代谢物的比例会增加, 在7天后达到80%~100%[38]。法匹拉韦主要通过肾脏排泄。
法匹拉韦在每天600 mg、给药7天的给药方案下, 第7天的Cmax为36 230 ng·mL-1[12], 经换算后约为230 μmol·L-1 (表 2)。根据其血清蛋白结合率(53.4%~54.4%)计算得其游离的药物浓度约为106 μmol·L-1, 大于对SARS-CoV-2的EC50值(61.88 μmol·L-1), 因此能在体内达到体外活性浓度。
5 阿比朵尔 5.1 药物概述阿比朵尔是一种广谱抗病毒药物, 用于治疗和预防甲型和乙型流感病毒引起的呼吸道疾病[39], 通过抑制流感病毒脂膜与宿主细胞的融合而阻断病毒的复制[40], 在俄罗斯与中国广为人知。2008年, 阿比朵尔抗冠状病毒的活性被首次报道。体外研究显示, 阿比朵尔在50μmol·L-1的浓度下能对SARS-CoV起到显著的抑制作用[41]。国内某研究团队提出, 根据体外细胞实验显示阿比朵尔在10~30 μmol·L-1浓度下与药物未处理的对照组比较, 能有效抑制冠状病毒达到60倍, 并且显著抑制病毒对细胞的病变效应[42]。Wang等[13]研究显示阿比朵尔在体外SARS-CoV-2的EC50为4.11 μmol·L-1。诊疗方案中推荐的阿比朵尔的用法用量如表 1所示。
5.2 阿比朵尔的代谢性质Deng等[14]和Wang等[43]对健康志愿者口服盐酸阿比多尔后的代谢概况、排泄途径和药动学等进行了研究。受试者口服盐酸阿比朵尔后, 在血浆、尿和粪中分别检测到16、32和24种代谢物。主要的生物转化途径包括S-氧化、N-去甲基、葡萄糖醛酸结合和硫酸结合, 其中S-氧化是最主要的代谢途径。血浆中与药物相关的主要成分是S-氧化代谢产物M6-1, 然后是为未被代谢的原形药物, N-去甲基并S-氧化代谢产物M5和双S-氧化代谢产物M8。在尿液中, 葡萄糖醛酸结合物和硫酸结合物是主要的代谢物, 占给药后0~96 h排泄量的6.3%。粪便中主要是未被代谢的原形药物, 占剂量的32.4%[14]。
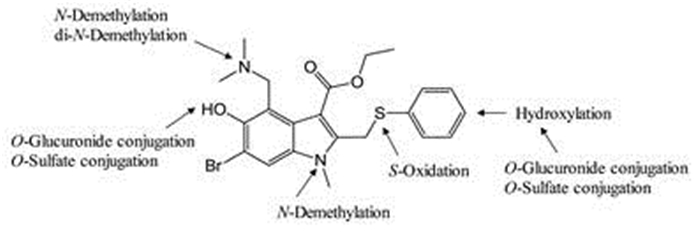
代谢和排泄的研究结果表明, 阿比朵尔在人体内经历了广泛的代谢, 包括Ⅰ相和Ⅱ相代谢。图 4展示了阿比朵尔在体内可能的代谢途径, 主要代谢位点是二甲胺侧链和苯基硫醚的位置, 以及这些单氧化代谢产物后续的氧化和Ⅱ相结合代谢[14]。
|
Figure 4 Identified metabolic processes of arbidol in humans |
肝脏和肠道是人体内代谢阿比朵尔的主要器官。CYP450重组酶实验和人肝微粒体化学抑制实验表明, CYP3A4是参与阿比朵尔代谢最活跃的酶, 其次是FMO3、CYP2E1、CYP1A2、CYP2D6、CYP2C9和CYP3A5。发生葡萄糖醛酸结合反应时, UGT1A1、UGT1A3、UGT1A9可以催化阿比朵尔的葡萄糖醛酸结合, UGT1A9是人肝微粒体中参与阿比朵尔葡萄糖醛酸化最主要的UGT酶[44]。Liu等[45]研究发现阿比朵尔对UGT1A9和UGT2B7的强烈抑制, 当将阿比朵尔与以UGT1A9和UGT2B7为主要代谢酶的药物联合用药时, 应进行临床监测关注其安全性。
阿比朵尔的氧化代谢途径由多种代谢酶参与, 包括CYP450和黄素单氧化酶(FMO), 氧化代谢产物也可以发生Ⅱ相结合反应。但CYP3A4是参与阿比朵尔代谢的主要酶亚型, FMO则起着较小的作用。因此应关注阿比朵尔与其他CYP3A4抑制剂或诱导剂联用时可能发生的药物-药物相互作用。
5.3 阿比朵尔的药动学性质人口服200 mg盐酸阿比朵尔后, 阿比朵尔的AUC为2 103 h·ng·mL-1, Cmax为467 ng·mL-1[14]。经换算后, 在人体内的浓度低于1 μmol·L-1 (未考虑血浆蛋白结合)。对比体外抗病毒实验结果[13, 42], 按照诊疗方案推荐的阿比朵尔的剂量(成人200 mg, 每日3次), 可能无法在体内达到有效抑制病毒的浓度。
人口服盐酸阿比朵尔200 mg后, 阿比朵尔吸收迅速, 达峰时间约为1.38 h。M6-1是血浆中的主要循环物质, 然后是M5和M8。3种代谢物的平均血浆消除半衰期均长于母体药物。在血浆中, M5和M8的血浆浓度低于阿比朵尔, 而M6-1在血浆中的暴露量则是阿比朵尔的12.9倍。影响M6-1药代动力学特征的因素很多, 其中包括其形成过程、肝脏和肠道中的转运体等。M6-1是人体血浆中浓度最高的代谢物, 具有较长tmax和较长的血浆消除半衰期, 比母体的暴露量更高。因此应进一步关注M6-1的药理活性以及其安全性。
6 黄芩苷 6.1 药物概述黄芩苷是黄芩的主要生物活性成分之一, 研究表明黄芩苷具有显著的药理特性, 包括抗肿瘤、抗菌、抗氧化活性。黄芩也是“双黄连口服液”、“清肺排毒汤”等中成药的主要成分, 在我国已被证明对治疗COVID-19患者有效[46]。且黄芩苷和黄芩素在细胞中显示出了抗病毒活性[15]。Su等[15]发现黄芩苷和黄芩素可以在体外抑制SARS-CoV-2类3CL蛋白酶。黄芩苷和黄芩素对SARS-CoV-2的EC50分别为10.27和1.69 μmol·L-1。黄芩素简单的化学结构、独特的作用模式和体外抗病毒活性, 加上良好的临床试验安全数据, 为研发亟需的抗新型冠状病毒药物提供了机会。
6.2 黄芩苷的代谢性质Zhang等[47]对大鼠灌胃给予黄芩苷后, 对大鼠血浆、尿液及各种组织中黄芩苷的代谢物进行了全面的表征。在大鼠体内共检测到了32个代谢产物, 血浆中检测到26种代谢物, 尿液中检测到23种代谢物。其中5个代谢物得到了结构确证。结果表明苯环上的羟基和8-, 4'-是黄芩苷最容易发生代谢的代谢位点。黄芩苷在大鼠体内主要发生甲基化、水解、羟基化、甲氧基化、葡萄糖醛酸结合等代谢反应。大鼠肝脏和肾脏是黄芩苷代谢产物存在的最主要的器官。
黄芩苷对CYP3A和CYP2E1有竞争性抑制作用, 对CYP2D有非竞争性抑制作用, 对CYP1A2具有抑制作用并可以改变非那西丁在大鼠体内的药动学[48-50]。黄芩苷对不同CYP亚型以及不同底物的抑制作用不同。此外, 黄芩苷显著诱导CYP2B6催化丁氨苯丙酮羟基化反应, 黄芩苷对其他CYP2B6底物药物的作用值得进一步研究[51]。黄芩苷能显著改变经CYP450酶代谢的药物的药代动力学。
6.3 黄芩苷的药动学性质黄芩苷作为一种糖苷类黄酮, 由于极性太大, 不能通过被动扩散穿过脂质双分子层, 因此在肠道吸收不良。然而, 黄芩苷经肠道菌群水解形成的黄芩素, 有良好的亲脂性, 能很好地被胃肠道吸收[52]。黄芩素被吸收后经UGT代谢生成黄芩苷。在剂量范围为100~2 800 mg的黄芩素单剂量递增试验中, 黄芩苷的Cmax为75.5~2 265 ng·mL-1, 黄芩素的Cmax为5.82~108 ng·mL-1, 黄芩苷的Cmax约为黄芩素的10倍[18]。且黄芩苷和黄芩素的药时曲线有双峰或者多峰现象[53]。人多次口服200、400和800 mg黄芩素后耐受性良好。每天两次, 重复给药5天后, 血浆浓度达到稳定状态[16]。在800 mg剂量下, 第10天黄芩苷和黄芩素的Cmax值见表 2。经换算, 在此给药剂量下, 黄芩苷和黄芩素的稳态浓度均难以达到在体外的活性浓度。
血浆蛋白结合在体内药物处置中起着关键的作用。黄芩苷在体内吸收迅速, 但在血浆中可将浓度维持在一定的范围内。黄芩苷的血浆蛋白结合率为86%~92%[17]。
黄芩苷主要以葡萄糖醛酸结合物的形式在胆汁中排泄[54]。由于黄芩苷在生理pH下主要以阴离子存在, 难以被动扩散透过生物膜, 因此黄芩苷经胆汁排泄需要MRP2转运蛋白的参与[52]。人口服黄芩苷后, 仅7.2%的剂量以黄芩苷的形式从尿液排出[55]。经肾脏排泄的主要是未经代谢的原形药物、硫酸结合物以及羟基化的代谢产物。
因此应关注与黄芩苷联合用药的安全性来减少临床中的药物不良反应。研究[56, 57]表明, 抗生素与黄芩苷合用时会通过抑制肠道菌群的水解而降低黄芩苷的吸收从而产生药物相互作用。因此抗生素与黄芩苷合用时也应引起注意。
7 连翘苷 7.1 药物概述诊疗方案中在医学观察期推荐的中成药包括连花清瘟胶囊。连花清瘟胶囊的主要成分包括连翘、金银花、麻黄等[58]。其中, 金银花的主要成分绿原酸口服不吸收[59]。连翘苷是从木犀科植物连翘中提取出的一类天然糖苷木脂素类化合物, 并收录在中国药典中[60], 拟开发用于治疗普通感冒和流行性感冒引起的发热。目前正在中国进行临床Ⅱ期研究。目前尚未有连翘苷对SARS-CoV-2体外活性数据的报道。
7.2 连翘苷的代谢性质健康受试者单次口服连翘苷胶囊100 mg后, 在人体血浆中检测到原形药物和4个代谢产物, 其中以苷元硫酸结合物M2为主, 其次为苷元葡萄糖醛酸结合物M7;在尿中发现了12个代谢产物, 以M2为主, 其次为原形去甲基并单氧化代谢物M5-2和苷元葡萄糖醛酸结合物M7;在粪便中发现了3个代谢产物, 同样以M2为主。因此, 在人血浆、尿液和粪便中共发现了13种代谢物, 其中水解代谢产物苷元M1、苷元硫酸结合物M2与苷元葡萄糖醛酸结合物M7的结构已通过合成的对照品进行了结构确认。推测的连翘苷在健康受试者体内的代谢途径如图 5所示。
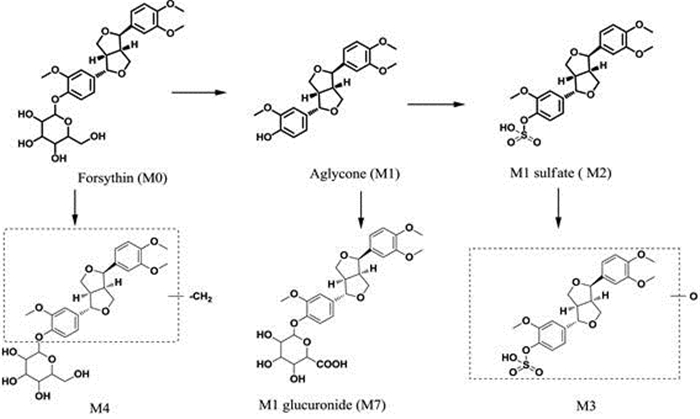
|
Figure 5 Proposed metabolic pathways of forsythin in humans |
人体内代谢产物鉴定结果表明, 连翘苷首先在体内水解形成苷元M1, 接着发生广泛的二相代谢, 生成苷元硫酸结合物M2与苷元葡萄糖醛酸结合物M7, 其中硫酸结合是主要的代谢途径[19]。
7.3 连翘苷的药动学性质连翘苷胶囊单次口服给药后, 药物吸收和消除均较快, 血浆中原形药物浓度在1.25 h左右达峰, 药物血浆消除半衰期为1.75 h。100 mg剂量下, M2的血浆浓度和暴露量最高, Cmax约为原形药物的46倍, AUC0-∞为原形药物的86倍; M7浓度次之, Cmax和AUC0-∞分别为原形药物的2.3和4.2倍。M2和M7的半衰期比原形药物长, 约为4~6 h。3个代谢物的药时曲线均存在双峰现象, 提示有肠肝循环的存在。根据药代动力学结果可知, 硫酸结合物M2的血浆暴露量以及峰浓度远高于原形药物, 葡萄糖醛酸结合物M7次之。因此硫酸结合物M2是体循环的主要物质。单次给药, 在50~800 mg剂量内硫酸结合物M2和葡萄糖醛酸结合物M7的Cmax和AUC随给药剂量增加而增加。由此表明, 人口服连翘苷后, 在体循环中主要的相关物质仍然为苷元硫酸结合物。
8名中国健康受试者单次口服100 mg连翘苷胶囊后, 尿中连翘苷、M1、M2和M7的累积排泄百分率分别为0.75%、0.004%、71.6%和2.79%。尿中排泄量最多的是M2。尿中连翘苷、M1、M2和M7累积排泄百分率之和为75.1%。因此肾脏排泄是连翘苷及其代谢物排泄的主要途径。从尿样中回收的原始剂量约为75.1%, 其中M2占绝对主导地位, 约占给药剂量的71.6%。
此外, 由于M2和M7均为强酸性物质, 在体液中以阴离子存在, 难以通过被动扩散透过生物膜, 因此其肾脏排泄需要阴离子转运体的参与。体外实验表明, M2和M7均为肾脏摄取转运体OAT3的底物。因此, 在慢性肾功能不全患者体内, 可能发生由于肾排泄过程受阻而导致肾清除率降低或血浆暴露量升高的药动学变化。应关注其在肾功能不全患者中的安全性。
8 总结和展望本文从药物代谢和药代动力学的角度总结了抗病毒药物瑞德西韦、氯喹和羟氯喹、克力芝、法匹拉韦、阿比朵尔、黄芩苷和连翘苷(连花清瘟胶囊主要成分)的特征。虽然随着研究的不断深入, COVID-19的诊疗方案也在不断更新, 但目前尚无治疗COVID-19的特效药物。
推荐治疗新型冠状病毒药物的选择一般基于老药新用的治疗经验以及治疗其他病毒感染的药物。为了能在体内达到体外的活性浓度, 采用静脉给药代替口服给药, 能使血药浓度在短时间内达到较高的浓度水平。间隔一定的时间重复给药能维持相对稳定的全身药物暴露, 一些药物的治疗效果可能需要通过每日多次给药来实现。在此次的疫情中, 中医药成分也彰显了其独特的特色和优势。目前, 瑞德西韦的临床试验结果表明, 尽管瑞德西韦安全、耐受性好, 但与安慰剂相比并没有显著的益处[61]。阿比朵尔、克力芝(洛匹那韦/利托那韦)、包括备受推崇的羟氯喹/氯喹等曾经被写入新冠治疗指南的建议药物在临床试验中的疗效仍待进一步确认。因此仍应该关注这些抗病毒药物的临床药物代谢和药代动力学的信息, 尤其是体外活性浓度EC50和血药浓度Cmax的关系, 从药动学药效学的角度为临床合理使用抗病毒药物提供依据。此外, 由于新型冠状肺炎重症患者往往存在着多种并发症, 因此临床上存在着联合用药的必然性。且联合用药往往是为了实现单独给药无法达到的治疗疗效, 因此仍应合理地进行联合用药, 避免或减少因药物-药物相互作用而引起的不良反应。
作者贡献:潘露露与钟大放负责稿件的撰写与修改。
利益冲突:本文没有利益冲突。本文的内容和撰写仅由作者负责。
| [1] |
General Office of National Health Commission. Chinese clinical guidance for COVID-19 pneumonia diagnosis and treatment (7th edition)[EB/OL]. 2020-05-02. http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe4cef80dc7f5912eb1989/files/ce3e6945832a438eaae415350a8ce964.pdf.
|
| [2] |
Sanders JM, Monogue ML, Jodlowski TZ, et al. Pharmacologic treatments for Coronavirus Disease 2019(COVID-19):a review[J]. JAMA, 2020, 323: 1824-1836. |
| [3] |
Yao X, Cui C, Liu D. Clinical pharmacology progress of chloroquine in the treatment of corona virus disease 2019[J]. Clin Med J (临床药物治疗杂志), 2020, 18: 30-33. |
| [4] |
Cui C, Yao X, Tu S, et al. Clinical pharmacology progress of hydroxychloroquine sulfate[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2020, 25: 221-226. |
| [5] |
Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro[J]. Cell Res, 2020, 30: 269-271. |
| [6] |
World Health Organization. Deliberations on design options for randomized controlled clinical trials to assess the safety and efficacy of investigational therapeutics for the treatment of patients with Ebola virus disease[EB/OL]. 2020-05-01. https://www.who.int/ebola/drc-2018/summaries-of-evidence-experimental-therapeutics.pdf?ua=1.
|
| [7] |
Ducharme J, Farinotti R. Clinical pharmacokinetics and metabolism of chloroquine[J]. Clin Pharmacokinet, 1996, 31: 257-274. |
| [8] |
Yao X, Ye F, Zhang M, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2(SARS-CoV-2)[J]. Clin Infect Dis, 2020, 71: 732-739. |
| [9] |
Browning DJ. Pharmacology of chloroquine and hydroxychloroquine[M]//Hydroxychloroquine and Chloroquine Retinopathy. New York: Springer, 2014: 35-63.
|
| [10] |
Fan HW, Ma ZX, Chen J, et al. Pharmacokinetics and bioequivalence study of hydroxychloroquine sulfate tablets in Chinese healthy volunteers by LC-MS/MS[J]. Rheumatol Ther, 2015, 2: 183-195. |
| [11] |
Cvetkovic RS, Goa KL. Lopinavir/ritonavir-a review of its use in the management of HIV infection[J]. Drugs, 2003, 63: 769-802. |
| [12] |
Japanese Pharmaceuticals and Medical Devices Agency (PMDA). Report on the deliberation results[EB/OL]. 2020-05-01. https://www.pmda.go.jp/files/000210319.pdf.
|
| [13] |
Wang X, Cao R, Zhang H, et al. The anti-influenza virus drug, arbidol is an efficient inhibitor of SARS-CoV-2 in vitro[J]. Cell Discov, 2020, 6: 28. |
| [14] |
Deng P, Zhong D, Yu K, et al. Pharmacokinetics, metabolism, and excretion of the antiviral drug arbidol in humans[J]. Antimicrob Agents Chemother, 2013, 57: 1743-1755. |
| [15] |
Su H, Yao S, Zhao W, et al. Discovery of baicalin and baicalein as novel, natural product inhibitors of SARS-CoV-23CL protease in vitro[J]. BioRxiv, 2020. |
| [16] |
Pang H, Xue W, Shi A, et al. Multiple-ascending-dose pharmacokinetics and safety evaluation of baicalein chewable tablets in healthy Chinese volunteers[J]. Clin Drug Investig, 2016, 36: 713-724. |
| [17] |
Tang Y, Zhu H, Zhang Y, et al. Determination of human plasma protein binding of baicalin by ultrafiltration and high-performance liquid chromatography[J]. Biomed Chromatogr, 2006, 20: 1116-1119. |
| [18] |
Li M, Shi A, Pang H, et al. Safety, tolerability, and pharmacokinetics of a single ascending dose of baicalein chewable tablets in healthy subjects[J]. J Ethnopharmacol, 2014, 156: 210-215. |
| [19] |
Pan L, Yang Y, Hui M, et al. Sulfation predominated the pharmacokinetics, metabolism and excretion of forsythinin human:major enzymes and transporters identified[J]. Acta Pharmacol Sin, 2020. |
| [20] |
Holshue ML, DeBolt C, Lindquist S, et al. First case of 2019 novel coronavirus in the United States[J]. N Engl J Med, 2020, 382: 929-936. |
| [21] |
Warren TK, Jordan R, Lo MK, et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys[J]. Nature, 2016, 531: 381-385. |
| [22] |
Al-Tawfiq JA, Al-Homoud AH, Memish ZA. Remdesivir as a possible therapeutic option for the COVID-19[J]. Travel Med Infect Dis, 2020. |
| [23] |
Food and Drug Administration. FDA Remdesivir EUA letter[EB/OL]. 2020-05-02. https://www.fda.gov/media/137564/download.
|
| [24] |
European Medicines Agency. EMA starts rolling review of remdesivir for COVID-19[EB/OL]. 2020-05-02. https://www.ema.europa.eu/en/news/ema-starts-rolling-review-remdesivir-covid-19.
|
| [25] |
Liu J, Cao R, Xu M, et al. Hydroxychloroquine, a less toxic derivative of chloroquine, is effective in inhibiting SARS-CoV-2 infection in vitro[J]. Cell Discov, 2020, 6: 16. |
| [26] |
Rand JH, Wu XX, Quinn AS, et al. Hydroxychloroquine directly reduces the binding of antiphospholipid antibody-β2-glycoprotein I complexes to phospholipid bilayers[J]. Blood, 2008, 112: 1687-1695. |
| [27] |
Ono C, Yamada M, Tanaka M. Absorption, distribution and excretion of 14C-chloroquine after single oral administration in albino and pigmented rats:binding characteristics of chloroquine-related radioactivity to melanin in-vivo[J]. J Pharm Pharmacol, 2003, 55: 1647-1654. |
| [28] |
Munster T, Gibbs JP, Shen D, et al. Hydroxychloroquine concentration-response relationships in patients with rheumatoid arthritis[J]. Arthritis Rheum, 2002, 46: 1460-1469. |
| [29] |
Kalia S, Dutz J. New concepts in antimalarial use and mode of action in dermatology[J]. Dermatol Ther, 2007, 20: 160-174. |
| [30] |
Zhang C, Chen S, Zhang J, et al. Analysis of chemical drugs applied for clinical trial for the treatment of COVID-19[J]. Acta Pharm Sin (药学学报), 2020, 55: 355-365. |
| [31] |
Chen SF, Chan KH, Jiang Y, et al. In vitro susceptibility of 10 clinical isolates of SARS coronavirus to selected antiviral compounds[J]. J Clin Virol, 2004, 31: 69. |
| [32] |
Weemhoff JL, von Moltke LL, Richert C, et al. Apparent mechanism-based inhibition of human CYP3A in-vitro by lopinavir[J]. J Pharm Pharmacol, 2003, 55: 381-386. |
| [33] |
Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism:regulation of gene expression, enzyme activities, and impact of genetic variation[J]. Pharmacol Ther, 2013, 138: 103-141. |
| [34] |
Kaufmann P, Niglis S, Bruderer S, et al. Effect of lopinavir/ritonavir on the pharmacokinetics of selexipag an oral prostacyclin receptor agonist and its active metabolite in healthy subjects[J]. Br J Clin Pharmacol, 2015, 80: 670-677. |
| [35] |
Ming JBM, Gill MJ. Drug-induced rhabdomyolysis after concomitant use of clarithromycin, atorvastatin, and lopinavir/ritonavir in a patient with HIV[J]. AIDS Patient Care STDS, 2003, 17: 207-210. |
| [36] |
Li TCM, Chan MCW, Lee N. Clinical implications of antiviral resistance in influenza[J]. Viruses, 2015, 7: 4929-4944. |
| [37] |
Furuta Y, Gowen BB, Takahashi K, et al. Favipiravir (T-705), a novel viral RNA polymerase inhibitor[J]. Antivir Res, 2013, 100: 446-454. |
| [38] |
Madelain V, Nguyen TH, Olivo A, et al. Ebola virus infection:review of the pharmacokinetic and pharmacodynamic properties of drugs considered for testing in human efficacy trials[J]. Clin Pharmacokinet, 2016, 55: 907-923. |
| [39] |
Boriskin YS, Leneva IA, Pécheur EI, et al. Arbidol:a broad-spectrum antiviral compound that blocks viral fusion[J]. Curr Med Chem, 2008, 15: 997-1005. |
| [40] |
Teissier E, Zandomeneghi G, Loquet A, et al. Mechanism of inhibition of enveloped virus membrane fusion by the antiviral drug arbidol[J]. PLoS One, 2011, 6: e15874. |
| [41] |
Khamitov RA, Loginova SY, Shchukina VN, et al. Antiviral activity of arbidol and its derivatives against the pathogen of severe acute respiratory syndrome in the cell cultures[J]. Vopr Virusol, 2008, 53: 9-13. |
| [42] |
Chinanews. The team of Li Lanjuan: abidor and darunavir can effectively inhibit coronavirus[EB/OL]. 2020-05-06. http://www.sd.chinanews.com/2/2020/0205/70145.html.
|
| [43] |
Wang Y, Chen X, Li Q, et al. Metabolite identification of arbidol in human urine by the study of CID fragmentation pathways using HPLC coupled with ion trap mass spectrometry[J]. J Mass Spectrom, 2008, 43: 1099-1109. |
| [44] |
Song JH, Fang ZZ, Zhu LL, et al. Glucuronidation of the broad-spectrum antiviral drug arbidol by UGT isoforms[J]. J Pharm Pharmacol, 2013, 65: 521-527. |
| [45] |
Liu X, Huang T, Chen JX, et al. Arbidol exhibits strong inhibition towards UDP-glucuronosyltransferase (UGT) 1A9 and 2B7[J]. Pharmazie, 2013, 68: 945-950. |
| [46] |
Ni L, Zhou L, Zhou M, et al. Combination of western medicine and Chinese traditional patent medicine in treating a family case of COVID-19 in Wuhan[J]. Front Med, 2020, 14: 210-214. |
| [47] |
Zhang J, Cai W, Zhou Y, et al. Profiling and identification of the metabolites of baicalin and study on their tissue distribution in rats by ultra-high-performance liquid chromatography with linear ion trap-Orbitrap mass spectrometer[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015, 985: 91-102. |
| [48] |
Tian X, Cheng ZY, He J, et al. Concentration-dependent inhibitory effects of baicalin on the metabolism of dextromethorphan, a dual probe of CYP2D and CYP3A, in rats[J]. Chem Biol Interact, 2013, 203: 522-529. |
| [49] |
Gao N, Zou D, Qiao HL. Concentration-dependent inhibitory effect of baicalin on the plasma protein binding and metabolism of chlorzoxazone, a CYP2E1 probe substrate, in rats in vitro and in vivo[J]. PLoS One, 2013, 8: e53038. |
| [50] |
Gao N, Fang Y, Qi B, et al. Pharmacokinetic changes of unbound theophylline are due to plasma protein binding displacement and CYP1A2 activity inhibition by baicalin in rats[J]. J Ethnopharmacol, 2013, 150: 477-484. |
| [51] |
Fan L, Wang JC, Jiang F, et al. Induction of cytochrome P4502B6 activity by the herbal medicine baicalin as measured by bupropion hydroxylation[J]. Eur J Clin Pharmacol, 2009, 65: 403-409. |
| [52] |
Kalapos-Kovacs B, Magda B, Jani M, et al. Multiple ABC transporters efflux baicalin[J]. Phytother Res, 2015, 29: 1987-1990. |
| [53] |
Zhang J, Zhang S, Teng S, et al. An LC-MS/MS method for simultaneous determination of four flavonoids from Semen Oroxyli in rat plasma and its application to a pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1020: 96-102. |
| [54] |
Xing J, Chen X, Zhong D. Absorption and enterohepatic circulation of baicalin in rats[J]. Life Sci, 2005, 78: 140-146. |
| [55] |
Lai MY, Hsiu SL, Chen CC, et al. Urinary pharmacokinetics of baicalein, wogonin and their glycosides after oral administration of scutellariae radix in humans[J]. Biol Pharm Bull, 2003, 26: 79-83. |
| [56] |
Xing J, Chen X, Sun Y, et al. Interaction of baicalin and baicalein with antibiotics in the gastrointestinal tract[J]. J Pharm Pharmacol, 2005, 57: 743-750. |
| [57] |
Kang MJ, Ko GS, Oh DG, et al. Role of metabolism by intestinal microbiota in pharmacokinetics of oral baicalin[J]. Arch Pharm Res, 2014, 37: 371-378. |
| [58] |
Wang L, Yang Z, Zhang H, et al. Study on the network pharmacology and preliminary evidence of Lianhua Qingwen in the treatment of novel corovirus (2019-nCoV) pneumonia[J]. J Chin Med Mater (中药材), 2020, 43: 772-778. |
| [59] |
Clifford M. Chlorogenic acids and other cinnamates-nature, occurrence, dietary burden, absorption and metabolism[J]. J Sci Food Agric, 2000, 80: 1033-1043. |
| [60] |
Wang Z, Xia Q, Liu X, et al. Phytochemistry, pharmacology, quality control and future research of Forsythia suspensa (Thunb.) Vahl:a review[J]. J Ethnopharmacol, 2018, 210: 318-339. |
| [61] |
Wang Y, Zhang D, Du G, et al. Remdesivir in adults with severe COVID-19:a randomised, double-blind, placebo-controlled, multicentre trial[J]. The Lancet, 2020, 395: 1569-1578. |
 2020, Vol. 55
2020, Vol. 55


