早在19世纪, 法国生物学家巴斯德发现真核生物在缺氧条件下会将葡萄糖转化为乳酸, 这一现象被称为“巴斯德效应”, 即无氧糖酵解[1]。20世纪初, 德国生理学家瓦博格在肿瘤细胞中观察到了类似现象的发生, 即在有氧条件下, 肿瘤细胞大量摄入葡萄糖, 被摄入的葡萄糖大部分经葡萄糖-丙酮酸-乳酸途径代谢, 转变成乳酸排出细胞, 这一现象被称为“瓦博格效应”, 即有氧糖酵解[2]。正常细胞的能量来源主要是葡萄糖的氧化磷酸化(oxidative phosphorylation, OXPHOS), 一分子葡萄糖经三羧酸(tricarboxylic acid, TCA)循环能产生36分子ATP; 而一分子葡萄糖经糖酵解分解则仅能产生两分子ATP。深入的研究表明, 肿瘤细胞选择低效的糖酵解能量代谢方式, 能为肿瘤细胞带来其他生长优势, 包括: ①在缺氧条件下保留氧分子参与到其他关键细胞过程[3, 4]; ②为肿瘤细胞快速增殖提供碳源[5, 6]; ③降低线粒体呼吸作用, 减少活性氧(reactive oxygen species, ROS)的产生, 由此逃避细胞凋亡[7]。
在能量代谢途径的选择中, 丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex, PDC)作为守门蛋白在细胞中起到调节氧化磷酸化和糖酵解平衡的作用(图 1)。正常细胞中, PDC将丙酮酸分解为乙酰辅酶A (CoA)进入TCA完成氧化磷酸化; 而在肿瘤细胞中, 由于PDC活性受到抑制, 氧化磷酸化途径受阻, 丙酮酸在细胞质中发生糖酵解, 继而被乳酸脱氢酶(lactate dehydrogenase, LDH)代谢为乳酸[8-10]。

|
Figure 1 Schematic diagram of pyruvate metabolism |
肿瘤细胞中对PDC起到抑制调控作用的主要是丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinases, PDKs)。在包括HIFs、Wnt、Myc等多种肿瘤因子的诱导下, PDKs活性上调, 从而抑制了线粒体中PDC活性, 导致糖酵解途径激活, 促进肿瘤细胞的生长和增殖[8]。研究表明, 抑制PDKs活性可以有效逆转这一生理过程, 起到增加肿瘤细胞耗氧量、减少乳酸生成、诱导肿瘤细胞凋亡、调节肿瘤组织微环境的作用, 达到直接或协同杀伤肿瘤的目的[11-13]。除此之外, 有研究指出抑制PDKs活性对肥胖症、2型糖尿病等代谢性疾病的治疗也能产生积极作用[14]。由此, PDKs相关研究逐渐发展为医药研究重点领域之一, 发展PDKs抑制剂也成为包括肿瘤在内多种疾病的潜在治疗手段。
1 PDKs研究背景PDKs主要分布在细胞线粒体基质中, 已发现的人PDKs包括PDK1~4四个亚型, 各亚型分子质量在45~48 kDa之间, 均具有通过磷酸化PDC的E1区域α亚基下调PDC的能力。这一过程通过磷酸化E1α的3个丝氨酸残基位点实现, 3个位点任何一个磷酸化都会导致整个复合物失去活性, 同时PDKs对3个位点的磷酸化能力各不相同, 具体情况为:位点1, Ser 293: PDK2 > PDK4≈PDK1 > PDK3;位点2, Ser 300: PDK3 > PDK4≈PDK2 > PDK1;位点3, Ser 232: PDK3[15]。具体结构以PDK1为例(图 2), 其单体结构包括C端和N端两部分, 其中N端是由8个α螺旋构成的四螺旋束状结构, 也是不同亚型PDK表现序列差异的部分; 与之相比C端相对保守, 由4个保守子域构成“α/β三明治”结构, 每个PDK结构单体通过C端尾部与另一单体的N末端脂酰基结合位点连接, 组成同型二聚体发挥生物活性[16, 17]。
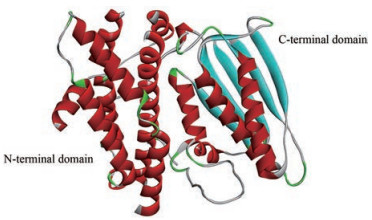
|
Figure 2 Ribbon diagram of PDK1 monomer (PDB code: 2Q8H) |
人体中PDKs的分布具有组织差异, PDK1主要分布在心脏、胰岛以及骨骼肌中; PDK2广泛分布在心脏、肾脏、肝脏等多种器官内; PDK3相对较为局限, 只在睾丸、肾脏和脑部有被检测到; PDK4在多种外周组织包括骨骼肌、乳腺、脂肪组织中表现出较高丰度。相比正常组织, 在不同类型的肿瘤组织中, 多种因素诱导不同亚型的PDKs表达上调, 导致PDC活性受到抑制、肿瘤细胞糖酵解途径增强[18-21]。抑制肿瘤组织中PDKs的活性, 可以起到调节肿瘤细胞代谢途径, 增加ROS含量, 诱导肿瘤细胞凋亡的作用, 达到肿瘤治疗目的。
2 PDKs小分子抑制剂研究表明, PDKs功能可以通过长期或短期进行调控, 其中长期调控指在PDKs转录水平进行干预, 包括microRNA转录诱导及长链非编码RNA (long non-coding RNA, lncRNA)转录抑制, 而短期调控主要是对已翻译的PDKs活性的抑制, 更适合小分子抑制剂发挥药理作用[22, 23]。目前, 已发现的PDKs小分子抑制剂主要作用位点有4个, 分别是两个变构位点(丙酮酸结合位点和辅酶A结合位点)、核苷酸(ATP)结合位点以及脂酰胺结合位点(图 3)[24]。本文以抑制剂作用位点进行分类, 对小分子PDKs抑制剂的研究进行综述, 并基于此对后续研究进行展望。

|
Figure 3 The binding sites of available PDK inhibitors |
丙酮酸结合位点是PDKs的活性调节位点。生理状态下, 高浓度的丙酮酸进入PDKs上丙酮酸结合位点, 下调PDKs活性, 促进PDC氧化磷酸化进程[9]。除丙酮酸外, 使用其他作用于丙酮酸位点抑制剂也可以达到抑制PDKs的效果。最具代表性的靶向丙酮酸结合位点的PDKs抑制剂是二氯乙酸(dichloroacetate, DCA)。丙酮酸结合位点位于N末端结构的螺旋束内部, 平时被水分子掩盖。丙酮酸类似物DCA在丙酮酸结合位点结合, 导致该位点中的His149向螺旋束外部发生位移, 促进了Arg148至Asp151间短节段中螺旋结构的解开(图 4), 解螺旋与基质中ADP协同抑制了PDKs的活性[15, 25]; 此外, 体内研究表明, DCA重复给药会抑制PDC去磷酸化失活的发生, 使PDC保持活性[26]。以上两种因素共同导致了DCA对PDC代谢途径的正向调节作用。
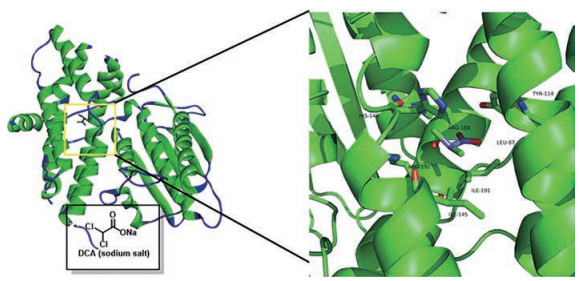
|
Figure 4 Binding mode of DCA with the pyruvate-binding site (PDB code: 2Q8H) |
DCA虽然对PDKs具有抑制活性, 但其较高的有效剂量(25~100 mg·kg-1)及外周运动神经毒性却限制了它的进一步的临床应用, 开发基于DCA结构的低毒性PDKs抑制剂成为了研究的重点。为进行结构改造, 研究人员首先合成化合物1~4考察二氯乙酰基是否为活性关键结构(图 5)。活性测试结果表明, 改变二氯乙酰基中氯原子数或以氟原子取代均会导致不同程度的活性下降, 由此证明二氯乙酰基是发挥活性的必需基团[27]。

|
Figure 5 Compounds tested for the importance of dichloroacetyl group (IC50 for DCA and compounds 1-4 were obtained from a primary enzymatic assay of PDK inhibition) |
基于二氯乙酰基这样一种简单的必需结构, 研究者将更多精力投入到对二氯乙酰基连接片段的开发中, 设计并得到了多种结构新颖、活性理想的化合物(图 6)。活性测试结果表明, 将适当取代的苯环、联苯或者三苯基团与二氯乙酰基进行拼接, 均可以得到PDKs抑制活性理想的化合物[28-30]。
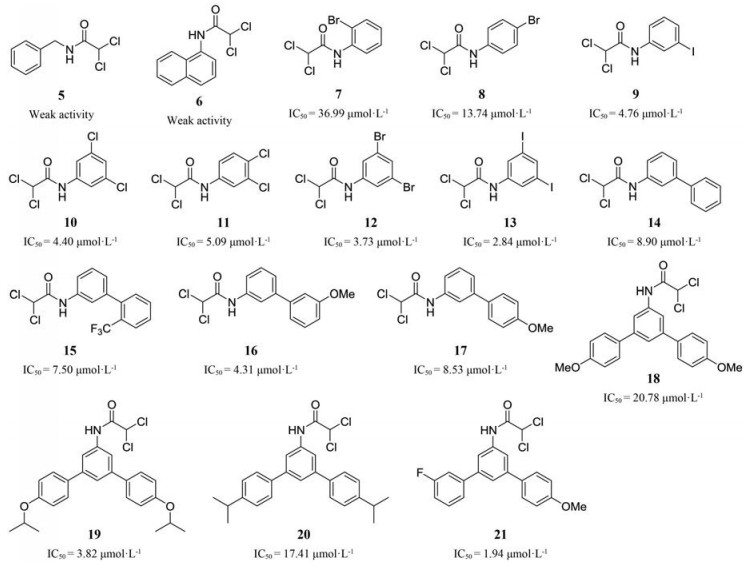
|
Figure 6 Series of compounds for fragment-based testing (IC50 for compounds 5-21 were recorded using cytotoxicity data of in vitro measurement by MTT assay) |
除了结构新颖的二氯乙酰连接片段的研发, 也有研究者将研究方向瞄准DCA支架的搭建。通过将DCA搭载在某些特异性结构骨架并将其递送至线粒体中, 再经由线粒体中水解酶催化分解释放DCA, 使得DCA可以靶向线粒体发挥作用, 有效解决了因DCA细胞分布性差而导致的大剂量及不良反应问题(图 7)[13, 31]。探索具有更高效价、更小不良反应的新颖结构将是靶向丙酮酸结合位点PDKs抑制剂的重要挑战。

|
Figure 7 Mitochondria-targeting DCA derivatives |
CoA结合位点位于PDKs的N端, 同样作为PDKs活性调节位点发挥生理作用。通过与CoA结合, CoA结合位点表现出抑制PDKs活性的效果[8]。CoA结合位点虽与丙酮酸结合位点同属变构结合位点, 但抑制剂结合该位点不会引起明显构象变化, 变构抑制机制尚停留在推测阶段[32]。同时因为发现的作用于该位点的抑制剂种类较少, CoA结合位点较少受到关注。在PDKs抑制剂的研发中, 辉瑞公司研究人员发现, 化合物Pfz3表现出一种全新的作用方式: Pfz3在CoA结合位点结合抑制PDK活性(图 8), 而且这种抑制活性仅在PDK2中表达(EC50 = 2 μmol·L-1)。这一发现引起了研究人员极大的兴趣, 但是研究者在Pfz3结合该位点时并没有观察到明显的构象变化, 因此尚未有Pfz3对PDK2的明确变构抑制机制提出。但是为解释Pfz3选择性抑制PDK2的现象, 科学家通过比较PDKs各亚型CoA结合位点氨基酸组成提出了这样的假设:与其他亚型CoA结合位点中心的Leu67相比, PDK2特有的Val67位阻较小, 不会阻碍Pfz3进入CoA位点, 于是Pfz3显示出了良好的PDK2选择抑制活性[32, 33]。
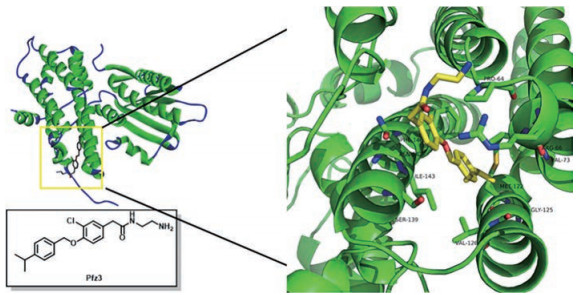
|
Figure 8 Binding mode of Pfz3 with the CoA-binding site (PDB code: 2BU7) |
除Pfz3外, 另一种被发现作用于该位点的化合物是苯基丁酸盐(图 9)。与Pfz3不同的是, 丁酸苯酯对PDK1~3均表现出抑制活性, 其相关变构调节机制同样尚未被阐明[34]。尽管作用于CoA结合位点的PDKs抑制剂报道较少, 但作为开发选择性PDKs抑制剂的重要方向, 此类结构类型仍具有较高的研究价值。
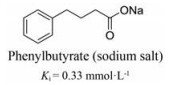
|
Figure 9 Structure of phenylbutyrate (IC50 for phenylbutyrate sodium salt obtained from a primary enzymatic assay of PDK inhibition) |
脂酰胺结合位点同样位于PDKs的N端, 通常情况下PDKs通过脂酰胺结合位点绑定PDC的E2亚基, 在E2域周围摆动、接触E1α进而产生磷酸化作用[35]。抑制该位点能有效阻断PDKs与PDC接触, 发挥抑制活性。自1999年, 诺华研究人员首先报道(R)-3, 3, 3-三氟-2-羟基-2-甲基丙酰胺结构(Nov3r)具有作用于脂酰胺结合位点抑制PDKs活性后, 已有包括阿斯利康在内多家跨国制药企业跟进开展相关研究, 脂酰胺结合位点俨然成为PDKs抑制剂研究的明星位点(图 10)[15, 36]。

|
Figure 10 Binding mode of AZD7545 with the lipoyl-binding site (PDB code: 2Q8G) |
在体外活性测试中, 诺华公司报道的这类抑制剂表现出了比DCA更高的效价和抑制活性, 受此鼓舞, 基于(R)-3, 3, 3-三氟-2-羟基-2-甲基丙酰胺结构的PDKs抑制剂研发在世界范围内紧锣密鼓地进行。研究者首先通过化合物22~25对(R)-3, 3, 3-三氟-2-羟基-2-甲基丙酰胺是否是该类抑制剂活性必需药效团进行考察, 在得到肯定结论后, 围绕该药效团连接片段结构的研究得到展开并被纷纷报道出来(图 11)[37, 38]。

|
Figure 11 Series of compounds with (R)-3, 3, 3-trifluoro-2-hydroxy-2-methyl as pharmacophore for fragment-based test (IC50 for Nov3r, AZD7545 and compounds 22-34 were obtained from a primary enzymatic assay of PDK inhibition) |
研究表明, 将(R)-3, 3, 3-三氟-2-羟基-2-甲基丙酰胺与芳香基团相连时, 邻位氯原子取代可以有效提高化合物的活性(如图 11, 化合物24~26), 而当(R)-3, 3, 3-三氟-2-羟基-2-甲基丙酰胺对位存在酯基、羧基及磺酰基等吸电子基团时, 随着基团吸电子能力增强, 化合物的活性又会进一步提高(化合物27~29), 基于以上研究成果阿斯利康成功研制出候选化合物AZD7545, 其对PDK1和3抑制活性分别达到87和600 nmol·L-1 [15, 37, 38]。同时诺华公司也基于已开发的Nov3r进行进一步改造, 通过修饰哌嗪环另一端芳基结构得到了具有与Nov3r相当活性的化合物31。脂酰胺结合位点一直是制药领域开发新型PDKs抑制剂的热门靶点, 靶向该位点可以阻断PDKs和PDC的联系, 最小程度影响PDC的正常生理功能, 深入研究PDC-PDKs复合物结构将对靶向脂酰胺结合位点抑制剂研究产生深刻影响。
2.4 作用于ATP结合位点的抑制剂PDKs将磷酸基团转移到E1α的过程需要能量供给, ATP结合位点为ATP与PDKs结合提供了合适的位置, 占据该位点将使E1α磷酸化因缺乏能量停滞[24]。ATP结合位点位于前文提到的C端“α/β三明治”结构内, 是由1个β折叠和3个α螺旋组成的一种叫做“Bergerat折叠”的特定模序结构。“Bergerat折叠”属于GHKL ATP酶/激酶超基因家族的保守模块在热休克蛋白90 (Hsp 90)及拓扑异构酶VI (Topo VI)中均有发现[35], 于是拓展Hsp 90抑制剂在PDKs中的使用成为了PDKs抑制剂的又一个热门研究方向。初期研究表明, Hsp 90抑制剂radicicol可以通过阻塞ATP结合位点入口, 使ATP无法进入活性位点, 起到抑制作用(图 12), 而另一种Hsp 90抑制剂M77976则可以结合在ATP结合位点, 引起位点构象变化以及大的结构域重排从而导致ATP结合亲和力下降、位点活性丧失[39, 40], 与radicicol相比, M77976表现出更强烈的抑制效果(radicicol, IC50 = 1 097 μmol·L-1; M77976, IC50 = 648 μmol·L-1)。

|
Figure 12 Binding mode of radicicol with the ATP-binding site (PDB code: 2Q8I) |
遵循在Hsp 90抑制剂中发展PDKs抑制剂的研究思路, 来自德克萨斯大学的Chuang课题组成功发展出Hsp 90/PDK2双重抑制剂(35~37, 图 13), 其保留对Hsp 90的作用的同时也具有可观的PDK2抑制活性[41]。除此之外, 基于M77976的结构改造研究表明, 保留间苯二酚及对甲氧基苯基部分, 改变芳杂环上甲基结构可以有效增强对PDK1的抑制活性(38~41), 细胞实验表明酰胺氢的除去可以有效提高化合物的细胞膜透过性[42], 化合物40和41因其良好的细胞膜透过性和抑制肿瘤细胞增殖能力受到广泛关注, 有望成为继DCA后下一批进入临床试验的PDKs抑制剂。值得一提的是, ATP竞争性抑制剂VER-246608在低营养培养液中表现出了增强多柔比星抗肿瘤活性的能力, 为PDKs抑制剂-抗肿瘤药物联合使用开拓了道路[43]。
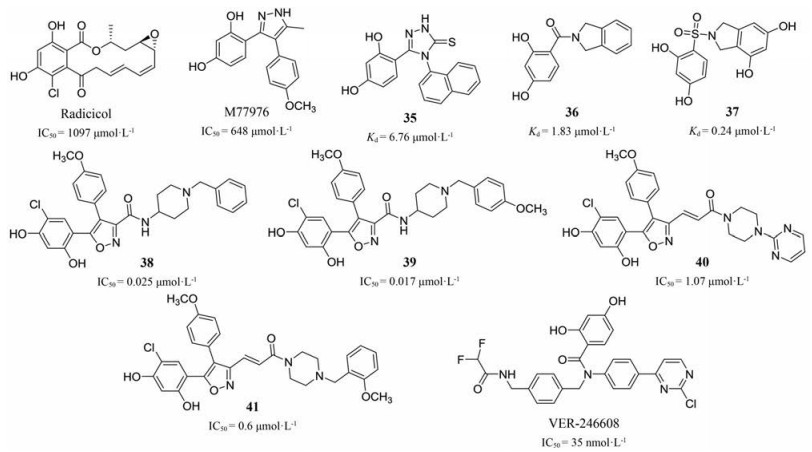
|
Figure 13 Some compounds binding with the ATP-binding site (IC50 for radicicol, M77976, VER-246608 and compounds 38-41 were obtained from a primary enzymatic assay of PDK inhibition, Kd for compounds 35-37 were determined by ITC) |
需要指出的是, 虽然借鉴Hsp 90抑制剂为开发有效的PDKs抑制结构提供极大的便利, 但ATP结合位点高度的相似也可能导致脱靶效应的发生, 引起不良反应。因此通过修饰提高化合物PDKs选择性, 将其发展成特异性PDKs抑制剂将成为药物化学工作者面临的严峻挑战。
2.5 作用于其他位点的抑制剂除作用在以上4个主要作用位点的抑制剂外, 2015年上海药物所和华东理工大学共同报道了一类作用方式新颖的化合物JX06 (图 14), 其与PDK1在ATP结合位点附近的疏水口袋结合, 通过与保守氨基酸Cys240形成二硫键诱导附近Arg286构象改变, 达到阻塞ATP进入结合位点, 抑制PDK1活性的目的[44]。这类化合物作用机制独特, 开拓了全新位点PDKs抑制剂研究方向。
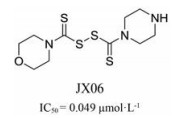
|
Figure 14 Structure of JX06 (IC50 for JX06 were obtained from a primary enzymatic assay of PDK inhibition) |
瓦博格效应被发现已有近百年时间, 一直以来围绕这一效应的肿瘤治疗研究从未中断, 其中PDKs作为调节肿瘤细胞代谢方式的关键蛋白受到了极大重视。深入研究表明, PDKs抑制剂除抗肿瘤外还具有抗糖尿病、抗肥胖等其他相关活性, 这些积极的研究成果都是PDKs抑制剂研究持续推进的动力。与此同时, PDKs抑制剂的研究也面临着突破专利束缚发展全新结构、增强DCA结合位点抑制剂亲和力、改善ATP结合位点抑制剂特异性以及提高PDK抑制剂亚型选择性的各种挑战。可以预见, PDKs抑制剂的研发还有很长的一段路要走, 但基于其在肿瘤和代谢疾病治疗上的巨大潜力, PDKs抑制剂的设计和开发仍将是一个充满吸引力的课题。
作者贡献:程卯生及刘洋监督了整个文章撰写并提供意见指导; 张作鹏完成了文章的文献收集及撰写; 仲烨对文章中蛋白结构图的完成提供了帮助。
利益冲突:作者声明没有利益冲突。
| [1] |
Gooch JW. Encyclopedic Dictionary of Polymers[M]. New York: Springer, 2011: 722.
|
| [2] |
Dang CV, Gao P, Kim J. Encyclopedia of Cancer[M]. Berlin: Springer, 2015: 67.
|
| [3] |
Nakazawa MS, Keith B, Simon MC. Oxygen availability and metabolic adaptations[J]. Nat Rev Cancer, 2016, 16: 663-673. DOI:10.1038/nrc.2016.84 |
| [4] |
Icard P, Shulman S, Farhat D, et al. How the Warburg effect supports aggressiveness and drug resistance of cancer cells?[J]. Drug Resist Update, 2018, 38: 1-11. DOI:10.1016/j.drup.2018.03.001 |
| [5] |
Wang QY, Jia F, Wang JY. Research progress of pyruvate dehydrogenase kinases in malignancies[J]. J Cancer Control Treat, 2019, 32: 945-950. |
| [6] |
Zhang BY, Liu AL, Du GH. Energy metabolism disorder and diseases: from effects to potential targets[J]. Acta Pharm Sin (药学学报), 2019, 54: 1372-1381. |
| [7] |
Kamarajugadda S, Stemboroski L, Cai Q, et al. Glucose oxidation modulates anoikis and tumor metastasis[J]. Mol Cell Biol, 2012, 32: 1893-1907. DOI:10.1128/MCB.06248-11 |
| [8] |
Zhang SL, Hu XH, Zhang W, et al. Development of pyruvate dehydrogenase kinase inhibitors in medicinal chemistry with particular emphasis as anticancer agents[J]. Drug Discov Today, 2015, 20: 1112-1119. DOI:10.1016/j.drudis.2015.03.012 |
| [9] |
Stacpoole PW. Therapeutic targeting of the pyruvate dehydrogenase complex/pyruvate dehydrogenase kinase (PDC/PDK) axis in cancer[J]. J Natl Cancer Inst, 2017, 109: 11. |
| [10] |
Bobrovnikova ME, Hurov JB. Targeting metabolic changes in cancer: novel therapeutic approaches[J]. Annu Rev Med, 2014, 65: 157-170. DOI:10.1146/annurev-med-092012-112344 |
| [11] |
Kery M, Oravcova N, Radenkovic S, et al. Pyruvate dehydrogenase kinase 1 and carbonic anhydrase IX targeting in hypoxic tumors[J]. Neoplasma, 2019, 66: 63-72. DOI:10.4149/neo_2018_180531N357 |
| [12] |
Filimonova MV, Podosinnikova TS, Samsonova AS, et al. Comparison of antitumor effects of combined and separate treatment with no synthase inhibitor T1023 and PDK1 inhibitor dichloroacetate[J]. Bull Exp Biol Med, 2019, 168: 92-94. DOI:10.1007/s10517-019-04655-1 |
| [13] |
Wei GF, Sun JS, Luan WJ, et al. Natural product albiziabioside A conjugated with pyruvate dehydrogenase kinase inhibitor dichloroacetate to induce apoptosis-ferroptosis-M2-TAMs polarization for combined cancer therapy[J]. J Med Chem, 2019, 62: 8760-8772. DOI:10.1021/acs.jmedchem.9b00644 |
| [14] |
Park S, Jeon JH, Min BK, et al. Role of the pyruvate dehydrogenase complex in metabolic remodeling: differential pyruvate dehydrogenase complex functions in metabolism[J]. Diabetes Metab J, 2018, 4: 270-281. |
| [15] |
Kato M, Li J, Chuang JL, et al. Distinct structural mechanisms for inhibition of pyruvate dehydrogenase kinase isoforms by AZD7545, dichloroacetate, and radicicol[J]. Structure, 2007, 15: 992-1004. DOI:10.1016/j.str.2007.07.001 |
| [16] |
Nicklaus SC, Kirill MP, Melissa MB, et al. Structure of pyruvate dehydrogenase kinase[J]. J Biol Chem, 2001, 276: 37443-37450. DOI:10.1074/jbc.M104285200 |
| [17] |
Patel MS, Nemeria NS, Furey W, et al. The pyruvate dehydrogenase complexes: structure-based function and regulation[J]. J Biol Chem, 2014, 289: 16615-16623. DOI:10.1074/jbc.R114.563148 |
| [18] |
Ognibene M, Cangelosi D, Morini M, et al. Immunohistochemical analysis of PDK1, PHD3 and HIF-1alpha expression defines thehypoxic status of neuroblastoma tumors[J]. PLoS One, 2017, 12: e0187206. DOI:10.1371/journal.pone.0187206 |
| [19] |
He Z, Li Z, Zhang X, et al. MiR-422a regulates cellular metabolism and malignancy by targeting pyruvate dehydrogenase kinase 2 in gastric cancer[J]. Cell Death Dis, 2018, 9: 505. DOI:10.1038/s41419-018-0564-3 |
| [20] |
Woolbright BL, Choudhary D, Mikhalyuk A, et al. The role of pyruvate dehydrogenase kinase-4 (PDK4) in bladder cancer and chemoresistance[J]. Mol Cancer Ther, 2018, 17: 2004-2012. DOI:10.1158/1535-7163.MCT-18-0063 |
| [21] |
Tereza G, Martin K, Silvia R, et al. Microenvironmental control of glucose metabolism in tumors by regulation of pyruvate dehydrogenase[J]. Int J Cancer, 2019, 144: 674-686. DOI:10.1002/ijc.31812 |
| [22] |
Ma X, Li C, Sun L, et al. Lin28/let-7 axis regulates aerobic glycolysis and cancer progression via PDK1[J]. Nat Commun, 2014, 5: 5212. DOI:10.1038/ncomms6212 |
| [23] |
Peng F, Wang JH, Fan WJ, et al. Glycolysis gatekeeper PDK1 reprograms breast cancer stem cells under hypoxia[J]. Oncogene, 2018, 37: 1062-1074. DOI:10.1038/onc.2017.368 |
| [24] |
Nam HJ. Pyruvate dehydrogenase kinases: therapeutic targets for diabetes and cancers[J]. Diabetes Metab J, 2015, 39: 188-197. DOI:10.4093/dmj.2015.39.3.188 |
| [25] |
Kankotia S, Stacpoole PW. Dichloroacetate and cancer: new home for an orphan drug?[J]. Biochim Biophys Acta, 2014, 1846: 617-629. |
| [26] |
Stacpoole PW. The dichloroacetate dilemma: environmental hazard versus therapeutic goldmine-both or neither?[J]. Environ Health Perspect, 2011, 19: 155-158. |
| [27] |
Thomas DA, Robert CA, Jia PG, et al. Secondary amides of (R)-3, 3, 3-trifluoro-2-hydroxy-2-methylpropionic acid as inhibitors of pyruvate dehydrogenase kinase[J]. J Med Chem, 2000, 43: 236-249. DOI:10.1021/jm990358+ |
| [28] |
Yang YC, Shang PH, Cheng CM, et al. Novel N-phenyl dichloroacetamide derivatives as anticancer reagents: design, synthesis and biological evaluation[J]. Eur J Med Chem, 2010, 45: 4300-4306. DOI:10.1016/j.ejmech.2010.06.032 |
| [29] |
Li TW, Yang YC, Cheng CM, et al. Multi-substituted N-phenyl-2, 2-dichloroacetamide analogues as anti-cancer drugs: design, synthesis and biological evaluation[J]. Acta Pharm Sin (药学学报), 2012, 47: 354-363. |
| [30] |
Li TW, Yang YC, Cheng CM, et al. Design, synthesis and biological evaluation of N-arylphenyl-2, 2-dichloroacetamide analogues as anti-cancer agents[J]. Bioorg Med Chem Lett, 2012, 22: 7268-7271. DOI:10.1016/j.bmcl.2012.07.057 |
| [31] |
Rakesh KP, Sean M, Donald AH, et al. Mito-DCA: amitochondria targeted molecular scaffold for efficacious delivery of metabolic modulator dichloroacetate[J]. ACS Chem Biol, 2014, 9: 1178-1187. DOI:10.1021/cb400944y |
| [32] |
Thorsten RK, Alec DT, Colin MR, et al. Regulatory roles of the N-terminal domain based on crystal structures of human pyruvate dehydrogenase kinase 2 containing physiological and synthetic ligands[J]. Biochemistry, 2006, 45: 402-415. DOI:10.1021/bi051402s |
| [33] |
Gahlot P, Kakkar R. Docking modes of Pfz3 and its analogues into the lipoamide binding site on PDHK2[J]. Int Res J Pharm, 2011, 1: 33-41. |
| [34] |
Ferriero R, Lannuzzi C, Manco G, et al. Differential inhibition of PDKs by phenylbutyrate and enhancement of pyruvate dehydrogenase complex activity by combination with dichloroacetate[J]. J Inherit Metab Dis, 2015, 38: 895-904. DOI:10.1007/s10545-014-9808-2 |
| [35] |
Elise S, Chantal B, Sylvie B. The pyruvate dehydrogenase complex in cancer: an old metabolic gatekeeper regulated by new pathways and pharmacological agents[J]. Int J Cancer, 2016, 138: 809-817. DOI:10.1002/ijc.29564 |
| [36] |
Aicher TD, Anderson RC, Bebernitz GR, et al. (R)-3, 3, 3-Trifluoro-2-hydroxy-2-methylpropionamides are orally active inhibitors of pyruvate dehydrogenase kinase[J]. J Med Chem, 1999, 42: 2741-2746. DOI:10.1021/jm9902584 |
| [37] |
Bebernitz GR, Aicher TD, Stanton JL, et al. Anilides of (R)-trifluoro-2-hydroxy-2-methylpropionic acid as inhibitors of pyruvate dehydrogenase kinase[J]. J Med Chem, 2000, 43: 2248-2257. DOI:10.1021/jm0000923 |
| [38] |
Aicher TD, Anderson RC, Gao JP, et al. Secondary amides of (R)-3, 3, 3-trifluoro-2-hydroxy-2-methylpropionic acid as inhibitors of pyruvate dehydrogenase kinase[J]. J Med Chem, 2000, 43: 236-249. DOI:10.1021/jm990358+ |
| [39] |
Kukimoto-Niino M, Tokmakov A, Terada T, et al. Inhibitor-bound structures of human pyruvate dehydrogenase kinase 4[J]. Acta Crystallogr D Biol Crystallogr, 2011, 67: 763-773. DOI:10.1107/S090744491102405X |
| [40] |
Hiromasa Y, Roche TE. Critical role of specific ions for ligand-induced changes regulating pyruvate dehydrogenase kinase isoform 2[J]. Biochemistry, 2008, 4: 2298-2311. |
| [41] |
Tso S, Qi XB, Gui WJ, et al. Structure-guided development of specific pyruvate dehydrogenase kinase inhibitors targeting the ATP-binding pocket[J]. J Biol Chem, 2014, 289: 4432-4443. DOI:10.1074/jbc.M113.533885 |
| [42] |
Meng T, Zhang DD, Xie ZQ, et al. Discovery and optimization of 4, 5-diarylisoxazoles as potent dual inhibitors of pyruvate dehydrogenase kinase and heat shock protein 90[J]. J Med Chem, 2014, 57: 9832-9843. DOI:10.1021/jm5010144 |
| [43] |
Moore JD, Staniszewska A, Shaw T, et al. VER-246608, a novel pan-isoform ATP competitive inhibitor of pyruvate dehydrogenase kinase, disrupts Warburg metabolism and induces context-dependent cytostasis in cancer cells[J]. Oncotarget, 2014, 5: 12862-12876. DOI:10.18632/oncotarget.2656 |
| [44] |
Sun WY, Xie ZQ, Liu YF, et al. JX06 selectively inhibits pyruvate dehydrogenase kinase PDK1 by a covalent cysteine modification[J]. Cancer Res, 2015, 75: 4923-4936. DOI:10.1158/0008-5472.CAN-15-1023 |
 2020, Vol. 55
2020, Vol. 55


