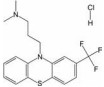
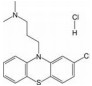
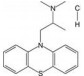
2. 中国食品药品检定研究院, 化学药品质量研究与评价重点实验室, 北京 100050
2. NMPA Key Laboratory for Quality Research and Evaluation of Chemical Drugs, National Institutes for Food and Drug Control, Beijing 100050, China
2019年12月暴发了一场由新型冠状病毒(2019 novel coronavirus, 2019-nCoV)引发的全球传染性肺炎疫情。对该冠状病毒的系统发育关系的分析表明, 2019-nCoV与严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)有约79%的同源性, 与中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)有约50%的同源性[1, 2], 同样具有传播速度快、范围广和引发具有致命性肺炎等特点, 目前已经波及了全球上百个国家。由于没有直接抑制该病毒的特异性治疗药物, 为了抗击疫情, 对于抗冠状病毒药物的开发目前是全世界学者的研究热点。
吩噻嗪类药物是一种抗精神病类药物, 最近研究发现, 除了抗精神病作用之外, 其具有一定的抗冠状病毒效果[3, 4]。自新型冠状病毒肺炎(corona virus disease 2019, COVID-19)暴发以来, Plaze等[3]观察到精神病患者中COVID-19重症患者的人数比例比医疗保健专业人员中重症患者的人数比例更少, 于是假设精神病患者可以通过某种抗精神病药物来防止重症COVID-19的出现。氯丙嗪(chlorpromazine, CPZ)作为美国食品药品监督管理局(Food and Drug Administration, FDA)已经批准上市的吩噻嗪类药物, 因其在体外实验表现出抗2019-nCoV活性而受到广泛关注[4]。2020年4月, 作者建立了一项多中心、随机对照Ⅲ期临床试验, 研究人群为需要入院治疗的轻症COVID-19患者, 以研究CPZ在感染早期是否可以有效阻止COVID-19从轻症向重症的不利转化的同时降低传染率, 该实验的建立证实了CPZ在抗冠状病毒活性方面具有老药新用的潜力。本文对冠状病毒及其筛选抑制剂的几类靶点作了简要介绍, 综述了吩噻嗪类化合物抗冠状病毒活性的相关体内外实验研究, 对其可能的作用机制以及作为先导化合物开发抗冠状病毒新药的优势进行了讨论。
1 冠状病毒及抗冠状病毒抑制剂靶点简介冠状病毒(coronaviruses, CoVs)是一类具有囊膜、基因组为线性单股正链的球状RNA病毒, 是许多家畜、宠物包括人类疾病的重要病原[5], 其结构如图 1所示。自出现以来, 冠状病毒在本世纪已经引起了3起致命性传染病的大暴发, 对人类构成了巨大威胁。SARS-CoV于2003年初暴发于中国广东, 直至2003年8月, SARS-CoV共导致774人死亡, 致死率为9.6%[6]。MERS-CoV于2012年9月暴发于沙特, 截至2016年4月, 共有包括27个国家的624例病例死亡, 病死率高达35%[7]。2019年12月, COVID-19在全球各地陆续暴发, 截止到2020年5月19日, COVID-19在全球已造成319 252起死亡病例, 死亡率达到6.7%, 并且这一数据目前仍在攀升中。国际病毒分类委员会于2020年2月11日将2019-nCoV归类为严重急性呼吸综合征冠状病毒2 (SARS-CoV-2), 到目前为止是已发现的第7种可以感染人的冠状病毒。
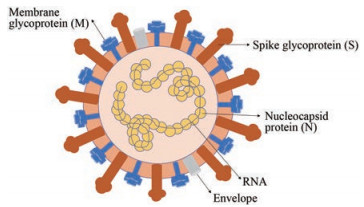
|
Figure 1 Structure of coronavirus. Coronavirus has surface viral protein, named spike glycoprotein (S). The viral membrane glycoprotein (M) and envelope (E) of coronavirus are embedded in host membrane-derived lipid bilayer encapsulating the helical nucleocapsid comprising viral RNA |
由于目前还没有特异性治疗药物或疫苗被批准用于治疗人类冠状病毒, 因此对冠状病毒的抑制剂的筛选仍然是一大挑战。目前用于治疗冠状病毒的潜在药物靶点可分为2类:第一类靶点作用于人体, 包括以下途径: ①作用于宿主自身免疫系统, 例如利用干扰素、重组干扰素或提供干扰素诱导剂等增强对病毒的免疫反应[8]; ②通过抑制宿主细胞特定的受体或酶来阻止病毒进入细胞, 例如SARS-CoV及SARS-CoV-2都可以与宿主细胞血管紧张素转换酶2 (angiotensin-converting enzyme 2, ACE2)受体结合, 可以通过ACE2衍生物或小分子靶向ACE2阻断SARS-CoV介导的细胞融合, 从而阻止病毒进入宿主细胞[9]; ③阻断与病毒复制有关的宿主信号途径。第二类靶点位于冠状病毒, 包括以下途径: ①作用于病毒的遗传物质, 阻止病毒RNA的合成; ②作用于病毒表面结构的棘突糖蛋白, 开发单克隆抗体或融合抑制剂, 从而阻断病毒与人类细胞受体的结合; ③通过抑制病毒的关键酶或功能蛋白从而阻断病毒在人体内的复制和转录。
利用现有的药物分子数据库, 高通量筛选发现具有抑制冠状病毒活性的化合物是一种药物开发策略, 可以发现许多已上市药物的新生物活性。相较于开发一种全新的药物, 该方法具有筛选范围广、研发周期短、成本低等特点, 能较快应用于临床, 是目前许多学者的研究方向。吩噻嗪类化合物是通过该方法筛选出的一种具有潜在抗冠状病毒活性的化合物, 其结构显示可以与冠状病毒功能蛋白结合以抑制病毒在宿主细胞中的复制, 通过对其体内外相关实验结果和可能的作用机制进行探讨后发现其具有老药新用的潜力。
2 吩噻嗪类化合物的抗冠状病毒活性及作用机制吩噻嗪类药物是一类含硫、氮的三环稠合的杂环化合物(图 2), 属于第一代精神类药物。除了具有治疗精神疾病的活性外, 吩噻嗪类衍生物还具有抗菌、抗癌、抗多药耐药活性、抗炎作用、治疗癫痫或阿尔茨海默症等各种生物活性及药理作用[10]。除此之外, 其抗病毒活性同样引起了研究人员的广泛关注。CPZ能够抑制乙型肝炎病毒、猴空泡病毒、人类疱疹病毒和基孔肯雅病毒等, 是一类具有潜在的广谱抗病毒活性的抑制剂。有学者对吩噻嗪药物的冠状病毒潜在抑制能力进行了评估, Dyall等[11]筛选了290余种化合物并检验其抗MERS-CoV和SARS-CoV的半数有效浓度(median effective concentration, EC50)及细胞毒性, 其中包括6种吩噻嗪类药物。结果表明, 盐酸CPZ、盐酸三氟丙嗪和盐酸异丙嗪可以在体外有效地阻断MERS-CoV和SARS-CoV在Vero E6细胞中的感染(病毒抑制率 > 50%), 且细胞毒性较低(细胞抑制率 < 30%) (表 1)。Weston等[12]发现CPZ在体外实验中对SARS-CoV-2的复制有明显的抑制作用, 并可以有效改善感染SARS-CoV的BALB/c小鼠的症状, 减缓体重的下降, 在高剂量下具有抗感染后炎症作用。
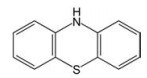
|
Figure 2 Structure of 10H-phenothiazine |
| Table 1 Phenothiazines with activity against Middle East respiratory syndrome coronavirus (MERS-CoV) and severe acute respiratory syndrome coronavirus (SARS-CoV). EC50: Median effective concentration |
吩噻嗪类衍生物对冠状病毒的抑制机制目前尚无定论, 其中一种可能是通过抑制病毒的关键酶或功能蛋白从而阻断病毒在人体内的复制和转录。在SARS-CoVs基因组中, 由5′末端开放阅读框1a/b编码的2个多蛋白复制酶经木瓜样蛋白酶(papain-like protease, PLpro)和主蛋白酶(main protease, Mpro) 2种水解酶剪切产生非结构蛋白(non-structural protein, Nsp)参与病毒的转录和复制[13]。因此PLpro和Mpro水解酶被认为是治疗SARS感染的2类重要的药物靶点, 并且已成功地用于其他多种病毒性疾病的药物开发。目前Mpro抑制剂洛匹那韦已在体外实验中被证明能够抑制MERS-CoV及SARS-CoV的复制, 已被《新型冠状病毒感染的肺炎诊疗方案(试行第三版)》作为推荐药物收录并开展临床试验[14]。Mpro晶体结构显示其分子包括3个结构域[15], 其活性口袋位于结构域I和II之间的缝隙中, 活性位点通常由4个位点(S1'、S1、S2和S4)组成, 在冠状病毒中具有高度的结构保守性, 其中的催化位点由多种氨基酸残基组成[16]。Zhang等[17]利用计算机模拟研究了6种化合物与SARS-COV Mpro的结合能力, 筛选出丙嗪能与Mpro结构域I和II之间的缝隙中的一系列氨基酸残基活性位点结合, 并预测了其与结合位点的亲和力, 结果表明丙嗪具有潜在的抗SARS病毒复制的作用。Liu等[18]通过计算机筛选出10种可能与SARS-CoV-2的Mpro底物结合位点结合的上市药物, 其中吩噻嗪类药物奋乃静可能与Mpro结合位点中的氨基酸残基ASN28和ASN119形成氢键, 从而干扰Mpro相关病毒复制及转录功能。Liu等[19]也通过计算机虚拟筛选SARS-CoV Mpro靶点的潜在抑制剂, 其中有3种吩噻嗪类化合物可能与Mpro结合位点中的1个或多个关键氨基酸残基相结合, 进而起到对Mpro功能的抑制作用。Ho等[20]建立了生物素化酶联免疫吸附实验和免疫荧光实验方法, 进一步研究并证明了异丙嗪对SARS-CoV Mpro蛋白和ACE2受体具有浓度依赖性抑制作用。除此之外, 吩噻嗪类化合物也可以利用PLpro作为靶点, 从而阻断病毒在宿主体内的复制过程。和Mpro一样, PLpro负责对冠状病毒多蛋白复制酶N端进行切割, 作为冠状病毒复制和宿主感染过程中不可缺少的酶, PLpro还具有识别和去除宿主细胞泛素化酶和泛素样蛋白的活性, 抑制干扰素激活表达通路等额外功能, 从而帮助冠状病毒逃避宿主固有免疫应答[21], 因此以PLpro为靶点筛选出的抗冠状病毒药物不仅具有抑制病毒复制方面的优势, 还可以抑制病毒对宿主干扰素表达通路的负调节作用, 是被证实具有重要研究意义的热门靶点。Wu等[22]通过ZINC药物数据库虚拟筛选出乙酰奋乃静可能与PLpro活性部位具有良好的结合能力, 具有潜在的抑制其功能的应用价值。
目前已知SARS-CoV可以通过网格蛋白介导的内吞作用进入体内, 吩噻嗪类化合物抗冠状病毒活性的另一种可能的机制是通过抑制发动蛋白-鸟苷三磷酸酶(guanosine triphosphatase, GTPase)活性的方式阻止网格蛋白在质膜上形成凹坑, 进而抑制其介导的病毒内吞作用。Inoue等[23]通过siRNA介导的基因沉默技术抑制细胞表面网格蛋白重链蛋白(clathrin heavy chain, CHC)以研究网格蛋白对SARS-CoV感染细胞的影响。结果表明, CHC的减少使SARS-CoV在24 h内的传染性大大降低, 并且与对照组相比, CPZ对治疗非网格蛋白依赖性的病毒几乎没有作用, 而对治疗SARS-CoV感染具有明显的呈浓度依赖性的抑制作用, 说明网格蛋白介导的内吞作用抑制剂CPZ是治疗SARS-CoV的一种潜在药物。de Wilde等[24]同样发现微量的CPZ (12 μmol·L-1)可以完全抑制感染MERS-CoV的Vero细胞和Huh7细胞中出现的细胞病变效应[EC50为4.9 μmol·L-1, 半数毒性浓度(median cytotoxic concentration, CC50)为21.3 μmol·L-1]。由于多种病毒入侵宿主细胞的途径中均包含网格蛋白介导的内吞作用, 因此CPZ不仅可以作为潜在MERS-CoV和SARS-CoV抑制剂, 也说明其具有作为广谱冠状病毒抑制剂的潜力。
除了冠状病毒之外, 吩噻嗪类衍生物已被证明具有抗多种病毒的活性。已有研究证实, 吩噻嗪类化合物可以抑制基孔肯雅病毒与宿主细胞的黏附作用, 被认为可以作为其潜在抑制剂的先导化合物进行开发[25]。Chamoun-Emanuelli等[26]发现吩噻嗪类化合物可以在宿主细胞膜中插入富含胆固醇的区域并增加膜流动性来干扰病毒与宿主细胞的融合, 有6种经FDA批准的吩噻嗪类药物及其衍生物具有抗丙型肝炎病毒的活性。Mayer等[27]发现吩噻嗪类衍生物可以与1型人类免疫缺陷病毒中的RNA序列特异区特异性结合, 阻断其与病毒编码蛋白的相互作用, 从而抑制病毒在宿主细胞内的增殖。Mucsi等[28]采用苯并[a]吩噻嗪与阿昔洛韦联合的方式来提高抗Vero细胞中单纯疱疹病毒(herpes simplex virus, HSV)的能力, 其中苯并[a]吩噻嗪可能起到降低HSV-2的致突变率来增强宿主细胞的抗病毒活性。
3 研究难点虽然吩噻嗪类衍生物具有潜在抗冠状病毒活性, 但对于将其正式开发成为抗冠状病毒药物仍然具有难度。首要考虑的因素是部分吩噻嗪类药物的细胞毒性, 以及其难以在临床上实现的有效活性浓度。Cong等[29]评估了CPZ及其他化合物抑制人外周血单核细胞源性巨噬细胞(monocyte-derived macrophages, MDMs)中的MERS-CoV活性的能力, CPZ具有较强的抑制MERS-CoV的能力, 但细胞毒性相对较高(CC50为25.64 μmol·L-1), 其抗病毒活性浓度(EC50为13.58 μmol·L-1)与细胞毒性浓度较为接近, 导致治疗窗口狭窄, 限制了其后续开发。Barnard等[30]对一些吩噻嗪类衍生物及其结构类似物在Vero E6细胞中的抗SARS-CoV活性进行了测试。结果表明, 部分吩噻嗪类衍生物可以有效降低病毒产量, 在类似浓度下还可以抑制其他SARS冠状病毒株; 然而体内实验显示, 丙嗪在10和50 mg·kg-1·d-1浓度下导致受感染小鼠肺部病毒感染时间延长, 原因可能是由于丙嗪可以诱导部分促炎症细胞因子产生, 加剧了SARS-CoV诱发的细胞因子风暴。
为了解决目前吩噻嗪类化合物对冠状病毒的有效抑制浓度较高、细胞毒性较大以及治疗窗狭窄等难题, 可以通过研究其结构-活性关系, 合理设计靶标, 将吩噻嗪结构作为先导化合物骨架来开发合成其他选择性更高、治疗效果更好、毒性更低的衍生物及结构类似物。在吩噻嗪类药物构效关系中, C2位取代基电负性越强, 其抗精神病活性越高; 而在抗冠状病毒活性中, C2位为吸电子基团结构的吩噻嗪衍生物对SARS-CoV复制的抑制作用更强[30], 可能是因为吩噻嗪结构中C2位被吸电子基团取代可以增强其对发动蛋白的抑制能力, 较不含C2位取代基的丙嗪、异丙嗪和三氟丙嗪抑制网格蛋白介导的病毒内吞途径的能力更强[31]。在进一步研究吩噻嗪类化合物结构-抑制发动蛋白活性关系后发现, 单纯的吩噻嗪结构、简单的N-烷基取代或N-芳基取代吩噻嗪化合物均缺乏抑制发动蛋白Ⅰ (dynamin Ⅰ, Dyn Ⅰ)活性的能力, 而其中具有抑制Dyn Ⅰ活性的4种吩噻嗪衍生物结构中均含有1个叔氮基(位于含氮杂环取代基中), 该基团通过脂肪族化合物间隔基与吩噻嗪结构中氮原子相连, 可以提高吩噻嗪类化合物抑制Dyn Ⅰ的活性[31], 进而可能增强其抑制冠状病毒通过内吞途径进入宿主细胞的能力。除此之外, 以吩噻嗪结构作为母核开发的其他结构类似物同样具有抗冠状病毒活性, 如噻吨类药物替沃噻吨和二苯并氮杂卓类药物盐酸氯米帕明也具有抗MERS-CoV和SARS-CoV活性[11], 当用氧原子取代吩噻嗪环结构中的氮原子或硫原子时, 得到的吩噁噻或吩噁嗪化合物的抗病毒活性及细胞毒性会大大降低[30]。
4 展望作为可以老药新用的经典药物之一, 吩噻嗪类药物作为先导化合物在抗肿瘤[32]、抗多药耐药[33]以及抗结核分枝杆菌药物[34]等各方面开发中仍然受到重视。由于近年来冠状病毒导致了多起大范围的传染性呼吸系统疾病暴发, 吩噻嗪类药物的抗冠状病毒能力被进一步挖掘。以CPZ为例, 作为一种已经被批准上市并且在临床上使用多年的药物, 近年来被发现其体外细胞实验表现出抗冠状病毒活性, 并且临床前和临床研究均表明给药后CPZ在肺中和唾液中的药物浓度较高[35, 36], 因此其对冠状病毒在肺部的感染可能具有良好的抑制能力的同时, 也可以降低唾液中的病毒载量, 从而降低其传染性。相比于开发全新结构的药物, CPZ安全性已经过验证, 其药代动力学等相关药学研究数据明确, 可以大大降低前期研发成本而直接进入临床研究, 在证实CPZ在临床试验中同样具有良好的抗冠状病毒活性后, 可以快捷高效地建立新型疗法投入使用, 以应对突发疫情[37]。
除了可以节省开发成本之外, 吩噻嗪类药物还可以用于治疗感染冠状病毒后引起的神经损伤。近日已有研究人员通过基因测序证实脑脊液中存在SARS-CoV-2, 感染后病毒可能攻击中枢神经系统引起严重的神经疾病[38]。作为抗精神病类药物, 吩噻嗪类药物由于脂溶性高, 较其他抗病毒药物更易透过血脑屏障, 可以对SARS-CoV-2引起的病毒性脑炎等神经疾病起到治疗作用。并且较其他精神类药物与抗病毒药物联合用药有可能引起不良反应的情况, 吩噻嗪类药物提供了一种在抗冠状病毒的同时缓解新冠肺炎患者在治疗期间可能产生的焦虑抑郁等不良心理症状方面的新型治疗思路, 其与广谱抗病毒药物配伍用于治疗患有精神疾病的新冠肺炎患者是否具有协同作用同样值得进一步研究。
吩噻嗪类化合物在抗冠状病毒中的应用具有良好的开发前景, 除了对已经批准上市的吩噻嗪类药物的抗冠状病毒活性进行研究之外, 在深入研究其构效关系后, 可以通过选用基于靶标进行虚拟筛选、基于病毒蛋白结构进行生物活性筛选和基于细胞水平进行表型筛选等多种手段[39]找出更加优效的吩噻嗪衍生物或结构类似物作为先导化合物, 对骨架进行合理设计及结构优化, 开发出具有选择性好、抑制活性高和毒性低的新颖化合物, 这种基于已有抗冠状病毒活性结构开发新药的思路可以有效加快研发速度, 为早日结束目前严峻的疫情提供有效的治疗方案, 并为应对未来可能出现的疫情打下基础。
作者贡献:陈华负责论文选题和设计, 并参与资料分析与论文审核; 尹婕负责资料收集整理并修改论文中关键性理论及主要内容; 万君玥负责论文撰写并按编辑部的修改意见进行核修。
利益冲突:本文所有作者均声明不存在利益冲突。
| [1] |
Lu R, Zhao X, Li J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding[J]. Lancet, 2020, 395: 565-574. |
| [2] |
Wang HR, Wang X. Advances in research of novel coronavirus related drugs and biological products[J]. Acta Pharm Sin (药学学报), 2020, 55: 349-354. |
| [3] |
Plaze M, Attali D, Petit AC, et al. Repurposing of chlorpromazine in COVID-19 treatment: the reCoVery study[J]. Encephale, 2020, 46: S35-S39. |
| [4] |
Plaze M, Attali D, Prot M, et al. Inhibition of the replication of SARS-CoV-2 in human cells by the FDA-approved drug chlorpromazine[J]. BioRxiv, 2020. DOI:10.1016/j.encep.2020.04.010 |
| [5] |
Kumar S, Nyodu R, Maurya VK, et al. Coronavirus Disease 2019 (COVID-19): Morphology, Genome Organization, Replication, and Pathogenesis of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2)[M]. Singapore: Springer, 2020: 23-31.
|
| [6] |
Peiris JSM, Guan Y, Yuen KY. Severe acute respiratory syndrome[J]. Nat Med, 2004, 10: S88-S97. |
| [7] |
de Groot RJ, Baker SC, Baric RS, et al. Middle East respiratory syndrome coronavirus (MERS-CoV): announcement of the Coronavirus Study Group[J]. J Virol, 2013, 87: 7790-7792. |
| [8] |
Zumla A, Chan JFW, Azhar EI, et al. Coronaviruses-drug discovery and therapeutic options[J]. Nat Rev Drug Discov, 2016, 15: 327. |
| [9] |
Kuba K, Imai Y, Rao S, et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury[J]. Nat Med, 2005, 11: 875-879. |
| [10] |
Pluta K, Morak-Młodawska B, Jeleń M. Recent progress in biological activities of synthesized phenothiazines[J]. Eur J Med Chem, 2011, 46: 3179-3189. |
| [11] |
Dyall J, Coleman CM, Hart BJ, et al. Repurposing of clinically developed drugs for treatment of Middle East respiratory syndrome coronavirus infection[J]. Antimicrob Agents Chemother, 2014, 58: 4885-4893. |
| [12] |
Weston S, Coleman CM, Sisk JM, et al. Broad anti-coronaviral activity of FDA approved drugs against SARS-CoV-2 in vitro and SARS-CoV in vivo[J]. BioRxiv, 2020. DOI:10.1101/2020.03.25.008482 |
| [13] |
Yang H, Yang M, Ding Y, et al. The crystal structures of severe acute respiratory syndrome virus main protease and its complex with an inhibitor[J]. Proc Natl Acad Sci U S A, 2003, 100: 13190-13195. |
| [14] |
Maxmen A. More than 80 clinical trials launch to test coronavirus treatments[J]. Nature, 2020, 578: 347. |
| [15] |
Anand K, Ziebuhr J, Wadhwani P, et al. Coronavirus main proteinase (3CLpro) structure: basis for design of anti-SARS drugs[J]. Science, 2003, 300: 1763-1767. |
| [16] |
Niu C, Yin J, Zhang J, et al. Molecular docking identifies the binding of 3-chloropyridine moieties specifically to the S1 pocket of SARS-CoV Mpro[J]. Bioorg Med Chem, 2008, 16: 293-302. |
| [17] |
Zhang XW, Yap YL. Old drugs as lead compounds for a new disease? Binding analysis of SARS coronavirus main proteinase with HIV, psychotic and parasite drugs[J]. Bioorg Med Chem, 2004, 12: 2517-2521. |
| [18] |
Liu X, Wang XJ. Potential inhibitors against 2019-nCoV coronavirus M protease from clinically approved medicines[J]. J Genet Genomics, 2020, 47: 119-121. |
| [19] |
Liu Z, Huang C, Fan K, et al. Virtual screening of novel noncovalent inhibitors for SARS-CoV 3C-like proteinase[J]. J Chem Inf Model, 2005, 45: 10-17. |
| [20] |
Ho TY, Wu SL, Chen JC, et al. Emodin blocks the SARS coronavirus spike protein and angiotensin-converting enzyme 2 interaction[J]. Antiviral Res, 2007, 74: 92-101. |
| [21] |
Báez-Santos YM, John SES, Mesecar AD. The SARS-coronavirus papain-like protease: structure, function and inhibition by designed antiviral compounds[J]. Antiviral Res, 2015, 115: 21-38. |
| [22] |
Wu C, Liu Y, Yang Y, et al. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods[J]. Acta Pharm Sin B, 2020, 10: 766-788. |
| [23] |
Inoue Y, Tanaka N, Tanaka Y, et al. Clathrin-dependent entry of severe acute respiratory syndrome coronavirus into target cells expressing ACE2 with the cytoplasmic tail deleted[J]. J Virol, 2007, 81: 8722-8729. |
| [24] |
de Wilde AH, Jochmans D, Posthuma CC, et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of Middle East respiratory syndrome coronavirus replication in cell culture[J]. Antimicrob Agents Chemother, 2014, 58: 4875-4884. |
| [25] |
Deeba F, Malik MZ, Naqvi IH, et al. Potential entry inhibitors of the envelope protein (E2) of Chikungunya virus: in silico structural modeling, docking and molecular dynamic studies[J]. Virusdisease, 2017, 28: 39-49. |
| [26] |
Chamoun-Emanuelli AM, Pecheur EI, Simeon RL, et al. Phenothiazines inhibit hepatitis C virus entry, likely by increasing the fluidity of cholesterol-rich membranes[J]. Antimicrob Agents Chemother, 2013, 57: 2571-2581. |
| [27] |
Mayer M, Lang PT, Gerber S, et al. Synthesis and testing of a focused phenothiazine library for binding to HIV-1 TAR RNA[J]. Chem Biol, 2006, 13: 993-1000. |
| [28] |
Mucsi I, Molnár J, Motohashi N. Combination of benzo[a] phenothiazines with acyclovir against herpes simplex virus[J]. Int J Antimicrob Agents, 2001, 18: 67-72. |
| [29] |
Cong Y, Hart BJ, Gross R, et al. MERS-CoV pathogenesis and antiviral efficacy of licensed drugs in human monocyte-derived antigen-presenting cells[J]. PLoS One, 2018, 13: e0194868. |
| [30] |
Barnard DL, Day CW, Bailey K, et al. Is the anti-psychotic, 10-(3-(dimethylamino) propyl) phenothiazine (promazine), a potential drug with which to treat SARS infections? Lack of efficacy of promazine on SARS-CoV replication in a mouse model[J]. Antiviral Res, 2008, 79: 105-113. |
| [31] |
Daniel JA, Chau N, Abdel-Hamid MK, et al. Phenothiazine-derived antipsychotic drugs inhibit dynamin and clathrin-mediated endocytosis[J]. Traffic, 2015, 16: 635-654. |
| [32] |
Wu CH, Bai LY, Tsai MH, et al. Pharmacological exploitation of the phenothiazine antipsychotics to develop novel antitumor agents-a drug repurposing strategy[J]. Sci Rep, 2016, 6: 27540. |
| [33] |
Bisi A, Meli M, Gobbi S, et al. Multidrug resistance reverting activity and antitumor profile of new phenothiazine derivatives[J]. Bioorg Med Chem, 2008, 16: 6474-6482. |
| [34] |
Amaral L, Kristiansen JE, Viveiros M, et al. Activity of phenothiazines against antibiotic-resistant Mycobacterium tuberculosis: a review supporting further studies that may elucidate the potential use of thioridazine as anti-tuberculosis therapy[J]. J Antimicrob Chemother, 2001, 47: 505-511. |
| [35] |
Bickel MH, Graber BE, Moor M. Distribution of chlorpromazine and imipramine in adipose and other tissues of rats[J]. Life Sci, 1983, 33: 2025-2031. |
| [36] |
May PRA, Van Putten T, Jenden DJ, et al. Chlorpromazine levels and the outcome of treatment in schizophrenic patients[J]. Arch Gen Psychiatry, 1981, 38: 202-207. |
| [37] |
Zhang C, Chen SB, Zhang J, et al. Analysis of chemical drugs applied for clinical trial for the treatment of COVID-19[J]. Acta Pharm Sin (药学学报), 2020, 55: 355-365. |
| [38] |
Wu Y, Xu X, Chen Z, et al. Nervous system involvement after infection with COVID-19 and other coronaviruses[J]. Brain Behav Immun, 2020, 87: 18-22. |
| [39] |
Li J, Jiang XY, Xu SJ, et al. Medicinal chemistry strategies in seeking coronavirus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 537-553. |
 2020, Vol. 55
2020, Vol. 55