纤维化是一种以组织瘢痕为特征的病理过程, 可由创伤、医源性损伤和疾病引起, 表现为组织过度生长、瘢痕或硬化, 主要原因是细胞外基质(extracellular matrix, ECM)的过度沉积。纤维化可发生于人体内几乎所有器官, 从而损伤组织结构和功能, 轻者成为器官纤维化, 重者可发展为器官硬化, 严重威胁人类的健康和生命。常见的与纤维化有关的疾病有:肝硬化、肝炎、非酒精性脂肪肝炎(non-alcoholic steatohepatitis, NASH)、慢性肾病、心肌梗死、心力衰竭、糖尿病、特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)和硬皮病等。全球范围内, 纤维化一直是众多疾病致残、致死的主要原因之一。受纤维化相关疾病影响的人数已将近人口总数的1/4[1], 给医疗体系和个人带来了沉重负担。不同器官纤维化的发病原因和表现型不尽相同, 因此对于不同器官纤维化疾病的药物研发应具有针对性。本文针对当前器官纤维化的治疗策略以及各种器官纤维化药物的研究进展进行综述。
1 器官纤维化机制器官纤维化是由多种急慢性病变引起的器官组织内纤维结缔组织增多和实质细胞减少的病理变化过程。感染、自身免疫反应、毒素、辐射和机械损伤等对组织造成一定程度的损伤后, 损伤组织可以进行自我修复。通常的修复过程有2个阶段: ①再生过程, 新生相同类型细胞替换损伤组织的细胞; ②纤维增生, 结缔组织代替正常组织。正常情况下, 组织修复是一个正常的生理过程, 但是如果修复过程失控, 会引起ECM大量沉积, 从而使得正常组织变成永久性的组织瘢痕[2]。ECM是一种存在于细胞外间质的一种大分子物质, 能够形成复杂的网架结构, 生理情况下起支持和连接组织的作用以及一些相关的生理活动。当ECM合成失控时, 大量ECM沉积进而导致纤维化[3]。持续性的器官纤维化最终可致器官结构破坏和功能减退, 使患者致残甚至死亡[4]。
2 器官纤维化的治疗策略 2.1 阻断TGF-β1/Smad信号通路转化生长因子β (transforming growth factor β, TGF-β)可以调节ECM, 在纤维化疾病的发展进程中起关键作用[5]。TGF-β超家族有3个亚型(TGF-β1、TGF-β2和TGF-β3), 三者生物活性相似, 其中组织纤维化主要与TGF-β1相关, 在组织纤维化的进程中参与炎症浸润、细胞生长、凋亡和分化等过程[6]。TGF-β1主要由循环单核细胞和组织巨噬细胞分泌, 但是最初分泌的TGF-β1是没有活性的, 当与组织中TGF-β结合蛋白(latent TGF-β-binding protein)结合后才能表现活性。活化的TGF-β1激活下游底物分子Smad蛋白后, 可诱导基质金属蛋白酶组织抑制因子1 (tissue inhibitors of metalloproteinase-1, TIMP-1)产生, 同时抑制成纤维细胞中基质金属蛋白酶1 (matrix metalloproteinase-1, MMP-1), 进而减少ECM和胶原蛋白降解, 导致ECM沉积与组织纤维化[7, 8]。除此之外, TGF-β1也可通过非Smad信号通路释放炎性细胞因子进一步加快纤维化进程。众多的研究表明, TGF-β1是造成肾、肺、肝和心肌纤维化的重要因素[9-11], 选择性阻断TGF-β1/Smad通路是抗纤维化治疗的关键策略(图 1)。
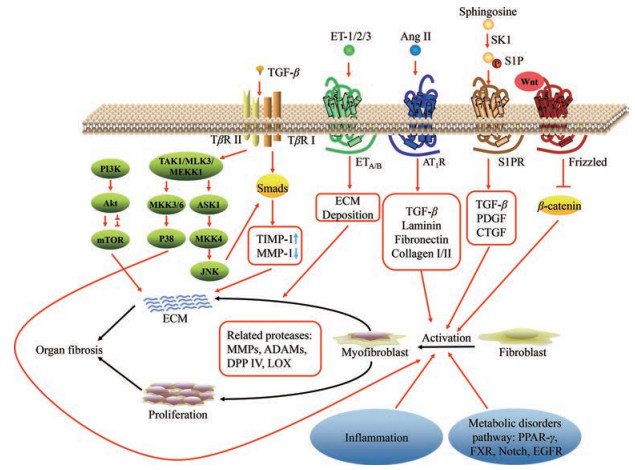
|
Figure 1 Cell signaling pathways mediating for organ fibrosis, including TGF-β1/Smad signaling pathway, SK1/S1P signaling pathway, vasoactive peptide receptors signaling pathways, metabolic pathways, Wnt/β-catenin signaling pathway, inflammation, and some proteases. TGF-β: Transforming growth factor β; ET: Endothelin; Ang Ⅱ: Angiotensin Ⅱ; SK1: Sphingosine kinase 1; S1P: Sphingosine-1-phosphate; Wnt: Wingless/Integrated; TβR: TGF-β receptor; AT1R: Angiotensin type 1 receptor; PI3K: Phosphatidylinositol 3-kinase; Akt: Protein kinase B; mTOR: Mammalian target of rapamycin; TAK1: Transforming growth factor-β-activated kinase 1; MLK3: Mixed-lineage kinase 3; MEKK1: Mitogen-activated protein kinase kinase kinase 1; MKK: Mitogen-activated protein kinase kinase; ASK1: Apoptosis signal-regulating kinase 1; JNK: c-Jun N-terminal kinase; TIMP-1: Tissue inhibitors of metalloproteinase-1; MMP-1: Matrix metalloproteinase-1; ECM: Extracellular matrix; PDGF: Platelet-derived growth factor; CTGF: Connective tissue growth factor; ADAM: A disintegrin and metalloprotease; DPP Ⅳ: Dipeptidyl peptidase Ⅳ; LOX: Lysyloxidase; PPAR-γ: Peroxisome proliferator activated receptor-γ; FXR: Farnesoid X receptor; EGFR: Epidermal growth factor receptor |
早期器官纤维化都伴有不同程度的炎症反应, 如肺纤维化、肝纤维化和肾纤维化等。在肺纤维化早期, 肺组织中有不同程度的巨噬细胞、粒细胞和淋巴细胞浸润。中性粒细胞和巨噬细胞能够产生大量的肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、干扰素-γ (interferon-γ, IFN-γ)、白介素-1β (interleukin-1β, IL-1β)和TGF-β等促炎细胞因子, 介导肺部纤维增生[12]。长期炎症反应也能够导致肺成纤维细胞的过度分裂增殖, 加快成纤维细胞向肌成纤维细胞转化的进程, 并且使ECM在肺间质大量积累, 从而引起肺纤维化的形成[13]。NASH和非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)早期均表现为症状较轻的炎症。炎症刺激能够进一步引起肝星状细胞(hepatic stellate cells, HSCs)的激活和肝纤维化的进程[14]。炎症应激已被证实与纤维化的发生有密切关系, 但是炎症在纤维化晚期较少发生, 因此抗炎策略多应用于纤维化早期。
2.3 调节SK1/S1P信号通路鞘氨醇-1-磷酸/鞘氨醇-1-磷酸受体(sphingosine-1-phosphate/sphingosine-1- phosphate receptor, S1P/S1PR)信号转导在许多器官和组织中表达活跃, 参与多种细胞进程。鞘氨醇是一种不饱和的18碳氨基醇细胞膜脂质, 在体内由鞘氨醇激酶-1 (sphingosine kinase 1, SK1)磷酸化为S1P[15]。S1P具有广泛的生物活性, 与细胞增殖、存活、迁移、细胞形态改变以及HSCs向肌成纤维细胞分化等过程密切相关。生理水平的S1P对血管系统和组织起保护作用, 但S1P水平升高及相关通路的异常激活通常将导致纤维化、癌症和血管功能障碍等疾病。血和组织中S1P的浓度与TGF-β、血小板衍生生长因子(platelet-derived growth factor, PDGF)以及结缔组织生长因子(connective tissue growth factor, CTGF)等纤维化因子密切相关。调节S1P/S1PR信号通路几乎对所有的器官纤维化有作用, 已经有针对心、肝、肾和肺纤维化等研究, 是非常重要的抗纤维化靶点[16]。SK具有2种亚型, 其中SK1在组织纤维化中的研究较为深入, 针对SK2的研究相对较少, 同时众多的研究表明在肺、肝、心以及肾纤维化模型中SK1均上调[17]。有研究表明褪黑素可通过抑制SK1/S1P信号通路降低四氯化碳诱导的肝纤维化。IPF患者主要的病理特征是细胞增殖, 很有可能是高浓度的S1P抑制了细胞凋亡的发生, 因此减少S1P的形成能够减少IPF患者成纤维细胞的增殖, 抑制SK1/S1P信号通路能够改善肺纤维化[18]。也有研究表明, 通过抑制SK1可抑制NF-κB信号介导的上皮-间质转化(epithelial-mesenchymal transition), 从而保护肾小管上皮细胞免受肾纤维化的影响[19]。抑制SK1/S1P信号通路可作为治疗纤维化的潜在策略, SK1抑制剂有望成为抗纤维化治疗的靶点。近年来由SK1/S1P介导的自噬与纤维化的复杂关系也受到研究人员的关注, 有研究表明活化SK1能够诱导自噬, 从而使肾小管上皮细胞免于纤维化[20]。
2.4 拮抗血管活性肽受体拮抗血管活性肽受体活性也能够抑制纤维化的发展, 如血管紧张素受体和内皮素受体。在多数器官中, 血管紧张素Ⅱ (angiotensin Ⅱ, Ang Ⅱ)激活血管紧张素受体1 (angiotensin type 1 receptor, AT1R), 可介导炎症和纤维的形成[21]。广泛的机制为: Ang Ⅱ与其受体AT1R的结合可激活丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)和Smad信号通路, 从而使得TGF-β合成与释放, 并且产生正反馈调节机制进一步放大并引发纤维化的TGF-β信号。除此之外, 在不同器官还有不同的引起纤维化的机制, 如在肝纤维化中, Ang Ⅱ可介导HSCs向肌成纤维细胞转化, 此外还可诱导血管内皮生长因子(vascular endothelial growth factor, VEGF)的产生, 进一步加重纤维化。在心肌纤维化中, Ang Ⅱ作用于AT1R, 可在mRNA和蛋白质水平上调整合素αv、β1、β3、β5和α8β1, 这些整合素在心脏的生理和病理中起着重要作用, 其中包括纤维化; 其次, Ang Ⅱ还通过AT1R上调TGF-β、层粘连蛋白(laminin)、纤连蛋白(fibronectin)和胶原蛋白Ⅰ/Ⅱ (collagen Ⅰ/Ⅱ), 进一步引起纤维化[22]。所以阻断肾素血管紧张素系统(renin-angiotensin-system, RAS)也是重要的抗纤维化策略之一。有项研究也表明激活血管紧张素受体2 (angiotensin type 2 receptor, AT2R)有抗炎和抗增殖的作用, 这提示AT2R激动剂可能有抗纤维化的作用[23]。内皮素(endothelin, ET)有ET-1、ET-2和ET-3三个亚型, 可作用于位于靶细胞的内皮素受体A/B (endothelin receptor A/B, ETA/B), 通过MAPK信号通路传递信号。其中ET-1介导TGF-β引发纤维化, 并且可以通过激活ETA/B诱导成纤维细胞增殖和ECM聚集和收缩, 在纤维化的发病机制中起重要作用[24, 25]。
2.5 酶抑制剂在纤维化过程中, 参与ECM降解和稳定的酶家族在ECM重建中发挥重要作用。基质金属蛋白酶(matrix metalloproteinases, MMPs)和解离素-金属蛋白酶(a disintegrin and metalloproteinases, ADAMs)等锌依赖性蛋白酶, 以及二肽基肽酶Ⅳ (dipeptidyl peptidase Ⅳ, DPP Ⅳ)家族的脯氨酸特异性丝氨酸蛋白酶均参与ECM的降解; 赖氨酰氧化酶(lysyloxidase, LOX)和赖氨酰氧化酶样蛋白1-4 (lysyloxidase-like 1-4, LOXL1-4)参与ECM的稳定化。MMPs和ADAMs介导ECM重构和释放TGF-β或TNF-α等纤维化因子, 可引起炎症和纤维化。已经有众多的MMPs抑制剂用于抗纤维化的研究, 有些已经进入临床试验[26]。一些DPP Ⅳ抑制剂已经获批治疗2型糖尿病, 而且DPP Ⅳ抑制剂在糖尿病肾病中表现出抗纤维化作用。已经证明糖尿病肾病与内皮和肾小管上皮细胞DPP Ⅳ的表达增加有关[27]。LOX和LOXL1-4酶是赖氨酸甲状腺素依赖性铜胺氧化酶的一个家族。TGF-β1上调LOX和LOXL1-4的表达, 这些酶催化胶原中赖氨酸残基的ε-胺氧化, 反应生成反应性醛, 在ECM中凝聚形成共价胶原交联。交联不仅稳定胶原纤维也激活肌成纤维细胞, 从而导致间质纤维化[28, 29]。抑制这些介导纤维化形成和ECM沉积的酶能够有效减缓纤维化进程, 也是抗纤维化治疗中一个有效的策略。
2.6 激酶抑制剂和细胞信号通路抑制剂多个激酶和细胞信号通路参与纤维化的发展和进展。表皮生长因子受体(epidermal growth factor receptor, EGFR)属于表皮因子(epidermal growth factor)受体超家族成员。EGFR信号通路的过表达与多种器官和组织的纤维化相关。生长因子激活EGFR发生二聚, 进而激活细胞内的蛋白-酪氨酸激酶的活性。由此产生的自磷酸化启动信号转导, 导致细胞活化、增殖和迁移, 进而加速纤维化进程。自磷酸化启动信号的转导主要通过MAPK、PI3K-Akt-mTOR (phosphatidylinositol 3-kinase/protein kinase B/mammalian target of rapamycin)和STAT/JNK (signal transducers and activators of transcription/C-Jun N-terminal kinase)信号通路。阻断EGFR在受体胞外区域结合位点或抑制细胞内酪氨酸激酶活性均可抑制EGFR信号通路。IL-3和IL-4等细胞因子激活成纤维细胞, 激活的成纤维细胞继而激活JAK3 (Janus kinase 3)和信号转导子和STAT6的磷酸化, 从而引发相关基因的转录, 进而产生ECM蛋白和纤维化。这些作用可被JAK3抑制剂拮抗[30]。
正常情况下, β-catenin只是一种细胞骨架蛋白, 发挥维持同型细胞黏附和防止其移动的作用。当细胞外的Wnt信号分子与细胞膜上的Frizzled受体蛋白结合后, 能够使β-catenin不被降解, 当β-catenin积累到一定浓度后, 可以转移至细胞核调节增殖核分化基因转录, 从而引起纤维化。Notch信号通路也参与心脏和其他器官的纤维化过程, 激活后可以抑制纤维化因子TGF-β促进成纤维细胞分化为成肌纤维细胞和Ⅰ型纤维胶原的生成[31]。同时也有研究表明, 在肝纤维化中, Notch信号通路的异常激活能够促进HSCs活化和增殖[32]。所以抑制此Wnt/β-catenin和Notch信号通路也能够起抗纤维化的作用。总的来讲, 参与纤维化的激酶和细胞信号通路均为抗纤维化的治疗提供了众多有潜力的靶点。
2.7 调节代谢途径调节代谢途径抗纤维化策略主要涉及的途径有氧化应激、过氧化物酶增殖体激活受体γ (peroxisome proliferator activated receptor-γ, PPAR-γ)、法尼醇X受体(farnesoid X receptor, FXR)以及脂肪酸合成。氧化应激参与许多疾病的发展, 其中包括纤维化。氧化应激反映了活性氧(reactive oxygen species)的产生和解毒机制之间的不平衡。氧化应激破坏正常细胞信号传导机制, 损害蛋白质、脂质和核酸等细胞成分, 影响细胞正常生理过程。氧化应激可影响TGF-β和RAS等众多与纤维化有关的信号通路, 抑制氧化应激也能抗纤维化, 一些抗氧化剂和自由基清除剂已陆续开展了相关的临床研究。FXR是一种核受体, 激活后转移至细胞核中, 在细胞核中与维甲酸X受体(retinoid X receptor)形成二聚体, 并与DNA上的激素反应元件(hormone response elements)结合调节基因转录。FXR能够诱导包括成纤维细胞生长因子19 (fibroblast growth factor 19)在内的下游基因表达, 这些基因可调节胆汁酸的合成与转运过程以及胆固醇与葡萄糖代谢[33, 34]。FXR在疾病状态下激活时可引起胆汁淤积性疾病、NAFLD、肝纤维化和肝癌。FXR小分子激动剂是极有前景的治疗NASH的策略, 多个FXR激动剂目前正在临床研究中。PPARs中, PPAR-γ亚型在器官纤维化的过程中起重要的调节作用, 能够抑制或减缓纤维化的进程[35], 其已经成为抗器官纤维化疾病防治的新靶点。研究表明, PPAR-γ激动剂通过抑制早期生长反应因子-1 (early growth response factor-1)、STAT3和激活蛋白-1 (activator protein-1)的表达来对抗TGF-β1的促纤维化作用, 同时也能够使MMPs/TIMP的失衡正常化[36]。溶血磷脂(lysophospholipids)包括S1P和溶血磷脂酸(lysophosphatidic acid, LPA), 通过细胞表面受体G蛋白偶联受体(G protein-coupled receptors)、S1P1-5R和LAP1-6R传递信号, 参与体内包括纤维化在内的多种生理和病理过程, 抑制其也能发挥抗纤维化的作用。
2.8 间充质干细胞治疗对于终末期纤维化疾病, 目前唯一的治疗方法是器官移植, 但由于供体器官非常稀缺, 所以间充质干细胞(mesenchymal stem cell)治疗成为了急慢性器官疾病的关键治疗策略。特别是在诱导病变组织修复中, 间充质干细胞治疗为器官纤维化的治疗开辟了新的治疗前景。间充质干细胞治疗在动物模型中已被证明对多种器官纤维化有改善作用[37-39]。就当前研究而言, 间充质干细胞可通过抑制HSCs和促进MMPs分泌来消除ECM沉积, 同时抑制HSCs的活化并可通过释放IL-10诱导HSCs凋亡来发挥抗纤维化作用[40]。也有研究表明, 骨髓间充质细胞能够下调Ⅰ型胶原和α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的表达来改善纤维化, 也有关于干细胞通过抗氧化和免疫调节来发挥抗纤维化的报道[41, 42]。关于间充质干细胞的研究还需进一步的深入, 间充质干细胞疗法有望成为治疗终末期器官纤维化的新策略。
3 器官纤维化与药物纤维化可由代谢和炎症疾病引起, 人体所有的器官几乎都可以发生纤维化。最初, 纤维化形成是为了修复短期的组织损伤, 但纤维形成失控时, 将导致器官纤维化甚至是硬化衰竭[43]。虽然纤维化是组织应对损伤普遍存在的病理过程, 但由此产生的表型是极具特异性的, 而且不同的器官因纤维化引起衰竭的时间表现出很大的差异性[44]。因此对不同器官的纤维化进行针对性的治疗是更可取的方式。
3.1 抗肝纤维化药物肝纤维化的发病率和死亡率都很高, 多种引起肝损伤的因素均可以在慢性炎症的基础上进一步导致肝纤维化, 这些因素包括病毒、自身免疫、药物诱导、胆汁淤积和代谢疾病等。肝炎病毒感染和慢性酒精消耗是导致肝纤维化的主要原因。如果不能得到有效的控制, 纤维化可能发展为肝硬化, 最终导致肝衰竭甚至死亡[45, 46]。NASH是一种严重的NAFLD, 以脂肪变性、炎症和细胞损伤为特征, 能进一步发展为肝硬化[47]。如今NAFLD/NASH已经越来越成为一种常见的疾病, 但目前临床中尚未有批准的药物。肝纤维化作为一种与代谢紊乱高度相关的纤维化, 其研发方向更倾向作用于代谢途径靶点的药物, 如FXR激动剂和PPARs激动剂。
FXR激动剂是目前治疗NASH最具潜力的药物, 多款候选化合物已处于临床试验阶段, 如奥贝胆酸(obeticholic acid, OCA, 1)、cilofexor (GS-9674, 2)、tropifexor (LJN452, 3)、nidufexor/LMB763 (4)、EYP001a (5)等(图 2、表 1)。PPARs因具有调节糖代谢和改善血脂水平等作用, 对NASH和HAFLD的多种病症都有显著的疗效, 已经成为该领域的热门靶点。Elafibranor (GFT505, 6)是典型的PPARα/δ双重激动剂, 对多种代谢疾病的研究均已开展, 其中针对NASH的研究已经进入Ⅲ期临床试验。羟尼酮(hydronidone, 7)是环氧化酶(cyclo-oxygenase, COX)和TGF-β抑制剂, 目前正在进行慢性乙型肝炎合并肝纤维化的临床试验。口服趋化因子受体-2/5 (C-C motif chemokine receptor 2/5, CCR2/5)抑制剂西尼韦罗(cenicriviroc/TAK-652/TBR-652, 8)已经进入Ⅲ期临床试验用于治疗NASH。S1PR激动与拮抗剂和SK抑制剂在抑制肝纤维化方面的研究较多, 已经发现其是一个非常有潜力的抗肝纤维化的靶点。芬戈莫德(fingolimod/FTY720, 9)是S1PR调节剂, 被SKs磷酸化后能与S1P1R、S1P3R、S1P4R和S1P5R结合, 在动物模型中可降低骨髓间质细胞运动并发挥抗肝纤维化的作用[48], 临床已经用于治疗复发型多发性硬化症的治疗。
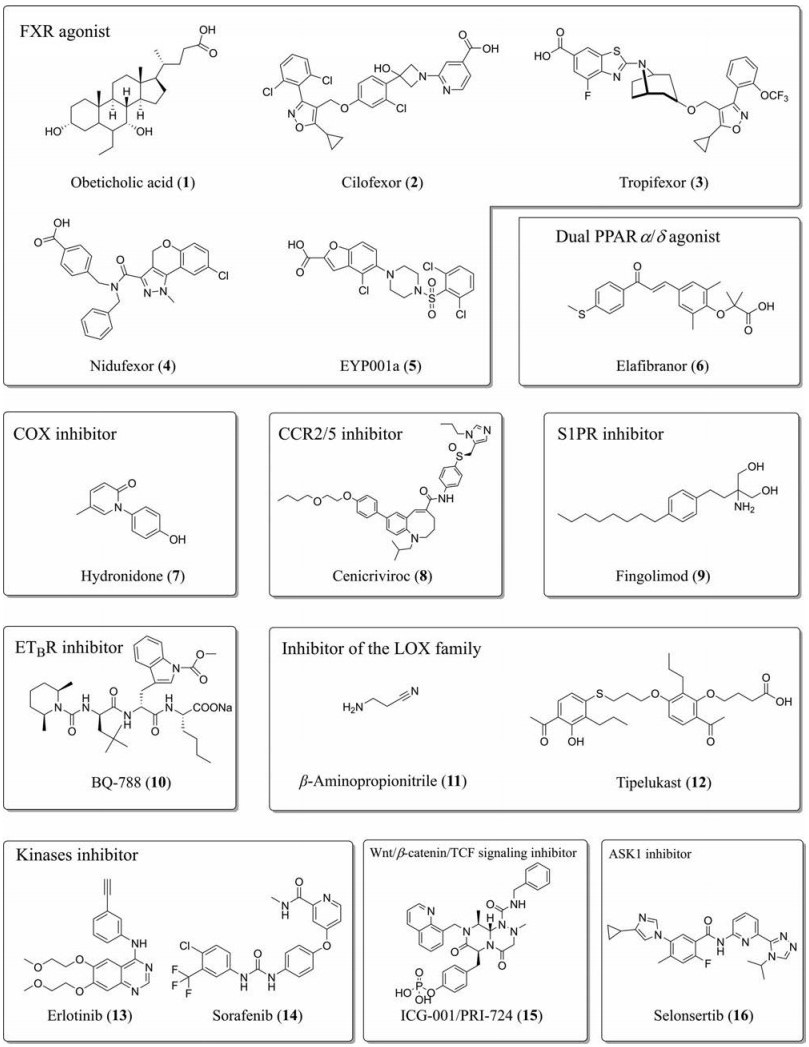
|
Figure 2 The structures of anti-liver fibrosis drugs. COX: Cyclo-oxygenase; CCR: C-C motif chemokine receptor; S1PR: Sphingosine-1-phosphate receptor; ETBR: Endothelin receptor B; TCF: T cell factor |
| Table 1 Advances in clinical trials of anti-organ fibrosis drugs. ETR: Endothelin receptor; LOXL2: Lysine oxidase like protein 2; PGI2: Prostacyclin; P2X2/3: Purinergic receptor P2X2/3; NOX1/4: NADPH oxidase 1/4; ATX: Autotaxin; IL-6: Interleukin-6; VEGF: Vascular endothelial growth factor; 5-FU: 5-Flourouracil |
多个研究已经表明拮抗ET-1的作用对多种器官纤维化均有治疗作用[25], 但选择性ETB抑制剂BQ-788 (10)在用于治疗肝硬化的研究中未得到很好的效果[49]。特异性的LOXL抑制剂可预防纤维化, β-氨基丙腈(β-aminopropionitrile, 11)是LOX家族的一种小分子抑制剂, 能够改善实验性肝纤维化和逆转性心肌炎的预后[50, 51]。泰鲁司特(tipelukast/MN-001, 12)是一个口服的LOXL2和白三烯受体双重抑制剂, 针对NASH和NAFLD已经完成了Ⅱ期临床试验, 其针对IPF的Ⅱ期临床试验也正在开展中。一些应用于抗癌的激酶抑制剂也有抗纤维化的作用, 厄洛替尼(erlotinib, 13)是EGFR抑制剂, 它能不可逆性地与受体的三磷酸腺苷(adenosine triphosphate, ATP)结合位点结合, 其对肝癌、肝硬化的研究已进入Ⅰ和Ⅱ期临床试验同步进行阶段; 多激酶抑制剂索拉非尼(sorafenib/BAY43-9006, 14)具有抑制血小板源性生长因子受体(platelet-derived growth factor receptor, PDGFR)和血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)的作用, 已经被批准用于治疗晚期肝细胞和肾细胞癌, 其也能够显著改善肝纤维化[52]。ICG-001/PRI-724 (15)能够特异性地与环磷腺苷效应元件结合蛋白(cAMP-response element binding protein)结合, 从而阻断Wnt/β-catenin/TCF (T cell factor)介导的转录, 抑制纤维化过程, 目前针对肝硬化和病毒性肝炎的研究处在Ⅰ和Ⅱ期临床试验同步进行状态[53]。凋亡信号调节激酶1 (apoptosis signal-regulating kinase 1, ASK 1)是细胞丝裂原活化蛋白激酶激酶激酶(mitogen-activated protein kinase kinase kinase, MAP3Ks)家族中的一种丝氨酸/苏氨酸蛋白激酶, 能够激活肝细胞中JNK和P38信号通路介导的细胞凋亡、炎症和纤维化。ASK 1抑制剂selonsertib (GS-4997, 16)曾作为单一剂型给药进入Ⅲ期临床试验, 最终以缺乏疗效提前终止。
3.2 抗肺纤维化药物肺纤维化主要表现为致密结缔组织进行性替换正常肺泡结构, 从而阻止正常的气体交换, 最终影响肺正常生理功能。肺纤维化包含多种特发性疾病, 并且有着不同的临床表现型, 其中IPF最为常见和严重。IPF是一种慢性进行性、致死性、病因不明的间质性肺病, 患者确诊后的平均生存期不足3年, 5年生存率低于30%[54], 故相对于其他器官纤维化, 肺纤维化的相关研究较多, 药物进展也较快。相关医学统计数据表明, 3种危险因素可能独立或协同增加患IPF的风险: ①内在危险因素(遗传、衰老、性别和肺部微生物群); ②共病(胃食管反流症、阻塞性睡眠呼吸暂停症、糖尿病和疱疹病毒感染); ③外在危险因素(吸烟和空气污染)[55]。
吡非尼酮(pirfenidone, 17)和尼达尼布(nintedanib/BIBF1120, 18)经过了一系列临床试验, 证明能够有效逆转IPF患者的肺功能低下, 已经被批准应用于临床[56], 也是目前治疗IPF仅有的两款上市药物(图 3)。吡非尼酮(17)通过下调TGF-β以及Ⅰ型胶原前体和Ⅱ型胶原前体的表达发挥抗纤维化作用和抗细胞增殖作用, 其对肾、心脏和肝的抗纤维化作用也有报道, 但没有应用于临床[57-59]。尼达尼布(18)属于小分子酪氨酸激酶抑制剂, 通过阻断PDGFR、VEGFR和成纤维细胞生长因子受体(fibroblast growth factor receptor)等与肺纤维化进程有关的信号通路抑制成纤维细胞的增殖、活化和迁移, 从而起到抗肺纤维化作用[60]。他克莫司(tacrolimus, 19)、环孢素A (cyclosporin A, 20)和罗氟司特(roflumilast, 21)是已上市的磷酸二酯酶-4 (phosphodiesterase-4, PDE-4)抑制剂, 被批准用于治疗慢性阻塞性肺病(chronic obstructive pulmonary disease)以及肺部炎症相关疾病。虽然临床暂时没有应用于抗纤维化治疗, 但动物实验已经表明他克莫司(19)能够阻断大多数与肺纤维化相关的代谢作用, 这也提示其有可能成为一款抗肺纤维化药物[61]。已经上市的血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor, ACEI)如卡托普利(captopril, 22)和依那普利(enalapril, 23)、AT1R拮抗剂缬沙坦(valsartan, 24)和氯沙坦(losartan, 25)在众多临床前实验研究中, 都表现出显著抗肺纤维化作用[62-65]。此外, 非肽小分子AT2R抑制剂C21 (26)在肺、肾、心脑血管疾病中也展示了良好的抗纤维化作用[66]。ETA/B拮抗剂波生坦(bosentan, 27)、马西替坦(macitentan, 28)、恩拉生坦(enrasentan, 29)和选择性ETA拮抗剂安立生坦(ambrisentan, 30)已经进行抗肺纤维化的临床试验。沙利度胺(thalidomide, 31)通过抑制炎症和抗氧化作用对肺纤维化小鼠和人肺成纤维细胞都有显著作用[67], 已经进行到用于治疗IPF的Ⅲ期临床试验。甲基巴多索隆(bardoxolone, 32)作为抗炎药物, 其抗肺动脉高压和肺纤维化等相关研究已经进入Ⅱ期临床试验, 但关于慢性肾病的临床试验被终止。PAT-1251 (33)是一种高效高选择性、不可逆的LOXL2抑制剂, 能显著降低博来霉素介导的肺损伤小鼠的纤维化, 已经完成Ⅰ期临床试验[68]。
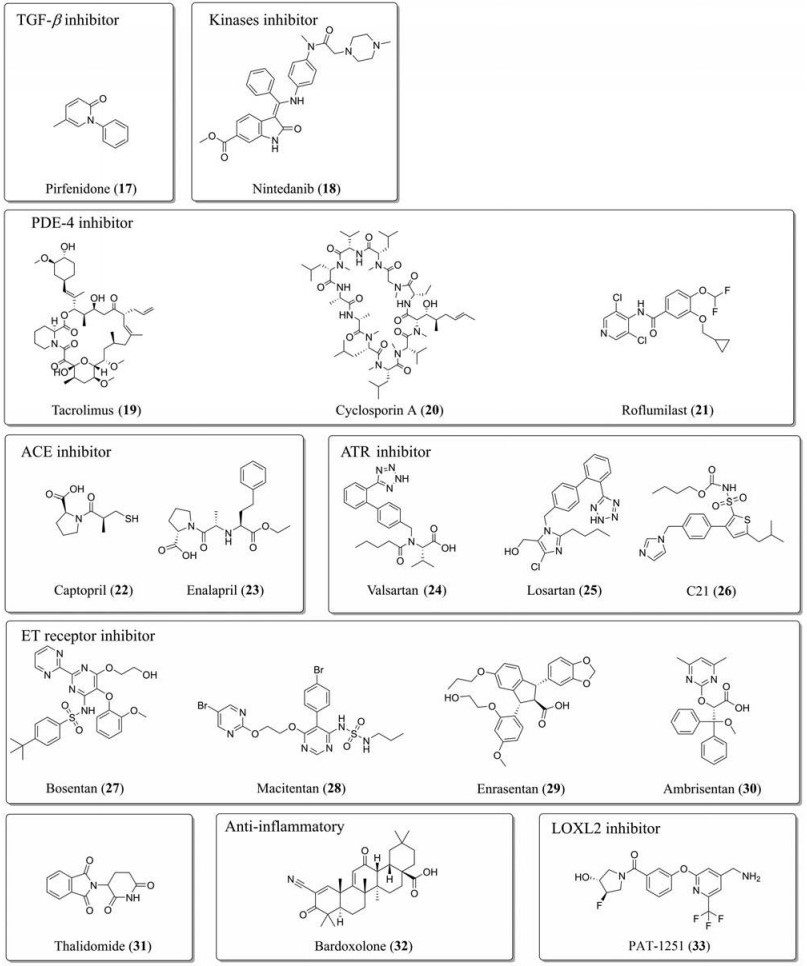
|
Figure 3 The structures of anti-pulmonary fibrosis drugs. PDE-4: Phosphodiesterase-4; ACE: Angiotensin converting enzyme; AT1/2R: Angiotensin Ⅱ type 1/2 receptor |
达沙替尼(dasatinib/BMS-483525, 34)是一种多激酶抑制剂, 与天然抗氧化剂联合使用治疗IPF的Ⅰ期临床试验已经完成(图 4)。奥米利塞(omipalisib/GSK2126458, 35)是一种高选择性、高效的p110α/β/δ/γ抑制剂和哺乳动物雷帕霉素靶蛋白复合物1/2 (mammalian target of rapamycin complex 1/2, mTORC1/2)抑制剂, 通过抑制PI3K/Akt/mTOR信号通路降低成纤维细胞的有丝分裂, 针对IPF已经完成了Ⅰ期临床试验, 结果表明受试者对此药物有良好耐受性[69]。KD025/Slx-2119 (36)是口服选择性ROCK2 (Rho-associated protein kinase)抑制剂, 能够减少白细胞分泌IL-21和IL-17促炎因子, 目前处于Ⅱ临床试验阶段, 用于评估对IPF的安全性和耐受性。Tanzisertib/CC930 (37)是口服选择性MAPK/JNK信号通路抑制剂, 有抗纤维化作用, 曾针对IPF进入Ⅱ期临床试验, 但由于某种原因被终止。CC90001 (38)属于第二代JNK抑制剂, 能够选择性抑制JNK1, 其针对肺纤维化的Ⅱ临床试验正在进行, 其针对NASH的Ⅱ期临床试验也在开展中。吉非替尼(gefitinib/ZD1839, 39)是第1个选择性EGFR酪氨酸激酶抑制剂, 临床上已经用于治疗癌症, 也有临床前实验证明其在动物模型中能够抑制肺纤维化[70]。伊马替尼(imatinib, 40)是酪氨酸激酶抑制剂, 广泛应用于治疗慢性髓性白血病和恶性胃肠道间质肿瘤, 除此之外, 临床前实验表明其对IPF也有疗效[71]。TD139 (41)是高亲和力的半乳凝素-3 (galectin-3)抑制剂, 能够抑制TGF-β1调控作用减少纤维化, 其正在进行IPF吸入治疗的Ⅱ期临床试验。前列环素(prostacyclin或prostaglandin I2, PGI2)抑制剂曲前列环素(treprostinil, 42)、P2X2/3嘌呤受体(purinergic receptor P2X2/3, P2X2/3)抑制剂gefapixant/AF219/MK7264 (43)和Hedgehog信号转导通路抑制剂维莫德吉(vismodegib, 44)这3款药物对IPF及肺纤维化相关疾病的研究都已经进入临床研究实验, 其中曲前列环素(42) Ⅱ期和Ⅲ期临床试验合并进行。整合蛋白αvβ6能够激活潜在的TGF-β, 已经开发的整合蛋白αvβ6抑制剂GSK3008348 (45)用于治疗IPF以及抗纤维化治疗[72], 目前正在准备Ⅱ期临床试验。GKT137831 (46)是NADPH氧化酶1/4 (NADPH oxidase 1/4, NOX1/4)抑制剂, 针对IPF的Ⅱ期临床试验正在进行。RO6842262 (47)是溶血磷脂酸受体1 (lysophosphatidic acid receptor 1, LPA1R)的选择性抑制剂, 它可抑制LPA介导的肺纤维细胞的增殖和收缩, 这有可能是一种治疗IPF的新方法[73]。BMS-986020/AM152 (48)作为一种LPA受体抑制剂已经完成其Ⅱ期临床试验。自分泌运动因子(autotaxin, ATX)是一种循环酶, 参与LPA的产生。GLPG1690 (49)是ATX抑制剂, 目前处于Ⅲ期临床。IPF的治疗也尝试了靶向组蛋白H4乙酰化过程, 组蛋白去乙酰化过程首先是由溴结构域家族蛋白4 (bromodomain-containing protein 4, BRD4)识别, 引起特定残基去乙酰化。BRD4抑制剂JQ1 (50)能够缓解肺纤维化中TGF-β1或者PDGF介导的增殖过程和炎症过程[74]。
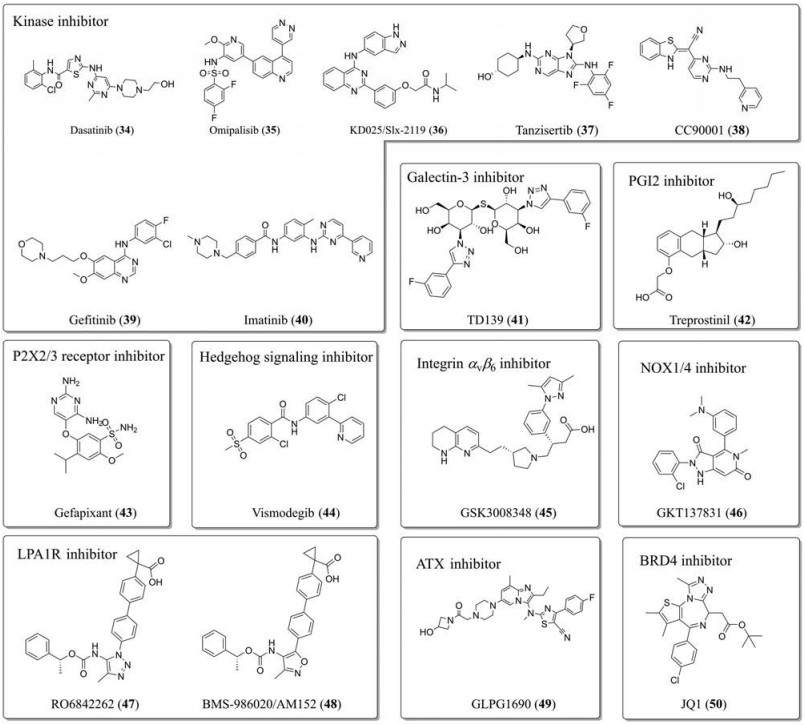
|
Figure 4 The structures of anti-pulmonary fibrosis drugs. LPA1R: Lysophosphatidic acid receptor 1; BRD4: Bromodomain-containing protein 4 |
肾纤维化是慢性肾病发展到终末期肾病的共同途径, 几乎所有的急性或慢性肾病患者最终都将发展为肾纤维化, 需要终生透析或肾移植[75], 其病理过程涉及炎性细胞浸润、ECM沉积、成纤维细胞聚集和肌成纤维细胞活化增殖[76], 表现为肾小球硬化、肾小管间质纤维化、血管系统的动脉硬化和血管周围纤维化。
研究表明, TGF-β拮抗剂对糖尿病肾病有效, 而且能够减缓糖尿病肾病纤维化进展(图 5), 选择性TGF-β1抑制剂包括GW788388 (51)、IN1130 (52)、LY364947 (53)、R268712 (54)、RepSox (55)、SB525334 (56)和ITD1 (57)等。此外, 非选择性TGF-β受体I (TGF-β receptor I, TGF-βRI)抑制剂也有类似药理作用, 如协同抑制间变性淋巴瘤激酶-4 (anaplastic lymphoma kinase-4, ALK-4)和ALK-7的A 83-01 (58)和SB431542 (59), 以及协同抑制酪蛋白激酶-1 (casein kinase-1)的D4476 (60)。ATP竞争性TGF-βRI抑制剂SD208 (61)也被报道。尽管有众多针对TGF-β的药物被报道, 但目前尚无抗肾纤维化的临床研究。除此之外, 选择性Smad3抑制剂SIS3 (62)可以通过降低ECM和拮抗C5a受体激活作用延缓糖尿病肾病的进展[77, 78]。对选择性ETA拮抗剂阿伏生坦(avosentan, 63)、西他生坦、(sitaxentan, 64)和达卢生坦(darusentan, 65)的肾纤维化和心脏纤维化临床评估已进行, 但未取得好的治疗效果[49]。ETA和AT1R双重拮抗剂司帕生坦(sparsentan, 66)正在进行Ⅲ临床试验, 评估其对局灶性节段性肾小球硬化(focal segmental glomerulosclerosis)的疗效。研究发现DPP Ⅳ抑制剂利拉利汀(linagliptin, 67)在糖尿病肾病中具有非肠促胰岛素依赖性的抗纤维化作用, 能够预防TGF-β介导的肾纤维化, 而且服用后肾排泄量少, 具有较好的肾安全性[79]。托法替布(tofacitinib/CP-690550, 68)是一种选择性JAK3抑制剂, 能控制淋巴细胞的存活、增殖、分化以及细胞因子和趋化因子的产生和凋亡。在小鼠肾纤维化模型中, 证明能够显著减少肌纤维母细胞的转化和纤维化的发展[30]。成纤维细胞的活化在糖尿病肾病中起关键作用, 钙激活的K+通道(Ca2+-activated K+ channel, IKCa1, KCa3.1)可介导包括成纤维细胞在内的多种细胞增殖。KCa3.1抑制剂TRAM34 (69)能够通过抑制Ca2+激活的K+通道, 从而抑制TGF-β1引起的ECM相关基因在肾脏成纤维细胞中的表达[80]。一些天然产物也可通过相关通路来缓解肾脏纤维化, 如五味子乙素(schisandrin B, 70)、黄芪甲苷(astragaloside Ⅳ, 71)和松果菊苷(echinacoside, 72)[81-83]。此外, 这些天然产物对其他器官纤维化也有一定的作用[84-86]。
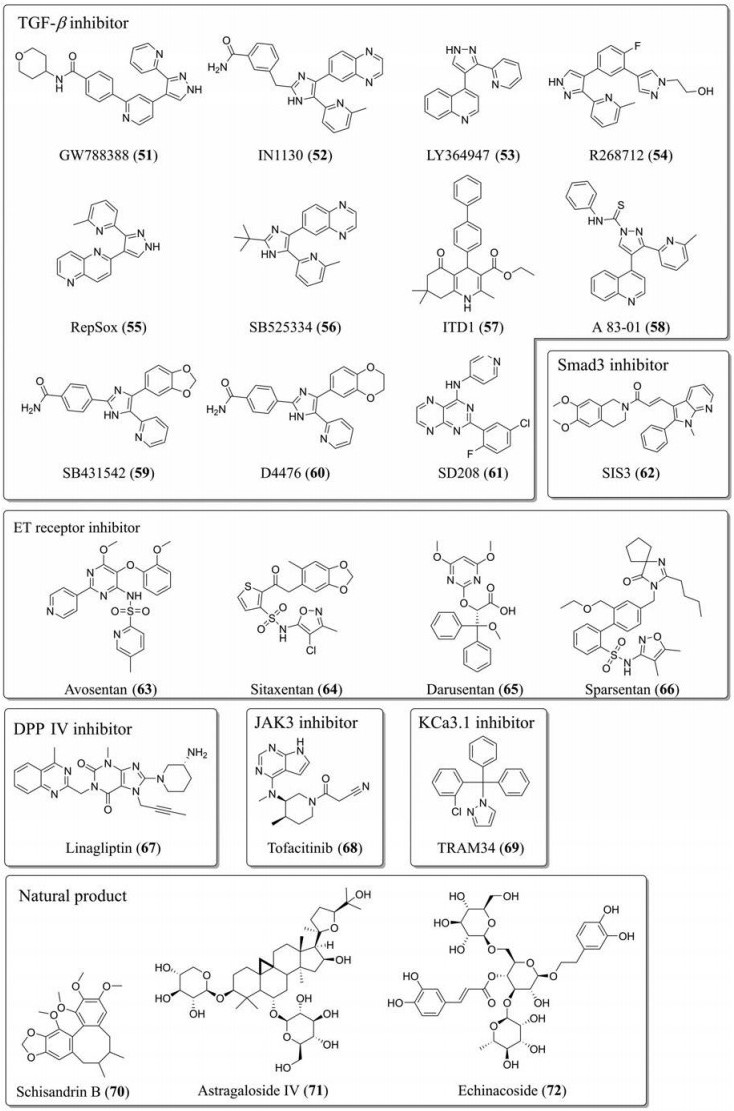
|
Figure 5 The structures of anti-renal fibrosis drugs. JAK3: Janus kinase 3; KCa3.1: Ca2+-activated K+ channel |
心血管系统纤维化可致心肌和血管舒张功能下降、心肌和血管硬化、慢性心功能不全、心律失常甚至猝死。心血管系统纤维化是多种心血管疾病发展到一定程度的共同病变过程, 表现为心血管重塑。常伴随着高血压、冠状动脉粥样硬化、心肌梗死以及风湿性心脏病等原发性疾病。针对此类纤维化, 一些既对心血管疾病有效, 也对纤维化有效的药物是更具发展潜力的, 如作用于RAS的药物既能抑制高血压, 也可预防高血压导致的纤维化发生。
曲尼斯特(tranilast, 73)是一种IL-6抑制剂类抗炎药物(图 6), 最初批准用于治疗过敏性支气管哮喘, 其后适应症扩大至抗纤维化, 体外实验已证明其可减少成纤维细胞的胶原合成而且有一定的抗TGF-β活性。在DOCA-Salt高血压小鼠实验中, 曲尼斯特能够抑制动物模型的心肌纤维化[87]。依达拉奉(edaravone, 74)是已经批准的抗氧化剂和自由基清除剂, 研究表明其通过下调TGF-β1/Smad2/3、减少Ⅰ型胶原合成、下调AT1R和上调AT2R减少心肌纤维化, 并且能够减少巨噬细胞和肌成纤维化细胞向心肌的聚集[88, 89]。盐皮质激素受体的激活在各种生理和病理事件中发挥重要作用, 临床上已经使用阻断盐皮质激素受体信号传导策略来治疗高血压和其他心脏和肾脏相关疾病, 也可用来抑制一些器官纤维化。非奈利酮(finerenone, BAY-94-8862, 75)和螺内酯(spironolactone, 76)可改善心肌纤维化和心衰症状, 目前已进入临床试验阶段。腺苷受体拮抗剂esaxerenone (CS-3150, 77)和PF-03882845 (78)在临床前实验中也表现了能够抑制心脏和肾脏纤维化发展的作用[90]。
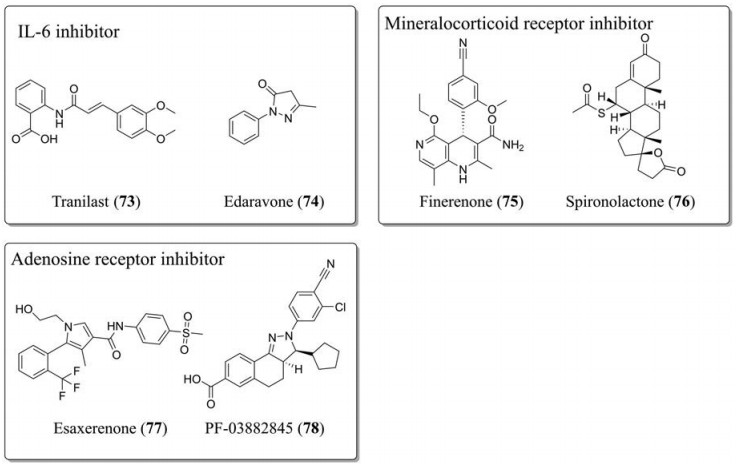
|
Figure 6 The structures of anti-cardiovascular fibrosis drugs |
与皮肤纤维化相关的疾病主要有增生性瘢痕和瘢痕疙瘩。增生性瘢痕是创伤愈合后常见的并发症之一。就目前的研究而言, 炎症是影响创面愈合和瘢痕形成的重要因素之一, 持续性的炎症可能导致细胞因子如IL-1、IL-6、TGF-β和PDGF的过表达和炎症细胞的强烈反应导致胶原的异常沉积和病理性瘢痕的形成。西罗莫司(sirolimus, 79)和曲尼斯特(73)已经被批准用于治疗增生性瘢痕以及支气管哮喘(图 7)。Diprotin A/Ile-Pro-Ile (80)是DPP Ⅳ样蛋白酶的底物, 能够竞争性抑制DPP Ⅳ的活性, 从而抑制皮肤瘢痕的形成[91, 92]。
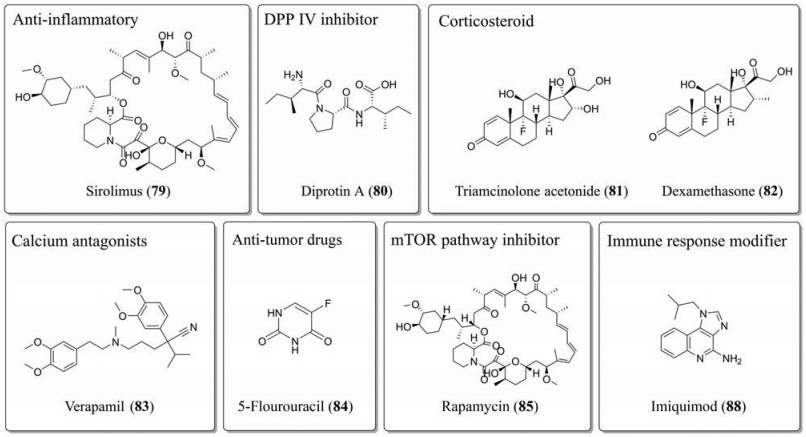
|
Figure 7 The structures of anti-skin fibrosis drugs |
瘢痕疙瘩是一种良性纤维增生性皮肤肿瘤, 病理特征表现为在真皮和皮下组织中的ECM与胶原蛋白的渗出性积聚。瘢痕疙瘩对个体的影响主要有外观损害、瘙痒和疼痛, 严重时可能影响关节活动[93]。目前为止, 对于瘢痕疙瘩的形成原因没有明确的定论, 但一些病理病因已被揭示。研究已经表明TGF-β是瘢痕疙瘩的主要调节因子, TGF-β刺激成纤维细胞的增殖和胶原的生成, 同时抑制MMPs的胶原降解活性。另外, TGF-β信号转导通路的其他效应分子如VEGF和PDGF也可进一步促进胶原合成和组织血管的生成。在瘢痕疙瘩中, IL-6、TNF-α和干扰素-β (interferon-β, IFN-β)的浓度也会增加, 促进细胞的迁移和增殖, 进一步促进纤维化[94]。临床中, 手术切除仍是治疗瘢痕疙瘩的主要方法, 药物主要用于辅助治疗。研究表明皮质类固醇类药物曲安奈德(triamcinolone acetonide, 81)可通过抑制炎症反应和TGF-β1的表达发挥作用, 其同时也可作为辅助药物用于手术后防止瘢痕疙瘩复发。地塞米松(dexamethasone, 82)已经完成了其作为手术切除后辅助药物的Ⅳ期临床试验, 可用于防止瘢痕疙瘩的复发。一些批准的药物也具有抗皮肤纤维化作用, 同样主要用于辅助治疗瘢痕疙瘩, 如维拉帕米(verapamil, 83)和5-氟尿嘧啶(5-flourouracil, 5-FU, 84)等[95, 96]。索拉非尼(14)通过拮抗TGF-β/Smad和MAPK/ERK (mitogen-activated protein kinases/extracellular signal-regulated kinase)通路发挥抗瘢痕疙瘩的作用[97], 曾进入Ⅱ期临床试验阶段, 但目前因为某些原因被终止。mTOR信号通路抑制剂雷帕霉素(rapamycin, 85)能够抑制PI3K/Akt/mTOR通路导致的ECM沉积, 是一种根除瘢痕疙瘩的治疗途径。近来以软膏作为剂型的雷帕霉素外用制剂已经进入临床研究阶段, 是极具发展潜力的一款抗皮肤纤维化药物。mTOR激酶抑制剂KU-006374 (86)和KU-0068650 (87)均能双重抑制雷帕霉素受体复合物1 (target of rapamycin complex 1, TORC1)和TORC2, 通过抑制PI3K/Akt/mTOR通路发挥治疗瘢痕疙瘩的作用, 但其结构均未公布[98]。咪喹莫特(imiquimod, 88)是一种能诱导IFN-α、TNF-α、IL-1、IL-6和IL-8的免疫应答调节剂, 也已进入临床试验阶段, 作为乳膏制剂用于术后预防瘢痕疙瘩的复发。Remlarsen (MRG-201, 89)是一种微小RNA-29 (microRNA-29, miR-29)的模拟物, 能够负向调节纤维化, 目前正处于Ⅱ期临床试验阶段[99]。
3.6 抗胰腺纤维化药物胰腺纤维化是慢性胰腺炎和胰腺癌的特征, 其病理过程为腺泡细胞损伤并引起巨噬细胞以及多种炎症细胞浸润, 从而引起大量炎症因子的分泌, 同时胰腺组织中胰腺星状细胞(pancreatic stellate cells, PSCs)活化, 进而引起ECM的产生导致纤维化[100]。目前研究表明, PSCs在慢性胰腺炎导致纤维化和胰腺癌的结缔组织增生的过程中起着至关重要的作用。PSCs受到氧化应激、乙醇及其代谢物乙醛和细胞因子的刺激时, 表型将从静态储脂细胞(quiescent fat-storing cells)转化为类似于肌成纤维细胞的活化PSCs, 随后产生的TGF-β、TNF-α、IL-1β以及CTGF将引起ECM的沉积, 最后引起纤维化[101]。HSCs与PSCs同为星状细胞, 转录表型有很大相似性, 但它们之间的差异性也反映了普通星状细胞表型的器官特异性变异, 这有可能是细胞生存的微环境差异造成的[102]。PSCs的激活是胰腺纤维化的标志, 同时也是抗胰腺纤维化的一个重要的靶点。
维生素A/视黄醇(vitamin A/retinol, 90)及其代谢产物全反式维甲酸(all-trans retinoic acid)和9-顺式维甲酸(9-cis retinoic acid)能够显著抑制PSCs的增殖, 同时抑制α-SMA、胶原蛋白I、牵连蛋白和层粘连蛋白的表达, 此外视黄醇还能阻止乙醇诱导的PSCs活化(图 8)[103]。维生素A有望作为治疗胰腺纤维化的有效手段。生育三烯酚(tocotrienols, 91)是存在于棕榈油和米糠油中的结构类似于生育酚的一种活性成分, 能够靶向线粒体膜通透性转换孔(mitochondrial permeablity transition pore), 诱导激活的PSCs凋亡, 而且有趣的是, 其只对激活的PSCs有细胞毒性。体外研究表明, 噻唑烷二酮类(thiazolidinedione derivatives, TZDs) PPAR-γ激动剂曲格列酮(troglitazone, 92)能够通过上调PPAR-γ抑制PSCs的增殖和ECM生成, 以及增加PSCs的凋亡率[104], 这也提示了上调PPAR-γ对胰腺纤维化是有积极作用的。同样, 阻断RAS系统也可抑制PSCs的增殖, 从而发挥抗慢性胰腺炎和纤维化的作用, 如ACE (angiotensin converting enzyme)抑制剂赖诺普利(lisinopril, 93)和AT2R拮抗剂氯沙坦(25)[105, 106]。甲磺酸卡莫斯塔(camostat mesylate, 94)是一种口服蛋白酶抑制剂, 已经用于治疗慢性胰腺炎, 能抑制PSCs的增殖和单核细胞趋化蛋白1 (monocyte chemotactic protein 1, MCP-1)的表达[107]。表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallare, EGCG, 95)和姜黄素(curcumin, 96)是具有抗感染、抗纤维化和抗癌作用的抗氧化多酚类天然产物, 能够抑制PSCs的增殖和活化, 这也提示抗氧化多酚可能有预防胰腺纤维化的作用[108]。有研究表明PSCs的激活需要自噬, 这也提供了一个抗胰腺纤维化的新思路[109]。从柴胡中分离的柴胡皂甙D (saikosaponin D, 97)在大鼠慢性胰腺炎模型中能够通过激活PIK3/Akt/mTOR途径抑制PSCs的自噬, 还能通过抑制TGF-β1/Smad信号通路促进ECM的降解和上调TIMPs, 从而发挥抗纤维化的作用[110]。

|
Figure 8 The structures of anti-pancreatic fibrosis drugs |
视网膜纤维化与增殖性糖尿病视网膜病变(proliferative diabetic retinopathy)的发生密切相关, 其特征是新血管形成, 并伴随着纤维组织沿视网膜内表面扩散至视盘甚至延伸到玻璃体腔。VEGF和CTGF都参与促进新血管的形成与之后视网膜的纤维化, 二者之间存在一种负反馈机制, VEGF可上调CTGF, 而后可抑制VEGF的产生, 这种负反馈机制使得2种生长因子之间能够达成一种平衡, 并促使病程从血管生成期向纤维化期的转变。这一负反馈过程被称为“血管纤维化开关(angiofibrotic switch)”。此外, 视网膜纤维化与炎症也有关, IL-8、TNF-α和血管生成炎性细胞因子能够促进新血管的生成和纤维血管瘢痕的形成。
ACE抑制剂培哚普利(perindopril, 98)能降低糖尿病大鼠视网膜VEGF的表达, 并且能够直接抑制新生血管介导的纤维化, 同时能够阻断RAS介导的增殖、炎症和纤维化(图 9)[111]。HMG-Co-A (hydroxy-methyl-glutaryl coenzyme A)还原酶抑制剂具有抗VEGF和抗炎的特性, 辛伐他汀(simvastatin, 99)可抑制VEGF诱导的细胞间黏附分子-1 (intercellular cell adhesion molecule-1)的表达来减少视网膜屏障的损伤, 从而发挥抗纤维化的作用[112]。在眼内注射皮质类固醇类药物曲安奈德(80)后, 能够减少VEGF, 使得前视网膜新生的血管消退[113]。CTGF抑制剂SERPINA3K (100)能够通过Wnt/β-catenin信号通路减少视网膜ECM沉积和血管生成, 发挥抗纤维化作用[114]。除化学试剂外, 一些生物制品如贝伐单抗(bevacizumab, 101)和兰尼单抗(ranibizumab, 102)也已作为VEGF的特异性抑制剂进入临床, 用于治疗或辅助治疗糖尿病视网膜病变。
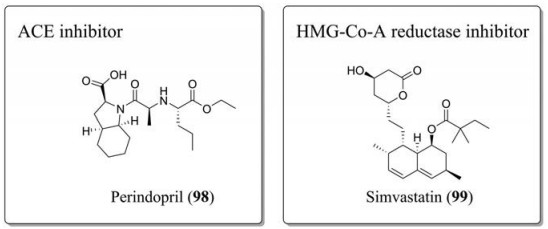
|
Figure 9 The structures of anti-retinal fibrosis drugs. HMG-Co-A: Hydroxy-methyl-glutaryl coenzyme A |
器官发展为纤维化主要是由于TGF-β信号通路的激活和ECM的沉积。阻断TGF-β通路是治疗纤维化疾病的重要靶点。但是由于TGF-β信号传导在人体内分布广泛并参与重要生理作用, 因此选择性抑制TGF-β是抗器官纤维化药物研究的重要目标。此外, 作用于Wnt和Notch信号通路的药物也存在选择性差的问题, 故提高选择性和特异性也是此类药物结构优化的主要方向。抗器官纤维化药物也可通过调节氧化应激、脂质代谢、酶或激酶等予以改善, 尽管这些药物在动物模型中显示出良好的抗纤维化作用, 但是大多数临床试验结果均不十分理想, 这主要是因为动物模型不能囊括人类纤维化疾病的复杂性, 动物模型治疗器官纤维化是在疾病早期阶段开始的, 而人类器官纤维化往往经过数十年发展, 可能需要更久的时间来评估药物的抗纤维化作用, 同时纤维化的类型、组织来源和纤维化阶段也是很重要的影响因素。此外, 由于器官纤维化的患者年龄较大, 肝肾功能相对较差, 而且通常可能患有其他疾病, 药物的联合使用和毒性在实验中也需要全面考虑。当前, 心、肝、肾和皮肤的终末期纤维化仍无获批药物, 主要还是通过自体或异体的移植予以治疗, 但往往都面临着供体不足的情况, 因此, 通过再生医学诱导病变组织修复也是治疗终末期纤维化的潜在治疗方案。综上所述, 器官纤维化的治疗及药物开发建议应遵守如下原则: ①靶向治疗器官纤维化, 尽量避免机体全身不良反应; ②针对不同分子途径进行联合治疗; ③尽早治疗, 避免器官发生不可逆功能障碍。
作者贡献:所有作者共同进行资料收集和文献检索, 第一作者负责撰写, 两位通讯作者负责思路设计和校审。
利益冲突:所有作者共同认可文章无相关利益冲突。
| [1] |
Zhao X, Kwan JYY, Yip K, et al. Targeting metabolic dysregulation for fibrosis therapy[J]. Nat Rev Drug Discov, 2020, 19: 57-75. |
| [2] |
Schuppan D, Ruehl M, Somasundaram R, et al. Matrix as a modulator of hepatic fibrogenesis[J]. Semin Liver Dis, 2001, 21: 351-372. |
| [3] |
Distler JHW, Györfi AH, Ramanujam M, et al. Shared and distinct mechanisms of fibrosis[J]. Nat Rev Rheumatol, 2019, 15: 705-730. |
| [4] |
Shan TJ, Sun J, Liang HH. Progress in the study of association between cellular senescence and organ fibrosis[J]. Acta Pharm Sin (药学学报), 2019, 54: 1531-1537. |
| [5] |
Lan HY. Diverse roles of TGF-β/Smads in renal fibrosis and inflammation[J]. Int J Biol Sci, 2011, 7: 1056-1067. |
| [6] |
Mack M, Yanagita M. Origin of myofibroblasts and cellular events triggering fibrosis[J]. Kidney Int, 2015, 87: 297-307. |
| [7] |
Yuan W, Varga J. Transforming growth factor-beta repression of matrix metalloproteinase-1 in dermal fibroblasts involves Smad3[J]. J Biol Chem, 2001, 276: 38502-38510. |
| [8] |
Biernacka A, Dobaczewski M, Frangogiannis NG. TGF-β signaling in fibrosis[J]. Growth Factors, 2011, 29: 196-202. |
| [9] |
Ojiaku CA, Cao G, Zhu W, et al. TGF-β1 evokes human airway smooth muscle cell shortening and hyperresponsiveness via Smad3[J]. Am J Resp Cell Mol, 2018, 58: 575-584. |
| [10] |
Yue Y, Meng K, Pu Y, et al. Transforming growth factor beta (TGF-β) mediates cardiac fibrosis and induces diabetic cardiomyopathy[J]. Diabetes Res Clin Pract, 2017, 133: 124-130. |
| [11] |
Meng XM, Nikolic-Paterson DJ, Lan HY. TGF-β: the master regulator of fibrosis[J]. Nat Rev Nephrol, 2016, 12: 325-338. |
| [12] |
Gao Q, Li Y, Pan X, et al. Lentivirus expressing soluble ST2 alleviates bleomycin-induced pulmonary fibrosis in mice[J]. Int Immunopharmacol, 2016, 30: 188-193. |
| [13] |
Todd NW, Luzina IG, Atamas SP. Molecular and cellular mechanisms of pulmonary fibrosis[J]. Fibrogenesis Tissue Repair, 2012, 5: 11. |
| [14] |
Ekstedt M, Hagström H, Nasr P, et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up[J]. Hepatology, 2015, 61: 1547-1554. |
| [15] |
González-Fernández B, Sánchez DI, González-Gallego J, et al. Sphingosine 1-phosphate signaling as a target in hepatic fibrosis therapy[J]. Front Pharmacol, 2017, 8: 579. |
| [16] |
Vestri A, Pierucci F, Frati A, et al. Sphingosine 1-phosphate receptors: do they have a therapeutic potential in cardiac fibrosis?[J]. Front Pharmacol, 2017, 8: 296. |
| [17] |
Wang E, He X, Zeng M. The role of S1P and the related signaling pathway in the development of tissue fibrosis[J]. Front Pharmacol, 2019, 9: 1504. |
| [18] |
Zhang X, Cai Y, Zhang W, et al. Quercetin ameliorates pulmonary fibrosis by inhibiting SphK1/S1P signaling[J]. Biochem Cell Biol, 2018, 96: 742-751. |
| [19] |
He F, Fan M, Jin Y, et al. Sphingosine kinase 1 inhibition decreases the epithelial-mesenchymal transition and ameliorates renal fibrosis via modulating NF-κB signaling[J]. Am J Transl Res, 2019, 11: 5879-5887. |
| [20] |
Du C, Ren Y, Yao F, et al. Sphingosine kinase 1 protects renal tubular epithelial cells from renal fibrosis via induction of autophagy[J]. Int J Biochem Cell Biol, 2017, 90: 17-28. |
| [21] |
Fang L, Murphy AJ, Dart AM. A clinical perspective of anti-fibrotic therapies for cardiovascular disease[J]. Front Pharmacol, 2017, 8: 186. |
| [22] |
Alqudah M, Hale TM, Czubryt MP. Targeting the renin-angiotensin-aldosterone system in fibrosis[J]. Matrix Biol, 2020. DOI:10.1016/j.matbio.2020.04.005 |
| [23] |
Wang Y, Del Borgo M, Lee HW, et al. Anti-fibrotic potential of AT2 receptor agonists[J]. Front Pharmacol, 2017, 8: 564. |
| [24] |
Clozel M, Salloukh H. Role of endothelin in fibrosis and anti-fibrotic potential of bosentan[J]. Ann Med, 2005, 37: 2-12. |
| [25] |
Rodríguez-Pascual F, Busnadiego O, González-Santamaría J. The profibrotic role of endothelin-1: is the door still open for the treatment of fibrotic diseases?[J]. Life Sci, 2014, 118: 156-164. |
| [26] |
Giannandrea M, Parks WC. Diverse functions of matrix metalloproteinases during fibrosis[J]. Dis Model Mech, 2014, 7: 193-203. |
| [27] |
Juillerat-Jeanneret L. Dipeptidyl peptidase Ⅳ and its inhibitors: therapeutics for type 2 diabetes and what else?[J]. J Med Chem, 2014, 57: 2197-2212. |
| [28] |
Georges PC, Hui JJ, Gombos Z, et al. Increased stiffness of the rat liver precedes matrix deposition: implications for fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 293: G1147-G1154. |
| [29] |
Goto Y, Uchio-Yamada K, Anan S, et al. Transforming growth factor-β1 mediated up-regulation of lysyl oxidase in the kidneys of hereditary nephrotic mouse with chronic renal fibrosis[J]. Virchows Arch, 2005, 447: 859-868. |
| [30] |
Yan J, Zhang Z, Yang J, et al. JAK3/STAT6 stimulates bone marrow-derived fibroblast activation in renal fibrosis[J]. J Am Soc Nephrol, 2015, 26: 3060-3071. |
| [31] |
Kumar R, Juillerat-Jeanneret L, Golshayan D. Notch antagonists: potential modulators of cancer and inflammatory diseases[J]. J Med Chem, 2016, 59: 7719-7737. |
| [32] |
Ni MM, Wang YR, Wu WW, et al. Novel insights on Notch signaling pathways in liver fibrosis[J]. Eur J Pharmacol, 2018, 826: 66-74. |
| [33] |
Jiang C, Xie C, Li F, et al. Intestinal farnesoid X receptor signaling promotes nonalcoholic fatty liver disease[J]. J Clin Invest, 2015, 125: 386-402. |
| [34] |
Xie C, Jiang C, Shi J, et al. An intestinal farnesoid X receptor-ceramide signaling axis modulates hepatic gluconeogenesis in mice[J]. Diabetes, 2017, 66: 613-626. |
| [35] |
Kulkarni AA, Thatcher TH, Olsen KC, et al. PPAR-gamma ligands repress TGF beta-induced myofibroblast differentiation by targeting the PI3K/Akt pathway: implications for therapy of fibrosis[J]. PLoS One, 2011, 6: e15909. |
| [36] |
Németh Á, Mózes MM, Calvier L, et al. The PPAR gamma agonist pioglitazone prevents TGF-beta induced renal fibrosis by repressing EGR-1 and STAT3[J]. BMC Nephrol, 2019, 20: 245. |
| [37] |
Franquesa M, Herrero E, Torras J, et al. Mesenchymal stem cell therapy prevents interstitial fibrosis and tubular atrophy in a rat kidney allograft model[J]. Stem Cells Dev, 2012, 21: 3125-3135. |
| [38] |
Eom YW, Shim KY, Baik SK. Mesenchymal stem cell therapy for liver fibrosis[J]. Korean J Intern Med, 2015, 30: 580-589. |
| [39] |
Li LL, Zhang Y, Li YL, et al. Mesenchymal stem cell transplantation attenuates cardiac fibrosis associated with isoproterenol-induced global heart failure[J]. Transpl Int, 2008, 21: 1181-1189. |
| [40] |
Dai LJ, Li HY, Guan LX, et al. The therapeutic potential of bone marrow-derived mesenchymal stem cells on hepatic cirrhosis[J]. Stem Cell Res, 2009, 2: 16-25. |
| [41] |
Ahmed RH, Roshdy NK, Aref MI, et al. Effect of bone marrow-derived mesenchymal stem cells and umbilical cord blood-CD34+ cells on experimental rat liver fibrosis[J]. Int J Stem Cell Res Transplant, 2014, 2: 63-68. |
| [42] |
Raafat N, Abdel Aal SM, Abdo FK, et al. Mesenchymal stem cells: in vivo therapeutic application ameliorates carbon tetrachloride induced liver fibrosis in rats[J]. Int J Biochem Cell Biol, 2015, 68: 109-118. |
| [43] |
Rockey DC, Bell PD, Hill JA. Fibrosis-a common pathway to organ injury and failure[J]. N Engl J Med, 2015, 372: 1138-1149. |
| [44] |
Hewitson TD, Holt SG, Smith ER. Progression of tubulointerstitial fibrosis and the chronic kidney disease phenotype-role of risk factors and epigenetics[J]. Front Pharmacol, 2017, 8: 520. |
| [45] |
Friedman SL. Liver fibrosis - from bench to bedside[J]. J Hepatol, 2003, 38: S38-S53. |
| [46] |
Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis[J]. Clin Chim Acta, 2006, 364: 33-60. |
| [47] |
Zhang WD, Wang RF, Wu HM, et al. Research progress in drugs for anti-hepatic fibrosis[J]. Acta Pharm Sin (药学学报), 2018, 53: 667-675. |
| [48] |
Kong Y, Wang H, Wang S, et al. FTY720, a sphingosine-1 phosphate receptor modulator, improves liver fibrosis in a mouse model by impairing the motility of bone marrow-derived mesenchymal stem cells[J]. Inflammation, 2014, 37: 1326-1336. |
| [49] |
Tripathi D, Therapondos G, Ferguson JW, et al. Endothelin-1 contributes to maintenance of systemic but not portal haemodynamics in patients with early cirrhosis: a randomised controlled trial[J]. Gut, 2006, 55: 1290-1295. |
| [50] |
Liu SB, Ikenaga N, Peng ZW, et al. Lysyl oxidase activity contributes to collagen stabilization during liver fibrosis progression and limits spontaneous fibrosis reversal in mice[J]. FASEB J, 2016, 30: 1599-1609. |
| [51] |
Iwasaki A, Sakai K, Moriya K, et al. Molecular mechanism responsible for fibronectin-controlled alterations in matrix stiffness in advanced chronic liver fibrogenesis[J]. J Biol Chem, 2016, 291: 72-88. |
| [52] |
Ma R, Chen J, Liang Y, et al. Sorafenib: a potential therapeutic drug for hepatic fibrosis and its outcomes[J]. Biomed Pharmacother, 2017, 88: 459-468. |
| [53] |
Bergmann C, Distler JH. Canonical Wnt signaling in systemic sclerosis[J]. Lab Invest, 2016, 96: 151-155. |
| [54] |
Hutchinson J, Fogarty A, Hubbard R, et al. Global incidence and mortality of idiopathic pulmonary fibrosis: a systematic review[J]. Eur Respir J, 2015, 46: 795-806. |
| [55] |
Zaman T, Lee JS. Risk factors for the development of idiopathic pulmonary fibrosis: a review[J]. Curr Pulmonol Rep, 2018, 7: 118-125. |
| [56] |
King TE, Bradford WZ, Castro-Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis[J]. N Engl J Med, 2014, 370: 2083-2092. |
| [57] |
Hewitson TD, Kelynack KJ, Tait MG, et al. Pirfenidone reduces in vitro rat renal fibroblast activation and mitogenesis[J]. J Nephrol, 2001, 14: 453-460. |
| [58] |
Shimizu T, Kuroda T, Hata S, et al. Pirfenidone improves renal function and fibrosis in the post-obstructed kidney[J]. Kidney Int, 1998, 54: 99-109. |
| [59] |
Noble PW, Albera C, Bradford WZ, et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials[J]. Lancet, 2011, 377: 1760-1769. |
| [60] |
Wollin L, Wex E, Pautsch A, et al. Mode of action of nintedanib in the treatment of idiopathic pulmonary fibrosis[J]. Eur Respir J, 2015, 45: 1434-1445. |
| [61] |
Milara J, Morcillo E, Monleon D, et al. Roflumilast prevents the metabolic effects of bleomycin-induced fibrosis in a murine model[J]. PLoS One, 2015, 10: e0133453. |
| [62] |
Wang R, Ibarra-Sunga O, Verlinski L, et al. Abrogation of bleomycin-induced epithelial apoptosis and lung fibrosis by captopril or by a caspase inhibitor[J]. Am J Physiol Lung Cell Mol Physiol, 2000, 279: L143-L151. |
| [63] |
Yao HW, Zhu JP, Zhao MH, et al. Losartan attenuates bleomycin-induced pulmonary fibrosis in rats[J]. Respiration, 2006, 73: 236-242. |
| [64] |
Raghu G, Behr J, Brown KK, et al. Treatment of idiopathic pulmonary fibrosis with ambrisentan. A parallel, randomized trial[J]. Ann Intern Med, 2014, 160: 658. |
| [65] |
Tanaka Y, Hino M, Gemma A. Potential benefit of bosentan therapy in borderline or less severe pulmonary hypertension secondary to idiopathic pulmonary fibrosis-an interim analysis of results from a prospective, single-center, randomized, parallel-group study[J]. BMC Pulm Med, 2017, 17: 200. |
| [66] |
Pandey A, Gaikwad AB. AT2 receptor agonist compound 21: a silver lining for diabetic nephropathy[J]. Eur J Pharmacol, 2017, 815: 251-257. |
| [67] |
Dong X, Li X, Li M, et al. Antiinflammation and antioxidant effects of thalidomide on pulmonary fibrosis in mice and human lung fibroblasts[J]. Inflammation, 2017, 40: 1836-1846. |
| [68] |
Hutchinson JH, Rowbottom MW, Lonergan D, et al. Small molecule lysyl oxidase-like 2 (LOXL2) inhibitors: the identification of an inhibitor selective for LOXL2 over LOX[J]. ACS Med Chem Lett, 2017, 8: 423-427. |
| [69] |
Lukey PT, Harrison SA, Yang S, et al. A randomised, placebo-controlled study of omipalisib (PI3K/mTOR) in idiopathic pulmonary fibrosis[J]. Eur Respir J, 2019, 53: 1801992. |
| [70] |
Li L, Cai L, Zheng L, et al. Gefitinib inhibits bleomycin-induced pulmonary fibrosis via alleviating the oxidative damage in mice[J]. Oxid Med Cell Longev, 2018, 2018: 8249693. |
| [71] |
Daniels CE, Lasky JA, Limper AH, et al. Imatinib treatment for idiopathic pulmonary fibrosis: randomized placebo-controlled trial results[J]. Am J Resp Crit Care, 2010, 181: 604-610. |
| [72] |
Agarwal SK. Integrins and cadherins as therapeutic targets in fibrosis[J]. Front Pharmacol, 2014, 5: 131. |
| [73] |
Qian Y, Hamilton M, Sidduri A, et al. Discovery of highly selective and orally active lysophosphatidic acid receptor-1 antagonists with potent activity on human lung fibroblasts[J]. J Med Chem, 2012, 55: 7920-7939. |
| [74] |
Tang X, Peng R, Phillips JE, et al. Assessment of Brd4 inhibition in idiopathic pulmonary fibrosis lung fibroblasts and in vivo models of lung fibrosis[J]. Am J Pathol, 2013, 183: 470-479. |
| [75] |
Djudjaj S, Boor P. Cellular and molecular mechanisms of kidney fibrosis[J]. Mol Aspects Med, 2019, 65: 16-36. |
| [76] |
Wu W, Liu C, Farrar CA, et al. Collectin-11 promotes the development of renal tubulointerstitial fibrosis[J]. J Am Soc Nephrol, 2018, 29: 168-181. |
| [77] |
Walton KL, Johnson KE, Harrison CA. Targeting TGF-β mediated SMAD signaling for the prevention of fibrosis[J]. Front Pharmacol, 2017, 8: 461. |
| [78] |
Li L, Yin Q, Tang X, et al. C3a receptor antagonist ameliorates inflammatory and fibrotic signals in type 2 diabetic nephropathy by suppressing the activation of TGF-β/smad3 and IKBα pathway[J]. PLoS One, 2014, 9: e113639. |
| [79] |
Kanasaki K, Shi S, Kanasaki M, et al. Linagliptin-mediated DPP-4 inhibition ameliorates kidney fibrosis in streptozotocin-induced diabetic mice by inhibiting endothelial-to-mesenchymal transition in a therapeutic regimen[J]. Diabetes, 2014, 63: 2120-2131. |
| [80] |
Huang C, Shen S, Ma Q, et al. KCa3.1 mediates activation of fibroblasts in diabetic renal interstitial fibrosis[J]. Nephrol Dial Transpl, 2014, 29: 313-324. |
| [81] |
Mao Q, Chen C, Liang H, et al. Astragaloside Ⅳ inhibits excessive mesangial cell proliferation and renal fibrosis caused by diabetic nephropathy via modulation of the TGF-beta 1/Smad/miR-192 signaling pathway[J]. Exp Ther Med, 2019, 18: 3053-3061. |
| [82] |
Tang F, Hao Y, Zhang X, et al. Effect of echinacoside on kidney fibrosis by inhibition of TGF-beta 1/Smads signaling pathway in the db/db mice model of diabetic nephropathy[J]. Drug Des Dev Ther, 2017, 11: 2813-2826. |
| [83] |
Cao G, Li S, Shi H, et al. Schisandrin B attenuates renal fibrosis via miR-30e-mediated inhibition of EMT[J]. Toxicol Appl Pharm, 2019, 385: 114769. |
| [84] |
Li N, Feng F, Wu K, et al. Inhibitory effects of astragaloside Ⅳ on silica-induced pulmonary fibrosis via inactivating TGF-beta 1/Smad3 signaling[J]. Biomed Pharmacother, 2019, 119: 109387. |
| [85] |
Liu X, Chen H, Su G, et al. An animal research and a chemical composition analysis of a Chinese prescription for pulmonary fibrosis: Yangfei Huoxue decoction[J]. J Ethnopharmacol, 2019, 245: 112126. |
| [86] |
You SP, Ma L, Zhao J, et al. Phenylethanol glycosides from Cistanche tubulosa suppress hepatic stellate cell activation and block the conduction of signaling pathways in TGF-β1/smad as potential anti-hepatic fibrosis agents[J]. Molecules, 2016, 21: 102. |
| [87] |
Kagitani S, Ueno H, Hirade S, et al. Tranilast attenuates myocardial fibrosis in association with suppression of monocyte/macrophage infiltration in DOCA/salt hypertensive rats[J]. J Hypertens, 2004, 22: 1007-1015. |
| [88] |
Zhang WW, Bai F, Wang J, et al. Edaravone inhibits pressure overload-induced cardiac fibrosis and dysfunction by reducing expression of angiotensin Ⅱ AT1 receptor[J]. Drug Des Dev Ther, 2017, 11: 3019-3033. |
| [89] |
Pang XF, Zhang LH, Bai F, et al. Attenuation of myocardial fibrosis with curcumin is mediated by modulating expression of angiotensin Ⅱ AT1/AT2 receptors and ACE in rats[J]. Drug Des Devel Ther, 2015, 9: 6043-6054. |
| [90] |
Tesch GH, Young MJ. Mineralocorticoid receptor signaling as a therapeutic target for renal and cardiac fibrosis[J]. Front Pharmacol, 2017, 8: 313. |
| [91] |
Driskell RR, Lichtenberger BM, Hoste E, et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair[J]. Nature, 2013, 504: 277-281. |
| [92] |
Rinkevich Y, Walmsley GG, Hu MS, et al. Identification and isolation of a dermal lineage with intrinsic fibrogenic potential[J]. Science, 2015, 348: aaa2151. |
| [93] |
Bock O, Yu H, Zitron S, et al. Studies of transforming growth factors beta 1-3 and their receptors Ⅰ and Ⅱ in fibroblast of keloids and hypertrophic scars[J]. Acta Derm Venereol, 2005, 85: 216-220. |
| [94] |
Andrews JP, Marttala J, Macarak E, et al. Keloids: the paradigm of skin fibrosis - pathomechanisms and treatment[J]. Matrix Biol, 2016, 51: 37-46. |
| [95] |
Khattab FM, Nasr M, Khashaba SA, et al. Combination of pulsed dye laser and verapamil in comparison with verapamil alone in the treatment of keloid[J]. J Dermatol Treat, 2020, 31: 186-190. |
| [96] |
Liu R, Yang B, Deng Z, et al. Efficacy and safety of verapamil vs triamcinolone acetonide for keloids and hypertrophic scars: a systematic review and meta-analysis[J]. Dermatol Ther, 2020. DOI:10.1111/dth.13564 |
| [97] |
Wang W, Qu M, Xu L, et al. Sorafenib exerts an anti-keloid activity by antagonizing TGF-β/Smad and MAPK/ERK signaling pathways[J]. J Mol Med, 2016, 94: 1181-1194. |
| [98] |
Syed F, Sanganee HJ, Bahl A, et al. Potent dual inhibitors of TORC1 and TORC2 complexes (KU-0063794 and KU-0068650) demonstrate in vitro and ex vivo anti-keloid scar activity[J]. J Invest Dermatol, 2013, 133: 1340-1350. |
| [99] |
Gallant-Behm CL, Piper J, Lynch JM, et al. A microRNA-29 mimic (remlarsen) represses extracellular matrix expression and fibroplasia in the skin[J]. J Invest Dermatol, 2019, 139: 1073-1081. |
| [100] |
Bynigeri RR, Jakkampudi A, Jangala R, et al. Pancreatic stellate cell: pandora's box for pancreatic disease biology[J]. World J Gastroenterol, 2017, 23: 382-405. |
| [101] |
Shimizu K. Mechanisms of pancreatic fibrosis and applications to the treatment of chronic pancreatitis[J]. J Gastroenterol, 2008, 43: 823-832. |
| [102] |
Pothula SP, Pirola RC, Wilson JS, et al. Pancreatic stellate cells: aiding and abetting pancreatic cancer progression[J]. Pancreatology, 2020, 20: 409-418. |
| [103] |
Mccarroll JA, Phillips PA, Santucci N, et al. Vitamin A inhibits pancreatic stellate cell activation: implications for treatment of pancreatic fibrosis[J]. Gut, 2006, 55: 79-89. |
| [104] |
Jaster R, Lichte P, Fitzner B, et al. Peroxisome proliferator - activated receptor γ overexpression inhibits pro-fibrogenic activities of immortalised rat pancreatic stellate cells[J]. J Cell Mol Med, 2005, 9: 670-682. |
| [105] |
Kuno A, Yamada T, Masuda K, et al. Angiotensin-converting enzyme inhibitor attenuates pancreatic inflammation and fibrosis in male Wistar Bonn/Kobori rats[J]. Gastroenterology, 2003, 124: 1010-1019. |
| [106] |
Liu WB, Wang XP, Wu K, et al. Effects of angiotensin Ⅱ receptor antagonist, losartan on the apoptosis, proliferation and migration of the human pancreatic stellate cells[J]. World J Gastroenterol, 2005, 11: 6489-6494. |
| [107] |
Gibo J, Ito T, Kawabe K, et al. Camostat mesilate attenuates pancreatic fibrosis via inhibition of monocytes and pancreatic stellate cells activity[J]. Lab Invest, 2005, 85: 75-89. |
| [108] |
Asaumi H, Watanabe S, Taguchi M, et al. Green tea polyphenol (-)-epigallocatechin-3-gallate inhibits ethanol-induced activation of pancreatic stellate cells[J]. Eur J Clin Invest, 2006, 36: 113-122. |
| [109] |
Endo S, Nakata K, Ohuchida K, et al. Autophagy is required for activation of pancreatic stellate cells, associated with pancreatic cancer progression and promotes growth of pancreatic tumors in mice[J]. Gastroenterology, 2017, 152: 1492-1506. |
| [110] |
Cui LH, Li CX, Zhuo YZ, et al. Saikosaponin d ameliorates pancreatic fibrosis by inhibiting autophagy of pancreatic stellate cells via PI3K/Akt/mTOR pathway[J]. Chem Biol Interact, 2019, 300: 18-26. |
| [111] |
Gilbert RE, Kelly DJ, Cox AJ, et al. Angiotensin converting enzyme inhibition reduces retinal overexpression of vascular endothelial growth factor and hyperpermeability in experimental diabetes[J]. Diabetologia, 2000, 43: 1360-1367. |
| [112] |
Fernandes R, Bento CF, Matafome P, et al. Atorvastatin-mediated protection of the retina in a model of diabetes with hyperlipidemia[J]. Can J Physiol Pharmacol, 2014, 92: 1037-1043. |
| [113] |
Brooks HL, Caballero S, Newell CK, et al. Vitreous levels of vascular endothelial growth factor and stromal-derived factor 1 in patients with diabetic retinopathy and cystoid macular edema before and after intraocular injection of triamcinolone[J]. Arch Ophthalmol, 2004, 122: 1801-1807. |
| [114] |
Zhang B, Zhou KK, Ma JX. Inhibition of connective tissue growth factor overexpression in diabetic retinopathy by SERPINA3K via blocking the WNT/β-catenin pathway[J]. Diabetes, 2010, 59: 1809-1816. |
 2020, Vol. 55
2020, Vol. 55


